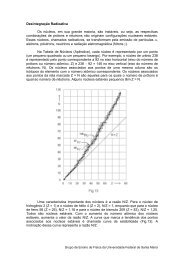
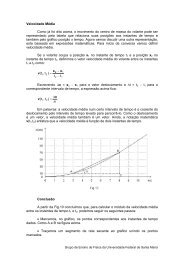
reprodução de colêmbolos nativos com diferentes ... - UFSM
reprodução de colêmbolos nativos com diferentes ... - UFSM
reprodução de colêmbolos nativos com diferentes ... - UFSM
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
REPRODUÇÃO DE COLÊMBOLOS NATIVOS COM<br />
DIFERENTES SUBSTRATOS EM CONDIÇÕES DE<br />
LABORATÓRIO<br />
Ricardo Bemfica Steffen 1 , Tatiana Bene<strong>de</strong>tti 2 , André Paulo Hubner 2 , Anelise Vicentini<br />
Kuss 2 , Zaida Inês Antoniolli 3 . 1 Acadêmico do curso <strong>de</strong> Agronomia, Bolsista Fapergs.<br />
Departamento <strong>de</strong> solos <strong>UFSM</strong>, 97105-900 Santa Maria. bemfica_steffen@yahoo.<strong>com</strong>.br<br />
2 Acadêmicos do curso <strong>de</strong> Pós Graduação em Ciência do Solo – <strong>UFSM</strong>/RS 3 Professora<br />
Adj. Departamento <strong>de</strong> Solos.<br />
Biologia do SoloMonferrer<br />
Os organismos da fauna edáfica são capazes <strong>de</strong> modificar as características do solo<br />
(Pankhurst e Lynch, 1994), por encontrar-se intimamente associados aos processos <strong>de</strong><br />
<strong>de</strong><strong>com</strong>posição e ciclagem <strong>de</strong> nutrientes. Estes organismos são agentes transformadores e<br />
atuam nas características físicas, biológicas e químicas do meio, bem <strong>com</strong>o auxiliam no<br />
monitoramento e qualida<strong>de</strong> solo.<br />
Os <strong>colêmbolos</strong> (Classe insecta, Sub-classe Apterygota) constituem juntamente <strong>com</strong> os<br />
ácaros a maior parte da mesofauna edáfica. São animais <strong>de</strong> tamanho reduzido (0,5 a 5 mm).<br />
Nos climas temperados o ciclo <strong>de</strong> vida é <strong>de</strong> dois a <strong>de</strong>z meses. Embora os <strong>colêmbolos</strong> do<br />
solo sejam menos diversificados e menos numerosos do que os ácaros, sua capacida<strong>de</strong><br />
reprodutiva parece ser bem maior, constituindo uma importante fonte <strong>de</strong> alimento para<br />
predadores <strong>com</strong> aranhas, coleópteros e ácaros. A quantida<strong>de</strong> <strong>de</strong> <strong>colêmbolos</strong> no solo<br />
<strong>de</strong>pen<strong>de</strong> <strong>de</strong> variações temporais e fatores climáticos, sendo assim, <strong>de</strong>pen<strong>de</strong>m da umida<strong>de</strong>,<br />
espessura do horizonte orgânico, macroporosida<strong>de</strong> do solo e a própria disponibilida<strong>de</strong> <strong>de</strong><br />
alimento.<br />
A ativida<strong>de</strong> agropecuária leva à perda da qualida<strong>de</strong> do solo ou a diminuição da<br />
“capacida<strong>de</strong> <strong>de</strong> um solo funcionar <strong>com</strong>o um ecossistema limite para sustentar a<br />
produtivida<strong>de</strong> biológica, manter a qualida<strong>de</strong> do meio ambiente e promover a saú<strong>de</strong> <strong>de</strong><br />
plantas e animais” (Doran e Parkin, 1994), sendo assim, vários estudos <strong>com</strong>provam a<br />
eficiência dos <strong>colêmbolos</strong> <strong>com</strong>o bioindicadores da qualida<strong>de</strong> do solo. Na Europa a espécie<br />
Folsomia candida já é utilizada em testes ecotoxicológicos padrão (ISO 11267), para testes<br />
<strong>de</strong> impacto <strong>de</strong> produtos químicos no ambiente (Crouau, 2002). No Brasil, os <strong>colêmbolos</strong><br />
estão sendo usados para estudos <strong>com</strong> relação ao impacto <strong>de</strong> metais pesados ao solo, efeitos<br />
residuais <strong>de</strong> <strong>de</strong>fensivos agrícolas e <strong>com</strong>o bioindicadores das condições hídricas do solo.<br />
Uma das gran<strong>de</strong>s barreiras no uso <strong>de</strong>stes organismos <strong>com</strong>o bioindicadores está no<br />
fato <strong>de</strong> que a multiplicação <strong>de</strong> espécies nativas em laboratório ainda é difícil (Greensla<strong>de</strong> &
Vaughan, 2002). Assim o objetivo <strong>de</strong>ste trabalho é <strong>de</strong>senvolver um protocolo <strong>de</strong><br />
multiplicação <strong>de</strong> <strong>colêmbolos</strong> <strong>nativos</strong> em condições <strong>de</strong> laboratório.<br />
O solo utilizado no experimento foi coletado na área experimental do Departamento<br />
<strong>de</strong> Solos da Universida<strong>de</strong> Fe<strong>de</strong>ral <strong>de</strong> Santa Maria, sob as coor<strong>de</strong>nadas geográficas 29 o<br />
43´12´´ S <strong>de</strong> latitu<strong>de</strong> e 53 o 43´01´´ W <strong>de</strong> longitu<strong>de</strong>. A coleta dos <strong>colêmbolos</strong> foi realizada<br />
em janeiro. Foram feitas coletas em pomar <strong>de</strong> cítrus e em bosque <strong>de</strong> Pínus eliotti. Os<br />
indivíduos coletados foram classificados <strong>com</strong>o pertencendo ao gênero Isotomidae, segundo<br />
<strong>de</strong>scrição <strong>de</strong> (GALLO 1988). Para coleta do solo utilizou-se um extrator <strong>de</strong> ferro <strong>de</strong> 10 cm<br />
<strong>de</strong> diâmetro e 20 cm <strong>de</strong> profundida<strong>de</strong>, para que pu<strong>de</strong>sse ser coletado o maior número <strong>de</strong><br />
indivíduos (Costa 1986). Após 5 dias da coleta, foi feita uma contagem para se <strong>de</strong>terminar a<br />
número inicial <strong>de</strong> indivíduos (Tabela 1). Após esta contagem o solo coletado foi<br />
acondicionado em recipientes cilíndricos <strong>de</strong> polietileno <strong>de</strong> coloração branca, <strong>de</strong> 14<br />
centímetros <strong>de</strong> diâmetro por 8 centímetros <strong>de</strong> altura. Colocou-se no interior <strong>de</strong>stes<br />
recipientes 600 gramas <strong>de</strong> solo, o que ocupa 2 / 3 do recipiente e 400ml <strong>de</strong> água <strong>de</strong>stilada,<br />
proporcionando um solo alagado (Edwards 1995), para a análise da multiplicação,<br />
estabeleceu-se os seguintes tratamentos: em solo <strong>de</strong> pomar <strong>de</strong> cítrus 1: Solo in natura + 3g<br />
<strong>de</strong> palha <strong>de</strong> ervilhaca moída, 2: Solo in natura + 3g <strong>de</strong> palha <strong>de</strong> milho moída, 3: Solo in<br />
natura + 3g <strong>de</strong> palha <strong>de</strong> nabo moída, 4: Solo in natura + 3g <strong>de</strong> cama <strong>de</strong> aviário moída, 5:<br />
Solo in natura e em solo <strong>de</strong> bosque <strong>de</strong> Pínus, 6: Solo in natura + 3g <strong>de</strong> palha <strong>de</strong> ervilhaca<br />
moída, 7: Solo in natura + 3g <strong>de</strong> palha <strong>de</strong> milho moída, 8: Solo in natura + 3g <strong>de</strong> palha <strong>de</strong><br />
nabo moída, 9: Solo in natura + 3g <strong>de</strong> cama <strong>de</strong> aviário moída e 10: Solo in natura.<br />
Além dos indivíduos coletados nas amostragens, adicionou-se 10 indivíduos adultos<br />
em cada tratamento. Os <strong>colêmbolos</strong> foram mantidos em ambiente escuro <strong>com</strong> temperatura<br />
<strong>de</strong> 26 o C e alimentados duas vezes por semana <strong>com</strong> 0,2 gramas <strong>de</strong> fermento biológico seco<br />
marca Mauri. Após 50 dias, foi realizada a segunda contagem, a fim <strong>de</strong> <strong>de</strong>terminar qual o<br />
tratamento que obteve maior eficiência na multiplicação <strong>de</strong> <strong>colêmbolos</strong> em laboratório<br />
(Tabela 1). As contagens foram realizadas lavando-se 3 cm 3 <strong>de</strong> solo, sendo três pontos <strong>de</strong><br />
coletas <strong>de</strong> 1cm 3 por tratamento, em Becker <strong>de</strong> 500 ml, utilizando-se 300ml <strong>de</strong> água<br />
<strong>de</strong>stilada e agitando-se <strong>com</strong> bastão <strong>de</strong> vidro por 1 minuto <strong>com</strong> movimentos circulares. Após<br />
o material <strong>de</strong>cantar, a solução <strong>de</strong> solo + água foi passada por uma peneira <strong>de</strong> 0,057 mm e<br />
feita à contagem em placas <strong>de</strong> Petri <strong>com</strong> auxílio <strong>de</strong> microscópio esterioscópico.
Tabela 1: Número <strong>de</strong> <strong>colêmbolos</strong> jovens e adultos 5 e 50 dias após instalação do experimento em<br />
condições <strong>de</strong> laboratório.<br />
Coleta do<br />
solo<br />
Pomar <strong>de</strong><br />
cítrus<br />
Bosque<br />
<strong>de</strong> pínus<br />
Tratamento Jovens/cm 3<br />
Adultos /cm<br />
5 dias após<br />
coleta<br />
3<br />
Jovens/cm<br />
5 dias após<br />
coleta<br />
3<br />
Adultos/cm<br />
50 dias após<br />
coleta<br />
3<br />
50 dias após<br />
coleta<br />
Palha <strong>de</strong> ervilhaca moída < 1 02 02 03<br />
Palha <strong>de</strong> milho moída 01 04 12 17<br />
Palha <strong>de</strong> nabo moída < 1 02 16 09<br />
Cana <strong>de</strong> aviário moída 02 05 22 28<br />
Somente solo < 1 01 04 03<br />
Palha <strong>de</strong> ervilhaca moída 03 05 25 26<br />
Palha <strong>de</strong> milho moída 03 03 06 12<br />
Palha <strong>de</strong> nabo moída < 1 02 05 03<br />
Cana <strong>de</strong> aviário moída 01 02 04 09<br />
Somente solo 01 01 11 06<br />
Como foi apresentado acima, os tratamentos solo <strong>de</strong> pomar <strong>de</strong> cítrus + cama <strong>de</strong><br />
aviário e solo <strong>de</strong> floresta <strong>de</strong> pínus + ervilhaca se equivalem, embora o primeiro tenha<br />
apresentado uma pequena superiorida<strong>de</strong>, sendo o indicado para uso na multiplicação <strong>de</strong><br />
<strong>colêmbolos</strong> em laboratório.
Literatura citada<br />
COSTA, E. C. Artrópo<strong>de</strong>s associados a bracatinga (Mimosa scabrella Benth). Curitiba:<br />
UFPR, 1986. 271 p. Tese (Doutorado em Ciências Florestais) – Universida<strong>de</strong> Fe<strong>de</strong>ral do<br />
Paraná, 1986.<br />
CROUAU, Y.; GISCLARD, C.; PEROTTI, P. The use of Folsomia candida (Collembola,<br />
Isotomidae) in biossays of waste. Applied Soil Ecology, n.19, p. 65-70, 2002.<br />
DORAN, J. W; PARKINS, T. B. Defining and assessing soil quality. In: Doran, J. W;<br />
Coleman, D. C; Bezdicek, D. F. e Stewart, B. A. eds. Defining soil quality for a sustainable<br />
invironment. Soil Science Society of America, Madison. SSSA. Special publication number<br />
35. 1994, 244p.<br />
EDWARDS, C.A. (1995) Simple techniques for rearing Collembola, Symphyla and other<br />
small soil inhabiting arthropods. In Soil Zoology. (Kevan, D.K., McE ed) London, New<br />
York, Toronto. P 412 – 416.<br />
GALLO, D. Manual <strong>de</strong> entomologia agrícola. 2. ed. São Paulo: Agronômica CERES, 1988.<br />
645 p.<br />
GREENLADE, P.; VAUGHAN, G.T. A <strong>com</strong>parison of Collembola species for toxicity<br />
testing of Australian soils. Pedobiologia, 47,2002.<br />
PANKHURST, C. E; LYNCH, J. M. The role of the soil biota in sustainable agriculture. In:<br />
Pankhurst, C. E; Double, B. M; Gupta, U. V. S. R; Grace, P. R. eds. Soil biota:<br />
Management in sustainable farming systems. CSI 1994, 3-12p.