1) Além da produção de metais, a redução metalotérmica - Ufrgs
1) Além da produção de metais, a redução metalotérmica - Ufrgs
1) Além da produção de metais, a redução metalotérmica - Ufrgs
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
ENG06632 - Metalurgia Extrativa dos Metais Não-Ferrosos II-A<br />
Nestor Cezar Heck – UFRGS / DEMET<br />
1<br />
Redução metalotérmica<br />
Status: 2004/2<br />
Questões para a fixação <strong>de</strong> conteúdo:<br />
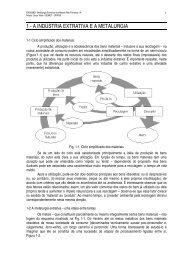
1) Além <strong>da</strong> produção <strong>de</strong> <strong>metais</strong>, a redução metalotérmica é usa<strong>da</strong> em outra área importante <strong>da</strong><br />
engenharia; qual<br />
2) Quando empregamos a redução metalotérmica<br />
3) Ela compete com qual processo<br />
4) Na redução metalotérmica <strong>de</strong> um óxido, MeO, pela oxi<strong>da</strong>ção do agente redutor, Me', forma-se o<br />
óxido, Me'X, que permanece no reator. Cite três conseqüências disso.<br />
5) Por qual razão po<strong>de</strong>mos fazer uma distinção entre a escória e o produto Me'O<br />
6) Quais são as três formas que usamos para separar os reagentes (tanto reatantes quanto produtos)<br />
após a redução metalotérmica<br />
7) Cite dois usos que po<strong>de</strong>mos <strong>da</strong>r ao produto Me'X .<br />
8) To<strong>da</strong>s as reações metalotérmicas são espontâneas Justifique.<br />
9) To<strong>da</strong>s as reações metalotérmicas são exotérmicas Justifique.<br />
10) Explique: por qual motivo uma redução metalotérmica tem ∆G° aproxima<strong>da</strong>mente in<strong>de</strong>pen<strong>de</strong>nte <strong>da</strong><br />
temperatura<br />
11) Na redução metalotérmica <strong>de</strong> um óxido, o grau <strong>de</strong> pureza do óxido do metal <strong>de</strong> valor, MeX, e o do<br />
óxido Me'X são importantes. a) Por qual motivo b) Desejamos que o quociente entre os seus graus<br />
<strong>de</strong> pureza (ou ativi<strong>da</strong><strong>de</strong>s) seja elevado ou baixo<br />
12) Como po<strong>de</strong>mos modificar o valor <strong>de</strong> ∆G° <strong>de</strong> uma redução metalotérmica – já que ele normalmente<br />
não tem uma <strong>de</strong>pendência acentua<strong>da</strong> <strong>da</strong> temperatura<br />
13) O uso <strong>de</strong> temperaturas altas na redução metalotérmica apresenta ao menos um aspecto positivo;<br />
qual é ele Justifique.<br />
14) Cite os dois problemas que po<strong>de</strong>m surgir com o uso <strong>de</strong> temperaturas muito baixas na redução<br />
metalotérmica.<br />
15) O grau <strong>de</strong> ‘reativi<strong>da</strong><strong>de</strong>’ <strong>de</strong> uma redução metalotérmica po<strong>de</strong> ser medido por meio <strong>de</strong> um índice.<br />
Explique como ele é calculado.<br />
16) Como se faz para se arrefecer uma redução metalotérmica explosiva (índice > 1100 cal/g)<br />
17) Como se faz para se ativar uma redução metalotérmica inoperante (índice < 550 cal/g)<br />
18) O que é a ‘temperatura adiabática’ <strong>de</strong> uma reação metalotérmica<br />
19) Qual a importância <strong>de</strong> se saber o valor <strong>da</strong> ‘temperatura adiabática’<br />
Questões para o <strong>de</strong>senvolvimento do tema:<br />
Informação: A variação <strong>da</strong> energia livre <strong>de</strong> Gibbs padrão, em função <strong>da</strong> temperatura, entalpia e<br />
entropia, ∆G T ° = ∆H° - T∆S° , para a formação dos óxidos Nb 2 O 5 , Al 2 O 3 e CaO , por mol <strong>de</strong> O 2 (g),<br />
po<strong>de</strong> ser <strong>de</strong>scrita, respectivamente, pelas seguintes equações:<br />
Óxido Equação ∆G° = f (T), com ∆G° em [J] e T em [K]<br />
Nb 2 O 5 y = 171 x - 757 283<br />
Al 2 O 3 y = 209 x - 1 117 130<br />
CaO y = 212 x - 1 269 840<br />
Observe que a inclinação <strong>de</strong>ssas retas é positiva, pois ∆S° < 0 (entropia aumenta) para esses casos.<br />
Massas atômicas: Nb= 92,9; Al= 27,0; Ca=40; O= 16,0 [u.m.a]<br />
1) Escreva as reações <strong>de</strong> oxi<strong>da</strong>ção dos <strong>metais</strong> Nb, Al e Ca, por mol <strong>de</strong> O 2 (g), formando os óxidos<br />
citados acima.<br />
2) Escreva a reação <strong>de</strong> redução aluminotérmica <strong>de</strong> um mol do óxido Nb 2 O 5 .<br />
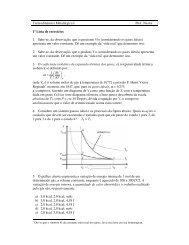
3) Qual é o valor <strong>da</strong> variação <strong>da</strong> energia livre <strong>de</strong> Gibbs padrão, ∆G T °, <strong>da</strong> redução aluminotérmica do<br />
Nb 2 O 5 , para as temperaturas <strong>de</strong> 500, 1000 e 1500 K, por mol <strong>de</strong> Nb 2 O 5 <br />
4) Quantos quilogramas <strong>de</strong> Al serão empregados na redução estequiométrica <strong>de</strong> 1 tonela<strong>da</strong> <strong>de</strong> Nb 2 O 5
ENG06632 - Metalurgia Extrativa dos Metais Não-Ferrosos II-A<br />
Nestor Cezar Heck – UFRGS / DEMET<br />
2<br />
5) Qual é o calor disponível para aquecer os produtos, em Joule, na redução <strong>de</strong> 1 mol <strong>de</strong> Nb 2 O 5 à<br />
25°C<br />
6) Qual será a temperatura adiabática que os produtos po<strong>de</strong>rão alcançar Use os seguintes <strong>da</strong>dos:<br />
Proprie<strong>da</strong><strong>de</strong> / Subst. elem.: Nb Al 2 O 3<br />
Cp (médio) [J/mol⋅°C] sólido 30 125<br />
líquido 33,47 192,5<br />
Ponto <strong>de</strong> fusão [°C] 2477 2054<br />
L f <strong>de</strong> fusão [kJ/ mol] 26,94 364,85<br />
7) Rosenqvist mostra, no diagrama ternário CaO - Al 2 O 3 - SiO 2 (Princ. of Extr. Metall., Fig.11-1, p.326),<br />
que a substância com a composição Ca 12 Al 14 O 33 está próxima a uma composição eutética, <strong>de</strong> menor<br />
temperatura do ternário. Um engenheiro metalúrgico quer saber quantos quilogramas <strong>de</strong> CaO por<br />
tonela<strong>da</strong> <strong>de</strong> Nb 2 O 5 ele <strong>de</strong>ve utilizar para obter esse produto, ao invés <strong>da</strong> alumina ‘pura’<br />
8) Qual seria o calor disponível para aquecer os produtos, se o redutor fosse o cálcio, na redução <strong>de</strong><br />
1 mol <strong>de</strong> Nb 2 O 5 à 25°C<br />
9) Sabemos que o valor <strong>da</strong> constante <strong>de</strong> equilíbrio, K, influencia o grau <strong>de</strong> pureza do metal obtido. Use<br />
uma temperatura <strong>de</strong> 1500 K como base para dizer se há uma tendência <strong>de</strong> aumento <strong>da</strong> pureza com o<br />
uso <strong>da</strong> calciotermia em relação à aluminotermia. Calcule, para isso, os valores <strong>de</strong> K para a redução<br />
aluminotérmica e calciotérmica <strong>de</strong> 1 mol <strong>de</strong> Nb 2 O 5 .<br />
Algumas informações ou <strong>da</strong>dos para estas questões provêm <strong>da</strong>s seguintes páginas:<br />
http://www.webelements.com<br />
http://webbook.nist.gov<br />
http://www.eng.fsu.edu