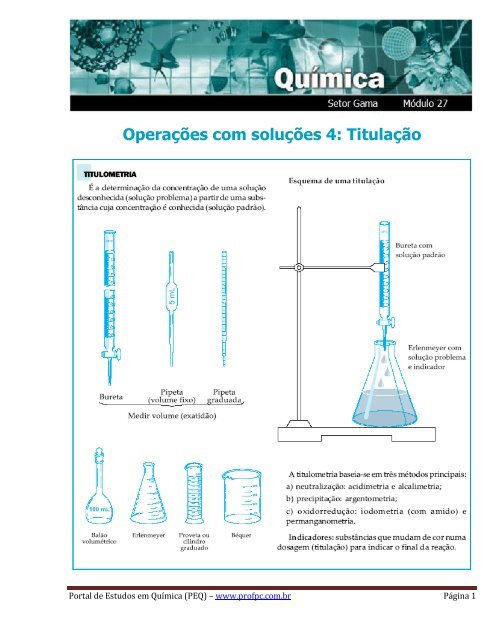
Operações com soluções 4: Titulação - Portal de Estudos em QuÃmica
Operações com soluções 4: Titulação - Portal de Estudos em QuÃmica
Operações com soluções 4: Titulação - Portal de Estudos em QuÃmica
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Operações <strong>com</strong> soluções 4: Titulação<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 1
EXERCÍCIO RESOLVIDO25,0 mL <strong>de</strong> solução 2,0 M <strong>de</strong> HCl exigiram, na titulação, 50,0 mL <strong>de</strong> solução <strong>de</strong> KOH. Calcule a molarida<strong>de</strong> dasolução <strong>de</strong> KOH.Interpretação dos dados:Retiramos, <strong>com</strong> auxílio <strong>de</strong> uma pipeta, 50 mL da solução contida no frasco abaixo, (observe que a solução possuiconcentração molar <strong>de</strong>sconhecida) e transferimos para um frasco erlenmeyer.No frasco erlenmeyer, contendo a solução básica, adicionamos algumas gotas <strong>de</strong> fenolftaleína, um indicadorque, na presença <strong>de</strong> base, adquire a coloração avermelhada.Com o auxílio <strong>de</strong> uma bureta (figura a seguir), adicionamos cautelosamente à solução contida no erlenmeyeruma solução <strong>de</strong> HCl (aq) 2,0 M.Assim, no erlenmeyer haverá a seguinte reação, representada pela equação.1 HCl (aq) + 1 KOH (aq) 1 KCl (aq) + 1 H 2 O (l)Pela equação, observar<strong>em</strong>os que a neutralização entre o ácido e a base será <strong>com</strong>pleta quando o número <strong>de</strong>mols <strong>de</strong> H + (aq) do ácido for igual ao número <strong>de</strong> mols <strong>de</strong> OH - (aq) da base.Esse fato é verificado exatamente no momento <strong>em</strong> que a coloração vermelha, <strong>de</strong>vido ao meio básico, mudapara incolor. Neste momento, o número <strong>de</strong> mols H + (aq), provenientes do ácido neutralizam totalmente onúmero <strong>de</strong> mols do OH - (aq), provenientes da base. Anotamos o volume <strong>de</strong> ácido gasto (25 mL).<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 2
Exist<strong>em</strong> três formas <strong>de</strong> resolução <strong>de</strong>ste probl<strong>em</strong>a:1ª Opção: Através da utilização <strong>de</strong> fórmulas1° Passo: Fazer a reação entre o ácido e a base: 1 HCl (aq) + 1 KOH (aq) 1 KCl (aq) + 1 H 2 O (l)2° Passo: Determinar a relação estequiométrica: 1mol 1mol3° Passo: Ponto <strong>de</strong> equivalência: N° Mols ácido = N° Mols base, on<strong>de</strong>: N° Mols = [ ].V(L)4° Passo: Substituição dos dados na fórmula obtida:[ácido].V ácido =[base].V base 2M.25mL = [base].50mL [base] = [KOH] = 1,0M2ª Opção: Através da utilização <strong>de</strong> regra <strong>de</strong> três1° Passo: Fazer a reação entre o ácido e a base: 1 HCl (aq) + 1 KOH (aq) 1 KCl (aq) + 1 H 2 O (l)2° Passo: Calcular quantos mols do ácido foram utilizados para reagir <strong>com</strong>pletamente <strong>com</strong> 50mL da base:n(HCl) = [HCl].V(L) n(HCl) = 2,0.0,025 n(HCl) = 0,05mol3° Passo: Calcular o número <strong>de</strong> mols da base (KOH) consumido:x = quantida<strong>de</strong> <strong>em</strong> mols <strong>de</strong> OH – presente no erlenmeyer = 0,05 mol4° Passo: Calcular a concentração molar da base (KOH (aq) ):3ª Opção: Através da utilização da análise dimensional (melhor opção)Utilizar<strong>em</strong>os o seguinte raciocínio:Volume titulante (L) nº mol titulante nº mol titulado. . mol titulado/LVolume titulado (L) Volume titulante (L) nº mol titulanteVolume gasto titulação [titulante] estequiometriaSubstituindo os dados na relação anterior, ficamos <strong>com</strong>:325.10 L HC (titulante) 2 mol HC 1 mol KOH350.10 L KOH (titulado). . 1mol KOH.L1L HC (titulante) 1 mol HCVolume gasto titulação [titulante] estequiometria1<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 3
EXERCÍCIOS DE APLICAÇÃO01 (PUC-Campinas) Em uma titulação <strong>de</strong> solução <strong>de</strong> um ácido orgânico monocarboxílico, para atingir o “ponto<strong>de</strong> equivalência”, utilizaram-se 25,0 mL <strong>de</strong> solução aquosa <strong>de</strong> soda cáustica (NaOH) <strong>de</strong> concentração 0,20 mol/L,e 25,0 mL <strong>de</strong> solução aquosa do ácido orgânico. No ponto <strong>de</strong> equivalência, a concentração, <strong>em</strong> mol/L, domonocarboxilato <strong>de</strong> sódio na solução final éa) 2,0 x 10 -3 b) 2,0 x 10 -2 c) 2,0 x 10 -1 d) 1,0 x 10 -2 e) 1,0 x 10 -102 (Vunesp-SP) Uma solução aquosa <strong>de</strong> cloreto <strong>de</strong> sódio <strong>de</strong>ver ter 0,90% <strong>em</strong> massa do sal para que sejautilizada <strong>com</strong>o solução fisiológica (soro). O volume <strong>de</strong> 10,0 mL <strong>de</strong> uma solução aquosa <strong>de</strong> cloreto <strong>de</strong> sódio foititulado <strong>com</strong> solução aquosa 0,10 mol/L <strong>de</strong> nitrato <strong>de</strong> prata, exigindo exatamente 20,0 mL <strong>de</strong> titulante.a) A solução aquosa <strong>de</strong> cloreto <strong>de</strong> sódio po<strong>de</strong> ou não ser utilizada <strong>com</strong>o soro fisiológico? Justifique sua resposta.b) Supondo 100% <strong>de</strong> rendimento na reação <strong>de</strong> precipitação envolvida na titulação, calcule a massa <strong>de</strong> cloreto <strong>de</strong>prata formado.Dados: massas molares, <strong>em</strong> g/mol: Na = 23,0; Cl = 35,5; Ag = 107,9; <strong>de</strong>nsida<strong>de</strong> da solução aquosa NaCl = 1,0g/mL.03 (Fuvest-SP) Para se <strong>de</strong>terminar o conteúdo <strong>de</strong> ácido acetilsalicílico (C 9 H 8 O 4 ) num <strong>com</strong>primido analgésico,isento <strong>de</strong> outras substâncias ácidas, 1,0 g do <strong>com</strong>primido foi dissolvido numa mistura <strong>de</strong> etanol e água. Essasolução consumiu 20 mL <strong>de</strong> solução aquosa <strong>de</strong> NaOH, <strong>de</strong> concentração 0,10 mol/L, para reação <strong>com</strong>pleta.Ocorreu a seguinte transformação química:C 9 H 8 O 4 (aq) + NaOH(aq)NaC 9 H 7 O 4 (aq) + H 2 O(l)Logo, a porcentag<strong>em</strong> <strong>em</strong> massa <strong>de</strong> ácido acetilsalicílico no <strong>com</strong>primido é <strong>de</strong>, aproximadamente:(Dado: massa molar do C 9 H 8 O 4 = 180 g/mol)a) 0,20% b) 2,0% c) 18% d) 36% e) 55%04 (FESP-PE) Dos conjuntos indicados abaixo, o mais a<strong>de</strong>quado para realizar uma titulação (iodometria) é:a) bureta e kitassato, utilizando fenolftaleína <strong>com</strong>o indicador.b) pipeta e bureta, utilizando fenolftaleína <strong>com</strong>o indicador.c) bureta (pipeta) e erlenmeyer, utilizando amido <strong>com</strong>o indicador.d) bureta e proveta, utilizando amido <strong>com</strong>o indicador.e) cuba e erlenmeyer, utilizando amido <strong>com</strong>o indicador.05 (UFMG-MG) 100 mL <strong>de</strong> uma solução aquosa <strong>de</strong> ácido clorídrico 1 mol/L foram misturados a 100 mL <strong>de</strong> umasolução aquosa <strong>de</strong> nitrato <strong>de</strong> prata 1 mol/L, formando um precipitado <strong>de</strong> cloreto <strong>de</strong> prata, <strong>de</strong> acordo <strong>com</strong> aequação (argentometria).HCl + AgNO 3 AgCl + HNO 3Em relação a esse processo, todas as afirmativas estão corretas, exceto:a) A concentração do íon nitrato na mistura é <strong>de</strong> 0,5 mol/L.b) A reação produz um mol <strong>de</strong> cloreto <strong>de</strong> prata.c) O cloreto <strong>de</strong> prata é muito pouco solúvel <strong>em</strong> água.d) O pH permanece inalterado durante a reação.e) O sist<strong>em</strong>a final é constituído <strong>de</strong> duas fases.06 (UnB-DF) Dissolv<strong>em</strong>-se 4,9 g do ácido sulfúrico (H 2 SO 4 ) <strong>em</strong> água, <strong>com</strong>pletando-se o volume para 2,0 litros.Titula-se, <strong>com</strong> essa solução, a base fraca hidróxido <strong>de</strong> amônio (NH 4 OH) usando-se a fenolftaleína <strong>com</strong>oindicador. Calcule a molarida<strong>de</strong> do NH 4 OH, consi<strong>de</strong>rando-se que foram necessários 100 mL do ácido paraneutralizar 5,0 mL da base. Dados: massas atômicas (<strong>em</strong> u): H = 1,0; C = 12; O = 16; N = 14; S = 32.<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 4
15 (UFV-MG) Chama-se titulação a operação na qual se adiciona a solução padrão, gota a gota, à soluçãoprobl<strong>em</strong>a(solução contendo a substância a analisar) até o término da reação, evi<strong>de</strong>nciada, por ex<strong>em</strong>plo, <strong>com</strong>substância indicadora.Numa titulação típica, dita acidimetria, titulou-se 10 mL <strong>de</strong> uma solução aquosa <strong>de</strong> HCl, gastando-se um volume<strong>de</strong> 20 mL <strong>de</strong> NaOH <strong>de</strong> concentração igual a 0,1 mol/L, segundo o esqu<strong>em</strong>a abaixo:Partindo do enunciado e do esqu<strong>em</strong>a fornecidos, pe<strong>de</strong>-se:a) a equação balanceada da reação entre HCl e NaOH;b) a concentração da solução <strong>de</strong> HCl.16 (Fuvest-SP) Calcule a massa máxima <strong>de</strong> sulfato <strong>de</strong> zinco que é possível obter quando 3,25 g <strong>de</strong> zinco metálicosão tratados <strong>com</strong> 200 mL <strong>de</strong> uma solução 0,05 M <strong>de</strong> ácido sulfúrico. Massa molar do sulfato <strong>de</strong> zinco (ZnSO 4 ) =161 g/mol. Massas atômicas: H = 1; O = 16; S = 32; Zn = 65.17 10,0g <strong>de</strong> H 2 SO 4 foram dissolvidas <strong>em</strong> água até <strong>com</strong>pletar o volume <strong>de</strong> 250 mL <strong>de</strong> solução. 50 mL <strong>de</strong>ssaexigiram na titulação 38,48 mL <strong>de</strong> solução 1,0 M <strong>de</strong> NaOH. Calcule a pureza do H 2 SO 4 analisando, supondo queas impurezas não reag<strong>em</strong> <strong>com</strong> NaOH. Massa molar do H 2 SO 4 = 98 g/mol.18 Barrilha, que é carbonato <strong>de</strong> sódio impuro, é um insumo básico da indústria química. Uma amostra <strong>de</strong>barrilha <strong>de</strong> 10 g foi totalmente dissolvida <strong>em</strong> 800 mL <strong>de</strong> ácido clorídrico 0,2 mol/L. O excesso <strong>de</strong> ácido clorídricofoi neutralizado por 250 mL <strong>de</strong> NaOH 0,1 mol/L. Qual é o teor <strong>de</strong> carbonato <strong>de</strong> sódio, <strong>em</strong> porcentag<strong>em</strong> <strong>de</strong>massa, na amostra da barrilha?19 Em uma titulação, foram gastos 7,0 mL <strong>de</strong> uma solução <strong>de</strong> HNO3 0,70 mol/L <strong>com</strong>o solução reagente paraanálise <strong>de</strong> 25,0 mL <strong>de</strong> uma solução <strong>de</strong> hidróxido <strong>de</strong> bário. A concentração, <strong>em</strong> mol/L, da solução <strong>de</strong> hidróxido <strong>de</strong>bário analisada foi:a) 0,098. b) 0,049. c) 0,030. d) 0,196. e) 0,070.20 Quantos gramas <strong>de</strong> hidróxido <strong>de</strong> potássio são neutralizados por 250 mL <strong>de</strong> solução <strong>de</strong> ácido nítrico <strong>de</strong>concentração 0,20 mol/L? Dado: Massa molar do KOH = 56,0 g/mola) 1,0g. b) 1,2g. c) 1,4g. d) 2,8g. e) 5,6g.21 0,195g <strong>de</strong> um metal bivalente foi dissolvido <strong>em</strong> 10 mL <strong>de</strong> ácido sulfúrico 0,50 molar. O excesso <strong>de</strong> ácido foineutralizado por 16 mL <strong>de</strong> hidróxido <strong>de</strong> potássio 0,25 molar. Calcule a massa atômica do metal.22 O rótulo <strong>de</strong> um produto <strong>de</strong> limpeza diz que a concentração <strong>de</strong> amônia (NH 3 ) é <strong>de</strong> 9,5 g/L. Com o intuito <strong>de</strong>verificar se a concentração <strong>de</strong> amônia correspon<strong>de</strong> à indicada no rótulo, 5 mL <strong>de</strong>sse produto foram titulados<strong>com</strong> ácido clorídrico (HCl) <strong>de</strong> concentração 0,1 mol/L. Para consumir toda a amônia <strong>de</strong>ssa amostra, foramgastos 25 mL do ácido. Qual a concentração, <strong>em</strong> g/L, da solução, calculada <strong>com</strong> os dados da titulação?<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 6
23 Em um Erlenmeyer foram colocados 20,0 mL <strong>de</strong> solução aquosa <strong>de</strong> ácido sulfúrico 0,1 mol/L, mais gotas <strong>de</strong>fenolftaleína (indicador, que é incolor <strong>em</strong> meio ácido e róseo <strong>em</strong> meio alcalino). Em seguida, <strong>com</strong> auxílio <strong>de</strong> umabureta, foi transferida para o Erlenmeyer solução aquosa <strong>de</strong> hidróxido <strong>de</strong> sódio 0,1mol/L gota a gota, agitandoseconstant<strong>em</strong>ente para homogeneização. A solução do Erlenmeyer terá cor rósea persistente quando o volume<strong>de</strong> solução <strong>de</strong> hidróxido <strong>de</strong> sódio transferido for <strong>de</strong>:a) 30,0 mL. b) 40,1 mL. c) 25,5 mL. d) 10,2 mL. e) 20,1 mL.24 Na titulação <strong>de</strong> 10 mL <strong>de</strong> ácido clorídrico existente numa amostra <strong>de</strong> suco gástrico, foram gastos 9,0mL <strong>de</strong>uma solução 0,20 mol/L <strong>de</strong> hidróxido <strong>de</strong> sódio. Qual a molarida<strong>de</strong> do ácido na amostra?a) 1,80 mol/L. b) 0,90 mol/L. c) 0,45 mol/L. d) 0,20 mol/L. e) 0,18 mol/L.25 (UDESC-SC) Em um laboratório <strong>de</strong> química são colocados a reagir <strong>com</strong>pletamente 100 mL <strong>de</strong> solução <strong>de</strong>hidróxido <strong>de</strong> sódio <strong>com</strong> 30 mL <strong>de</strong> HCl 1,5 molar (mol/L). Pe<strong>de</strong>-se:I - A molarida<strong>de</strong> da solução <strong>de</strong> hidróxido <strong>de</strong> sódio.II - A massa <strong>de</strong> hidróxido <strong>de</strong> sódio aí existente.A alternativa que apresenta corretamente o que se pe<strong>de</strong> é:a) 0,225 mol/L e 1,8 g.b) 0,45 mol/L e 1,8 g.c) 0,045 mol/L e 1,8 g.d) 0,225 mol/L e 5,4 g.e) 0,45 mol/L e 3,6 g.26 (FESP-PE) Preparou-se 100,00mL uma solução <strong>de</strong> um ácido diprótico <strong>de</strong> massa molar 162g/mol e <strong>de</strong>nsida<strong>de</strong>1,80g/mL, diluindo-se 1,00mL <strong>de</strong>ste ácido <strong>em</strong> quantida<strong>de</strong> suficiente <strong>de</strong> água <strong>de</strong>stilada para <strong>com</strong>pletar o balãovolumétrico até a aferição (100,00mL). Em seguida retira-se do balão 5,00mL da solução e titula-se <strong>com</strong>hidróxido <strong>de</strong> sódio 1molar, gastando-se 1,00mL, para a <strong>com</strong>pleta neutralização. A pureza do ácido analisado é<strong>de</strong>: (H = 1u, S = 32u, O = 16u e Na = 23u)a) 70% b) 75% c) 83% d) 90% e) 78%27 Por lei, o vinagre (solução aquosa <strong>de</strong> ácido acético) po<strong>de</strong> conter, no máximo, 4% <strong>em</strong> massa <strong>de</strong> ácido acético(M = 0,67 mol/L). Suponha que você queira verificar se o vinagre utilizado <strong>em</strong> sua casa aten<strong>de</strong> as especificaçõeslegais. Para isso, você verifica que 40 mL <strong>de</strong> vinagre são <strong>com</strong>pletamente neutralizados por 15 mL <strong>de</strong> umasolução aquosa <strong>de</strong> hidróxido <strong>de</strong> sódio 2,0 molar. A que conclusão você chega?28 Quando se adiciona uma solução <strong>de</strong> cloreto <strong>de</strong> cálcio a uma solução <strong>de</strong> carbonato <strong>de</strong> sódio forma-se umasolução <strong>de</strong> carbonato <strong>de</strong> cálcio insolúvel (utilizado <strong>com</strong>o giz), <strong>de</strong> acordo <strong>com</strong> a equação:CaCl 2 + Na 2 CO 3CaCO 3 + 2 NaClPara reagir <strong>com</strong>pletamente <strong>com</strong> 50 mL <strong>de</strong> solução 0,15 mol/L <strong>de</strong> Na 2 CO 3 , é necessário um volume <strong>de</strong> solução0,25 mol/L <strong>de</strong> CaCl 2 igual a:a) 15,0 mL. b) 25,0 mL. c) 30,0 mL. d) 50,0 mL. e) 75,5 mL.29 Acrescentando um volume V2 (<strong>em</strong> mL) <strong>de</strong> uma solução aquosa 1,0 molar <strong>de</strong> nitrato <strong>de</strong> chumbo a um volumeV1 (<strong>em</strong> mL) 1,0 molar <strong>em</strong> sulfato <strong>de</strong> potássio e supondo que a reação representada pela equação:Pb +2 (aq) + SO 4 2- (aq)PbSO 4 (c)seja <strong>com</strong>pleta, <strong>em</strong> qual das alternativas seria formada a maior quantida<strong>de</strong> <strong>de</strong> PbSO 4 (c)?a) V1 = 5; V2 = 25.d) V1 = 20; V2 = 10.b) V1 = 10; V2 = 20.e) V1 = 25; V2 = 5.c) V1 = 15; V2 = 15.<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 7
35 (Fuvest-SP) O rótulo <strong>de</strong> um produto <strong>de</strong> limpeza diz que a concentração <strong>de</strong> amônia, NH 3 , é <strong>de</strong> 9,5 g/L. Com ointuito <strong>de</strong> verificar se a concentração <strong>de</strong> amônia correspon<strong>de</strong> à indicada no rótulo, 5,00 mL <strong>de</strong>sse produto foramtitulados <strong>com</strong> ácido clorídrico <strong>de</strong> concentração 0,100 mol/L. Para consumir toda a amônia <strong>de</strong>ssa amostra foramgastos 25,00 mL do ácido.Com base nas informações fornecidas indique a alternativa que respon<strong>de</strong> corretamente às seguintes questões:I. Qual a concentração da solução, calculada <strong>com</strong> os dados da titulação?II. A concentração indicada no rótulo é correta?IIIa) 0,12 mol/L simb) 0,25 mol/L nãoc) 0,25 mol/L simd) 0,50 mol/L nãoe) 0,50 mol/L sim36 (Faap-SP) Calcule o grau <strong>de</strong> pureza <strong>de</strong> uma amostra <strong>de</strong> 4,80 g <strong>de</strong> hidróxido <strong>de</strong> sódio, sabendo que umaalíquota <strong>de</strong> 10 mL <strong>de</strong> uma solução <strong>de</strong> 100 mL <strong>de</strong>sse material consumiu, na titulação, 20,0 mL <strong>de</strong> uma solução0,25 mol/L <strong>de</strong> H 2 SO 4 (aq). Consi<strong>de</strong>re que as impurezas presentes na massa da amostra são inertes ao ácido.37 (UnB-DF) Uma r<strong>em</strong>essa <strong>de</strong> soda cáustica está sob suspeita <strong>de</strong> estar adulterada. Dispondo <strong>de</strong> uma amostra <strong>de</strong>0,5 grama, foi preparada uma solução aquosa <strong>de</strong> 50 mL. Esta solução foi titulada, sendo consumidos 20 mL <strong>de</strong>uma solução 0,25 mol/L <strong>de</strong> ácido sulfúrico. Determine a porcentag<strong>em</strong> <strong>de</strong> impureza existente na soda cáustica,admitindo que não ocorra reação entre o ácido e as impurezas. Massa molar: NaOH = 40 g/mol.38 (UFPI-PI) Desejando-se verificar o teor <strong>de</strong> ácido acético, CH 3 COOH, <strong>em</strong> um vinagre obtido numa pequenaindústria <strong>de</strong> fermentação, pesou-se uma massa <strong>de</strong> 20 g do mesmo e diluiu-se a 100 cm 3 <strong>com</strong> água <strong>de</strong>stilada <strong>em</strong>balão volumétrico. A seguir, 25 cm 3 <strong>de</strong>sta solução foram pipetados e transferidos para erlenmeyer, sendotitulados <strong>com</strong> solução 0,100 mol/L <strong>de</strong> hidróxido <strong>de</strong> sódio, da qual foram gastos 33,5 cm 3 . A concentração <strong>em</strong>massa do ácido no vinagre <strong>em</strong> % é: Massa molar do ácido acético = 60 g/mol.a) 4,0% b) 3,3% c) 2,0% d) 2,5% e) 0,8%39 (UCG-GO) Para <strong>de</strong>terminar a porcentag<strong>em</strong> <strong>de</strong> prata, Ag, <strong>em</strong> uma liga, um analista dissolve uma amostra <strong>de</strong>0,800 g da liga <strong>em</strong> ácido nítrico. Isto causa a dissolução da prata <strong>com</strong>o íons Ag 1+ . A solução é diluída <strong>com</strong> água etitulada <strong>com</strong> solução 0,150 mol/L <strong>de</strong> tiocianato <strong>de</strong> potássio, KSCN. É formado, então, um precipitado:Ag 1+ (aq) + SCN 1– (aq)AgSCN(ppt)Ele <strong>de</strong>scobre que são necessários 42 mL <strong>de</strong> solução <strong>de</strong> KSCN para a titulação. Qual é a porcentag<strong>em</strong> <strong>em</strong> massa<strong>de</strong> prata na liga? Massa molar do Ag = 108 g · mol –1 .<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 9
40 (PUC-PR) Em um erlenmeyer foram colocados 20,0 cm 3 <strong>de</strong> solução aquosa <strong>de</strong> ácido sulfúrico 0,1M, maisgotas <strong>de</strong> fenolftaleína (indicador, que é incolor <strong>em</strong> meio ácido e róseo <strong>em</strong> meio alcalino). Em seguida, <strong>com</strong>auxilio <strong>de</strong> uma bureta, foi transferida para o erlenmeyer solução aquosa <strong>de</strong> hidróxido <strong>de</strong> sódio 0,1M gota a gota,agitando constant<strong>em</strong>ente para homogeneização. A solução do erlenmeyer terá a cor rósea persistente quando ovolume <strong>de</strong> solução <strong>de</strong> hidróxido <strong>de</strong> sódio transferido for <strong>de</strong>:a) 30,0cm 3 b) 40,1cm 3 c) 25,5cm 3 d) 10,2cm 3 e) 20,1cm 341 (UNIUBE-MG) Um estudante, ao fazer uma titulação <strong>de</strong> 25mL <strong>de</strong> uma solução <strong>de</strong> hidróxido <strong>de</strong> sódio (NaOH),gastou 30mL <strong>de</strong> uma solução <strong>de</strong> ácido sulfúrico (H 2 SO 4 ) 0,2M. A concentração da solução <strong>de</strong> hidróxido <strong>de</strong> sódio<strong>em</strong> mol . L -1 é:a) 0,12 b) 0,24 c) 0,33 d) 0,48 e) 0,9642 (CESGRANRIO-RJ) Desejando <strong>de</strong>terminar a concentração <strong>de</strong> uma solução <strong>de</strong> NaOH, usou-se uma titulação<strong>com</strong> H 2 SO 4 , 0,1M. Para a neutralização <strong>de</strong> 25mL da base, foram necessários 27,5mL solução ácida aconcentração <strong>de</strong> NaOH, <strong>em</strong> mol/L, encontrada foi:a) 0,09 b) 0,10 c) 0,22 d) 0,15 e) 0,1943 (UEPG-PR) São submetidos a titulação 10 mL <strong>de</strong> uma solução <strong>de</strong> H 2 SO 4 <strong>com</strong> uma solução <strong>de</strong> NaOH 0,5 M.Determine a concentração da solução <strong>de</strong> H 2 SO 4 <strong>em</strong> g/L, sabendo que foram consumidos 20 mL da solução <strong>de</strong>NaOH. (Dados <strong>de</strong> massas atômicas: H = 1; S = 32; O = 16.44 (UDESC-SC) Para a titulação <strong>de</strong> 200 mililitros <strong>de</strong> uma solução 0,2 mol/L <strong>de</strong> HCl, o técnico <strong>em</strong> químicadispunha <strong>de</strong> uma solução <strong>de</strong> NaOH 8g/L. O volume da solução básica nessa concentração, que será gasto paraneutralizar <strong>com</strong>pletamente a solução ácida, é:a) 300mL. b) 100mL. c) 500mL. d) 200mL. e) 50mL.45 (UFRRJ-RJ) Soluções aquosas <strong>de</strong> hidróxido <strong>de</strong> sódio (NaOH) po<strong>de</strong>m ser utilizadas <strong>com</strong>o titulantes na<strong>de</strong>terminação da concentração <strong>de</strong> soluções ácidas. Qual seria o volume <strong>de</strong> solução <strong>de</strong> NaOH 0,1 mol/L gasto naneutralização <strong>de</strong> 25 mL <strong>de</strong> uma solução aquosa <strong>de</strong> um ácido monoprótico fraco (HA) <strong>com</strong> concentração 0,08mol/L.46 (Faap-SP) Um controle rápido sobre a condição <strong>de</strong> utilização <strong>de</strong> uma bateria <strong>de</strong> automóvel é a medida da<strong>de</strong>nsida<strong>de</strong> da solução aquosa <strong>de</strong> H 2 SO 4 que a mesma contém e que <strong>de</strong>ve se situar entre 1,25 g/mL e 1,30 g/mL.Outro ensaio consistiria <strong>em</strong> retirar uma alíquota <strong>de</strong> 1 mL <strong>de</strong>ssa solução que é colocada <strong>em</strong> erlenmeyer, diluída<strong>com</strong> água <strong>de</strong>stilada, adicionada <strong>de</strong> indicador e titulada <strong>com</strong> solução aquosa <strong>de</strong> NaOH 1 molar. Supondo quenessa titulação o volume <strong>de</strong> titulante gasto fosse <strong>de</strong> 26 mL, a molarida<strong>de</strong> da solução ácida da bateria testadaseria igual a:a) 36 b) 26 c) 13 d) 18 e) 2<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 10
47 (U<strong>de</strong>sc-SC) As reações <strong>de</strong> neutralização são importantes <strong>em</strong> um procedimento <strong>de</strong> laboratório conhecido<strong>com</strong>o titulação ácido-base, no qual a concentração molar <strong>de</strong> um ácido <strong>em</strong> uma solução aquosa é <strong>de</strong>terminadapela aplicação vagarosa <strong>de</strong> uma solução básica <strong>de</strong> concentração conhecida, na solução do ácido. (As funções doácido e da base po<strong>de</strong>m ser invertidas.)Em relação a isso:a) Responda: <strong>em</strong> que momento <strong>de</strong>ve ser interrompida a adição da base ao ácido?b) Escreva a reação química que represente a neutralização do ácido clorídrico pelo hidróxido <strong>de</strong> sódio.c) Repita o it<strong>em</strong> b, substituindo o ácido clorídrico por ácido sulfúrico.48 (Unifenas-MG) 25 g <strong>de</strong> hidróxido <strong>de</strong> sódio impuro são dissolvidos <strong>em</strong> água suficiente para 500 mL <strong>de</strong>solução. Uma alíquota <strong>de</strong> 50 mL <strong>de</strong>ssa solução foi gasta na titulação <strong>de</strong> 25 mL <strong>de</strong> ácido sulfúrico 1,00 mol/L.Qual a porcentag<strong>em</strong> <strong>de</strong> pureza do hidróxido <strong>de</strong> sódio?a) 8% b) 20% c) 80% d) 100% e) 2%49 (PUC-MG) 10 gramas <strong>de</strong> hidróxido <strong>de</strong> sódio impuro são dissolvidos <strong>em</strong> água suficiente para 500 mL <strong>de</strong>solução. Uma alíquota <strong>de</strong> 50 mL <strong>de</strong>ssa solução gasta, na titulação, 15 mL <strong>de</strong> ácido sulfúrico 0,5 mol/L. Aporcentag<strong>em</strong> <strong>de</strong> pureza do hidróxido <strong>de</strong> sódio inicial é:a) 90% b) 80% c) 60% d) 50% e) 30%50 (UnB-DF) Um auxiliar <strong>de</strong> laboratório encontrou, <strong>em</strong> uma bancada, um frasco <strong>com</strong> o rótulo “óleo <strong>de</strong> vitriol”.Esclarecido pelo químico responsável pelo laboratório, o auxiliar foi informado <strong>de</strong> que se tratava <strong>de</strong> ácidosulfúrico (H 2 SO 4 ). Uma amostra <strong>de</strong> 50 mL do ácido foi então analisada por meio <strong>de</strong> um procedimento conhecido<strong>com</strong>o titulação. O químico utilizou 800 mL <strong>de</strong> uma solução <strong>de</strong> hidróxido <strong>de</strong> sódio (NaOH) 0,5 mol/L paraneutralizar toda a amostra tomada. Calcule a concentração <strong>em</strong> quantida<strong>de</strong> <strong>de</strong> matéria relativa à solução <strong>de</strong>ácido contida no frasco. Dê a sua resposta <strong>em</strong> mol/L, <strong>de</strong>sconsi<strong>de</strong>rando a parte fracionária do resultado, casoexista.<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 11
GABARITO01- Alternativa ECalculando o número <strong>de</strong> mols do NaOH: n(NaOH) = [NaOH].V(L) = 0,2.0,025 = 5.10 -3 molReação química: R-COOH + NaOH R-COO - Na + + H 2 OEstequiometria: 1mol 1mol 1mol5.10 -3 mol 5.10 -3 mol 5.10 -3 molCalculando a concentração molar do sal obtido na solução resultante cujo volume é 50mL (50.10 -3 L):3N mol sal 5.101[sal]0,1mol.L3V solução final(L) 50.1002-a) Reação química: NaCl(aq) + AgNO 3 (aq) AgCl(s) + NaNO 3 (aq)Estequiometria: 1mol 1mol 1molCalculando a massa <strong>de</strong> NaCl na solução:320.10 L solução AgNO30,1mol AgNO31mol NaC 58,5g NaC310.10 L solução NaC 1L solução AgNO31mol AgNO31mol NaC. . . 11,7g NaCCalculando a porcentag<strong>em</strong> <strong>em</strong> massa <strong>de</strong> NaCl na solução cuja <strong>de</strong>nsida<strong>de</strong> é igual a 1g/mL:10g solução <strong>de</strong> soro fisiológico 100%11,7g <strong>de</strong> NaCl XX = 1,17% <strong>em</strong> massa <strong>de</strong> NaCl no soro fisiológicoPortanto a solução não po<strong>de</strong> ser utilizada, pois apresenta porcentag<strong>em</strong> <strong>em</strong> massa <strong>de</strong> NaCl superior ao do sorofisiológico.b) Calculando o número <strong>de</strong> mols <strong>de</strong> AgNO 3 consumido: n(AgNO 3 ) = [AgNO 3 ].V(L) = 0,1.0,02 = 2.10 -3 molCalculando o número <strong>de</strong> mols <strong>de</strong> AgCl formado: NaCl(aq) + AgNO 3 (aq) AgCl(s) + NaNO 3 (aq)1mol 1mol2.10 -3 mol Xon<strong>de</strong> X = 2.10 -3 molCalculando a massa <strong>de</strong> AgCl formado: m = n . M = 2.10 -3 .143,4 = 0,2868g03- Alternativa DCálculo do número <strong>de</strong> mols <strong>de</strong> NaOH consumido: n(NaOH) = [NaOH].V(L) = 0,1.0,02 = 2.10 -3 molCálculo do número <strong>de</strong> mols <strong>de</strong> ácido acetilsalicílico (C 9 H 8 O 4 ) que reagiu <strong>com</strong>pletamente <strong>com</strong> o NaOH:C 9 H 8 O 4 (aq) + NaOH(aq) NaC 9 H 7 O 4 (aq) + H 2 O(l)1mol 1molX 2.10 -3 molX = 2.10 -3 mol <strong>de</strong> ácido acetilsalicílico (C 9 H 8 O 4 )Cálculo da massa <strong>de</strong> ácido acetilsalicílico (C 9 H 8 O 4 ) existente <strong>em</strong> 1 <strong>com</strong>primido: m = n . M = 2.10 -3 .180 = 0,36gCálculo da porcentag<strong>em</strong> <strong>em</strong> massa <strong>de</strong> ácido acetilsalicílico (C 9 H 8 O 4 ) no <strong>com</strong>primido:1g <strong>de</strong> <strong>com</strong>primido 100%0,36g ácido acetilsalicílico XX = 36% <strong>em</strong> massa ácido acetilsalicílico (C 9 H 8 O 4 ) no <strong>com</strong>primido.<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 12
04- Alternativa CBureta ou pipeta graduada e erlenmeyer são os aparelhos mais indicados para uma titulação. O amido é o indicadorutilizado para iodometria. Para titulações ácido (H + )/base (OH - ) po<strong>de</strong>mos utilizar os outros indicadores, <strong>com</strong>o por ex<strong>em</strong>plo:fenolftaleína: incolor (H + )/vermelho (OH - )metil orange: vermelho(H + )/amarelo (OH - )tornassol: vermelho (H + )/azul (OH - )azul <strong>de</strong> bromotimol: amarelo (H + )/azul (OH - )05- Alternativa BCalculando número <strong>de</strong> mols <strong>de</strong> AgNO 3 : n = [AgNO 3 ].V(L) = 1.0,1 = 0,1molReação química: HCl + AgNO 3 AgCl + HNO 3Estequiometria: 1mol 1mol 1mol 1mol0,1mol 0,1mol 0,1mol 0,1mola) (V) Calculando a [NO - 3 ] na solução resultante cujo volume é <strong>de</strong> 200mL (0,2L):N mol 0,11[NO3]0,5mol.LV(L) 0,2b) (F) vi<strong>de</strong> a estequiometria da reação acima.c) (V) cloreto <strong>de</strong> prata é um sal insolúvel <strong>em</strong> água.d) (V) Como o HCl e o HNO 3 são ácidos fortes, a aci<strong>de</strong>z praticamente não se altera (pH ≅ cte.).e) (V) O AgCl é um sólido insolúvel na água (bifásico).06-3100.10 L H2SO4 4,9g H2SO4 1mol H2SO4 2mol NH4OH. . . 1mol.L35.10 L NH OH 2L H SO 98g H SO 1mol H SO42 4 2 4 2 407- Alternativa ECálculo do número <strong>de</strong> mol <strong>de</strong> H 2 SO 4 que reage <strong>com</strong> o NaOH:Reação química: 2 NaOH + H 2 SO 4 Na 2 SO 4 + 2 H 2 OEstequiometria: 2mol 1molDado: 0,5mol XX = 0,25molN mol 0,25molCálculo do volume <strong>de</strong> solução <strong>de</strong> H 2 SO 4 1mol/L: [H2SO 4] V 0,25L ou 250mL1V(L) 1mol.L08- Alternativa BBureta contém o titulante, erlenmeyer contém o titulado.09- Alternativa AReação química: HCl + NaOH NaCl + H 2 OEstequiometria: 1mol 1molCálculo da concentração da solução <strong>de</strong> NaOH:320.10 L HC 0,1mol HC 1mol NaOH. . 0,2mol.L310.10 L NaOH 1L HC 1mol HC10- Alternativa BReação química: CH 3 -COOH + NaOH CH 3 -COO - Na + + H 2 OEstequiometria: 1 mol 1 molCálculo da concentração da solução <strong>de</strong> NaOH:325.10 L CH3COOH 0,06mol CH3COOH 1mol NaOH. . 0,1mol.L315.10 L NaOH 1L CH COOH 1mol CH COOH3 3111<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 13
11-Reação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2mola) Cálculo da concentração molar do ácido na solução <strong>de</strong> bateria:340.10 L NaOH 0,75mol NaOH 1mol H2SO41. . 2mol.L37,5.10 L H SO 1L NaOH 2mol NaOH2 4b) Reação <strong>de</strong> neutralização total: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 ONome do produto formado: sulfato <strong>de</strong> sódio e águaReação <strong>de</strong> neutralização parcial: H 2 SO 4 + NaOH NaHSO 4 + H 2 ONome do produto formado: hidrogenossulfato <strong>de</strong> sódio ou sulfato ácido <strong>de</strong> sódio.12-Reação química: HCl + NaOH NaCl + H 2 OEstequiometria: 1mol 1mola) Cálculo da molarida<strong>de</strong> da solução <strong>de</strong> NaOH:350.10 L HC 0,1mol HC 1mol NaOH. . 0,25mol.L320.10 L NaOH 1L HC 1mol HCb) Cálculo da concentração da solução <strong>de</strong> NaOH <strong>em</strong> g/L:0,25mol NaOH 40g NaOH1. 10g.L1L NaOH 1mol NaOH13-Reação química: NH 3 (aq) + HCl(aq) NH 4 Cl(aq)Estequiometria: 1mol 1mola) Cálculo da concentração molar <strong>de</strong> amônia no produto <strong>de</strong> limpeza:331,2.10 L HC 1mol HC 1mol NH31. . 6,24mol.L35.10 L produto limpeza 1L HC 1mol HCb) Cálculo da massa <strong>de</strong> amônia na solução:6,24mol NH3 17g NH31. 106,08g.L1L produto limpeza 1mol NH3Cálculo da porcentag<strong>em</strong> <strong>de</strong> amônia no produto <strong>de</strong> limpeza <strong>com</strong> <strong>de</strong>nsida<strong>de</strong> <strong>de</strong> 1g/mL:1000g produto <strong>de</strong> limpeza 100%106,08g <strong>de</strong> amônia XX = 10,6% <strong>em</strong> massa14- Alternativa DCálculo do número <strong>de</strong> mol <strong>de</strong> HCl: n = [HCl].V(L) = 0,1.10.10 -3 = 1.10 -3 molCálculo do número <strong>de</strong> mol <strong>de</strong> NaOH: n = [NaOH].V(L) = 0,01.50.10 -3 = 0,5.10 -3 molReação química: HCl + NaOH NaCl + H 2 OEstequiometria: 1mol 1molDados: 1.10 -3 mol 0,5.10 -3 molexcessoPortanto, t<strong>em</strong>os: 0,5.10 -3 mol <strong>de</strong> HCl <strong>em</strong> excesso, reagindo 0,5.10 -3 mol <strong>de</strong> HCl1<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 14
15-a) Reação química: HCl + NaOH NaCl + H 2 OEstequiometria: 1mol 1molb) Cálculo da concentração molar <strong>de</strong> HCl na solução:320.10 L NaOH 0,1mol NaOH 1mol HC310.10 L HC. . 0,2mol.L1L NaOH 1mol NaOH16-Cálculo do número <strong>de</strong> mols <strong>de</strong> H 2 SO 4 : n = [H 2 SO 4 ].V(L) = 0,05.0,2 = 0,01molm 3,25Cálculo do número <strong>de</strong> mols <strong>de</strong> Zn: n0,05molM 65Reação química: Zn + H 2 SO 4 ZnSO 4 + H 2Estequiometria: 1mol 1mol 1molDados: 0,05mol 0,01mol XExcessoX=0,01molCálculo da massa <strong>de</strong> ZnSO 4 formada: m = n.M = 0,01.161 = 1,61g117-Reação química: H 2 SO 4 + 2NaOHEstequiometria: 1mol 2molNa 2 SO 4 + 2H 2 OCálculo da concentração molar do H 2 SO 4 na solução:338,48.10 L NaOH 1mol NaOH 1mol H2SO4. .350.10 L H 1L NaOH 2mol NaOH2SO40,3848mol.LCálculo da massa <strong>de</strong> H 2 SO 4 existente na solução <strong>de</strong> 250mL:m[H2SO 4] M.V(L)m 0,3848.98.0,25 m 9,4276gCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza <strong>de</strong> H 2 SO 4 na solução:10,0g <strong>de</strong> H 2 SO 4 impuro 100%9,4276g <strong>de</strong> H 2 SO 4 puro XX = 94,27% <strong>de</strong> pureza18-Cálculo do número <strong>de</strong> mol <strong>de</strong> HCl na solução inicial: n = [HCl].V(L) = 0,2.0,8 = 0,16molCálculo do número <strong>de</strong> mol <strong>de</strong> NaOH que reage <strong>com</strong> excesso <strong>de</strong> HCl: n = [NaOH].V(L) = 0,1.0,25 = 0,025molCálculo do número <strong>de</strong> mol <strong>de</strong> HCl <strong>em</strong> excesso:Reação química <strong>de</strong> neutralização entre o ácido e a base: HCl + NaOH NaCl + H 2 OEstequiometria:1mol 1molDados: X 0.025molX = 0,025mol <strong>de</strong> HCl <strong>em</strong> excessoCálculo do número <strong>de</strong> mol <strong>de</strong> HCl que reage totalmente <strong>com</strong> a barrilha: n = 0,16 – 0,025 = 0,135molCálculo do número <strong>de</strong> mol <strong>de</strong> Na 2 CO 3 que reage <strong>com</strong> o HCl:Reação química: Na 2 CO 3 + 2HCl 2NaCl + H 2 O + CO 2Estequiometria: 1mol 2molDados: X 0,135molX= 0,0675molCálculo da massa <strong>de</strong> Na 2 CO 3 que reage <strong>com</strong> o HCl: m = n . M = 0,0675.106 = 7,155gCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza <strong>de</strong> Na 2 CO 3 na amostra:10g <strong>de</strong> Na 2 CO 3 impuro 100%7,155g <strong>de</strong> Na 2 CO 3 puro X = 71,55 <strong>de</strong> pureza.<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 151
19- Alternativa AReação química: 2 HNO 3 + Ba(OH) 2 BaCl 2 + 2H 2 OEstequiometria: 2mol 1molCálculo da concentração <strong>de</strong> Ba(OH) 2 na solução:37.10 L HNO3 0,7mol HNO3 1mol Ba(OH)231L HNO232mol HNO325.10 L Ba(OH). . 0,098mol.L20- Alternativa DReação química: HNO 3 + KOH KNO 3 + H 2 OEstequiometria: 1mol 1molCálculo da massa <strong>de</strong> KOH:0,2mol HNO31mol KOH 56g KOH0,25L HNO3. . . 2,8g1L HNO 1mol HNO 1mol KOH3 321-Cálculo do número <strong>de</strong> mol do H 2 SO 4 na solução: n = [H 2 SO 4 ].V(L) = 0,01.0,5 = 5.10 -3 molCálculo do número <strong>de</strong> mol <strong>de</strong> KOH que reage <strong>com</strong> o excesso <strong>de</strong> ácido: n = [KOH].V(L) = 0,016.0,25 = 4.10 -3 molCálculo do número <strong>de</strong> mol <strong>de</strong> H 2 SO 4 <strong>em</strong> excesso que reage <strong>com</strong> KOH:Reação química entre H 2 SO 4 e KOH: H 2 SO 4 + 2 KOH K 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molDados: X 4.10 -3 molX = 2.10 -3 mol <strong>de</strong> H 2 SO 4 (excesso)Cálculo do número <strong>de</strong> mol <strong>de</strong> H 2 SO 4 que reage <strong>com</strong>pletamente <strong>com</strong> o metal: n= 5.10 -3 – 2.10 -3 = 3.10 -3 mol1Cálculo do número <strong>de</strong> mol do metal que reage <strong>com</strong> o H 2 SO 4 :Reação química entre o metal e o H 2 SO 4 : M + H 2 SO 4 MSO 4 + H 2Estequiometria: 1mol 1molDados: X 3.10 -3 molX = 3.10 -3Cálculo da massa molar do metal: nm m 0,195M M3M n 3.1065g.molCom isso ficamos <strong>com</strong> a massa atômica igual a 65u.122-Reação química: NH 3 + HCl NH 4 ClEstequiometria: 1mol 1molCálculo da concentração <strong>em</strong> g/L da solução <strong>de</strong> NH 3 :325.10 L HC 0,1mol HC 1mol NH3 17g NH3. . . 8,5g.L35.10 L NH 1L HC 1mol HC 1mol NH3Conclusão: o produto <strong>de</strong> limpeza não aten<strong>de</strong> às especificações.31<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 16
23- Alternativa BReação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo do volume <strong>de</strong> NaOH gasto na titulação:3 0,1mol H2SO42mol NaOH 1L NaOH320.10 L H2SO 4. . . 40.10 L ou 40mL1L H2SO4 1mol H2SO40,1mol NaOHCom o volume <strong>de</strong> 40mL <strong>de</strong> NaOH ocorre a neutralização total, acima <strong>de</strong>s<strong>de</strong> volume ter<strong>em</strong>os excesso <strong>de</strong> NaOHon<strong>de</strong> predominará a coloração rósea do indicador fenolftaleína.24- Alternativa EReação química: HCl + NaOH NaCl + H 2 OEstequiometria: 1mol 1molCálculo da concentração <strong>de</strong> HCl no suco gástrico:39.10 L NaOH 0,2mol NaOH 1mol HC. . 0,18mol.L310.10 L HC 1L NaOH 1mol NaOH25- Alternativa BReação química: HCl + NaOH NaCl + H 2 OEstequiometria: 1mol 1molCálculo da concentração <strong>de</strong> NaOH na solução:330.10 L HC 1,5mol HC 1mol NaOH. . 0,45mol.L3100.10 L NaOH 1L HC 1mol HCCálculo da massa <strong>de</strong> NaOH existente na solução:0,45mol NaOH 40g NaOH0,1L NaOH. . 1,8g1L NaOH 1mol NaOH26- Alternativa DReação química: H 2 X + 2 NaOH Na 2 X + 2 H 2 OEstequiometria: 1mol 2molCálculo da massa <strong>de</strong> ácido que foi neutralizado na titulação:31.10 L NaOH 1mol NaOH 1mol H2X162g H2X1. . . 16,2g.L35.10 L H 1L NaOH 2mol NaOH 1mol H2X2X16,2g H2XCálculo da massa <strong>de</strong> ácido que reage na solução inicial (100mL): 0,1L H2X. 1,62g1L H2XCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza na amostra <strong>de</strong> 1,8g do ácido:1,8g <strong>de</strong> H 2 X impuro 100%1,62g <strong>de</strong> H 2 X puro XX = 90% <strong>de</strong> pureza.27-Reação química: CH 3 -COOH + NaOH CH 3 -COO - Na + + H 2 OEstequiometria: 1 mol 1 molCálculo da concentração da solução <strong>de</strong> ácido acético no vinagre:315.10 L NaOH 2mol NaOH 1mol CH3COOH. . 0,75mol.L340.10 L CH COOH 1L NaOH 1mol NaOH3O vinagre analisado não aten<strong>de</strong> às especificações: 0,75M > 0,67M111<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 17
28- Alternativa CCálculo do número <strong>de</strong> mol <strong>de</strong> Na 2 CO 3 : n = [Na 2 CO 3 ].V(L) = 0,15.0,05 = 7,5.10 -3 molCálculo do número <strong>de</strong> mol <strong>de</strong> CaCl 2 :Reação química: CaCl 2 + Na 2 CO 3 CaCO 3 + 2 NaClEstequiometria: 1mol 1molDados: X 7,5.10 -3 molX = 7,5.10 -3 molCálculo do volume gasto <strong>de</strong> solução <strong>de</strong> CaCl 2 :3n n 7,5.10[Na2CO 3] V 0,03L ou 30mLV(L) [Na CO ] 0,252 329- Alternativa CSoluções que possu<strong>em</strong> a mesma concentração molar reag<strong>em</strong> <strong>com</strong> volumes iguais. Sendo assim, a solução quepossui o maior volume formará a maior quantida<strong>de</strong> <strong>de</strong> PbSO 4 .30-Reação química: CH 3 -COOH + NaOH CH 3 -COO - Na + + H 2 OEstequiometria: 1 mol 1 molCálculo da massa <strong>de</strong> ácido acético no vinagre:310.10 L NaOH 0,4mol NaOH 1mol CH3COOH 60g CH3COOH. . . 40g CH33COOH6.10 L vinagre 1L NaOH 1mol NaOH 1mol CH3COOHDensida<strong>de</strong> da solução <strong>de</strong> vinagre: d = 1,01g/mL ou d = 1010g/LCálculo da porcentag<strong>em</strong> <strong>de</strong> ácido acético no vinagre:1010g <strong>de</strong> vinagre 100%40g <strong>de</strong> CH 3 COOH XX = 4%31-Cálculo do número <strong>de</strong> mol <strong>de</strong> tiossulfato <strong>de</strong> sódio: n = [Na 2 S 2 O 3 ].V(L) = 0,2.0,005 = 1.10 -3 molCálculo do número <strong>de</strong> mol <strong>de</strong> iodo:Reação química: I 2 + 2Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6Estequiometria: 1mol 2molDados: X 1.10 -3 molX = 0,5.10 -3 molCálculo da concentração molar do iodo <strong>em</strong> 25mL <strong>de</strong> solução:35.10 L Na2S2O3 0,2mol Na2S2O3 1mol I21. . 0,02mol.L325.10 L I 1L Na22S2O3 2mol Na2S2O3Cálculo da massa <strong>de</strong> iodo existente na solução inicial (250mL):0,02mol I2 254g I20,25L I2. .1L I2 1mol I21,27gCálculo da porcentag<strong>em</strong> <strong>de</strong> iodo na massa inicial:1,4g <strong>de</strong> iodo impuro 100%1,27g <strong>de</strong> iodo puro XX = 90,7% <strong>de</strong> pureza.<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 18
32-Cálculo do número <strong>de</strong> mol <strong>de</strong> tiocianato: n = [SCN - ].V(L) = 0,15.0,042 = 6,3.10 -3 molCálculo do número <strong>de</strong> mol <strong>de</strong> íons prata:Reação química: Ag + + SCN - AgSCN1molX1mol6,3.10 -3 molX = 6,3.10 -3 molCálculo da massa <strong>de</strong> prata na liga metálica: nm3m n.M m 6,3.10 .107,8M0,6791gCálculo da porcentag<strong>em</strong> <strong>de</strong> prata na liga metálica:0,8g liga metálica 100%0,6498g prata XX = 85%33- Alternativa BReação química: HNO 3 + KOH KNO 3 + H 2 OEstequiometria: 1mol 1molCálculo da concentração molar do KOH na solução:3100.10 L HNO3 0,1mol HNO31mol KOH. . 0,05mol.L3200.10 L KOH 1L HNO 1mol HNO3 334-Cálculo do número <strong>de</strong> mol <strong>de</strong> Na 2 C 2 O 4 : n = [Na 2 C 2 O 4 ].V(L) = 0,1.0,025 = 2,5.10 -3 molReação química: CaCl 2 + Na 2 C 2 O 4 CaC 2 O 4 + 2NaClCálculo do número <strong>de</strong> mol <strong>de</strong> CaCl 2 :Estequiometria: 1mol 1molDados: X 2,5.10 -3 molCálculo da massa <strong>de</strong> CaCl 2 : m = n.M = 2,5.10 -3 .111 = 0,2775gCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza do CaCl 2 :0,3g <strong>de</strong> CaCl 2 impuro 100%0,2775g CaCl 2 puro XX = 92,5%35- Alternativa DReação química: NH 3 + HCl NH 4 ClEstequiometria:1mol 1molCálculo da concentração <strong>em</strong> mol/L e <strong>em</strong> g/L do NH 3 no <strong>de</strong>tergente:325.10 L HC 0,1mol HC 1mol NH31. . 0,5mol.L35.10 L NH 1L HC 1mol HC0,5mol NH1L NH317g NH. 8,5g.L1mol NH3 33 311<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 19
36-Reação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da massa <strong>de</strong> NaOH <strong>em</strong> 100mL da solução inicial:320.10 L H2SO4 0,25mol H2SO42mol NaOH 40g NaOH0,1L NaOH. . . . 4g NaOH310.10 L NaOH 1L H2SO41mol NaOH 1mol NaOHCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza na amostra:4,80g <strong>de</strong> NaOH impuro 100%4,00g <strong>de</strong> NaOH puro XX = 83,3% <strong>de</strong> pureza37-Reação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da concentração <strong>em</strong> g/L <strong>de</strong> NaOH <strong>em</strong> 50mL da solução inicial:320.10 L H2SO4 0,25mol H2SO42mol NaOH 40g NaOH. . . 8g.L350.10 L NaOH 1L H2SO41mol NaOH 1mol NaOHCálculo da massa <strong>de</strong> NaOH existente <strong>em</strong> 50mL <strong>de</strong> solução:8g NaOH0,05L NaOH. 0,4g NaOH1L NaOHCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza na amostra:0,5g <strong>de</strong> NaOH impuro 100%0,4g <strong>de</strong> NaOH puro XX = 80% <strong>de</strong> pureza38- Alternativa AReação química: CH 3 -COOH + NaOH CH 3 -COO - Na + + H 2 OEstequiometria: 1mol 1molCálculo da massa <strong>de</strong> ácido acético no vinagre:335,5.10 L NaOH 0,1mol NaOH 1mol CH3COOH 60g CH3COOH0,1L vinagre. . . .325.10 L vinagre 1L NaOH 1mol NaOH 1mol CH3COOH0,852gCálculo da porcentag<strong>em</strong> <strong>de</strong> ácido acético no vinagre:20g <strong>de</strong> vinagre 100%0,852g ác. acético XX = 4,26% <strong>de</strong> ác. acético no vinagre39-Reação química: Ag 1+ (aq) + SCN 1– (aq) AgSCN(ppt)Estequiometria: 1mol 1molCálculo da massa <strong>de</strong> prata que reagiu na titulação:0,15mol SCN 1mol Ag 107,8g Ag0,042L SCN . . . 0,67914g1L SCN 1mol SCN 1mol AgCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza <strong>de</strong> prata na liga metálica:0,800g liga metálica 100%0,67914g prata XX = 84,9% <strong>de</strong> pureza.1<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 20
40- Alternativa BCálculo do número <strong>de</strong> mol <strong>de</strong> H 2 SO 4 : n = [H 2 SO 4 ].V(L) = 0,1.0,02 = 2.10 -3 molCálculo do número <strong>de</strong> mol <strong>de</strong> NaOH:Reação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molDados: 2.10 -3 mol XX = 4.10 -3 molCálculo do volume <strong>de</strong> solução <strong>de</strong> NaOH: [NaOH]3n n 4.10VV(L) [NaOH] 0,10,04L ou 40mL41- Alternativa DReação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da concentração molar do NaOH na solução:330.10 L H2SO4 0,2mol H2SO42mol NaOH1. . 0,48mol.L325.10 L NaOH 1L H SO 1mol H SO2 4 2 442- Alternativa CReação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da concentração molar do NaOH na solução:327,5.10 L H2SO4 0,1mol H2SO42mol NaOH. . 0,22mol.L325.10 L NaOH 1L H SO 1mol H SO2 4 2 443-Reação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da concentração <strong>em</strong> g/L do H 2 SO 4 na solução:320.10 L NaOH 0,5mol NaOH 1mol H2SO4 98g H2SO4. . . 49g.L310.10 L H SO 1L NaOH 2mol NaOH 1mol H SO2 42 444- Alternativa DReação química: HCl + NaOH NaCl H 2 OEstequiometria:1mol 1molCálculo do volume gasto da solução <strong>de</strong> NaOH na titulação:0,2mol HC 1mol NaOH 40g NaOH 1L NaOH0,2L HC . . . . 0,2L ou 200mL1L HC 1mol HC 1mol NaOH 8g NaOH45-Reação química: HA + NaOH NaA H 2 OEstequiometria:1mol 1molCálculo do volume gasto da solução <strong>de</strong> NaOH na titulação:0,08mol HA 1mol NaOH 1L NaOH0,025L HA. . . 0,02L ou 20mL1L HA 1mol HA 0,1mol NaOH11<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 21
46- Alternativa CReação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da concentração <strong>em</strong> mol/L do H 2 SO 4 na solução:326.10 L NaOH 1mol NaOH 1mol H2SO4. . 13mol.L31.10 L H SO 1L NaOH 2mol NaOH2 447-a) No ponto <strong>de</strong> equivalência: número <strong>de</strong> mols <strong>de</strong> íons H + do ácido = número <strong>de</strong> mols <strong>de</strong> íons OH - da base.b) HCl + NaOH NaCl + H 2 Oc) H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 O48- Alternativa CReação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da massa <strong>de</strong> NaOH na solução que reage:325.10 L H2SO4 1mol H2SO42mol NaOH 40g NaOH0,5L NaOH. . . . 20g NaOH puro350.10 L NaOH 1L H2SO4 1mol H2SO41mol NaOHCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza <strong>de</strong> NaOH na amostra:25g <strong>de</strong> NaOH impuro 100%20g <strong>de</strong> NaOH puro XX = 80% <strong>de</strong> pureza49- Alternativa CReação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da massa <strong>de</strong> NaOH na solução que reage:315.10 L H2SO4 0,5mol H2SO42mol NaOH 40g NaOH0,5L NaOH. . . . 6g NaOH puro350.10 L NaOH 1L H2SO4 1mol H2SO41mol NaOHCálculo da porcentag<strong>em</strong> <strong>de</strong> pureza <strong>de</strong> NaOH na amostra:10g <strong>de</strong> NaOH impuro 100%6g <strong>de</strong> NaOH puro XX = 60% <strong>de</strong> pureza50-Reação química: H 2 SO 4 + 2NaOH Na 2 SO 4 + 2H 2 OEstequiometria: 1mol 2molCálculo da concentração <strong>em</strong> mol/L do H 2 SO 4 na solução:3800.10 L NaOH 0,5mol NaOH 1mol H2SO4. . 4mol.L350.10 L H SO 1L NaOH 2mol NaOH2 411<strong>Portal</strong> <strong>de</strong> <strong>Estudos</strong> <strong>em</strong> Química (PEQ) – www.profpc.<strong>com</strong>.br Página 22