Tentamen med svarsmallar Biokemi KE7001p3, 22:e mars 2005, 09 ...
Tentamen med svarsmallar Biokemi KE7001p3, 22:e mars 2005, 09 ...
Tentamen med svarsmallar Biokemi KE7001p3, 22:e mars 2005, 09 ...
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
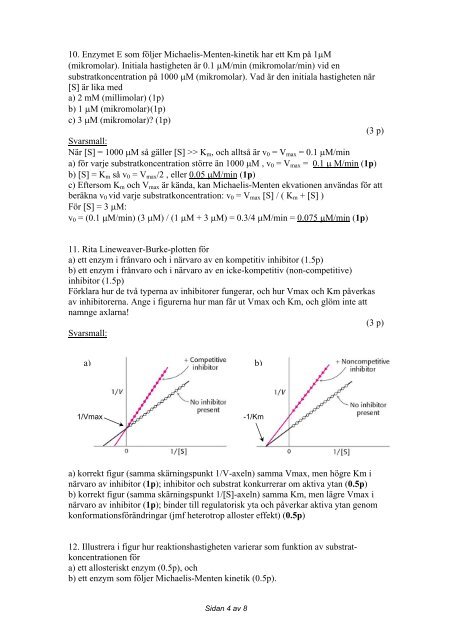
10. Enzymet E som följer Michaelis-Menten-kinetik har ett Km på 1μM(mikromolar). Initiala hastigheten är 0.1 μM/min (mikromolar/min) vid ensubstratkoncentration på 1000 μM (mikromolar). Vad är den initiala hastigheten när[S] är lika <strong>med</strong>a) 2 mM (millimolar) (1p)b) 1 μM (mikromolar) (1p)c) 3 μM (mikromolar)? (1p)(3 p)Svarsmall:När [S] = 1000 μM så gäller [S] >> K m , och alltså är v 0 = V max = 0.1 μM/mina) för varje substratkoncentration större än 1000 μM , v 0 = V max = 0.1 μ M/min (1p)b) [S] = K m så v 0 = V max /2 , eller 0.05 μM/min (1p)c) Eftersom K m och V max är kända, kan Michaelis-Menten ekvationen användas för attberäkna v 0 vid varje substratkoncentration: v 0 = V max [S] / ( K m + [S] )För [S] = 3 μM:v 0 = (0.1 μM/min) (3 μM) / (1 μM + 3 μM) = 0.3/4 μM/min = 0.075 μM/min (1p)11. Rita Lineweaver-Burke-plotten föra) ett enzym i frånvaro och i närvaro av en kompetitiv inhibitor (1.5p)b) ett enzym i frånvaro och i närvaro av en icke-kompetitiv (non-competitive)inhibitor (1.5p)Förklara hur de två typerna av inhibitorer fungerar, och hur Vmax och Km påverkasav inhibitorerna. Ange i figurerna hur man får ut Vmax och Km, och glöm inte attnamnge axlarna!(3 p)Svarsmall:a) b)1/Vmax-1/Kma) korrekt figur (samma skärningspunkt 1/V-axeln) samma Vmax, men högre Km inärvaro av inhibitor (1p); inhibitor och substrat konkurrerar om aktiva ytan (0.5p)b) korrekt figur (samma skärningspunkt 1/[S]-axeln) samma Km, men lägre Vmax inärvaro av inhibitor (1p); binder till regulatorisk yta och påverkar aktiva ytan genomkonformationsförändringar (jmf heterotrop alloster effekt) (0.5p)12. Illustrera i figur hur reaktionshastigheten varierar som funktion av substratkoncentrationenföra) ett allosteriskt enzym (0.5p), ochb) ett enzym som följer Michaelis-Menten kinetik (0.5p).Sidan 4 av 8