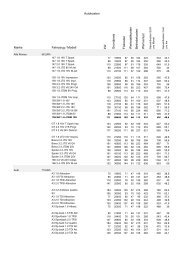
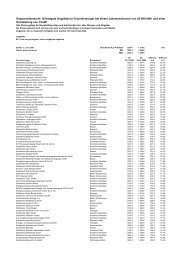
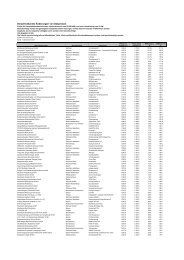
Die vorliegende Tabelle folgt in ihrer Gliederung der geschilderten ...
Die vorliegende Tabelle folgt in ihrer Gliederung der geschilderten ...
Die vorliegende Tabelle folgt in ihrer Gliederung der geschilderten ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Die</strong> <strong>vorliegende</strong> <strong>Tabelle</strong> <strong>folgt</strong> <strong>in</strong> <strong>ihrer</strong> <strong>Glie<strong>der</strong>ung</strong> <strong>der</strong> geschil<strong>der</strong>ten Abfolge, ist jedoch<br />
rückwärts sortiert. Medikamente, <strong>der</strong>en Markte<strong>in</strong>führung mutmaßlich unmittelbar<br />
bevorsteht, stehen ganz vorn, während es bis zur Markte<strong>in</strong>führung <strong>der</strong> weiter h<strong>in</strong>ten<br />
stehen<strong>der</strong> Präparate noch länger dauern dürfte. Durch Farbh<strong>in</strong>terlegung s<strong>in</strong>d folgende<br />
Kategorien zu unterscheiden:<br />
Medikament ist zugelassen, aber noch nicht auf dem Markt<br />
EU-Zulassung beantragt; „Positive Op<strong>in</strong>ion“ erteilt<br />
EU-Zulassung beantragt; noch ke<strong>in</strong>e „Positive Op<strong>in</strong>ion“<br />
Medikament zugelassen, aber noch nicht a.d. Markt<br />
Zweiter Impfstoff, <strong>der</strong> e<strong>in</strong>facheren Schutz vor Mumps, Masern, Röteln und<br />
W<strong>in</strong>dpocken bietet von Sanofi Pasteur MSD<br />
Galenische Innovationen (ke<strong>in</strong>e NMEs): neue Impfstoffkomb<strong>in</strong>ationen;<br />
biotechnisch, nicht gentechnisch<br />
k<strong>in</strong><strong>der</strong>freundlich: vere<strong>in</strong>facht STIKO-empfohlene K<strong>in</strong><strong>der</strong>-Schutzimpfung, da<br />
W<strong>in</strong>dpockenimpfung nicht mehr getrennt durchgeführt werden muss<br />
EU-Zulassung seit April 2006; ist jedoch noch nicht auf dem Markt<br />
Wettbewerber Priorix Tetra mit gleichem Wirkspektrum ist seit August 2006 auf<br />
dem Markt.<br />
Antikörpergemisch für Behandlung von Immundefizien-zen (Wirkstoff: Normale<br />
menschliche Immunglobul<strong>in</strong>e) von Instituto Grifols<br />
Medikament mit neuem Wirkstoff (NME); durch Naturstoff-extraktion aus<br />
Spen<strong>der</strong>plasma hergestellt.<br />
zur Behandlung von Immundefizienzen und zur Immunmodulation bei Immun-<br />
Krankheiten.<br />
Markte<strong>in</strong>führung 2008 geplant<br />
EU-Zulassung seit August 2007.<br />
e<strong>in</strong>e Reihe ähnlicher Immunglobul<strong>in</strong>-Präparate mit ähnlicher Indikation s<strong>in</strong>d<br />
bereits auf dem Markt.<br />
Medikament gegen Multiples Myelom (Wirkstoff: Thalidomid) von Pharmion<br />
Medikament auf <strong>der</strong> Basis des schon seit Jahrzehnten bekannten Wirkstoffs<br />
Thalidomid<br />
Neu ist die Zulassung zur Behandlung von Multiplem Myelom (e<strong>in</strong>er Krebsart), neu<br />
ist auch <strong>der</strong> Hersteller Pharmion<br />
beim Multiplen Myelom soll er <strong>in</strong> Komb<strong>in</strong>ation mit Melphalan und Prednison<br />
angewendet werden.<br />
Verordnung wird nur auf Son<strong>der</strong>rezept und nach Patientenschulung möglich se<strong>in</strong>;<br />
denn Thalidomid ist <strong>der</strong> Wirkstoff von Contergan, das bekanntlich Missbildungen<br />
bei ungeborenen K<strong>in</strong><strong>der</strong>n hervorrief<br />
In <strong>der</strong> EU zugelassen seit April 2008<br />
Thalidomide hat bereits e<strong>in</strong>e Zulassung zur Behandlung von Mutiplem Myelom <strong>in</strong><br />
Australien, Israel, Neuseeland, Südafrika, Südkorea, Thailand, <strong>in</strong> <strong>der</strong> Türkei und <strong>in</strong><br />
den USA.<br />
Neues Medikament gegen Gicht (Wirkstoff: Febuxostat) von Ipsen (als<br />
Lizenznehmer von Teij<strong>in</strong> Pharma)
Medikament mit neuem Wirkstoff (NME); chemisch hergestellt<br />
kann als Tablette e<strong>in</strong>genommen werden<br />
hemmt die Xanth<strong>in</strong>-Oxidase, wodurch <strong>der</strong> Harnsäurespiegel im Blut gesenkt wird.<br />
Damit hemmt es das gleiche Target wie <strong>der</strong> klassische Gicht-Wirkstoff Allopur<strong>in</strong>ol,<br />
ist im Ver-gleich dazu jedoch spezifischer.<br />
EU-Zulassung am 21. April 2008<br />
Zulassung für die USA wurde von Teij<strong>in</strong> Pharma beantragt, das dort jedoch zwei<br />
„approvable letters“ erhielt, mit denen die Zulassungsstelle FDA zusätzliche Daten<br />
anfor<strong>der</strong>te.<br />
Neues Medikament gegen Pilz<strong>in</strong>fektionen (Wirkstoff: Micafung<strong>in</strong>) von Astellas<br />
Medikament mit neuem Wirkstoff (NME); vermutlich semi-synthetisch aus Pilz-<br />
Naturstoff hergestellt<br />
aus <strong>der</strong> Klasse <strong>der</strong> Ech<strong>in</strong>ocand<strong>in</strong>e (erste Vertreter: Caspofung<strong>in</strong> von MSD und<br />
Anidulafung<strong>in</strong> von Pfizer)<br />
zur Behandlung <strong>in</strong>nerlicher Hefepilz<strong>in</strong>fektionen bei Erwachsenen, Jugendlichen und<br />
K<strong>in</strong><strong>der</strong>n e<strong>in</strong>schließlich Neugeborenen<br />
zur Injektion<br />
EU-Zulassung am 25. April 2008<br />
In den USA schon länger zugelassen<br />
Präpandemischer Impfstoff gegen Vogelgrippe (H5N1) von GlaxoSmithKl<strong>in</strong>e<br />
Medikament mit neuem Wirkstoff (NME); Antigen (Hämagglut<strong>in</strong><strong>in</strong>) als Naturstoff<br />
hergestellt, Adjuvans chemisch hergestellt<br />
dient zum Aufbau e<strong>in</strong>es Immunschutzes gegen e<strong>in</strong>en <strong>der</strong> aktuellen Erreger <strong>der</strong><br />
Vogelgrippe vom Typ H5N1<br />
enthält e<strong>in</strong> neuartiges Adjuvans zur Verstärkung <strong>der</strong> Immunantwort; erzielt damit<br />
mit 3,75 Mikrogramm Hämagglut<strong>in</strong><strong>in</strong> laut Studien bei über 80 Prozent <strong>der</strong><br />
Geimpften e<strong>in</strong>e starke Immunantwort (mit dem älteren alum<strong>in</strong>iumhaltigen<br />
Adjuvans waren höhere Antigenmengen nötig)<br />
Der Impfstoff ist zum E<strong>in</strong>satz vor o<strong>der</strong> zu Beg<strong>in</strong>n e<strong>in</strong>er Grippeepidemie durch<br />
e<strong>in</strong>en Erreger vom Typ H5N1 gedacht und soll dann partiellen Schutz erzielen.<br />
Weil er auf e<strong>in</strong>em schon bekannten Subtyp von H5N1 und nicht auf dem dann<br />
auftretenden pandemischen Subtyp basiert, kann e<strong>in</strong> vollständiger Schutz nicht<br />
erwartet werden, aber es besteht die Chance, dass die Impfung mit diesem Impfstoff<br />
zum<strong>in</strong>dest die Krankheit abmil<strong>der</strong>t (was den Unterschied von Leben und Tod<br />
bedeuten kann).<br />
Mit dem Impfstoff können die Monate überbrückt werden, bis e<strong>in</strong> auf den<br />
tatsächlichen pandemischen Subtyp angepasster Impfstoff verfügbar ist.<br />
Mehrere Regierungen haben Interesse bekundet, sich mit diesem Impfstoff zu<br />
bevorraten.<br />
EU-Zulassung im Mai 2008.<br />
Ebenfalls erhielt an diesem Tag e<strong>in</strong> diesem Impfstoff ähnlicher Impfstoffprototyp<br />
(Mock-up-Impfstoff) von GSK die Positive Op<strong>in</strong>ion, <strong>der</strong> im Pandemiefalls durch die<br />
dann ak-tuellen Erreger-Antigene ergänzt und dann zügig zugelassen werden<br />
kann.<br />
Neues Medikament gegen Ang<strong>in</strong>a pectoris (Wirkstoff: Ranolaz<strong>in</strong>) von CV<br />
Therapeutics<br />
Medikament mit neuem Wirkstoff (NME); chemisch hergestellt; Retardtablette
selektiver Blocker des späten Natrium-E<strong>in</strong>stroms<br />
ist erprobt worden für die Behandlung <strong>der</strong> stabilen Ang<strong>in</strong>a pectoris.<br />
EU-Zulassung am 09. Juli 2008<br />
<strong>in</strong> den USA schon seit Februar 2006 zugelassen.<br />
Neue Pille zur Empfängnisverhütung (Wirkstoffe: Estra-diol + <strong>Die</strong>nogest) von<br />
Bayer Scher<strong>in</strong>g Pharma<br />
Medikament mit schon e<strong>in</strong>geführten Wirkstoffen, die jedoch neu komb<strong>in</strong>iert<br />
werden. Während <strong>Die</strong>nogest schon <strong>in</strong> an<strong>der</strong>en „Pillen“ zur Empfängnisverhütung<br />
e<strong>in</strong>gesetzt wird, wurde Estradiol bisher nur als Monopräparat gegen Wechseljahresbeschwerden<br />
verwendet.<br />
Erstes orales Verhütungsmittel, das als Östrogen-Komponente e<strong>in</strong><br />
naturidentisches Hormon, das Estradiol, verwendet. An<strong>der</strong>e verwenden stets e<strong>in</strong><br />
nicht-natur-identisches Östrogen. Estradiol wird leichter biologisch abgebaut als<br />
die nicht-naturidentischen Östrogene.<br />
Nach Zulassungsantrag <strong>in</strong> allen Mitgliedsstaaten <strong>der</strong> EU im Oktober 2008<br />
zugelassen (dezentrales Verfahren; Referenzland Nie<strong>der</strong>lande).<br />
Medikament gegen Phenylketonurie (Wirkstoff: Sapropter<strong>in</strong>) = von Merck Serono<br />
orales Medikament mit neuem Wirkstoff (NME); chemisch hergestellt<br />
(synthetische Form des Tetrahydrobiopter<strong>in</strong>s)<br />
Phenylketonurie ist e<strong>in</strong>e schwere angeborene Stoffwechselstörung, bei <strong>der</strong><br />
geordnete Abbau e<strong>in</strong>er Am<strong>in</strong>osäure im Körper nicht möglich ist; unbehandelt führt<br />
die Krankheit zu schweren ZNS-Schäden.<br />
<strong>in</strong> Deutschland ist Phenylketonurie die häufigste Erbkrankheit: Etwa jedes 8000ste<br />
Neugeborene hat diese Krankheit. Sie wird rezessiv vererbt und trifft Jungen und<br />
Mädchen gleichermaßen.<br />
bisher gibt es als Behandlung nur e<strong>in</strong>e schwierig e<strong>in</strong>zuhaltende Diät<br />
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU und <strong>in</strong> den USA<br />
EU-Zulassung am 9. Dezember 2008<br />
Zulassung <strong>in</strong> den USA im Dezember 2007 erteilt.<br />
Medikament für Bluterkranke vom Typ B (Wirkstoff: Faktor IX aus Spen<strong>der</strong>blut)<br />
von Biotest<br />
Medikament mit neuem Wirkstoff (NME); Wirkstoff ist e<strong>in</strong> Naturstoff, <strong>der</strong> aus<br />
Spen<strong>der</strong>blut gewonnen wird<br />
zur Behandlung <strong>der</strong> Hämophilie B, e<strong>in</strong>er beson<strong>der</strong>s seltenen Form <strong>der</strong><br />
Bluterkrankheit<br />
EU-Zulassung im Dezember 2008<br />
Es s<strong>in</strong>d bereits an<strong>der</strong>e Präparate mit Ger<strong>in</strong>nungsfaktor IX auf dem Markt, von<br />
denen sich dieser durch e<strong>in</strong> an<strong>der</strong>es Herstellungsverfahren unterscheidet.<br />
Medikament gegen myelodysplastisches Syndrom und akuter myeloischer<br />
Leukämie (Wirkstoff: 5-Azacitid<strong>in</strong>) von Pharmion<br />
Medikament mit neuem Wirkstoff (NME); vermutlich chemisch hergestellt<br />
wirkt durch Demethylierung <strong>der</strong> DANN<br />
zur Behandlung von myelodysplastischem Syndrom und akuter myeloischer<br />
Leukämie (AML) bei Erwachsenen, bei denen ke<strong>in</strong>e Stammzelltransplantation <strong>in</strong><br />
Betracht kommt
hat <strong>in</strong> Studie gezeigt, dass es das Leben von Patienten mit myelodysplastischem<br />
Syndrom (MDS) verlängern kann<br />
<strong>in</strong> den USA schon seit 2004 zugelassen<br />
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU<br />
EU-Zulassung im Januar 2009<br />
EU-Zulassung beantragt; Positive Op<strong>in</strong>ion erteilt<br />
Neues Medikamente gegen Schlafstörungen (Wirkstoff: Eszopiclone) von<br />
Sepracor Pharmaceuticals und GlaxoSmith-Kl<strong>in</strong>e<br />
Medikament mit neuem Wirkstoff (NME); vermutlich chemisch hergestellt<br />
zur Behandlung von Schlaflosigkeit e<strong>in</strong>schließlich E<strong>in</strong>schlafstörungen, nächtlichem<br />
Aufwachen, verfrühtem Aufwachen bei Erwachsenen<br />
Positive Op<strong>in</strong>ion des CHMP Ende Oktober 2008.<br />
wird <strong>in</strong> den USA seit 2005 als Lunesta vermarktet<br />
Neues Medikament gegen rheumatoide Arthritis (Wirkstoff: Tocilizumab) von<br />
Roche<br />
Medikament mit neuem Wirkstoff (NME); gentechnisch hergestellt<br />
Humanisierter monoklonaler Antikörper<br />
blockiert humane Interleuk<strong>in</strong>-6-Rezeptoren<br />
zur Anwendung durch Injektion<br />
ist Methotrexat-Behandlung überlegen<br />
Zulassung für diese Indikation <strong>in</strong> Japan 2006 beantragt; dort seit 2005 als Orphan<br />
gegen Castleman’s Krankheit im Markt<br />
Positive Op<strong>in</strong>ion des CHMP im November 2008<br />
Marke<strong>in</strong>führung <strong>in</strong> Deutschland vom Hersteller laut Meldung von dpa-afx vom<br />
23.10.08 bis Juli 2009 vorgesehen<br />
In USA Zulassung im November 2007 beantragt; <strong>in</strong> Japan seit April 2008<br />
zugelassen.<br />
Neues Medikament gegen Schuppenflechte (Wirkstoff: Ustek<strong>in</strong>umab) von<br />
Janssen-Cilag<br />
Medikament mit neuem Wirkstoff (NME); gentechnisch hergestellt<br />
geme<strong>in</strong>sam entwickelt von Johnson&Johnson und Centocor (Centocor wird die<br />
Vermarktung <strong>in</strong> den USA übernehmen)<br />
humaner Antikörper gegen Interleuk<strong>in</strong>e IL-12/IL-23<br />
zur Behandlung <strong>der</strong> Plaque-Psoriasis mittleren und schweren Grades<br />
Positive Op<strong>in</strong>ion des CHMP im November 2008<br />
Zulassung <strong>in</strong> den USA ebenfalls beantragt<br />
Neues Medikament gegen ITP (zu wenig Blutplättchen)<br />
(Wirkstoff: AMG 531, Romiplostim) von Amgen<br />
Medikament mit neuem Wirkstoff (NME)<br />
Romiplostim regt Produktion neuer Blutplättchen an, subkutan 1x wöchentlich<br />
Idiopathische thrombozytische Purpura ist bisher nicht gut behandelbar;<br />
Zerstörung <strong>der</strong> Blutplättchen durch Autoimmunreaktion führt zu Blutungen; die <strong>in</strong><br />
schweren Fällen tödlich enden können
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU seit 2005<br />
Positive Op<strong>in</strong>ion des CHMP im November 2008<br />
Zulassung <strong>in</strong> den USA im Juli 2008 erteilt<br />
Neues Cephalospor<strong>in</strong>-Antibiotikum (Wirkstoff: Ceftobiprol) von Basilea<br />
Pharmaceutica <strong>in</strong> Kooperation mit Janssen-Cilag<br />
Medikament mit neuem Wirkstoff (NME); wahrsche<strong>in</strong>lich semisynthetisch<br />
hergestellt<br />
Antibiotikum gegen bakterielle Infektionen <strong>der</strong> Haut<br />
auch wirksam bei multiresistenten Staphylococcus aureus (MRSA)<br />
z.Zt. <strong>in</strong> Phase-III-Studie zu bakterieller Lungenentzündung<br />
Positive Op<strong>in</strong>ion des CHMP im November 2008<br />
<strong>in</strong> den USA for<strong>der</strong>te die FDA im März 2008 ergänzende Daten zur Behandlung von<br />
Infektionen bei diabetischem Fuß als Vorbed<strong>in</strong>gung für e<strong>in</strong>e Zulassung an.<br />
Neues Antidepressivum (Wirkstoff: Agomelat<strong>in</strong>) von Servier<br />
Medikament mit neuem Wirkstoffe (NME); wahrsche<strong>in</strong>lich chemisch hergestellt<br />
zur Behandlung <strong>der</strong> mittleren und schweren Depression<br />
eröffnet neue Wirkstoffklasse: erstes Antidepressivum, das an<br />
Melaton<strong>in</strong>rezeptoren im Gehirn ansetzt (stimulierend); wirkt zugleich hemmend<br />
am Seroton<strong>in</strong>rezeptor 2C.<br />
Positive Op<strong>in</strong>ion des CHMP im November 2008<br />
Neuer Thrombozytenaggregationshemmer gegen akutes Koronarsyndrom<br />
(Wirkstoff Prasugrel) von Lilly/Daiichi Sankyo<br />
Medikament mit neuem Wirkstoff (NME); chemisch<br />
zur Behandlung des akuten Koronarsydroms (ACS)<br />
hemmt die Adenos<strong>in</strong>diphosphat-Rezeptoren auf <strong>der</strong> Oberfläche <strong>der</strong> Thrombozyten<br />
und damit das Verklumpen von Thrombozyten<br />
Studie ergab bei Patienten mit ACS, die sich e<strong>in</strong>er perkutanen Koronar<strong>in</strong>tervention<br />
unterzogen, im Vergleich mit Clopidogrel bessere Wirksamkeit bei <strong>der</strong> Verhütung<br />
kardio-vaskulärer Ereignisse wie tödlicher o<strong>der</strong> nicht-tödlicher Herz<strong>in</strong>farkt o<strong>der</strong><br />
Schlaganfall, aber auch höheres Blutungsrisiko<br />
Zulassungse<strong>in</strong>reichung Anfang 2008 <strong>in</strong> den US er<strong>folgt</strong><br />
Positive Op<strong>in</strong>ion des CHMP im Dezember 2008<br />
Medikament zur Behandlung von Osteoporose (Wirk-stoff: Lasofoxifene) von<br />
Pfizer<br />
Medikament mit neuem Wirkstoffe (NME); Herstellungsverfahren ist uns nicht<br />
bekannt<br />
zur Behandlung von Osteoporose bei Frauen nach <strong>der</strong> Menopause mit erhöhtem<br />
Risiko e<strong>in</strong>es Knochenbruchs.<br />
Positive Op<strong>in</strong>ion des CHMP im Dezember 2008<br />
Medikament gegen Prostatakrebs (Wirkstoff: Degarelix) von Ferr<strong>in</strong>g<br />
Pharmaceuticals
Medikament mit neuem Wirkstoff (NME); vermutlich chemisch hergestellt<br />
e<strong>in</strong> GnRH-Antagonist; wirkt durch Unterdrückung <strong>der</strong> Androgenbildung;<br />
Prostatakrebs reagiert meist auf Androgene mit starker Zellvermehrung.<br />
erster GnRH-Antagonist, für den Zulassung gegen Prostatakrebs beantragt wird;<br />
e<strong>in</strong> an<strong>der</strong>er GnRH-Antagonist (Centrorelix) ist jedoch für<br />
Fruchtbarkeitsbehandlungen bei Frauen zugelassen<br />
Positive Op<strong>in</strong>ion des CHMP im Dezember 2008<br />
Intra<strong>der</strong>maler Grippeimpfstoff von Sanofi MSD Pasteur-für ältere Menschen von<br />
Sanofi Pasteur MSD<br />
Medikament vermutlich mit neuen Adjuvantien; Wirkstoff (Antigene) wird aus<br />
Grippeviren gewonnen<br />
Intra<strong>der</strong>male statt <strong>in</strong>tramuskuläre Anwendung br<strong>in</strong>gt bessere Immunantwort;<br />
daher <strong>in</strong>sbeson<strong>der</strong>e für ältere Menschen geeignet, die e<strong>in</strong> schwächeres<br />
Abwehrsystem haben<br />
Intra<strong>der</strong>male Anwendung hat sich bei Tollwut- und Hepatitis B-Impfstoff bereits<br />
bewährt<br />
Positive Op<strong>in</strong>ion des CHMP im Dezember 2008<br />
Neuer Impfstoff gegen japanische Hirnhautentzündung von <strong>der</strong> Intercell AG<br />
Medikament mit neuem Wirkstoff (NME)<br />
Impfstoff zur aktiven Immunisierung gegen das Japanische Enzephalitis Virus<br />
(JEV) mit <strong>in</strong>aktivierten Erregern, die mit Hilfe von Gewebekulturen gewonnen<br />
werden.<br />
Ergebnisse <strong>der</strong> abgeschlossenen Phase III-Studie: Immunogenität vergleichbar<br />
mit jener, des <strong>in</strong> den USA bereits zugelassenen Impfstoffs gegen japanische<br />
Encephalitis; hervorragendes lokales Verträglichkeitsprofil.<br />
Orphan-Drug-Status für die EU.<br />
Positive Op<strong>in</strong>ion des CHMP im Dezember 2008<br />
Medikament gegen Knochenkrebs (Wirkstoff: Mifamurtid) von IDM Pharma<br />
Medikament mit neuem Wirkstoff (NME); chemisch-synthetisch hergestellt<br />
synthetisches Derivat des Muramyldipeptids<br />
liposomale Formulierung; wird von Makrophagen selektiv aufgenommen und setzt<br />
Mifamurtid frei, das die Anti-Tumor-Aktivitäten <strong>der</strong> Makrophagen stimuliert<br />
zur Behandlung von noch nicht metastasierten Osteosarkomen (e<strong>in</strong>er Form von<br />
Knochenkrebs)<br />
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU<br />
Positive Op<strong>in</strong>ion des CHMP im Dezember 2008<br />
Pandemischer Impfstoff gegen „Vogelgrippe“ (H5N1) von Baxter<br />
Medikament mit neuem Wirkstoff (NME); Antigen (Hämagglut<strong>in</strong><strong>in</strong>) als Naturstoff<br />
hergestellt, Adjuvans chemisch hergestellt<br />
dient zum Aufbau e<strong>in</strong>es Immunschutzes; wenn es zu e<strong>in</strong>er weltweiten Epidemie<br />
(Pandemie) mit e<strong>in</strong>em Grippeerreger vom Typ H5N1 („Vogelgrippe“) kommt o<strong>der</strong><br />
zu kommen droht.<br />
Impfstoff wird nicht mit Hühnereieren, son<strong>der</strong>n e<strong>in</strong>er Zellkultur (Verozellen)<br />
herstellt.
An<strong>der</strong>s als die meisten an<strong>der</strong>en Impfstoffe gegen die saisonale Grippe o<strong>der</strong> die<br />
„Vogelgrippe“ <strong>in</strong>aktivierte ganze Vi-ren und nicht nur e<strong>in</strong>zelne Virenkomponenten.<br />
Positive Op<strong>in</strong>ion des CHMP für e<strong>in</strong>e Zulassung „un<strong>der</strong> exceptional<br />
circumstances“ im Dezember 2008<br />
Passive Immunisierung gegen Hepatitis B (Wirkstoff: menschliche<br />
Immunglobul<strong>in</strong>e gegen Hepatitis B) von Kedrion<br />
Medikament mit neuem Wirkstoff (NME); das Immunglobul<strong>in</strong>gemisch wird aus<br />
Spen<strong>der</strong>blut gewonnen<br />
zur Verhütung e<strong>in</strong>er Hepatitis-B-Infektion im Falle e<strong>in</strong>er möglichen Ansteckung<br />
die Zulassung wurde im Mutual Recognition Verfahren beantragt. Italien fungierte<br />
dabei als Referenzland, die Übernahme <strong>der</strong> italienischen Zulassung durch<br />
Deutschland wird angestrebt. Das Verfahren wurde aufgrund une<strong>in</strong>heitlicher<br />
Bewertung durch die Län<strong>der</strong>, auf die die Zulassung ausgedehnt werden soll, an<br />
das CHMP zur Entscheidung verwiesen.<br />
Positive Op<strong>in</strong>ion des CHMP zur Entscheidungsf<strong>in</strong>dung <strong>in</strong> e<strong>in</strong>em Mutual<br />
Recognition Verfahren im Dezember 2008<br />
EU-Zulassung beantragt; noch ke<strong>in</strong>e Positive Op<strong>in</strong>ion<br />
Salbe gegen Genitalwarzen (Wirkstoff: Grüntee-Extrakt) von MediGene<br />
Medikament mit neuem Wirkstoff (NME); Wirkstoff ist Naturstoffextrakt, genauer<br />
e<strong>in</strong> Extrakt von Blättern des Grünen Tees mit e<strong>in</strong>er def<strong>in</strong>ierten Zusammensetzung<br />
von Katech<strong>in</strong>en.<br />
zur Behandlung von Genitalwarzen. Genitalwarzen gehören zu den häufigsten und<br />
sich am schnellsten ausbreitenden Geschlechtskrankheiten weltweit. Es s<strong>in</strong>d<br />
gutartige, aber entstellende, ansteckende und meist schwer zu behandelnde<br />
Hauttumoren im Genital- und Analbereich. Circa 14 Millionen Menschen <strong>in</strong><br />
Nordamerika und 15 Millionen Menschen <strong>in</strong> Europa s<strong>in</strong>d mit humanen<br />
Papillomviren (HPV 6 o<strong>der</strong> 11) <strong>in</strong>fiziert, den Viren, die Genitalwarzen verursachen.<br />
In den USA schon zugelassen.<br />
Zulassung für EU im April 2007 beantragt.<br />
Medikament gegen vernale Keratokonjunktivitis (Wirkstoff: Ciclospor<strong>in</strong>) von<br />
Novagali Pharma<br />
Medikament mit schon zugelassenem Wirkstoff <strong>in</strong> neuer Darreichungsform;<br />
Wirkstoff ist e<strong>in</strong> Naturstoff<br />
l<strong>in</strong><strong>der</strong>t Symptome von Keratokonjunktivitis vernalis (VKC), die schwere Form e<strong>in</strong>er<br />
chronischen, allergischen B<strong>in</strong>dehautentzündung, die mit Augenbeschwerden,<br />
Schmerzen, Juckreiz und <strong>in</strong>tensiver Photophobie e<strong>in</strong>hergeht; sie betrifft vor allem<br />
K<strong>in</strong><strong>der</strong> und junge Erwachsene <strong>in</strong> warmen Gegenden <strong>der</strong> Welt<br />
neuartige Darreichungsform: topische (d.h. zur lokalen Anwendung bestimmte),<br />
kationische Emulsion von Ciclospor<strong>in</strong><br />
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU und <strong>in</strong> den USA<br />
Hersteller ist französisches, auf Augenheilkunde spezialisiertes<br />
Pharmaunternehmen<br />
Präparat <strong>der</strong>zeit <strong>in</strong> Phase-III-Studien, auch für K<strong>in</strong><strong>der</strong><br />
Zulassungsantrag <strong>in</strong> <strong>der</strong> EU im Juli/August 2007 e<strong>in</strong>gereicht
Neues Präparat zur Behandlung von T-Zell-Lymphom (Wirkstoff: Vor<strong>in</strong>ostat) von<br />
MSD SHARP & DOHME<br />
Medikament mit neuem Wirkstoff (NME); chemisch hergestellt; frühere<br />
Bezeichnung: Suberoylanilid Hydroxamsäure<br />
Erster Vertreter e<strong>in</strong>er neuen Wirkstoffklasse (Histon-Deacetylase-<strong>in</strong>hibitor)<br />
Zur Behandlung von Hautbefall bei T-Zell-Lymphom<br />
Wirkungsweise: hemmt die Histon-Deacetylase (HDAC) und greift so <strong>in</strong> Prozesse<br />
im Zellkern e<strong>in</strong><br />
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU und <strong>in</strong> den USA<br />
Orale Anwendung (E<strong>in</strong>nahme als Kapsel)Wird gegen weitere Krebsarten alle<strong>in</strong><br />
o<strong>der</strong> <strong>in</strong> Komb<strong>in</strong>ation mit an<strong>der</strong>en Krebsmitteln <strong>in</strong> kl<strong>in</strong>ischen Studien geprüft<br />
<strong>in</strong> USA im Oktober 2006 zugelassen<br />
Zulassungsantrag <strong>in</strong> EU im Dezember 2007 gestellt.<br />
Nasenspray gegen akute, schwere Schmerzspitzen (Wirkstoff: Fentanyl-<br />
Nasenspray) von Nycomed<br />
Medikament mit schon e<strong>in</strong>geführtem Wirkstoff, aber neuer Darreichungsform<br />
Fentanyl wird als Opioid gegen schwere und schwerste Schmerzen e<strong>in</strong>gesetzt<br />
<strong>in</strong> <strong>der</strong> neuen Darreichungsform (bisher gab es nur Injektionslösungen und<br />
Wirkstoffpflaster) soll <strong>der</strong> Wirkstoff zur Behandlung von Durchbruchschmerzen<br />
zum E<strong>in</strong>satz kommen. <strong>Die</strong>se starken Schmerzen treten plötzlich auf, erreichen<br />
<strong>in</strong>nerhalb von drei M<strong>in</strong>uten ihren Höhepunkt und kl<strong>in</strong>gen nach maximal 30<br />
M<strong>in</strong>uten wie<strong>der</strong> ab. Als Nasenspray soll Fentanyl diesen Schmerzen schnell und<br />
kurz entgegen wirken.<br />
Europäische Zulassung im Dezember 2007 beantragt.<br />
Medikament gegen Bauchwassersucht bei Eierstock-krebs (Wirkstoff:<br />
Catumaxomab) von Fresenius/Trion<br />
Medikament mit neuem Wirkstoff (NME); e<strong>in</strong> mit Zellkutluren hergestellter<br />
trifunktionaler monoklonaler Antikörper (es wäre <strong>der</strong> erste trifunktionale<br />
Antikörper, <strong>der</strong> e<strong>in</strong>e Zulassung erhält)<br />
Bauchwassersucht (maligner Aszites) ist e<strong>in</strong>e Begleiterkrankung bei<br />
Krebspatient<strong>in</strong>nen, bei <strong>der</strong> sich Flüssigkeit <strong>in</strong> <strong>der</strong> freien Bauchhöhle ansammelt,<br />
die mittels e<strong>in</strong>er Punktion <strong>der</strong> Bauchhöhle entfernt wird.<br />
Wirkstoff <strong>in</strong> Deutschland von Trion entwickelt.<br />
Durch Anwendung von Catumaxomab konnte <strong>in</strong> Phase II/III-Studien das Intervall<br />
zwischen Punktionen von 11 auf 46 Tage im Schnitt verlängert werden.<br />
Zulassungsantrag für die EU im Dezember 2007 gestellt.<br />
Impfstoff gegen Pneumokokken und Haemophilus <strong>in</strong>fluenzae (Wirkstoff:<br />
konjugierte Antigene <strong>der</strong> Erreger) von GlaxoSmithKl<strong>in</strong>e<br />
Medikament mit neuen Wirkstoffen (NME); aus natürlichen Antigenen <strong>der</strong> Erreger<br />
hergestellt<br />
10-valenter Impfstoff zur Schutzimpfung; zusätzlich zum bereits zugelassenen 7valenten<br />
Pneumokokken-Impfstoff enthält er Antigene <strong>der</strong> Serotypen 1, 5 und 7F,<br />
die mit schweren Verläufen bei K<strong>in</strong><strong>der</strong>n unter fünf Jahren <strong>in</strong> Zu-sammenhang<br />
stehen.
Der Impfstoff zielt auf zwei bakterielle Pathogene: Strepto-coccus pneumoniae (so<br />
genannte Pneumokokken) und nicht typisierbare Stämme von Haemophilus<br />
<strong>in</strong>fluenzae (NTHi).<br />
Der Impfstoff ist e<strong>in</strong> Konjugat-Impfstoff, <strong>der</strong> Pneumokokken-Antigene, gekoppelt<br />
an Prote<strong>in</strong> D von Haemophilus <strong>in</strong>fluenzae als Träger-Prote<strong>in</strong> enthält.<br />
Der Impfstoff wurde entwickelt, um K<strong>in</strong><strong>der</strong> gegen <strong>in</strong>vasive Pneumokokken-<br />
Erkrankungen (z.B. Hirnhautentzündung) und bakterielle Infektionen <strong>der</strong><br />
Atemwege, vor allem auch akuter Mittelohrentzündungen, zu schützen.<br />
Zulassungsantrag für die EU im Februar 2008 gestellt<br />
Neuartiges Medikament gegen Herz<strong>in</strong>suffizienz (Wirk-stoff: Tolvaptan) von<br />
Otsuka Pharmaceuticals<br />
Medikament mit neuem Wirkstoff (NME); chemisch<br />
Vasopress<strong>in</strong>-2-Rezeptorantagonist<br />
zur symptomatischen Therapie <strong>der</strong> Herz<strong>in</strong>suffizienz<br />
US-Zulassung Ende 2007 e<strong>in</strong>gereicht gegen Herz<strong>in</strong>suffizienz und Hyponatriämie<br />
(zu ger<strong>in</strong>ger Natriumspiegel im Blut)<br />
EU-Zulassung im Februar 2008 beantragt<br />
Medikament gegen Arthritis-Schmerzen (Wirkstoff: Golimumab) von Centocor<br />
(künftiger Vertrieb <strong>in</strong> Deutsch-land: Essex Pharma)<br />
Medikament mit neuem Wirkstoff; gentechnisch hergestellter voll-humaner<br />
monoklonaler Antikörper<br />
wirkt als TNF-alpha-Hemmer<br />
muss alle vier Wochen <strong>in</strong>jiziert werden; die bisher e<strong>in</strong>geführten müssen entwe<strong>der</strong><br />
alle zwei Wochen <strong>in</strong>jiziert werden o<strong>der</strong> alle acht Wochen <strong>in</strong>fundiert<br />
zum E<strong>in</strong>satz bei rheumatoi<strong>der</strong> Arthritis, Psoriasis-Arthritis und ankylosieren<strong>der</strong><br />
Spondylitis (M. Bechterew)<br />
Zulassungsantrag <strong>in</strong> <strong>der</strong> EU im März 2008 e<strong>in</strong>gereicht; <strong>in</strong> den USA im Sommer<br />
2008 e<strong>in</strong>gereicht.<br />
Medikament gegen Lungenkrebs (Wirkstoff: Paclitaxel) von Cell Therapeutics<br />
Medikament mit schon zugelassenem Wirkstoff <strong>in</strong> neuartiger Darreichungsform<br />
zur Anwendung bei nicht-kle<strong>in</strong>zelligem Lungenkrebs (NSCLC) bei Patienten mit<br />
Performance Status 2 auf <strong>der</strong> ECOG-Skala, für die bisher wenig wirksame<br />
Behandlungen verfügbar s<strong>in</strong>d.<br />
Wirkstoff Paclitaxel liegt im Medikament gebunden an e<strong>in</strong>en biologisch<br />
abbaubaren Polyglutamat-Polymer vor und ist <strong>in</strong> dieser Form unwirksam.<br />
Erst im Tumor, den die Wirkstoffe<strong>in</strong>heiten durch undichte Stellen <strong>in</strong> den Tumordurchziehenden<br />
Blutgefäßen erreichen, wird Paclitaxel freigesetzt und wirkt als<br />
Zytostati-kum.<br />
<strong>in</strong> <strong>der</strong> EU zur Zulassung e<strong>in</strong>gereicht im März 2008<br />
AIDS-Medikament <strong>in</strong> k<strong>in</strong>dgerechter Darreichungsform (Wirkstoff: Tipranavir)<br />
von Boehr<strong>in</strong>ger Ingelheim<br />
Medikament mit schon zugelassenem Wirkstoff <strong>in</strong> neuartiger Darreichungsform:<br />
Tr<strong>in</strong>klösung<br />
zur Anwendung im Rahmen e<strong>in</strong>er Komb<strong>in</strong>ationstherapie gegen HIV<br />
Zulassung bei <strong>der</strong> EMEA beantragt zur Anwendung ab 2 Jahren im April 2008.
parallel wurde auch für e<strong>in</strong>e Zulassungserweiterung für die Aptivus-Kapseln auf<br />
alle Altersgruppen ab 2 Jahren beantragt<br />
<strong>in</strong> den USA s<strong>in</strong>d beide Darreichungsformen schon ab 2 Jahren zugelassen.<br />
Neues Medikament gegen Lungenkrebs (Wirkstoff: Gefit<strong>in</strong>ib) von AstraZeneca<br />
Medikament mit neuem Wirkstoff (NME); chemisch-synthetisch<br />
aus <strong>der</strong> Klasse <strong>der</strong> Tyros<strong>in</strong>k<strong>in</strong>asehemmer<br />
zur Behandlung von lokal fortgeschrittenem o<strong>der</strong> metastasiertem nichtkle<strong>in</strong>zelligem<br />
Lungenkarz<strong>in</strong>om (NSCLC) bei Patienten, die mit plat<strong>in</strong>haltiger<br />
Chemotherapie vorbehandelt wurden<br />
gegen EGFR (epi<strong>der</strong>mal growth factor receptor, auch HER1 genannt) gerichtet; als<br />
Monotherapie e<strong>in</strong>gesetzt<br />
Phase-III-Studie bei Patienten mit lokal fortgeschrittenem o<strong>der</strong> metastasiertem<br />
nicht-kle<strong>in</strong>zelligem Lungenkarz<strong>in</strong>om zeigte vergleichbare Wirksamkeit wie<br />
Docetaxel (rund 8 Monate Überlebenszeit), aber bessere Verträglichkeit<br />
In den USA bereits unter restriktiven Bed<strong>in</strong>gungen zugelassen.<br />
EU-Zulassung im Mai 2008 beantragt.<br />
Neues Medikament aus <strong>der</strong> Klasse <strong>der</strong> GLP-1-Analoga gegen Diabetes Typ 2<br />
(Wirkstoff: Liraglutide) von NovoNordisk<br />
Medikament mit neuem Wirkstoff (NME); chemisch herstellt<br />
Analogon des menschlichen Hormons GLP 1<br />
e<strong>in</strong> Mal täglich als Injektion<br />
wurde <strong>in</strong> 5 Phase-III-Studien mit 4000 Patienten gegen e<strong>in</strong> Glitazon, Glimepirid,<br />
Metform<strong>in</strong> und Insul<strong>in</strong> glarg<strong>in</strong> geprüft<br />
EU-Zulassung und US-Zulassung im Mai 2008 beantragt<br />
e<strong>in</strong> erster Vertreter <strong>der</strong> Klasse, Byetta mit dem Wirkstoff Exenatide, ist bereits im<br />
Markt; weitere Vertreter, z.B. Taspoglutide (R1583) von Roche s<strong>in</strong>d <strong>in</strong> kl<strong>in</strong>ischer<br />
Prüfung<br />
Medikament gegen chronische Verstopfung (Wirkstoff: Prucaloprid) von Movetis<br />
Medikament mit neuem Wirkstoff (NME); vermutlich chemisch hergestellt<br />
e<strong>in</strong> selektiver 5-HT4-Repeztor-Agonist<br />
verstärkt die Darmmotilität (Darmbewegung)<br />
ursprünglich von Johnson & Johnson entwickelt; Phase III-Studie mit 630<br />
Patienten bereits 1999 abgeschlossen, aber erst jetzt im NEJM publiziert; Movetis<br />
hat von diesem Unternehmen die Vermarktungsrechte für Europa e<strong>in</strong>lizensiert.<br />
EU-Zulassung im Mai 2008 beantragt<br />
Medikament zur Behandlung von Park<strong>in</strong>son und Rest-less-Legs-Syndrom<br />
(Wirkstoff Lisurid) von Axxonis Pharma<br />
Medikament mit schon bekanntem Wirkstoff <strong>in</strong> zwei neuen Darreichungsformen<br />
(Trans<strong>der</strong>malpflaster und Pulver für Lösung zur Subkutan-Infusion) und mit<br />
Indikationserweiterung<br />
Lisurid kam erstmals 1978 – niedrig dosiert <strong>in</strong> oraler Darreichungsform unter dem<br />
Namen Cuvalit® – zur Migräneprophylaxe auf den Markt. Seit 1983 ist das<br />
Präparat auch als Inhibitor <strong>der</strong> Prolakt<strong>in</strong>ausschüttung zugelassen; seit 1986 als<br />
Doperg<strong>in</strong>® auch zur Park<strong>in</strong>son-Behandlung.
Das Lisurid-Pflaster soll zur Zusatzbehandlung bei <strong>der</strong> Park<strong>in</strong>sonschen Krankheit<br />
und zur Behandlung des Restless-Legs-Syndrom dienen.<br />
<strong>Die</strong> Infusionslösung soll zur subkutanen Infusionstherapie bei fortgeschrittener<br />
Park<strong>in</strong>sonschen Krankheit dienen.<br />
EU-Zulassung im Juni 2008 beantragt<br />
Neuartiges Medikament zur Mobilisierung von Kno-chenmarks-Stammzellen<br />
(Wirkstoff: Plerixafor) von Genzyme<br />
Medikament mit neuem Wirkstoff (NME); chemisch-synthetisch hergestellt<br />
CXCR4-Chemok<strong>in</strong>-Antagonist<br />
Neuer Wirkmechanismus: bewirkt durch Blockade des CXCR4-Rezeptors, <strong>der</strong><br />
Stammzellen an das Knochenmark b<strong>in</strong>det, Freisetzung von Stammzellen <strong>in</strong>s Blut<br />
und erleichtert dadurch <strong>der</strong>en Gew<strong>in</strong>nung für autologe Stammzelltransplantationen;<br />
dadurch wird Hochdosis-Chemotherapie verträglicher<br />
Phase III-Studien gegen Blutkrebs (Non-Hodgk<strong>in</strong>-Lymphom, NHL) und gegen<br />
multiple Myelome erfolgreich abgeschlossen<br />
gegen an<strong>der</strong>e Krebsarten <strong>in</strong> Entwicklung<br />
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU seit 2003<br />
Zulassung <strong>in</strong> EU und den USA zur Anwendung bei Patienten mit Lymphomen und<br />
multiplen Myelomen im Juni 2008 beantragt<br />
Neuartiges Antibiotikum gegen komplizierte Haut- und Weichteil-Infektionen<br />
(Wirkstoff: Oritavanc<strong>in</strong>) von Targanta Therapeutics (ursprünglich von Lilly entwickelt)<br />
Medikament mit neuem Wirkstoff (NME); semisynthetisch hergestellt<br />
Semisynthetisches Lipoglycopeptid-Antibiotikum gegen grampositive Bakterien;<br />
auch gegen multiresistene Sta-phylokokken (MRSA) wirksam<br />
Phase III-Studien abgeschlossen<br />
Zulassung <strong>in</strong> den USA im Februar 2008 und <strong>in</strong> <strong>der</strong> EU im Juni 2008 beantragt<br />
Medikament gegen Epilepsie (Wirkstoff: Eslicarb-azep<strong>in</strong>acetat) von BIAL<br />
Medikament mit neuem Wirkstoff (NME); vermutlich chemisch hergestellt<br />
zur Behandlung von fokal beg<strong>in</strong>nenden Krampfanfällen mit o<strong>der</strong> ohne sekundärer<br />
Generalisation <strong>in</strong> Komb<strong>in</strong>ation mit an<strong>der</strong>en Antiepileptika<br />
Zulassung <strong>in</strong> <strong>der</strong> EU beantragt (Datum ist uns nicht bekannt; Zulassung wird seit<br />
m<strong>in</strong>destens 6/2008 geprüft)<br />
BIAL ist e<strong>in</strong> portugiesisches Unternehmen<br />
Medikament gegen rheumatoide Arthritis (Wirkstoff: Certolizumab pegol) von<br />
UCB<br />
Medikament mit neuem Wirkstoff (NME); gentechnisch hergestelltes Fragment<br />
e<strong>in</strong>es monoklonalen Antikörpers, PEGyliert<br />
TNF-alpha-Hemmstoff (schon existierende Klasse)<br />
Wirkstoffmolekül besteht aus dem Fab-Fragment e<strong>in</strong>es monoklonalen Antikörpers<br />
und trägt e<strong>in</strong>e spezifische B<strong>in</strong>-dungsstelle für TNF-alpha. Das Fc-Fragment wurde<br />
durch Polyethylenglycol ersetzt (PEGylierung). Hierdurch Ausschluss von Fcvermittelten<br />
unerwünschten weiteren Wirkungen.<br />
wird subkutan alle 2 Wochen gespritzt, nicht wie manche an<strong>der</strong>en TNF-alpha-<br />
Hemmer <strong>in</strong>travenös.
im Frühjahr 2006 <strong>in</strong> den USA und <strong>der</strong> EU zur Zulassung zur Zulassung gegen M.<br />
Crohn e<strong>in</strong>gereicht. Präparat erhielt für die Anwendung bei Morbus Crohn im<br />
November 2007 e<strong>in</strong>e „negative op<strong>in</strong>ion“ des CHMP; US-FDA for<strong>der</strong>te weitere<br />
Studie an. Im April 2008 erteilte die FDA dann die Zulassung gegen M. Crohn.<br />
Zulassungsantrag zur Anwendung bei rheumatoi<strong>der</strong> Arthritis <strong>in</strong> den USA im<br />
Februar 2008, <strong>in</strong> <strong>der</strong> EU im Juli 2008 e<strong>in</strong>gereicht.<br />
Medikament gegen Übelkeit und Erbrechen bei <strong>der</strong> Krebstherapie (Wirkstoff:<br />
Casopitant) von GlaxoSmithKli-ne<br />
Medikament mit neuem Wirkstoff (NME); chemisch hergestellt<br />
Neurok<strong>in</strong><strong>in</strong>-1 (NK-1)-Rezeptor-Antagonist (zweiter Wirkstoff aus dieser Klasse)<br />
Verh<strong>in</strong><strong>der</strong>t B<strong>in</strong>dung von Substanz P an die NK-1-Rezeptoren und dadurch die<br />
zentrale Auslösung von Übelkeit und Erbrechen<br />
Kann als Tablette o<strong>der</strong> Infusion gegeben werden<br />
Phase III-Studien abgeschlossen<br />
Zulassungsantrag <strong>in</strong> den USA (dortige Marke: Rezonic®) und <strong>der</strong> EU im Juli 2008<br />
e<strong>in</strong>gereicht.<br />
Weiterer DPP IV-Hemmer gegen Typ 2-Diabetes (Wirk-stoff: Saxaglipt<strong>in</strong>) von<br />
Bristol-Myers Squibb / AstraZeneca<br />
Medikament mit neuem Wirkstoff (NME); chemisch<br />
Phase III-Studien abgeschlossen<br />
Zulassungsantrag soll <strong>in</strong> den USA Mitte 2008 gestellt werden; <strong>in</strong> <strong>der</strong> EU für Herbst<br />
2008 geplant.<br />
Aus <strong>der</strong> neuen Klasse <strong>der</strong> DPP-IV-Hemmer s<strong>in</strong>d bereits Sitaglipt<strong>in</strong> (Januvia) von<br />
MSD und Vildaglipt<strong>in</strong> (Galvus) von Novartis zugelassen und <strong>in</strong> Deutschland auf<br />
dem Markt<br />
Zulassungsantrag <strong>in</strong> den USA und <strong>der</strong> EU im Juli 2008 e<strong>in</strong>gereicht.<br />
E<strong>in</strong> weiterer DPP IV-Hemmer, Aloglipt<strong>in</strong> wurde von Takeda bisher nur <strong>in</strong> den USA<br />
zur Zulassung e<strong>in</strong>gereicht; weitere DPP IV-Hemmer z.B. von Boehr<strong>in</strong>ger Ingelheim<br />
(<strong>in</strong> Phase III-Prüfung: BI 1356 = On<strong>der</strong>o®).<br />
Neues Antibiotikum (Wirkstoff: Iclaprim) von Arpida<br />
Medikament mit neuem Wirkstoff (NME); chemisch hergestellt<br />
gegen komplizierte Haut<strong>in</strong>fektionen; parenterale und orale Gabe möglich<br />
gegen multiresistente Staphylococcus aureus (MRSA) wirksam<br />
zählt zu schon etablierter Klasse von Antibiotika: greift als Dihydrofolat-Reduktase<br />
<strong>in</strong> den Folsäurestoffwechsel <strong>der</strong> Bakterien e<strong>in</strong><br />
zwei Phase III-Studien durchgeführt<br />
Zulassungsantrag im März 2008 <strong>in</strong> den USA e<strong>in</strong>gereicht, Expertengremium<br />
verabschiedete aber Ende Nov. 2008 e<strong>in</strong> negatives Votum.<br />
Zulassungsantrag für die EU im August 2008 e<strong>in</strong>ge-reicht.<br />
Neues Medikament zur örtlichen Blutstillung (Wirkstoff: Thromb<strong>in</strong> alfa =<br />
rekomb<strong>in</strong>antes Thromb<strong>in</strong>) von Bayer HealthCare und Zymo-Genetics<br />
Medikament mit neuem Wirkstoff (NME); gentechnisch hergestellt<br />
zur Blutungskontrolle bei Operationen<br />
Thromb<strong>in</strong> aus Spen<strong>der</strong>blut und aus Tierblut ist bereits auf dem Markt
Präparat wurde von Zymo-Genetics entwickelt, Bayer HealthCare hat die<br />
Vermarktungsrechte außerhalb <strong>der</strong> USA.<br />
Zulassungsantrag für die EU im September 2008 e<strong>in</strong>ge-reicht.<br />
US-Zulassung schon im Januar 2008 er<strong>folgt</strong><br />
Neues Medikament gegen Vorhofflimmern (Wirkstoff: Dronedaron) von Sanofi-<br />
Aventis<br />
Medikament mit neuem Wirkstoff (NME); vermutlich chemisch hergestellt.<br />
Zulassungsanträge <strong>in</strong> <strong>der</strong> EU und <strong>in</strong> den USA e<strong>in</strong>gereicht; Präparat hat <strong>in</strong> den<br />
USA Priority-Review-Status erhalten.<br />
Neues Antimykotikum (Wirkstoff: Abafung<strong>in</strong>) von York Pharma<br />
Erster Vertreter e<strong>in</strong>er neuen Wirkstoffklasse<br />
Ursprünglicher Bayer-Wirkstoff mit dualem Wirkmechanismus: Hemmung <strong>der</strong><br />
Synthese <strong>der</strong> Zellmembran von Pilzen (an an<strong>der</strong>em Angriffspunkt als bisher<br />
bekannte Pilzmittel) und direkte Schädigung <strong>der</strong> Zellmembran – daher wirksam <strong>in</strong><br />
Ruhe- und Wachstumsphase<br />
Weniger Wechselwirkungen erwartet, da nicht über Cy-tochrom P450<br />
verstoffwechselt<br />
Zulassung im September 2008 für 1 %ige Creme <strong>in</strong> eu-ropäischem<br />
Zulassungsverfahren e<strong>in</strong>gereicht (Refe-renzmitgliedstaat UK)<br />
Medikament gegen Hypereos<strong>in</strong>ophiles Syndrom (Wirk-stoff: Mepolizumab) von<br />
GlaxoSmithKl<strong>in</strong>e<br />
Medikament mit neuem Wirkstoff (NME); gentechnisch hergestellter Antikörper<br />
Interleuk<strong>in</strong>-5-(IL-5)-Hemmstoff<br />
zur Behandlung des Hypereos<strong>in</strong>ophilen Syndroms, e<strong>in</strong>er Form von Leukämie<br />
Orphan-Drug-Status für die EU<br />
Zulassung <strong>in</strong> <strong>der</strong> EU im September 2008 beantragt.<br />
Medikament gegen Muckle-Wells-Syndrom (Wirkstoff: Rilonacept) von Regeneron<br />
Medikament mit neuem Wirkstoff (NME), gentechnisch hergestellt (Fusionsprote<strong>in</strong><br />
mit Antikörperfragment)<br />
b<strong>in</strong>det Interleuk<strong>in</strong> IL-1beta<br />
zur Behandlung e<strong>in</strong>er Reihe von Cryopir<strong>in</strong>-assoziierter wie<strong>der</strong>kehren<strong>der</strong> Syndrome<br />
(Familial Cold Urticaria Syndrome (FCUS), Muckle-Wells Syndrome (MWS), and<br />
Neonatal On-set Multisystem Inflammatory Disease (NOMID), auch genannt<br />
Chronic Infantile Neurological Cutaneous Articular Syndrome (CINCA))<br />
Orphan-Drug-Status für die EU<br />
<strong>in</strong> den USA schon zugelassen<br />
Zulassung <strong>in</strong> <strong>der</strong> EU im August o<strong>der</strong> September 2008 beantragt.<br />
Medikament gegen Nierenzellkarz<strong>in</strong>om (Wirkstoff: Hitzeschock-Prote<strong>in</strong>-Peptid-<br />
Komplex [HSPPC-96; Vitespen]) von Antigenics<br />
Medikament mit neuem Wirkstoff (NME); autologer, aus patienteneigenen<br />
Tumorzellen gewonnener gp96 Hitzeschock-Prote<strong>in</strong>-Peptid-Komplex<br />
Könnte erste zugelassene therapeutische Impfung gegen e<strong>in</strong>e Krebsart werden.
gedacht als Zusatzbehandlung zu verfügbaren Therapien<br />
wird auch bei Melanomen und Gliomen geprüft<br />
Orphan-Drug-Status für die EU<br />
Zulassung (conditional approval) <strong>in</strong> <strong>der</strong> EU im Oktober 2008 beantragt<br />
<strong>in</strong> Russland seit 2008 zugelassen<br />
Impfstoff gegen Pneumokokken-Infektionen (13 valen-ter Pneumokokken-<br />
Konjugatimpfstoff) von Wyeth Pharma<br />
Prevenar13® baut auf dem bisher bereits vermarkteten Pneumokokken-<br />
Konjugatimpfstoff Prevenar® auf, <strong>der</strong> um sechs Pneumokokkenstämme erweitert<br />
wurde<br />
Gegen Pneumokokken-Infektionen (u.a. Lungenentzündungen) und<br />
Mittelohrentzündung<br />
Impfstoff eignet sich aufgrund <strong>der</strong> gewählten Erregerstämme auch für den E<strong>in</strong>satz<br />
<strong>in</strong> Afrika<br />
Derzeit <strong>in</strong> Phase-III-Prüfung bei K<strong>in</strong><strong>der</strong>n von 6 Monaten bis 2 Jahren,<br />
erwachsenen Risikopersonen und über 50 Jährigen<br />
Zulassung <strong>in</strong> <strong>der</strong> EU im Dezember 2008 beantragt; Zulassungsantrag bei <strong>der</strong><br />
FDA bereits eher gestellt<br />
Gentherpaie zur Behandlung von Hirntumoren (Wirk-stoff: Adenovirus-Vektor<br />
Ad5 mit Gen für Thymid<strong>in</strong>-K<strong>in</strong>ase) von Ark Therapeutics<br />
Medikament mit neuem Wirkstoff (NME); gentechnisch hergestellt<br />
zur Behandlung von Tumorzellen im Gehirn: nach <strong>der</strong> operativen Entfernung des<br />
Tumors wird das Medikament an <strong>der</strong> Operationsstelle ausgebracht. Der<br />
Vektorviren fügen e<strong>in</strong> Thymid<strong>in</strong>-K<strong>in</strong>ase-Gen <strong>in</strong> die Zellen <strong>der</strong> Umgebung e<strong>in</strong>.<br />
Anschließend wird <strong>der</strong> Wirkstoff Ganciclovir verabreicht, <strong>der</strong> von den modifzierten<br />
Zellen <strong>in</strong> e<strong>in</strong>e stark Substanz umgewandelt wird, die sich teilende Zellen abtötet,<br />
<strong>in</strong>takte Gehirnzellen (diese teilen sich fast nie) dagegen kaum schädigt.<br />
Zulassung <strong>in</strong> <strong>der</strong> EU im Dezember 2008 beantragt.<br />
Neues Medikament gegen seltene entzündliche Erkran-kungen (Wirkstoff:<br />
ACZ885, e<strong>in</strong> monoklonaler Antikör-per) von Novartis<br />
Medikament mit neuem Wirkstoff (NME); gentechnisch hergestellt<br />
Wirkstoff ist e<strong>in</strong> humaner monoklonaler Anti-Interleuk<strong>in</strong>-1beta-Antikörper<br />
u.a. gegen Muckle-Wells Syndrom<br />
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU<br />
Zulassung <strong>in</strong> <strong>der</strong> EU im Januar 2009 beantragt<br />
Neues Medikament gegen Mangel an Blutplättchen (Wirkstoff: Eltrombopag) von<br />
GlaxoSmithKl<strong>in</strong>e/Ligand Pharmaceuticals<br />
Medikament mit neuem Wirkstoff (NME); chemisch hergestellt<br />
erfunden <strong>in</strong> Geme<strong>in</strong>schaftsprojekt von GSK und Ligand Pharmaceuticals<br />
erster oraler Blutplättchenwachstumsfaktor gegen Throm-bozytopenie<br />
(idiopathische thrombozytopenische Purpura)<br />
Erhöht die Zahl <strong>der</strong> Blutplättchen und reduziert dadurch die Fälle des Auftretens<br />
von Blutergüssen und Nasen- und Zahnfleischbluten.<br />
Orphan-Drug-Status <strong>in</strong> <strong>der</strong> EU
<strong>der</strong>zeit <strong>in</strong> Phase-III-Studien; wird auch gegen weitere Krankheiten (u.a. Hepatitis<br />
C, Chemotherapie-bed<strong>in</strong>gte Thrombozytopenien) geprüft<br />
Zulassung <strong>in</strong> den USA im November 2008 er<strong>folgt</strong>;<br />
Zulassung <strong>in</strong> <strong>der</strong> EU im Januar 2009 beantragt.<br />
Weiteres Präparat <strong>in</strong> dieser Indikation: Romiplostim von AMGEN<br />
Medikament gegen Endometriose (Wirkstoff: <strong>Die</strong>nogest) von Bayer HealthCare<br />
Medikament mit schon bekanntem Wirkstoff<br />
Bei Endometriose kommt Gewebe, das <strong>der</strong> Gebärmutterschleimhaut gleicht, auch<br />
an an<strong>der</strong>en Stellen im Bauchraum e<strong>in</strong>er Frau vor. Es verursacht Beschwerden.<br />
Der Wirkstoff ist e<strong>in</strong> Hormon vom Typ Gestagen, er wurde bisher nur <strong>in</strong><br />
Verhütungsmitteln e<strong>in</strong>gesetzt.<br />
Das Medikament soll zur Langzeittherapie <strong>der</strong> Erkrankung e<strong>in</strong>gesetzt werden. <strong>Die</strong><br />
<strong>der</strong>zeitige Standardtherapie mit GnRH-Analoga (Arzneimittel zur künstlichen<br />
Absenkung des Östrogen-Spiegels) ist auf Grund des Nebenwirkungsprofils – z.B.<br />
Verr<strong>in</strong>gerung <strong>der</strong> Knochendichte und Hitzewallungen – nur zur Kurzzeitbehandlung<br />
geeignet.<br />
Zulassung <strong>in</strong> allen Mitgliedsstaaten <strong>der</strong> EU im Januar 2009 beantragt (ke<strong>in</strong><br />
Zulassungsantrag bei <strong>der</strong> EMEA)<br />
Impfstoff gegen Gürtelrose von Sanofi Pasteur MSD<br />
Medikament mit biotechnisch, nicht gentechnisch hergestelltem Antigen; könnte<br />
e<strong>in</strong> neuer Wirkstoff se<strong>in</strong> o<strong>der</strong> das gleiche Antigen wie bei e<strong>in</strong>em schon<br />
zugelassenen W<strong>in</strong>dpocken-Impfstoff.<br />
Erster Impfstoff zur Vorbeugung gegen Gürtelrose.<br />
Gürtelrose ist vor allem bei älteren Patienten gefürchtet, weil sich bei diesen<br />
häufig <strong>der</strong> Schmerz nach Abkl<strong>in</strong>gen <strong>der</strong> Gürtelrose nicht wie<strong>der</strong> zurückbildet.<br />
Zulassung für e<strong>in</strong>e Version, die gefroren gelagert werden muss, liegt seit Mai 2006<br />
vor; diese wurde aber nicht auf den Markt gebracht. Der Hersteller hat die<br />
Zulassung für e<strong>in</strong>e Version beantragt, die im Kühlschrank gelagert wer-den kann.<br />
Daten vom<br />
Verband Forschen<strong>der</strong> Arzneimittelhersteller e.V.