3. Kohlenhydrate
3. Kohlenhydrate
3. Kohlenhydrate
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>3.</strong> <strong>Kohlenhydrate</strong><br />
<strong>3.</strong>1. Monosaccaride<br />
a. Grundlagen<br />
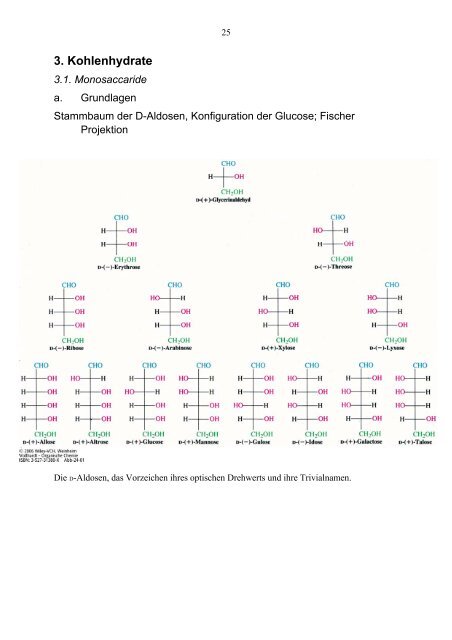
Stammbaum der D-Aldosen, Konfiguration der Glucose; Fischer<br />
Projektion<br />
Die D-Aldosen, das Vorzeichen ihres optischen Drehwerts und ihre Trivialnamen.<br />
25
Stammbaum der Ketohexosen; Konfiguration der D-Fructose (Fischer-<br />
Projektion)<br />
26<br />
Die D-Ketosen (bis zu den Ketohexosen), das Vorzeichen ihres optischen Drehwerts und ihre<br />
Trivialnamen.
Halbacetal-Bildung: Bildung der cyclischen Form (Pyranose) aus der<br />
offenkettigen Aldehydform am Beispiel der D-Glucose<br />
α- und β-Anomere, Mutarotation; Haworth-Projektion<br />
am Beispiel der Glucose<br />
27
28<br />
α- und β-Anomere; Haworth-Projektion<br />
am Beispiel der Fructose<br />
Die Konformation der Glucopyranosen
29<br />
Struktur von α-D-( + )-Glucopyranose mit einigen ausgewählten Bindungslängen<br />
und -winkeln.
30<br />
b) Reaktionen der Monosaccharide<br />
Eliminierungen, Isomerisierungen
31<br />
Oxidation und Reduktion (Fehling, Tollens)
Phenylhydrazone und Osazone<br />
32
Auf- und Abbau-Reaktionen<br />
33
Fischers Konfigurationszuordnung der Glucose (in Grundzügen)<br />
34
35<br />
Die Glycosid-Bildung: Halbacetal ⇒ Acetal<br />
Glycosidierungen: Methoden nach Fischer, Helferich, Koenigs-Knorr,<br />
Chloracetimidat-Methode (R. R. Schmidt). Der anomere Effekt
36<br />
c. Synthesen<br />
Synthese von Ascorbinsäure (Vitamin C)<br />
HO<br />
CHO<br />
OH<br />
OH<br />
OH<br />
CH 2OH<br />
HO<br />
HO<br />
HO<br />
Tautomerie<br />
H2 Ni<br />
CH 2OH<br />
OH<br />
OH<br />
O<br />
COOH<br />
O<br />
OH OH<br />
O<br />
O<br />
HO<br />
CH 2OH<br />
HCl<br />
H2O CH 2OH<br />
H OH<br />
OH<br />
OH<br />
CH 2OH<br />
OH<br />
OH<br />
OH<br />
CH 2OH<br />
D-Glucose D-Glucit,<br />
D-Sorbit<br />
sek. Alkohol<br />
prim. Alkohol<br />
Lactonringbildung<br />
O2/Pt oxid. nur<br />
prim. OH<br />
O<br />
O<br />
Acetobacter<br />
subox.<br />
HO<br />
HO<br />
CH 2OH<br />
H OH<br />
O<br />
OH<br />
H<br />
HO<br />
O<br />
CH 2OH<br />
OH OH<br />
OH<br />
OH<br />
O<br />
CH 2OH<br />
L-Sorbose<br />
COOH<br />
5-Ringlacton<br />
L-Ascorbinsäure<br />
(ein Endiol)<br />
intramolekulare H-Brücke
Synthese der Aldohexosen<br />
37<br />
(Syntheseprinzip) nach Sharpless/ Masamune<br />
Sharpless-Epoxidierung: enantioselektive Katalyse:<br />
Anwendung in der Synthese der Aldohexosen
38<br />
c) grundlegende Ideen zur Biosynthese: Gluconeogenese, Aldolase:<br />
die biochemische Aldoladdition<br />
HO<br />
HO<br />
2 CH2OPO3 C<br />
+<br />
NH (CH2) 4<br />
C H<br />
H<br />
CH 2OPO 3 2<br />
C<br />
C<br />
H<br />
CH 2OPO 3 2<br />
C O<br />
CH2OH Dihydroxyaceton-<br />
Phosphat<br />
N<br />
N<br />
H<br />
NH (CH 2) 4<br />
H<br />
N<br />
N<br />
+ H<br />
H 2O<br />
HS<br />
HS<br />
Gluconeogenese und Glycolyse<br />
biochemische Aldoladdition<br />
NH 2<br />
+<br />
H<br />
N<br />
N<br />
H<br />
H<br />
H<br />
C<br />
C<br />
(CH2) 4<br />
Lys<br />
His<br />
O<br />
OH<br />
S<br />
Cys<br />
Aldolspaltung<br />
Aldoladdition<br />
2 CH2OPO3 Glycerinaldehyd-<br />
3-phosphat<br />
CH 2OPO 3 2<br />
C O NH2 HO H<br />
H OH<br />
H OH<br />
2 CH2OPO3 H 2O<br />
CH 2OPO 3 2<br />
CH 2OPO 3 2<br />
C O<br />
HO H<br />
H OH<br />
H OH<br />
2-<br />
CH2OPO3 (CH2) 4<br />
Lys<br />
S<br />
Cys<br />
His<br />
C N<br />
HO H<br />
H OH<br />
H OH<br />
2 CH2OPO3 + H (CH2) 4<br />
Lys<br />
S<br />
Cys<br />
His
<strong>3.</strong>2. Disaccharide<br />
39<br />
nicht-reduzierende Disaccharide:<br />
Beispiel Saccharose<br />
H<br />
HO<br />
HO<br />
H<br />
CH2OH<br />
O<br />
H<br />
H<br />
CH2OH<br />
H<br />
OH<br />
OH<br />
O<br />
HO<br />
O<br />
CH2OH<br />
α-D-Glucopyranosylβ-D-fructofuranosid<br />
= Saccharose<br />
(Rohrzucker)<br />
Die polare Natur der Oberfläche von Saccharose wird am Kugel-Stab-Modell (die<br />
Sauerstoffatome sind rot) und am Elektronendichtemodell (Hydroxylgruppen in<br />
orange-rot) deutlich.<br />
Hydrolyse von Saccharose; „Invertzucker“
40<br />
Reduzierende Disaccharide: Beispiele:<br />
Maltose<br />
HO<br />
HO<br />
CH2OH O<br />
OH<br />
O<br />
HO<br />
CH2OH O<br />
4-O-(α-D-Glucopyranosyl)-<br />
D-glucopyranose<br />
1<br />
α<br />
Lactose (Milchzucker):<br />
4<br />
HO<br />
OH<br />
4<br />
CH2OH O<br />
HO<br />
D-Galactose<br />
1<br />
3<br />
β<br />
O<br />
Maltose (Malzzucker)<br />
α, 1 4<br />
2<br />
HO<br />
1<br />
OH<br />
OH<br />
4<br />
α<br />
CH 2OH<br />
OH<br />
O<br />
1<br />
D-Glucose<br />
OH
Cyclodextrine<br />
41
<strong>3.</strong>3 Polysaccharide<br />
Stärke:<br />
Amylose<br />
Amylopektin<br />
42
Cellulose<br />
43<br />
Reaktionen, Umwandlungen der Cellulose;