6. Isomere - Chemie
6. Isomere - Chemie
6. Isomere - Chemie
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
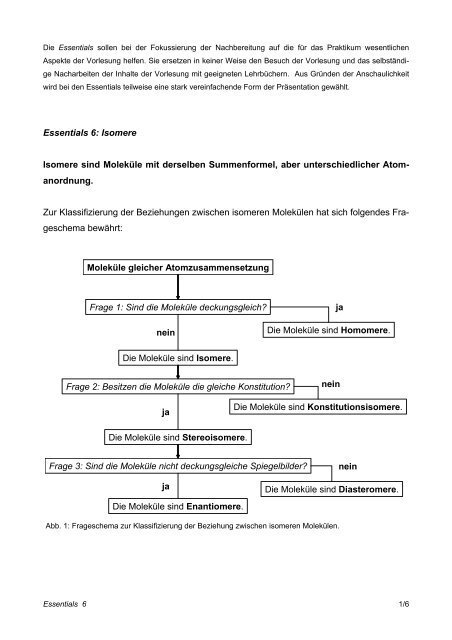
Die Essentials sollen bei der Fokussierung der Nachbereitung auf die für das Praktikum wesentlichenAspekte der Vorlesung helfen. Sie ersetzen in keiner Weise den Besuch der Vorlesung und das selbständigeNacharbeiten der Inhalte der Vorlesung mit geeigneten Lehrbüchern. Aus Gründen der Anschaulichkeitwird bei den Essentials teilweise eine stark vereinfachende Form der Präsentation gewählt.Essentials 6: <strong>Isomere</strong><strong>Isomere</strong> sind Moleküle mit derselben Summenformel, aber unterschiedlicher Atomanordnung.Zur Klassifizierung der Beziehungen zwischen isomeren Molekülen hat sich folgendes Frageschemabewährt:Moleküle gleicher AtomzusammensetzungFrage 1: Sind die Moleküle deckungsgleich?neinjaDie Moleküle sind Homomere.Die Moleküle sind <strong>Isomere</strong>.Frage 2: Besitzen die Moleküle die gleiche Konstitution?neinjaDie Moleküle sind Konstitutionsisomere.Die Moleküle sind Stereoisomere.Frage 3: Sind die Moleküle nicht deckungsgleiche Spiegelbilder?neinjaDie Moleküle sind Enantiomere.Die Moleküle sind Diasteromere.Abb. 1: Frageschema zur Klassifizierung der Beziehung zwischen isomeren Molekülen.Essentials 6 1/6
Beispiel 1.: 1-Chlorbutan und 2-Chlorbutan besitzen die gleiche Summenformel.ClC 4 H 9 ClCl1-Chlorbutan(1-Butylchlorid)C 4 H 9 Cl2-Chlorbutan(2-Butylchlorid)Frage 1: Sind die Moleküle deckungsgleich? Antwort: Nein.=> Es handelt sich um <strong>Isomere</strong>.Frage 2: Besitzen die Moleküle die gleiche Konstitution, d.h. sind die Atome in der gleichen"Reihenfolge" miteinander verknüpft? Antwort: Nein.=> Es handelt sich um Konstitutionsisomere (Verknüpfungsisomere).Beispiel 2.: (E)-But-2-en und (Z)-But-2-en besitzen die gleiche Summenformel.(E)-But-2-en(Z)-But-2-enC 4 H 8C 4 H 8Frage 1: Sind die Moleküle deckungsgleich? Antwort: Nein.=> Es handelt sich um <strong>Isomere</strong>.Frage 2: Besitzen die Moleküle die gleiche Konstitution? Antwort: Ja.=> Es handelt sich um Stereoisomere.Frage 3: Sind die Moleküle nicht deckungsgleiche Spiegelbilder? Antwort: Nein.=> Es handelt sich um Diastereomere.Beispiel 3.: Bei 2-Chlorbutan sind verschiedene Anordnungen der Substituenten umdas C-Atom 2 möglich.Cl H2-ChlorbutanH Cl(2-Butylchlorid)Frage 1: Sind die Moleküle deckungsgleich? Antwort: Nein.=> Es handelt sich um <strong>Isomere</strong>.Frage 2: Besitzen die Moleküle die gleiche Konstitution? Antwort: Ja.=> Es handelt sich um Stereoisomere.Frage 3: Sind die Moleküle nicht deckungsgleiche Spiegelbilder? Antwort: Ja.=> Es handelt sich um Enantiomere.Um besser erkennen zu können, dass sich die dargestellten 2-Chlorbutanmoleküle wieBild und Spiegelbild verhalten ist eine Drehung einer der Darstellungen hilfreich.Cl H H ClH Cl≡180°-Drehung um Achse durch C-2(Drehachse liegt in der Zeichenebene)Spiegelebene(senkrecht zur Zeichenebene)Essentials 6 2/6
Moleküle, wie z.B. die Enantiomere des 2-Chlorbutans, die sich nicht mit ihrem Spiegelbildzur Deckung bringen lassen werden chiral genannt. Moleküle, die nicht chiral sind, werdenachiral genannt.Chirale Moleküle zeigen in achiralen Umgebungen gleiche Eigenschaften. So sind z.B.Siede- und Schmelzpunkt der Enantiomere des 2-Chlorbutans identisch.In chiralen Umgebungen können sich die Eigenschaften chiraler Moleküle jedoch unterscheiden.Chirale Moleküle drehen z.B. die Polarisationsebene von linear polarisiertem Licht. Deshalbspricht man im Zusammenhang mit Chiralität auch von optischer Aktivität. So drehtz.B. ein Enantiomer des 2-Chlorbutan die Polarisationsebene im Uhrzeigersinn und wirdrechtsdrehend bzw. das (+)-Enantiomer genannt. Sein Spiegelbild dreht die Polarisationsebenedagegen um den gleichen Betrag gegen den Uhrzeigersinn und wird linksdrehendbzw. das (-)-Enantiomer genannt.Eine äquimolare Mischung von Enantiomeren wird Racemat genannt. Ein Racemat drehtdie Polarisationsebene von linear polarisiertem Licht nicht, da sich die Effekte der einzelnenEnantiomere (der optischen Antipoden) gegenseitig kompensieren.Kann die Chiralität eines Moleküls auf die Anordnung der Substituenten um ein Zentralatomzurückgeführt werden, wird dieses Zentralatom Stereozentrum genannt (Manspricht auch vom Chiralitätszentrum oder Asymmetriezentrum, was jedoch zu Verwirrungenführen kann.). Im Fall des 2-Chlorbutan ist C-2 ein Stereozentrum.Die spezielle Anordnung der Substituenten um ein Stereozentrum wird Konfigurationgenannt. Die Enantiomere des 2-Chlorbutans unterscheiden sich somit in ihrer Konfigurationam C-2.C-Atome, die vier unterschiedliche Substituenten tragen sind, sind Stereozentren. Besitztein Molekül nur ein C-Stereozentrum, so ist es chiral.Zur Nomenklatur der C-Stereozentren hat sich die R/S-Nomenklatur von Cahn, Ingoldund Prelog bewährt. Hiernach werden den Substituenten eines Stereozentrums nachgenauen Regeln Prioritäten zugewiesen.Regel 1: Man betrachtet die Atome, die direkt an ein Stereozentrum gebunden sind (1.Sphäre). Je höher die Ordnungszahl, desto höher die Priorität.Regel 2: Kann mit Regel 1 kein Prioritätsunterschied in der 1. Sphäre festgelegt werden,betrachtet man die Atome der 2. Sphäre. D.h. die Atome, die an die Atome der 1. Sphäregebunden sind. Man erhöht die Sphären so lange, bis ein Prioritätsunterschied festgestelltwird.Essentials 6 3/6
ClHH 3 C H 2 C CH 3≡142 3Rot: Atome der 1. SphäreBlau: Atome der 2. SphäreCyan: Atome der 3. SphäreAbb. 2: Bestimmung der Prioritäten nach der R/S-Nomenklatur am Bespiel eines Enantiomers des 2-Chlorbutan.Cl hat in der 1. Sphäre die höchste, H, die niedrigste Priorität. Zwischen Ethyl- und Methyl- kann mitRegel 2 der Prioritätsunterschied festgelegt werden. Ethyl hat eine höhere Priorität als Methyl.Regel 3: Mehrfachbindungen werden wie gesättigte Verbindungen behandelt.HHRwird behandelt alsHCHCROHwird behandelt alsOHOCNachdem die Prioritäten der Substituenten eines Stereozentrums bestimmt sind, drehtman das Stereozentrum so, dass der Substituent mit der niedrigsten Priorität am weitestenvom Betrachter entfernt ist. Die drei ranghöheren Substituenten liegen dann in einer Ebene.Bewegt man sich in dieser Ebene im Uhrzeigersinn, um vom ranghöchsten über denmittleren zum Substituent mit der Priorität 3 zu gelangen, ist das Stereozentrum R- konfiguriert.Bewegt man sich gegen den Uhrzeigersinn, ist es S- konfiguriert.ClClHH 3 C H 2 C CH 3≡142 3≡EtHMeDrehung gegen den Uhrzeigersinn=> S-KonfigurationAbb. 3: Bestimmung der Konfiguration nach der R/S-Nomenklatur am Bespiel des schon in Abb. 2 betrachtetenEnantiomers des 2-Chlorbutan. Das Stereozentrum ist S-konfiguriert. Das Stereozentrum seines (hiernicht abgebildeten) Spiegelbildes weist somit eine R-Konfiguration auf.Zur zweidimensionalen Abbildung tetraedrischer Kohlenstoffatome hat sich die Fischer-Projektion bewährt. Bei der Fischer-Projektion werden die C-Atome so positioniert, dassdie längste C-Kette senkrecht und das am höchsten oxidierte C-Atom oben steht. Weiterhinwerden die Kohlenstoffatome so gedreht, dass die beiden Bindungen, die hinter dieZeichenebene gerichtet sind, durch vertikale Striche veranschaulicht werden können. Diebeiden Bindungen, die vor der Zeichenebene liegen, werden durch horizontale Striche dargestellt.ClH≡HCH 3Cl≡HCH 3ClH 5 C 2 CH 3C 2 H 5C 2 H 5Abb. 4: Verdeutlichung der Regeln der Fischer-Projektion am Beispiel der Projektion des C-2-Atoms einesder Enantiomere des 2-Chlorbutan.Essentials 6 4/6
Achtung: Bestimmte Drehungen einer Fischer-Projektion ändern die Konfiguration desdargestellten Stereozentrums!Die Konfiguration eines Stereozentrums kann natürlich auch in der Fischer-Projektionbestimmt werden. Hierzu wird die Fischer-Projektion in eine äquivalente Projektion umgewandelt,bei der der rangniedrigste Substituent des Stereozentrums nach unten zeigt.Anschließend wird der "Drehsinn" der ranghöheren Substituenten in der so erzeugten Projektionbestimmt.HCH 3ClCH 3≡ H Cl ≡ 1 ≡34 1 23C 2 H 5C 2 H 52Cyklische Permutationder Substituenten4Drehung gegen denUhrzeigersinn=> S-KonfigurationAbb. 5: Bestimmung der Konfiguration des C-2-Atoms eines der Enantiomere des 2-Chlorbutan in derFischer-Projektion.Es können auch andere Atome als Kohlenstoff Stereozentren bilden. So kann z.B. einStickstoff-Atom, das drei unterschiedliche Substituenten trägt, mit seinem Spiegelbild nichtzur Deckung gebracht werden.Spiegelebene(senkrecht zur Zeichenebene)Rotation um Drehachse(senkrecht auf der Zeichenebene)EtMeNHHNEtMe≡HNEtMeHNEtMe≡EtMeNHBildSpiegelbild(nicht deckungsgleich)"Durchschwingen"des ZentralatomsBildAbb. 6: Auswirkung der Inversion des Stickstoffs auf die Stereochemie am Beispiel des Ethyl-methyl-amin.Trotzdem wird die Verbindung i.A. nicht als reines Enantiomer zu isolieren sein, da dieInversionsbarriere des N-Sterozentrums so gering ist, dass ein Umklappen der Konfigurationnicht verhindert wird.Essentials 6 5/6
Es gibt auch Verbindungen mit C-Stereozentren, die nicht chiral sind. Die soll am Beispielder <strong>Isomere</strong> des 2,3-Dibrombutans verdeutlicht werden.In der Fischer-Projektion sind vier unterschiedliche Anordnungen der Atome denkbar. DieC-Atome C-2 und C-3 sind Stereozentren, da sie jeweils vier unterschiedliche Substituenten(Br-, CH 3 -CHBr-, CH 3 -, H-) tragen.HCH 3BrBrCH 3HHCH 3BrBrCH 3HBrHHBrHBrBrHCH 3CH 3CH 3CH 31 2 3 4Abb. 7: <strong>Isomere</strong> des 2,3-Bibrombutan in der Fischer-Projektion.Bei den Projektionen 1 und 2 handelt es sich um Darstellungen von Molekülen, die sichzueinander wie nicht deckungsgleiche Spiegelbilder verhalten. Sie bilden also ein Enantiomerenpaarab. 1 ist die Fischer-Projektion des (2S,3S)-2,3-Dibrombutan und 2 folglich diedes (2R,3R)-2,3-Dibrombutan.Die Projektionen 3 und 4 verhalten sich zwar auch wie Bild und Spiegelbild. Eine genauereBetrachtung zeigt jedoch, dass die abgebildeten Moleküle deckungsgleich sind. Die Projektionenbilden daher das selbe Molekül ab.CH 3H BrH BrCH 3≡CH 3H BrH BrCH 3≡Rotation um 180°H BrH BrCH 3CH 3CH 3Br HBr HCH 33 4Sägebock-Darstellung≡Br HBr HCH 3CH 3Abb. 8: Die Fischer-Projektionen 3 und 4 bilden das selbe Molekül ab (3 und 4 sind Homomere).≡Das mit Fischer-Projektion 3 dargestellte Molekül besitzt eine intramolekulare Spiegelebene.Solche Spiegelebenen heben die Chiralität der Stereozentren auf und machen eineVerbindung achiral. Dies wird durch den Stereopräfix meso- kenntlich gemacht. 3 und 4sind somit Fischer-Projektionen des meso-2,3-Dibrombutan. meso-2,3-Dibrombutan ist einDiastereomer von sowohl (2S,3S)-2,3-Dibrombutan als auch von (2R,3R)-2,3-Dibrombutan.In Abb. 8 wird ein Nachteil der Fischer-Projektion ersichtlich. Sie bildet Moleküle immer ineiner ungünstigen eklipitischen Konformation ab.Essentials 6 6/6