Kohlenstoff-Gruppe
Kohlenstoff-Gruppe
Kohlenstoff-Gruppe
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
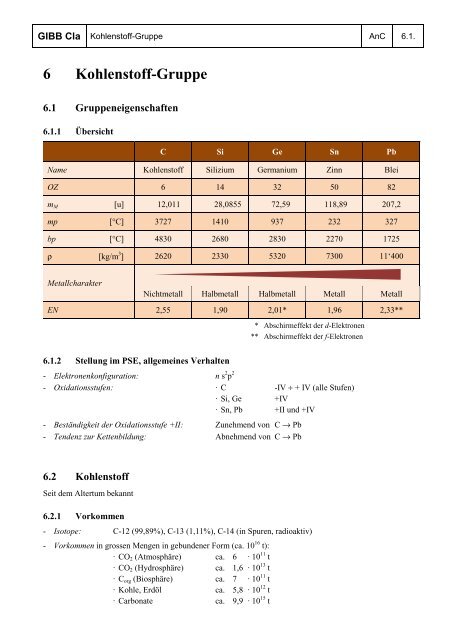
GIBB Cla <strong>Kohlenstoff</strong>-<strong>Gruppe</strong> AnC 6.1.<br />
6 <strong>Kohlenstoff</strong>-<strong>Gruppe</strong><br />
6.1 <strong>Gruppe</strong>neigenschaften<br />
6.1.1 Übersicht<br />
C Si Ge Sn Pb<br />
Name <strong>Kohlenstoff</strong> Silizium Germanium Zinn Blei<br />
OZ 6 14 32 50 82<br />
mM [u] 12,011 28,0855 72,59 118,89 207,2<br />
mp [°C] 3727 1410 937 232 327<br />
bp [°C] 4830 2680 2830 2270 1725<br />
ρ [kg/m 3 ] 2620 2330 5320 7300 11‘400<br />
Metallcharakter<br />
Nichtmetall Halbmetall Halbmetall Metall Metall<br />
EN 2,55 1,90 2,01* 1,96 2,33**<br />
6.1.2 Stellung im PSE, allgemeines Verhalten<br />
* Abschirmeffekt der d-Elektronen<br />
** Abschirmeffekt der f-Elektronen<br />
- Elektronenkonfiguration: n s 2 p 2<br />
- Oxidationsstufen: · C -IV ÷ + IV (alle Stufen)<br />
· Si, Ge +IV<br />
· Sn, Pb +II und +IV<br />
- Beständigkeit der Oxidationsstufe +II: Zunehmend von C → Pb<br />
- Tendenz zur Kettenbildung: Abnehmend von C → Pb<br />
6.2 <strong>Kohlenstoff</strong><br />
Seit dem Altertum bekannt<br />
6.2.1 Vorkommen<br />
- Isotope: C-12 (99,89%), C-13 (1,11%), C-14 (in Spuren, radioaktiv)<br />
- Vorkommen in grossen Mengen in gebundener Form (ca. 10 16 t):<br />
· CO2 (Atmosphäre) ca. 6 · 10 11 t<br />
· CO2 (Hydrosphäre) ca. 1,6 · 10 13 t<br />
· Corg (Biosphäre) ca. 7 · 10 11 t<br />
· Kohle, Erdöl ca. 5,8 · 10 12 t<br />
· Carbonate ca. 9,9 · 10 15 t
GIBB Cla <strong>Kohlenstoff</strong>-<strong>Gruppe</strong> AnC 6.2.<br />
6.2.2 Verwendung<br />
- Energieträger: Holz, Kohle, Erdöl, Erdgas<br />
- Werkstoff: · Ausgangsmaterial für Kunststoffe (Erdöl)<br />
· Elektrotechnik (Graphit)<br />
6.2.3 Modifikationen<br />
- Hauptmodifikationen:<br />
Bezeichnung Graphit Diamant<br />
Kristallform<br />
Vorkommen<br />
Aspekt<br />
Härte<br />
Ceylon, Madagaskar<br />
Künstlich aus Kohle bei hohen<br />
Temperaturen<br />
Schwarz-grau, undurchsichtig, metallischer<br />
Glanz<br />
Sehr weich, MOHS-Skala: 1<br />
Spaltbarkeit parallel zu den Schichten gut<br />
Afrika, Brasilien, Sibirien<br />
1 kg Diamant in 10‘000 - 15‘000 t Gestein<br />
(= 0,1 - 0,15 ppm)<br />
Farblos, klar, n = 2,42 (→ stark lichtbrechend)<br />
Härtester Stoff, MOHS-Skala: 10<br />
→ nur in eigenem Pulver schleifbar<br />
Leitfähigkeit Elektrisch und thermisch leitend Schlechte Leitfähigkeit<br />
Chem. Eigenschaften<br />
Verwendung<br />
Umwandlung<br />
Schwerflüchtig, schwerlöslich, reaktionsträge,<br />
brennbar, reduziert Metalloxide<br />
Elektroden, Tiegel, Bleistiftminen,<br />
Schmiermittel, Farbstoff<br />
100‘000 bar, 2400°C, Cr/Mn<br />
Luftabschluss, 1500°C<br />
Schwerflüchtig, schwerlöslich, reaktionsträge,<br />
verbrennt bei ϑ > 800°C<br />
Schmuck (5-20%), Rest für Bohrkronen,<br />
Glasschneider, Schleif- und Trennscheiben
GIBB Cla <strong>Kohlenstoff</strong>-<strong>Gruppe</strong><br />
- Fullerene: · Sphärische phärische <strong>Kohlenstoff</strong> <strong>Kohlenstoff</strong>-Modifikation, z.B. C60<br />
· Erste rste theoretische Vorhersage 1970 1970, erste Herstellung<br />
1985 (Nobelpreis 1996)<br />
· Braun-schwarzes schwarzes Pulver mit metallischem Glanz<br />
· Löslich öslich in vielen organischen Lösungsmitteln<br />
· Natürliches atürliches Vorkommen in Kristallen (Shungit)<br />
· Herstellung aus Graphit (Verdampfung im Lichtbogen<br />
in He-Atmosphäre)<br />
Atmosphäre)<br />
· Verwendung u.a. zur Herstellung von Nanotubes<br />
6.2.4 Reaktionen des <strong>Kohlenstoff</strong>s<br />
+ HClO4/H2SO4 (heiss) → CO, CO2, Carbonsäuren<br />
+ Luft/O2<br />
+ H2 (Katalysator)<br />
C + Metalle<br />
+ Metalloxide<br />
+ F2<br />
+ S8<br />
6.3 Anorganische <strong>Kohlenstoff</strong>verbindungen<br />
6.3.1 Kohlenmonoxid (<strong>Kohlenstoff</strong>monoxid)<br />
- Struktur: CO<br />
C O<br />
→ CO, CO2 (→ Synthesegas)<br />
→ CnHm<br />
→ Carbide (z.B. CaC2)<br />
→ Metalle<br />
→ CF4<br />
→ CS2<br />
C O C O<br />
- Eigenschaften: · Farb-, geruch-<br />
und geschmackloses Gas (bp = -191,5°C)<br />
· Reaktionsträge eaktionsträge und hitzestabil<br />
· Verbrennt erbrennt mit bläulicher Farbe zu CO CO2<br />
· Vereinigt sich katalytisch mit Wasserstoff zu Kohlenwasserstoffen oder Methanol<br />
· Mit fein verteilten Metallen enstehen flüchtige, brennbare, giftige Carbonyle<br />
z.B. Ni(CO)4<br />
· Höchst giftig (LC (LC100 = 500 ppm, MAK-Wert = 30 ppm)<br />
Mechanismus: Konkurrenzreaktion zu OO2<br />
im Hämoglobin (bindet ca. 300x stärker)<br />
· An Aktivkohle (Schutzmaskenfilter) nicht absorbierbar<br />
- Vorkommen: Verbrennungsvorgänge unter Sauerstoffmangel (Verbrennungsmotoren)<br />
- Verwendung: · In der Metallurgie als Re Reduktionsmittel (Hochofenprozess)<br />
· Zur Gewinnung von reinen Metallen über die Carbonyle ( (MOND OND-Prozess für Ni)<br />
· Ausgangsstoff zur Synthese von organischen Grundstoffen (z.B. Methanol)<br />
AnC 6.3.
GIBB Cla <strong>Kohlenstoff</strong>-<strong>Gruppe</strong><br />
6.3.2 Kohlendioxid (<strong>Kohlenstoff</strong>dioxid)<br />
- Struktur: CO2<br />
O<br />
C<br />
O<br />
- Eigenschaften: · Farb-, , geschmackloses, leicht säuerlich riechendes Gas<br />
· Sublimiert unter Atmosphärendruck bei ϑ = -78,5°C (feste, gepresste Form: Trockeneis)<br />
· Lässt sich unter Druck verflüssigen ( (z.B. ϑ = 20°C, p = 50 bar)<br />
· Kritischer Punkt: Tc = 304 K, pc = 73,75 bar; darüber superkritische Flüssigkeit<br />
· Bildet in Wasser die schwache Kohlensäure:<br />
CO2 + H2O<br />
→<br />
← H2CO3 (pKA = 3,16)<br />
· BOUDOUARD--Gleichgewicht<br />
(Hochofenprozess):<br />
C + CO2 →<br />
← 2 CO ΔH = 172,4 kJ/mol<br />
- Vorkommen: · Gär- und Verbrennungsprozesse<br />
· In der Atmosphäre (ca. 400 ppm)<br />
- Ökologie: Bedeutendes, anthropogenes Treibhausgas<br />
- Verwendung: · Trockeneis als Kältemittel (z.B. mit Aceton)<br />
· Feuerlöschmittel<br />
· Getränkeindustrie<br />
6.3.3 Carbonate, Hydrogencarbonate<br />
- Definition: Die Kohlensäure bildet zwei Salzreihen Salzreihen:<br />
· Carbonate [CO [CO3] 2- · Hydrogencarbonate [HCO<br />
O<br />
O<br />
- Eigenschaften: · Carbonate häufig schwerlöslich<br />
· Carbonate reagieren in Wasser basisch<br />
· Carbonate und Hydrogensarbonate zerfallen beim Erhitzen in CO CO2 und Metalloxide:<br />
CaCO3 → CO2 + CaO<br />
- Beispiele: · CaCO3<br />
· CaCO3 · MgCO MgCO3<br />
· Ca(HCO3)2<br />
· Na2CO3<br />
· K2CO3<br />
- Verwendung: · Herstellung von CO CO2 im Labor durch Freisetzung mit Säure:<br />
CaCO3 + 2 HCl → CO2 + CaCl2 + H2O<br />
· CaCO3 als Mörtel<br />
· K2CO3 als Trocknungsmittel für basische Stoffe (→ K2CO3 · 2 HH2O)<br />
· Na2CO3 als Waschmittelzusatz und Neutralisationsmittel<br />
6.3.4 Phosgen<br />
C O<br />
- Struktur: COCl2<br />
Dichlorid der Kohlensäure<br />
2-<br />
Cl<br />
Cl<br />
C<br />
O<br />
O<br />
C<br />
OH<br />
O<br />
-<br />
[HCO3] -<br />
AnC 6.4.<br />
Calciumcarbonat (Kalkstein, Marmor, Kreide)<br />
Dolomit<br />
Calciumhydrogencarbonat (löslich → Härtebildner im Wasser)<br />
Natriumcarbonat (Soda)<br />
Kaliumcarbonat (Pottasche)
GIBB Cla <strong>Kohlenstoff</strong>-<strong>Gruppe</strong><br />
- Eigenschaften: · Farbloses, , leicht zu verflüssigendes Gas (bp = 7,4°C)<br />
· Heuartiger euartiger Geruch<br />
· Gut löslich in organischen Lösungsmitteln<br />
· Hoch toxisch sch (Lungenödem)<br />
· Kann sich bei der Verbrennung von chlorhaltigen organischen Substanzen bilden<br />
- Verwendung: Wichtiger Grundstoff der technischen organischen Chemie (z.B. Kunststoffe)<br />
6.4 Silizium<br />
1824 von BERZELIUS entdeckt<br />
silex, lat - Kieselstein<br />
6.4.1 Vorkommen<br />
- 3 stabile Isotope: Si-28 28 (92,23%), Si Si-29 (4,67%), Si-30 30 (3,1%) + zahlreiche instabile Isotope<br />
- Neben dem Sauerstoff das am weitesten verbreitete Element der Erdkruste (25,7%)<br />
- Wichtigstes Element des Mineralreichs<br />
- Tritt im m Gegensatz zu <strong>Kohlenstoff</strong> nur in unbedeutenden Mengen elementar auf (höhere Reaktionsfähigkeit)<br />
- Hauptvorkommen: · Siliziumdioxid<br />
· Silikate<br />
6.4.2 Eigenschaften<br />
- Dunkelgraue, metallisch glänzende Kristalle Kristalle; Diamantstruktur<br />
- Härter als Stahl, sehr spröde<br />
- Halbmetall<br />
- Ist - wie der <strong>Kohlenstoff</strong> - zur Selbstbindung fähig: Silane SinH2n+2 (n < 15)<br />
6.4.3 Gewinnung<br />
- Technische Qualität: Reduktion von SiO SiO2 mit C oder CaC2<br />
SiO2 + C → Si + CO2<br />
- Reinst-Silizium: Für elektrotechnische Zwecke (Elektronik) wird der Gehalt an Verunreinigungen<br />
durch das Zonenschmelzverfahren auf
GIBB Cla <strong>Kohlenstoff</strong>-<strong>Gruppe</strong> AnC 6.6.<br />
6.4.4 Reaktionen des Siliziums<br />
Bei Raumtemperatur reagiert Silizium nur mit HF und F2.<br />
+ Säuren → keine Reaktion<br />
+ N2 → Si3N4 (Si-Nitrid)<br />
+ Mg/H3PO4 → SiH4 (Monosilan)<br />
Si + Halogen → SiX4<br />
6.4.5 Verwendung<br />
+ O2/Luft → SiO, SiO2<br />
+ Metalle → Silicide<br />
+ NaOH → [Na4SiO4]x (Wasserglas)<br />
- Legierungsbestandteil<br />
- Ausgangsstoff für siliziumorganische Verbindungen<br />
- Halbleitertechnk: Reinst-Silizium mit Al, Sb, As, B oder P dotiert<br />
6.5 Siliziumverbindungen<br />
6.5.1 Siliziumdioxid<br />
- Struktur: (SiO2)n<br />
Tetraedrische dreidimensionale Gitterstruktur<br />
- Trivialnamen: · Quarz (kristallin)<br />
· Achat, Opal (wasserhaltig, amorph)<br />
· Kieselgur (erdig)<br />
- Eigenschaften: · Hart, diamantartig, mp = 1705°C<br />
· Piezoelektrischer Effekt<br />
· Optisch aktiv (Spiegelbildisomerie)<br />
· Unlöslich in Wasser und Säuren<br />
· Reaktionsträge; wird nur von HF oder F2 und geschmolzenen Alkalihydroxiden<br />
angegriffen:<br />
SiO2 + 4 HF → SiF4(g) + 2 H2O<br />
SiO2 + 4 NaOH → Na4SiO4 + 2 H2O<br />
- Verwendung: · Quarzsand (Mörtel, Beton)<br />
· Gläser (SiO2 + CaO, Al2O3, Na2O, B2O3)<br />
· Quarzglas (UV-durchlässig → Küvettenmaterial, hoher Schmezpunkt, gute<br />
Temperaturwechselbeständigkeit)<br />
· Schwingquarz<br />
· Kieselgur (Adsorptionsmaterial)<br />
O<br />
O<br />
Si<br />
O<br />
O
GIBB Cla <strong>Kohlenstoff</strong>-<strong>Gruppe</strong> AnC 6.7.<br />
6.5.2 Kieselsäure und Silikate<br />
OH<br />
- Struktur: [H4SiO4]n = Orthokieselsäure (SiO2 · 2 H2O)<br />
Tetraedrische dreidimensionale Ketten- und Gitterstruktur<br />
Si<br />
OH<br />
- Salze: V.a. Alkali- und Erdalkali-Silikate, z.B.<br />
HO<br />
Na4SiO4<br />
OH<br />
- Eigenschaften: · Unter Wasserabspaltung Kondensation zu Polykieselsäuren<br />
. Hochkondensierte Polykieselsäure nennt man Kieselgel, in entwässerter Form Silicagel<br />
· In den Silikaten sind SiO4-Tetraeder über gemeinsame Ecken verknüpft<br />
· Bildung von Ketten- und Schichtsilikaten<br />
· Silikate bilden den Hautbestandteil der Erdkruste<br />
z.B. Feldspat (K2O · Al2O3 · 6 SiO2), Tone, Kaolin, Asbest (faserige Silikate der Formel<br />
[Mg,Fe,Ni]3Si2O5[OH]4)<br />
- Verwendung: · Adsorptionsmittel (Silicagel, Kieselgel)<br />
· Wasserglas ([Na4SiO4]x als Flammschutzmittel, Klebstoff für Porzellan)<br />
· Glas, Porzellan (Ca- und Alkali-Silikate)<br />
· Keramische Massen (Kaolinit, Al4[SiO10][OH]8)<br />
· Zement, Beton (Ca-Alumo-Silikate → Si statistisch durch Al ersetzt)<br />
· Talk (Mg3[Si4O10][OH]2) → weichstes bekanntes Mineral<br />
· Meerschaum (Mg4[Si6O15][OH]2 + Fe, Al, H2O) → weiches Mineral<br />
6.5.3 Weitere Siliziumverbindungen<br />
Formel Name Eigenschaften, Verwendung<br />
SinH2n + 2 Silane Analoge zu den KWS mit Si-Si-Bindungen<br />
R 1<br />
Si<br />
R 2<br />
O<br />
n<br />
Silikone Ketten- und Netzstruktur → Silikonfett, Silikongummi<br />
SiC Siliziumcarbid Harte Kristalle → Schleif- und Poliermittel (Carborund)