Grundlagen der Physikalischen Chemie 1 - TUM
Grundlagen der Physikalischen Chemie 1 - TUM
Grundlagen der Physikalischen Chemie 1 - TUM
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
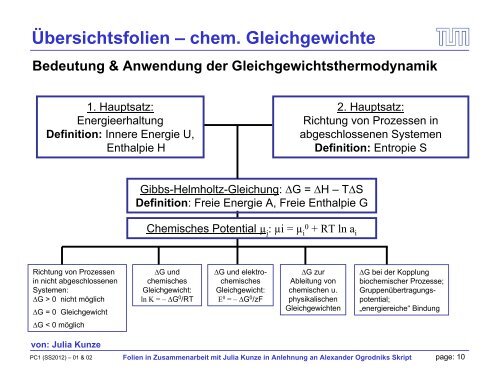
Übersichtsfolien – chem. Gleichgewichte<br />
Bedeutung & Anwendung <strong>der</strong> Gleichgewichtsthermodynamik<br />
1. Hauptsatz:<br />
Energieerhaltung<br />
Definition: Innere Energie U,<br />
Enthalpie H<br />
Richtung von Prozessen<br />
in nicht abgeschlossenen<br />
Systemen:<br />
G > 0 nicht möglich<br />
G = 0 Gleichgewicht<br />
G < 0 möglich<br />
von: Julia Kunze<br />
Gibbs-Helmholtz-Gleichung: G = H – TS<br />
Definition: Freie Energie A, Freie Enthalpie G<br />
Chemisches Potential µ i : µi = µ i 0 + RT ln ai<br />
G und<br />
chemisches<br />
Gleichgewicht:<br />
ln K = – G 0 /RT<br />
G und elektrochemisches<br />
Gleichgewicht:<br />
0 = – G 0 /zF<br />
2. Hauptsatz:<br />
Richtung von Prozessen in<br />
abgeschlossenen Systemen<br />
Definition: Entropie S<br />
G zur<br />
Ableitung von<br />
chemischen u.<br />
physikalischen<br />
Gleichgewichten<br />
G bei <strong>der</strong> Kopplung<br />
biochemischer Prozesse;<br />
Gruppenübertragungspotential;<br />
„energiereiche“ Bindung<br />
PC1 (SS2012) – 01 & 02 Folien in Zusammenarbeit mit Julia Kunze in Anlehnung an Alexan<strong>der</strong> Ogrodniks Skript page: 10