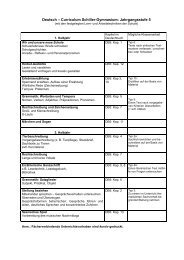
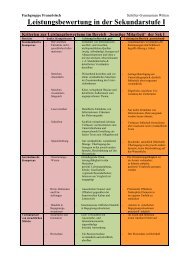
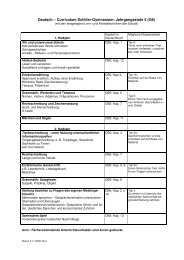
Klasse 9 - Schiller - Gymnasium Witten
Klasse 9 - Schiller - Gymnasium Witten
Klasse 9 - Schiller - Gymnasium Witten
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
- Ablenkung eines Wasserstrahls im<br />
elektrischen Feld eines Hartgummistabes<br />
Elektronenpaarbindung, Atombindung<br />
Elektronenpaarabstoßungsmodell, Wassermoleküle<br />
gewinkelt,<br />
Wassermoleküle als Dipole,<br />
polare Elektronenpaarbindung<br />
Elektronegativität<br />
Warum können die Fische im Winter unter der<br />
Eisfläche im flüssigen Wasser leben?<br />
Versuche zur Oberflächenspannung, Dichteanomalie,<br />
hohe Siedetemperatur, symmetrische<br />
Schneekristalle<br />
⇒ Wasserstoffbrückenbindung<br />
Lösevorgänge genauer betrachtet:<br />
verschiedene Salze und Fett werden in<br />
Wasser gelöst, Temperaturveränderungen<br />
werden beobachtet<br />
⇒ Wasser löst Salze, Hydratation,<br />
aber keine Fette<br />
Energieschema zu Lösungsvorgang,<br />
Wasser löst Stoffe, deren Moleküle Dipole besitzen,<br />
Dipol-Dipol-Wechselwirkungen,<br />
polare- und unpolare Stoffe<br />
M II.5b<br />
Kräfte zwischen Molekülen als Van-der-Waals-Kräfte, Dipol-Dipol-Wechselwirkung<br />
und Wasserstoffbrückenbindungen<br />
bezeichnen<br />
M II.6<br />
Den Zusammenhang zwischen Stoffeigenschaften und<br />
Bindungsverhältnissen ( Ionenbindung, Elektronenpaarbindung<br />
und Metallbindung) erklären<br />
M II.7b<br />
Mithilfe eines Elektronenpaarabstoßungsmodells die<br />
räumliche Struktur von Molekülen erklären<br />
M II.2<br />
Die Vielfalt der Stoffe und ihrer Eigenschaften auf der Basis<br />
unterschiedlicher Kombinationen und Anordnungen von<br />
Atomen mit Hilfe von Bindungsmodellen erklären.<br />
Hier: Salze und ihre Löseverhalten in Wasser, polare - unpolare<br />
Stoffe<br />
M II.5a<br />
Kräfte zwischen Molekülen und Ionen beschreiben und<br />
erklären<br />
M II.5b<br />
Kräfte zwischen Molekülen als Van-der-Waals-Kräfte, Dipol-Dipol-Wechselwirkung<br />
und Wasserstoffbrückenbindungen<br />
bezeichnen<br />
Atombindung/ unpolare<br />
Elektronenpaarbindung<br />
Elektronenpaarabstoßungsmodell,<br />
Dipol<br />
polare Elektronenpaarbindung<br />
Elektronegativität<br />
Oberflächenspannung<br />
Dichteanomalie<br />
Kristalle<br />
Wasserstoffbrückenbindung<br />
Hydratisierung<br />
Energieschema zum Lösungsvorgang<br />
Dipol-Dipol-<br />
Wechselwirkungen,<br />
polare- und unpolare Stoffe<br />
Elektronegativität<br />
2