Skriptum Bl 12 Physiol d Respiration.pdf
Skriptum Bl 12 Physiol d Respiration.pdf
Skriptum Bl 12 Physiol d Respiration.pdf
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
BLOCK <strong>12</strong>: PHYSIOLOGIE DER RESPIRATION<br />
1) Mechanik der Atmung<br />
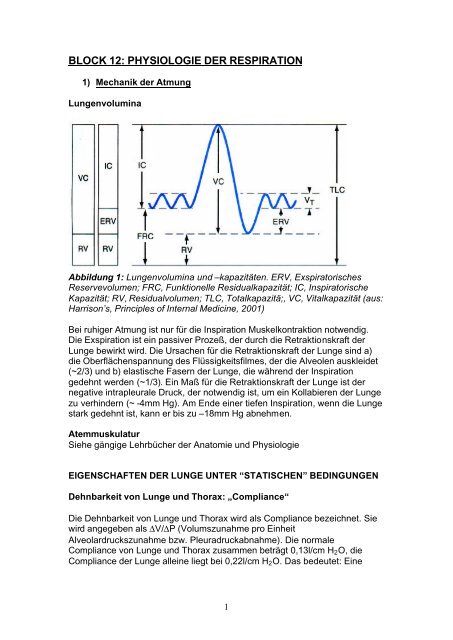
Lungenvolumina<br />
Abbildung 1: Lungenvolumina und –kapazitäten. ERV, Exspiratorisches<br />
Reservevolumen; FRC, Funktionelle Residualkapazität; IC, Inspiratorische<br />
Kapazität; RV, Residualvolumen; TLC, Totalkapazitä;, VC, Vitalkapazität (aus:<br />
Harrison’s, Principles of Internal Medicine, 2001)<br />
Bei ruhiger Atmung ist nur für die Inspiration Muskelkontraktion notwendig.<br />
Die Exspiration ist ein passiver Prozeß, der durch die Retraktionskraft der<br />
Lunge bewirkt wird. Die Ursachen für die Retraktionskraft der Lunge sind a)<br />
die Oberflächenspannung des Flüssigkeitsfilmes, der die Alveolen auskleidet<br />
(~2/3) und b) elastische Fasern der Lunge, die während der Inspiration<br />
gedehnt werden (~1/3). Ein Maß für die Retraktionskraft der Lunge ist der<br />
negative intrapleurale Druck, der notwendig ist, um ein Kollabieren der Lunge<br />
zu verhindern (~ -4mm Hg). Am Ende einer tiefen Inspiration, wenn die Lunge<br />
stark gedehnt ist, kann er bis zu –18mm Hg abnehmen.<br />
Atemmuskulatur<br />
Siehe gängige Lehrbücher der Anatomie und <strong>Physiol</strong>ogie<br />
EIGENSCHAFTEN DER LUNGE UNTER “STATISCHEN” BEDINGUNGEN<br />
Dehnbarkeit von Lunge und Thorax: „Compliance“<br />
Die Dehnbarkeit von Lunge und Thorax wird als Compliance bezeichnet. Sie<br />
wird angegeben als ΔV/ΔP (Volumszunahme pro Einheit<br />
Alveolardruckszunahme bzw. Pleuradruckabnahme). Die normale<br />
Compliance von Lunge und Thorax zusammen beträgt 0,13l/cm H2O, die<br />
Compliance der Lunge alleine liegt bei 0,22l/cm H2O. Das bedeutet: Eine<br />
1
isolierte Lunge ist dehnbarer als ein Lunge „in situ“, wo auch der Thorax<br />
mitgedehnt werden muß.<br />
A<br />
Abbildung 2: Statisches Druck-Volumen-Diagramm. Reinflation nach<br />
Kollaps. Bemerke: Ein- und Ausatmungskurven verlaufen unterschiedlich.<br />
Aus: W.F. Boron & E.L. Boulpaep, Medical <strong>Physiol</strong>ogy<br />
2
Abbildung 3: Druck-Volumen Diagramm der Lunge bei Gesunden und bei<br />
Paatienten mit Emphysem bzw. Lungenfibrose. Aus: W.F. Boron & E.L.<br />
Boulpaep, Medical <strong>Physiol</strong>ogy<br />
3
Abbildung 4: Statisches Druck-Volumen-Diagramm. Bemerke: Die<br />
Oberflächenspannung (Grenzfläche Luft-Wasser in den Alveolen) vermindert<br />
die Complience (blaue Kurven), sie trägt wesentlich zu den „elastischen“<br />
Rückstellkräften der Lunge bei. Aus: W.F. Boron & E.L. Boulpaep, Medical<br />
<strong>Physiol</strong>ogy<br />
Synthese, Zusammensetzung und Funktion des Surfactant<br />
Surfactant ist ein Lipoproteingemisch, das von Alveolarepithelzellen Typ II<br />
synthetisiert wird und die Wand der Alveolen auskleidet. Er ist wie folgt<br />
zusammengesetzt:<br />
• Dipalmitoylphosphatidylcholin (62%)<br />
• Phosphatidylglycin (5%)<br />
• Andere Phospholipide (10%)<br />
• Neutrale Lipide (13%)<br />
• Proteine (8%)<br />
• Kohlenhydrate (2%)<br />
Durch den Surfactant wird die Oberflächenspannung (siehe Physik) des<br />
Flüssigkeitsfilmes, der die Alveolen auskleidet, vermindert. Ohne Surfactant<br />
wären zur Dehnung der Lunge viel negativere Pleuradrucke erforderlich als im<br />
Normalfall. Der Oberflächenspannungs-vermindernde Effekt des Sufactant ist<br />
abhängig von seiner Konzentration pro Flächeneinheit. Bei Verkleinerung der<br />
Alveolen nimmt die Surfactant-Konzentration an der Oberfläche zu und<br />
folglich die Oberflächenspannung ab. Das ist notwendig, da ansonsten bei<br />
4
kleineren Alveolenradien (r) viel höhere Drucke erforderlich wären, um die<br />
Alveolen offen zu halten (Gesetz von Laplace: P=2T/r, T,<br />
Oberflächenspannung). Dieser Mechanismus bewirkt auch, daß die Größe<br />
der einzelnen Alveolen stabilisiert wird. Ohne Surfactant käme es aufgrund<br />
der hohen Oberflächenspannung außerdem zu Verschiebung von Flüssigkeit<br />
aus der Alveolarwand in die Alveolen.<br />
EIGENSCHAFTEN DER LUNGE UNTER „DYNAMISCHEN“<br />
BEDINGUNGEN<br />
Wenn Luft strömt (dynamische Bedingungen), braucht man Kraft nicht nur,<br />
um in Lunge und Thoraxraum ein gewisses Volumen aufrechtzuhalten<br />
(„statische“ Komponente) sondern auch, um Gewebs- und<br />
Atemwegswiderstände zu überwinden „dynamische“ Komponente). Die<br />
Luftströmung (Volumen/Zeit) ist direkt proportional zur treibenden Kraft<br />
[Differenz zwischen alveolärem und atmosphärischen Druck (ΔP)] und<br />
umgekehrt proportional zum Atemwegswiderstand (R). D.h. bei gleichem<br />
Widerstand braucht man um eine größere Strömung zu erreichen eine<br />
größere Druckdifferenz (mehr Anstrengung). Oder anders ausgedrückt: Um<br />
eine gewünschte Luftströmung zu erreichen braucht man bei größerem<br />
Widerstand eine größere Druckdifferenz (vgl. auch elektr. Strom bzw.<br />
Strömung durch <strong>Bl</strong>utgefäße). Der Widerstand ist propotional der Vikosität des<br />
Gases und der Länge des Rohres (beide nicht wichtig für Lunge) und<br />
umgekehrt proportional dem Radius (und zwar r 4 ), d.h. eine relativ geringe<br />
Abnahme des Radius bewirkt eine starke Zunahme des Widerstandes.<br />
Pharynx, Larynx und große Atemwege tragen am meisten zum<br />
Gesamtatemwegswiderstand bei, der Beitrag der kleinsten Luftwege ist sehr<br />
gering.<br />
Die gesamte Atemarbeit kann in drei Komponenten unterteilt werden.<br />
1) Nicht-elastische Arbeit:<br />
Visköser Widerstand (Gewebswiderstand) (7%)<br />
Atemwegswiderstand (28%)<br />
2) Elastische (compliance) Arbeit (65%)<br />
Bronchialtonus<br />
Tonus der Bronchien abhängig von Inspiation (Dilatation durch Sympathikus)<br />
und Exspiration (Konstriktion durch Parasympathikus)<br />
Bronchialtonus am höchsten um ca. 6h morgens, am niedrigsten um ca. 18h<br />
abends.<br />
Bronchokonstriktion durch: Cholinerge Reflexe (durch z.B. Chemikalien, kalte<br />
Luft, etc.), Leukotriene, Substanz P, Adenosin<br />
Bronchodilatation durch: VIP<br />
Forcierte Exspiration<br />
Bei forcierter Exspiration wird von außen derselbe Druck auf die Alveolen und<br />
die Bronchiolen ausgeübt. Dieser Druck treibt einerseits die Luft aus den<br />
Alveolen in die Bronchiolen, andererseits verengt er die Bronchiolen (siehe<br />
5
Abb. 2). Die maximal-erreichbare exspiratorische Flußrate ist bei großen<br />
Lungenvolumina größer als bei kleinen.<br />
Abbildung 5: Forcierte Exspiration. A, Kollaps der Atemwege bei<br />
maximaler, forcierter Exspiration, ein Effekt, der limitierend für die<br />
exspiratorische Flußrate ist.<br />
B, Abhängigkeit der maximalen exspiratorischen Flußrate vom<br />
Lungenvolumen.<br />
(aus: Guyton, Textbook of Medical <strong>Physiol</strong>ogy)<br />
6
Abbildung 6: Forcierte Exspiration nach maximaler Inspiation bei gesunden<br />
Normalpersonen (A), bei Patienten mit obstruktiven Lungenerkrankungen<br />
(z.B. Asthma, B) und Patienten mit parenchymal restriktiven<br />
Lungenerkrankungen (z.B. Lungenfibrose, C). FVC, forcierte Vitalkapazität;<br />
VC, Vitalkapazität; FEV1, forciertes exspiratorisches Volumen/1s, 1-<br />
Sekundenkapazität; MMFR, forcierte mittlere Flußrate. (aus: Harrison’s<br />
Principles of Internal Medicine, 2001)<br />
Abbildung 7: Fluß-Volumen Diagramm bei physiologischen und<br />
pathologischen Bedingungen. O, Obstruktive Erkrankung (z.B. Asthma);<br />
R(E), extraparenchymal restiktive Erkrankung (z.B. neuromuskuläre oder<br />
Thoraxerkrankungen); R(P) parenchymal restriktive Erkrankung (z.B.<br />
Lungenfibrose). Aus: Harrison’s Principles of Internal Medicine.<br />
2) Lungenzirkulation:<br />
Das <strong>Bl</strong>utgefäßsystem der Lunge ist ein dehnbares Niederdrucksystem. Der<br />
Druck in der Pulmonalarterie beträgt ca. 24/9mm Hg; der Mitteldruck ist ca.<br />
15mm Hg. Der diastolische Druck im linken Vorhof ist ca. 8mm Hg, sodaß der<br />
Druckgradient im Lungenkreislauf nur ca. 7mm Hg beträgt (vergleiche 90 mm<br />
Hg im systemischen Kreislauf). Der Druck in den Lungenkapillaren ist ca.<br />
10mm Hg, sodaß (bei einem onkotischen Druck von ca. 25mm Hg) ein<br />
einwärts gerichteter Druckgradient von ca 15mm Hg besteht, der<br />
normalerweise die Alveolen frei von Flüssigkeit hält.<br />
Aufgrund der Schwerkraft kommt es bei aufrechter Körperhaltung zu<br />
ausgeprägten Druckunterschieden in den Lungenarterien zwischen<br />
Lungenspitzen und Lungenbasis, und einer daraus resultierenden<br />
unterschiedlichen Durchblutung (Lungenbasen stärker durchblutet als<br />
Lungenspitzen). Auch die Ventilation nimmt von den Spitzen zur Basis zu.<br />
Das Ventilations-/Perfusionsverhältnis beträgt für die gesamte Lunge im<br />
7
Schnitt 0,8 (4,2l/min Ventilation, 5,5l/min Durchblutung), ist jedoch in den<br />
oberen Abschnitten der Lunge am größten.<br />
3) Gasaustausch in der Lunge<br />
Die Zusammensetzung des alveolären Gasgemisches ist relativ konstant<br />
(siehe Abbildung 6), weil pro Atemzug bei ruhiger Atmung nur eine geringe<br />
Menge Frischluft [Atemzugvolumen (~500ml) minus Totraumvolumen<br />
(~170ml), d.h. ~330ml] einem relativ großen Volumen (funktionelle<br />
Residualkapazität, ~2,5l) zugemischt wird. Bei alveolärer Hyperventilation<br />
wird die Zusammensetzung des alveolären Gasgemisches in Richtung<br />
„Frischluft“ verschoben , d.h. pCO2 sinkt, pO2 steigt. Bei alveolärer<br />
Hypoventilation sinkt der alveoläre pO2 und steigt der alveoläre pCO2.<br />
Abbildung 8: Partialdrucke von Gasen (mm Hg) in verschiedenen Teilen<br />
des <strong>Respiration</strong>straktes und Kreislaufsystems (aus: W.F. Ganong, Review<br />
of Medical <strong>Physiol</strong>ogy, 1999).<br />
Diffusion durch die alveolo-kapilläre Membran (siehe Physik)<br />
4) Atemgastransport zwischen Lunge und Gewebe:<br />
Sauerstofftransport im <strong>Bl</strong>ut<br />
S-förmiger Verlauf der Sauerstoff-Bindungskurve ist von praktischer Relevanz<br />
für die Sauerstofftransportfunktion des <strong>Bl</strong>utes: Im oberen Bereich (pO2<br />
8
~60mm Hg) verläuft die Kurve flach, Veränderungen des pO2 ändern daher<br />
an der Sättigung des Hämoglobins nur wenig. Das bedeutet einerseits, daß<br />
eine geringe Abnahme des alveolären pO2 die Sauerstoffsättigung des<br />
arteriellen <strong>Bl</strong>utes nicht vermindert. Andererseits nimmt das <strong>Bl</strong>ut bei erhöhtem<br />
alveolären pO2 nicht nennenswert mehr Sauerstoff auf, da es schon bei<br />
normaler Luftatmung vollständig gesättigt ist. Im unteren Bereich fällt die<br />
Kurve steil ab. Das gewährleistet, daß der pO2 in der Peripherie trotz der<br />
Sauerstoffabgabe hoch genug bleibt, um die Gewebe durch Diffusion zu<br />
versorgen.<br />
Rechtsverschiebung der Sauerstoffbindungskurve (= Affinitätsabnahme,<br />
erleichterte O2-Abgabe) durch Erhöhung bzw. Linksverschiebung (=<br />
Affinitätszunahme, erleichterte O2-Bindung) durch Erniedrigung der:<br />
• H + -Ionen-Konzentration<br />
• CO2-Konzentration<br />
• Temperatur<br />
• 2,3-Diphosphoglycerat (DPG)-Konzentration; DPG ist ein Metabolit des<br />
Glucosestoffwechsels und in Erythrozyten reichlich vorhanden. Es<br />
bindet an die beta-Ketten des desoxygenierten Hämoglobins. bei<br />
hohem pH (z.B. bei Hyperventilation in großen Höhen) steigt die 2,3-<br />
DPG-Konzentration, bei niedrigem sinkt sie. Fetales Hämoglobin (HbF)<br />
hat anstelle von beta-Ketten gamma-Ketten, die 2,3-DPG viel<br />
schlechter binden als die beta Ketten des adulten Hämoglobins (HbA).<br />
HbF hat daher eine höhere O2-Affinität als HbA und kann leichter O2<br />
aus dem mütterlichen <strong>Bl</strong>ut aufnehmen.<br />
Mit Sauerstoff gesättigtes Hämoglobin enthält (theoretisch) pro g 1,39ml O2<br />
(tatsächlich 1,34ml/g). Dieser Wert ergibt sich aus folgendem: 1 Mol Hb<br />
(~64,500g) kann 4 Mol Sauerstoff (Molvolumen eines idealen Gases:<br />
22,4l/Mol) binden. Daraus folgt, daß in 100ml arteriellem <strong>Bl</strong>ut (Hb-<br />
Konzentration ~15g/100ml) bei 100%iger Sättigung des Hämoglobins ca. 20<br />
ml Sauerstoff an Hämoglobin gebunden sind. Die Menge an gelöstem O2 ist<br />
vergleichsweise sehr gering (siehe Tabelle in Abbildung 7).<br />
9
Abbildung9: Sauerstoffbindungskurve (aus: W.F. Ganong, Review of<br />
Medical <strong>Physiol</strong>ogy, 1999)<br />
10
CO2-Transport im <strong>Bl</strong>ut<br />
Abbildung 10: CO2-Transport im <strong>Bl</strong>ut. Hgb, Hämoglobin (aus: Guyton,<br />
Textbook of Medical <strong>Physiol</strong>ogy)<br />
5) Atemregulation:<br />
Atemzentrum und Atemregulation (siehe Lehrbücher)<br />
Stimuli, die das Atemzentrum beeinflussen:<br />
• CO2 über periphere (Glomus caroticum und Glomus aorticum) und<br />
zentrale Chemorezeptoren. Zentral: CO2 passiert sehr leicht die <strong>Bl</strong>ut-<br />
Hirn-Schranke und gelangt in den Liquor. Dort kommt es zu einer<br />
Erhöhung der H + -Ionen-Konzentration (pH-Abfall), die chemosensitive<br />
Areale der Medulla oblongata stimuliert.<br />
• O2 und H + über periphere Chemorezeptoren (Glomus caroticum und<br />
Glomus aorticum)<br />
• Vagale Afferenzen von Rezeptoren in Luftwegen und Lunge<br />
• Afferenzen von Brücke, Hypothalamus und limbischem System<br />
• Afferenzen von Propriozeptoren<br />
• Afferenzen von Barorezeptoren (Hoch- und Niederdrucksystem)<br />
6) Anpassungsmechanismen der Atmung:<br />
Atmung in großer Höhe<br />
Problem: Mit zunehmender Höhe sinkt der Umgebungsluftdruck und damit<br />
auch der pO2. In 3000m Höhe ist der alveoläre pO2 ca. 60mm Hg. Durch den<br />
hypoxischen Stimulus kommt es zur Hyperventilation, was dem pO2-Abfall bei<br />
weiterem Anstieg entgegenwirkt und zu einem Absinken des pCO2 und<br />
11
espiratorischer Alkalose führt. Bei nicht-akklimatisierten Personen kommt es<br />
bei Luftatmung in einer Höhe von 6100m zur Bewußtlosigkeit. Bei Atmen von<br />
reinem Sauerstoff wird der Umgebungsdruck limitierend: Alveolärer pCO2<br />
(=40mm Hg) und alveolärer pH2O (=47mm Hg) sind unabhängig vom<br />
Umgebungsdruck. Um daher einen alveolären pO2 von 100mm Hg zu<br />
erreichen ist daher ein Luftdruck von mindestens 187mm Hg erforderlich<br />
(entsprechend einer Höhe von ca. 10400m).<br />
Kompensationsmechanismen, Akklimatisation: Hyperventilation mit<br />
resultierender resp. Alkalose, Anstieg des 2,3-DPG durch die Alkalose, leichte<br />
Rechtsverschiebung der Sauerstoffbindungskurve durch 2,3-DPG, dadurch<br />
erleichterte O2-Abgabe im Gewebe, aber auch erschwerte O2-Aufnahme,<br />
Anstieg des Erythropoetin und Erhöhung der Erythrozytenzahl. Anstieg der<br />
Mitochondrienzahl, des Myoglobins und der Cytochrom Oxidase.<br />
Tauchen (nur einige Überlegungen):<br />
Abbildung 11: Effekt der Tiefe auf Gasvolumina (aus: Guyton, Textbook of<br />
Medical <strong>Physiol</strong>ogy)<br />
<strong>12</strong>
• Unter Wasser nimmt der Umgebungsdruck pro ~10m Tiefe um eine<br />
Atmosphäre zu (d.h. in 10m Tiefe herrscht ein Druck von 2atm, in 20m<br />
Tiefe ein Druck von 3atm, usw.).<br />
• Durch den hohen Druck unter Wasser werden Gase auf immer kleinere<br />
Volumina komprimiert (siehe Abbildung 9). Hoher Druck kann die<br />
Lufträume des Körpers, inkl. der Lunge so stark verkleinern, daß es<br />
beim Abtauchen - zu Schädigungen kommt („squeeze“).<br />
• In Analogie dazu: Wenn ein Taucher, der in der Tiefe unter hohem<br />
Druck geatmet hat, die Luft anhält und auftaucht, kann es durch die<br />
Expansion der Luft in der Lunge zu Rupturen der Lungengefäße und<br />
Luftembolie kommen.<br />
• „Stickstoffnarkose/Tiefenrausch“: Wenn komprimierte Luft (ca.4/5 N2)<br />
unter hohem Druck geatmet wird, kommt es ab einer Tiefe von ca. 30m<br />
zu neurologischen Erscheinungen (Symptome ähnlich einer<br />
Alkoholintoxikation). Der Grund dafür ist, daß Stickstoff gut Lipid-löslich<br />
ist und in Membranen und anderen Lipiden des Nervensystems gelöst<br />
wird, wo er ähnlich wie ein Narkotikum wirken kann.<br />
• „Dekompression“: Wenn ein Taucher über längere Zeit Stickstoff unter<br />
hohem Druck atmet, wird dieser entsprechend seinem Druck in<br />
Körperflüssigkeiten und Geweben gelöst. Beim Auftauchen sinkt der<br />
Druck und Stickstoff diffundiert in die Lunge. Erfolgt der Druckabfall zu<br />
rasch, entstehen Gasblasen (ähnlich wie beim Öffnen einer<br />
Sodawasserflasche), die je nach Menge und Lokalisation<br />
Gewebeschädigungen und entsprechende Symptome verursachen.<br />
13