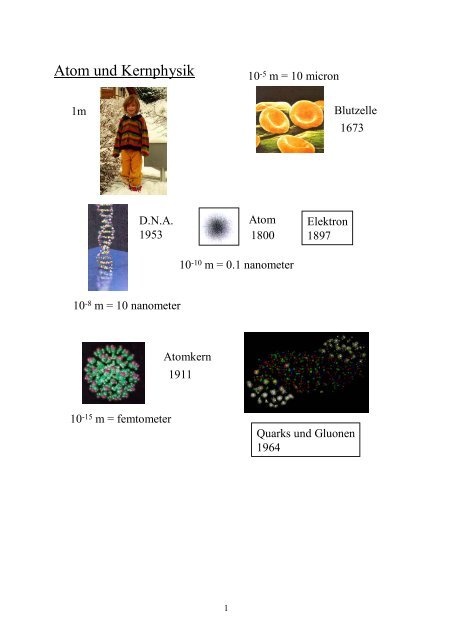
Atom und Kernphysik
Atom und Kernphysik
Atom und Kernphysik
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Atom</strong> <strong>und</strong> <strong>Kernphysik</strong><br />
1m<br />
D.N.A.<br />
1953<br />
10 -8 m = 10 nanometer<br />
10 -15 m = femtometer<br />
<strong>Atom</strong>kern<br />
1911<br />
1<br />
10 -5 m = 10 micron<br />
<strong>Atom</strong><br />
1800<br />
10 -10 m = 0.1 nanometer<br />
Elektron<br />
1897<br />
Blutzelle<br />
1673<br />
Quarks <strong>und</strong> Gluonen<br />
1964
<strong>Atom</strong>e<br />
Dalton: Jeder Stoff ist aus chemische Elementen<br />
zusammengesetzt.<br />
1Mol Na + 1Mol Cl -> 1Mol NaCl<br />
Ein Mol enthält immer die gleiche Anzahl <strong>Atom</strong>e NA .<br />
N<br />
A<br />
= 6,<br />
022<br />
Die molaren Massen dieser Elemente zeigen ein fast<br />
ganzzahliges Verhältnis.<br />
<strong>Atom</strong>are Masseneinheit:<br />
1u<br />
=<br />
12<br />
2<br />
10<br />
m(<br />
C)<br />
12g<br />
=<br />
12 12N<br />
A<br />
23<br />
=<br />
1.<br />
66<br />
10<br />
−27<br />
kg<br />
Chemische Eigenschaften lassen sich nach der Tabelle<br />
von Mendeljev klassifizieren.
1897: Entdeckung des Elektrons durch J.J. Thomson<br />
1<br />
me = u,<br />
qe<br />
1836<br />
Geiger Rutherford<br />
3<br />
= −e<br />
1911: Entdeckung des <strong>Atom</strong>kerns: fast die gesamte<br />
Masse steckt im <strong>Atom</strong>kern. Radius:~10 -15 m.
Kernradien sind 100000 mal kleiner als <strong>Atom</strong>radien<br />
1m<br />
10 -5 m = 10 micron<br />
10 -10 m = Angström<br />
10 -15 m = femtometer<br />
4<br />
Mensch<br />
<strong>Atom</strong><br />
1800<br />
Der <strong>Atom</strong>kern enthält 99.97 % der gesamten<br />
Materie <strong>und</strong> ist positiv geladen.<br />
-e<br />
Li<br />
Blutzelle<br />
1673<br />
<strong>Atom</strong>kern<br />
1911<br />
-e<br />
+3e<br />
.<br />
-e
Die klassische Physik kann <strong>Atom</strong>e nicht beschreiben!<br />
Verwenden wir ein einfaches Kreisbahn-Modell für<br />
ein Wasserstoffatom,<br />
dann gilt:<br />
m e<br />
2<br />
ω R =<br />
1<br />
4πε<br />
Dies ergibt zwei Widersprüche:<br />
1) Jedes R ist erlaubt, also auch jede Elektronenenergie<br />
(kontinuierliches Energiespektrum).<br />
2) Eine beschleunigte Ladung sendet elektromagnetische<br />
Strahlung aus. Also verliert das Elektron<br />
kontinuierlich Energie <strong>und</strong> stürzt in einer<br />
spiralförmigen Bahn in den <strong>Atom</strong>kern.<br />
Experimentell beobachtet man nur diskrete <strong>und</strong><br />
Element-spezifische Energiezustände.<br />
5<br />
0<br />
e<br />
R<br />
Spektrallinien (Absorption)<br />
2<br />
2
Lösung: Quantenmechanik (N. Bohr 1913)<br />
Postulat 1: Elektronen bewegen sich strahlungslos in<br />
Quantenzuständen mit bestimmten Energien E i.<br />
Postulat 2: Die Energiewerte werden durch die<br />
Quantifizierung des Drehimpulses bestimmt:<br />
L m<br />
mit m=0,1,2,,3,... <strong>und</strong><br />
h<br />
= m =<br />
2π<br />
6<br />
mh<br />
Wellenfunktionen<br />
Wellenfunktionen beschreiben die Quantenzustände<br />
h: Planck´sches Wirkungsquant h=6.6 10 -34 J.s
Postulat 3: Übergänge zwischen Quantenzuständen<br />
(Quantensprünge) finden mittels Absorption <strong>und</strong><br />
Emission von Photonen (Lichtquanten) statt.<br />
Photonen sind die Lichtquanten der elektromagnetischen<br />
Strahlung. Ihre Energie ist gegeben<br />
durch: E photon=hν<br />
-e<br />
Li<br />
E photon=E 2 -E 1<br />
E 2<br />
E 1<br />
Absorption Emission<br />
-e<br />
+3e<br />
.<br />
-e<br />
7<br />
-e<br />
Li<br />
-e<br />
-e<br />
+3e<br />
.<br />
E 2<br />
E 1
Energiezustände des Wasserstoffsatoms (Bohr 1913)<br />
E<br />
n<br />
0<br />
4<br />
mee<br />
Z<br />
= −<br />
2<br />
2( 4πε<br />
h)<br />
n<br />
E[eV]<br />
0.0<br />
Mögliche<br />
angeregte<br />
Energiezustände<br />
Gr<strong>und</strong>zustand<br />
2<br />
2<br />
mit<br />
8<br />
mee = 13.<br />
6 2<br />
2(<br />
4πε<br />
h)<br />
0<br />
4<br />
n: Hauptquantenzahl<br />
-13.6<br />
Weitere Quantenzahlen:<br />
Bahndrehimpuls L = 0,1,2,...,n-1<br />
magnetische Quantenzahl M = -L,-L+1,..,L-1,L<br />
eV<br />
n<br />
:<br />
4<br />
3<br />
2<br />
1
Eine genaue Beschreibung zeigt, dass Elektronen einen<br />
inneren Drehimpuls, Spin genannt, besitzen. Der<br />
Elektronenspin hat der Wert:<br />
<strong>Atom</strong>e mit mehreren Elektronen müssen außerdem das<br />
Pauli-Prinzip erfüllen.<br />
Pauli-Prinzip: Zwei Fermionen können nicht denselben<br />
Quantenzustand besetzen.<br />
<strong>Atom</strong>radien in 10 -12 m<br />
1<br />
s = h<br />
2<br />
Teilchen mit halbzahligem Spin nennt man Fermionen.<br />
Dies ergibt eine Schalenstruktur mit den Edelgasen<br />
als <strong>Atom</strong>e mit volle Schalen <strong>und</strong> erklärt das periodische<br />
System der Elemente (Tabelle von Mendeljev)<br />
Ordnungszahl Z<br />
9
Die Quantentheorie erklärt die Spektrallinien <strong>und</strong><br />
liefert die Ionisierungsenergien (notwendig Energien<br />
um Elektronen aus dem <strong>Atom</strong> herauszulösen).<br />
E Ion<br />
E Ion<br />
hν<br />
hν<br />
kl<br />
kl<br />
= 13.<br />
6<br />
=<br />
E<br />
K-Linien<br />
1 1<br />
= 13. 6(<br />
− ) 2 2<br />
l k<br />
eV<br />
M-Linien<br />
k<br />
−<br />
10<br />
E<br />
l<br />
für Wasserstoff bis zu<br />
N-Elektronen<br />
M-Elektronen<br />
K-Elektronen<br />
= 115.<br />
6 keV für K-Elektronen in Uranium
Der <strong>Atom</strong>kern<br />
1932: Entdeckung des Neutrons<br />
Ladung Spin Masse (kg) Lebensdauer (s)<br />
Proton: + e 1/2 1.672649 10 -27 >10 33<br />
Neutron: 0 1/2 1.674955 10 -27 887<br />
<strong>Atom</strong>kerne bestehen aus N Neutronen <strong>und</strong> Z Protonen.<br />
7<br />
3 4<br />
-e<br />
Li<br />
A: Nukleonenzahl (Massenzahl)<br />
chemisches<br />
Element<br />
N: Neutronenzahl<br />
Z: Protonenzahl<br />
Ordnungszahl<br />
11<br />
-e<br />
+3e<br />
Zu den meisten chemischen Elementen existieren<br />
sogenannte Isotope. Das sind Kerne gleicher Protonenzahl<br />
(also dasselbe Element), aber unterschiedlicher<br />
Neutronenzahl.<br />
Wichtig: Isotope reagieren chemisch identisch.<br />
-e
Es gibt stabile <strong>und</strong> instabile (radioaktive) Isotope.<br />
Z<br />
Stabile Isotope<br />
z.B.:Wasserstoff:<br />
Kupfer:<br />
N<br />
12<br />
1<br />
1<br />
stabil<br />
instabil<br />
2<br />
1<br />
65<br />
29<br />
99. 985%<br />
H 0 + 0.<br />
015%<br />
H1<br />
63<br />
69. 17%<br />
Cu + 30.<br />
83%<br />
Cu<br />
29<br />
34<br />
Isotope zeigen auch eine Schalenstruktur<br />
Protonenzahl<br />
28<br />
50<br />
82<br />
Neutronenzahl<br />
36
Im <strong>Atom</strong>kern existieren zwei neue Kräfte:<br />
die stärke Wechselwirkung<br />
die schwache Wechselwirkung<br />
V NN<br />
Sehr kleine Reichweite um die 10 -15 m (bei<br />
schwacher Wechselwirkung nur 10 -17 m ).<br />
Repulsiv bei kleinem Abstand.<br />
CHEMIE<br />
ATOM<br />
10 -5 10 0 10 5 10 10 eV<br />
1K 300K Sonne<br />
13<br />
Abstand<br />
Protonrestmasse<br />
10 -15 m<br />
Wie das <strong>Atom</strong> stellt der <strong>Atom</strong>kern ein rein quantenmechanisches<br />
System dar, aber mit sehr hohen<br />
Anregungsenergien.<br />
ATOMKERN
Bindungsenergien im <strong>Atom</strong>kern.<br />
Wichtig im <strong>Atom</strong>kern ist die Masse-Energie-<br />
Äquivalenz von Einstein:<br />
E =<br />
2<br />
mc<br />
weil Bindungsenergien von <strong>Atom</strong>kernen fast im<br />
prozentualen Bereich ihrer Massenenergie liegen.<br />
Beispiel: 4He hat eine Masse von 6,645 10-27 kg aber<br />
die Masse von zwei Protonen <strong>und</strong> zwei Neutronen ist:<br />
2mp<br />
+ 2mn<br />
=<br />
6.<br />
69510<br />
14<br />
−27<br />
kg<br />
Also muss der Energiesatz im <strong>Atom</strong>kern lauten:<br />
E( N,<br />
Z)<br />
= Zmpc<br />
+ Nmnc<br />
2<br />
2<br />
− B(<br />
N,<br />
Z)<br />
Die Bindungsenergie B(N,Z) ist für verschiedene Kerne<br />
sehr unterschiedlich <strong>und</strong> erlaubt den radioaktiven<br />
Zerfall bestimmter Kerne.<br />
B(N,Z)<br />
A<br />
[MeV]<br />
Fusion<br />
Spaltung<br />
A
Instabile <strong>Atom</strong>kerne zerfallen auf unterschiedliche<br />
Arten.<br />
α-Zerfall: Emission eines 4 He <strong>Atom</strong>kerns,<br />
A<br />
Z<br />
A−4<br />
X N →Z −2<br />
YN<br />
−2<br />
15<br />
+<br />
4<br />
2<br />
He<br />
β−-Zerfall: Umwandlung eines Neutrons in ein<br />
Proton<br />
A<br />
Z<br />
A<br />
→ + 1 −1<br />
X N Z YN<br />
2<br />
+ Elektron +<br />
Antineutrino<br />
β + -Zerfall: Umwandlung eines Protons in ein<br />
Neutron<br />
A<br />
Z<br />
A<br />
→ −1 + 1<br />
X N Z YN<br />
+<br />
Positron<br />
+<br />
Neutrino<br />
Spaltung: Zerfall eines <strong>Atom</strong>kerns in zwei Teile.
Übung<br />
Berechnen Sie die Wellenlänge des Photons, das<br />
emitiert wird, wenn ein Elektron des Wasserstoff-<br />
<strong>Atom</strong>s vom Zustand mit n=2 in der Gr<strong>und</strong>zustand<br />
übergeht.<br />
16
Positronen-Emissions-Tomographie<br />
17