Curriculum für das Fach Chemie in Klasse 9 - Ritzefeld-Gymnasium
Curriculum für das Fach Chemie in Klasse 9 - Ritzefeld-Gymnasium
Curriculum für das Fach Chemie in Klasse 9 - Ritzefeld-Gymnasium
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
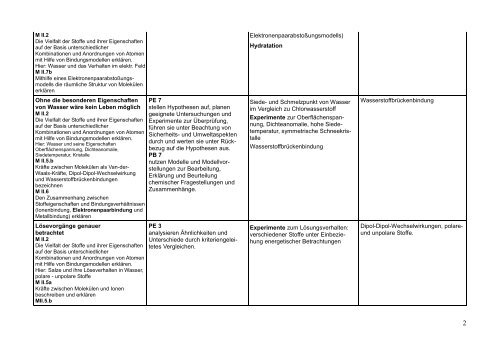
M II.2<br />
Die Vielfalt der Stoffe und ihrer Eigenschaften<br />
auf der Basis unterschiedlicher<br />
Komb<strong>in</strong>ationen und Anordnungen von Atomen<br />
mit Hilfe von B<strong>in</strong>dungsmodellen erklären.<br />
Hier: Wasser und <strong>das</strong> Verhalten im elektr. Feld<br />
M II.7b<br />
Mithilfe e<strong>in</strong>es Elektronenpaarabstoßungsmodells<br />
die räumliche Struktur von Molekülen<br />
erklären<br />
Ohne die besonderen Eigenschaften<br />
von Wasser wäre ke<strong>in</strong> Leben möglich<br />
M II.2<br />
Die Vielfalt der Stoffe und ihrer Eigenschaften<br />
auf der Basis unterschiedlicher<br />
Komb<strong>in</strong>ationen und Anordnungen von Atomen<br />
mit Hilfe von B<strong>in</strong>dungsmodellen erklären.<br />
Hier: Wasser und se<strong>in</strong>e Eigenschaften<br />
Oberflächenspannung, Dichteanomalie,<br />
Siedetemperatur, Kristalle<br />
M II.5.b<br />
Kräfte zwischen Molekülen als Van-der-<br />
Waals-Kräfte, Dipol-Dipol-Wechselwirkung<br />
und Wasserstoffbrückenb<strong>in</strong>dungen<br />
bezeichnen<br />
M II.6<br />
Den Zusammenhang zwischen<br />
Stoffeigenschaften und B<strong>in</strong>dungsverhältnissen<br />
(Ionenb<strong>in</strong>dung, Elektronenpaarb<strong>in</strong>dung und<br />
Metallb<strong>in</strong>dung) erklären<br />
Lösevorgänge genauer<br />
betrachtet<br />
M II.2<br />
Die Vielfalt der Stoffe und ihrer Eigenschaften<br />
auf der Basis unterschiedlicher<br />
Komb<strong>in</strong>ationen und Anordnungen von Atomen<br />
mit Hilfe von B<strong>in</strong>dungsmodellen erklären.<br />
Hier: Salze und ihre Löseverhalten <strong>in</strong> Wasser,<br />
polare - unpolare Stoffe<br />
M II.5a<br />
Kräfte zwischen Molekülen und Ionen<br />
beschreiben und erklären<br />
MII.5.b<br />
PE 7<br />
stellen Hypothesen auf, planen<br />
geeignete Untersuchungen und<br />
Experimente zur Überprüfung,<br />
führen sie unter Beachtung von<br />
Sicherheits- und Umweltaspekten<br />
durch und werten sie unter Rückbezug<br />
auf die Hypothesen aus.<br />
PB 7<br />
nutzen Modelle und Modellvorstellungen<br />
zur Bearbeitung,<br />
Erklärung und Beurteilung<br />
chemischer Fragestellungen und<br />
Zusammenhänge.<br />
PE 3<br />
analysieren Ähnlichkeiten und<br />
Unterschiede durch kriteriengeleitetes<br />
Vergleichen.<br />
Elektronenpaarabstoßungsmodells)<br />
Hydratation<br />
Siede- und Schmelzpunkt von Wasser<br />
im Vergleich zu Chlorwasserstoff<br />
Experimente zur Oberflächenspannung,<br />
Dichteanomalie, hohe Siedetemperatur,<br />
symmetrische Schneekristalle<br />
Wasserstoffbrückenb<strong>in</strong>dung<br />
Experimente zum Lösungsverhalten:<br />
verschiedener Stoffe unter E<strong>in</strong>beziehung<br />
energetischer Betrachtungen<br />
Wasserstoffbrückenb<strong>in</strong>dung<br />
Dipol-Dipol-Wechselwirkungen, polare-<br />
und unpolare Stoffe.<br />
2