4 Enzyme - Biochemie - Nachhilfe
4 Enzyme - Biochemie - Nachhilfe
4 Enzyme - Biochemie - Nachhilfe
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
00_biochemie.book Seite 69 Freitag, 15. August 2003 6:47 06<br />
4.2 Regulationsmechanismen 69<br />
Reaktionsgeschwindigkeit<br />
des Enzyms<br />
K-TYP<br />
Reaktionsgeschwindigkeit<br />
des Enzyms<br />
V-TYP<br />
1<br />
2<br />
V max<br />
Aktivierung<br />
Zunehmende<br />
Affinität<br />
V max<br />
Hemmung<br />
Abnehmende<br />
Affinität<br />
V max<br />
Aktivierung<br />
Zunehmende<br />
Arbeitskapazität<br />
2 V max<br />
Hemmung Abnehmende<br />
1<br />
2<br />
V max<br />
Arbeitskapazität<br />
Km Km Km Substratkonzentration<br />
ohne<br />
aktiviert<br />
gehemmt<br />
allosterische<br />
Regulation<br />
Substratkonzentration<br />
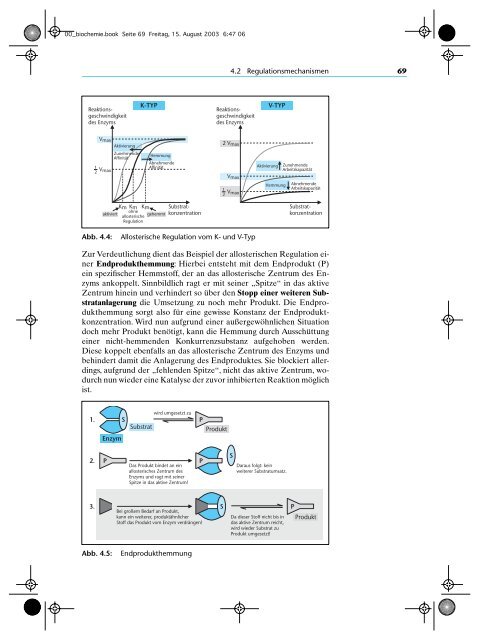
Abb. 4.4:<br />
Allosterische Regulation vom K- und V-Typ<br />
Zur Verdeutlichung dient das Beispiel der allosterischen Regulation einer<br />
Endprodukthemmung: Hierbei entsteht mit dem Endprodukt (P)<br />
ein spezifischer Hemmstoff, der an das allosterische Zentrum des Enzyms<br />
ankoppelt. Sinnbildlich ragt er mit seiner „Spitze“ in das aktive<br />
Zentrum hinein und verhindert so über den Stopp einer weiteren Substratanlagerung<br />
die Umsetzung zu noch mehr Produkt. Die Endprodukthemmung<br />
sorgt also für eine gewisse Konstanz der Endproduktkonzentration.<br />
Wird nun aufgrund einer außergewöhnlichen Situation<br />
doch mehr Produkt benötigt, kann die Hemmung durch Ausschüttung<br />
einer nicht-hemmenden Konkurrenzsubstanz aufgehoben werden.<br />
Diese koppelt ebenfalls an das allosterische Zentrum des Enzyms und<br />
behindert damit die Anlagerung des Endproduktes. Sie blockiert allerdings,<br />
aufgrund der „fehlenden Spitze“, nicht das aktive Zentrum, wodurch<br />
nun wieder eine Katalyse der zuvor inhibierten Reaktion möglich<br />
ist.<br />
1.<br />
Enzym<br />
S<br />
Substrat<br />
wird umgesetzt zu<br />
P<br />
Produkt<br />
2. P<br />
Das Produkt bindet an ein<br />
P<br />
allosterisches Zentrum des<br />
Enzyms und ragt mit seiner<br />
Spitze in das aktive Zentrum!<br />
S<br />
Daraus folgt: kein<br />
weiterer Substratumsatz.<br />
3.<br />
Bei großem Bedarf an Produkt,<br />
kann ein weiterer, produktähnlicher<br />
Stoff das Produkt vom Enzym verdrängen!<br />
S<br />
Da dieser Stoff nicht bis in<br />
das aktive Zentrum reicht,<br />
wird wieder Substrat zu<br />
Produkt umgesetzt!<br />
P<br />
Produkt<br />
Abb. 4.5:<br />
Endprodukthemmung