Wasser - HZDR
Wasser - HZDR
Wasser - HZDR
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
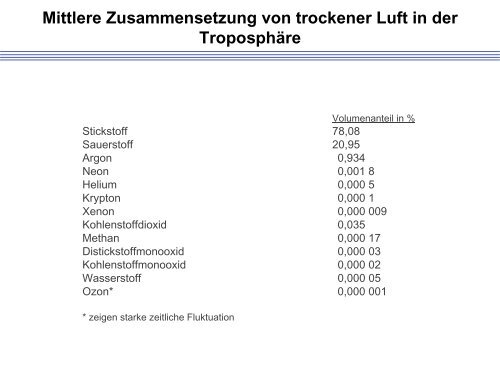
Mittlere Zusammensetzung von trockener Luft in der<br />
Troposphäre<br />
Volumenanteil in %<br />
Stickstoff 78,08<br />
Sauerstoff 20,95<br />
Argon 0,934<br />
Neon 0,001 8<br />
Helium 0,000 5<br />
Krypton 0,000 1<br />
Xenon 0,000 009<br />
Kohlenstoffdioxid 0,035<br />
Methan 0,000 17<br />
Distickstoffmonooxid 0,000 03<br />
Kohlenstoffmonooxid 0,000 02<br />
<strong>Wasser</strong>stoff 0,000 05<br />
Ozon* 0,000 001<br />
* zeigen starke zeitliche Fluktuation
Auswurf Kohlekraftwerk
<strong>Wasser</strong><br />
<strong>Wasser</strong>molekül<br />
<strong>Wasser</strong>stoffbindung<br />
O<br />
n<br />
n<br />
H<br />
H<br />
n<br />
n<br />
n<br />
HYDROGEN<br />
ATOM<br />
n<br />
◦<br />
HYDROGEN<br />
BONDS<br />
n<br />
n<br />
◦<br />
n<br />
OXYGEN<br />
ATOM<br />
◦<br />
n<br />
◦ n<br />
◦
<strong>Wasser</strong>arten und Verteilung<br />
- Oberflächenwasser (<strong>Wasser</strong> in Bächen, Flüssen, Seen, Meeren, Ozeanen)<br />
- <strong>Wasser</strong>verteilung auf der Erde:<br />
∗ 97,4 % Salzwasser<br />
∗ 2,6 % Süßwasser, davon<br />
77,2 % Eis<br />
22,2 % Grundwasser (bis 800 m Tiefe 9,9 %, bis 4000 m Tiefe 12,3 %<br />
0,35 % Seenwasser<br />
0,003 % Flusswasser<br />
- nur noch selten hat das in der Natur vorkommende <strong>Wasser</strong> Trinkwasserqualität<br />
bei Grund- und Quellwässern:<br />
Abhängigkeit von durchströmten Formationen (Zusammensetzung der Gesteine<br />
und Minerale)<br />
von der Verweilzeit im Boden, Bodenarten, Korngröße, Acidität, Gehalt an<br />
organischem Material
DIN-Verfahren für die Probenahme von Wässern<br />
DIN<br />
Bezeichnung<br />
38 402 T11 Probenahme von Abwasser<br />
38 402 T12 Probenahme aus stehenden Gewässern<br />
38 402 T13 Probenahme aus Grundwasserleitern<br />
38 402 T14 Probenahme aus Rohwasser und Trinkwasser<br />
38 402 T15 Probenahme aus Fließgewässern<br />
38 402 T16 Probenahme aus dem Meer<br />
38 402 T17 Probenahme von fallenden, nassen Niederschlägen<br />
in flüssigem Aggregatzustand<br />
38 402 T18 Probenahme von <strong>Wasser</strong> aus Mineral- und Heilquellen<br />
38 402 T19 Probenahme von Schwimm- und Badewasser<br />
38 402 T20 Probenahme von Tidegewässern<br />
38 402 T21 Probenahme von Kühlwasser für den industriellen<br />
Gebrauch
<strong>Wasser</strong> für die Spurenanalytik<br />
- <strong>Wasser</strong> ist bedeutendstes Lösungsmittel im analytischen Labor<br />
- Reinheit beeinflusst spurenanalytisches Ergebnis<br />
(„Geisterpeaks“ im IC-Chromatogramm „unmögliche Wert“ bei AAS, ICP-MS)<br />
- Reinstwasseranlagen sind industriellen Großanlagen in der Technologie nachempfunden<br />
Herstellung:<br />
Trinkwasser Enthärtung<br />
Reinwasser Umkehrosmose, UV-Behandlung, Mikro- und Ultrafiltration<br />
Reinstwasser<br />
UV-Oxidation: (266 nm Desinfektion und Abtöten von Mikroorganismen,<br />
185 nm Zerstören org. Materials)<br />
Ionenaustauscher: (Entfernen ionischer Inhaltsstoffe)<br />
Adsorberharze: (Aufnahme von organischen Verbindungen)<br />
Ultrafiltration: (Rückhaltung Partikeln)<br />
Permanenter Kreislaufbetrieb, Qualität: TOC < 0,5 µg/l; anorg. Ionen < ng/l;<br />
Koloniebildende Mikroorganismen 0, partikelfrei 0,2 … 0,005 µm
Analysenwerte für verschiedene Regenwässer mg/L<br />
Ion Schottisches Niederländ. Schwarzwald Dortmund<br />
Hochland Küste<br />
Stadtgebiet<br />
(a) (b) (c) (c)<br />
H + 0,058 0,06 0,06 0,07<br />
Na + 1,83 2,6 0,43 0,35<br />
K + 0,18 0,2 0,27 0,21<br />
Ca 2+ 0,47 0,40 0,28 0,69<br />
Mg 2+ 0,22 0,35 0,03 0,15<br />
NH 4+ 0,20 1,1 0,30 1,47<br />
Cl - 2,9 5,0 0,67 1,85<br />
-<br />
NO 3 4,0 3,2 1,12 3,05<br />
2-<br />
SO 4 4,7 5,2 3,20 6,36<br />
-<br />
HCO 3 0,1 - - -
Bestandteile des Bodens<br />
- anorganische, mineralische Verbindungen<br />
- abgestorbene und teilweise zersetztes organisches Material<br />
- Bodenorganismen<br />
- Bodenluft<br />
- Bodenwasser incl. der gelösten anorganischen und organischen<br />
Bestandteile
Bodenbestandteile<br />
Poren<br />
Luft<br />
20 … 30 %<br />
<strong>Wasser</strong><br />
20 … 30 %<br />
Mineralische<br />
Bestandteile<br />
45 %<br />
Organische<br />
Bestandteile<br />
5 %<br />
feste<br />
Bestandteile
Analyse von Gestein und Boden<br />
Gestein:<br />
- Probenahme<br />
Sammlung, Bohrkerne<br />
- Großteil der Gesteinscharakterisierung basiert auf mikroskopischen<br />
Methoden<br />
∗ Indentifizierung der mineralischen Komponenten im polarisierten Licht<br />
∗ kristalline Gesteinskörnchen – Dünnschliff – Betrachtung im Durchlicht<br />
- Chemische Zusammensetzung (quantitative Analyse)<br />
AAS, RFA<br />
gibt Auskunft über Grad der Verwitterung, Entstehung<br />
An- und Abwesenheit von Spurenelementen ist ein Fingerprint für Lagerstätte<br />
- Kristallstrukturanalyse (Röntgenbeugung, Röntgenfeinstrukturanalyse)
Korngrößenbereiche für Bodenpartikel<br />
Bezeichnung<br />
Größenbereich (µm)<br />
Grobsand 2000 - 200<br />
Feinsand 200 - 50<br />
Schluff 50 - 2<br />
Ton < 2
Bodenhorizonte
Zusammensetzung (mg/g) verbreiteter Sedimentgesteine
»<br />
Humus – ein wesentlicher Bestandteil des Bodens<br />
(lat. Boden)<br />
- Gesamtheit der im Böden befindlichen abgestorbenen pflanzlichen und<br />
tierischen (demgemäß organischen) Substanzen<br />
- Besteht aus hochpolymeren Huminstoffen (Huminsäure z.B.)<br />
uneinheitliche makromolekulare Struktur, Biopolymere<br />
- „Ionenaustauschfunktion der Huminsäuren“<br />
- Anteil an Huminstoffen<br />
∗ Ackerböden 1 … 2 %<br />
∗ Schwarzerde 2 ... 7 %<br />
∗ Wiesen ca. 10 %<br />
∗ moorige Böden 10 … 20 %
»<br />
Huminsäuren<br />
-Postmortale Substanzen (Humine, Fulvi- und Huminsäuren)<br />
-Ubiquitäres Auftreten (Aquifer, Oberflächenwässer, Böden)<br />
-Unterschiedliche Strukturen und Funktionalitäten<br />
-Polyelektrolyte<br />
-Komplexierung von Schwermetallen
Ausgezähltes Bodenleben
Summenparameter<br />
● Organoleptische und sensorische Summenparameter<br />
Geruch:<br />
Geruchssinn 10mal empfindlicher als Geschmackssinn, <strong>Wasser</strong> in Flasche umschütteln,<br />
Geruchsprüfung: metallisch, erdig, fischig, aromatisch, grasartig, modrig, faulig, widerlich,<br />
stinkend, auch nach Stoffen differenzierbar: Chlor, Ammoniak, Schwefelwasserstoff, Teer, Stärke<br />
Trinkwasser muss geruchlos sein!<br />
Geschmack:<br />
(wenn Infektions- oder Vergiftungsgefahr besteht hat diese Prüfung zu unterbleiben!)<br />
Prüfung insbesondere von Trink- und Mineralwässern,<br />
Kleine Menge des <strong>Wasser</strong>s wird im Mund bewegt und dann geschluckt,<br />
differenzieren: säuerlich, salzig, süßlich, bitter, metallisch, laugig, fade, moorig, chlorig, seifig,<br />
widerlich<br />
Färbung:<br />
es interessiert vor allem die Färbung der dispergierten Teilchen, z.B. durch Huminstoffe<br />
gelbbraune Färbung (Fulvinsäuren), Sinkstoffe absetzen lassen, auch kolorimetrische Prüfung<br />
möglich, Trinkwasser muss farblos sein.<br />
Trübung:<br />
Betrachtung der Flüssigkeit vor weißem, dann schwarzem Hintergrund, besser Sichtprüfung mit<br />
eingetauchter weißer Porzellanscheibe – sichtbare Eintauchtiefe ist das Maß –<br />
es ist auch photometrische Bestimmung möglich, kontinuierliche Trübungsmessung mittels<br />
Sonde
● Physikalische und physikalisch-chemische<br />
Summenparameter<br />
Temperatur:<br />
Charakteristikum zur Einschätzung der mikrobiellen Aktivität<br />
Dichte:<br />
bei stärker mineralisierten Wässern ist die Dichte wichtig, da diese mit dem Gehalt an gelösten<br />
Stoffen ansteigt<br />
Elektrische Leitfähigkeit:<br />
ist ein Maß für die gelösten Ionen<br />
Redoxspannung (Redoxpotential):<br />
ähnlich der pH-Messung mit Einstabmesskette<br />
Werte unterhalb von -200 mV geben den Hinweis auf anaerobe Verhältnisse, positive Werte<br />
deuten auf aerobe Vorgänge hin<br />
pH-Wert:<br />
pH-Papier, Einstabmesskette
Leitfähigkeit umweltrelevanter Wässer und<br />
<strong>Wasser</strong>typen<br />
Vollentsalzung<br />
Trinkwasser<br />
Abwasser<br />
Oberflächenwasser<br />
Brack- und Meerwasser<br />
konz. Säuren<br />
0,1 1 10 100 1 10 100 1000<br />
µs / cm mS / cm
100<br />
CO 2<br />
-<br />
HCO 3<br />
--<br />
CO 3<br />
%<br />
80<br />
60<br />
40<br />
20<br />
4 5 6 7 8 9 10 11 12 pH<br />
Relativer Anteil der drei Formen des Carbonatsystems in Abhängigkeit vom pH-Wert<br />
Meerwasser<br />
Süßwasser (aus Ott 1988)
Summen- und Gruppenparameter
● Bestimmung chemischer und biochemischer<br />
Summenparameter (Fortsetzung II)<br />
Säurekapazität/Basenkapazität:<br />
Basenkapazität K B / Säurekapazität K S ist das Vermögen von Inhaltsstoffen einer Stoffproportion<br />
<strong>Wasser</strong> bis zum Erreichen eines bestimmten pH-Wertes OH-Ionen / Hydroniumionen<br />
aufzunehmen,<br />
Bestimmung mittels übliche Titration<br />
Sauerstoffbedarf:<br />
1 chemischer Sauerstoffbedarf (CSB):<br />
darunter versteht man die Menge an Sauerstoff, die erforderlich ist, alle organischen Inhaltsstoffe<br />
einer Stoffproportion <strong>Wasser</strong> zu oxidieren,<br />
Angabe als β(O 2 ) in mg/L. CSB-Wert ist höher als biologischer Sauerstoffbedarf, da biologisch<br />
nicht<br />
abbaubare Substanzen mitbestimmt werden.<br />
Mit zwei Oxidationsmitteln wird der CSB-Wert bestimmt:<br />
Kaliumpermanganat, Kaliumdichromat.<br />
CSB Mn :<br />
Überschuss von Permanganat zugeben, Rücktittration mit Oxalsäure (1 g KMnO 4 entspricht 0,405<br />
g O 2 )<br />
2 KMnO 4 + H 2 C 2 O 4 + 3 H 2 SO 4 ↔K 2 SO 4 + 2 MnSO 4 + 10 CO 2 + 8 H 2 O<br />
nicht alles ist dadurch oxidierbar: z.B. einige Chlorwasserstoffe, Ketone, Alkohole, Aminosäuren,<br />
auch oxidiert werden anorganische Komponenten wie Fe-II, Nitrit, Cl-Ionen,<br />
weitgehend werden oxidiert: Kohlenhydrate, Phenole
● Bestimmung chemischer und biochemischer Summenparameter (Fortsetzung III)<br />
1 chemischer Sauerstoffbedarf (CSB): (Fortsetzung)<br />
Es werden nur 20-25 % der organischen Stoffe oxidiert, ein hoher Wert weist aber auf eine hohe<br />
Verschmutzung hin<br />
ß(KMnO 4 ):<br />
humushaltige Moorwässer: 350 mg/L<br />
Trinkwasser:<br />
ab 12 mg/L bedenklich<br />
reine Fließwässer: 6 mg/L<br />
mäßig verunreinigte Flüsse.<br />
11-15-mg/L<br />
stark verunreinigte Flüsse: 30-150 mg/L<br />
CSB Cr :<br />
mit Kaliumdichromat werden bis zu 97 % der organischen Stoffe oxidiert, Benzol, Pyridin werden<br />
nur zum Teil erfasst, anorganische Stoffe werden teilweise oxidiert,<br />
sehr wichtiger Summernparameter zur Bestimmung des Verschmutzungs- bzw. Reinheitsgrades<br />
von Wässern der Kläranlagen<br />
Elektrochemischer Sauerstoffbedarf(ECSB):<br />
elektrochemische Erzeugung des Oxidationsmittels, z.B. Bildung von Hydroxylradikalen an<br />
PbO 2 -Anaode, erforderliche Strommenge um Potential an der Anode konstant zu halten ist ein Maß<br />
für die umgesetzte Stoffmenge
<strong>Wasser</strong>charakterisierung durch gemessene Parameter<br />
Güte- O 2 -Sättigungs- BSB 5 : CSB Mn : CSB Cr : Charakterisierung des<br />
Klasse index (%) β (O 2 ) β (KMnO 4 ) β (O 2 ) <strong>Wasser</strong>s<br />
(mg/L) (mg/L) (mg/L)<br />
1 100 < 2 < 6 < 2 unbelastet<br />
1 bis 2 85 bis 100 2 bis 3 6 bis 11 2 bis 6 gering belastet<br />
2 70 bis 85 3 bis 4 11 bis 15 6 bis 9 mäßig belastet<br />
2 bis 3 50 bis 70 4 bis 7 15 bis 30 9 bis 18 kritisch belastet<br />
3 25 bis 50 7 bis 40 30 bis 150 18 bis 80 stark verschmutzt<br />
3 bis 4 10 bis 25 40 bis 120 150 bis 390 80 bis 200 sehr stark verschmutzt<br />
4 0 bis 10 > 120 > 390 > 200 übermäßig verschmutzt<br />
(nach Koch)
Maximal gelöster Sauerstoff in Gewässern<br />
Sauerstoff (mg/L)<br />
Temperatur (°C)<br />
7,5 30<br />
8,1 25<br />
8,8 20<br />
9,8 15<br />
10,9 10<br />
12,4 5<br />
Gewässer-Güteklasse z.B. I: rein, gering belastet<br />
III: Stark verschmutzt<br />
BSB 5<br />
= 1-2 mg/L; CSB = 1-2 mg/L<br />
BSB 5<br />
= 7-13 mg/L; CSB = 20-65 mg/L
Schema eines AOX-Gerätes
Gruppenparameter<br />
- zur Einschätzung der (meist „organischen“) Belastung von <strong>Wasser</strong>, Boden und Luft<br />
ist es oft wichtig zu wissen ob bestimmte Stoffgruppen vorhanden sind<br />
- Bestimmung der Gruppenparameter ist „Vorprobe“ um Individuenanalytik anzuschließen<br />
Organisch gebundenes Halogen (Halogenkohlenwasserstoffe)<br />
Diese Verbindungen werden meist als Halogen- bzw. Chlorgehalt bestimmt, wobei aufgrund<br />
der Eigenschaften verschiedene Gruppenparameter unterschieden werden können:<br />
TOX = total organic halogenes<br />
DOX = dissolved organic halogenes<br />
POX = purgeable organic halogenes<br />
AOX = adsorbable organic halogenes<br />
EOX = extractable organic halogenes<br />
VOX = volatile organic halogenes<br />
Verschiedene Bestimmungsmethoden sind möglich:<br />
Verbrennung, anfallende Halogene oder Halogenidionen werden gegen Silber coulometrisch titriert,<br />
Gaschromatographie aber eine vorherige Anreicherung, z.B. durch flüssig/flüssig-Extraktion und<br />
HPLC-Fraktionierung notwendig, MS-Detektor
Kohlenwasserstoffbestimmung<br />
TC = gesamter Kohlenstoff<br />
TOC = gesamter organischer Kohlenstoff<br />
TIC = gesamter anorganischer Kohlenstoff<br />
DOC = gelöster organischer Kohlenstoff<br />
- Grundlage aller Verfahren beruht auf der Oxidation des Kohlenstoffes zu CO 2 oder<br />
auch die Reduktion zu Methan, zur CO 2 -Bestimmung kann die IR-Spektrometrie,<br />
nichtwässrige Acidimetrie, Coulumetrie, CO 2 -sensitive Elektroden und GC z.B.<br />
eingesetzt werden<br />
- UV-Strahlung, Zusatz von Peroxidisulfat zur Oxidation (wässrige Proben)<br />
- TIC Wert muss vorher bestimmt werden (Zugabe von Phosphorsäure ) oder der Anteil<br />
wird entfernt<br />
- Hochtemperaturaufschluss für Feststoffe und Suspensionen: homogenisierte Probe wird<br />
in Trägergasstrom eingebracht, Passage eines Katalysators bei hoher Temperatur,<br />
danach verschiedene Arten der Endbestimmung.<br />
Empfindlichkeit beträgt 0,1 mg/L
TOC-Funktionsprinzip
neue Trinkwasserverordnung<br />
Definition Trinkwasser<br />
<strong>Wasser</strong> für den menschlichen Gebrauch:<br />
- Trinkwasser zum Trinken, kochen, zur Zubereitung von Speisen und<br />
Getränken und zu anderen häuslichen Zwecken wie<br />
- Körperpflege und –reinigung<br />
- Reinigung von Gegenständen, die bestimmungsgemäß mit<br />
Lebensmitteln in Berührung kommen<br />
- Reinigung von Gegenständen, die bestimmungsgemäß nicht nur<br />
vorübergehend mit dem menschlichen Körper in Kontakt kommen<br />
Nutzung von Regenwasseranlagen (Bedenken):<br />
- Kontamination des Trinkwassers bei nicht DIN-gerechtem Einbau<br />
- Kontamination der Wäsche mit Bakterien etc. (z.B. durch den Spülvorgang)<br />
Parameter alter Grenzwert (mg/l) neuer Grenzwert (mg/l)<br />
Nickel 0,05 0,02<br />
Antimon 0,01 0,005<br />
Blei 0,04 0,025 (ab 12/2003), 0,010 (ab 12/2013)<br />
Trihalogen- 0,025 0,050<br />
methane
Fette<br />
Die Bestimmungsmethode beruht auf der Extraktion der Öle und Fette durch<br />
Trichlortrifluorethan in einer Soxhletapparatur und der Auswaage der<br />
trockenen<br />
extrahierten Öle und Fette nach Abdampfen des Lösungsmittels bei 80 °C,<br />
diese Methode ist nicht sehr spezifisch, da andere Stoffe störend wirken<br />
Beispiele Fettsäuren:<br />
C 15 H 31 – COOH Hexadecansäure (Palmitinsäure), gesättigte FS<br />
C 17 H 35 – COOH Octadecansäure (Stearinsäure), gesättigte FS<br />
C 17 H 33 – COOH 9-Octadecansäure (Ölsäure), ungesättigte FS
Analyse von Blei, Fluorid und Eisen<br />
Bestimmung von Blei<br />
100 l Luft werden durch ein Papierfilter gesaugt. Filter samt Staub werden mit 2 ml verd. Salpetersäure<br />
(5 ml konz. Salpetersäure auf 100 ml verdünnt) 5 min bei Zimmertemperatur oder unter sehr gelindem<br />
Erwärmen behandelt. Man dekantiert, wäscht das Filter und versetzt 100 ml der <strong>Wasser</strong>probe mit 30 ml<br />
ammoniakalischer Sulfit-Cyanidllösung (350 ml konz. Ammoniumhydroxid-Lösung, 3 g Kaliumcyanid und<br />
10 g Natriumsulfid zu 1 L gelöst) und 10 ml Dithizon-Lösung. Man schüttelt 30 sec. lang kräftig und filtriert<br />
die organische Phase über etwas Watte direkt in eine 10 mm-Küvette.<br />
Die Messung des roten Komplexes erfolgt bei 515 nm. Für die Erstellung der Eichkurve werden Standardproben<br />
mit Gehalten zwischen 5 und 30 µg in gleicher Weise behandelt, wodurch man ein Eichgerade<br />
für 0,5 - 3 mg l -1 erhält.<br />
N N C NH NH<br />
Bestimmung von Fluorid<br />
S<br />
Die wie oben gesammelte Probe wird in einem Plastikbecher mit 2 ml 0,1 molare Natriumhydroxid-Lösung<br />
behandelt. Nach Zusatz der beschriebenen Pufferlösung wird der Fluoridgehalt mit einer ionenspezifischen<br />
Elektrode bestimmt. MAK-Wert 2,5 mg m -3 .<br />
Bestimmung von Eisen<br />
Die wie oben gesammelte Probe wird mit 5 ml konz. Salpetersäure zur Zerstörung des Filters zum Trocknen<br />
eingedampft, eventuell unter neuerlicher Zugabe von Salpetersäure. Der Trockenrückstand wird in 5 ml<br />
konz. Salzsäure aufgenommen und auf 25 ml aufgefüllt. 5 ml dieser Lösung werden mit 5 ml Kaliumthiocyanat-<br />
Lösung (W=20%) versetzt und auf 25 ml aufgefüllt. Man misst die Farbintensität bei 475 nm und vergleicht<br />
mit einer Eichreihe aus in derselben Weise behandelten Proben mit einem Eisengehalt von 10-50 µg.
Einzelnachweis mit Dithizon<br />
Ø -N = N - C - NH - NH - Ø<br />
=<br />
S<br />
Metallion<br />
pH-Wert Farbe org. Phase<br />
Ag 4 goldgelb<br />
Hg < 0 orangegelb<br />
Hg > 7 violettrot<br />
Pd 4 fahlgrün<br />
Au(III) 4 goldgelb<br />
Cu 4 rotviolett<br />
Cu 9 gelbbraun<br />
Bi(III) 4-10 rotorange<br />
Sn 5-9 rot<br />
Zn 4,5-5 purpurrot<br />
Cd 13 rosarot<br />
Co 5-9 rotviolett<br />
Pb 8-11 karminrot<br />
Tl > 14 himbeerrot
Bestimmung von Schwefelwasserstoff<br />
Man pumpt 100 - 500 l Luft mit einer Geschwindigkeit von 10 - 15 l·min -1 durch eine mit 100 ml Absorptionslösung gefüllte Glasfrittenwaschflasche.<br />
Als Absorptionsmedium wird vorzugsweise eine Suspension von Cadmiumhydroxid verwendet, die folgendermaßen hergestellt wird:<br />
50 ml einer 1 %igen (Massengehalt) Lösung von Tricadmiumsulfat-octahydrat (3 CdSO 4 · 8 H 2<br />
0) werden in der Waschflasche mit 50 ml 0,1 molarer<br />
Natriumhydroxidlösung versetzt, wobei die Lösung nahezu neutral bleibt. Eine etwas beständigere Lösung wäre eine Zn(CH 3<br />
COO) 2<br />
-Lösung mit<br />
w = 0,25 %.<br />
Um sicherzustellen, dass keine Sulfidpartikel durch Adsorption an der Glasoberfläche verloren gehen, gibt man die Reagenzien für die Farbreaktion<br />
unmittelbar nach Beendigung des Pumpens zu der Suspension in der Waschflasche, Üblicherweise verwendet man die Methylenblau-Reaktion, die<br />
schnell und einfach durchzuführen und ebenso empfindlich wie selektiv ist. Als Nachteil ist jedoch der Umstand zu verzeichnen, dass sowohl das<br />
Reagenz, als auch das Reaktionsprodukt nicht stabil sind. Durch Verwendung der Methylenblau-Reaktion kann dieser Nachteil vermieden werden.<br />
Die Reaktion besteht in der oxidativen Kupplung zweier aromatischer Ringe.<br />
(H3C)2N<br />
H2S<br />
N(CH3)2 (H3C)2N<br />
S<br />
N(CH3)2<br />
H 3<br />
NH2<br />
H2N<br />
Fe 3+<br />
N<br />
Methylenblau<br />
Das mit Perchlorat gebildete lonenpaar lässt sich mit Chloroform sehr gut extrahieren, wodurch man die Empfindlichkeit steigern und Störungen durch<br />
andere gefärbte Verbindungen ausschalten kann, wie dies bei der Analyse von <strong>Wasser</strong>proben der Sedimenten der Fall sein kann.<br />
Arbeitsvorschrift: Man fügt zu den in der Waschflasche befindlichen 100 ml Absorptionsmittel 2 ml 1 molares Natriumperchlorat, 1 ml Lösung von<br />
N.N-Diethyl-p-phenylendiamin (w = 2 %) in 50 %iger Schwefelsäure und 1 ml filtrierter 10 %iger Eisen(III)Ammoniumsulfat in 1 molarer<br />
Schwefelsäure.<br />
Nach 10 min bringt man die Lösung in einen Scheidetrichter und extrahiert mit 2mal 10 ml Chloroform. Die Extrakte werden in einem Messkolben auf<br />
25 ml aufgefüllt. Man bestimmt die Absorption in 10- oder 40-mm-KÜvetten bei 670 nm. Zur Eichung verwendet man eine Standardlösung von<br />
Natriumsulfid-Kristallen, die man mit Alkohol wäscht und auf Filterpapier trocknet. Die Natriumsulfid-Lösung muss iodometrisch kontrolliert werden, da<br />
weder die Kristalle noch die Lösung stabil sind. Die Eichung selbst erfolgt für den Bereich 1-10 µg Sulfid-Ion.
Bestimmung von Kohlendioxid<br />
Eine sehr alte Methode beruht auf der Absorption in einer Lösung von Bariumhydroxid, wobei Bariumcarbonat<br />
ausfällt.<br />
Das überschüssige Bariumhydroxid wird durch Rücktitration erfasst. Erstaunlicherweise ist aber die Reaktion<br />
zwischen<br />
dem in Lösung gehenden CO 2 und der stark alkalischen Bariumhydroxid-Lösung mit pH 12 sehr langsam. Man<br />
muss daher, wenn man eine Frittenwaschflasche als Absorptionsgefäß verwendet, die<br />
Strömungsgeschwindigkeit sehr niedrig halten, um Verluste zu vermeiden.<br />
Zusatz von etwas 1-Propanol führt zu leichter Schaumbildung und erhöht dadurch die Kontaktzeit. Zwei<br />
Methoden<br />
stehen zur Wahl:<br />
Methode1l – Pumpmethode:<br />
Man pipettiert 50 ml einer 0,01 molaren Bariumhydroxid-Lösung in einer Frittenwaschflasche, setzt einige<br />
Tropfen<br />
1-Propanol zu und pumpt 10 l Luft mit einer Geschwindigkeit von 1 l·min -1 durch. Man setzt einige Tropfen<br />
Phenolphthalein-Lösung zu und titriert mit 0,01 molarer HC1 bis die Rosafärbung verschwindet. Es ist darauf zu<br />
achten, dass der Endpunkt nicht durch Aufnahme von CO 2 verschleppt wird (Abdecken mit Watte oder<br />
Überleiten von Stickstoff).<br />
Methode 2 - Flaschenmethode nach Wagner :<br />
Man verwendet am besten einen 2,5-l-Erlenmeyerkolben, der mit einem doppelt durchbohrten Gummistopfen<br />
verschlossen ist. Man füllt den Kolben luftblasenfrei mit <strong>Wasser</strong> und entleert ihn, wodurch ein bekanntes<br />
Volumen Luft im Kolben vorgegeben ist. Durch eine der beiden Bohrungen pipettiert man 15 ml 0,01 molarer<br />
Bariumhydroxid-Lösung ein, fügt einige Tropfen 1-Propanol zu und schüttelt 10 min. Nach Zusatz von einigen<br />
Tropfen Phenolphthalein-Lösung titriert man bis zur Entfärbung, wobei man die Bürette durch eine der beiden<br />
Bohrungen in den Kolben einführt. Zur Bestimmung des Titers titriert man dieselbe Menge Bariurohydroxid-<br />
Lösung in einen mit Stickstoff gefüllten Kolben.
Gaschromatographische Bestimmung<br />
Bestimmung von Sauerstoffe Stickstoff und Kohlenmonoxid<br />
Man verwendet eine 1-ml-Probenschleife, Zwillings-Kolonnen mit 5-A-Molekularsieb bei 40 °C und<br />
Helium unter 1,7 bar Druck; Leitfähigkeitsdetektor (TCD). Als Standard verwendet man Luft (21 %<br />
O 2<br />
+ Ar; 79 % N 2<br />
). Falls kein reines Kohlenmonoxid zur Eichung zur Verfügung steht, kann für CO<br />
derselbe Faktor wie für N 2<br />
verwendet werden. Der dadurch entstehende Fehler ist gering.<br />
Auswertung durch Flächenmessung.<br />
Bestimmung der aromatischen Kohlenwasserstoffe<br />
Probeschleife1l ml; Carbowax 1540-Kolonne bei 90 °C, Stickstoff als Trägergas unter 0,7 bar<br />
Druck, Flammenionisationsdetektor (PID). Die Messung der Peakhöhen ist ausreichend genau.<br />
Als Standards werden 10 µl Portionen von Lösungen der einzelnen Verbindungen in<br />
Schwefelkohlenstoff injiziert. Man notiert die Retentionszeit jeder einzelnen Komponente zur<br />
Identifizierung sowie die Peakhöhe zur quantitativen Auswertung.<br />
Bestimmung von Luftverunreinigungen<br />
Die Verunreinigungen werden in einem Aktivkohle-Probensammelrohr aufgefangen. Das<br />
Adsorptionsrohr wird mit frischer, mit Schwefelkohlenstoff gereinigter Aktivkohle gefüllt und durch<br />
Erhitzen im Stickstoffstrom auf 600 °C aktiviert und mit Gummistopfen verschlossen. Am<br />
Entnahmeort pumpt man 10 l Luft mit einer Geschwindigkeit von 1-2 l•min -1 durch das<br />
Adsorptionsrohr. Es kann behelfsmäßig so erfolgen, dass man zwei mit <strong>Wasser</strong> gefüllte 5 l<br />
Flaschen als Saugpumpe verwendet, indem man Luft durch Auslaufenlassen des <strong>Wasser</strong>s<br />
ansaugt. Man verschließt das Adsorptionsrohr sorgfältig. Im Labor wird die Aktivkohle mit 10 ml<br />
analysenreinem Schwefelkohlenstoff ausgewaschen, wobei man den Extrakt direkt in einen 10 ml<br />
Messkolben spült. Nach dem Auffüllen zur Marke mischt man gründlich und injiziert 5 µl in die<br />
Kolonne. Die quantitative Auswertung erfolgt durch Vergleich mit Standardlösungen
Bestimmung von Schwefeldioxid<br />
Zur Bestimmung von Schwefeldioxid eignet sich besonders die bekannte "Pararosanilin-Methode" nach<br />
West und Gaeke. Sie beruht auf der Bildung des Aminomethansulfonsäure-Derivats eines<br />
Triphenylmethan-Farbstoffes. Das eigentliche Reagenz verbleibt im protonierten Zustand farblos,<br />
wahrend die zugehörige, nicht protonierte Schiffsche Base als Salz einer starken Säure intensiv gefärbt<br />
ist. Die Reaktion, die auf einer Kupplung in Gegenwart von Formaldehyd beruht, ist für Schwefeldioxid<br />
spezifisch.<br />
Arbeitsvorschrift:<br />
Man pumpt 30 - 60 l Luft mit einer Geschwindigkeit von 1-2 l·min -1 durch einen mit 10 ml beschickten<br />
Impinger.<br />
Absorptionslösung:<br />
13,6 g Quecksilber(II)chlorid und 7,5 g Kaliumchlorid gelöst in 1 l H 2<br />
O. Anschließend setzt man 1 ml<br />
verdünnte Pararosanilin-Lösung (4 ml 1%ige Lösung des Reagenz werden mit 6 ml konz. Salzsaure<br />
angesäuert und mit <strong>Wasser</strong> zu 100 ml aufgefüllt) und 1 ml Formaldehydiösung (w = 0,2 %) zu.<br />
Man misst die Absorption bei 560 nm nach 20 - 30 min. Als Standardlösung dient eine iodometrisch<br />
kontrollierte Natriumsulfit-Lösung
Gaschromatographische Analyse von Butan-Gas
Bestimmung nitroser Gase<br />
Absorptionslösung:<br />
Eine Lösung von 5 g wasserfreier Sulfanilsäure in 800 ml <strong>Wasser</strong> und 140 ml Eisessig (eventuell gelinde<br />
erwärmen). Nach dem Erkalten fügt man 20 ml einer Lösung von N-(α-Naphtyl)-ethylendiamindihydrochlorid<br />
(w =0,1 %) in <strong>Wasser</strong> zu und verdünnt auf 1 l. Diese Lösung ist im Kühlschrank mehrere<br />
Monate haltbar.<br />
Arbeitsvorschrift:<br />
Man pumpt 1,0 l Luft (oder so viel wie nötig ist, um eine Färbung zu erzielen) mit einer Geschwindigkeit<br />
von 0,05 l·min -1 durch eine mit 10 ml Absorptionslösung beschickte Waschflasche. Die niedrige<br />
Durchflussgeschwindigkeit ist notwendig, um vollständige Oxidation von NO über dem Oxidationsmittel zu<br />
erreichen, das in Form eines sehr feinen Granulats vorliegt. Falls nur N0 2<br />
bestimmt werden soll, kann die<br />
Strömungsgeschwindigkeit 0,4 l·min -1 betragen. Man wartet 15 min und bestimmt die Absorption bei 550<br />
nm. Ein ml einer Lösung von 20,3 mg·l -1 Natriumnitrit entspricht 10 µl NO oder N0 2<br />
und gibt eine bereits<br />
gut messbare Absorption.<br />
HO 3<br />
S NH 2<br />
+ NO 2<br />
-<br />
+ 2 H +<br />
HO 3<br />
S N + ≡ N + 2 H 2<br />
O<br />
HO 3<br />
S N + ≡ N + NH 2<br />
HO 3<br />
S N = N NH 2<br />
+ H +
Infrarot-Absorptionsspektren von Gasen<br />
cm -1 3000 2000 1400 1000 600<br />
Propan<br />
Kohlenmonoxid<br />
Kohlendioxid<br />
Schwefeldioxid<br />
cm -1 3000 2000 1400 1000 600<br />
Freon 22
Analytik der <strong>Wasser</strong>-Hauptinhaltsstoffe<br />
- Fortsetzung 2<br />
- Bestimmung:<br />
nach „Deutsche Einheitsverfahren zur <strong>Wasser</strong>-, Abwasser- und Schlammuntersuchung“<br />
ausgewählte Anionen:<br />
∗ Bestimmung von Chloridionen (DEV-D4)<br />
Maßanalytisch nach Mohr<br />
Potentiometrische Bestimmung<br />
Coulometrische Bestimmung<br />
∗ Bestimmung von Sulfationen (DEV-D5)<br />
Komplexometrische Titration nach Kationenaustausch<br />
Gravimetrische Bestimmung<br />
organische Einzelkomponenten:<br />
∗ gaschromatographische Dampfraumanalyse<br />
(<strong>Wasser</strong>probe verschlossen auf 80 °C erwärmen, Verteilungsgleichgewicht<br />
einstellen lassen, Probe aus Gasphase in Gaschromatographen injizieren,<br />
FID-Detektor)
Carbonat-Spezies in Regenwasser
Beziehung zwischen dem Mobilitätsstatus von<br />
Schwermetallen und gebräuchlichen Extraktionslösungen<br />
langfristig verfügbar<br />
Gesamtgehalte<br />
mittelfristig verfügbar<br />
kurzfristig verfügbar<br />
Bodensättigungsextrakt<br />
NH 4 NO 3<br />
MgCl 2<br />
CaCl 2<br />
EDTA<br />
DTPA<br />
NH 4 OAc<br />
Königswasser<br />
HCl<br />
HNO 3<br />
(hochmolar)<br />
Totalaufschluss
Analyse im Boden frei verfügbarer Elemente<br />
- wichtig zur Einschätzung der Bioverfügbarkeit (Pflanzenwachstum)<br />
- Methode der sequentiellen Extraktion:<br />
(Auslaugbarkeit des interessierenden Elements von Böden und Gesteinen in<br />
Abhängigkeit verschiedener Extraktionsmittel, Methode muss an die Chemie des<br />
Bodens und des Elements angepasst sein)<br />
∗ <strong>Wasser</strong><br />
∗ KCl (verfügbarer Stickstoff)<br />
∗ verdünnte Essigsäure/Acetatlösung<br />
∗ verdünnte Salzlösung<br />
∗ EDTA-Lösung<br />
- Beispiel: Ra-Verteilung: 1. 1 M Ammoniumacetat<br />
2. 1 M Natriumacetat<br />
3. 0,1 M NH 3 OHCl<br />
4. H 2 O 2<br />
5. 0,25 M EDTA<br />
6. HNO 3 Druckaufschluss (zur Bilanzierung)
Schema zur Pestizid-Analytik in Umweltproben
Weit unter Richtwert
Die beim Menschen endende Nahrungskette<br />
Mensch<br />
Chemikalien<br />
Ackerland<br />
Nahrungsmittel<br />
<strong>Wasser</strong><br />
Tiere<br />
Fische<br />
Mikroorganismen<br />
Feldfrüchte
Nahrungsmittel<br />
Gründe für die Notwendigkeit der Überwachung und Analyse:<br />
- Lebens- und Genussmittel können durch Zusatz anderer Substanzen<br />
absichtlich verfälscht werden (Vortäuschung besserer Qualität z.B.)<br />
- Eintrag unerwünschter oder schädlicher Stoffe über „Nahrungskette“ in<br />
Nahrungsmittel<br />
- Mindestanforderungen im Lebensmittelgesetz festgelegt<br />
∗ Lebensmittelkennzeichnungsverordnung (1935)<br />
∗ Lebensmittelgesetz (1936)<br />
∗ Novelle zum Lebensmittelgesetz (1958)<br />
(weitgehendes Verbot von Konservierungsmitteln, Künstlichen Farbstoffen,<br />
fremden Zusatzstoffen)<br />
- Unbedenklichkeit muss strengstens überprüft werden, Verwendung muss<br />
anerkannt werden!
Beimengen zu Lebensmitteln<br />
„zulässige“ Additive<br />
Konservierungsmittel<br />
Antioxidantien<br />
zugelassene Farbstoffe<br />
Emulgations- und<br />
Stabilisierungshilfsmittel<br />
Vitamine<br />
Gewürze<br />
„unzulässige“ Verunreinigungen<br />
Lösungsmittel<br />
Verpackungshilfsstoffe<br />
Pestizide<br />
Hormone<br />
Toxine (durch Verarbeitung nicht entfernbar)<br />
Schwermetalle<br />
- zugelassene Konservierungsmittel:<br />
∗ Sorbinsäure und ihre Na, K-Salze<br />
∗ Benzoesäure und Na-Salze<br />
∗ p-Hydroxybenzoesäure-ethyl(propyl)ester<br />
- Fleisch, Milch, Brot darf keine Konservierungsmittel enthalten!
Formeln<br />
Konservierungsmittel:<br />
COOH<br />
COOC2H5<br />
Benzoesäure<br />
p-Hydroxybenzoesäureäthylester<br />
Antioxidanten:<br />
Butylhydroxyanisol (BHA)<br />
OH<br />
Butylhydroxytoluol (BHT)<br />
OH<br />
C4H9<br />
OH<br />
C4H9<br />
C4H9<br />
Pestizide:<br />
(DDT)<br />
OCH3<br />
Cl CH Cl<br />
CCl3<br />
Dieldrin<br />
Cl<br />
Cl<br />
Cl<br />
CCl2<br />
Cl<br />
O<br />
CH3<br />
Vitamine:<br />
Vitamin C (Ascorbinsäure)<br />
O<br />
HO<br />
O<br />
CH(OH)CH2OH<br />
OH
Bestimmung von Antioxidanten<br />
- Chemikalien werden Lebensmitteln zugesetzt, die natürliche Fette und<br />
Öle enthalten, vor allem vorgekochten Speisen, um Zersetzung bei<br />
Verarbeitung zu verhindern<br />
- Beispiele: Buthylhydrosyanisol (BHA), Buthylhydroxytoluol<br />
- zulässige Gehalte (z.B. BHA): 200 µg/g essbare Fette, 179 µg/g Butter<br />
- Methode:<br />
<strong>Wasser</strong>dampfdestillation, Fluorimetrische Bestimmung im Destillat,<br />
Anregung bei 293 nm, Emission 323 nm, Verwendung von Standards,<br />
Kalibrierkurve
Anwendung titrimetrischer Verfahren in der Lebensmittelund<br />
Umweltchemie<br />
- <strong>Wasser</strong>bestimmung nach Karl-Fischer-Titration<br />
- Säurezahl von Fetten und Ölen<br />
- Oxidierbarkeit von Trinkwasser mit Permanganat<br />
- Ascorbinsäurebestimmung mit Iodlösung<br />
- SO 2 -Bestimmung im Wein<br />
- Sulfatbestimmung mit ionenselektiver Elektrode<br />
- <strong>Wasser</strong>härte, komplexometrisch<br />
- Säure-Basen-Kapazität von <strong>Wasser</strong> u.a.<br />
- Kochsalzbestimmung in Aschen<br />
- Kjiedahl-Bestimmung (N, Proteine)<br />
Vorteile:<br />
Nachteile:<br />
- einfache Handhabung - Chemikalienverbrauch<br />
- schnelle Durchführung - geringe Spezifität (z.B. bei Redoxtitrationen)
Bestimmung von Konservierungsmitteln in Citrusschalen<br />
(Apparatur)
Nachweis gentechnisch veränderter Organismen<br />
- Forderung nach Kennzeichnungspflicht<br />
- gentechnische Veränderungen beeinflussen die biochemischen, biologischen,<br />
physikalischen und chemischen Eigenschaften des Produktes<br />
- die durch die gentechnische Veränderung des Erbmaterials hervorgerufene<br />
Merkmalsänderung wird nachgewiesen<br />
(Veränderung der Fettsäurezusammensetzung ☞ Methodiken der Fettsäureanalytik)<br />
- Kontrollanalytiken der Lebensmittelüberwachung konzentrieren sich auf den<br />
Nachweis der gentechnisch veränderten DNA<br />
(z.B. Nachweis einer gentechnischen Veränderung von Sojabohnen durch Amplifizierung der<br />
veränderten DNA-Sequenz mit Hilfe der PCR [Polymerase-Ketten-Reaktion] und Hybridisierung des<br />
PCR-Produktes mit einer DNA-Sonde)
Zusammensetzung des menschlichen Körpers<br />
(Standardmensch)
Durchschnittliche elementare Zusammensetzung des<br />
menschlichen Körpers (70 kg)<br />
(nach Merian und Elmadfa, Leitzmann)<br />
Element Elementsymbol Masse Entdeckung als essentielles<br />
Element<br />
Sauerstoff O 45,5 kg<br />
Kohlenstoff C 12,6 kg<br />
<strong>Wasser</strong>stoff H 7,0 kg<br />
Stickstoff N 2,1 kg<br />
Calcium Ca 1,05 kg<br />
Phosphor P 700 g<br />
Schwefel S 175 g<br />
Kalium K 140 g<br />
Chlor Cl 105 g<br />
Natrium Na 105 g<br />
Magnesium Mg 35 g<br />
Eisen Fe 4,2 g 17. Jh.<br />
Zink Zn 2,3 g 1896<br />
Silicium Si 1,4 g 1972<br />
Rubidium a Rb 1,1 g<br />
Fluor F 0,8 g 1972<br />
Zirconium a Zr 0,3 g<br />
Brom b Br 0,2 g<br />
Strontium a Sr 0,14 g<br />
Kupfer Cu 0,11 g 1925
Durchschnittliche elementare Zusammensetzung des<br />
menschlichen Körpers (70 kg)<br />
(nach Merian und Elmadfa, Leitzmann)<br />
Element Elementsymbol Masse Entdeckung als essentielles<br />
Element<br />
Aluminium a Al 0,10 g<br />
Blei b Pb 0,08 g 1977<br />
Antimon a Sb 0,07 g<br />
Cadmium b Cd 0,03 g 1977<br />
Zinn Sn 0,03 g 1970<br />
Iod I 0,03 g 1820<br />
Mangan Mn 0,02 g 1931<br />
Vanadium V 0,02 g 1971<br />
Selen Se 0,02 g 1957<br />
Barium a Ba 0,02 g<br />
Arsen b As 0,01 g 1975<br />
Bor B 0,01 g<br />
Nickel Ni 0,01 g 1971<br />
Chrom Cr 0,005 g 1959<br />
Cobalt Co 0,003 g 1935<br />
Molybdän Mo < 0,005 g 1953<br />
Lithium b,c Li 0,002 g<br />
a<br />
Nicht als essentiell bewertet. b Essentieller Charakter nicht eindeutig.<br />
c<br />
Nach Pfannhauser
Doping unter dem Gesichtspunkt des Leistungssports<br />
- Einnahme verbotener chemischer Substanzen zur Steigerung der<br />
Leistungsfähigkeit<br />
- „Verbot“ entsprechender Substanzen und Methoden ab 1968 durch IOC<br />
- Einleitung des Wettlaufes zwischen Dopingsündern und findigen<br />
Analytikern
Verbotene Wirkstoffgruppen<br />
(lt. Medizinischer Kommission des IOC)<br />
Stimulantien:<br />
Narkotika:<br />
Anabole Wirkstoffe:<br />
Diuretika:<br />
Peptidhormone:<br />
Verbotene Methoden:<br />
Amphetamin, Cocain, Coffein, Ephidrin, Methamphetamin,<br />
Strychnin<br />
Diamorphin (Heroin), Methadon, Morphin<br />
Methandienon, Methyltestosteron, Testosteron, Stanozolol<br />
(β 2 -Argonisten z.B. Clenbuterol)<br />
Bumetanid, Furosemid<br />
Choriongonadotropin, Wachstumshormon<br />
Blutdoping, pharmakologische, chemische und<br />
physikalische Manipulation<br />
Wirkstoffe mit Einschränkungen zugelassen: Alkohol, Marihuana, Corticosteroide,<br />
Beta-Blocker
Dopinganalytik<br />
- Urinprobe (in A und B Probe unterteilt) möglich wären noch Speichel, Blut,<br />
Haare (Blut in Diskussion zur Peptidhormonanalyse)<br />
- Stimulantien/Narkotika: Kontrolle nach Wettkampf, Analytik leicht möglich<br />
- Anabole Wirkstoffe: 2/3 der Dopingfälle zurückgeführt auf diese Gruppe,<br />
auch verboten Testosteron, das der Körper selbst<br />
produziert (Analyse des ausgeschiedenen T. relativ zu<br />
seinen Isomeren)<br />
Analytik mit hochauflösender Massenspektrometrie<br />
- Diuretika: durch <strong>Wasser</strong>ausscheidung Körpergewicht senken<br />
- Peptidhormone: derzeit größte Schwierigkeit bei Analytik,<br />
HCG-Nachweis beim Mann möglich (fördert Bildung von<br />
Testosteron)<br />
Bestimmung von Grenzüberschreitungen!<br />
Coffein: 12 µg/ml, Ephidrin 5 µg/ml; Morphin 1 µg/ml
Dopinganalytik (cont.)<br />
Probenvorbereitung:<br />
Isolierung:<br />
Flüssig-Flüssig-Extraktion, Trennung am Adsorberharz, Stimulantien unter alkalischen<br />
Bedingungen aus Urin mit Ether abtrennen, Aliquot der organischen Phase direkt gaschromatographisch<br />
bestimmen,<br />
oft Anschließen eines substanzspezifischen Reinigungsschrittes -HPLC-, danach nach<br />
Elution von der Säule GC/HRMS<br />
oft Derivatisierung (Überführung z.B. von Testosteron mit z.B. Trimethylsilyether zu<br />
Entspr. Ether) danach GC/MS<br />
Analytische Messung:<br />
GC/MS-Kopplung<br />
GC:<br />
Trennsäulen: Quarzkapillarsäulen mit quervernetzten Methylsilicon-Phasen, Filmdicke<br />
0,11µm<br />
Verwendung stickstoff-phosphor-sensitiver Detektoren<br />
MS:<br />
Hochauflösende MS, Nachweis im Urin anaboler Wirkstoffe 0,2-2 ng/mL
Massenspektren von 19-Norandrosteron<br />
Ionisation: El mit 70 eV; Einlass: GC)<br />
a) frei (B+ = 276)<br />
b) als TMS-Ether (B + = 333)<br />
c) als Bis-TMS-Derivat (B + = 405<br />
B + = m/z des Basispeaks
Formeln einiger häufig missbrauchter anaboler Steroide<br />
Metandienon<br />
19-Nortestosteron<br />
Stanozolol<br />
Testosteron<br />
(körpereigenes Sexualhormon)