Kapitel 6 (pdf) - Institut für Technische Verbrennung
Kapitel 6 (pdf) - Institut für Technische Verbrennung
Kapitel 6 (pdf) - Institut für Technische Verbrennung
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Thermodynamik II<br />
<strong>für</strong> den Studiengang<br />
Computational Engineering Science<br />
B. Binninger<br />
<strong>Institut</strong> <strong>für</strong> <strong>Technische</strong> <strong>Verbrennung</strong><br />
Templergraben 64
6. Beziehungen zwischen Zustandsgrößen<br />
6.1 Thermische Zustandsgleichungen<br />
6.2 Allgemeine Beziehungen zwischen Zustandsgrößen<br />
6.3 Der Joule-Thomson-Effekt<br />
7. Chemische Stoffumwandlungen<br />
7.1 Massenbilanz<br />
7.2 Energiebilanz bei chemischen Zustandsänderungen<br />
Inhalt von Thermodynamik II<br />
0.4
8. Stoffumwandlungen als Gleichgewichtsprozesse<br />
8.1 Mechanisches und thermisches Gleichgewicht<br />
8.2 Stoffliches Gleichgewicht<br />
8.3 Das Chemische Potential<br />
8.4 Ausgleichsprozesse in geschlossenen Systemen<br />
8.5 Gleichgewicht als Minimum der Freien Energie bzw. der Freien<br />
Enthalpie<br />
8.6 Phasengleichgewichte<br />
8.7 Das Reaktionsgleichgewicht<br />
Inhalt von Thermodynamik II<br />
0.4
9. Eindimensionale Gasdynamik<br />
9.1 Stationäre kompressible Strömungen in Rohren oder Kanälen mit nicht<br />
konstantem Querschnitt<br />
9.2 Stationäre kompressible Strömungen in Rohren oder Kanälen mit<br />
konstantem Querschnitt<br />
10. Thermodynamik der Wärmestrahlung<br />
10.1 Grundlegendes<br />
10.2 Reflexion, Absorption und Transmission<br />
10.3 Die spektrale Energieverteilung der schwarzen Strahlung<br />
10.4 Die spektrale Energieverteilung realer Körper<br />
10.5 Strahldichte<br />
10.6 Energiedichte der Strahlung<br />
10.7 Entropie der Strahlung eines schwarzen Körpers<br />
Inhalt von Thermodynamik II<br />
0.6
6. Beziehungen zwischen Zustandsgrößen<br />
6.1 Thermische Zustandsgleichungen<br />
Allgemeine Formulierung der thermischen Zustandsgleichung:<br />
Wir wollen hier nochmals Überlegungen aus Thermodynamik I aufgreifen und<br />
am Beispiel der van-der-Waalsschen Zustandsgleichung demonstrieren, wie der<br />
1. und 2. Hauptsatz weitergehende Aussagen über das Zweiphasengebiet<br />
erlauben.<br />
Zunächst eine kurze Wiederholung:<br />
6.1-1
Die Grafik zeigt die experimentell ermittelte Zustandsgleichung eines realen<br />
Gases.<br />
Alle Zustandsvariablen sind auf Größen im kritischen Zustand K bezogen.<br />
Im kritischen Punkt K gilt:<br />
6.1-2
Theoretische Beschreibung des Realgasverhaltens<br />
Ausgangspunkt:<br />
Zustandsgleichung <strong>für</strong> ein ideales Gas:<br />
1. Virialzustandsgleichung mit Realgasfaktor Z ≠ 1:<br />
Entwicklung:<br />
Die Koeffizienten B, C müssen so bestimmt werden, dass spezielle Bedingungen<br />
erfüllt sind wie zum Beispiel<br />
6.1-3
2. Van-der-Waals-Gleichung (1873) (vergl. Thermodznamik I)<br />
Korrektur <strong>für</strong> endliches Volumen der Atome:<br />
Die Größe b wird Kovolumen genannt.<br />
Korrektur <strong>für</strong> Anziehungskräfte zwischen den Atomen,<br />
hervorgerufen durch unsymmetrische Ladungsverteilungen<br />
in der Elektronenhülle:<br />
Johannes Diderik<br />
van der Walls, 1837-1923,<br />
Physiknobelpreis 1910<br />
Die Größe a heißt Binnen- oder Kohäsionsdruck (Van-der-Waals-Bindung).<br />
Zustandsgleichung<br />
oder<br />
Anwendung in der belebten Natur:<br />
Geckos benutzen die van-der-Waalsschen Anziehungskräfte, um sich an glatten Wänden zu halten.<br />
6.1-4
Beispiel <strong>für</strong> eine Anwendung der Van-der-Waals-Kräfte in der Natur:<br />
Geckos benutzen die Van-der-Waals-Kräfte, um sich an glatten Wänden zum Beispiel<br />
an Glas zu halten.<br />
Dazu sind ihre Füße mit feinsten Härchen besetzt,<br />
die eine große Kontaktfläche ermöglichen, sich<br />
kleinsten Unebenheiten des Untergrundes anpassen<br />
und so eine sehr große Kontaktfläche ermöglichen .<br />
Trotzdem bleibt kein Staub an den Füßen haften, der die<br />
Behaarung wirkungslos machen würde. Geckos putzen<br />
ihre Füße nicht! Der Mechanismus, der dies verhindert,<br />
wurde erst kürzlich geklärt:<br />
"Proceedings of the National Academy of Sciences" (Bd.<br />
102, 2005, S. 385)<br />
Gecko
Die freien Parameter der Van-der-Waals-Gleichung werden aus den<br />
Bedingungen am kritischen Zustand ermittelt. Aus den Bedingungen<br />
folgt:<br />
Damit ist die Van-der-Waals-Gleichung <strong>für</strong> jedes reale Gas angebbar:<br />
mit<br />
6.1-5
Diskussion der Van-der-Waals-Zustandsgleichung<br />
1. Vergleich mit der Virialzustandsgleichung:<br />
Van-der-Waals-Zustandsgleichung am kritischen Punkt:<br />
Eingesetzen von a und b liefert:<br />
Vergleich mit Messwerten <strong>für</strong> verschiedene Gase:<br />
6.1-6
2. Kurvenverlauf der Isothermen nach der Van-der-Waals-Gleichung im p,v-Diagramm<br />
Experiment zum Vergleich:<br />
Der Verlauf der Isothermen im Nassdampfgebiet nicht entspricht nicht dem Experiment,<br />
die Grenzen des Nassdampfgebietes (Siede- und Taulinie) werden nicht festgelegt.<br />
6.1-7
3. Unterkühlter Dampf und überhitztes Wasser<br />
Verlauf der Isothermen nach der Zustandsgleichung von Van-der-Waals<br />
Im Widerspruch mit der Alltagserfahrung fallen im Zweiphasengebiet bei der<br />
Van-der-Waals-Gleichung Isotherme und Isobare nicht zusammen.<br />
6.1-8
Die Zustände zwischen Siede- und Taupunkt sind metastabil oder instabil.<br />
Experimentell lassen sich die Zustände zwischen 1 und a (überhitzte Flüssigkeit)<br />
und zwischen 2 und c (unterkühlter Dampf) bei sorgfältigsten<br />
Versuchsbedingungen tatsächlich erreichen.<br />
Bei kleinsten Störungen (Erschütterungen, Kondensationskeime) zerfallen diese<br />
Zustände in sehr kurzem Zeitraum in die beiden Phasen trockener Dampf und<br />
siedende Flüssigkeit (z.B. Siedeverzug).<br />
Zustände auf dem Kurvenast a über b nach c werden nicht beobachtet, das<br />
Volumen steigt hier unphysikalisch mit zunehmendem Druck.<br />
Diese Zustände werden experimentell tatsächlich nicht beobachtet. können.<br />
6.1-9
4. Konstruktion von Siede- und Taulinie<br />
Die Einführung der anziehenden Molekülkräfte und der Abstoßung durch das<br />
endliche Volumen in der<br />
van-der-Waalsschen Zustandsgleichung<br />
ermöglicht jedoch trotzdem die Festlegung<br />
von Siede- und Taupunkt<br />
auf der Isothermen und damit die<br />
Konstruktion der Siede- und Taulinie.<br />
Dazu stehen<br />
1. Hauptsatz der Termodynamik<br />
und 2. Hauptsatz der Termodynamik<br />
zur Verfügung.<br />
6.1-10
Festlegung von Siedepunkt 1 und Taupunkt 2 auf einer Isothermen<br />
Nach dem ersten Hauptsatz und wegen der Reversiblität<br />
des Phasenübergangs gilt:<br />
Es folgt daher <strong>für</strong> isotherme Zustandsänderung:<br />
Diese Bedingung ist gleichbedeutend mit der<br />
Gleichheit der im Diagramm farbig<br />
hinterlegten Flächen über und unterhalb der<br />
jeweiligen Isothermen (Maxwell-Clausius):<br />
6.1-11
6.2 Allgemeine Beziehungen zwischen Zustandsgrößen<br />
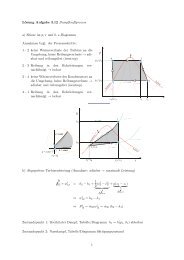
Totales oder vollständiges Differential einer Zustandsfunktion f (x,y) :<br />
Die Größe ist<br />
die Steigung der Geraden A:B in<br />
nebenstehender Skizze.<br />
Analog lässt sich N interpretieren.<br />
6.2-1
Grundsätzliches:<br />
1. Wir finden <strong>für</strong> jede beliebige Zustandsfunktion f (x,y) unter der Bedingung<br />
wegen<br />
die allgemeine Beziehung<br />
oder in zyklischer Schreibweise<br />
6.2-2
2. Gemischte Ableitungen:<br />
Wenn dies gilt, dann ist df ein totales oder vollständiges Differential der<br />
Funktion f (x,y) und die Funktion eine Zustandsfunktion.<br />
Die Bedingungen heißen deshalb auch in der Mathematik ganz allgemein<br />
Integrabilitätsbedingungen.<br />
In der Thermodynamik: Mit den Fundamentalgleichungen von Zustangsgrößen<br />
erhält man unter Ausnutzung der Integrabilitätsbedingungen die<br />
Maxwellschen Relationen.<br />
6.2-3
Maxwellsche Relationen<br />
Ausgangspunkt Fundamentalgleichungen:<br />
Innere Energie u:<br />
Enthalpie h:<br />
Freie Energie (Helmholtz) a = u - T s :<br />
Freie Enthalpie (Gibbs) g = h - T s :<br />
6.2-4
Fundamentalgleichung<br />
Maxwell Relation<br />
Von besonderem Interesse sind die Relationen, nach denen kalorische Zustandsgrößen<br />
nur durch thermische ausgedrückt werden können (hellblau markiert).<br />
6.2-5
Weitere Zusammenhänge<br />
Vollständiges Differential:<br />
Fundamentalgleichung:<br />
Wegen<br />
liefert der Vergleich von (**) mit (*)<br />
die Beziehungen:<br />
6.2-6
Beispiel 1:<br />
Für ein Van-der-Waals-Gas mit<br />
u(T,v) und s(T,v) zu bestimmen.<br />
sind die Zustandsgleichungen<br />
Lösung: Im vollständigen Differential der Inneren Energie<br />
kann die erste partielle Ableitung durch die Definition der Wärmekapazität bei constantem<br />
Volumen<br />
und die zweite partielle Ableitung durch Vergleich mit dem<br />
vollständigen Differential der Entropie unter Nutzung der Fundamentalgleichung und der<br />
Maxwellbeziehung ersetzt werden<br />
Vollständiges Differential der Entropie:<br />
Fundamentalgleichung:<br />
6.2-7
Es ergibt sich allgemein<br />
Für das Van-der-Waals-Gas ist<br />
und deshalb<br />
Mit diesen Zusammenhängen können die partiellen Ableitung im vollständigen Differential der<br />
Entropie ersetzt werden<br />
Für das Van-der-Waals-Gas gilt dann<br />
6.2-8
Beispiel 2: Modellansatz <strong>für</strong> die thermische und kalorische Zustandsgleichung<br />
Für ein Photonengas werden <strong>für</strong> die Zustandsgleichungen folgende Modellansätze formuliert:<br />
Ges.:<br />
a) Welcher Kopplungsbeziehung zwischen und müssen die Ansätze gehorchen?<br />
b) Für welche Wahl der Exponenten α und β wird die Kopplungsbeziehung erfüllt?<br />
6.2-9
Lösung:<br />
a) Auf der rechten Seite der Kopplungsbeziehung wird die Funktion u = u(T,v) betrachtet.<br />
Für ihr vollständiges Differential gilt<br />
Aus der Fundamentalgleichung<br />
erhält man mit dem vollständigen Differential<br />
nach Einsetzen der Differentiale du und ds in die Fundamentalgleichung das Zwischenergebnis:<br />
6.2-10
Wegen der gesuchten Zusammenhänge betrachten wir außerdem die Funktion u=u(s,v).<br />
Mit dem vollständigen Differential und der Fundamentalgleichung und<br />
Vergleich der Koeffizienten liefert:<br />
Die Gleichheit der gemischten Ableitungen liefert die Maxwell-Relation:<br />
Mit der Vertauschungsregel<br />
gilt<br />
6.2-11
Darin wird die partielle Ableitung durch die Maxwell-Relation<br />
ersetzt und man erhält<br />
so dass wir die gesuchte Kopplungsbeziehung<br />
erhalten.<br />
6.2-12
) Vorgeschlagene Zustandsgleichungen:<br />
Prüfen der Kopplungsbeziehung<br />
durch Ausrechnen der partiellen Ableitungen<br />
sowie Einsetzen und Gleichsetzen:<br />
Dimensionsanalyse und Exponentenvergleich liefert: α = 1 und β =1<br />
Vorgeschlagenes Gasmodell:<br />
6.2-13
6.3 Der Joule-Thomson-Effekt und die Gasverflüssigung<br />
Der erste Hauptsatz <strong>für</strong> das Bilanzzsystem liefert unabhängig vom strömenden<br />
Medium:<br />
Strömung konstanter Enthalpie<br />
Frage:<br />
Ändert sich die Temperatur mit dem Druck unter der Voraussetzung<br />
konstanter Enthalpie?<br />
Bekannt:<br />
6.3-1
Wegen der Vertauschungsregel<br />
und<br />
gilt<br />
Mit<br />
und der Maxwell Relation<br />
folgt<br />
Eine Beziehung zwischen ausschließlich thermischen Zustandsgrößen!<br />
6.3-2
Mit<br />
folgt<br />
Für ideale Gase ( Z = 1 ):<br />
Das Bild zeigt den Joule-Thomson-Koeffizient<br />
μ JT <strong>für</strong> Luft.<br />
In weiten Bereichen gilt ,<br />
also Abnahme der Temperatur über die<br />
Drosselstelle.<br />
Dies wird beim Linde-Verfahren zur<br />
Gasverflüssigung genutzt (Übungsaufgabe).<br />
6.3-3