Enthalpie der Luft
Enthalpie der Luft
Enthalpie der Luft
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
3.3.5 Energiebilanz bei <strong>der</strong> Mischung feuchter <strong>Luft</strong><br />
Bezugsgröße: Masse <strong>der</strong> trockenen <strong>Luft</strong> m L<br />
Beladung:<br />
Auf die Masse <strong>der</strong> <strong>Luft</strong> bezogene <strong>Enthalpie</strong><br />
<strong>Enthalpie</strong>nullpunkt von <strong>Luft</strong> und Wasser am Tripelpunkt des siedenden<br />
Wassers T=T tr = 273,16 K:<br />
<strong>Enthalpie</strong> <strong>der</strong> <strong>Luft</strong> (Annahme: ideales Gas mit konst. spezifischen Wärmen)<br />
3.3-46
<strong>Enthalpie</strong> des Wasserdampfes<br />
(wie <strong>Luft</strong> als ideales Gas mit konstanter<br />
spezifischer Wärme behandelt)<br />
<strong>Enthalpie</strong> des flüssigen Wassers (ideale Flüssigkeit, v dp-Anteil vernachlässigt)<br />
mit<br />
3.3-47
<strong>Enthalpie</strong> des Wasserdampfes<br />
(wie <strong>Luft</strong> als ideales Gas mit konstanter spezifischer Wärme behandelt)<br />
<strong>Enthalpie</strong> des flüssigen Wassers (ideale Flüssigkeit, vdp vernachlässsigt)<br />
Festlegung:<br />
3.3-47
Ungesättigte feuchte <strong>Luft</strong> *) : x < x s (T)<br />
Gemisch idealer Gase (kein flüssiges Wasser o<strong>der</strong> Eis im <strong>Luft</strong>strom)<br />
Gesättigte feuchte <strong>Luft</strong> im Gleichgewicht: x ≥ x s (T),<br />
mit überschüssigem flüssigen Wasser, x - x s (T), als Flüssigkeit im <strong>Luft</strong>strom<br />
mitgeführt (kein Eis vorhanden):<br />
*)<br />
vergl. 2.4-2:<br />
3.3-48
Beispiel: Adiabate Mischung zweier Ströme feuchter <strong>Luft</strong><br />
Massenbilanz trockener <strong>Luft</strong><br />
Massenbilanz Wasserdampf<br />
3.3-49
Energiebilanz (vernachlässigte kinetische und potentielle Energien)<br />
1. Hauptsatz:<br />
3.3-50
Verhältnis <strong>der</strong> Massenströme<br />
Die Formel stellt Mischungsgeraden im<br />
h 1+x ,x-Diagramm dar.<br />
3.3-51
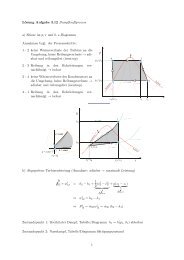
Der Mischpunkt M 12 zweier Stoffströme<br />
1 und 2 ungesättigter <strong>Luft</strong> liegt auf <strong>der</strong><br />
im Verhältnis <strong>der</strong> Massenströme<br />
geteilten Verbindungsgerade zwischen<br />
den Zustandspunkten <strong>der</strong> Stoffströme.<br />
Bei <strong>der</strong> Mischung zweier Stoffströme 3<br />
und 4 in <strong>der</strong> Nähe <strong>der</strong> Sättigungslinie ϕ = 1<br />
kann <strong>der</strong> Mischpunkt M 34 wegen <strong>der</strong><br />
Krümmung <strong>der</strong> Sättigungslinie im<br />
Nebelgebiet liegen. Z.B. Atemluft 3 mit<br />
kalter Umgebungsluft 4 im Winter.<br />
3.3-52
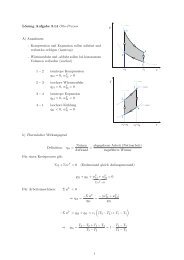
Abkühlung bzw. Erwärmung von<br />
feuchter <strong>Luft</strong> konstanter Beladung<br />
Abkühlung kann zur Nebelbildung führen,<br />
Erwärmung zur Auflösung vorhandenen<br />
Nebels.<br />
Zuzuführende Wärme:<br />
3.3-53
Beispiel: Stationärer Trocknungsprozess in Ziegelei<br />
Massenstrom Formlinge:<br />
Massenanteil Wasser darin: Y e<br />
= 21 %<br />
Massenstrom trockene <strong>Luft</strong>:<br />
Wasserbeladung <strong>der</strong> <strong>Luft</strong>:<br />
Wasseranteil in Formlingen soll auf Y a<br />
= 1 % reduziert werden Rohlinge<br />
Welches ist die Wasserbeladung x a<br />
<strong>der</strong> <strong>Luft</strong> am Austritt?<br />
3.3-54
Lösung:<br />
Massenbilanz <strong>der</strong> Trockensubstanz <strong>der</strong> Ziegel:<br />
Gesamtmassenbilanz:<br />
3.3-55
Welche Temperatur muss die beladene <strong>Luft</strong> am Austritt mindestens haben, damit die<br />
gefor<strong>der</strong>te Wassermenge durch die <strong>Luft</strong> überhaupt aufgenommen werden kann?<br />
Lösung: Das Wasseraufnahmevermögen <strong>der</strong> <strong>Luft</strong> ist durch die maximale relative<br />
Feuchte von 100 %, ϕ = 100%, begrenzt. Der Partialdruck des Wassers in <strong>der</strong><br />
<strong>Luft</strong> erreicht dann am Austritt gerade den Sättigungsdruck, <strong>der</strong> näherungsweise<br />
als identisch mit dem Dampfdruck von reinem Wasser bei <strong>der</strong> betreffenden<br />
Temperatur angesetzt wird.<br />
Aus<br />
folgt<br />
Aus <strong>der</strong> Wasserdampftafel liest man die Temperatur ab:<br />
3.3-56
3.4 Instationäre Prozesse<br />
Massenbilanz und Erster Hauptsatz für instationäre Fließprozesse<br />
mit .<br />
Integriert zwischen und (Zustand 1 und 2)<br />
3.4-1
Beispiel: Instationärer Füllvorgang aus einer Versorgungsleitung<br />
Ein adiabates, senkrecht stehendes Zylin<strong>der</strong>-Kolben-System<br />
enthält anfänglich eine Masse m 1<br />
an Wasser im<br />
Zweiphasengleichgewicht beim Druck p 1<br />
.<br />
Aus einer Versorgungsleitung wird zum Befüllen<br />
Überhitzter Dampf vom Zustand p r<br />
, T r<br />
über ein Ventil in<br />
das System einströmen gelassen bis die Wasserfüllung<br />
gerade als Sattdampf vorliegt.<br />
Geg.: m 1<br />
= 10 kg , m 1<br />
’ = 8 kg , p 1<br />
= 300 kPa ,<br />
p r<br />
= 0,5 MPa , ϑ r<br />
= 350 o C<br />
Ges.: die Endtemperatur T 2<br />
im Zylin<strong>der</strong> und<br />
die eingefüllte Masse Δm an Wasser<br />
3.4-2
Der Vorgang läuft bei konstantem Druck ab, da Kolbengewicht und Umgebungsdruck<br />
konstant bleiben.<br />
Nach dem Einfüllen soll Sattdampf vorliegen: x = 1<br />
Mit dem Druck ist daher die Temperatur als Siedetemperatur<br />
im Zustand 2 aus <strong>der</strong> Dampftafel bestimmbar.<br />
Abgelesen: x 2<br />
= 1, p 2<br />
= 300 kPa →ϑ 2<br />
= 133,6 o C<br />
Energiebilanz am offenen System<br />
integriert<br />
Energieinhalt <strong>der</strong> Masse im Behälter (da Behälter ruht,<br />
potentielle Energie vernachlässigt: e ≅ u)<br />
3.4-3
Die <strong>Enthalpie</strong> h r<br />
in <strong>der</strong> Referenzleitung ist konstant, kinetische und potentielle Energien<br />
<strong>der</strong> eintretenden Masse werden vernachlässigt<br />
Volumenän<strong>der</strong>ungsarbeit<br />
Daher<br />
o<strong>der</strong><br />
Der Vorgang läuft bei konstantem Druck, daher än<strong>der</strong>t sich die <strong>Enthalpie</strong> im System!<br />
3.4-4
Stoffwerte im Zustand 1:<br />
Stoffwerte im Zustand 2:<br />
Stoffwerte in <strong>der</strong> Versorgungsleitung<br />
3.4-5
3.5. Quasistatische Zustandsän<strong>der</strong>ungen in geschlossenen Systemen<br />
Quasistatische Zustandsän<strong>der</strong>ungen können als eine Folge von<br />
Gleichgewichtszuständen angesehen werden.<br />
Mit dieser Voraussetzung gilt:<br />
Der innere Zustand des Systems kann durch zwei unabhängige Zustandsgrößen<br />
vollständig beschrieben werden.<br />
Dann gilt nach dem 1. Hauptsatz für die Zustandsän<strong>der</strong>ungen:<br />
Irreversibel:<br />
Reversibel: quasistatische und verlustlose Prozessführung<br />
3.5-1
Quasistatische Zustandsän<strong>der</strong>ungen bei konstantem Volumen<br />
Annahme:<br />
Isochore:<br />
Vereinfachung ideales Gas:<br />
3.5-2
Quasistatische Zustandsän<strong>der</strong>ungen bei konstantem Druck (isobar)<br />
Annahme:<br />
Isobare:<br />
Vereinfachung ideales Gas:<br />
Volumenän<strong>der</strong>ungsarbeit:<br />
3.5-3
Quasistatische Zustandsän<strong>der</strong>ungen bei konstantem pv ,<br />
bzw. bei konstanter Temperatur für ein ideales Gas (isotherm)<br />
Annahmen:<br />
Vereinfachung ideales Gas:<br />
Isotherme<br />
kalorische Zustandsgleichung<br />
3.5-4
Adiabate und reibungsfreie Zustandsän<strong>der</strong>ung mit<br />
Adiabat und reibungsfrei (isentrop, vergl. 5.2-21):<br />
Nach dem 1. Hauptsatz folgt:<br />
Isentropenbeziehung<br />
o<strong>der</strong><br />
mit dem Isentropenexponenten k, für den sich<br />
folgende Darstellung ableiten lässt:<br />
Für die Än<strong>der</strong>ung <strong>der</strong> inneren Energie o<strong>der</strong> die Volumenän<strong>der</strong>ungsarbeit ergibt sich<br />
damit:<br />
3.5-5
Für ein ideales Gas gilt mit <strong>der</strong> thermischen Zustandsgleichung<br />
für den Isentropenexponenten folgen<strong>der</strong> Zusammenhang:<br />
Der Isentropenexponent k ist beim idealen Gas mit dem Verhältnis <strong>der</strong><br />
spezifischen Wärmen κ identisch.<br />
Isentropenbeziehung für ideale Gase mit konstanten spezifischen Wärmen:<br />
Isentrope Zustandsän<strong>der</strong>ung bei idealen Gasen mit konstanten spezifischen<br />
Wärmen:<br />
o<strong>der</strong><br />
3.5-6
Polytrope:<br />
Beschreibung durch:<br />
Damit lässt sich <strong>der</strong> Polytropenexponent darstellen:<br />
Polytropenbeziehung:<br />
o<strong>der</strong><br />
Analog zur isentropen Zustandsän<strong>der</strong>ung ergibt sich für die Volumenän<strong>der</strong>ungsarbeit:<br />
3.5-7
Für ein ideales Gas kann mit <strong>der</strong> Zustandsgleichung wie<strong>der</strong> auf das<br />
Temperaturverhältnis geschlossen werden:<br />
Polytropenbeziehung für ideale Gase:<br />
o<strong>der</strong><br />
Für die Volumenän<strong>der</strong>ungsarbeit eines idealen Gases ergibt sich:<br />
3.5-8
Mit dem Polytropenexponenten können die verschiedenen quasistatischen<br />
Zustandsän<strong>der</strong>ungen zusammengefasst werden.<br />
*)<br />
für ideale Gase gilt:<br />
3.5-9
Polytrope ist nützlich zur Beschreibung verlustbehafteter, irreversibler Prozesse<br />
1. Hauptsatz:<br />
Für ideales Gas mit konst. spez. Wärmen:<br />
Beispielsweise:<br />
Zur Modellierung von Zustandsän<strong>der</strong>ung mit Reibung und Wärmeverlusten, die die<br />
Reibungswärme überwiegen:<br />
Typischer Wert:<br />
3.5-10
3.6 Kreisprozesse<br />
Definition:<br />
Än<strong>der</strong>t ein System seinen Zustand so, dass es von<br />
einem Anfangszustand 1 über Zwischenzustände<br />
wie<strong>der</strong> in den Anfangszustand zurückkehrt 2=1,<br />
so hat das System einen Kreisprozess durchlaufen.<br />
Für jede Zustandsgröße ζ = f(ζ i ,ζ j ) gilt dann:<br />
Es gilt auch umgekehrt:<br />
Verschwindet das Umlaufintegral<br />
Beispiele für thermische Zustandsgrößen:<br />
Beispiele für kalorische Zustandsgrößen:<br />
, so ist die Größe ζ eine Zustandsgröße.<br />
Druck, Volumen, Temperatur<br />
Innere Energie, <strong>Enthalpie</strong>,<br />
spezifische Wärmekapazitäten, Entropie (Kap. 5)<br />
3.6-1
Darstellung von Kreisprozessen mit quasistatischen Zustandsän<strong>der</strong>ungen<br />
rechtslaufen<strong>der</strong> Kreisprozesse<br />
linkslaufen<strong>der</strong> Kreisprozess<br />
(Arbeit wird an die Umgebung abgegeben) (Arbeit wird von <strong>der</strong> Umgebung zugeführt)<br />
Die Umlaufintegrale verschwinden jeweils nicht.<br />
Die Volumenän<strong>der</strong>ungsarbeit ist damit keine Zustandsgröße son<strong>der</strong>n eine Prozessgröße!<br />
3.6-2
Bemerkung:<br />
Genauso wie die Volumenän<strong>der</strong>ungsarbeit ist auch die bei einem Prozess zugeführte Wärme<br />
keine Zustandsgröße, son<strong>der</strong>n vom Prozessverlauf abhängig.<br />
Zustandgrößen ζ besitzen ein vollständiges Differential: dζ<br />
Zum Beispiel: Volumen V: dV , Druck p: dp , innere Energie U: dU<br />
Wärme Q und Volumenän<strong>der</strong>ungsarbeit W V besitzen kein vollständiges Differential.<br />
Wir schreiben deshalb: δQ und δW V = - p dV<br />
In differentieller Form lautet deswegen <strong>der</strong> erste Hauptsatz:<br />
Im Übrigen drückt sich diese Unterscheidung zwischen Prozess- und Zustandsgräßen auch in<br />
<strong>der</strong> Indizierung bei <strong>der</strong> integralen Schreibweise aus:<br />
(Ein Q 2<br />
-Q 1<br />
etc. wäre unsinnig, ebenso wie etwa ein U 12<br />
!)<br />
3.6-3
Beispiel: Dampfkraftanlage<br />
1. Hauptsatz für stationäre offene Systeme<br />
(stationärer Fließprozess)<br />
0 – 1, Speisepumpe:<br />
1 – 2, Dampferzeuger:<br />
2 – 3, Turbine:<br />
3 – 0, Kondensator:<br />
Insgesamt:<br />
aber:<br />
3.6-4
Technische Arbeit:<br />
(rechtslaufen<strong>der</strong> Prozess)<br />
In einem Kreisprozess ist die insgesamt abgegebene technische Arbeit gleich <strong>der</strong><br />
Differenz <strong>der</strong> zugeführten minus <strong>der</strong> abgegebenen Wärme.<br />
Thermischer Wirkungsgrad<br />
Definition des Wirkungsgrades allgemein: Nutzen / Aufwand<br />
hier:<br />
abgegebene technische Arbeit / zugeführte Wärme<br />
3.6-5