Lösung Aufgabe 4.8.1 ”Carnot-Prozess” a) p, v-Diagramm a ...
Lösung Aufgabe 4.8.1 ”Carnot-Prozess” a) p, v-Diagramm a ...
Lösung Aufgabe 4.8.1 ”Carnot-Prozess” a) p, v-Diagramm a ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Lösung</strong> <strong>Aufgabe</strong> <strong>4.8.1</strong> <strong>”Carnot</strong>-<strong>Prozess”</strong><br />
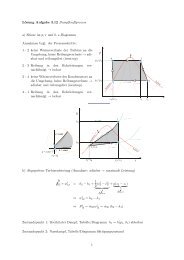
a) p, v-<strong>Diagramm</strong><br />
p<br />
p max<br />
2<br />
isotherm<br />
adiabat<br />
3<br />
p min<br />
T 1 = T min<br />
= const<br />
1<br />
s 1 = const<br />
adiabat<br />
isotherm<br />
T 2 = T max = const<br />
4 s 3 = const<br />
a) Spezifische technische Arbeiten und Wärmen<br />
1 - 2: Adiabate Kompression<br />
1. Hauptsatz für stationären Fließprozess:<br />
Zahlenwert:<br />
q 12 + w t 12 = h 2 − h 1 adiabat: q 12 = 0<br />
w t 12 = c p (T 2 − T 1 ) > 0 (ideales Gas)<br />
w t 12 = 5 2<br />
2 - 3: Isotherme Expansion<br />
1. Hauptsatz für stationären Fließprozess:<br />
kJ<br />
kJ<br />
2, 077 550 K = 2856<br />
kgK kg<br />
q 23 + w t 23 = h 3 − h 2 = c p (T 3 − T 2 ) ideales Gas und isotherm: T 3 = T 2<br />
q 23 ≠ 0 , w t 23 ≠ 0 1
Definition:<br />
w t = ∫ vdp<br />
Mit Zustandsgleichung: pv = RT = const ⇒ v = RT 2 /p<br />
w t 23 = RT 2<br />
∫ 3<br />
2<br />
w t 23 = RT 2<br />
∫ 3<br />
Kopplung an das Temperaturverhältnis:<br />
Zahlenwert:<br />
p 3<br />
p 2<br />
= p 3<br />
p 4<br />
p 4<br />
p 2<br />
mit<br />
2<br />
dp<br />
p = RT 2<br />
ln( p 3<br />
p 2<br />
)<br />
∫ 3<br />
2<br />
dp<br />
p<br />
p 3<br />
= ( T κ<br />
3<br />
) κ − 1 = ( T κ<br />
3<br />
) κ − 1<br />
p 4 T 4 T 4<br />
κ<br />
w23 t = RT 2 ln(( T 3<br />
) κ − 1 p 4<br />
) = −q 23<br />
T 4 p 2<br />
w23 t = 2, 077 kJ 850 K ln( (850<br />
kgK 300 ) 5 2<br />
1<br />
kJ<br />
) = −2310<br />
50 kg<br />
Analog für die anderen beiden Teilprozesse:<br />
3 - 4: Adiabate Expansion<br />
1. Hauptsatz für stationären Fließprozess:<br />
q 34 + w34 t = h 4 − h 3 adiabat: q 34 = 0<br />
w34 t = c p (T 3 − T 4 ), 0 (ideales Gas)<br />
w34 t = −w12<br />
t<br />
Zahlenwert:<br />
w t 12 = 5 2<br />
4 - 1: Isotherme Kompression<br />
2, 077<br />
kJ<br />
kgK<br />
− 550 K = −2856<br />
kJ<br />
kg<br />
1. Hauptsatz für stationären Fließprozess:<br />
q 41 + w t 41 = h 4 − h 1 = c p (T 4 − T 1 ) ideales Gas und isotherm: T 4 = T 1<br />
q 41 ≠ 0 , w t 41 ≠ 0 2
w t 41 = RT 1<br />
∫ 1<br />
4<br />
w t 41 = RT 1<br />
∫ 1<br />
Kopplung an das Temperaturverhältnis:<br />
p 1<br />
p 4<br />
= p 1<br />
p 2<br />
p 2<br />
p 4<br />
4<br />
mit<br />
∫<br />
dp<br />
1<br />
p = RT dp<br />
1<br />
4 p<br />
ln( p 1<br />
p 4<br />
)<br />
p 1<br />
= ( T κ<br />
1<br />
) κ − 1<br />
p 2 T 2<br />
κ<br />
w41 t = RT 1 ln(( T 1<br />
) κ − 1 p 2<br />
) = −q 23<br />
T 2 p 1<br />
Zahlenwert:<br />
Nutzarbeit:<br />
⇒ p 1<br />
p 4<br />
= p 2<br />
p 3<br />
w41 t = 2, 077 kJ 300 K ln( (850<br />
kgK 300 ) 5 kJ<br />
2 50) = +81, 5<br />
kg<br />
Zahlenwert:<br />
Wirkungsgrad:<br />
Zahlenwert:<br />
− ∑ w t = −[w t 12 + wt 23 + wt 34 + wt 41 ] = −[wt 23 + wt 41<br />
− ∑ w t = −[−2310 + 815] kJ<br />
kJ<br />
kg<br />
= 1495<br />
kg<br />
∑ w<br />
t<br />
η th = − = −wt 23 − wt 41<br />
= q 23 + q 41<br />
q zu q 23 q 23<br />
= 1 + q 41<br />
= 1 + −RT 1 ln p 1<br />
p 4<br />
q 23 −RT 2 ln p 3<br />
= 1 − T 1<br />
T 2<br />
p 2<br />
η th = 1 − 300<br />
850<br />
= 0, 647<br />
3