Präparat 5 - Christopher Gallian, Diplom-Ingenieur der Chemischen ...
Präparat 5 - Christopher Gallian, Diplom-Ingenieur der Chemischen ...
Präparat 5 - Christopher Gallian, Diplom-Ingenieur der Chemischen ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Name: <strong>Gallian</strong> Studiengang: Chemische Technik (4T) Datum: 21.12.04<br />
Vorname: <strong>Christopher</strong> Matrikelnummer: 0321296 Seite: 1 von 4<br />
<strong>Präparat</strong>: 5 Produkt: Bernsteinsäurediethylester durchgeführt: 16.11.04<br />
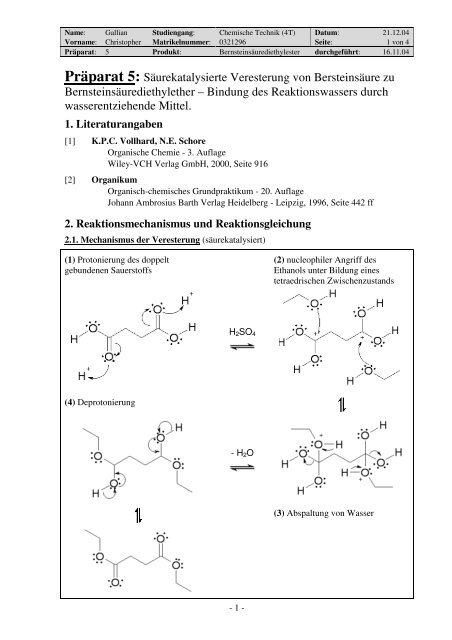
<strong>Präparat</strong> 5: Säurekatalysierte Veresterung von Bersteinsäure zu<br />
Bernsteinsäurediethylether – Bindung des Reaktionswassers durch<br />
wasserentziehende Mittel.<br />
1. Literaturangaben<br />
[1] K.P.C. Vollhard, N.E. Schore<br />
Organische Chemie - 3. Auflage<br />
Wiley-VCH Verlag GmbH, 2000, Seite 916<br />
[2] Organikum<br />
Organisch-chemisches Grundpraktikum - 20. Auflage<br />
Johann Ambrosius Barth Verlag Heidelberg - Leipzig, 1996, Seite 442 ff<br />
2. Reaktionsmechanismus und Reaktionsgleichung<br />
2.1. Mechanismus <strong>der</strong> Veresterung (säurekatalysiert)<br />
(1) Protonierung des doppelt<br />
gebundenen Sauerstoffs<br />
(4) Deprotonierung<br />
H2SO4<br />
- H2O<br />
- 1 -<br />
(2) nucleophiler Angriff des<br />
Ethanols unter Bildung eines<br />
tetraedrischen Zwischenzustands<br />
(3) Abspaltung von Wasser
Name: <strong>Gallian</strong> Studiengang: Chemische Technik (4T) Datum: 21.12.04<br />
Vorname: <strong>Christopher</strong> Matrikelnummer: 0321296 Seite: 2 von 4<br />
<strong>Präparat</strong>: 5 Produkt: Bernsteinsäurediethylester durchgeführt: 16.11.04<br />
2.2. Reaktionsgleichung<br />
3. Ansatz<br />
H2SO4<br />
118 g/mol 46 g/mol 174 g/mol 18 g/mol<br />
Substanz Molmasse Dichte<br />
[g/mol] [g/cm 3 Stoffmenge Masse Volumen<br />
] [mol] [g] [ml]<br />
Bernsteinsäure 118,09 - - - 0,10 11,8 - - -<br />
Ethanol, absolut 46,07 0,79 1,00 46,0 60<br />
Schwefelsäure, konz. 98,09 1,84 0,04 4,0 2<br />
4. Versuchsdurchführung<br />
4.1. Aufbau <strong>der</strong> Reaktionsapparatur:<br />
Die Reaktionsapparatur besteht aus einem 250ml Dreihalskolben mit KPG-Rührer<br />
Tropftrichter, Rückflusskühler und Innenthermometer. Zum erhitzen <strong>der</strong> Lösung dient ein<br />
Heizpilz.<br />
4.2. Durchführung:<br />
Die Bernsteinsäure wird im Dreihalskolben in Ethanol gelöst. Danach wird unter Rühren mit<br />
einer Pipette die Schwefelsäure hinzu gegeben. Die Apparatur wir dann mit dem Heizpilz<br />
zum Sieden gebracht (80°C) und für drei Stunden am Rückfluss gekocht. Über den gesamten<br />
Reaktionsverlauf hinweg werden keine sichtbaren Verän<strong>der</strong>ungen des Reaktionsgemisches<br />
erkannt.<br />
4.3. Reinigung des Produkts:<br />
Überschüssiges Ethanol muss Abdestilliert werden danach muss <strong>der</strong> Destillationsrückstand<br />
durch Waschen, Trocknen und eine Vakuumdestillation aufarbeitet werden.<br />
4.3.1. Aufbau <strong>der</strong> Destillationsapparatur<br />
Destillationskolben dient eine 250ml Rundkolben. Über eine Claisenaufsatz wird <strong>der</strong> Kolben<br />
mit dem Liebigkühler verbunden. Der Claisenaufsatz wird mit einem Glasstopfen und einem<br />
Destillationsthermometer versehen. An das Ende des Liebigkühlers wird zum auffangen des<br />
abdestillierten Ethanols ein 100ml Rundkolben befestigt. Die Lösung wird mit einem<br />
Magnetrührer gerührt und mit einem Heizpils erhitzt.<br />
Bei <strong>der</strong> Vakuumdestillation verwendet man den Selben Aufbau. Das Vakuum wird durch eine<br />
Wasserstrahlpumpe erzeugt. Zwischen Wasserstrahlpumpe und Apparatur wird ein Manometer<br />
geschaltet.<br />
4.3.2. Abdestillieren des Ethanols:<br />
Die Lösung wird zum Sieden gebraucht, wobei sie bei einer Temperatur um 90°C übergeht.<br />
Nachdem kein Destillat mehr über geht wird <strong>der</strong> Heizpilz entfernt. Die Lösung hat sich<br />
dunkel gefärbt. Sie wurde überhitzt.<br />
- 2 -
Name: <strong>Gallian</strong> Studiengang: Chemische Technik (4T) Datum: 21.12.04<br />
Vorname: <strong>Christopher</strong> Matrikelnummer: 0321296 Seite: 3 von 4<br />
<strong>Präparat</strong>: 5 Produkt: Bernsteinsäurediethylester durchgeführt: 16.11.04<br />
4.3.3. Waschen, Extrahieren, Neutralisieren, Trocknen:<br />
Der Destillationsrückstand wird in 100ml Eiswasser gegossen. Danach wird die Lösung mit<br />
Diethylether ausgeschüttelt. Die dunklen verschmutzen Partikel verbleiben dabei in <strong>der</strong><br />
wässrigen Phase. Die Etherphase verbleibt Farblos.<br />
Die Etherphase wird abgetrennt und mit Natriumcarbonat-Lösung Säurefrei gewaschen. Die<br />
Natriumcarbonat-Lösung wird abgetrennt. Es wird erneut mit Wasser gewaschen. Dann wird<br />
auch das Wasser abgetrennt und die Etherphase wird mit Natriumsulfat (wasserfrei)<br />
getrocknet.<br />
Der Ether wird über den Rotationsverdampfer abgezogen.<br />
4.3.4. Durchführung <strong>der</strong> Vakuumdestillation:<br />
Der Etherfreie Rückstand wird in einen 100ml Rundkolben gegeben. Nach anlegen des<br />
Vakuums stellt sich ein druck zwischen 10 und 20mbar ein. Die Lösung wird erhitzt. Bei etwa<br />
100°C geht <strong>der</strong> Ester über.<br />
5. Auswertung<br />
Es gehen nur 3,3g des Esters über. Bei einer theoretischen Ausbeute von 11,8g (100%) beträgt<br />
die tatsächliche Ausbeute nur 28%. Da die Lösung beim Abdestillieren des Ethanols durch<br />
überhitzen wohl Teilweise zersetzt wurde resultierte diese geringe Ausbeute. Es wäre besser<br />
gewesen das Ethanol unter mil<strong>der</strong>en Bedingungen über den Rotationsverdampfer abzuziehen.<br />
6. Durchschnittliche Ausbeuteberechnung <strong>der</strong> Synthesevarianten<br />
Variante<br />
A Variante B Variante C<br />
Matrikelnummer g % g % g %<br />
032 17 14 - - - - 8,8 61,1<br />
022 22 83 - - - - 9,0 62,0<br />
032 24 48 3,6 21,0 - - - -<br />
031 12 05 - - - - 8,4 58,0<br />
032 13 72 - - - - 9,5 67,0<br />
021 13 57 - - - - 7,7 53,0<br />
032 07 43 10,5 60,4 - - - -<br />
031 03 72 - - 14,0 80,4 - -<br />
032 12 95 - - - - 11,1 77,1<br />
032 12 96 3,3 28 - - - -<br />
032 21 56 - - 12,6 72,4 - -<br />
032 12 93 5,7 32,7<br />
032 08 75 9,6 55,1 - - - -<br />
durchschnittliche Ausbeute<br />
6,5 42,3 13,3 76,4 9,1 63,0<br />
- 3 -
Name: <strong>Gallian</strong> Studiengang: Chemische Technik (4T) Datum: 21.12.04<br />
Vorname: <strong>Christopher</strong> Matrikelnummer: 0321296 Seite: 4 von 4<br />
<strong>Präparat</strong>: 5 Produkt: Bernsteinsäurediethylester durchgeführt: 16.11.04<br />
7. Vergleich <strong>der</strong> verschiedenen Arbeitsvorschriften zur Veresterung.<br />
Für das <strong>Präparat</strong> 5 wurden drei verschiedene Arbeitsvorschriften vorgestellt. Die Veresterung<br />
unter Bindung des Reaktionswassers mit wasserentziehenden Mitteln, die Azeotrope<br />
Veresterung und die Estersynthese aus Anhydriden. Eine weitere Möglichkeit <strong>der</strong> Veresterung<br />
bietet noch die extraktive Veresterung.<br />
Das Gleichgewicht <strong>der</strong> Veresterung lässt sich durch Wasserentzug zur Seite des Esters hin<br />
verschieben. Auch ein Arbeiten unter Alkoholüberschuss Verschiebt das Gleichgewicht zum<br />
Ester. Ein ständiger Abzug des Esters aus <strong>der</strong> Reaktion ist ebenfalls eine Möglichkeit um das<br />
Gleichgewicht zum Ester hin zu verschieben.<br />
7.1. Bindung des Reaktionswassers mit wasserentziehenden Mitteln:<br />
Bei dieser Variante wird das Reaktionswasser durch die zugesetzte Schwefelsäure gebunden.<br />
Das Wasser geht dabei mit <strong>der</strong> Schwefelsäure Wasserstoffbrücken-Bindungen ein und wird<br />
dadurch fest gehalten. Das Wasser wird jedoch nicht komplett aus dem Reaktionsgemisch<br />
entfernt. Es somit dennoch die Reaktion beeinflussen. Deshalb eignet sich dieses Verfahren<br />
nicht für große Ansätze, da die Säure nur eine kleine Menge Wasser binden kann. Es muss<br />
absolut Ethanol verwendet werden, das im Gegensatz zu herkömmlichem Ethanol teurer ist.<br />
7.2. Azeotrope Veresterung:<br />
Bei <strong>der</strong> Azeotropen Veresterung wird das Reaktionswasser durch einen Schlepper <strong>der</strong><br />
Reaktionslösung kontinuierlich entzogen. Als Schlepper wird Chloroform verwendet.<br />
Chloroform, Ethanol und Wasser bilden ein azeotropes Gemisch. Das Gemisch geht bei einer<br />
gewissen Temperatur über und kondensiert dann an einem Wasserabschei<strong>der</strong>. Da Wasser in<br />
Chloroform unlöslich ist scheidet es sich hier ab und wird somit <strong>der</strong> Gesamtreaktion<br />
entzogen. Das Chloroform fließt mit dem Ethanol wie<strong>der</strong> zurück in die Reaktionsapparatur.<br />
Bei dieser Variante wird nur eine katalytische Menge an Schwefelsäure und eine geringe<br />
Menge an Ethanol benötigt. Außerdem muss das Ethanol nicht wasserfrei sein. Es wird<br />
jedoch <strong>der</strong> Einsatz von Chloroform notwendig, welches nach vollendeter Reaktion zusammen<br />
mit dem Ethanol noch abrotiert werden muss.<br />
7.3. Estersynthese aus Anhydriden:<br />
Carbonsäureanhydride zerfallen in Anwesenheit von Wasser zu den jeweiligen Carbonsäuren.<br />
Bei <strong>der</strong> Veresterung <strong>der</strong> Carbonsäureanhydride entsteht <strong>der</strong> Ester und die Carbonsäure, die<br />
dann weiter unter Wasserabspaltung zum Ester reagiert. Diese Art <strong>der</strong> Veresterung ist nur mit<br />
Carbonsäureanhydriden möglich. Der Vorteil liegt darin, dass nur die Hälfte an<br />
Reaktionswasser entsteht. Es muss mit Wasserfreiem Alkohol gearbeitet werden.<br />
7.4. Extraktive Veresterung:<br />
Bei <strong>der</strong> Extraktiven Veresterung wird <strong>der</strong> Ester durch einen Schlepper entzogen, <strong>der</strong> nur<br />
wenig Wasser löst. Das Wasser verbleibt im Reaktionsgemisch <strong>der</strong> Ester wird kontinuierlich<br />
entzogen. Dies führt dazu, dass das Reaktionsgleichgewicht nach rechts verschoben wird. Die<br />
extraktive Veresterung eignet sich zur Darstellung von Methylestern. Methylester können<br />
nicht durch Azeotrope Veresterung gebildet werden, da Methanol mit dem Schlepper in<br />
solcher Menge übergeht, dass keine Phasentrennung im Wasserabschei<strong>der</strong> erfolgt.<br />
- 4 -