Arbeitsbogen: Berliner Blau - Experimente, Synthese
Arbeitsbogen: Berliner Blau - Experimente, Synthese
Arbeitsbogen: Berliner Blau - Experimente, Synthese
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
www.chemiezauber.de<br />
<strong>Berliner</strong> <strong>Blau</strong><br />
<strong>Experimente</strong><br />
Farbmittel<br />
Seite im Hefter: .......<br />
Datum: ……..........…<br />
Vorgegebene Zeit für die Durchführung der <strong>Experimente</strong>: 30-45 Minuten<br />
Geräte und Chemikalien:<br />
• Reagenzgläser<br />
• Spatel<br />
• Glasstab (zum Rühren)<br />
• Tropfpipetten<br />
• Großer Trichter mit<br />
Filterpapier<br />
• Becherglas 250 ml<br />
• Eisen(III)-chlorid<br />
• Eisen(II)-sulfat--<br />
Hexahydrat<br />
• Kaliumhexacyanoferrat(II)<br />
(„gelbes Blutlaugensalz“)<br />
• Kaliumhexacyanoferrat(III)<br />
(„rotes Blutlaugensalz“)<br />
• Sodalösung (w = 5%)<br />
• Salzsäure (c = 0,1 mol/l)<br />
• destilliertes Wasser (aqua<br />
dest.)<br />
• Plastiktüte<br />
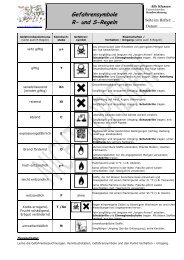
Gefahren:<br />
Eisen(III)-chlorid, Eisen(II)-sulfat-<br />
Hexahydrat, Salzsäure<br />
Informationen:<br />
Detaillierte Informationen zum <strong>Berliner</strong> <strong>Blau</strong> finden sich im<br />
Informationsbogen "<strong>Berliner</strong> <strong>Blau</strong> - Informationen". Entscheidend für uns<br />
hier soll der Gedanken sein, dass Eisen(II)-Ionen Ionen gerne ein Elektron<br />
abgeben und damit einen energetisch günstigen Zustand erreichen.<br />
Soda = Natriumcarbonat<br />
Soda bildet sich vorwiegend durch Verdunstung an den Rändern von<br />
Salzseen oder durch Ausfällung am Seegrund bei kaltem Wetter. Bereits<br />
im Altertum wurde es allgemein als Reinigungsmittel verwendet, da die<br />
wässrige Lösung von Soda infolge Hydrolyse 1 reagiert stark alkalisch<br />
reagiert:<br />
CO 2- 3 + H 2 O HCO - 3 + OH -<br />
1 Eine Hydrolyse nennt man die Spaltung einer chemischen Verbindung durch die<br />
Reaktion mit Wasser.<br />
1/3<br />
| <strong>Berliner</strong> <strong>Blau</strong> - <strong>Experimente</strong>
Durchführung:<br />
1. Lösen Sie etwas Eisen(III)-chlorid in Wasser und tropfen Sie eine<br />
wässrige Kaliumhexacyanoferrat(II)-Lösung hinzu.<br />
2. Lösen Sie etwas Eisen(II)-sulfat-Hexahydrat in Wasser und<br />
tropfen Sie eine wässrige Kaliumhexacyanoferrat(III)-Lösung<br />
hinzu.<br />
Ergebnis:<br />
In beiden Fällen entsteht das Pigment <strong>Berliner</strong> <strong>Blau</strong>.<br />
Die <strong>Blau</strong>färbung mit Kaliumhexacyanoferrat ist eine empfindliche<br />
Nachweismethode für Eisen-Ionen.<br />
Durchführung (Fortsetzung):<br />
3. Nehmen Sie eine Probe des Reaktionsproduktes, versetzen Sie sie<br />
mit etwas von der von Ihnen hergestellten Sodalösung (w = 5%) 2<br />
und schütteln oder rühren Sie.<br />
Ergebnis:<br />
Die blaue Farbe verschwindet.<br />
Durchführung (Fortsetzung):<br />
4. Versetzen Sie die Probe vorsichtig mit verdünnter Salzsäure (c =<br />
0,1 mol/l), bis sich die blaue Farbe wieder zurück bildet.<br />
5. Filtrieren Sie sämtliches <strong>Berliner</strong> <strong>Blau</strong> in das Becherglas<br />
(gegebenenfalls mit aqua dest. nachspülen).<br />
Hinweis: : Da das Pigment sehr fein ist, durchdringt es teilweise<br />
das Filterpapier.<br />
6. Legen Sie das Filterpapier zum Trocknen auf die Heizung. Legen<br />
Sie ein Stück Plastiktüte zwischen Heizung und Filterpapier, damit<br />
die Heizung nicht gefärbt wird.<br />
Noch besser: Stellen Sie das Becherglas mit Filter an einen<br />
ruhigen Ort und lassen Sie die Flüssigkeit bis zur nächsten<br />
Unterrichtsstunde durch laufen.<br />
2 w = Massenanteil = Angabe, wie viel Gramm gelöster reiner Stoff in 100g Lösung<br />
enthalten sind. Hier: 5g Soda in 95g aqua dest. lösen.<br />
2/3<br />
| <strong>Berliner</strong> <strong>Blau</strong> - <strong>Experimente</strong>
Aufträge:<br />
1. Formulieren Sie die Oxidationsreaktion eines Eisen(II)-Ions in<br />
Ionenformelschreibweise.<br />
2. Schreiben Sie für ein Eisen-Atom, ein Eisen(II)-Ion Ion und ein<br />
Eisen(III)-Ion Ion die Elektronenanordnungen in der<br />
Kästchenschreibweise (Orbitaltheorie) und vergleichen<br />
Sie. Erklären<br />
Sie, weshalb das Eisen(III)-Ion Ion gegenüber dem Eisen(II)-Ion<br />
stabiler ist.<br />
3. Erklären Sie mit Hilfe einer einfachen Modellvorstellung, wieso<br />
<strong>Berliner</strong> <strong>Blau</strong> für uns diese Farbe besitzt.<br />
4. Formulieren Sie für folgende Neutralisationsreaktion das<br />
Reaktionsschema in Symbolformelschreibweise und<br />
Ionenformelschreibweise: Eine wässrige Natriumcarbonat-Lösung<br />
reagiert mit verdünnter Salzsäure.<br />
5. <strong>Berliner</strong> <strong>Blau</strong> wird auch für Füllhaltertinten benutzt. Teile der<br />
<strong>Experimente</strong> könnten sich vielleicht für die Benutzung von<br />
Geheimtinte verwenden (Experiment Nr. 3 und 4). Interpretieren<br />
Sie.<br />
6. Den Namen Preußisch <strong>Blau</strong> erhielt der Farbstoff im 18. Jahrhundert,<br />
da er zum Färben der preußischen Uniformen verwendet wurde.<br />
Welche Bedeutung hat der Versuch mit Soda in diesem<br />
Zusammenhang?<br />
3/3<br />
| <strong>Berliner</strong> <strong>Blau</strong> - <strong>Experimente</strong>