Indolente und intermediäre Lymphome - Klinik für Hämatologie und ...
Indolente und intermediäre Lymphome - Klinik für Hämatologie und ...
Indolente und intermediäre Lymphome - Klinik für Hämatologie und ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Indolente</strong> <strong>und</strong> intermediäre <strong>Lymphome</strong><br />
Deutsche niedrigmaligne <strong>Lymphome</strong> Studiengruppe - GLSG<br />
Studienleitung<br />
Prof. Dr. W. Hiddemann, Dr. M. Unterhalt, Medizinische <strong>Klinik</strong> III, Universitätsklinikum Großhadern<br />
Tegernseer Landstr. 243, 81549 München<br />
Tel.: 089-6995-83-0 /-10, Fax: 089-6995-83-12<br />
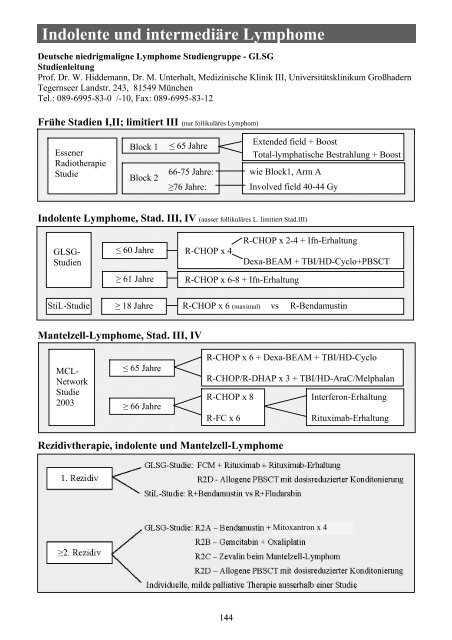
Frühe Stadien I,II; limitiert III (nur follikuläres Lymphom)<br />
Essener<br />
Radiotherapie<br />
Studie<br />
Block 1<br />
Block 2<br />
≤ 65 Jahre<br />
66-75 Jahre:<br />
≥76 Jahre:<br />
Extended field + Boost<br />
Total-lymphatische Bestrahlung + Boost<br />
wie Block1, Arm A<br />
Involved field 40-44 Gy<br />
<strong>Indolente</strong> <strong>Lymphome</strong>, Stad. III, IV (ausser follikuläres L. limitiert Stad.III)<br />
GLSG-<br />
Studien<br />
≤ 60 Jahre<br />
≥ 61 Jahre<br />
R-CHOP x 2-4 + Ifn-Erhaltung<br />
R-CHOP x 4<br />
Dexa-BEAM + TBI/HD-Cyclo+PBSCT<br />
R-CHOP x 6-8 + Ifn-Erhaltung<br />
StiL-Studie ≥ 18 Jahre R-CHOP x 6 (maximal) vs R-Bendamustin<br />
Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
MCL-<br />
Network<br />
Studie<br />
2003<br />
≤ 65 Jahre<br />
≥ 66 Jahre<br />
R-CHOP x 6 + Dexa-BEAM + TBI/HD-Cyclo<br />
R-CHOP/R-DHAP x 3 + TBI/HD-AraC/Melphalan<br />
R-CHOP x 8<br />
Interferon-Erhaltung<br />
R-FC x 6<br />
Rituximab-Erhaltung<br />
Rezidivtherapie, indolente <strong>und</strong> Mantelzell-<strong>Lymphome</strong><br />
Mitoxantron x 4<br />
144
<strong>Indolente</strong> <strong>Lymphome</strong><br />
Therapiegr<strong>und</strong>sätze<br />
Prinzip<br />
Die Therapie kann häufig nur ein palliatives, zytoreduktives Ziel verfolgen, da niedrigmaligne NHL<br />
ganz überwiegend in einem bereits fortgeschrittenen Stadium (III, IV) diagnostiziert werden, das mit<br />
den heute verfügbaren Standardtherapien nicht heilbar ist.<br />
Ein kurativer Anspruch besteht lediglich im Stad. I <strong>und</strong> mit Einschränkung im Stad. II.<br />
Eine Heilung ist nur erreichbar mit einer Radiotherapie.<br />
Die Bestrahlung muß in kurativer Intention als Total-Nodale-Bestrahlung (TNI) oder als Extended-<br />
Field-Bestrahlung (EF) mit einem Linearbeschleuniger oder mit einem Telekobaltgerät in<br />
Großfeldtechnik erfolgen. Die Dosis hat mindestens 30 Gy zu betragen. Die lymphombefallenen<br />
Areale erhalten einen zusätzlichen Boost mit 10 Gy.<br />
Beim Keimzentrumslymphom kann strahlentherapeutisch ausnahmsweise noch im Stad. III eine<br />
Kuration erzielt werden, wenn keine lymphomabhängigen Risikofaktoren vorhanden sind.<br />
Spezifische Risikofaktoren CB/CC-Lymphom im Stad. III<br />
• > 6 Lnn-Regionen befallen, die zueinander in Kontinuität stehen. Definition einer Lnn-Region siehe<br />
Blatt: NHL, Strahlentherapie, Definition Lnn-Regionen.<br />
• Bulky disease ( d.h. Lnn > 5 cm, Mediastinal-TU > 7,5 cm ) mit mindestens einem Lnn, der im<br />
größten Durchmesser > 5 cm mißt.<br />
• Mediastinaltumor mit einem Durchmesser größer als 1/3 des Thoraxdurchmessers<br />
in Höhe von Th 5/6.<br />
Therapiebedürftigkeit<br />
Für die Stadien III, IV besteht mit Stellung der Diagnose nicht automatisch die Notwendigkeit einer<br />
Behandlung, da bei diesem Grad der Lymphomausbreitung gewöhnlich eine Heilung nicht erreicht<br />
werden kann <strong>und</strong> ein frühzeitiger Therapiebeginn das Gesamtüberleben nicht beeinflußt.<br />
Ausnahme: Stad. III CB/CC-<strong>Lymphome</strong> ohne Risikofaktoren. Siehe oben.<br />
Für alle übrigen niedrigmalignen <strong>Lymphome</strong> im fortgeschrittenen Stadium ist nach der Empfehlung<br />
von W.Hiddemann (Deutsche niedrigmaligne Non-Hodgkin-Lymphom-Studiengruppe) die Indikation<br />
für die Einleitung einer zytoreduktiven Chemotherapie gegeben, wenn mindestens eines der folgenden<br />
Kriterien erfüllt ist:<br />
- B-Symptomatik<br />
- Lymphombedingte Zytopenien, d.h. Granulozyten < 1500/ul, Hb < 10 g/dl,<br />
Thrombozyten < 100.000/ul<br />
- Objektivierbare Tumorprogredienz, d.h. > 50% Zunahme der Produkte der beiden größten,<br />
senkrecht aufeinander stehenden Durchmesser der evaluierbaren Lnn innerhalb eines halben<br />
Jahres<br />
- Bulky disease, d.h. Lnn > 5 cm, Mediastinaltumor > 7,5 cm<br />
- Dringender Therapiewunsch des Patienten<br />
- Kompression oder drohende Kompression lebenswichtiger Organe<br />
Beachte<br />
Für die obligat leukämisch verlaufenden <strong>Lymphome</strong> wie die chronische lymphatische Leukämie <strong>und</strong><br />
die Haarzellen-Leukämie, die primär extranodal auftretenden <strong>Lymphome</strong>, wie die vom MALT<br />
ausgehenden lymphatischen Neoplasien <strong>und</strong> auch für die kutanen <strong>Lymphome</strong> gelten spezifische<br />
Therapieempfehlungen, siehe dort.<br />
145
<strong>Indolente</strong> <strong>Lymphome</strong><br />
Therapiestrategie<br />
Das Behandlungskonzept legt zugr<strong>und</strong>e, dass niedrigmaligne NHL in den Stadien I <strong>und</strong> II durch eine<br />
Strahlentherapie heilbar sind.. Beim follikulären Lymphom ist auch noch im limitiertem Stad. III eine<br />
Kuration durch eine alleinige Radiatio möglich.<br />
<strong>Indolente</strong> <strong>Lymphome</strong>, Mantelzell-<strong>Lymphome</strong><br />
Stadium<br />
Therapie<br />
Follikuläre L.<br />
Stad. I, II, <strong>und</strong><br />
limitiertes<br />
Stad.III*<br />
IC,MZL, MCL<br />
Stad. I, II<br />
Stad. III, IV<br />
Individuelle<br />
Therapie<br />
Stad. III,IV<br />
CB/CC, IC<br />
Pat. < 60 Jahre<br />
Pat. ≥ 60 Jahre<br />
MCL<br />
≤ 65 Jahre<br />
Rezidive<br />
> 65 Jahre<br />
≥ 2. Rezidiv<br />
Möglichst Therapie in der altersadaptierten Essener Radiotherapiestudie, sonst<br />
Pat. 18-65 Jahre: Total-Nodale Bestrahlung (TNI) 30 Gy + Boost 10 Gy (14-20)<br />
Pat. 66-75 Jahre: Extended field (EF)<br />
Pat. >75 Jahre: Involved field (IF) 40-44 Gy<br />
Pat. 18-75 Jahre EF 30 Gy + Boost 10 Gy (14-20) nur eine Seite des Zwerchfells<br />
Pat. > 75 Jahre IF 40-44 Gy<br />
Eine zytoreduktive Therapie ist nicht unbedingt mit Stellung der Diagnose<br />
erforderlich, sondern nur dann, wenn der Pat. nach individuellem Entscheid<br />
von einer spezifischen Behandlung profitieren wird. Therapie möglichst im Rahmen<br />
c klinischer Studien durchführen. Siehe untere Spalte, sonst individuell, z.B.<br />
Chemotherapie: Leukeran-Monotherapie, Leukeran+Prednison, Rituximab-Mono,<br />
COP±, CHOP±, MCP±Rituximab, Bendamustin±R oder andere Kombinationen.<br />
Interferon: Indiziert nach Erreichen einer CR oder PR. Dauer der Ifn-Therapie bis<br />
zum Nachweis eines Rezidivs, Progresses oder bis zum Abbruch wegen<br />
Unverträglichkeit.<br />
Strahlentherapie, wenn indiziert als IF oder EF-Bestrahlung.<br />
Therapie in Studien: Prospektiv randomisierte kooperative GLSG-Studie<br />
Therapieteil 1 : CHOP + Rituximab.<br />
Therapieteil 2 : Myeloablative Radio-Chemotherapie mit peripherer<br />
Stammzellentransplantation vs Interferon-Erhaltungstherapie<br />
CHOP + Rituximab + Alpha-Interferon<br />
STiL-Studie: R-CHOP vs R-Bendamustin<br />
European MCL-Studie: R-CHOP x 6 + Dexa-BEAM + HD-Cyclo/TBI+PBSCT vs<br />
R-CHOP/R-DHAP x 3 + HD-AraC/Melph/TBI+PBSCT<br />
2003<br />
European MCL-Studie: R-CHOP x 8 vs R-FC x 6 + Erhaltung Ifn vs Rituximab<br />
GLSG-Studie: FCM+Rituximab ± Rituximab-Erhaltung<br />
StiL-Studie:<br />
R+Bendamustin vs R+Fludarabin<br />
GLSG-Studie: R2A – Bendamustin+Mitoxantron+Rituximab x 4<br />
R2B – Gemcitabin+Oxaliplatin<br />
R2C – Zevalin beim Mantelzell-Lymphom<br />
R2D – Allogene Transplantation mit dosisreduzierter Konditonierung.<br />
* Follikuläres Lymphom, Definition limitiertes klinisches Stad. III<br />
Befall auf einer Seite des Zwerchfells nur in einer, insgesamt nur in ≤ 4 Regionen.<br />
Grösster Tumor ≤ 10 cm Ø.<br />
146
<strong>Indolente</strong> <strong>Lymphome</strong><br />
Prognosefaktoren<br />
Follicular Lymphoma International Prognostic Index (FLIPI), bcl-2<br />
Follikuläre <strong>Lymphome</strong> (FL) sprechen gewöhnlich auf die Primärtherapie an, weisen aber im weiteren Verlauf<br />
häufig Rezidive auf, die nach einem medianen Verlauf von ungefähr 10 Jahren zum Tode führen. Ein Teil der<br />
Patienten überlebt sehr lange, während andere nach kürzerer Zeit, häufig infolge einer Transformation in ein<br />
hochmalignes Lymphom versterben.<br />
Aufgr<strong>und</strong> dieser sehr unterschiedlichen Verläufe, wurde nach prognostischen Faktoren gesucht. Eine<br />
interationale kooperative Gruppe begann 1999 die Arbeit. Es wurden 4.167 Patienten mit FL aus 27<br />
Zentren in Europa <strong>und</strong> den USA analysiert.<br />
Ungünstige Prognosefaktoren - Univariatanalyse<br />
Die folgenden Parameter hatten einen ungünstigen Einfluss auf das Gesamtüberleben:<br />
Alter ≥60 Jahre, männliches Geschlecht, Ann Arbor Stad III,IV, Knochenmarkbefall, Splenomegalie, ≥5 nodale<br />
Lokalisationen, ≥2 extranodale Manifestationen, Performance status ≥2, Vorhandensein von B-Symptomen,<br />
Hämoglobin ≤12 g/dl, Thrombozyten
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, frühe Stadien<br />
Essener Studie, Radiotherapie<br />
Ein-, Ausschlusskriterien<br />
Therapie der niedrigmalignen nodalen Non-Hodgkin-<strong>Lymphome</strong> in frühen Stadien mit alleiniger<br />
Strahlentherapie<br />
In der Vorläuferstudie waren Patienten mit CB/CC-Lymphom im Stadium I/II mit einem modifizierten<br />
Extended-field, Patienten im Stadium III mit begrenzter Tumormasse modifiziert total-lymphatisch<br />
bestrahlt worden. Nach einer medianen Beobachtungszeit von 5 ½ Jahren waren 31% Rezidive zu<br />
verzeichnen, davon lagen 52% außerhalb des Strahlenfeldes, 40% im Strahlenfeld.<br />
Auf der Gr<strong>und</strong>lage dieser Erkenntnisse wurde die aktuelle Therapiestudie erstellt. Sie sieht vor:<br />
Eine Erhöhung der Strahlendosis im Extended field-Arm. Für Patienten 18-65 Jahre Randomisation<br />
zwischen Extended field-Radiatio [A] <strong>und</strong> Total-lymphatischer Bestrahlung [B]. Es soll die Frage<br />
beantwortet werden, ob eine intensivierte Extended field-Bestrahlung kurativ sein kann oder ob eine<br />
total-lymphatische Bestrahlung zur Heilung niedrigmaligner <strong>Lymphome</strong> in frühen Stadien erforderlich<br />
ist.<br />
Die Studie wird in Abhängigkeit vom Lebensalter der Patienten <strong>und</strong> von histologischen Typen in zwei<br />
Blöcken durchgeführt, siehe Studiendesign.<br />
Zielkriterien<br />
Hauptkriteriun: Rezidivfreies Überleben. Nebenkriterien: Gesamt-Überleben, Rezidivmuster,<br />
Toxizitätsbeurteilung<br />
Ärztliche Koordination/Studiensekretariat/Randomisation<br />
Frau Dr. med. M. Engelhard<br />
Strahlenklinik <strong>und</strong> Poliklinik<br />
Universitätsklinikum Essen, Hufelandstraße 55,<br />
45122 Essen,<br />
Tel.: 0201 / 7232056, Fax: 0201 / 7235910<br />
Einschlusskriterien<br />
Follikuläre <strong>Lymphome</strong> (FL) der REAL-Klassifikation bzw. zentroblastisch-zentrozytische <strong>Lymphome</strong><br />
(CB-CC) der Kiel-Klassifikation<br />
Nicht vorbehandelte nodale <strong>Lymphome</strong> einschl. Manifestation im Waldeyer’schen Rachenring<br />
Alter 18 bis 65 Jahre<br />
Stadium CS I <strong>und</strong> II, limitiertes CS III (Ann-Arbor-Klassifikation)<br />
Definition des limitierten Stadium III: Befall auf einer Seite des Zwerchfelles nur in einer, insgesamt in maximal<br />
4 Regionen<br />
Größter Tumor < 10 cm im Durchmesser<br />
Schriftliche Einverständniserklärung, keine Teilnahme an einer anderen Studie<br />
Ausschlusskriterien<br />
Allgemeinzustand WHO > 2<br />
Follikuläres Lymphom Grad III (REAL-Klassifikation) bzw. CB-CC diffuser Subtyp (Kiel-Klass.)<br />
Lymphomdurchmesser > 10 cm (Bulky disease)<br />
Milzbefall<br />
Strahlentherapeutische oder zytostatische Vorbehandlung<br />
Relevante Funktionseinschränkung vitaler Organe (Lunge, Leber, Herz)<br />
Zweitneoplasie<br />
Schwere Begleiterkrankungen, z.B. kongenitale oder erworbene Imm<strong>und</strong>efizienzsyndrome,<br />
Schwere psychiatrische Erkrankungen<br />
Schwangerschaft<br />
148
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, frühe Stadien<br />
Essener Studie, Radiotherapie<br />
Staging<br />
Histologie <strong>und</strong> Diagnosesicherung<br />
Voraussetzung zur Aufnahme in die Studie ist eine neu entdeckte, noch nicht vorbehandelte NHL-<br />
Erkrankung, deren Diagnose durch eine aktuelle, ausreichende Biopsie festgestellt <strong>und</strong> durch einen der<br />
Referenzpathologen bestätigt worden ist. Dabei wird die NHL-Entität sowohl nach Kriterien der<br />
WHO-, der REAL- oder auch nach der Kiel-Klassifikation definiert. Dazu ist die<br />
Immunphänotypisierung der Biopsate zwingend erforderlich. Zusätzlich werden die zytogenetische<br />
<strong>und</strong> molekularbiologische Charakterisierung des Lymphoms <strong>und</strong> möglichst auch der peripheren<br />
Blutlymphozyten angestrebt.<br />
Staging – Diagnostik<br />
Das Ausbreitungsstadium nach der Ann-Arbor-Klassifikation wird durch klinische Staging-<br />
Untersuchungen ermittelt. Ein pathologisches Staging (Staging-Laparotomie) ist nicht erforderlich.<br />
Sollte diese etwa im Rahmen einer Probe- oder Notfalllaparotomie erfolgt sein, steht der<br />
Studienteilnahme des Patienten nichts im Wege.<br />
Obligate Untersuchungen<br />
Erhebung der Anamnese (einschl. Erfassung der B-Symptomatik)<br />
Klinische Untersuchung (einschl. genauer Erfassung des Lymphknotenstatus)<br />
Laboruntersuchungen<br />
Blut-/Differentialblutbild, Elektrolyte, Kreatinin, Harnsäure, Harnstoff-N, Transaminasen, LDH,<br />
Bilirubin, alk. Phosphatase, Gesamteiweiß, Elektrophorese, quantitative Immunglobuline,<br />
Immunelektrophorese, β 2 m, Harnstatus, Hepatitis- <strong>und</strong> HIV-Serologie<br />
Schilddrüsenfunktionsparameter T3, T4, TSH<br />
Seitengetrennte Nierenclearance<br />
EKG, Echokardiogramm<br />
Röntgen-Thorax (in zwei Ebenen), Sonographie Hals <strong>und</strong> Abdomen<br />
CT-Gesichtsschädel, -Hals, -Thorax, -Abdomen, -Beckenregion<br />
HNO-fachärztlicher Konsiliarbef<strong>und</strong><br />
Oesophago-Gastro-Duodenoskopie<br />
Knochenmark-Zytologie <strong>und</strong> –Biopsie beidseits<br />
Leberblindpunktion<br />
Lungenfunktionsprüfung<br />
Symptomabhängige zusätzliche Untersuchungen<br />
z.B. Kolon-Kontrasteinlauf, Skelettszintigramm<br />
Definition der Lymphknotenregionen<br />
1- Waldeyerscher Rachenring u. hochzervikale Lnn bds<br />
2- Zervikale <strong>und</strong> supraklavikuläre Lymphknoten rechts<br />
3- Zervikale <strong>und</strong> supraklavikuläre Lymphknoten links<br />
4- Axilläre Lymphknoten rechts<br />
5- Axilläre Lymphknoten links<br />
6- Mediastinum <strong>und</strong> Hili<br />
7- Paraaortale abdominelle Lymphknoten<br />
8- Parailiakale Lymphknoten rechts<br />
9- Parailiakale Lymphknoten links<br />
10- Inguinale Lymphkoten rechts<br />
11- Inguinale Lymphknoten links<br />
4<br />
2<br />
1 1<br />
3<br />
6<br />
7<br />
8 9<br />
10 11<br />
5<br />
149
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, frühe Stadien<br />
Essener Studie, Radiotherapie<br />
Übersicht, Studienblock 1, 2<br />
Die Studie zur alleinigen Strahlentherapie der frühen Stadien der niedrigmalignen <strong>Lymphome</strong> wird in<br />
zwei Blöcken durchgeführt. Im Block 1 wird im randomisierten Vergleich geprüft, ob die Totallymphatische<br />
Bestrahlung einen Vorteil gegenüber einer Extended field Bestrahlung aufweist. Der<br />
Block 2 stellt eine prospektive Beobachtungsstudie dar.<br />
Studienblock 1<br />
Multizentrische, randomisierte Phase III-Therapiestudie<br />
Patienten 18-65 Jahre<br />
Follikuläres Lymphom<br />
Stad. I,II, limiert III*<br />
R<br />
Extended field Bestrahlung + Boost<br />
Total-lymphatische Bestrahlung + Boost<br />
Arm A<br />
Arm B<br />
Studienblock 2<br />
Multizentrische, nicht randomisierte, prospektive Beobachtungsstudie<br />
Dieser Block umfasst in Abhängigkeit von Histologie <strong>und</strong> dem Lebensalter der Patienten drei<br />
verschiedene Therapieoptionen.<br />
Follikuläre <strong>Lymphome</strong><br />
Follikuläres Lymphom, Stad. I, II, limitiert III*<br />
Patienten 66-75 Jahre: Extended-field-Bestrahlung + Boost, wie Arm A, Studienblock 1<br />
Patienten ≥ 76 Jahre:<br />
Involved-field-Bestrahlung 40-44 Gy<br />
Nichtfollikuläre indolente L <strong>und</strong> Mantelzell-<strong>Lymphome</strong><br />
IC / MZL / MCL**, Stad. I,II<br />
Modifizierte Extended field Bestrahlung, nur die befallenene Zwerchfellseite wird bestrahlt.<br />
Pat. 18-75 Jahre<br />
Supradiaphragmale Manifestation<br />
Mantelfeld 30 Gy, Waldeyer (nur bei Befall hochzervikal): 30 Gy<br />
Boost: <strong>Lymphome</strong>
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, frühe Stadien<br />
Essener Studie, Radiotherapie<br />
Bestrahlungstechnik, Kontrolluntersuchungen<br />
Apparative Voraussetzungen, Zielvolumina, Bestrahlungstechnik<br />
Die protokollgerechte Strahlentherapie erfolgt unter Einsatz von Linearbeschleunigern <strong>und</strong> unter Anwendung<br />
der Großfeldtechnik mit individuellen Abschirmblöcken. Die Bestrahlungsplanung <strong>und</strong> –technik entspricht dem<br />
Standardvorgehen. Dies gilt auch für die Definition der Zielvolumina für die Total-lymphatische Bestrahlung.<br />
Das bekannte „Extended field“ wurde für diese Studie gesondert definiert (siehe Therapieplan).<br />
Dosierung <strong>und</strong> Fraktionierung<br />
Die Strahlendosis im Mantelfeld, Minimantelfeld <strong>und</strong> Waldeyer‘schen Feld, im Supraklavikular-, Paraaortal<strong>und</strong><br />
im umgekehrten Y-Feld sowie im Inguinal-/Hochfemoralfeld beträgt 30 Gy mit einer täglichen Einzeldosis<br />
von 2 Gy <strong>und</strong> einer Fraktionierung von 5x2 Gy/Woche.<br />
Die Strahlendosis im gesamten Abdomen (sog. Abdominelles Bad) beträgt 25,5 Gy mit einer täglichen<br />
Einzeldosis von 1,5 Gy <strong>und</strong> einer Fraktionierung von 5x1 Gy/Woche.<br />
Die Boostdosis beträgt für <strong>Lymphome</strong> mit einem Durchmesser von < 3 cm 10 Gy (supradiaphragmal) bzw. 16<br />
Gy (infradiaphragmal). Für <strong>Lymphome</strong> von 3-10 cm Durchmesser beträgt die Boostdosis 14 Gy<br />
(supradiaphragmal) bzw. 20 Gy (infradiaphragmal). Die tägliche Einzeldosis beträgt 2 Gy, die Fraktionierung<br />
5x2 Gy/Woche. Durch die Erhöhung der Boostdosis im Abdomen wird der geringeren Einzeldosis im Rahmen<br />
des Abdominellen Bades Rechnung getragen. Für paraaortale <strong>Lymphome</strong> von 3.000/ul <strong>und</strong> Thrombozyten > 150.000/ul:<br />
Leukozyten < 3.000/ul oder Thrombozyten < 150.000/ul:<br />
Falls nach 1 Woche Pause:<br />
Leukozyten > 3.000/ul <strong>und</strong> Thrombozyten > 100.000/ul:<br />
Leukozyten < 3.000/ul <strong>und</strong> Thrombozyten < 100.000/ul:<br />
Blutbild 2x/Woche<br />
Blutbild 1x/Woche<br />
Fortsetzung d. Therapie<br />
1 Woche Therapiepause<br />
Fortsetzung d. Therapie<br />
Rücksprache mit der Studienzentrale<br />
Bestrahlung während des zweiten Großfeldes<br />
Thrombozyten < 75.000/ul:<br />
Thrombozyten < 25.000/ul:<br />
Bei Wiederanstieg > 100.000/ul:<br />
Bei fehlendem Wiederanstieg nach 7 Tagen:<br />
Bei fehlendem Wiederanstieg nach 14 Tagen:<br />
Blutbild 3x/Woche<br />
Blutbild täglich<br />
Therapiepause, Blutbild täglich<br />
Fortsetzung d. Therapie<br />
Rücksprache / Studienzentrale<br />
Therapieabbruch<br />
Im Falle von Unklarheiten bitte mit der Studienzentrale in<br />
Verbindung setzen. Tel. 0201/723-2056<br />
151
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, frühe Stadien<br />
Essener Studie, Radiotherapie<br />
Studienblock 1, Therapie<br />
Studienblock 1<br />
Therapiearm A: Extended-field-Bestrahlung Stadium I/II lim. Stad III<br />
Therapieplan bei supradiaphragmaler Manifestation<br />
Kein Mediastinalbefall: Mini-Mantelfeld 30 Gy 30 Gy<br />
Mediastinalbefall: Mantelfeld 30 Gy 30 Gy<br />
Befall hochzervikal: Waldeyer 30 Gy 30 Gy<br />
Immer: Boost auf befallene Lnn: < 3 cm Ø 10 Gy 10 Gy<br />
3 – 10 cm Ø 14 Gy 14 Gy<br />
Paraaortalfeld<br />
30 Gy<br />
Therapieplan bei infradiaphragmaler Manifestation<br />
Befall paraaortal/mesenterial<br />
Abdominelles Bad 25,5 Gy 25,5 Gy<br />
Boost auf <strong>Lymphome</strong>: < 3 cm Ø 16 Gy 16 Gy<br />
3 – 10 cm Ø 20 Gy 20 Gy<br />
Supraclavicularfeld<br />
30 Gy<br />
Befall iliakal/inguinal<br />
Umgekehrtes Y-Feld 30 Gy 30 Gy<br />
Boost auf <strong>Lymphome</strong> < 3 cm Ø 10 Gy 10 Gy<br />
3 – 10 cm Ø 14 Gy 14 Gy<br />
Supraclavicularfeld<br />
30 Gy<br />
Therapiearm B: Total-lymphatische Bestrahlung Stadium I/I lim. Stad III<br />
Therapiebeginn auf der Zwerchfellseite der Lymphommanifestation<br />
Mantelfeld 30 Gy 30 Gy<br />
Waldeyer’scher Rachenring 30 Gy 30 Gy<br />
Abdominelles Bad 25,5 Gy 25,5 Gy<br />
Inguinale <strong>und</strong> hochfemorale Lymphknoten 30 Gy 30 Gy<br />
Boost auf <strong>Lymphome</strong> < 3 cm Ø 10 o. 16* Gy 10 o. 16* Gy<br />
3 – 10 cm Ø 14 o. 20* Gy 14 o. 20* Gy<br />
* Infradiaphragmale Boost-Regionen<br />
Der Boost wird supra- <strong>und</strong> infradiaphragmal mit unterschiedlichen Dosen appliziert. Die Bestrahlung des<br />
Mantelfeldes erfolgt gleichzeitig mit der des Waldeyer-Feldes. In beiden Therapiearmen beginnt die Bestrahlung<br />
in der Region der Lymphom-(Stad. I/II) bzw. der Hauptlymphom-Manifestation (Stad.III) supra- oder<br />
infradiaphragmal <strong>und</strong> wird nach einer Therapiepause von 3 Wo. in der Gegenregion fortgesetzt. Bei Leukopenie<br />
< 3 G/l <strong>und</strong>/oder Thrombopenie < 100 G/l kann dieses Intervall auf max. 4 Wochen verlängert werden.<br />
Bei persistierender Myelosuppression: Rücksprache mit der Studienzentrale<br />
152
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, frühe Stadien<br />
Essener Studie, Radiotherapie<br />
Studienblock 2, Therapie<br />
Studienblock 2<br />
In dem zweiten Studienblock soll bei älteren Patienten altersadaptiert der Effekt einer intensivierten Extended<br />
field-Bestrahlung (Alter 66 – 75 Jahre) bzw. einer Involved field-Bestrahlung (über 75 Jahre) prospektiv<br />
untersucht werden. Eine Randomisation findet nicht statt.<br />
Die Ein- <strong>und</strong> Ausschlusskriterien entsprechen denen des Studienblocks 1. Zusätzlich werden Patienten mit<br />
Immunozytom (IC) <strong>und</strong> Mantelzell-Lymphom bzw. zentrozytischem Lymphom (MZ/CC) in den Stadien I <strong>und</strong> II<br />
eingeschlossen.<br />
Therapie<br />
Follikuläres Lymphom, Stad I/II, limitiert Stad III, 66 bis 75 Jahre<br />
Extended field-Bestrahlung wie im Block 1, Arm A<br />
FL/CB-CC Stadium I/II, limitiert III, > 75 Jahre<br />
Involved field-Bestrahlung<br />
Standard-Zielvolumen<br />
30 Gy<br />
Boost auf <strong>Lymphome</strong>
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, frühe Stadien<br />
Essener Studie, Radiotherapie<br />
Remissionsbeurteilung, Rezidivtherapie<br />
Erfolgsbeurteilung<br />
Die Bewertung des Therapieerfolges geschieht nach folgenden Kriterien.<br />
Vollremission:<br />
vollständige Rückbildung aller initialen Lymphommanifestationen<br />
Teilremission: Rückbildung aller Lymphommanifestationen um > 50%<br />
Minimales Ansprechen: Rückbildung aller Lymphommanifestationen um < 50%<br />
Progression:<br />
Größenzunahme residualer <strong>Lymphome</strong> um > 25% <strong>und</strong>/oder<br />
Auftreten von Neumanifestationen<br />
Rezidiv:<br />
Erneute Progression initialer <strong>Lymphome</strong> <strong>und</strong>/oder Auftreten<br />
von Neumanifestationen bei Patienten in Vollremission<br />
Zusätzliche Untersuchungen zur Ermittlung der Langzeittoxizität<br />
1. – 4. Jahr Nach Bestrahlung des gesamten Abdomens (abdominelles Bad):<br />
seitengetrennte Nierenclearance 1x /Jahr<br />
2. <strong>und</strong> 5. Jahr Nach Bestrahlung des Mini-Mantel- oder Mantelfeldes:<br />
Schilddrüsenfunktion<br />
Lungenfunktionsprüfung, EKG, Echokardiogramm<br />
Dabei sind folgende kardiopulmonale Risikofaktoren <strong>und</strong> Begleiterkrankungen zu erfassen:<br />
Rauchen, Diabetes mellitus, Hyperlipoproteinämie, arterielle Hypertonie, Asthma bronchiale, COPD,<br />
Tuberkulose, Silikose.<br />
Vorgehen bei Rezidiv<br />
Bei Auftreten eines suspekten klinischen Sonographie- oder Röntgenbef<strong>und</strong>es muss ein vollständiges<br />
Restaging einschliesslich der HNO-Untersuchung, der Computertomographien <strong>und</strong> evtl. der<br />
symptomorientierten Diagnostik (z.B. Magen-Darm-Untersuchung) veranlasst werden. Ausserdem<br />
sollte - wenn irgend möglich - eine bioptische Sicherung erfolgen.<br />
Therapiestrategie<br />
Rezidiv-Histologie: FL / CB-CC<br />
Initial Therapiearm A, Rezidiv als nodales Stadium I/II ausserhalb des initialen Strahlenfeldes<br />
/Zielvolumens<br />
Involved-field-Bestrahlung<br />
Alle anderen Patienten < 65 Jahre<br />
Einleitung einer standardisierten systemischen Rezidivtherapie.<br />
Alle anderen Patienten ≥ 66 Jahre<br />
Expektativ-palliative Strategie, d.h. Beobachtung „watch and wait“, bei Entwicklung einer<br />
Behandlungsindikation (Lymphomprogression, B-Symptomatik, Anämie/Leuko- oder<br />
Thrombozytopenie). Einleitung einer standardisierten systemischen Rezidivtherapie.<br />
Rezidiv-Histologie: hochmaliges NHL<br />
Stadium I ausserhalb des initialen Strahlenfeldes / Zielvolumens<br />
Chemotherapie mit 3 – 4 Zyklen CHOP, dann Involved-field Radiotherapie<br />
Stadium I innerhalb des initialen Strahlenfeldes, Stadium II-IV<br />
Chemotherapie mit 6 Zyklen CHOP<br />
Während der Chemotherapie ist dabei u.U. eine ausgeprägte Myelosuppression zu erwarten, die<br />
engere Kontrollen <strong>und</strong> evtl. Dosisanpassungen erfordert.<br />
154
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
Deutsche niedrigmaligne Lymphomstudie (GLSG)<br />
Übersicht<br />
Als Ergebnis der bisherigen Studien sowie aufgr<strong>und</strong> weiterer Daten ergeben sich für die künftige<br />
Studie die folgenden Fragestellungen:<br />
1. Kann das Ergebnis der Erhaltungstherapie mit Interferon alpha <strong>und</strong> der Hochdosistherapie mit<br />
Stammzellensupport durch eine Intensivierung der initialen zytoreduktiven Chemotherapie durch<br />
die Kombination von CHOP mit Rituximab weiter verbessert werden?<br />
2. Wie ist der Stellenwert der myeloablativen Radio-Chemotherapie mit nachfolgender Stammzell-<br />
Transplantation im Vergleich zu einer Erhaltungstherapie mit Interferon alpha in Bezug auf das<br />
Gesamtüberleben?<br />
Da die Studienziele vom Lebensalter der Patienten abhängen, ergibt sich ein Unterschied für die zwei<br />
Patientengruppen: 60 Jahre<br />
Dementsprechend wurde das Studienkonzept modifiziert. Auf die weitere Prüfung der Dosis <strong>und</strong> der<br />
Applikationsweise von Interferon konnte verzichtet werden, nachdem die intensivierte<br />
Interferontherapie keinen Vorteil gegenüber der Standarddosis erbracht hatte. Damit entfällt für die<br />
Pat. >60 Jahre die zweite Randomisation.<br />
Studienkonzept der GLSG zur Behandlung niedrigmaligner <strong>Lymphome</strong><br />
*<br />
*<br />
*<br />
Achtung<br />
Seit * 8/2003 wird nicht mehr randomisiert CHOP vs R-CHOP, sondern alle Patienten erhalten<br />
wegen der signifikant besseren Ergebnisse einheitlich R-CHOP.<br />
Künftig werden die MCL wegen ihrer ungünstigen Prognose nach einem eigenem, intensiveren<br />
Protokoll behandelt.<br />
155
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
Deutsche niedrigmaligne Lymphomstudie (GLSG)<br />
Studienergebnisse<br />
Ergebnisse früherer Studien<br />
Nach Abschluß der Studie 1/88 wurde im April 1996 die Nachfolgestudie 3/96 begonnen, die in einer ersten<br />
Randomisation die Wirkung der Therapieschemata CHOP <strong>und</strong> MCP auf die Remissionsrate prüfen sollte. In<br />
einer zweiten Randomisation wurden Pat. < 60 Jahre entweder einer Hochdosistherapie mit<br />
Stammzelltransplantation oder einer Standard-Interferontherapie zugeführt. Pat. > 60 Jahre oder Patienten mit<br />
Kontraindikationen gegen eine Hochdosistherapie erhielten entweder eine Standard- oder eine intensivierte<br />
Interferontherapie.<br />
Eine Zwischenauswertung der Studie 3/96 stellte fest, dass in der Induktionsphase die CHOP-Therapie<br />
bezüglich der Gesamtremissionsrate gegenüber dem MCP-Schema einen deutlichen Vorteil aufweist<br />
(Ansprechrate 91% vs. 78%). Außerdem ist die Stammzellausbeute nach CHOP deutlich besser als nach MCP.<br />
Somit wurde entschieden, die Studie 3/96 dahingehend zu modifizieren, den MCP-Arm zu streichen <strong>und</strong> die<br />
Randomisation gegen CHOP+CD20–Antikörper (Rituximab) vorzunehmen. Diese Modifikation trat ab Herbst<br />
1999 in Kraft. Die zweite Randomisation blieb zunächst unverändert. Eine erneute Zwischenauswertung im<br />
Frühjahr 2001 konnte zeigen, dass die intensivierte IFN-Therapie keinen signifikanten Vorteil für die Patienten<br />
ergab. Daher wurde von der Studiengruppe beschlossen, die zweite Randomisation bei Patienten > 60 Jahren zu<br />
verlassen <strong>und</strong> die Erhaltungstherapie in der Standarddosis mit 3 x 5 Mio. IE IFN / Woche fortzuführen.<br />
Interferon alpha<br />
Mit Interferon-Alpha konnte eine signifikante Verlängerung des progressionsfreien Intervalls erreicht werden,<br />
jedoch keine Verlängerung des Gesamtüberlebens. Die Effektivität der Ifn-Behandlung scheint von der Qualität<br />
der initialen Zytoreduktion abzuhängen. Bei der Mehrzahl der Pat. ist die Ifn-Therapie über einen mehr als<br />
dreijährigen Zeitraum durchführbar.<br />
Hochdosistherapie vs Ifn-Erhaltung<br />
Bei Pat.
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG-Studien<br />
Zytogenetische Untersuchung<br />
Im Rahmen der Studie „Niedrigmaligne <strong>Lymphome</strong>“ werden wissenschaftliche Begleitprogramme<br />
durchgeführt, insbesondere zytogenetische Untersuchungen. Dazu kann folgendes Material eingesandt<br />
werden.<br />
Lymphknoten<br />
anderes Tumorgewebe<br />
Pleuraerguß<br />
Ascites<br />
Blut <strong>und</strong> Knochenmark (hieraus Chromosomenanalyse nur bei zytologisch gesicherter<br />
Infiltration durch Blasten oder mehr als 10% Tumorzellen).<br />
Die Versendung erfolgt an ein regional zuständiges Referenzzentrum. Die Zuordnung der<br />
teilnehmenden <strong>Klinik</strong>en zum jeweiligen regionalen Referenzzentrum wird noch festgelegt werden.<br />
Vorerst soll die Materialversendung über das Institut für Humangenetik in Kiel organisiert werden.<br />
Anmeldung von Frischmaterial für zytogenetische Untersuchungen:<br />
Tumorzytogenetische Arbeitsgruppe<br />
PD Dr. R. Siebert<br />
Frau PD Dr. Harder<br />
Institut für Humangenetik<br />
Schwanenweg 24, 24105 Kiel<br />
Tel.: 0431 / 597 – 1784 ( Fr. Schneider, Fr. Jäger)<br />
Rückfragen: PD Dr. R. Siebert<br />
Tel.: 0431 / 597 – 1781<br />
0431 / 597 – 1787 ( Frau Dr. Harder)<br />
Fax: 0431 / 597 / 1880<br />
Ablauf<br />
Anmeldung des Materials per Telefon oder Fax im zuständigen Referenzzentrum (z.Zt. in Kiel) unter<br />
genauer Angabe von Datum, Uhrzeit <strong>und</strong> Ort, wo das Material abgeholt werden kann. Verpackung <strong>und</strong><br />
Bereitlegung des Materials an den angegebenen Ort in der <strong>Klinik</strong>. Der Transportauftrag an den<br />
Transportdienst erfolgt durch das zuständige Referenzzentrum.<br />
Versand- <strong>und</strong> Transportkosten können im Einzelfall nach telefonischer Rücksprache mit der<br />
Studienzentrale übernommen werden.<br />
157
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG, Myeloablative Radio-Chemotherapie, Pat < 60 Jahre<br />
Behandlungsplan<br />
Gr<strong>und</strong>lagen<br />
Im Gegensatz zu besseren Kenntnissen über die Biologie <strong>und</strong> die Pathogenese niedrigmaligner NHL<br />
sind die therapeutischen Möglichkeiten besonders der fortgeschrittenen Krankheitsstadien noch immer<br />
unbefriedigend. Dementsprechend besitzen die bisher verfügbaren zytostatischen<br />
Kombinationstherapien kein kuratives Potential. Auch der Einsatz intensiverer Regime, wie sie für die<br />
hochmalignen NHL zur Anwendung kommen, hat daran nichts gr<strong>und</strong>sätzliches geändert.<br />
Myeloablative Radio - Chemotherapie mit Stammzellensupport<br />
Eine Intensivierung der Chemo- <strong>und</strong> der Radiotherapie mit einer nachfolgenden Reinfusion von<br />
prätherapeutisch aus dem peripheren Blut gewonnenen autologen hämatopoetischen Stammzellen läßt<br />
es denkbar erscheinen, auch in fortgeschrittenen Stadien niedrigmaligner NHL eine Kuration zu<br />
erreichen.<br />
Da es sich um einen experimentellen Therapieansatz handelt, ist ein prospektiv randomisierter<br />
Vergleich mit einer Standardbehandlung erforderlich.<br />
Die Deutsche niedrigmaligne Non-Hodgkin-Lymphom-Studiengruppe hat ein Therapieprotokoll<br />
erarbeitet, das für Patienten bis maximal 60 Jahre mit den NHL-Typen CB/CC, CC, IC der Stadien III,<br />
IV bestimmt ist <strong>und</strong> in Anlehnung an die frühere NHL 01/89 Studie aus zwei Therapiephasen besteht.<br />
Therapieablauf<br />
Induktionsbehandlung - Therapie 1<br />
1. Randomisation:<br />
4 x CHOP<br />
4 x CHOP+Rituximab<br />
Restaging: CR: → Therapie 2;<br />
PR, MR, SD:<br />
zwei zusätzliche Zyklen CHOP oder CHOP+Rituximab<br />
Konsolidierungsbehandlung - Therapie 2<br />
2. Randomisation:<br />
Myeloablative Radio-Chemotherapie<br />
(Dexa-BEAM+HD-Endoxan + Ganzkörper RT) + PBSC-Support<br />
Konventionelle Therapie:<br />
2 x CHOP oder 2 x CHOP+Rituximab<br />
Entsprechend der 1. Randomisation.<br />
Nachfolgend Interferon-Alpha<br />
Achtung<br />
Seit<br />
*<br />
8/2003 wird nicht mehr randomisiert CHOP CHOP vs R-CHOP, vs R-CHOP, sondern sondern alle alle Patienten Patienten erhalten erhalten<br />
wegen der signifikant besseren Ergebnisse einheitlich R-CHOP.<br />
Künftig werden die MCL wegen ihrer ungünstigen Prognose nach einem eigenem, intensiveren<br />
Protokoll behandelt.<br />
158
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG, Myeloablative Radio-Chemotherapie, Pat. < 60 Jahre<br />
Flussdiagramm<br />
Patienten<br />
Patienten<br />
<<br />
<<br />
60<br />
60<br />
Jahre<br />
Jahre<br />
<strong>und</strong><br />
<strong>und</strong><br />
qualifiziert<br />
qualifiziert<br />
für<br />
für<br />
Stammzelltransplantation<br />
Stammzelltransplantation<br />
Prüfung Prüfung des des kurativen kurativen Potentials Potentials von von myeloablativer<br />
myeloablativer<br />
Radio-Chemotherapie mit mit peripherer peripherer<br />
Stammzelltransplantation in in erster erster Remission Remission<br />
Randomisation CHOP CHOP vs. vs. CHOP+Rituximab<br />
Therapie<br />
für<br />
refraktäre<br />
<strong>Lymphome</strong><br />
PD, SD<br />
2<br />
2<br />
Kurse<br />
Kurse<br />
CHOP<br />
CHOP<br />
o.<br />
o.<br />
CHOP+Rituxi.<br />
CHOP+Rituxi.<br />
CR, PR, MR, SD<br />
Randomisation Stammzelltransplantation<br />
versus versus alpha-Interferon Erhaltung<br />
2<br />
2<br />
Kurse<br />
Kurse<br />
CHOP<br />
CHOP<br />
o.<br />
o.<br />
CHOP+Rit.<br />
CHOP+Rit.<br />
PD SD<br />
PR, MR SD<br />
Therapie<br />
für<br />
refraktäre<br />
<strong>Lymphome</strong><br />
CR<br />
MR SD, PD<br />
2<br />
2<br />
Kurse<br />
Kurse<br />
CHOP<br />
CHOP<br />
o.<br />
o.<br />
CHOP+Rit.<br />
CHOP+Rit.<br />
PR<br />
CR<br />
Dexa-BEAM<br />
Dexa-BEAM<br />
mit<br />
mit<br />
anschließender<br />
anschließender<br />
Separation<br />
Separation<br />
periph.<br />
periph.<br />
Stammzellen<br />
Stammzellen<br />
2<br />
2<br />
Kurse<br />
Kurse<br />
CHOP<br />
CHOP<br />
o.<br />
o.<br />
CHOP+Rit.<br />
CHOP+Rit.<br />
PR, MR SD<br />
2<br />
2<br />
Kurse<br />
Kurse<br />
CHOP<br />
CHOP<br />
o.<br />
o.<br />
CHOP+Rit.<br />
CHOP+Rit.<br />
PR<br />
CR<br />
CR<br />
MR, SD PD<br />
PD SD<br />
Therapie<br />
für<br />
refraktäre<br />
<strong>Lymphome</strong><br />
2<br />
2<br />
Kurse<br />
Kurse<br />
CHOP<br />
CHOP<br />
o.<br />
o.<br />
CHOP+Rit.<br />
CHOP+Rit.<br />
als<br />
als<br />
Konsolidierungstherapie<br />
Konsolidierungstherapie<br />
myeloablative<br />
myeloablative<br />
Radio-<br />
Radio-<br />
Chemotherapie<br />
Chemotherapie<br />
mit<br />
mit<br />
Stammzellsupport<br />
Stammzellsupport<br />
Erhaltungstherapie<br />
Erhaltungstherapie<br />
mit<br />
mit<br />
alphaalpha-<br />
Interferon<br />
Interferon<br />
(3<br />
(3<br />
x<br />
x<br />
5<br />
5<br />
Mio.<br />
Mio.<br />
/<br />
/<br />
Woche)<br />
Woche)<br />
Beobachtung bis zum Rezidiv<br />
Beobachtung bis zum Rezidiv<br />
*<br />
Achtung<br />
Seit 8/2003 wird nicht mehr randomisiert CHOP vs R-CHOP, sondern alle Patienten erhalten<br />
wegen der signifikant besseren Ergebnisse einheitlich R-CHOP.<br />
Künftig werden die MCL wegen ihrer ungünstigen Prognose nach einem eigenem, intensiveren<br />
Protokoll behandelt.<br />
159
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG, Myeloablative Radio-Chemotherapie, Pat. < 60 Jahre<br />
Therapieablauf<br />
Durchführung der Behandlung<br />
1. Prüfen, ob die Einschluß- <strong>und</strong> Ausschlusskriterien erfüllt sind. Die Frage der Therapiebedürfigkeit<br />
relativiert sich für jüngere Patienten, bei denen die Kuration das angestrebte Behandlungsziel<br />
dargestellt.<br />
2. Erläuterung des Behandlungskonzeptes <strong>und</strong> Einverständniserklärung zur Teilnahme an der<br />
Studie vom Patienten unterschreiben lassen.<br />
3. Den Patienten der Studienzentrale melden <strong>und</strong> randomisieren lassen.<br />
4. Durchführung der initialen zytoreduktiven Chemotherapie entsprechend der Randomisation mit<br />
CHOP oder CHOP + Rituximab.<br />
Für die Patienten, die im Behandlungsteil 2 auf den Arm der myeloablativen Radio-Chemotherapie<br />
randomisiert wurden, ist eine frühzeitige Kontaktaufnahme zu einem Zentrum herzustellen, das die<br />
Kollektion der peripheren Blutstammzellen, deren Krypkonservierung <strong>und</strong> die Phase-2-<br />
Chemotherapie mit der Ganzkörperbestrahlung sicherstellen kann.<br />
Nach jeweils 2 Zyklen der CHOP- oder CHOP + Anti CD20 - Therapie ist ein Restaging<br />
erforderlich.<br />
Patienten, die bereits nach 4 Zyklen der Initialtherapie eine komplette Remission erreicht haben,<br />
erhalten keine weitere CHOP- oder CHOP + Anti CD20 - Therapie, sondern bekommen innerhalb<br />
von 4 - 6 Wochen nach Abschluß dieser Behandlung eine intensivierte Chemotherapie mit Dexa<br />
BEAM. Für Patienten, die nach 4 Zyklen noch keine CR erreicht haben, werden noch zwei weitere<br />
identische Zyklen angeschlossen. Ergibt das Restaging nach spätestens 6 Zyklen eine CR oder eine<br />
PR, erfolgt die Konsolidierungstherapie, die randomisiert vergleicht<br />
Arm A<br />
Dexa-BEAM mit anschließender PBSC-Gewinnung <strong>und</strong> anschließender myeloablativer Radio-<br />
Chemotherapie mit PBSC-Support.<br />
Arm B<br />
Noch zwei weitere Zyklen der Induktionschemotherapie. Anschließend Erhaltungstherapie mit<br />
Alpha-Interferon<br />
Wird nicht mindestens eine PR festgestellt, gilt der Patient als Therapieversager <strong>und</strong> fällt aus der<br />
Studie heraus. Der Pat. wird in diesem Falle als therapierefraktär eingestuft <strong>und</strong> symptomorientiert<br />
betreut.<br />
Arm A<br />
Myeloablative Radio-Chemotherapie<br />
Voraussetzung für diese Behandlung:<br />
Sorgfältiges Restaging wie oben beschrieben mit Überprüfung aller primären lymphombedingten<br />
Veränderungen.<br />
Außerdem Funktionsdiagnostik: EKG, Lungenfunktionsanalyse, Echokardiographie.<br />
Nach Feststellung der Erfüllung der Kriterien zur myeloablativen Radio-Chemotherapie Überweisung<br />
des Patienten in das Zentrum, das diesen Therapieteil durchführt.<br />
Arm B<br />
Alpha-Interferon-Erhaltungstherapie<br />
Restaging wie oben, aber ohne die zusätzliche Funktionsdiagnostik.<br />
Konsolidierungstherapie mit zwei Zyklen CHOP + Anti CD20.<br />
Einleitung der subkutanen Alpha-Interferontherapie mit 5 Mio. IE 3x pro Woche als Selbstmedikation<br />
durch den Patienten.<br />
160
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG, Myeloablative Radio-Chemotherapie, Pat. 1 G/l beträgt. Es müssen mindestens zwei<br />
Asservate (zur Transplantation <strong>und</strong> als Back-up) gewonnen werden.<br />
Wenn nicht genügend CD34 + Zellen zu gewinnen waren, wird 2-3 Wochen später ein erneuter<br />
Separationsversuch unternommen. Zur Stammzellmobilisierung erhalten die Pat. dann eine alleinige<br />
G-CSF-Stimulation in einer Dosierung von 2 x 10 – 15 μg/kg/KG/d.<br />
Mit der Separation kann begonnen werden, wenn die CD34+Zellen mehr als 20/μl ausmachen. Eine<br />
Bestimmung der CD34+Zellen ist erforderlich, da trotz hoher Leukozytenzahlen von >50 G/l der<br />
Stammzellenanteil
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG, Myeloablative Radio-Chemotherapie, Pat. < 60 Jahre<br />
HD-Endoxan, Ganzkörperbestrahlung, PBSC-R<br />
Voraussetzung<br />
Die kombinierte Radio-Chemotherapie mit peripherer Blutstammzellen-Reinfusion wird innerhalb von<br />
zwei Monaten nach Abschluß der Dexa-BEAM-Therapie durchgeführt. Voraussetzung ist:<br />
• eine anhaltende CR oder PR,<br />
• ein suffizientes Leukapheresat mit 2,5 - 4,0 x 10 6 /kg/KG CD34+Stammzellen,<br />
• keine Kontraindikation gegen die myeloablative Kombinationstherapie.<br />
Therapieplan<br />
Tag -6, -5, -4 : Fraktionierte Ganzkörperbestrahlung<br />
Tag -3, -2 : Chemotherapie mit Endoxan<br />
Tag 0 : Reinfusion der peripheren Stammzellen<br />
Fraktionierte Ganzkörperbestrahlung<br />
Diese Bestrahlungsart ist apparativ <strong>und</strong> personell anspruchsvoll. Die therapieführende <strong>Klinik</strong> muß mit<br />
der Technik der Ganzkörperbestrahlung vertraut sein.<br />
Es werden an Tagen -6, -5, -4 je 2 Fraktionen pro Tag mit jeweils 2 Gy appliziert mit Reduktion der<br />
Lungendosis auf 2/3 der Körperdosis. Gesamtdosis an den drei Tagen 12 Gy.<br />
Die Bestrahlungstechnik wie bilaterale Gegenfelder mit oder ohne Kombination der Anterior-<br />
Posterior-Bestrahlung bleibt der jeweiligen <strong>Klinik</strong> überlassen. Vorzugsweise wird eine a.-p./p.-a.-<br />
Bestrahlung gewählt.<br />
Hochdosis-Endoxantherapie<br />
Endoxan 60 mg/kg/KG/d Inf. 1h Tag -3, -2<br />
Uromitexan 20 mg/kg/KG/d h: 0, 4, 8, 12 Tag -3, -2<br />
Für ausreichende Diurese (> 100 ml/h) sorgen. Dafür ist mit mindestens 2000 ml/m²/d Ringer-Lösung<br />
für 72 St<strong>und</strong>en zu wässern. 6-stündlich Einfuhr-, Ausfuhrbilanz machen. Bei einem<br />
Ausscheidungsdefizit > 1000 ml 20 mg Furosemid i.v.. Urin-pH > 7 halten, gegebenenfalls NaHCO 3<br />
hinzufügen. Siehe Blatt: Plasmozytom, Düsseldorfer Studie, Therapieprotokoll 1, Therapieregime.<br />
Antiemese mit einem Serotonin-Antagonisten sicherstellen.<br />
Stammzellen-Reinfusion (PBSC-R)<br />
Reinfusion der autologen peripheren Stammzellen als Kurzinfusion am Tag 0.<br />
Im Anschluß an die PBSC-R-Therapie Gabe von G-CSF 5 µg/kg/KG/d s.c. bis zum Erreichen einer<br />
Granulozytenzahl von > 1000/µl.<br />
162
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG-Studie, Patienten ≥ 60 Jahre<br />
Ein-, Ausschlusskriterien<br />
Gr<strong>und</strong>lagen<br />
Für die Mehrzahl der Patienten mit niedrigmalignem NHL im Stad. III oder IV ist eine auf Kuration<br />
angelegte Therapie nicht durchführbar oder nicht sinnvoll. Patienten, die nicht myeloablativ behandelt<br />
werden können, erhalten im Rahmen der Hiddemann-Studie eine konventionelle Chemotherapie<br />
CHOP + Rituximab mit jeweils 6-8 Zyklen. Anschließend erfolgt eine Erhaltungstherapie mit<br />
Interferon in Standarddosis. Eine Zwischenauswertung in 2001 hatte keinen signifikanten Vorteil für<br />
den ursprünglich bestehenden Randomisationsarm mit intensivierter Interferonerhaltung gezeigt.<br />
Studiensekretariat<br />
Prof. Dr. W. Hiddemann, Dr. M. Unterhalt<br />
Ludwig-Maximilian-Universität München, <strong>Klinik</strong>um Großhadern, Medizinische <strong>Klinik</strong> III,<br />
Tegenseer Landstraße 243, 81549 München, Tel. 089 / 6995830, Fax: 089 / 69958312.<br />
Einschluss-, Ausschlusskriterien; Definition der Therapiebedürftigkeit<br />
Entsprechen dem myeloablativen Therapieprotokoll (Siehe Blatt: indolente <strong>Lymphome</strong>, Mantelzell-L,<br />
Stad. III, IV, Myeloablative Radio-Chemotherapie).<br />
Ausnahme: Mantelzelllymphome, sie werden allein aufgr<strong>und</strong> der Diagnose behandelt, wiesen in einer<br />
Zwischenauswertung von 5/2002 ein signifikant besseres Ansprechen im CHOP – Rituximab – Arm<br />
auf (OR 97% vs. 69%) <strong>und</strong> sollen zukünftig einheitlich mit CHOP + Rituximab behandelt werden. *<br />
Referenzpathologie<br />
Die Teilnahme an der Studie setzt eine histologische Reevaluation des Lymphknotenmaterials durch einen der<br />
drei Referenzpathologen voraus:<br />
Prof. Dr. R. Parwaresch, Kiel<br />
Prof. Dr. H. Stein, Berlin<br />
Prof. Dr. K. Müller-Hermelink, Würzburg<br />
Konventionelle Therapie<br />
Erhalten Pat. > 60 Jahre oder wenn eine relevante Komorbidität eine myeloablative Therapie ausschließt.<br />
Therapieablauf<br />
R<br />
4 x CHOP * Nach Restaging: noch 2 – 4 x CHOP<br />
4 x CHOP + Rituximab Nach Restaging: noch 2 – 4 x CHOP +<br />
Rituximab<br />
Die weitere Therapie hängt von dem Behandlungsergebnis ab, das beim Restaging nach 4 Zyklen<br />
festgestellt wird.<br />
Restagingergebnis: CR : 2 x CHOP + Rituximab<br />
PR : 4 x CHOP + Rituximab<br />
Pat. mit minor response oder mit Progress<br />
scheiden aus der Studie aus.<br />
Erhaltung mit Alpha-Interferon 5 Mio IE 3x/Woche s.c. unlimitiert bis zum Rezidiv<br />
*<br />
Achtung<br />
Seit 8/2003 wird nicht mehr randomisiert CHOP vs R-CHOP, sondern alle Patienten erhalten wegen<br />
der signifikant besseren Ergebnisse einheitlich R-CHOP.<br />
Künftig werden die MCL wegen ihrer ungünstigen Prognose nach einem eigenem, intensiveren<br />
Protokoll behandelt.<br />
163
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG-Studie, Pat. ≥ 60 Jahre<br />
Flussdiagramm<br />
Studiendesign zur Behandlung therapiebedürftiger NHL vom niedrigen Malignitätsgrad. Dieses<br />
Therapieregime ist vorgesehen für Pat. > 60 Jahre <strong>und</strong> für die Pat., bei denen eine myeloablative<br />
Therapie wegen patientenseitiger Gründe nicht durchführbar ist.<br />
Gegenüber der ursprünglichen Fassung des Studienablaufes wurde die zweite Randomisation, die eine<br />
Unterschiedlichkeit der Interferondosierung betraf, weggelassen.<br />
*<br />
Erhaltungstherapie mit<br />
Alpha-Interferon<br />
3 x 5 Mio. / Woche<br />
*<br />
Achtung<br />
Seit 8/2003 wird nicht mehr randomisiert CHOP vs R-CHOP, sondern alle Patienten erhalten<br />
wegen der signifikant besseren Ergebnisse einheitlich R-CHOP.<br />
Künftig werden die MCL wegen ihrer ungünstigen Prognose nach einem eigenem, intensiveren<br />
Protokoll behandelt.<br />
164
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG – Studien, Pat. < 60 Jahre, Pat. ≥ 60 Jahre<br />
CHOP vs. CHOP + Rituximab<br />
Entsprechend der Randomisation erhalten die für die Studie qualifizierten Patienten eine Chemotherapie<br />
entweder nach dem CHOP- oder dem CHOP Anti CD20-Protokoll. Im konventionellen Arm werden 6 – 8<br />
Chemotherapiezyklen mit oder ohne Rituximab durchgeführt <strong>und</strong> als Erhaltungstherapie Interferon in<br />
Standarddosierung gegeben.<br />
CHOP<br />
Cyclophosphamid 750 mg/m 2 1000 ml NaCl Tag 1<br />
Uromitexan 300 mg (abs.) i.v. h 0,4,8 Tag 1<br />
Adriamycin 50 mg/m 2 i.v. Bypass Tag 1<br />
Vincristin 2 mg (abs.) i.v. Bypass Tag 1<br />
Prednison 100 mg/ m 2 /d p.o. Tag 1 - 5<br />
Wiederholung: Tag 22<br />
CHOP + Rituximab –Therapie<br />
Der oben genannten Therapie wird einen Tag vorher, also am Tag 0 eine Antikörpertherapie mit Mabthera®<br />
vorangestellt. Dosierung 375 mg/m 2 . Zur besseren Handhabung eines evtl. auftretenden cytokine-releasingsyndromes<br />
sollte zumindest der erste Zyklus dieser Therapie unter krankenhausähnlichen Bedingungen gegeben<br />
werden. (Anwendungsmodus, Begleitmedikation siehe Manualblatt Mabthera). Ab Zyklus 2 kann Rituximab am<br />
gleichen Tag, vor der CHOP-Medikation gegeben werden.<br />
R-CHOP<br />
Rituximab 375 mg/m² i.v. Inf. Tag 0*<br />
Cyclophosphamid 750 mg/m 2 1000 ml NaCl Tag 1<br />
Uromitexan 300 mg (abs.) i.v. h 0,4,8 Tag 1<br />
Adriamycin 50 mg/m 2 i.v. Bypass Tag 1<br />
Vincristin 2 mg (abs.) i.v. Bypass Tag 1<br />
Prednison 100 mg/ m²/d p.o. Tag 1 – 5<br />
Wiederholung: Tag 22<br />
Mabthera® als Kombinationspartner für CHOP wurde auf der Gr<strong>und</strong>lage internationaler Daten ausgewählt. Es<br />
besteht ein synergistischer Effekt zwischen Rituximab <strong>und</strong> den Zytostatika des CHOP-Schemas.<br />
Monotherapiestudien mit Mabthera bei vorbehandelten follikulären <strong>Lymphome</strong>n zeigen eine Ansprechrate<br />
zwischen 43% <strong>und</strong> 50%. Begrenzte Erfahrungen bei nicht vorbehandelten follikulären <strong>Lymphome</strong>n zeigen eine<br />
Gesamtansprechrate von 65%. In Kombination mit CHOP sind diese Ansprechraten noch weiter steigerbar wie<br />
die bisherigen Ergebnisse der randomisierten Studien der GLSG zeigen. Die Responseraten der Rituximabhaltigen<br />
Arme waren sowohl in der First-line- als auch in der Rezidivtherapie signifikant überlegen, so dass die<br />
Randomisation beendet <strong>und</strong> die Behandlung nur mit dem Rituximab-Arm weitergeführt wurde. Am<br />
markantesten waren die Unterschiede in der Therapie der Mantelzell-<strong>Lymphome</strong>.<br />
Alpha-Interferon<br />
Wird als Erhaltungstherapie gegeben für alle Patienten, die durch die Induktionschemotherapie mindestens eine<br />
PR erreicht haben.<br />
Dosierung<br />
Interferon 5 Mio. IE s.c. 3x/Woche<br />
Erlaubt ist auch ein Beginn mit 3 x 3 Mio. E s.c. /Woche, um das Nebenwirkungsprofil klein zu halten. Im<br />
Verlauf sollte dann sukzessive auf 5 Mio. E pro Gabe gesteigert werden.<br />
Die Interferontherapie ist zeitlich nicht limitiert. Bei Auftreten eines Rezidivs oder einer Progression wird die<br />
Ifn-Therapie beendet.<br />
165
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong>, Stad. III, IV<br />
GLSG-Studien<br />
Restagingdiagnostik<br />
Zwischenstaging nach 2 Zyklen Chemotherapie<br />
- Anamnese <strong>und</strong> körperliche Untersuchung mit genauer Dokumentation der Lymphommanifestationen<br />
- Abdomen-Sonogramm, Röntgen-Thorax<br />
- Laboruntersuchungen (vollständiges Blutbild, LDH, Kreatinin, Transaminasen, Bilirubin,<br />
Gesamteiweiß, Elektrophorese, Immunglobuline quantitativ, Cholestaseparameter, Urinstatus)<br />
Zwischenstaging nach 4 Zyklen<br />
Überprüfung aller lymphombedingten Veränderungen vor Therapie.<br />
- Anamnese <strong>und</strong> körperliche Untersuchung mit genauer Dokumentation der Lymphommanifestationen<br />
(Therapieverlaufsbogen)<br />
- Röntgen-Thorax p.a. <strong>und</strong> seitlich, fakultativ Thorax-CT<br />
- Abdomen-Sonogramm, fakultativ Abdomen-CT<br />
- Knochenszintigramm, wenn primär pathologisch verändert<br />
- Knochenmarkzytologie <strong>und</strong> -histologie, wenn primär befallen<br />
- ggf. weitere Diagnostik zur Verlaufsbeurteilung von anderen Lymphommanifestationen<br />
- Laboruntersuchungen wie oben, EKG<br />
Definitives Restaging nach 6 oder 8 Zyklen<br />
- wie Zwischenstaging nach 4 Zyklen<br />
Diagnostik vor myeloablativer Radio-Chemotherapie<br />
Ergänzend zum definitiven Restaging :<br />
- EKG, Echokardiographie, Lungenfunktionstest.<br />
166
Mantelzell-<strong>Lymphome</strong><br />
EORTC, MCL-Studien 06-97; 2003<br />
Übersicht<br />
Sonderstellung des MCL unter den indolenten <strong>Lymphome</strong>n<br />
Mantelzell-<strong>Lymphome</strong> (MCL) zählten lange zu einer<br />
klinisch <strong>und</strong> morphologisch nur eingeschränkt<br />
einzuordnenden Entität, die den niedrigmalignen<br />
<strong>Lymphome</strong>n zugeordnet wurde. Die MCL weisen eine<br />
schlechte Prognose mit einem mittleren Überleben von<br />
nur 3-4 Jahren auf. Die Einstufung als ein indolentes<br />
Lymphom ist deshalb problematisch. Die Biologie des<br />
MCL wird treffender mit der Bezeichnung intermediärmalignes<br />
Lymphom wiedergegeben. Die<br />
Deutsche Studiengruppe für niedrigmaligne <strong>Lymphome</strong><br />
MCL. Sehr geringe Raten progressionsfreiem Überlebens<br />
mit koventioneller Therapie. EORTC-Daten.<br />
(GLSG) hat der Sonderstellung der MCL bereits in den<br />
ersten Studiengenerationen Rechnung getragen. Anders<br />
als bei den übrigen niedrigmalignen <strong>Lymphome</strong>n stellte<br />
die Diagnose eines MCL an sich bereits eine Behandlungsindikation<br />
dar. Erste Daten zeigten zwar einen Erfolg einer anthrazyklinhaltigen Chemotherapie <strong>und</strong> der<br />
Interferon-Erhaltungstherapie. Kurative Ansätze waren nur in den Stadien I, II mittels Bestrahlung möglich.<br />
Auch bei diesen Patienten kam es häufiger zu Rezidiven. Somit stellen MCL eine <strong>Lymphome</strong>ntität mit noch<br />
unbefriedigendem Verlauf dar.<br />
Hochdosistherapie<br />
Eine Verbesserung der Therapieergebnisse ist ein vordringliches Ziel der Lymphomforschung. Eine<br />
Hochdosistherapie mit darauffolgender Stammzelltransfusion erscheint als eine Erfolg versprechende<br />
Möglichkeit. Bei aggressiven <strong>Lymphome</strong>n im Rezidiv <strong>und</strong> indolenten <strong>Lymphome</strong>n in der Erstlinientherapie<br />
konnte ein Vorteil für die Hochdosistherapie gezeigt werden.<br />
In einer Vorläuferstudie, die von der German Low Grade Lymphoma Study Group (GLSG) in Kooperation mit<br />
der EORTC Lymphoma Study Group, der Groupe D'Etudes des <strong>Lymphome</strong>s De l' Adulte <strong>und</strong> der Italian<br />
Lymphoma Intergroup durchgeführt wurde, zeigte sich in einer Zwischenauswertung nach 130 von geplanten<br />
180 Patienten ein signifikanter Vorteil für eine Hochdosistherapie mit autologer Stammzelltransplantation nach<br />
Remissionsinduktion durch ein CHOP-ähnliches Protokoll in Bezug auf progressionsfreies Überleben. Für das<br />
Overall Survival ist dieser Unterschied derzeit nicht nachzuweisen.<br />
Der CD20-Antikörper Rituximab hat in der Studie der GLSG einen signifikanten Vorteil für R-CHOP<br />
gegenüber CHOP gezeigt, der sich bei den, meist hoch CD20-positiven, MCL besonders ausgeprägt war.<br />
European MCL Network<br />
Aus diesem Gr<strong>und</strong> soll in einer neu aufgelegten Studie des jetzt umbenannten ‚European MCL Network’ die<br />
Therapie mit R-CHOP, gefolgt von Ganzkörperbestrahlung + HD-Endoxan <strong>und</strong> ASZT verglichen werden mit<br />
einer Therapie aus 3 Zyklen CHOP/DHAP + Rituximab mit nachfolgender HD-Ara-C/Melphalan-Therapie <strong>und</strong><br />
Ganzkörperbestrahlung.<br />
Die Studie wird im Folgenden vorgestellt, auch wenn das Protokoll noch nicht in der endgültigen Form vorliegt,<br />
die Aktivierung ist für das Frühjahr 2004 geplant.<br />
MCL bei älteren Patienten<br />
Da eine Hochdosis für ältere Patienten meist zu toxisch ist, wurde in einer neuen Studiengeneration des<br />
European MCL Network eine gesonderte Studie aufgelegt, in der R-CHOP mit R-FC (Fludarabin,<br />
Cyclophosphamid) randomisiert verglichen werden soll, gefolgt von alternativ Rituximab- oder IFN-Erhaltung.<br />
Gr<strong>und</strong> für diesen Vergleich sind vielversprechende Ergebnisse der GLSG mit FCM in der Rezidivtherapie bei<br />
gleichzeitig guter Verträglichkeit.<br />
EORTC <strong>und</strong> European MCL Network<br />
Bis zur Aktivierung des European MCL Network Trial, der die zweite Generation der MCL-Protokolle darstellt,<br />
bleibt die EORTC-Studie der MCL noch offen. In Deutschland erhalten die Patienten eine<br />
Induktionschemotherapie mit R-CHOP, die Randomisation zwischen IFN-Erhaltung <strong>und</strong> Hochdosistherapie<br />
bleibt bestehen, zumal im Rezidivfall ohnehin ein Crossover vorgesehen ist.<br />
167
Mantelzell-<strong>Lymphome</strong><br />
EORTC, MCL-Studie 06-97<br />
Ein-, Ausschlusskriterien<br />
Studienziele<br />
Prospektiv randomisierte Prüfung von myeloablativer Radio-Chemotherapie mit peripherer<br />
Stammzelltransplantation im Vergleich zu konventioneller Erhaltungstherapie mit Interferon-alpha<br />
nach initialer zytoreduktiver Chemotherapie mit einem anthracyclinhaltigen oder anthrachinonhaltigen<br />
Schema bei Patienten mit gesichertem Mantelzell-Lymphom anhand folgender Parameter:<br />
Vergleich der Zeit des krankheitsfreien Überlebens nach erster Remission, Vergleich der<br />
Überlebenszeit bei initialer Stammzelltransplantation in erster Remission versus Stammzelltransplantation<br />
in zweiter oder späterer Remission, Vergleich der Überlebenszeit mit einer historischen<br />
Kontrollgruppe.<br />
Patientenkollektiv <strong>und</strong> Einschlusskriterien<br />
Νicht vorbehandelte Patienten mit Mantelzell-Lymphom nach der R.E.A.L.-Klassifikation (nach Kiel-<br />
Klassifikation: centrocytisches Lymphom oder centroblastisches Lymphom vom centrocytoiden<br />
Subtyp, welches der blastoiden Variante des Mantelzell-Lymphoms entspricht.)<br />
Stadium III oder IV<br />
Alter > 18 Jahre <strong>und</strong> ≤ 65 Jahre<br />
Ausschlusskriterien<br />
- Option einer primären, potentiell kurativen Strahlentherapie<br />
- Alter < 18 oder > 65 Jahre<br />
- ECOG Performance Status > 2<br />
- Schwere Begleiterkrankungen, die keine protokollgerechte Therapiedurchführung erlauben.<br />
Behandlungsplan<br />
Patienten, die die Einschlusskriterien erfüllen, werden initial randomisiert für eine Therapie in<br />
Remission mit myeloablativer Radio-Chemotherapie <strong>und</strong> Stammzelltransplantation versus<br />
konventionelle Erhaltungstherapie mit Interferon alpha. Zunächst wird entsprechend den Vorgaben des<br />
behandelnden Zentrums bzw. der teilnehmenden Studiengruppe eine initiale zytoreduktive<br />
Chemotherapie eingeleitet.<br />
Alle Patienten erhalten im Rahmen dieser initialen Therapie zunächst vier Therapiekurse, soweit keine<br />
Progredienz des Lymphoms unter Therapie auftritt. Bei Patienten, die nach vier Zyklen eine komplette<br />
Remission (keine nachweisbaren Lymphommanifestationen mehr) erreicht haben, wird nach diesen<br />
vier Zyklen die initial durch Randomisation zugeordnete Therapie in Remission eingeleitet; wurde<br />
keine komplette Remission erreicht, so erhalten die Patienten zwei weitere Kurse der initialen<br />
Therapie. Wird hiermit mindestens eine partielle Remission (mindestens 50% Reduktion der initialen<br />
Tumormasse, maximal 20% Knochenmarkinfiltration <strong>und</strong> keine peripher zirkulierenden<br />
Lymphomzellen im Ausstrich) erreicht, so wird ebenfalls anschließend die initial durch Randomisation<br />
zugeordnete Therapie in Remission eingeleitet.<br />
Patienten, bei denen nach sechs Therapiezyklen die Kriterien einer partiellen Remission nicht erreicht<br />
sind, werden wie Patienten mit Progredienz des Lymphoms außerhalb der Studie behandelt. Patienten,<br />
die initial für eine konventionelle Erhaltungstherapie mit Interferon alpha randomisiert wurden,<br />
erhalten zwei weitere Therapiezyklen der initialen zytoreduktiven Chemotherapie als Konsolidierung<br />
<strong>und</strong> anschließend eine Erhaltungstherapie mit Interferon alpha. Bei Patienten, die initial für<br />
myeloablative Radio-Chemotherapie <strong>und</strong> Stammzelltransplantation randomisiert wurden, wird nach<br />
vier bis acht Wochen die intensivierte Chemotherapie mit Stammzellseparation eingeleitet. Nach<br />
erfolgreicher Stammzellseparation erfolgt anschließend die myeloablative Radio-Chemotherapie mit<br />
Stammzellretransfusion.<br />
Bei Patienten, die unter Interferon-Erhaltungstherapie einen Progreß des Lymphoms aufweisen, soll<br />
eine erneute Remission des Lymphoms durch eine zytoreduktive Chemotherapie angestrebt werden. In<br />
zweiter Remission soll dann geprüft werden, ob eine myeloablative Radio-Chemotherapie <strong>und</strong><br />
Stammzelltransplantation entsprechend der Vorgehensweise in dieser Studie durchgeführt werden<br />
kann.<br />
168
Flussdiagramm MCL-Studie<br />
Mantelzell-<strong>Lymphome</strong><br />
EORTC, MCL-Studie 06-97<br />
Flussdiagramm<br />
169
Mantelzell-<strong>Lymphome</strong><br />
EORTC, MCL-Studie 06-97<br />
Therapieschemata<br />
Die initiale Therapie wird durch das behandelnde Zentrum innerhalb der Studie festgelegt; dabei sollten nur<br />
Therapieschemata mit vergleichbarer Intensität zu den unten genannten Schemata zur Anwendung kommen. Im<br />
Rahmen der Deutschen Studiengruppe für niedrig maligne <strong>Lymphome</strong> sollte die Therapie innerhalb der<br />
aktuellen Studie für nicht vorbehandelte niedrig maligne <strong>Lymphome</strong> randomisiert mit CHOP oder MCP<br />
erfolgen. Da diese Randomisation nach einem signifikanten Vorteil im Juli 1998 bei Patienten mit geplanter<br />
Stammzelltransplantation beendet wurde, werden alle Patienten der Deutschen Studiengruppe, die für diese<br />
Studie qualifizieren, der CHOP-Therapie zugeordnet.<br />
CHOP-21<br />
Cyclophosphamid * 750 mg/m 2 i.v. Tag 1<br />
Uromitexan 300 mg/m 2 0, 4 <strong>und</strong> 8 h nach Cyclophosphamid<br />
Doxorubicin 50 mg/m 2 i.v. Tag 1<br />
Vincristin 2 mg i.v. Tag 1<br />
Prednison 100 mg/m 2 p.o. Tag 1-5<br />
Wiederholung Tag 22<br />
Außerdem sind bei der international angelegten Studie folgende Protokolle zugelassen:<br />
CNOP<br />
Cyclophosphamid * 750 mg/m 2 i.v. Tag 1<br />
Uromitexan 200 mg/m 2 0, 4 <strong>und</strong> 8 h nach Cyclophosphamid<br />
Mitoxantron 12 mg/m 2 i.v. Tag 1<br />
Vincristin 2 mg i.v. Tag 1<br />
Prednison 100 mg p.o. Tag 1-5<br />
Wiederholung Tag 22-29<br />
* Uroprotektion mit Mesna 20% der Cyclophosphamiddosis<br />
MCP<br />
Mitoxantron 8 mg/m 2 i.v. Tag 1 <strong>und</strong> 2<br />
Chlorambucil 3x3 mg/m 2 p.o. Tag 1-5 (alle 8h)<br />
Prednison ** 25 mg p.o. Tag 1-5<br />
Wiederholung Tag 29<br />
Behandlungsschemata für die Therapie in Remission<br />
Intensivierte Chemotherapie <strong>und</strong> Stammzellseparation<br />
Die intensivierte Chemotherapie mit Dexa-BEAM soll innerhalb von 4 bis 8 Wochen nach Abschluß der<br />
initialen zytoreduktiven Therapie erfolgen.<br />
Dexa-BEAM<br />
Dexamethason 3 x 8 mg p.o. Tag 1-10<br />
BCNU 60 mg/m 2 i.v. (30min) Tag 2<br />
Melphalan 20 mg/m 2 i.v. (5min) Tag 3<br />
Ara-C 2 x 100 mg/m 2 i.v. Tag 4-7 alle 12h<br />
Etoposid 75/m 2 mg p.o. Tag 4-7<br />
G-CSF 5-10µg/kg Ab Tag 8 bis zur Leukapherese<br />
** Künftig wird in allen Studien der GLSG <strong>und</strong> der europäischen MCL-Gruppe die Standarddosis von 100 mg<br />
Prednison absolut verwendet.<br />
170
Mantelzell-<strong>Lymphome</strong><br />
EORTC, MCL-Studie 06-97<br />
Hochdosistherapie<br />
Myeloablative Radio-Chemotherapie mit peripherer Stammzelltransplantation<br />
Die myeloablative Radio-Chemotherapie mit peripherer Stammzelltransplantation soll innerhalb von<br />
zwei Monaten nach Abschluß der intensivierten Chemotherapie mit Stammzellgewinnung<br />
durchgeführt werden.<br />
Voraussetzungen<br />
Anhaltende komplette bzw. partielle Remission des Lymphoms<br />
Asservation von mindestens 2,0 - 2,5 x 10 6 /kg Körpergewicht CD 34+ Stammzellen zur<br />
Transplantation <strong>und</strong> als "Back-up"<br />
Keine Kontraindikationen gegen das konzipierte Therapiekonzept<br />
Durchführung<br />
- Fraktionierte Ganzkörperbestrahlung mit 12 Gy an den Tagen -6 bis -4<br />
- Cyclophosphamid 60mg/kg KG pro Tag an den Tagen -3 <strong>und</strong> -2,<br />
- Stammzell-Retransfusion Tag 0 (2,0 – 2,5 x 10 6 /kg KG CD 34+ Zellen)<br />
- G-CSF 5 µg/kg ab Tag 1 tägl., bis Leukozyten > 1000/m3<br />
Erhaltungstherapie mit Interferon alpha<br />
Konventionelle, intermittierende Erhaltungstherapie mit Interferon alpha:<br />
Anfangsdosis: 3 x 5 Mio. IE absolut pro Woche<br />
Dosisreduktion: In Abhängigkeit von therapieassoziierten Nebenwirkungen<br />
Hierzu sollte, zumindest in der Anfangsphase, eine Begleitmedikation mit Paracetamol erfolgen, die<br />
Interferon-Injektion erfolgt zweckmäßig in den Abendst<strong>und</strong>en.<br />
Randomisation<br />
Randomisiert wird stratifiziert nach Risikofaktoren <strong>und</strong> Institution per Telefon <strong>und</strong> Fax vor<br />
Therapiebeginn:<br />
Dr. M. Unterhalt<br />
Medizinische <strong>Klinik</strong> III<br />
Universitätsklinikum Großhadern<br />
Tegernseer Landstr. 243<br />
81549 München<br />
Tel.: 089-6995-83-0 /-10<br />
Fax: 089-6995-83-12<br />
171
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network-Studien 2003<br />
Übersicht, Patienten 18-65 Jahre<br />
European Intergroup on Mantle cell lymphoma<br />
Zweiarmige multizentrische prospektive Phase III-Studie der deutschen GLSG, der französischen<br />
GELA, der niederländischen HOVON <strong>und</strong> der EORTC Lymphoma group.<br />
Voraussetzung: Referenz-pathologisch bestätigte Diagnose eines Mantelzell-Lymphoms. Stadien IE<br />
<strong>und</strong> ≥ II. In Abhängigkeit vom Lebensalter wird die Studie in zwei unterschiedlichen Formen<br />
durchgeführt.<br />
Zwei Studien des European MCL Network 2003<br />
Patienten 18 –64 Jahre<br />
Immuno-Chemotherapie + myeloablative Radio-Chemotherapie mit autologem Stammzellsupport.<br />
Patienten ≥ 65 Jahre <strong>und</strong> 60-65 Jahre, nicht geeignet für eine Hochdosistherapie<br />
Immuno-Chemotherapie + Interferon oder Rituximab<br />
Hochdosistherapie, Patienten 18-65 Jahre<br />
Flussdiagramm<br />
Mantelzell-Lymphom, Stadium IE <strong>und</strong> ≥2, Alter 18-65 Jahre<br />
R-CHOP21 x 3<br />
Woche 0, 3, 6<br />
R-CHOP / R-DHAP x 2<br />
Alle 7 Wochen<br />
Evaluation<br />
Woche 8<br />
SD, PD<br />
Evaluation<br />
Woche 12-14<br />
MRD<br />
MRD<br />
Response<br />
Response >50%<br />
R-CHOP21 x 3<br />
Woche 9, 12, 15<br />
Off<br />
Study<br />
R-CHOP / R-DHAP<br />
Woche 21<br />
MRD<br />
Evaluation<br />
Woche 18<br />
Response >50%<br />
Response<br />
50%<br />
Hochdosistherapie<br />
TBI 10 Gy + Ara-C + Melphalan<br />
Woche 25-30<br />
Hochdosistherapie<br />
Cyclophosphamid +TBI<br />
Woche 25-30<br />
172
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. 18-65 Jahre, Studie 2003<br />
Ein-, Ausschlusskriterien<br />
Studiendesign<br />
In dieser Studie wird bei Patienten zwischen 18 <strong>und</strong> 65 Jahren eine Induktionstherapie aus 8 Zyklen R-CHOP<br />
verglichen mit 3 Zyklen R-CHOP/DHAP, es folgt gr<strong>und</strong>sätzlich eine Hochdosistherapie mit autologer<br />
Stammzelltransplantation, wobei zur Mobilisierung im Arm 1 Dexa-BEAM, im Arm 2 der 3. Zyklus R-<br />
CHOP/DHAP zur Anwendung kommt, transplantiert wird im Arm 1 nach HD-Endoxan, im Arm 2 nach HD<br />
Ara-C + Melphalan, beide kombiniert mit Ganzkörperbestrahlung.<br />
In dieser Phase III-Studie sollen insgesamt etwa 270 Patienten randomisiert werden, die geplante Dauer der<br />
multinationalen Studie wird etwa 3 Jahre sein.<br />
Studienziele: Time To Treatment Failure (TTTF), CR-Rate <strong>und</strong> Overall Survival<br />
Studienzentrale für Deutschland<br />
PD Dr. M. Dreyling, Prof. Dr. W. Hiddemann, Dr. M. Unterhalt, GLSG<br />
Universitätsklinikum Großhadern / LMU, III. Medizinische <strong>Klinik</strong>, Marchioninistr. 15<br />
81549 München<br />
Telefonnummer für Randomisation: 089-6995-830, Fax 089 / 6995-8312<br />
Einschlusskriterien<br />
Histologischer Nachweis eines MCL nach der WHO-Klassifikation<br />
Klinische Stadien II, III, IV<br />
Patienten mit multipler Polyposis <strong>und</strong> alleiniger KM-Beteiligung sind randomisierbar, werden jedoch nur bei<br />
Erreichen einer CR(u) nach der Induktion ausgewertet.<br />
Keine Vorbehandlung<br />
WHO Performance Status 0-2<br />
Alter 18-65 Jahre<br />
Einverständniserklärung des Patienten<br />
Ausschlusskriterien<br />
WHO-Performance Status 3 oder höher<br />
Bekannte Reaktivität von Anti-murinen Antikörpern oder bekannte Überempfindlichkeit<br />
Nicht eindeutig lymphombedingte Leukopenie 2,5x ONW, wenn nicht lymphombedingt<br />
Kreatinin >2xONW, alters- <strong>und</strong> gewichtskorrigiert, wenn nicht lymphombedingt<br />
Chronische Hepatitis B oder C Infektion oder bekannte HIV-Positivität<br />
Nicht kontrollierte Infektion<br />
Schwerwiegende Depression, die in den letzten 5 Jahren therapiebedürftig war<br />
Jedwede psychologische, soziologische oder geographische Situation, die die Therapiecompliance zum<br />
Studienprotokoll oder der Nachsorge verhindern könnte.<br />
Schwangerschaft<br />
Koronare Herzerkrankung<br />
Stadium I außer Multipler Polyposis<br />
Z.n. Stammzelltransplantation oder KMT<br />
Gleichzeitige oder vorbestehende Malignome außer Basalzellkarzinome, In situ Cervixkarzinom oder andere<br />
Tumore mit mindestens 5 Jahren Krankheitsfreiheit<br />
Die Referenzzentren für Pathologie sind identisch mit denen der GLSG-Studien.<br />
173
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. 18-65 Jahre, Studie 2003<br />
Diagnostik, Staging<br />
Histologie<br />
Eine Bestätigung der Diagnose eines MCL durch eines der für die GLSG-Studien ausgewiesenen<br />
Pathologischen Institute ist zwingend erforderlich.<br />
Staginguntersuchungen<br />
(Müssen innerhalb von 6 Wochen vor Therapiebeginn durchgeführt sein)<br />
Anamnese inclusive Gewicht <strong>und</strong> Größe<br />
Körperliche Untersuchung mit HNO-Konsil, WHO-Performance Status<br />
EKG, evtl. UKG<br />
Röntgen Thorax<br />
CT Hals bis Becken<br />
Evtl. Abdomensonographie<br />
Endoskopie nach klinischer Indikation<br />
Knochenmarkspunktion mit Zytologie <strong>und</strong> Histologie, ggf. Immunphänotypisierung (CD 5, 20)<br />
Labor: Differentialblutbild, Immunphänotypisierung (CD19,CD20,CD5), Glukose, K + , Na + , Kreatinin,<br />
Harnstoff, Harnsäure, ASAT, ALAT, AP, GGT, Bilirubin, LDH, Gesamteiweiß, Albumin,<br />
Immunglobuline (IgG, IgA, IgM); Direkter Coombs-Test, Urinstatus, Serologie: HIV, HBV, HCV.<br />
10ml EDTA-Blut /5ml EDTA-KM <strong>und</strong> 10ml Heparinblut/5ml Heparin-KM für MRD-Diagnostik <strong>und</strong><br />
biologische Studien (t(11;14)(q13;q32), Immunglobulinrearrangierungen).<br />
Erneute Untersuchung obligat zu den Zeitpunkten der festgelegten MRD-Diagnostik, siehe Graphik<br />
oben <strong>und</strong> nach hämatologischer Rekonstitution im Anschluss an die Hochdosistherapie.<br />
Prüfung der Ein- <strong>und</strong> Ausschlusskriterien<br />
Einverständniserklärung des Patienten<br />
Materialgewinnung für Begleituntersuchungen<br />
Je 10ml EDTA-Blut/ 5ml EDTA-KM werden zu folgenden Zeitpunkten verschickt:<br />
Primärstaging<br />
Zwischenstaging<br />
Abschluss-Staging<br />
Danach alle 6 Monate<br />
Einsendeadresse:<br />
Staging: PD Dr. M. Dreyling<br />
Universitätsklinikum Großhadern/LMU,<br />
III. Medizinische <strong>Klinik</strong><br />
Marchioninistr. 15<br />
81377 München<br />
Follow-Up:<br />
Dr. C. Pott<br />
Universitätsklinikum Kiel<br />
II. Medizinische <strong>Klinik</strong><br />
Chemnitzstr. 33<br />
24116 Kiel<br />
Verlaufsuntersuchungen<br />
Das Zwischenstaging erfolgt zweimal <strong>und</strong> ist im Arm 1 <strong>und</strong> 2 verschieden. Die Graphik oben weist die<br />
Zeitpunkte für die Therapiebewertung mit Evaluation aus (siehe S.172). Restaging 4 Wochen nach<br />
Therapieabschluss zur Determinierung CR, CRu <strong>und</strong> PR. CRu heisst komplette Remission mit einer<br />
Unsicherheit <strong>und</strong> wird inhaltlich als PR gewertet.<br />
174
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. 18-65 Jahre, Studie 2003<br />
Therapieschemata<br />
R-CHOP21<br />
Rituximab 375 mg/m 2 i.v. Tag 1 (eventuell Tag 0)<br />
Cyclophosphamid 750 mg/m 2 i.v. Tag 1<br />
Uromitexan 300 mg/m 2 0, 4 <strong>und</strong> 8 h nach Cyclophosphamid<br />
Doxorubicin 50 mg/m 2 i.v. Tag 1<br />
Vincristin 2 mg i.v. Tag 1<br />
Prednison 100 mg total Tag 1-5<br />
Wiederholung Tag 22<br />
Dexa BEAM<br />
Dexamethason 3 x 8 mg p.o. Tag 1-10<br />
BCNU 60 mg/m 2 i.v. Tag 2<br />
Melphalan 20 mg/m 2 Tag 3<br />
Etoposid 75 mg/m 2 i.v. Tag 4-7<br />
Cytarabin 2 x 100mg/m 2 i.v. q 12h Tag 4-7<br />
R-CHOP/DHAP<br />
Rituximab 375 mg/m 2 i.v. Tag 1, wenn 3 x 10 9 /l >100 x 10 9 /l 100% 100% 100% 100% 100%<br />
2-3 x 10 9 /l >100 x 10 9 /l 75% 75% 100% 100% 100%<br />
1-2 x 10 9 /l 50-100 x 10 9 /l 50% 50% 100% 100% 100%<br />
100 x 10 9 /l 100% 100% 100% 100% 100%<br />
2-3 x 10 9 /l >100 x 10 9 /l 75% 75% 100% 100% 100%<br />
1-2 x 10 9 /l 50-100 x 10 9 /l 50% 50% 100% 100% 100%<br />
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. 18-65 Jahre, Studie 2003<br />
Hochdosistherapie<br />
Stammzell-Apherese<br />
Zur Stammzellapherese wird im Arm 1, wie bislang üblich, eine Mobilisierungstherapie mit Dexa<br />
BEAM unter G-CSF-Gabe (5-10µg/kg KG) ab Tag 1 durchgeführt, nach Beendigung der Therapie<br />
wird dann nach Anstieg der Leukozyten bei Nachweis ausreichender CD34 + Zellen in der FACS-<br />
Analyse die Apherese mit dem Ziel von >2,0-2,5x10 6 /kg KG CD34 + Zellen in entsprechenden Zentren<br />
durchgeführt. Hierbei ist auf eine frühzeitige Anmeldung (möglichst vor Therapiebeginn) sowie das<br />
Vorliegen der Virusausschlussdiagnostik (insbesondere HIV, Hepatitis B <strong>und</strong> C – die Apharesatbeutel<br />
sind nicht virendicht, Lagerungsproblem) zu achten.<br />
Der Patient sollte darauf hingewiesen werden, das an den Apheresetagen die G-CSF-Applikation<br />
möglichst früh <strong>und</strong> unbedingt vor Apherese erfolgen soll.<br />
Im Arm 2 wird ein 3. Zyklus R-CHOP/DHAP zur Mobilisierung verwendet (Ergebnisse aus<br />
Frankreich zeigen, dass die Therapie nur relativ gering toxisch ist <strong>und</strong> eine ausreichende Apherese gut<br />
durchführbar war). Die G-CSF-Gabe erfolgt ab Tag 6 nach Beendigung der Chemotherapie.<br />
Voraussetzungen<br />
Die Hochdosistherapie sollte möglichst innerhalb von 6 Wochen nach Mobilisationstherapie erfolgen,<br />
wenn:<br />
Weiterhin eine CR oder PR besteht<br />
Ausreichend Stammzellen gewonnen werden konnten<br />
Keine medizinischen Kontraindikationen für die myeloablative Radio-Chemotherapie bestehen<br />
Durchführung<br />
Therapiearm 1<br />
Im Arm 1 folgt auf eine Ganzkörperbestrahlung (Total Body Irradiation, TBI) von 2 x 2Gy/Tag mit<br />
einer Gesamtdosis von 10-12 Gy an den Tagen -6 bis -4, gerechnet auf das Stammzelltransplantationsdatum,<br />
die Hochdosistherapie mit<br />
Cyclophosphamid 60mg/kg KG/Tag i.v. Inf. Tag -3 <strong>und</strong> -2<br />
Eine umgekehrte Reihenfolge ist prinzipiell erlaubt.<br />
Therapiearm 2<br />
Im Arm 2 erfolgt die TBI auch innerhalb von 6 Wochen, sofern klinisch nicht kontraindiziert (vgl.<br />
Voraussetzungen), hier an den Tagen -9 bis -7 in Dosen von 2 x 2Gy/Tag mit einer Gesamtdosis von<br />
10-12 Gy.<br />
Als Hochdosistherapie werden appliziert:<br />
Cytarabin 1500 mg/m 2 /12h i.v. Inf. Tag -5 <strong>und</strong> -4<br />
Melphalan 140 mg/m 2 i.v. Inf. Tag -2<br />
Die Applikation von G-CSF nach Stammzelltransplantation (5µg/kg KG) wird in beiden Armen<br />
empfohlen, obliegt aber der Handhabe im Transplantationszentrum.<br />
Weitere Therapie<br />
Nach Abschluss der Hochdosistherapie mit Stammzelltransplantation ist keine weitere Therapie<br />
innerhalb des Studienprotokolls vorgesehen.<br />
176
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. 18-65 Jahre, Studie 2003<br />
Kontrolluntersuchungen<br />
Verlaufsuntersuchungsschema<br />
Untersuchung Staging 1 jedem<br />
Vor<br />
Zyklus<br />
Nach<br />
3.R-<br />
CHOP<br />
oder 2. R-<br />
CHOP/D<br />
HAP<br />
Vor<br />
Hochdosisther<br />
apie<br />
Alle 3<br />
Monate<br />
nach<br />
Transplan<br />
tation<br />
Halbjährl<br />
ich<br />
Bei<br />
Progress<br />
Einschluss-,<br />
Ausschlusskriterien?<br />
Einverständniserklärung<br />
X<br />
X<br />
Anamnese X X<br />
Körperl.<br />
Untersuchung<br />
X 2 X 2 X 2 X 2 X 2 X 2 X 2<br />
EKG/UKG X X<br />
Rö-Thorax X X 3 X 3<br />
Abdomensonographie X X 3<br />
CT X X 3 X 3 X X<br />
KM-Stanze X X 4 X 4 X 4 X<br />
Labor X 5 X 6 X 6 X 6 X 6 X 6 X 6<br />
Direkter Coombs<br />
Anti HIV, HBV,<br />
HCV<br />
X<br />
X<br />
Urinuntersuchung X X X<br />
FACS-Analyse X X X X<br />
MRD-Diagnostik<br />
X<br />
X<br />
X<br />
X<br />
X<br />
Biolog. Programm<br />
(PB+KM)<br />
(PB+KM)<br />
PB<br />
(PB+KM)<br />
(PB+KM)<br />
Endoskopie X 7 X 7 X 7<br />
1- Innerhalb von 14 Tagen vor Therapiebeginn<br />
2- Inclusive Symptome/NW, WHO-Performance Status<br />
3- Wenn klinisch Partielle/Komplette Remission<br />
4- Wenn initialer Befall, Immunphänotypische Analyse initial <strong>und</strong> bei Befall siehe MRD<br />
5- BB+Diff, LDH, ß2-MG, Kreatinin, Harnsäure, Glucose, Calzium, AP, Transaminasen, Serumeiweiß, Albumin,<br />
Immunglobuline quantitativ, Bilirubin.<br />
6-BB+Diff, Kreatinin, Bilirubin, AP, GGT, Transaminasen, LDH, Albumin, ß2MG+Gesamteiweiß vor <strong>und</strong> nach<br />
ASZT<br />
7- Wenn ein klinischer Verdacht besteht<br />
177
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. ≥ 66 Jahre, Studie 03-2003<br />
Ein-, Ausschlusskriterien<br />
Fragestellung der Studie<br />
Lässt sich, gemessen an der CR-Rate, mit einer Kombination aus 6 Zyklen Rituximab, Fludarabin <strong>und</strong><br />
Cyclophosphamid eine bessere Reduktion der Lymphommasse erreichen, als mit 8 Zyklen R-CHOP?<br />
Bietet eine Erhaltungstherapie mit Rituximab im Vergleich zu einer Interferonerhaltung (incl. PEG-<br />
IFN) einen Vorteil für das progressionsfreie Überleben?<br />
Patientenrekrutierung<br />
Erwartete Patientenzahl: 570 innerhalb von 4-6 Jahren.<br />
Studienzentrale für Deutschland<br />
PD Dr. M. Dreyling, Prof. Dr. W. Hiddemann, Dr. M. Unterhalt, GLSG<br />
Universitätsklinikum Großhadern / LMU, III. Medizinische <strong>Klinik</strong>, Marchioninistr. 15<br />
81549 München<br />
Telefonnummer für Randomisation: 089 / 6995-830, Fax 089 / 6995-8312<br />
Einschlusskriterien<br />
Histologische Sicherung eines Mantelzell-Lymphoms, bestätigt durch die Referenzpathologie<br />
Klinische Stadien II-IV<br />
Keine Vorbehandlung<br />
Alter >65 Jahre<br />
WHO-Performance Status ≤2<br />
Einverständniserklärung des Patienten<br />
Messbare Erkrankung, bei ausschließlichem KM-Befall kann nur bei Erreichen einer CR die<br />
zweite Randomisation erfolgen.<br />
Ausschlusskriterien<br />
WHO-Performance Status 3 oder höher<br />
Bekannte Reaktivität von Anti-murinen Antikörpern oder bekannte Überempfindlichkeit<br />
Nicht eindeutig lymphombedingte Leukopenie 2,5x ONW, wenn nicht lymphombedingt<br />
Kreatinin >2xONW, alters- <strong>und</strong> gewichtskorrigiert, wenn nicht lymphombedingt<br />
Chronische Hepatitis B oder C Infektion oder bekannte HIV-Positivität<br />
Nicht kontrollierte Infektion<br />
Schwerwiegende Depression, die in den letzten 5 Jahren therapiebedürftig war<br />
Jedwede psychologische, soziologische oder geographische Situation, die die Therapiecompliance zum<br />
Studienprotokoll oder der Nachsorge verhindern könnte.<br />
Gleichzeitige oder vorbestehende Malignome außer Basalzellkarzinome, In situ Cervixkarzinom oder<br />
andere Tumore mit mindestens 5 Jahren Krankheitsfreiheit<br />
178
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. ≥ 66 Jahre, Studie 03-2003<br />
Therapie, Flussdiagramm<br />
Diagnostik, Staging<br />
Wie MCL-Studie der Patienten < 66 Jahre siehe dort.<br />
Therapie<br />
Die Behandlung erfolgt im randomisierten Vergleich zweier Rituximab-enthaltender<br />
Chemotherapieregime unter Verzicht auf eine Hochdosistherapie.<br />
Flussdiagramm<br />
179
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. ≥ 66 Jahre, Studie 03-2003<br />
Therapieschemata<br />
R-CHOP21<br />
Rituximab 375 mg/m 2 i.v. Tag 0, wenn 100 x 10 9 /l 100% 100% 100% 100% 100%<br />
2-3 x 10 9 /l >100 x 10 9 /l 75% 75% 100% 100% 100%<br />
1-2 x 10 9 /l 50-100 x 10 9 /l 50% 50% 100% 100% 100%<br />
100 x 10 9 /l 100% 100% 100%<br />
2-3 x 10 9 /l >100 x 10 9 /l 75% 75% 100%<br />
1-2 x 10 9 /l 50-100 x 10 9 /l 50% 50% 100%<br />
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. ≥ 66 Jahre, Studie 03-2003<br />
Randomisation, Remissionsbeurteilung, Toxizität<br />
Studienzentrale <strong>und</strong> Randomisation<br />
M. Dreyling, W. Hiddemann<br />
German Low Grade Lymphoma Study Group<br />
Dr. M. Unterhalt<br />
Universitätsklinikum Großhadern/LMU<br />
III. Medizinische <strong>Klinik</strong><br />
Marchioninistr. 15<br />
81549 München<br />
Telefonnummer für Randomisation: 089-6995-830/ Fax -8312<br />
Referenzpathologien<br />
Prof. Feller, Lübeck<br />
Prof. Hansmann, Frankfurt<br />
Prof. Möller, Ulm<br />
Prof. Müller-Hermelink, Würzburg<br />
Prof. Parwaresch, Kiel<br />
Prof. Stein, Berlin<br />
Remissionsbeurteilung<br />
Die Remissionskriterien entsprechen denen der anderen Lymphomstudien, wichtig ist jedoch, dass<br />
eine CRu (CR mit kontrollbedürftigem Residualbef<strong>und</strong>) als partielle Remission gewertet wird.<br />
Als Rezidiv gilt ein Wiederauftreten der Erkrankung in zuvor befallenen Arealen, als Progrediente<br />
Erkrankung (PD) wird definiert, wenn mindestens 50% Lymphomzunahme nach dem Nadir oder<br />
Neuauftreten von Befällen während oder zum Ende der Therapie zu verzeichnen sind.<br />
Schwere unerwünschte Wirkungen<br />
Schwere unerwünschte Wirkungen (Serious Adverse Events, SAE) werden definiert als jeder<br />
beobachtete medizinische Zustand, der:<br />
Zum Tode führt<br />
Lebensbedrohlich ist<br />
Zu permanenter oder wesentlicher Behinderung führt.<br />
Diese SAE’s müssen innerhalb von 48 St<strong>und</strong>en der Studienzentrale gemeldet werden, danach<br />
entsprechend dokumentiert werden. Folgende Informationen sind erforderlich:<br />
Datum, Uhrzeit des Beginns<br />
Dauer (Datum Beginn <strong>und</strong> Ende)<br />
Maximale Intensität (nach CTC-Kriterien)<br />
Zusammenhang mit der Medikation (s.u.)<br />
Outcome<br />
Beurteilung der Schwere der Nebenwirkung<br />
Gründe für eine Beendigung der Studientherapie<br />
Progress der Erkrankung unter Therapie<br />
Schwere Nebenwirkungen<br />
Begleiterkrankungen<br />
Tod<br />
Andere Gründe müssen dargelegt werden<br />
Die Kriterien zur Evaluation eines Zusammenhangs einer Komplikation mit der Studienmedikation<br />
entsprechen denen der klinischen Evaluation, unterschieden wird zwischen einem fehlendem, einem<br />
unwahrscheinlichen, einem möglichen, einem wahrscheinlichen <strong>und</strong> einem sicheren Zusammenhang.<br />
181
Mantelzell-<strong>Lymphome</strong><br />
European MCL Network, Pat. ≥ 66 Jahre, Studie 03-2003<br />
Verlaufsuntersuchungsschema<br />
Verlaufsuntersuchungsschema<br />
Untersuchung Staging 1 jedem<br />
Vor<br />
Zyklus<br />
Einschluss-,<br />
Ausschlusskriterien?<br />
Einverständniserklärung<br />
X<br />
Nach<br />
3.R-FC<br />
oder 4. R-<br />
CHOP<br />
Restaging<br />
X<br />
Alle 2<br />
Monate<br />
Halbjährlich<br />
Bei<br />
Progress<br />
Anamnese<br />
X<br />
Körperl. Untersuchung X X X X X X X<br />
EKG/UKG X X<br />
Rö-Thorax X X<br />
CT X X 3 X 3 X 3 X<br />
KM-Stanze X X 4 X 4 X 4 X<br />
Labor (s.u.) X 5 X 5 X 5 X 5 X 5 X 5 X 5<br />
Direkter Coombs<br />
Anti HIV, HBV, HCV<br />
Urinuntersuchung<br />
X<br />
X<br />
X<br />
FACS-Analyse X 6 X 6 X 6 X 6<br />
MRD-Diagnostik<br />
Biologisches<br />
Programm<br />
X<br />
(PB+KM)<br />
X<br />
(PB+KM)<br />
X<br />
PB<br />
X<br />
(PB+KM)<br />
X<br />
PB+KM)<br />
Häusl. Medikation X X X X X X<br />
Nebenwirkungen X X X X X<br />
1- Innerhalb von 14 Tagen vor Therapiebeginn<br />
2- Inclusive Symptome/NW, WHO-Performance Status<br />
3- Kontrolle aller befallenen Regionen<br />
4- Wenn initial befallen<br />
5- BB+Diff, Na + , K + , Kreatinin, Transaminasen, AP,GGT, Bilirubin, LDH<br />
Staging zusätzlich: Glucose, Harnstoff, Harnsäure, IgG, IgA, IgM, Gesamteiweiß, Albumin<br />
6- Quantitative Bestimmung zirkulierender B-Lymphozyten/MCL-Zellen (zB. CD19/20/CD5)<br />
182
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
STIL*, Primärtherapie, R-CHOP vs R-B-Studie<br />
Ein-, Ausschlusskriterien<br />
Phase III-Protokoll der Studiengruppe indolente <strong>Lymphome</strong><br />
Im Rahmen dieser Phase III-Studie soll primär die Frage beantwortet werden, ob in der Primärtherapie<br />
niedrigmaligner <strong>und</strong> Mantelzell <strong>Lymphome</strong> die Monotherapie mit Bendamustin der etablierten<br />
Polychemotherapie mit CHOP, jeweils in Kombination mit Rituximab, in Bezug auf die ereignisfreie<br />
Überlebenszeit (EFS) gleichwertig ist.<br />
Studienzentrale<br />
Dr. M. Rummel Tel.: 069 / 6301 - 7319 email: rummel@em.uni-frankfurt.de<br />
Dr. St. Krüger Tel.: 069 / 6301 - 5976 email: krueger.stefan@gmx.de<br />
B. Kosleck-Pikowsk Tel.: 069 / 6301 - 4039 email: barbara.kosleck-pikowski@kgu.de<br />
Med. <strong>Klinik</strong> III, Universitätsklinik Fax: 069 / 6301 - 5038<br />
Theodor-Stern-Kai, 760590 Frankfurt/Main<br />
Einschlusskriterien<br />
Patienten mit histologisch verifizierten B-Zell-<strong>Lymphome</strong>n folgender Entitäten:<br />
a) Follikuläres Lymphom Grad 1 <strong>und</strong> 2 (cb-cc nach der Kiel-Klassifikation)<br />
b) Lymphoplasmazytisches Lymphom / Immunozytom (inkl. M. Waldenström)<br />
c) Lymphozytisches Lymphom (CLL ohne Leukämie) (lymphoplasmazytoid Kiel)<br />
d) Nodales <strong>und</strong> generalisiertes (nodal <strong>und</strong> extranodal) Marginalzonen Lymphom<br />
e) Mantelzell- Lymphom (cc nach der Kiel-Klassifikation)<br />
f) nicht weiter oder näher klassifizierbare niedrigmaligne <strong>Lymphome</strong><br />
(z.B., wenn nicht genügend Biopsiematerial gewonnen werden konnte, oder wenn kein<br />
Lymphknoten exstirpiert werden konnte <strong>und</strong> die Diagnose anhand einer Knochenmark- oder<br />
anderen Biopsie gestellt wurde, das Gewebe trotz vollständiger Untersuchung nicht in eine<br />
der histologischen Kategorien der WHO-Klassifikation zugeordnet werden konnte <strong>und</strong> es sich<br />
sicher um ein niedrigmalignes B-Zell Lymphom handelt. Bitte in diesem Fall Rücksprache mit<br />
der Studienzentrale)<br />
Histologie positiv für CD20<br />
Keine Vorbehandlung mit Zytostatika, Interferonen oder monoklonalen Antikörpern<br />
Therapiebedürftigkeit (siehe folgende Seite unter 4.3), außer bei Mantelzell <strong>Lymphome</strong>n<br />
Stadium III oder IV<br />
Alter mindestens 18 Jahre<br />
Allgemeinzustand nach WHO 0-2<br />
Schriftliche Einverständniserklärung des Patienten<br />
Eine aktuelle Histologie, die nicht älter als 6 Monate sein sollte, ist erforderlich.<br />
Ausschlusskriterien<br />
Patienten, die die Einschlusskriterien unter nicht erfüllen<br />
Möglichkeit einer primären, potentiell kurativen Strahlentherapie<br />
Vorbehandlung, außer mit einer einmaligen lokal begrenzten Strahlentherapie (Strahlenfeld nicht<br />
größer als zwei benachbarte Lymphknotenregionen)<br />
Begleiterkrankungen, die eine studiengerechte Therapiedurchführung ausschließen:<br />
Herzinfarkt innerhalb der letzten 6 Monate, schwere medikamentös nicht einstellbare Hypertonie,<br />
schwere Funktionseinschränkungen des Herzens nach NYHA III oder IV, der Lunge WHO-Grad III<br />
oder IV, der Leber <strong>und</strong> der Niere (Kreatinin > 2 mg/dl, GOT <strong>und</strong> GPT oder Bilirubin über 3-faches der<br />
Norm), außer wenn lymphombedingt<br />
Patienten mit nachgewiesener HIV-Infektion<br />
Aktive Hepatitis-Infektion<br />
Schwere psychiatrische Erkrankungen<br />
Fehlende oder nicht zu erwartende Compliance<br />
Schwangere oder stillende Frauen<br />
Patienten mit einem Zweitmalignom oder einer malignen Erkrankung in der Vorgeschichte, wenn<br />
nicht von einer sicheren chirurgischen Kuration ausgegangen werden kann<br />
183<br />
* Studiengruppe indolente <strong>Lymphome</strong>
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
STIL*, Primärtherapie, R-CHOP vs R-B-Studie<br />
Indikation, Diagnostik<br />
Indikation zur Therapie<br />
Bei den aggressiveren <strong>und</strong> prognostisch ungünstigen Mantelzell <strong>Lymphome</strong>n ist die Indikation zur Therapie<br />
stets gegeben.<br />
Bei den anderen niedrigmalignen <strong>Lymphome</strong>ntitäten besteht eine Therapiebedürftigkeit, wenn eines der<br />
folgenden Kriterien erfüllt ist:<br />
B-Symptomatik:<br />
- Fieber unklarer Ätiologie > 38 °C<br />
- Nachtschweiß<br />
- Gewichtsverlust > 10% des Ausgangsgewichtes innerhalb von 6 Monaten<br />
Hämatopoetische Insuffizienz:<br />
Periphere Zytopenie, nicht durch eine Splenomegalie bedingt<br />
(Granulozyten < 1.500 /µl, Hb < 10 g/dl, Thrombozyten < 100.000 /µl)<br />
Objektivierbare, rasche Tumorprogredienz:<br />
- Zunahme der Zahl oder Größe von Lymphommanifestationen um > 50% innerhalb eines halben Jahres<br />
Große Tumormasse („bulky disease“):<br />
<strong>Lymphome</strong> > 5 cm Durchmesser in 3 <strong>und</strong> mehr Regionen oder > 7,5 cm in einer Region<br />
Lymphombedingte Komplikationen, wie Einengung von Ureteren oder Gallengängen, rezidivierende<br />
Milzinfarkte, tumorbedingte Kompression eines lebenswichtigen Organs, lymphominduzierte Schmerzen, etc.<br />
Hyperviskositätssyndrom durch monoklonale Gammopathie<br />
Diagnostik vor Therapiebeginn<br />
Zur genauen Stadieneinteilung vor Therapiebeginn gehören folgende Untersuchungen:<br />
Anamnese <strong>und</strong> körperliche Untersuchung<br />
Palpation der peripheren Lymphknotenregionen<br />
Knochenmark-Zytologie (Aspiration) <strong>und</strong> -Histologie (Stanze)<br />
Lymphknotenexstirpation bei Befall von peripheren Lymphknoten<br />
Bei leukämischer Ausschwemmung (> 4.000 Lymphozyten /µl) immunologische Charakterisierung (CD3, CD4,<br />
CD5, CD8, CD10, CD19, CD20, CD23, FMC7, Doppelmarkierung CD5/CD19 oder CD5/CD20)<br />
CT-Thorax <strong>und</strong> röntgenologische Untersuchung der Thoraxorgane<br />
CT-Abdomen <strong>und</strong> Sonographie des Abdomens<br />
Laboruntersuchungen:<br />
Blutbild, Diff., Reti., CD4-/CD8-Lymphozyten, Coombs-Test, BSG, biochemisches Profil, Gerinnung,<br />
Immunglobuline, Immunelektrophorese, Beta-2-Mikroglobulin<br />
EKG <strong>und</strong> Echokardiographie<br />
Histologie: Eine aktuelle Histologie, die nicht älter als 6 Monate sein sollte, ist erforderlich.<br />
Diagnostik während der Therapie<br />
Vor jedem Therapiezyklus<br />
Blutbild <strong>und</strong> Diff., biochemisches Profil, FACS-Analyse CD4- /CD8-Lymphozyten<br />
Zwischen den Therapiezyklen<br />
1 x wöchentlich Bestimmung des Blutbildes <strong>und</strong> Differentialblutbildes.<br />
Während der Phthise können Blutbildkontrollen in kürzeren Abständen indiziert sein.<br />
* Studiengruppe indolente <strong>Lymphome</strong><br />
Nach dem 3. Zyklus<br />
Eine Reevaluation der Tumorparameter erfolgt nach dem 3. Therapiezyklus mit Wieder-holung aller<br />
entsprechenden Untersuchungen. Die Knochenmarkbiopsie sollte jedoch erst nach Abschluß der Chemotherapie<br />
(spätestens nach dem 6. Therapiezyklus) durchgeführt werden, sofern die anderen Untersuchungen auf eine<br />
Remission des Lymphoms hinweisen.<br />
Diagnostik nach Abschluß der Therapie<br />
Nach dem letzten bzw. 6. Therapiezyklus erfolgt ein komplettes Restaging mit Wiederholung aller Eingangsuntersuchungen,<br />
inklusive Knochenmark-Zytologie (Aspiration) <strong>und</strong> -Histologie (Stanze). Dabei sollen<br />
apparative bzw. invasive diagnostische Maßnahmen nur bei positivem (pathologischen) Bef<strong>und</strong> des letzten<br />
Stagings erfolgen.<br />
184
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
STIL*, Primärtherapie, R-CHOP vs R-B-Studie<br />
Indikation, Diagnostik<br />
* Studiengruppe indolente <strong>Lymphome</strong><br />
Behandlungsstrategie<br />
Die Monotherapie Bendamustin plus Rituximab (B-R) wird gegen die Polychemotherapie CHOP plus<br />
Rituximab (CHOP-R) prospektiv randomisiert bei Patienten mit follikulären, lymphoplasmozytischen<br />
(Immunozytomen), lymphozytischen, Marginalzonen-, nicht näher klassifizierbaren niedrigmalignen<br />
sowie Mantelzell-<strong>Lymphome</strong>n als Primärtherapie geprüft.<br />
Bendamustin plus Rituximab (B-R)<br />
R<br />
B B-R B-R B-R<br />
B-R<br />
B-R<br />
Tag<br />
0 1 29 57 85 113 141<br />
B = Bendamustin 90 mg/qm Tag 1+2 29+30 57+58 85+86 113+114 141+142<br />
R = Rituximab 375 mg/qm Tag 0 29 57 85 113 141<br />
Randomisation<br />
CHOP plus Rituximab (CHOP-R)<br />
R<br />
CHOP CHOP-R CHOP-R CHOP-R<br />
CHOP-R<br />
CHOP-R<br />
Tag<br />
0 1 22 43 64 85 106<br />
CHOP Tag 1 22 43 64 85 106<br />
Rituximab 375 mg/qm Tag 0 22 43 64 85 106<br />
Beim 1. Zyklus erfolgt die Gabe von Rituximab einen Tag vor Bendamustin. Bendamustin als 30-Minuten-Infusion. Rituximab stets vor<br />
Bendamustin geben. CHOP wird in der Standarddosierung gegeben. Siehe CHOP-Therapie.<br />
Beachte: R-CHOP wird im Abstand von 3 Wochen, , R-Bendamustin im Abstand von 4 Wochen wiederholt.<br />
Maximal 6 Zyklen. Bei früher eintretender CR oder bei Progression Reduktion der Zahl der Zyklen. Bei früher<br />
eintretender CR oder sehr guter PR können 2 weitere konsolidierende Zyklen verabreicht werden, jedoch<br />
insgesamt maximal nur 6 Zyklen.<br />
Nach dem 3. Zyklus erfolgt ein Zwischenstaging. Wenn ein Ansprechen auf die Therapie zu beobachten ist,<br />
Therapiefortführung bis zum max. Ansprechen, jedoch maximal 6 Zyklen.<br />
Zellzahlen vor Fortsetzung der Therapie<br />
Vor Beginn eines neuen Chemotherapiezyklus sollen Werte für Leukozyten > 2.000 /µl <strong>und</strong> Thrombozyten ><br />
100.000 /µl vorliegen. Sind diese Grenzwerte 3 Wochen nach CHOP-R bzw. 4 Wochen nach B-R nicht erreicht,<br />
wird der nächste Zyklus um eine Woche verschoben. Bei persistierender Leukozytopenie oder<br />
Thrombozytopenie kann die Therapie mit einer reduzierten Dosis fortgeführt werden.<br />
Stammzellsammlung<br />
Für die möglichen Rezidive der Erkrankung bei Patienten, die bezüglich ihres Alters <strong>und</strong> ihrer Compliance für<br />
eine spätere Rezidiv-Hochdosischemotherapie mit Stammzellsupport in Frage kommen, können nach<br />
abgeschlossener Therapie CD34-positive Stammzellen gesammelt werden, um dann in einer späteren<br />
Rezidivsituation die Hochdosistherapie mit autologem Stammzellsupport als therapeutische Option nutzen zu<br />
können. Dazu wird ca. 8 Wochen nach Abschluß der Therapie ein „Endoxanstoß“ mit nachfolgend G-CSF<br />
appliziert, wenn auf die initiale Therapie zumindest eine „gute“ Remission (CR oder PR > 75%) erreicht wurde.<br />
In der Regenerationsphase nach Endoxan sollen Stammzellen gesammelt werden.<br />
185
<strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
STIL*, Primärtherapie, R-CHOP vs R-B-Studie<br />
Dosisreduktion,<br />
Dosisreduktion bei therapieinduzierter Myelosuppression<br />
Bei höhergradiger therapieinduzierter Myelosuppression mit einem der folgenden Parameter wird in den<br />
nachfolgenden Zyklen die Dosis wie folgt reduziert unter Beibehaltung der vollenRituximabdosis:<br />
Leukozyten < 1.000 /µl gemessen an 2 Tagen<br />
Thrombozyten < 75.000 /µl (außer wenn lymphombedingt) gemessen an 2 Tagen<br />
1. Reduktionsstufe CHOP-R: Doxorubicin 40 mg/m 2 i.v. Tag 1<br />
Cyclophosphamid 600 mg/m 2 i.v. Tag 1<br />
1. Reduktionsstufe B-R: Bendamustin 70 mg/m 2 i.v. Tag 1+2<br />
Tritt unter reduzierter Dosis gemäß 1. Reduktionsstufe eine erneute Myelosuppression mit Unterschreiten der<br />
oben genannten Leukozyten- oder Thrombozytenwerten auf, erfolgt eine weitere Dosisreduktion auf die 2. <strong>und</strong><br />
ggf. auf die 3. Reduktionsstufe:<br />
2. Reduktionsstufe CHOP-R: Doxorubicin 30 mg/m 2 i.v. Tag 1<br />
Cyclophosphamid 450 mg/m 2 i.v. Tag 1<br />
2. Reduktionsstufe B-R: Bendamustin 60 mg/m 2 i.v. Tag 1+2<br />
3. Reduktionsstufe CHOP-R: Doxorubicin 20 mg/m 2 i.v. Tag 1<br />
Cyclophosphamid 300 mg/m 2 i.v. Tag 1<br />
3. Reduktionsstufe B-R: Bendamustin 50 mg/m 2 i.v. Tag 1+2<br />
Unerwünschte Wirkungen<br />
Bendamustin (Ribomustin® )<br />
Die hauptsächliche Toxizität von Bendamustin ist die Myelotoxizität, wobei die Leukozytopenie meist stärker<br />
ausgeprägt ist als die Thrombozytopenie <strong>und</strong> die Anämie. Abhängig von Dosierung, Vorbehandlungen <strong>und</strong><br />
Krankheitsentität wird eine Myelotoxizität WHO Grad 3 <strong>und</strong> 4 in 0-50% der Patienten angegeben, wobei Grad 4<br />
selten beschrieben wird.<br />
Seltenere Nebenwirkungen sind Venenreizungen (Thrombophlebitiden) an der Applikationsstelle,<br />
Abgeschlagenheit, M<strong>und</strong>trockenheit, Geschmacksveränderungen, Haut- <strong>und</strong> Schleimhautreizungen <strong>und</strong><br />
Haarausfall, wobei letzterer kaum eine Rolle spielt.<br />
Dosierung, Verabreichung<br />
Bendamustin soll als Kurzinfusion verabreicht werden, um Venenreizungen zu vermeiden.<br />
Die Dosis beträgt 90 mg/qm an zwei aufeinanderfolgenden Tagen. Ein solcher Zyklus wird maximal 6 x alle 28<br />
Tage verabreicht.<br />
Rituximab<br />
Rituximab kann ambulant verabreicht werden, es wird jedoch empfohlen, die erste Gabe unter zumindest<br />
teilstationären Bedingungen zu inf<strong>und</strong>ieren, Steigerung der Infusionsgeschwindigkeit nach Schema.<br />
Bei Rituximab tritt ein infusionsbedingter Symptomkomplex, der hauptsächlich aus Fieber <strong>und</strong><br />
Schüttelfrost/Zittern besteht, zumeist während der ersten Infusion auf, in der Regel innerhalb der ersten zwei<br />
St<strong>und</strong>en. Andere häufige, infusionsbedingte Symptome sind Übelkeit, Urtikaria/Exanthem, Müdigkeit,<br />
Kopfschmerz, Juckreiz, Bronchospasmus/Dyspnoe, Zungenbrennen oder Rachenschwellung (Angioödem),<br />
Rhinitis, Erbrechen, vorübergehende Hypotension, Gesichtsrötung <strong>und</strong> Schmerz an den Erkrankungsorten. Die<br />
Häufigkeit der infusionsbedingten Ereignisse nimmt mit zunehmender Anzahl an Infusionen drastisch ab. Die<br />
Mehrheit der Nebenwirkungen ist in der Regel leicht <strong>und</strong> begrenzt <strong>und</strong> verhindert im Allgemeinen nicht die<br />
Fortführung der Behandlung. Hämatologische Nebenwirkungen der Schweregrade 3 <strong>und</strong> 4 treten bei weniger als<br />
3% der Patienten auf.<br />
Vor Beginn der Infusion, insbesondere vor der ersten Gabe, sollten für den Fall eines anaphylaktischen Schocks<br />
Notfallmed. <strong>und</strong> ein Notfallset zur Akutintervention bereitstehen.<br />
Bei akuten Nebenwirkungen (WHO-Grad II/III) wird die Rituximab-Applikation unterbrochen. Es erfolgt in<br />
diesem Falle eine symptomorientierte Therapie sowie die Verabreichung von 100 mg Solu-Decortin plus<br />
Antihistaminikum. Nach Verschwinden der Nebenwirkungen kann die Weitergabe der Medikation erfolgen.<br />
Eine Reduktion der Dosis von Rituximab erfolgt nicht.<br />
Beim ersten Zyklus soll Rituximab einen Tag vor der Chemotherapie verabreicht werden.<br />
Ab dem zweiten Therapiezyklus wird Rituximab zusammen mit der Chemotherapie am gleichen Tag, <strong>und</strong> zwar<br />
vor der Chemotherapie, verabreicht.<br />
186<br />
* Studiengruppe indolente <strong>Lymphome</strong>
<strong>Indolente</strong> <strong>Lymphome</strong><br />
MCP vs MCP + Rituximab<br />
Erfurter Studie<br />
Studientitel<br />
Multizentrische, randomisierte Phase III-Studie zur Primärtherapie von Patienten mit niedrigmalignen Non-<br />
Hodgkin-<strong>Lymphome</strong>n in fortgeschrittenen Stadien. Chemotherapie vs. Chemotherapie plus Rituximab. Da<br />
Mitoxantron deutlich geringer kardiotoxisch als Doxorubicin wirkt, kann eine Optimierung des MCP-Schemas<br />
vor allem für ältere <strong>und</strong> kardial vorbelastete Patienten ohne Therapieoptionen eine Möglichkeit eröffnen.<br />
Einschlusskriterien<br />
Therapiebedürftige Patienten mit CD20-positivem follikulären Non-Hodgkin-Lymphom<br />
(Kiel-Klassifikation: CB-CC-Lymphom), Immunozytom sowie CD20-positivem<br />
Mantelzell-Lymphom (Zentrozytom), jeweils im Stadium III oder IV<br />
Alter 18 – 75 Jahre<br />
Keine zytostatische oder radiologische Vorbehandlung<br />
WHO-Zustand < 2<br />
Schriftliche Einwilligung des Patienten<br />
Ausschlusskriterien<br />
Möglichkeiten einer kurativen Strahlentherapie<br />
Teilnahme an einer anderen klinischen Prüfung, z.B. mit zytostatischer Chemotherapie oder Zytokinen<br />
Vorbehandlung mit murinen Antikörpern oder Hypersensitivität gegenüber murinem Eiweiß<br />
Schwere Begleiterkrankungen (Herz, Lunge, Niere, Hirn), nicht einstellbarer Hypertonus, nicht einstellbarer<br />
Diabetes mellitus<br />
Schwangerschaft <strong>und</strong> Stillzeit<br />
HIV-Positivität<br />
Studienzentrale<br />
PD Dr.med.M.Herold<br />
<strong>Klinik</strong>um Erfurt GmbH, 2. Medizinische <strong>Klinik</strong><br />
Nordhäuser Str. 74, 99089 Erfurt<br />
Tel.: 0361 / 781-3502 oder 781-2566, Fax: 0361 / 781-4803<br />
Studienablauf<br />
Nach Prüfung von Ein- <strong>und</strong> Ausschlusskriterien erfolgt die telefonische Randomisation in Erfurt. Die Patienten<br />
werden randomisiert auf den Arm:<br />
Dosierungen<br />
Rituximab 375 mg/m 2 /d i.v. Tag 1<br />
Mitoxantron 8 mg/m 2 /d i.v. Tag 1, 2<br />
Chlorambucil 3 x 3 mg/m 2 /d per os Tag 1 – 5<br />
Prednison 25 mg/m 2 /d per os Tag 1 – 5<br />
Wiederholung Tag 29, maximal 8 Zyklen<br />
MCP-Protokoll<br />
oder<br />
Rituximab + MCP<br />
Die Rekrutierung der<br />
Studie ist inzwischen<br />
beendet. Eine erste<br />
Auswertung ist für das<br />
ASH-Meeting 2004 geplant.<br />
Der Antikörper Rituximab wird für diese Studie zur Verfügung gestellt. Bei CR oder PR nach maximal 8<br />
Kursen wird eine Erhaltungstherapie mit Interferon 4,5 Mio. i.E. s.c. 3x pro Woche bis zum Rezidiv verabreicht.<br />
Im Falle eines schwerwiegenden unerwünschten Ereignisses (SUE; z.B. Tod des Patienten, lebensbedrohliche<br />
Ereignisse, unvorhergesehene Hospitalisation, Ereignisse mit nachfolgender dauerhafter <strong>und</strong> signifikanter<br />
körperlicher Schädigung) muß innerhalb eines Arbeitstages telefonisch oder per Fax eine Meldung an den<br />
Monitor Verum staticon erfolgen. Verum staticon (clinical research organization), Behringerstr. 12,<br />
82152 Planegg, Tel.: 089 / 895780, Fax: 089 / 8957811.<br />
187
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
Therapiestrategie<br />
Morphologie<br />
Wenn klinisch vertretbar, soll ein Rezidiv morphologisch gesichert werden. Gewünscht ist eine histologische<br />
Bestätigung, ist diese unter zumutbaren Bedingungen nicht erreichbar, kann eine eine Feinnadelaspirations-<br />
Zytologie eine sinnvolle <strong>und</strong> in vielen Fällen eine ausreichende Alternative sein.<br />
Stagingdiagnostik<br />
Der Umfang hängt ab von der beabsichtigten Behandlungsstrategie. Erscheint eine Kuration möglich, ist ein<br />
vollständiges Diagnostikprogramm wie bei der Ersterkrankung erforderlich, einschließlich der<br />
Knochenmarkbiopsie. Siehe Blatt: NHL, Diagnostik.<br />
Therapieindikation<br />
Die Entscheidung für eine lymphomspezifische Behandlung wird von mehreren Faktoren bestimmt.<br />
Gr<strong>und</strong>sätzlich gelten die gleichen Regeln wie für die Primärtherapie. Folgende Fragen müssen vorab<br />
beantwortet werden:<br />
Wie vieltes Rezidiv<br />
Besteht die Möglichkeit einer Kuration<br />
Histologischer Typ, CD20-Expression<br />
Liegt eine Therapiebedürftigkeit vor<br />
Lebensalter<br />
Allgemeinzustand<br />
Leidensdruck durch das Lymphom<br />
Therapieverlangen durch den Patienten<br />
Art der Vorbehandlung<br />
Besteht die Notwendigkeit<br />
charakterisiert werden:<br />
Art des Rezidivs<br />
einer Behandlung, muss das Rezidiv nach klinischen Gesichtspunkten<br />
Rein nodales Rezidiv in nicht oder nicht ausreichend bestrahlter Region (selten)<br />
Therapie: Bestrahlung in kurativer Intention nach dem Essener Protokoll<br />
Rezidiv nach vorangegangener Chemotherapie<br />
Therapiebedürftigkeit prüfen. Notwendigkeit einer lymphomspezifischen Behandlung besteht:<br />
Bei gutem AZ, keine relevante Komorbidität <strong>und</strong> Alter ≤ 65 Jahre:<br />
Intensive Chemotherapie in Abhängigkeit von der Vortherapie <strong>und</strong> dem gewünschten Behandlungsergebnis,<br />
bei CD20-positiven B-Zell-Lymphom Rituximab + Chemotherapie, siehe Kasten unten<br />
Bei schlechtem AZ, relevanter Komorbidität oder Alter > 75 Jahre:<br />
Milde, symptomorientierte, zytoreduktive Therapie, bei einem CD20-positivem Lymphom mit Rituximab,<br />
entweder als Monotherapie oder in Kombination mit Zytostatika in Abhängigkeit von der Primärbehandlung.<br />
Therapiestrategie<br />
1. Rezidiv<br />
GLSG-Studie: FCM + Rituximab ± Rituximab-Erhaltung<br />
R2D - Allogene PBSCT mit dosisreduzierter Konditionierung<br />
StiL-Studie: R+Bendamustin vs R+Fludarabin<br />
≥2. Rezidiv<br />
GLSG-Studie: R2A – Bendamustin + Mitoxantron + Rituximab x 4<br />
R2B – Gemcitabin + Oxaliplatin<br />
R2C – Zevalin beim Mantelzell-Lymphom<br />
R2D – Allogene PBSCT mit dosisreduzierter Konditionierung<br />
Individuelle, milde palliative Therapie ausserhalb einer Studie<br />
188
Rezidive: <strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
GLSG-Studien<br />
Therapieindikation, Diagnostik<br />
Voraussetzung<br />
Histologie: Keimzentrums-Lymphom (CB/CC), Mantelzell-Lymphom (CC), Immunozytom (IC).<br />
Spätrezidiv (> 6 Monate) nach first-line-Therapie mit Prednimustin + Mitoxantron beziehungsweise<br />
MCP oder COP. Zweites oder nachfolgendes Rezidiv nach Radiotherapie oder Knospe-Behandlung<br />
nach einer Remission ≥ 6 Monate.<br />
Die Diagnose eines niedrigmalignen Lymphoms im fortgeschrittenen Stadium ergibt nicht automatisch<br />
die Notwendigkeit zu einer Behandlung. Eine Therapiebedürftigkeit besteht bei folgenden Situationen:<br />
Therapieindikation<br />
Die Feststellung eines Rezidivs bedingt nicht zwangsläufig die Notwendigkeit einer Therapie. Die<br />
Entscheidung ist individuell zu treffen. Allgemein anerkannte Kriterien zur Einleitung einer<br />
Behandlung sind:<br />
- B-Symptome<br />
- Granulozyten < 1.500/µl, Hb < 10 g/dl, Thrombo < 100.000/µl.<br />
- Bei Immunozytom Gesamteiweiß > 9,5 g/dl<br />
- Bulky disease mediastinal > 7,5 cm, Lnn > 5 cm.<br />
- Vermehrung der Lymphomzellmasse > 50% innerhalb von 6 Monaten.<br />
- Kompression oder drohende Kompression eines lebenswichtigen Organs<br />
Diagnostik<br />
Gr<strong>und</strong>sätzlich wie bei einer Erstmanifestation. Wenn klinisch vertretbar, möglichst eine histologische<br />
(zytologische) Sicherung der Rezidivdiagnose erreichen.<br />
Anamnese, körperliche Untersuchung inclusive Lnn-Dokumentation.<br />
Rö-Thorax<br />
CT-Thorax, CT-Abdomen<br />
Abdominelle Sonographie<br />
Knochenszintigraphie<br />
KM-Zytologie <strong>und</strong> -Histologie.<br />
Optional weitere symptomorientierte Diagnostik gegebenenfalls mit Einbeziehung endoskopischer<br />
Untersuchungen. Laborroutine einschließlich Immunglobuline quantitativ, optional Immunfixation.<br />
Ausschlusskriterien<br />
Allgemeinzustand: WHO-Grad > 3. Schwerwiegende Begleiterkrankungen: Herzinsuffizienz,<br />
Kardiomyopathie, Herzinfarkt in den letzten 6 Monaten, chronische Lungenerkrankung mit<br />
Hypoxämie, schwere, nicht kontrollierte Hypertension. Schwerer, nicht kontrollierbarer Diabetes<br />
mellitus. Niereninsuffizienz, nicht durch das Lymphom bedingt, Kreatinin > 2 mg/dl. Schwere<br />
Leberfunktionsstörung, nicht durch das Lymphom verursacht. Transaminasenerhöhung > 3fach der<br />
Norm, oder Bilirubin > 2,0 mg/dl. Klinische Zeichen einer ausgeprägten vaskulären zerebralen<br />
Erkrankung, psychiatrische Veränderungen.<br />
Schwangerschaft.<br />
189
Rezidive: <strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
GLSG-Studie, FCM vs FCM + Rituximab<br />
Ein-, Ausschlusskriterien<br />
Dieses Protokoll ist vorgesehen für Patienten mit zentroblastisch/zentrozytischem oder immunozytischem<br />
Lymphom mit histologisch nachgewiesenem Stadium III oder IV im ersten Rezidiv nach Chemotherapie oder<br />
Stammzelltransplantation.<br />
Studienzentrale<br />
Deutsche Studiengruppe für niedrigmaligne Non-Hodgkin-<strong>Lymphome</strong><br />
Prof.Dr.med.W.Hiddemann / Dr.med. M. Unterhalt,<br />
Universitätsklinikum Großhadern, Abteilung Innere Medizin III,<br />
Marchioninistraße 15, 81377 München,<br />
Tel.: 089 / 699 583 10, 699 583 11, 699 5830, Fax: 089 / 699 583 12<br />
Einschlusskriterien<br />
Pat. > 18 Jahre<br />
Gesichertes Rezidiv nach o.g. Kriterien<br />
Zweidimensional meßbare Läsion außerhalb einer vorbestrahlten Region (osteoblastische Knochenläsionen,<br />
Ascites <strong>und</strong> Pleuraergüsse gelten als nicht messbar).<br />
Karnofsky-Index > 60<br />
Lebenserwartung mindestens 3 Monate<br />
Effektive Kontrazeption bei Frauen im gebärfähigen Alter<br />
Schriftliche Einverständniserklärung<br />
Ausschlusskriterien<br />
Patienten jünger als 18 Jahre<br />
Karnofsky-Index < 60<br />
Primär refraktäre Erkrankung<br />
Behandlung mit Fludarabin oder Mitoxantron innerhalb von drei Monaten vor Therapie<br />
Aktive autoimmunhämolytische Anämie bei geplantem Therapiebeginn<br />
Vorherige Therapie mit murinen Antikörpern<br />
Begleiterkrankung: Herzinsuffizienz NYHA Grad III – IV, dilatative Kardiomyopathie. KHK mit ST-<br />
Senkungen, Myokardinfarkt während der letzten 6 Monate; chronische Lungenerkrankung mit Hypoxie,<br />
schwerer, nicht einstellbarer Hypertonus, schwerer, nicht einstellbarer Diabetes; Niereninsuffizienz mit<br />
Kreatinin > 2 mg/dl, nicht ausgelöst durch das Lymphom; Leberinsuffizienz mit mehr als dreifacher<br />
Transaminasenerhöhung oder Bilirubin > 2 mg/dl; zerebrovaskuläre Insuffizienz.<br />
Schwangerschaft, Stillzeit- oder unzureichende Kontrazeption<br />
Schwere psychiatrische Erkrankungen<br />
Seropositivität für HBV, HCV, HIV<br />
Frühere Organtransplantationen mit Ausnahme von autologer Stammzelltransplantation<br />
Fehlende schriftliche Einverständniserklärung<br />
Die histologische Untersuchung des repräsentativen Materials (Lymphknoten, Knochenmark) sollte bei<br />
geplantem Studienbeginn nicht älter als 8 Wochen sein. Der Nachweis CD20-positiver Zellen muss geführt<br />
werden. Innerhalb von 4 Wochen nach Diagnose des Rezidivs muss das Material einem Referenzpathologen<br />
zugeschickt werden<br />
.<br />
Referenzpathologen sind:<br />
Prof.Dr.R.Parwaresch / Dr.M.Tiemann, Lymphknotenregister, Niemannsweg 11, 24105 Kiel<br />
Prof.Dr.Stein, Uniklinik Benjamin Franklin, Hindenburgdamm 30, 12200 Berlin<br />
Prof.Dr.K.Müller-Hermelink, Universität Würzburg, Josef-Schneider-Straße 2, 97080 Würzburg<br />
Prof.Dr.M.Hansmann, Universität Frankfurt, Theodor-Stern-Kai 7, 60590 Frankfurt<br />
Prof.Dr.A.C.Feller, Universitätsklinikum, Ratzeburger Allee 160, 23538 Lübeck<br />
Prof.Dr.P.Möller, Universität Ulm, Albert-Einstein-Allee 11, 89091 Ulm<br />
190
Rezidive: <strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
GLSG-Studie, FCM vs FCM + Rituximab<br />
Ergebnisse<br />
Das Therapiekonzept der Rezidivbehandlung indolenter <strong>Lymphome</strong> bestand in einer zweifachen Randomisation. Im ersten<br />
Teil sollte geprüft werden, welchen Einfluss Rituximab auf die Remissionsrate der in der Studie eingeschlossenen<br />
niedrigmalignen <strong>Lymphome</strong> hat. Zweitens sollte eine Antwort gegeben werden, ob eine Erhaltungstherapie mit dem CD20-<br />
Antikörper das progressionsfreie <strong>und</strong> das Gesamtüberleben verlängern kann.<br />
Studiendesign<br />
Ergebnisse einer Interimsanalyse<br />
Die Rezidivstudie der GLSG verglich als<br />
zytoreduktive Initialtherapie die Kombination<br />
Fludarabin / Cyclophosphamid / Mitoxantron (FCM)<br />
mit der gleichen Chemotherapie, die zusätzlich<br />
Rituximab (FCMR) enthielt.<br />
Für die follikulären <strong>Lymphome</strong> ergaben sich<br />
signifikant höhere Ansprechraten mit 92% vs 75%<br />
<strong>und</strong> eine höhere Rate an kompletten Remissionen von<br />
40 vs 21% gegenüber der nur mit FCM behandelten<br />
Gruppe. Besonders ausgeprägt war der Unterschied<br />
bei den Mantelzell-<strong>Lymphome</strong>n. Die Remissionsrate<br />
konnte hier durch die Hinzunahme von Rituximab<br />
zum FCM-Schema von 33 auf 64% gesteigert<br />
werden. Hinsichtlich der Nebenwirkungen war kein<br />
wesentlicher Unterschied festzustellen. Allerdings<br />
fanden sich im FCMR-Arm häufiger Lymphopenien,<br />
die aber nicht mit einer erhöhten Rate an Infektionen<br />
einhergingen.<br />
Die Überlegenheit des FCMR-Armes gegenüber der<br />
FCM-Therapie war so überzeugend, dass die<br />
Studienleitung beschloss, die primäre Randomisation<br />
zu beenden <strong>und</strong> initial allen Pat. die Kombination<br />
FCMR zu geben. Nach der Interimsanalyse erfolgt<br />
eine Randomisation nur für die Erhaltungstherapie mit<br />
oder ohne den CD20-Antikörper. Details siehe das<br />
Flussdiagramm auf der folgenden Seite.<br />
Ansprechrate Ansprechrate<br />
Follikuläres Lymphom<br />
Mantelzell-Lymphom<br />
Vergleich der Ansprechraten FCM vs R-FCM beim<br />
follikulären <strong>und</strong> beim Mantelzell-Lymphom. Interim-<br />
Analyse, Studie der GLSG<br />
191
Rezidive: <strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
GLSG-Studie, FCM vs FCM + Rituximab<br />
Flussdiagramm<br />
Das ursprüngliche Studiendesign sah zwei Randomisationen vor. Die initiale Chemotherapie bestand aus zwei<br />
Armen: FCM vs FCM+Rituximab. Eine Interimsanalyse ergab für die Ansprechraten einen signifikanten Vorteil<br />
der Kombination FCM+R gegenüber der alleinigen Chemotherapie. Darauf hin wurde der Arm A geschlossen<br />
<strong>und</strong> die primäre Randomisation weg gelassen. Daraus ergibt sich der nun veränderte Studienablauf.<br />
.<br />
Beachte: Schwerwiegende Zwischenfälle (Severe adverse events, SAE), d.h. Medikamentenunverträglichkeit, Toxizität<br />
mit Komplikationen, auch krankheits- <strong>und</strong> therapieunabhängige schwerwiegende Erkrankungen müssen der<br />
Studienzentrale innerhalb eines Arbeitstages umgehend mitgeteilt werden.<br />
192
Rezidive: <strong>Indolente</strong> L, Mantelzell-<strong>Lymphome</strong><br />
GLSG-Studie, FCM vs FCM + Rituximab<br />
Staging, Therapieschemata<br />
Staging vor Studienbeginn<br />
Anamnese <strong>und</strong> sorgfältige klinische Untersuchung zur Dokumentation der Lymphomlokalisation<br />
Röntgen Thorax in 2 Ebenen, CT Thorax<br />
Abdomensonogramm, CT Abdomen<br />
Optional Knochenszintigramm, Röntgenuntersuchung klinisch suspekter Knochenareale<br />
Knochenmarkzytologie <strong>und</strong> -histologie<br />
HNO-Konsil<br />
Bei klinisch suspekten extranodalen Manifestationen: gezielte bildgebende Diagnostik, Endoskopie<br />
EKG, UKG<br />
Routinelabor einschl. Beta2-Mikroglobulin, Immunglobuline<br />
Blut <strong>und</strong> KM auf chromosomale Aberrationen t (14;18), t (11;14), bcl 2, bcl 1<br />
Vor jedem Chemotherapiezyklus<br />
Anamnese <strong>und</strong> klinische Untersuchung<br />
Labor mit BB, Diff. BB, LDH, Kreatinin, Harnsäure, Transaminasen, Bilirubin, Gamma GT,<br />
alk. Phosphatase, Elektrolyte, Urinstatus.<br />
Restaging nach initialer Chemotherapie<br />
Anamnese <strong>und</strong> klinische Untersuchung mit Lymphomdokumentation<br />
Knochenmarkzytologie <strong>und</strong> –histologie, wenn primär ein Befall vorlag.<br />
PCR von Blut <strong>und</strong> Knochenmark auf t (14;18), t (11;14), bcl 2, bcl 1<br />
Komplettes Labor<br />
Bildgebende Diagnostik nur von Orten der initialen Manifestation<br />
Diagnostik in Remission<br />
Alle 3 Monate, Umfang wie beim Restaging nach initialer Chemotherapie<br />
Therapieschema FCM + R<br />
Rituximab 375 mg/m 2 d 0, 7, 14, 21<br />
Fludarabin 25 mg/m 2 /d als 30 min.-Inf. d 1-3<br />
Cyclophosphamid 200 mg/m 2 /d als 30 min-Inf. d 1-3<br />
Mitoxantron 8 mg/m 2 /d als 30 min.-Inf. d 1<br />
Wiederholung d 29<br />
Voraussetzung: Granulozyten > 2000/μl, Thrombozyten > 75.000/μl, wenn diese Werte nicht erreicht werden<br />
⇒ Therapieverzögerung um eine Woche.<br />
Bei weiterhin zu geringen Werten: Dosisreduktion wie folgt:<br />
Fludarabin 15 mg/m 2 /d über 30 min. d 1 – 3<br />
Cyclophosphamid 200 mg/m 2 /d über 60 min. d 1 – 3<br />
Mitoxantron 5 mg/m 2 über 30 min. d 1<br />
Rituximab 375 mg/m 2 d 0, 7, 14, 21<br />
Rituximabgabe: soll am Tag vor FCM erfolgen. Prämedikation, Modus der Verabreichung, Verhalten bei<br />
Infusionszwischenfällen siehe Manualblatt : Mabthera.<br />
Vorphasetherapie: bei Patienten mit peripheren Lymphozytenwerten > 20.000/μl <strong>und</strong> großer Tumormasse,<br />
z.B. bulky disease > 10 cm, soll eine Vorphasetherapie durchgeführt werden mit<br />
Cyclophosphamid 200 mg/m 2 /d über 60 min. d 1 – 3<br />
max. d 1 – 5<br />
Danach erfolgt die FCM bzw. FCM + Rituximab-Gabe in voller Dosierung.<br />
193
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
GLSG, R2A-Studie, BMR<br />
Einschluss-, Ausschlusskriterien<br />
Prospektive, nicht-randomisierte, multizentrische Phase II-Studie. Therapie des<br />
rezidivierten/refraktären, indolenten B-Zell-Lymphoms mit Bendamustin/Mitoxantron/Rituximab<br />
Einschlusskriterien<br />
Patienten > 18 Jahre<br />
Histologisch gesicherte Diagnose eines indolenten B-Zell-Lymphoms nach WHO-Klassifikation der<br />
folgenden Typen:<br />
Follikuläres Lymphom Grad I oder II<br />
Mantelzell-Lymphom<br />
Lymphoplasmozytisches Lymphom (Immunozytom)<br />
Nodales, extranodales oder splenisches Marginalzonenlymphom<br />
Lymphozytisches Lymphom mit plasmozytischer Differenzierung<br />
Sek<strong>und</strong>är hochmalignes Lymphom der o.g. <strong>Lymphome</strong><br />
Vorliegen einer Therapiebedürftigkeit<br />
Positiver CD20-Nachweis im Lymphomgewebe<br />
Die <strong>Lymphome</strong>rkrankung muss rezidiviert oder refraktär sein<br />
Es muss eine <strong>Lymphome</strong>rkrankung im Stadium III oder IV nach Ann Arbor-Kriterien vorliegen<br />
Sonographisch <strong>und</strong>/oder radiologisch messbare Läsion<br />
Bei Frauen im gebärfähigen Alter: Vorliegen eines negativen Schwangerschaftstests binnen 72<br />
St<strong>und</strong>en vor Beginn der Studienmedikation<br />
WHO-Performace Score < 3<br />
Ausreichende hämatologische Funktionen:<br />
Absolute Neutrophilenzahl > 1,5 G/l x 10 9 / l<br />
Thrombozyten<br />
> 100 G/l x 10 9 / l<br />
Ausnahmen: - Immunthrombozytopenie, Thrombozytopenie <strong>und</strong> Granulozytopenie bei<br />
ausgedehnter Knochenmarkinfiltration durch das maligne Lymphom<br />
Vorliegen einer schriftlichen Einverständniserklärung.<br />
Ausschlusskriterien<br />
Patienten mit einer nicht-kontrollierten Infektion oder einer nicht-kontrollierten Hyperkalzämie<br />
Patienten mit einer bekannten Unverträglichkeit gegenüber Bendamustin, Mitoxantron oder<br />
Rituximab.<br />
Patienten, die über keine ausreichende hepatische oder renale Funktion verfügen, sofern kein<br />
Zusammenhang zum malignen Lymphom besteht:<br />
- Gesamtbilirubin > 2,0 mg/dl<br />
- Transaminasen > 3 x obere Normwertgrenze<br />
- Serumkreatinin > 2,0 mg/dl<br />
Patienten, die ges<strong>und</strong>heitlich instabil sind (z.B. nicht eingestellter Diabetes mellitus, unkontrollierte<br />
arterielle Hypertonie oder akute respiratorische Erkrankung, akute Lebererkrankung, akute<br />
Nierenerkrankung).<br />
Schwangere oder stillende Frauen sowie gebärfähige Frauen, die keine angemessenen Kontrazeptiva<br />
benutzen.<br />
Psychische Erkrankungen, Suchtformen oder sonstige Erkrankungen, welche die Fähigkeit des<br />
Patienten zur Einverständniserklärung oder zur Teilnahme an der Studie einschränken.<br />
Gleichzeitige oder nicht weniger als 28 Tage zurückliegende Teilnahme an einer anderen klinischen<br />
Studie.<br />
Patienten, bei denen eine HIV-Infektion diagnostiziert wurde.<br />
194
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
GLSG, R2A-Studie, BMR<br />
Staging<br />
Primäres Ziel der Studie<br />
Abschätzung des Therapieerfolges, d.h. der Gesamtremissionsrate (CR+PR) bei Patienten mit<br />
rezidivierten oder therapierefraktären niedrigmalignen <strong>Lymphome</strong>n<br />
Sek<strong>und</strong>äre Ziele der Studie: Verträglichkeit <strong>und</strong> Sicherheit, Gesamtüberleben, Time to progression,<br />
Lebensqualität<br />
Studienleitung<br />
Studienzentrale<br />
PD Dr. R. Weide , PD Dr. H. Köppler<br />
Med. <strong>Klinik</strong> III, <strong>Klinik</strong>um Großhadern<br />
Praxisklinik für Hämatologie <strong>und</strong> Onkologie Tegernseer Landstrasse 243<br />
Neversstr. 5<br />
81549 München<br />
56068 Koblenz Tel.: 089-6995830, Fax: 089-69958312<br />
Tel. 0261-304930, Fax: 0261-3049333<br />
Zeitplan<br />
Der Start der Studie erfolgte 2003, mit einer anschließenden zweijährigen Rekrutierungsphase.<br />
Ethikvotum<br />
Liegt von zahlreichen Ärztekammern vor.<br />
Staging<br />
Standarddiagnostik wie in anderen GSLG-Studien. Dazu gehören initial:<br />
Laborroutine<br />
EKG, UKG<br />
CT-Hals, -Thorax, -Abdomen <strong>und</strong> –Becken<br />
Zweidimensionale Vermessung der Referenzläsion<br />
KM-Histologie/-Zytologie<br />
Untersuchung/<br />
Maßnahme<br />
Patienteneinverständnis<br />
Schwangerschaftstest<br />
(wenn nötig)<br />
Anamnese<br />
Körperliche<br />
Untersuchung<br />
Körpergewicht<br />
Performance Status<br />
Differentialblutbild,<br />
Thrombozyten, Hb<br />
Serumchemie<br />
Vor<br />
Studienbeginn<br />
a) nur beim initialen Staging erhoben<br />
b) Laboruntersuchungen nur am Tag 1+8, nicht am Tag 2<br />
X<br />
X<br />
X<br />
In der Behandlungsphase<br />
vor jeder vor jedem nach 2<br />
Applikation Zyklus Zyklen<br />
Abschlussuntersuchung<br />
In der<br />
Nachsorge<br />
X X X X<br />
X X a X a<br />
X X X X<br />
X X b X X<br />
X X b X X<br />
Nach dem zweiten Zyklus findet ein Zwischenstaging statt, hierbei wird neben der körperlichen Untersuchung<br />
eine Sonographie oder Computertomographie der befallenen Region(en) durchgeführt. Die im Rahmen des<br />
Abschlussstagings vorzunehmenden Untersuchungen entsprechen denen des initialen Stagings.<br />
195
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
GLSG, R2A-Studie, BMR<br />
Therapie<br />
Prämedikation<br />
Vor Bendamustin: (z.B.) 3 mg Granisetron i.v. Kurzinfusion, 8 mg Dexamethason i.v. Kurzinfusion<br />
Ondansetron 8 mg p.o. St<strong>und</strong>e 8 nach Beginn Chemotherapie sowie am Chemotherapie-Folgetag morgens, mittags <strong>und</strong><br />
abends 30 Minuten.<br />
Vor Rituximab: 50 mg Ranitidin (Kurzinfusion), 4 mg Dimentiden (Kurzinfusion), 8 mg Dexamethason (Kurzinfusion)<br />
BMR-Therapie<br />
Bendamustin (B) 90 mg/m²/d 60min.-Inf. Tag 1, 2<br />
Mitoxantron (M) 10 mg/m² 30 min.-Inf. Tag 1<br />
Rituximab (R) 375 mg/m² 6h-Inf Tag 8<br />
ab Zyklus 2:<br />
4h-Inf.<br />
Die Zyklen 2-4 erfolgen im vierwöchigen Abstand. Dies entspricht Behandlungen an den folgenden Tagen:<br />
Bendamustin (B): Tag 29, 30, 57, 58, 85 <strong>und</strong> 86<br />
Mitoxantron (M): Tag 29, 57, 85<br />
Rituximab (R): Tag 36, 64 <strong>und</strong> 92<br />
Schematischer Ablauf der Studie<br />
Medikament B B B B B B B B<br />
Medikament M M M M<br />
Medikament R R R R<br />
Staging<br />
Tag 1 2 8 29 30 36 57 58 64 85 86 92<br />
Abschlussstaging<br />
Nach dem zweiten Zyklus findet ein Zwischenstaging statt, hierbei wird neben der körperlichen Untersuchung eine<br />
Sonographie oder Computertomographie der befallenen Region(en) durchgeführt. Die im Rahmen des Abschlussstagings<br />
vorzunehmenden Untersuchungen entsprechen denen des initialen Stagings.<br />
Kontrolluntersuchungen<br />
Untersuchung/ Vor<br />
Maßnahme Studienbeginn<br />
In der Behandlungsphase<br />
vor jeder vor jedem nach 2<br />
Applikation Zyklus Zyklen<br />
Abschlussuntersuchung<br />
In der<br />
Nachsorge<br />
CT-Hals, -Thorax, CT-<br />
Abdomen, CT-Becken<br />
X X X<br />
Skelettszintigraphie<br />
(fakultativ)<br />
X<br />
X<br />
Abdomensonographie X X X<br />
2 D Vermessung der<br />
Referenzläsion<br />
X e X e X e X e<br />
KM-Histologie/-<br />
Zytologie<br />
X<br />
X<br />
EKG, Echokardiographie<br />
X<br />
X<br />
Beschwerden <strong>und</strong><br />
Symptome<br />
X X X<br />
Nebenwirkungen <strong>und</strong><br />
Toxizitäten<br />
X<br />
X c<br />
Beurteilung d. Lebensqualität<br />
(mittels Frage-<br />
X X X X f<br />
bogen LQ-30)<br />
c Nebenwirkungen <strong>und</strong> Toxizitäten müssen zusätzlich im Falle ausserplanmäßiger Kontrollen erhoben <strong>und</strong> dokumentiert werden.<br />
d<br />
e<br />
f<br />
Obligat nur bei initialem Knochenmarksbefall.<br />
Sonographie oder Computertomographie<br />
2 x jährlich<br />
196
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
GSLG, Gemzar/Oxaliplatin, R2B-Studie<br />
Ein-, Ausschlusskriterien<br />
Multizentrische Phase I/II-Studie zur Wirksamkeit einer kombinierten Gemcitabin/Oxaliplatin-<br />
Therapie bei rezidivierten indolenten <strong>Lymphome</strong>n.<br />
Zielstellung<br />
Das Ziel der Studie ist die Etablierung eines nicht kreuzresistenten Therapieregimes beim rezidivierten<br />
indolenten Lymphom<br />
Studienleitung<br />
Studienzentrale<br />
Dr.M. Hoffmann<br />
Dr. M.Unterhalt<br />
Medizinische <strong>Klinik</strong> A<br />
<strong>Klinik</strong>um Großhadern, München<br />
<strong>Klinik</strong>um der Stadt Ludwigshaften<br />
Medizinische <strong>Klinik</strong> III<br />
Bremserstr. 79 Tegernseer Landstr. 243<br />
67063 Ludwigshafen 81549 München<br />
Tel.: 0621/503-0 Tel.: 089 / 6995-830<br />
Fax. 0621/503-3918 Fax: 089 / 6995-8312<br />
Emal: HoffmannM@KliLu.de<br />
Einschlusskriterien<br />
Therapiebedürftige Patienten mit rezidiviertem oder therapierefraktärem indolentem NHL,<br />
histologisch gesicherte Erkrankung<br />
(WHO-Klassifikation: Follikuläres Lymphom Grad I oder II, Mantelzell-Lymphom, Lymphoplasmozytisches<br />
Lymphom (Immunozytom), nodales oder splenisches Marginalzonenlymphom, lymphozytisches<br />
Lymphom mit plasmozytischer Differenzierung)<br />
messbare Tumormanifestation<br />
keine zytotoxische Therapie in den letzten vier Wochen vor Studienbeginn<br />
ECOG-Status 0-2<br />
geschätzte Lebenserwartung mindestens 12 Wochen<br />
Alter > 18 Jahre<br />
schriftliche Patienteneinwilligung<br />
Vorliegen des Ethikvotums der Landes-Ärztekammer<br />
Ausschlusskriterien<br />
Patienten, die für eine Hochdosistherapie in Betracht kommen<br />
sek<strong>und</strong>är hochmalignes Lymphom<br />
andere maligne Vorerkrankung in der Anamnese, soweit nicht nach allgemeiner Kenntnis von einer<br />
sicheren Heilung ausgegangen werden kann<br />
schwere Allgemeinerkrankungen (nach Einschätzung der Prüfarztes)<br />
nicht Lymphom-bedingte Leberschädigung mit Transaminasen-Werten über dem Dreifachen der Norm<br />
<strong>und</strong>/oder Bilirubinwerten > 2,0 mg/dl<br />
nicht Lymphom-bedingte Niereninsuffizienz (Serumkreatinin > 2,0 mg/dl)<br />
Schwangerschaft <strong>und</strong> Stillzeit<br />
Neutrophile < 1,5/nl oder Thrombozyten < 100/nl, wenn nicht als Folge des Lymphoms<br />
ZNS-Erkrankung (z.B. Metastasen, therapierefraktäres Krampfleiden)<br />
schwere psychiatrische Erkrankung<br />
HIV-Infektion<br />
akute nicht beherrschbare Infektionen<br />
197
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
GSLG, Gemzar/Oxaliplatin, R2B-Studie<br />
Diagnostik, Therapie<br />
Eingangsuntersuchungen<br />
körperliche Untersuchung, Karnofsky-Index, Körpergewicht,<br />
Großes Blutbild, Na, K, Ca, Kreatinin, Harnstoff, Harnsäure, LDH, GOT, GPT,<br />
γGT, AP, Bilirubin, Quick, PTT, BZ, Gesamt-Eiweiß, Serum-Elektrophorese, β2-Mikroglobulin,<br />
Urinstatus, Schwangerschaftstest<br />
HIV- <strong>und</strong> Hepatitis-Serologie (B+C)<br />
EKG, Herzecho,<br />
RöThorax, Abdomen-Sono, bildgebende Diagnostik der Lymphom-Manifestationen (bevorzugt CT)<br />
Knochenmarkzytologie <strong>und</strong> –histologie<br />
Therapie<br />
Gemcitabin 1.000 mg/m² 30 Min-Inf. Tag 1 <strong>und</strong> 15<br />
Oxaliplatin 70 mg/ m² 120 Min. Tag 1 <strong>und</strong> 15<br />
Wiederholung der Therapie am Tag 29, insgesamt 4 Zyklen<br />
Interindividuelle Dosissteigerung<br />
Oxaliplatin wird in Schritten von 10 mg/ m² nach folgendem Plan gesteigert:<br />
Dosisstufe<br />
Oxaliplatindosis<br />
1 70 mg/m²<br />
2 80 mg/m²<br />
3 90 mg/m²<br />
4 100 mg/m²<br />
Ablauf<br />
Gabe von 2 Zyklen, danach Restaging<br />
Fortsetzung der Therapie bei CR, PR oder SD<br />
Abbruch bei Progression oder Toxizität WHO-Grad IV<br />
Kontrolluntersuchungen während der Therapie wöchentlich<br />
wöchentlich Blutbild, Elektrolyte, Nieren- <strong>und</strong> Leberwerte<br />
Zwischenuntersuchung<br />
Erfolgt nach jeweils zwei Zyklen direkt vor dem Folgezyklus<br />
Labor wie Eingangsuntersuchung (kein Schwangerschaftstest) <strong>und</strong> sonstige vorher pathologisch<br />
veränderte Bef<strong>und</strong>e, bildgebende Diagnostik der Lymphom-Manifestationen<br />
Knochenmarkzytologie <strong>und</strong> –histologie (nur bei vorherigem Befall)<br />
Abschlussuntersuchung (nach Therapieende unabhängig vom Gr<strong>und</strong>)<br />
Parameter s. Eingangsuntersuchung<br />
Knochenmarkzytologie <strong>und</strong> –histologie (nur bei vorherigem Befall)<br />
Nachsorge<br />
Parameter s. Zwischenuntersuchung<br />
sonstige Untersuchungen<br />
Studiendauer<br />
die Behandlung erfolgt über maximal 4 Zyklen<br />
Abbruchkriterien für den einzelnen Patienten<br />
messbarer Progress (> 25% des Basiswertes)<br />
oder nicht-hämatologische Toxizitäten Grad IV der WHO-Klassifikation (mit Ausnahme von<br />
Erbrechen, Übelkeit oder Haarausfall)<br />
Therapienebenwirkungen müssen im Falle von SAE sofort gemeldet werden (Anhang L), bei<br />
einem therapiebedingtem Todesfall überprüft die Studienleitung das Protokoll, ob wegen des Todesfalls<br />
Protokolländerungen erfolgen müssen.<br />
198
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
STIL*, Rezidivtherapie, R-B vs R-F-Studie<br />
Ein-, Ausschlusskriterien<br />
* Studiengruppe indolente <strong>Lymphome</strong><br />
Phase III-Protokoll der Studiengruppe indolente <strong>Lymphome</strong>.<br />
Es soll primär die Frage beantwortet werden, ob in der Rezidivtherapie niedrigmaligner <strong>und</strong> Mantelzell-<br />
<strong>Lymphome</strong> die Chemo-/Immuntherapie mit Bendamustin <strong>und</strong> Rituximab der bereits erprobten Anwendung von<br />
Fludarabin plus Rituximab bezüglich der ereignisfreien Überlebenszeit (EFS) gleichwertig ist.<br />
Studiensekretariat<br />
Dr. M. Rummel, Dr. St. Krüger, B. Kosleck-Pikowski<br />
Medizinische <strong>Klinik</strong> III, Universitätsklinikum, Theodor-Stern-Kai 7<br />
60590 Frankfurt, Tel.: 069 / 6301 – 4039, Fax: 069 / 6301 - 5038<br />
Einschlusskriterien<br />
Rezidiv der nachstehenden histologischen Entitäten<br />
a) Follikuläres Lymphom Grad 1 <strong>und</strong> 2 (cb-cc nach der Kiel-Klassifikation)<br />
b) Lymphoplasmozytisches Lymphom / Immunozytom (inkl. M. Waldenström)<br />
c) Lymphozytisches Lymphom (CLL ohne Leukämie) (lymphoplasmozytoid Kiel)<br />
d) Nodales <strong>und</strong> generalisiertes (nodal <strong>und</strong> extranodal) Marginalzonen Lymphom<br />
e) Mantelzell Lymphom (CC nach der Kiel-Klassifikation)<br />
f) nicht weiter oder näher klassifizierbare niedrigmaligne <strong>Lymphome</strong><br />
(z.B., wenn nicht genügend Biopsiematerial gewonnen werden konnte, oder wenn kein<br />
Lymphknoten exstirpiert werden konnte <strong>und</strong> die Diagnose anhand einer Knochenmark- oder<br />
anderen Biopsie gestellt wurde, das Gewebe trotz vollständiger Untersuchung nicht in eine<br />
der histologischen Kategorien der WHO-Klassifikation zugeordnet werden konnte <strong>und</strong> es sich<br />
sicher um ein niedrigmalignes B-Zell Lymphom handelt. Bitte in diesem Fall Rücksprache mit<br />
der Studienzentrale)<br />
Histologie positiv für CD20<br />
Klinisch mindestens 3 Monate Remissionsdauer:<br />
- unabhängig von der Art <strong>und</strong> der Anzahl der Vortherapien, wenn bisher noch keine Therapie mit<br />
Rituximab erfolgt ist oder<br />
- nach vorheriger Rituximab-haltiger Therapie bei einer Remissionsdauer > 1 Jahr<br />
oder<br />
- therapierefraktär auf die Vortherapie (Progression unter der Therapie oder innerhalb 3 Monate nach<br />
Ende der vorherigen Therapie), außer Therapierefraktärität auf Purinanaloga oder Bendamustin<br />
Therapiebedürftigkeit (siehe unten), bei Mantelzell <strong>Lymphome</strong>n immer gegeben.<br />
Stadium II (bulky disease 7,5 cm), III oder IV<br />
Alter mindestens 18 Jahre<br />
Allgemeinzustand nach WHO 0-2<br />
Schriftliche Einverständniserklärung des Patienten<br />
Eine aktuelle Histologie, die nicht älter als 6 Monate sein sollte, ist erforderlich.<br />
Ausschlusskriterien<br />
Möglichkeit einer potentiell kurativen Strahlentherapie<br />
Patienten, die therapierefraktär auf eine Rituximab-haltige Therapie sind<br />
Begleiterkrankungen, die eine studiengerechte Therapiedurchführung ausschließen:<br />
Herzinfarkt innerhalb der letzten 6 Monate, schwere medikamentös nicht einstellbare Hypertonie, schwere<br />
Funktionseinschränkungen des Herzens nach NYHA III oder IV, der Lunge WHO-Grad III oder IV, der Leber<br />
<strong>und</strong> der Niere (Kreatinin > 2 mg/dl, GOT <strong>und</strong> GPT oder Bilirubin über 3-faches der Norm), außer wenn<br />
lymphombedingt<br />
Aktive autoimmunhämolytische Anämie (AIHA)<br />
Patienten mit nachgewiesener HIV-Infektion<br />
Aktive Hepatitis-Infektion<br />
Schwere psychiatrische Erkrankungen<br />
Fehlende oder nicht zu erwartende Compliance<br />
Schwangere oder stillende Frauen<br />
Patienten mit Zweitmalignom oder einer malignen Erkrankung in der Vorgeschichte, wenn nicht von einer<br />
sicheren chirurgischen Kuration ausgegangen werden kann<br />
199
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
STIL*, Rezidivtherapie, RB vs RF-Studie<br />
Indikation, Diagnostik<br />
Indikation zur Therapie<br />
Bei den aggressiveren <strong>und</strong> prognostisch ungünstigen Mantelzell <strong>Lymphome</strong>n ist die Indikation zur Therapie<br />
stets gegeben. Bei den anderen niedrigmalignen <strong>Lymphome</strong>ntitäten besteht eine Therapiebedürftigkeit, wenn<br />
eines der folgenden Kriterien erfüllt ist:<br />
B-Symptomatik:<br />
- Fieber unklarer Ätiologie > 38 °C<br />
- Nachtschweiß<br />
- Gewichtsverlust > 10% des Ausgangsgewichtes innerhalb von 6 Monaten<br />
Hämatopoetische Insuffizienz:<br />
Periphere Zytopenie, nicht durch eine Splenomegalie bedingt<br />
(Granulozyten < 1.500 /µl, Hb < 10 g/dl, Thrombozyten < 100.000 /µl)<br />
Objektivierbare, rasche Tumorprogredienz:<br />
Zunahme der Zahl oder Größe von Lymphommanifestationen um > 50% innerhalb eines halben Jahres<br />
Große Tumormasse („bulky disease“):<br />
<strong>Lymphome</strong> > 5 cm Durchmesser in 3 <strong>und</strong> mehr Regionen oder > 7,5 cm in einer Region<br />
Lymphombedingte Komplikationen, wie Einengung von Ureteren oder Gallengängen, rezidivierende<br />
Milzinfarkte, tumorbedingte Kompression eines lebenswichtigen Organs, lymphominduzierte Schmerzen, etc.<br />
Hyperviskositätssyndrom durch monoklonale Gammopathie<br />
Diagnostik vor Therapiebeginn<br />
Zur genauen Stadieneinteilung <strong>und</strong> Statuserhebung vor Therapiebeginn gehören folgende Untersuchungen:<br />
Anamnese <strong>und</strong> körperliche Untersuchung<br />
Palpation der peripheren Lymphknotenregionen<br />
Knochenmark-Zytologie (Aspiration) <strong>und</strong> -Histologie (Stanze)<br />
Lymphknotenexstirpation bei Befall von peripheren Lymphknoten<br />
Bei leukämischer Ausschwemmung (> 4.000 Lymphozyten/µl) immunologische Charakterisierung der<br />
Lymphomzellen (CD3, CD4, CD5, CD8, CD10, CD19, CD20, CD23, FMC7, Doppelmarkierung CD5/CD19<br />
oder CD5/CD20)<br />
CT-Thorax <strong>und</strong> röntgenologische Untersuchung der Thoraxorgane<br />
CT-Abdomen <strong>und</strong> Sonographie des Abdomens<br />
Laboruntersuchungen:<br />
Blutbild, Diff., Reti., CD4-/CD8-Lymphozyten, Coombs-Test, BSG, biochemisches Profil, Gerinnung,<br />
quantitativ Immunglobuline, Immunelektrophorese, Beta-2-Mikroglobulin<br />
EKG<br />
Diagnostik während der Therapie<br />
Vor jedem Therapiezyklus<br />
Blutbild <strong>und</strong> Differentialblutbild, biochemisches Profil, CD4-/CD8-Lymphozyten<br />
Zwischen den Therapiezyklen<br />
1 x wöchentlich Bestimmung des Blutbildes <strong>und</strong> Differentialblutbildes.<br />
Während der Phthise können Blutbildkontrollen in kürzeren Abständen indiziert sein.<br />
* Studiengruppe indolente <strong>Lymphome</strong><br />
Nach dem 3. Zyklus<br />
Eine Reevaluation der Tumorparameter erfolgt nach dem 3. Therapiezyklus mit Wiederholung aller<br />
entsprechenden Untersuchungen. Die Knochenmarkbiopsie sollte jedoch erst nach Abschluß der Chemotherapie<br />
(spätestens nach dem 6. Therapiezyklus) durchgeführt werden, sofern die anderen Untersuchungen auf eine<br />
Remission des Lymphoms hinweisen.<br />
Diagnostik bei Abschluß der Therapie<br />
Nach dem letzten bzw. 6. Therapiezyklus erfolgt ein komplettes Restaging mit Wiederholung aller<br />
Eingangsuntersuchungen, inklusive Knochenmark-Zytologie (Aspiration) <strong>und</strong> -Histologie (Stanze). Dabei<br />
sollen apparative bzw. invasive diagnostische Maßnahmen nur bei positivem (pathologischen) Bef<strong>und</strong> des<br />
letzten Stagings erfolgen.<br />
200
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
STIL*, Rezidivtherapie, R-B vs R-F-Studie<br />
Therapie<br />
* Studiengruppe indolente <strong>Lymphome</strong><br />
Therapieplan<br />
Bendamustin plus Rituximab (B-R)<br />
R<br />
B B-R B-R B-R<br />
B-R<br />
B-R<br />
Tag<br />
0 1 29 57 85 113 141<br />
B = Bendamustin 90 mg/qm Tag 1+2 29+30 57+58 85+86 113+114 141+142<br />
R = Rituximab 375 mg/qm Tag 0 29 57 85 113 141<br />
Randomisation<br />
Fludarabin plus Rituximab (F-R)<br />
R<br />
F F-R F-R F-R<br />
F-R<br />
F-R<br />
Tag<br />
0 1 29 57 85 113 141<br />
F = Fludarabin 25 mg/qm Tag 1-3 29-31 57-59 85-87 113-115 141-143<br />
R = Rituximab 375 mg/qm Tag 0 29 57 85 113 141<br />
Therapiedauer<br />
Maximal 6 Zyklen. Bei früher eintretender CR oder bei Progression Reduktion der Zahl der Zyklen. Bei früher<br />
eintretender CR oder sehr guter PR können 2 weitere konsolidierende Zyklen verabreicht werden, jedoch<br />
insgesamt maximal nur 6 Zyklen.<br />
Nach dem 3. Zyklus erfolgt ein Zwischenstaging. Wenn ein Ansprechen auf die Therapie zu beobachten ist,<br />
Therapiefortführung bis zum max. Ansprechen, jedoch maximal 6 Zyklen.<br />
Zellzahlen vor Fortsetzung der Therapie<br />
Vor Beginn eines neuen Chemotherapiezyklus sollen Werte für Leukozyten > 2.000 /µl <strong>und</strong> Thrombozyten ><br />
100.000 /µl vorliegen. Sind diese Grenzwerte 4 Wochen nach B-R oder F-R nicht erreicht, wird der nächste<br />
Zyklus um eine Woche verschoben. Bei persistierender Leukozytopenie oder Thrombozytopenie kann die<br />
Therapie mit einer reduzierten Dosis (siehe nachfolgenden Punkt) fortgeführt werden.<br />
Dosisreduktion bei therapieinduzierter Myelosuppression<br />
Bei höhergradiger therapieinduzierter Myelosuppression mit einem der folgenden Parameter wird in den<br />
nachfolgenden Zyklen die Dosis wie folgt reduziert bei voller Rituximabdoserung:<br />
Leukozyten < 1 G/l gemessen an 2 Tagen<br />
Thrombozyten < 75 G/l (außer wenn lymphombedingt) gemessen an 2 Tagen<br />
1. Reduktionsstufe B-R: Bendamustin 70 mg/m 2 i.v. Tag 1+2<br />
1. Reduktionsstufe F-R: Fludarabin 20 mg/m 2 i.v. Tag 1-3<br />
Tritt unter reduzierter Dosis gemäß 1. Reduktionsstufe eine erneute Myelosuppression<br />
mit Unterschreiten der oben genannten Leukozyten- oder Thrombozytenwerten auf,<br />
erfolgt eine weitere Dosisreduktion auf die 2. <strong>und</strong> ggf. auf die 3. Reduktionsstufe:<br />
2. Reduktionsstufe B-R: Bendamustin 60 mg/m 2 i.v. Tag 1+2<br />
2. Reduktionsstufe F-R: Fludarabin 25 mg/m 2 i.v. Tag 1+2<br />
3. Reduktionsstufe B-R: Bendamustin 50 mg/m 2 i.v. Tag 1+2<br />
3. Reduktionsstufe F-R: Fludarabin 20 mg/m 2 i.v. Tag 1+2<br />
Strahlentherapie ist nicht vorgesehen, kann jedoch nach Beendigung der<br />
Chemotherapie zur Elimination verbliebener größerer Tumorherde oder bei<br />
Krankheitsprogression durchgeführt werden.<br />
Fludarabin:<br />
Beachte die<br />
Notwendigkeit der<br />
Dosisreduktion bei<br />
eingeschränkter<br />
Nierenfunktion!<br />
Siehe: Fludarabin<br />
Infektionsprophylaxe:<br />
eine Pneumocystiscarinii-Prophylaxe<br />
mit Cotrim forte 2x1Tbl<br />
3x/ Woche (Mo- Mi-Fr)<br />
ist erforderlich<br />
201
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
Allogene PBSCT, R2D-Studie<br />
Ein-, Ausschlusskriterien<br />
Prospektive, multizentrische Phase II-Studie. Allogene Blutstammzell-Transplantation mit<br />
dosisreduzierter Konditionierung bei Patienten mit fortgeschrittenem follikulärem <strong>und</strong> Mantelzell-<br />
Lymphom (MCL).<br />
Primäres Studienziel<br />
Ansprechrate (best response) innerhalb eines Jahres.<br />
Sek<strong>und</strong>äres Studienziel: Therapieassoziierte Mortalität, progressionsfreies Überleben,<br />
Gesamtüberleben, molekulare Remission, Chimärismus<br />
Studienleitung<br />
Studiensekretariat<br />
Prof. Dr. W.Hiddemann, München<br />
Dr. M. Unterhalt<br />
Prof. Dr. H.-J- Kolb, München Tegernseer Landstr. 243<br />
Prof. Dr. A.Neubauer, Marburg<br />
81549 München<br />
Prof. Dr. N. Schmitz, Hamburg Tel.: 089 / 6995-830<br />
Fax: 089 / 6995-8312<br />
Medizinische Nachfragen: Dr. M. Weisser<br />
III. Med. <strong>Klinik</strong>, <strong>Klinik</strong>um Großhadern, München, Tel.: 089 / 7095-4241<br />
Einschlusskriterien<br />
histologisch erneut gesichertes follikuläres Lymphom Grad I/II oder Mantelzell-Lymphom<br />
(Primärerkrankung < 6 Monate zurückliegend)<br />
zweites oder höheres Rezidiv (follikuläres Lymphom) bzw. rezidiviertes Mantelzell-Lymphom<br />
Z.n. Hochdosistherapie mit autologer Stammzelltransplantation oder Z.n. erfolgloser<br />
Stammzellmobilisation<br />
Behandlungsbedürftigkeit<br />
Vorhandensein eines HLA-identischen Familien- oder Fremdspenders (1 Mismatch erlaubt)<br />
Alter 18-60 Jahre (Fremdspender) bzw. 18-65 Jahre (Familienspender)<br />
Karnofsky-Index > 70%<br />
keine Interferongabe in den letzten 3 Monaten<br />
Einverständniserklärung des Patienten<br />
Ausschlusskriterien<br />
sek<strong>und</strong>är hochmalignes Lymphom<br />
ZNS-Befall durch das Lymphom<br />
Coombs-positive hämolytische Anämie<br />
kardiale Erkrankungen (therapiebedürftige kardiale Arrhythmien, Verringerung der Auswurffraktion<br />
auf < 30%, höhergradige KHK)<br />
schwere Lungenerkrankungen (Einschränkung der Lungenfunktion mit Reduktion der DLCO auf<br />
< 60% oder VK < 60% des Sollwertes)<br />
Lebererkrankungen (Erhöhung der Serumwerte der Transaminasen <strong>und</strong>/oder des Bilirubins auf das<br />
> 2.0-fache des oberen Normwertes, nicht Lymphom-bedingt)<br />
deutliche Nierenfunktionseinschränkungen (Kreatininclearance < 50 ml/min, nicht lymphom-bedingt)<br />
Infektionen mit Hepatitis B, Hepatitis C oder HIV<br />
aktive Zweitmalignome (ausgenommen Basaliom der Haut, Cervix-Ca in situ)<br />
schwerwiegende neurologische oder psychiatrische Erkrankungen<br />
Schwangerschaft<br />
Lebenserwartung weniger als 6 Monate nach klinischer Einschätzung<br />
Fehlende Einverständniserklärung<br />
202
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
Allogene PBSCT, R2D-Studie<br />
Flussdiagramm<br />
Flussdiagramm<br />
Behandlungsschemata für die initiale zytoreduktive Therapie<br />
Vor der allogenen Transplantation werden die Patienten bezüglich des geschätzten Tumorloads in zwei<br />
Gruppen eingeteilt: einen Hochrisiko- <strong>und</strong> einen Standardrisikoarm. Kriterien für eine<br />
Hochrisikokonstellation sind:<br />
Lymphom-Bulk > 5 cm<br />
oder 3 <strong>Lymphome</strong> > 3 cm<br />
oder LDH > 1.5 x Normwert<br />
oder KM-Infiltration > 20%<br />
oder Lymphom-bedingte hämatopoetische Insuffizienz<br />
203
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
Palliative Chemotherapie I<br />
Chlorambucil + Prednison stellt noch immer den Goldstandard in der Chemotherapie der CLL dar. Die<br />
Ansprechraten liegen bei 60 - 80 %.<br />
Knospe-Schema 1974<br />
Leukeran 5 mg/m 2 /d p.o. d 1-3<br />
Prednison 75 mg, absolut p.o. d 1<br />
50 mg, absolut p.o. d 2<br />
25 mg, absolut p.o. d 3<br />
Wiederholung: Tag 15<br />
Leukeran kann um 1,3 mg/m 2 gesteigert werden, bis eine Wirksamkeit erreicht ist oder eine Toxizität<br />
auftritt. Praktikabler als das Original-Knospe-Schema ist diese Modifikation.<br />
Leukeran + Prednison<br />
Leukeran 10-15 mg (abs.)/d p.o. d 1-7<br />
Prednison 60 mg (abs.)/d p.o. d 1-7<br />
Beachte:<br />
Die Therapie ist gut verträglich. Initial kommt es häufig zu einem vorübergehenden Leukozytenanstieg<br />
infolge eines kortisonbedingten Poolshifts. Bei sehr hohen Lymphozytenzahlen einer CLL kann die<br />
Therapie initial auch bis zum Tag 14, im Einzelfall sogar noch länger durchgeführt werden. Die<br />
Möglichkeit einer KM-Depression ist jedoch zu beachten.<br />
Die Therapie kann auch als alleinige Leukeranbehandlung durchgeführt werden.<br />
L+P stellt die Standardtherapie der CLL <strong>und</strong> des Immunozytoms dar.<br />
Weitere Therapieschemata:<br />
Endoxan + Prednison (mod. Ezdinli et al. 1980)<br />
Endoxan 600 mg/m 2 /d Inf. d 1, 8<br />
Prednison 100 mg/m 2 /d i.v. d 1, 8<br />
100 mg/m 2 /d p.o. d 2 - 7<br />
Uromitexan 200 mg abs./d h 0, 4, (8) d 1, 8<br />
Wiederholung: Tag 22 - 29<br />
COP<br />
Endoxan 400 mg/m²/d 1h-Inf. Tag 1 - 5<br />
Vincristin 2 mg (abs.) i.v. Bypass Tag 1<br />
Prednison 40 mg/m²/d p.o. Tag 1 - 5<br />
Wiederholung: Tag 22 – 29<br />
CAP<br />
Endoxan 750 mg/m² 1h-Inf. Tag 1<br />
Adriamycin 50 mg/m² i.v. Bypass Tag 1<br />
Prednison 40 mg/m² p.o. Tag 1-5<br />
Wiederholung: Tag 22 – 29<br />
chop (induvidualisierte Variante von CHOP)<br />
Wie COP zusätzlich<br />
Adriamycin 25 mg/m² i.v. Bypass Tag 1<br />
Wiederholung: Tag 22 – 29<br />
204
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
Palliative Chemotherapie II<br />
Kommt bei einem Rezidiv oder bei einem primären Therapieversagen nach einer CHOP-Behandlung<br />
eines hochmalignen NHL keine kurativ-intentionierte Therapie in Frage, empfiehlt sich eine<br />
zytoreduktive, auf Palliation orientierte Behandlung, die definitionsgemäß nur eine geringe Toxizität<br />
aufweisen darf. Mit einer solchen Behandlung läßt sich bei einem Teil der Patienten eine subjektive<br />
Besserung erreichen <strong>und</strong> für eine Zeit ein Fortschreiten der Erkrankung vermeiden.<br />
Palliativtherapien<br />
IMEP - Siehe Blatt: NHL - hochmaligne, Rezidivtherapie IMVP-16, IMEP.<br />
Senioren - CHOP - Siehe Blatt: NHL - hochmaligne, Senioren - CHOP.<br />
VCR - BLEO - PRED<br />
Vincristin 0,5 - 1 mg i.v. Bypass Tag 1<br />
Bleomycin 15 mg Inf. Tag 1<br />
Decortilen 90 mg i.v. Tag 1<br />
Decortin 60 mg p.o. Tag 2 - 5<br />
Wiederholung: alle 14 Tage.<br />
VP-16 + DEXA<br />
Vepesid 100 mg (abs.)/d Inf. / 250 ml NaCl Tag 1 - 3<br />
Dexamethason 40 mg (abs.)/d Inf. / 250 ml NaCl Tag 1 - 3<br />
Wiederholung: Tag 22.<br />
Vepesid oral: Siehe Blatt: NHL, CB/CC, CC, IC, Rezidivtherapie, orales Vepesid<br />
CYT + PRED<br />
Endoxan 500 mg Inf. / 500 ml NaCl Tag 1<br />
Decortilen 90 mg i.v. Tag 1<br />
Wiederholung: wöchentlich<br />
VBL - PRED<br />
Vinblastin 5 - 10 mg (abs.) i.v. Bypass Tag 1<br />
Decortilen 90 mg (abs.) i.v. Tag 1<br />
Wiederholung: Tag 15<br />
205
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
Rituximab, Fludarabin<br />
Rituximab<br />
Aufgr<strong>und</strong> der ausgezeichneten Ansprechraten von z. B. 67% (CR 11%, PR 45%, MR 11%) in der<br />
skandinavischen Nordic Group bei den indolenten <strong>Lymphome</strong>n auf eine Monotherapie mit dem<br />
CD20-Antikörper, hat die Substanz einen festen Platz in der Rezidivtherapie, wenn Mabthera in der<br />
Ersttherapie nicht zum Einsatz gekommen war. Rituximab kann sowohl als Einzelsubstanz als auch in<br />
einer Kombination gegeben werden, z.B. zusammen mit Interferon oder mit Bendamustin (siehe R-B-<br />
Studie). Rituximab+Interferon erhöhte in der Studie der Nordic Group die Responserate signifikant<br />
gegenüber einer alleinigen Mabtheratherapie (Kimby E. Evolution <strong>und</strong> Revolution in NHL Therapy, Monaco 31.10.-<br />
2.11.2003).<br />
Mabthera 375 mg/m² i.v. Inf. wöchentlich x 4<br />
Wiederholung wöchentlich, 4 Applikationen für einen Zyklus<br />
Fludarabin<br />
Voraussetzung:Histologische Sicherung des Rezidivs. Spätrezidiv > 6 Monate nach Ende einer COPoder<br />
PmM- bzw. einer vergleichbaren Therapie. Eine Interferonbehandlung während der Remission<br />
hat keinen Einfluß auf den Therapieentscheid. Einverständniserklärung.<br />
Dosierung<br />
Fludarabin 25 mg/m 2 /d 30 min. Inf. Tag 1 – 5<br />
Wiederholung Tag 29. Zahl der Zyklen: 4<br />
Beachte<br />
Fludarabin darf nicht gegeben werden, wenn eine Coombs-positive autoimmunhämolytische Anämie<br />
vorliegt. In der Literatur sind bei lymphom-assoziierter AIHA <strong>und</strong> Fludarabin hämolytische Krisen mit<br />
letalem Ausgang beschrieben worden.<br />
Auf die Dosisreduktion bei eingeschränkter Nierenfunktion ist unbedingt zu achten. Details siehe Blatt<br />
Fludarabin.<br />
Nebenwirkungen: Siehe Blatt: NHL, Fludarabin.<br />
Dosismodifikationen<br />
Dosisreduktion auf 20 mg/m 2 für alle nachfolgenden Zyklen, wenn eine der folgenden<br />
hämatologischen Toxizitäten auftrat:<br />
- Leukozytennadir < 1.000/µl<br />
- Thrombozytennadir < 20.000/µl<br />
- Verzögerte Recovery: Erst nach Tag 35 Granulozyten > 1 G/l,<br />
Thrombozyten > 100 G/l.<br />
Dies gilt nicht, wenn die Zytopenie lymphombedingt ist.<br />
Eine Einschränkung der Nierenfunktion verlangt eine Dosisreduktion. Siehe Blatt Fludarabin<br />
Zahl der Zyklen<br />
Hängt vom Therapieergebnis ab.<br />
CR nach 4 Zyklen: zwei weitere Zyklen zur Konsolidierung<br />
CR oder PR nach 6 Zyklen: keine weitere Behandlung.<br />
PD: Beendigung der Behandlung.<br />
206
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
IMEP-Schema<br />
Zielgruppe<br />
Patienten mit primärer Resistenz oder mit Frührezidiv (< 6 Monate) nach COP oder PmM bzw. MCP.<br />
Therapieerforderlichkeit<br />
B-Symptome.<br />
Granulozyten < 1500/µl, Hb < 10 g/dl, Thrombo < 100.000/µl.<br />
Bei Immunozytom Gesamteiweiß > 9,5 g/dl.<br />
Bulky disease mediastinal ≥ 7,5 cm, Lnn ≥ 5 cm.<br />
Vermehrung der Lymphomzellmasse ≥ 50 % innerhalb von 6 Monaten.<br />
Kontraindikationen<br />
Manifeste Herzinsuffizienz. Kreatinin > 2.0 mg/dl. Sonstige Gegebenheiten, die eine intensive<br />
Chemotherapie nicht sinnvoll erscheinen lassen.<br />
IMEP<br />
Ifosfamid 1000 mg/m 2 /d Infusion Tag 1-5<br />
Mesna 200 mg/m 2 /d h 0,4,8 Inf. Tag 1-5<br />
Methotrexat 30 mg/m 2 /d i.v. Tag 3<br />
Etoposid 100 mg/m 2 /d Infusion Tag 1-3<br />
Prednison 40 mg/m 2 /d po. (i.v.) Tag 1-7<br />
Wiederholung Tag 14 (-21). Zahl der Zyklen: 6 + 2<br />
Zahl der Zyklen<br />
Hängt von dem Therapieergebnis nach 4 Zyklen ab:<br />
Im Falle einer CR: Gesamtzahl der Zyklen 6<br />
Im Falle einer PR: Gesamtzahl der Zyklen 8<br />
Bei fehlender PR oder CR: Beendigung der IMEP-Therapie.<br />
Durchführung<br />
Die Therapie wird dosis- <strong>und</strong> zeitgerecht bei Leuko > 2.5 G/l <strong>und</strong> Thrombo > 80 G/l nach<br />
Durchschreiten des Nadirs fortgesetzt. Sind die Grenzwerte nicht erreicht, wird bis zur Rekonstitution<br />
gewartet. Geht die Verzögerung über den Tag 21 hinaus, dann Dosisreduktion aller Zytostatika auf<br />
75 % mit Ausnahme des Prednison.<br />
Radiatio<br />
Erreicht der Patient nach 8 Zyklen lediglich eine PR, so wird bei nodalen Manifestationen eine<br />
involved field-Bestrahlung (40 Gy) empfohlen.<br />
Beachte<br />
Nephro-, Myelotoxizität, emetogene Wirkung, besonders des Ifosfamid, Alopezie Grad 3.<br />
Berücksichtige Dosierungsökonomie des Vepesid. Eine Ampulle enthält 100 mg.<br />
207
<strong>Indolente</strong> L, Mantelzell-L, Rezidiv/refraktär<br />
Orales Vepesid<br />
Die orale Vepesidtherapie kann in sinnvoller Weise eingesetzt werden, wenn es nach mehreren<br />
Standardrezidivtherapien erneut zu einer Progression kommt <strong>und</strong> eine wenig toxische zytoreduktive,<br />
ambulant durchführbare Behandlung gewünscht wird.<br />
Therapie<br />
Vepesid 50 mg/m 2 /d p.o. Tag 1 – 21<br />
Bei stärkerer Knochenmarktoxizität kann die Therapie auf 14 Tage verkürzt werden.<br />
Wiederholung: Tag 29, vorausgesetzt die Leuko sind > 3000/µl, Thrombo > 100.000 u/l<br />
Dauer<br />
Mindestens 4 Zyklen, falls keine schwerwiegenden Nebenwirkungen oder ein Krankheitsprogreß zum<br />
Abbruch zwingen.<br />
PR nach 4 Zyklen: zwei weitere Therapien, dann Ende der Behandlung, unabhängig vom erreichten<br />
Ergebnis.<br />
MR nach 6 Zyklen: Ende der Therapie.<br />
Progrediente Erkrankung: Ende der Therapie nach Feststellung der PD.<br />
Hinweis<br />
Vepesid Oral steht als unteilbare 50 mg <strong>und</strong> 100 mg Kapseln zur Verfügung. Die Therapie ist gut<br />
verträglich, problemlos ambulant durchführbar, jedoch teuer (10 Kps. à 100 mg = € 594,55). Diese<br />
Therapie verursacht regelmäßig eine Alopezie vom Schweregrad 3.<br />
Beachte<br />
Die Therapie ist myelotoxisch. BB-Kontrollen zweimal pro Woche sind erforderlich.<br />
Ein Abfall der Leuko < 2 G/l, der Thrombo 3 G/l <strong>und</strong> die Thrombo > 100 G/l betragen.<br />
Kontrollen<br />
Kleines Blutbild zweimal wöchentlich. Zusätzliche Untersuchungen nach klinischer Erforderlichkeit.<br />
Zwischenstaging<br />
nach je zwei Therapiezyklen:<br />
Laborroutine <strong>und</strong> Evaluation der Tumorparameter zur Beurteilung des Therapieergebnisses mit Hilfe<br />
bildgebender Verfahren.<br />
Restaging<br />
nach Therapieende. Überprüfung aller ursprünglich pathologisch veränderten Parameter.<br />
208