Lehrplan Chemie Grundkurs Jahrgänge 11 bis 13 - Gesamtschule ...
Lehrplan Chemie Grundkurs Jahrgänge 11 bis 13 - Gesamtschule ...
Lehrplan Chemie Grundkurs Jahrgänge 11 bis 13 - Gesamtschule ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Gesamtschule</strong> Langerfeld<br />
Lehrpläne Gymnasiale Oberstufe <strong>Chemie</strong> <strong>Grundkurs</strong><br />
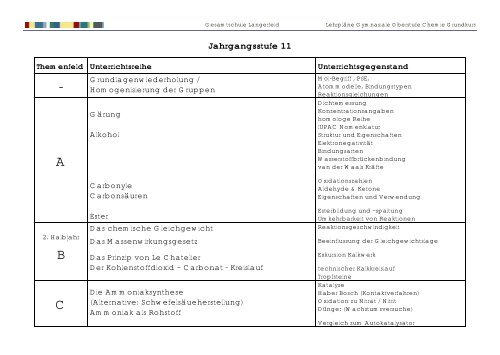
Jahrgangsstufe <strong>11</strong><br />
Themenfeld Unterrichtsreihe<br />
-<br />
A<br />
Grundlagenwiederholung /<br />
Homogenisierung der Gruppen<br />
Gärung<br />
Alkohol<br />
Carbonyle<br />
Carbonsäuren<br />
Unterrichtsgegenstand<br />
Mol-Begriff , PSE,<br />
Atommodelle, Bindungstypen<br />
Reaktionsgleichungen<br />
Dichtemessung<br />
Konzentrationsangaben<br />
homologe Reihe<br />
IUPAC Nomenklatur<br />
Struktur und Eigenschaften<br />
Elektronegativität<br />
Bindungsarten<br />
Wasserstoffbrückenbindung<br />
van der Waals Kräfte<br />
Oxidationszahlen<br />
Aldehyde & Ketone<br />
Eigenschaften und Verwendung<br />
2. Halbjahr<br />
B<br />
C<br />
Ester<br />
Das chemische Gleichgewicht<br />
Das Massenwirkungsgesetz<br />
Das Prinzip von Le Chatelier<br />
Der Kohlenstoffdioxid – Carbonat - Kreislauf<br />
Die Ammoniaksynthese<br />
(Alternative: Schwefelsäueherstellung)<br />
Ammoniak als Rohstoff<br />
Esterbildung und –spaltung<br />
Umkehrbarkeit von Reaktionen<br />
Reaktionsgeschwindigkeit<br />
Beeinflussung der Gleichgewichtslage<br />
Exkursion Kalkwerk<br />
technischer Kalkkreislauf<br />
Tropfsteine<br />
Katalyse<br />
Haber Bosch (Kontaktverfahren)<br />
Oxidation zu Nitrat / Nitrit<br />
Dünger (Wachstumsversuche)<br />
Vergleich zum Autokatalysator
<strong>Gesamtschule</strong> Langerfeld<br />
Lehrpläne Gymnasiale Oberstufe <strong>Chemie</strong> <strong>Grundkurs</strong><br />
Jahrgangsstufe 12<br />
Themenfeld Unterrichtsreihe<br />
A<br />
C<br />
2. Halbjahr<br />
B<br />
Gewinnung, Speicherung und Nutzung elektrischer<br />
Energie in der <strong>Chemie</strong><br />
ÄÅ Wiederholung elektrochemische Spannungsreihe<br />
ÄÇ Materialveredlung mit Hilfe des elektrischen Stroms<br />
ÄÉ Batterie und Akkumulator<br />
ÄÑ Korrosion und Korrosionsschutz<br />
ÄÖ Aluminiumgewinnung<br />
Konzentrationszelle und pH-Wertmessung<br />
Titration von Säuren in Lebensmitteln<br />
Vom Raps zum Biodiesel<br />
Unterrichtsgegenstand<br />
Integrierte Wh. Ion, Ionengitter, Hydratation,<br />
Hydratationsenergie, Elektrolyt,<br />
Redoxreaktionen<br />
Einfache Elektrolyse im Labor, Galvanisieren<br />
eines Werkstückes<br />
Grundprinzip der Batterien und<br />
Akkumulatoren (z.B. Zink-Kohle / Bleiakku)<br />
Redoxreihe<br />
Nernst-Gleichung<br />
Lokalelement und Schutzmöglichkeiten<br />
(Opferanode, Schutzüberzüge)<br />
Vom Bauxit zum Aluminium<br />
Das pH -Meter<br />
Integrierte Anwendung der gelernten<br />
Zusammenhänge zum Verständnis und<br />
Gebrauch<br />
eines pH –Meters<br />
Potentiometrie, Leitfähigkeitstitration<br />
Donator- / Akzeptormodelle<br />
Integrierte Wiederholung MWG<br />
Integrierte Wiederholung der homologen<br />
Reihen und funktionellen Gruppen<br />
Grundlagen der Oleochemie<br />
Substitution, Addition, Eliminierung (3<br />
Reaktionstypen im Gk nicht Mechanismen)<br />
Projekt vom Futterraps zu verschiedenen<br />
Anwendungsprodukten:<br />
Rapsöl – Biodiesel (RME)-Seife - Tenside-<br />
Polyester<br />
Referate zu IR, NMR und Massenspektroskopie
<strong>Gesamtschule</strong> Langerfeld<br />
Lehrpläne Gymnasiale Oberstufe <strong>Chemie</strong> <strong>Grundkurs</strong><br />
Jahrgangsstufe <strong>13</strong><br />
Themenfeld Theoriekonzept Unterrichtsreihe Unterrichtsgegenstand<br />
Farbstoffe<br />
und<br />
Farbigkeit<br />
und / oder<br />
Pharmaka<br />
und Drogen<br />
Das aromatische System<br />
Modellvorstellungen<br />
zum Verständnis wichtiger<br />
organischer Verbindungen<br />
Das Orbitalmodell<br />
Azofarbstoffe<br />
Aspirin<br />
Strukturen des aromatischen Systems<br />
(konjugierte Doppelbindungen in Zyklen,<br />
Mesomerie, Hückel Regel)<br />
((SE Reaktionsmechanismus))<br />
Zweitsubstitution<br />
Natürliche<br />
und<br />
synthetische<br />
Werkstoffe<br />
und / oder<br />
Komplexverbindungen<br />
Makromoleküle<br />
Bausteine vieler Natur und<br />
Kunststoffe<br />
oder<br />
Die koordinative<br />
Bindung<br />
Modellvorstellung zum<br />
Verständnis komplexer<br />
Verbindungen<br />
Proteine – Kohlenhydrate –<br />
Nukleinsäuren<br />
Kunststoffe<br />
Metallkomplexfarbstoffe,<br />
analytische Bestimmung von<br />
Metallkationen in wässriger<br />
Lösung<br />
zu Beachten sind die<br />
Vorgaben des MfSW<br />
für 2007 ist die<br />
Komplexchemie nicht<br />
Zentral-Abiturrelevant<br />
Aufbau von Makromolekülen (Monomere,<br />
räumliche Struktur)<br />
Reaktionstypen zur Verknüpfung bei<br />
Polymeren (Polymerisation, Kondensation,<br />
Addition)<br />
Struktureigenschaftsbeziehungen.<br />
Aufbau und Struktur von komplexen<br />
Verbindungen; Zentralatom, Ligand,<br />
Koordinationszahl und räumliche Anordnung;<br />
Nomenklatur ;<br />
Analytische Bestimmungen von<br />
Metallkationen;<br />
Ligandenaustauschreaktionen;<br />
Stabilität von Komplexen;<br />
Mehrzähnige Liganden; Chelate;<br />
Modellvorstellungen zur koordinativen<br />
Bindung:<br />
Elektronenstruktur; harte und weiche<br />
Liganden; Elektronendonatoren und<br />
und –akzeptoren;