GRUNDWISSEN CHEMIE - am Gymnasium Kirchheim
GRUNDWISSEN CHEMIE - am Gymnasium Kirchheim
GRUNDWISSEN CHEMIE - am Gymnasium Kirchheim
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
1. Stoffe und Reaktionen<br />
1.1 Gemische und Reinstoffe, Teilchenstruktur<br />
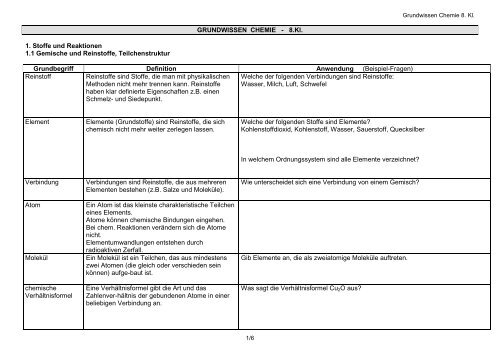
<strong>GRUNDWISSEN</strong> <strong>CHEMIE</strong> - 8.Kl.<br />
Grundbegriff Definition Anwendung (Beispiel-Fragen)<br />
Reinstoff Reinstoffe sind Stoffe, die man mit physikalischen<br />
Methoden nicht mehr trennen kann. Reinstoffe<br />
haben klar definierte Eigenschaften z.B. einen<br />
Schmelz- und Siedepunkt.<br />
Element Elemente (Grundstoffe) sind Reinstoffe, die sich<br />
chemisch nicht mehr weiter zerlegen lassen.<br />
Verbindung Verbindungen sind Reinstoffe, die aus mehreren<br />
Elementen bestehen (z.B. Salze und Moleküle).<br />
Atom Ein Atom ist das kleinste charakteristische Teilchen<br />
eines Elements.<br />
Atome können chemische Bindungen eingehen.<br />
Bei chem. Reaktionen verändern sich die Atome<br />
nicht.<br />
Elementumwandlungen entstehen durch<br />
radioaktiven Zerfall.<br />
Molekül Ein Molekül ist ein Teilchen, das aus mindestens<br />
zwei Atomen (die gleich oder verschieden sein<br />
können) aufge-baut ist.<br />
chemische<br />
Verhältnisformel<br />
Eine Verhältnisformel gibt die Art und das<br />
Zahlenver-hältnis der gebundenen Atome in einer<br />
beliebigen Verbindung an.<br />
Welche der folgenden Verbindungen sind Reinstoffe:<br />
Wasser, Milch, Luft, Schwefel<br />
Welche der folgenden Stoffe sind Elemente?<br />
Kohlenstoffdioxid, Kohlenstoff, Wasser, Sauerstoff, Quecksilber<br />
In welchem Ordnungssystem sind alle Elemente verzeichnet?<br />
Wie unterscheidet sich eine Verbindung von einem Gemisch?<br />
Gib Elemente an, die als zweiatomige Moleküle auftreten.<br />
Was sagt die Verhältnisformel Cu2O aus?<br />
1/6<br />
Grundwissen Chemie 8. Kl.
Grundbegriff Definition Anwendung (Beispiel-Fragen)<br />
Summenformel Die Summenformel gibt die Art und die genaue<br />
Anzahl der Atome an, die in einer Verbindung (z.B.<br />
in einem Molekül) gebunden sind.<br />
Was sagt die Summenformel NH3 aus?<br />
stöchiometrische<br />
Wertigkeit<br />
Die stöchiometrische Wertigkeit eines Atoms ist die<br />
Anzahl der Wasserstoffatome, die das betreffende<br />
Atom in einer Verbindung bindet bzw. ersetzt. Die<br />
Angabe der Wertigkeit erfolgt in römischen Ziffern.<br />
Wasserstoff besitzt jeweils die Wertigkeit I.<br />
1.2 Chem. Reaktionen, Reaktionsgleichung<br />
2/6<br />
Grundwissen Chemie 8. Kl.<br />
Wie sind die Wertigkeiten der jeweils ersten Elemente in folgenden Verbindungen?<br />
CH4, NH3, CO2<br />
Erstelle die Verhältnisformeln:<br />
Kupfer (I)-oxid, Kupfer (II)-oxid<br />
Welche Wertigkeiten besitzen die Elemente der Hauptgruppen I-VII generell?<br />
Grundbegriffe Definitionen Anwendung (Beispiel-Fragen)<br />
Analyse<br />
Synthese<br />
Umsetzung<br />
Eine Analyse (=Zersetzung) ist eine chem.<br />
Reaktion, bei der eine Verbindung in ihre Elemente<br />
zerlegt wird.<br />
Eine Synthese (=Aufbau) ist eine chem. Reaktion,<br />
bei der eine Verbindung aus den Elementen<br />
aufgebaut wird.<br />
Eine chemische Umsetzung ist eine Reaktion, bei<br />
der aus 2 oder mehreren Edukten<br />
(Ausgangsstoffen) 2 oder mehrere Produkte<br />
(Endstoffe) werden.<br />
Legt man an (elektrisch leitend gemachtes) Wasser eine Spannung an, so entstehen<br />
zwei Gase: Wasserstoff und Sauerstoff. Wie nennt man diese chemische Reaktion?<br />
Lässt man Bleisulfid (eine Verbindung) mit Sauerstoff (ein Element) reagieren, so<br />
entstehen Blei (ein Element) und Schwefeldioxid (eine Verbindung). Wie kann man<br />
eine solche Reaktion benennen?<br />
Kohlenstoff verbrennt in einer reinen Sauerstoffatmosphäre zu Kohlenstoffdioxid. Wie<br />
heißt der Typ der Reaktion?
Grundbegriffe Definitionen Anwendung (Beispiel-Fragen)<br />
exotherme<br />
Reaktion<br />
endotherme Reaktion <br />
Reaktionsgleichung<br />
Eine exotherme Reaktion ist eine Reaktion, die<br />
unter Wärmeabgabe erfolgt.<br />
Die innere Energie aller Edukte ist dabei größer als<br />
die innere Energie aller Produkte.<br />
Eine endotherme Reaktion ist eine Reaktion, die<br />
unter Wärmeaufnahme erfolgt. Die innere Energie<br />
aller Edukte (Ausgangsstoffe) ist dabei kleiner als<br />
die innere Energie aller Produkte (Endstoffe). Die<br />
Reaktion stoppt daher, sobald keine Energie mehr<br />
zugeführt wird.<br />
Eine chemische Reaktionsgleichung gibt an, welche<br />
Edukte verbraucht werden und welche Produkte<br />
entstehen. Sie gibt das Teilchenverhältnis der<br />
beteiligten Stoffe an.<br />
2. Atombau und gekürztes Periodensystem (PSE)<br />
3/6<br />
Grundwissen Chemie 8. Kl.<br />
Um Silberoxid in seine Elemente zu zerlegen, muss ständig erwärmt werden, d<strong>am</strong>it<br />
die Reaktion weiterläuft. Wird die Erwärmung unterbrochen, stoppt die Reaktion sofort.<br />
Wie ist diese Reaktion energetisch einzuordnen?<br />
Bei der Walpurgisnacht wird ein Feuer entzündet. Dabei verbrennt Holz unter<br />
Wärme- und Lichtabstrahlung zu verschiedenen Produkten (die du in der Asche und<br />
als Gase – z.B. Kohlenstoffmonoxid – wieder findest). Wie bezeichnet man diese<br />
Reaktion bezüglich ihrer Energiebeteiligung?<br />
Was sagt die folgende Reaktionsgleichung aus?<br />
6 CO2 + 6 H2O � C6H12O6 + 6O2<br />
Erstelle folgende Reaktionsgleichung:<br />
Methan reagiert mit Sauerstoff zu Kohlenstoffmonooxid<br />
Methan reagiert mit Sauerstoff zu Kohlenstoffdioxid<br />
Grundbegriffe Definitionen Anwendung (Beispiel-Fragen)<br />
Elementarteilchen Bausteine der Atomen sind<br />
Protonen und Neutronen (=Atomkern), Elektronen<br />
(=Atomhülle)<br />
Isotope Isotope sind Atome eines Elements, die eine unterschiedliche<br />
Anzahl an Neutronen besitzen.<br />
Gib die Anzahl der Elementarteilchen folgender Atome an:<br />
a) 6 3Li b) 35 17Cl c) 31 15P<br />
Nenne je 2 Isotope von Wasserstoff und Kohlenstoff mit den entsprechenden Massen-<br />
und Ordnungszahlen.<br />
Was ist unter der Massenzahl (im Gegensatz zur Atommasse) zu verstehen?<br />
Warum unterscheidet sich die Atommasse von Isotopen eines Elements?
4/6<br />
Grundwissen Chemie 8. Kl.<br />
Grundbegriffe Definitionen Anwendung (Beispiel-Fragen)<br />
Valenzelektronen Elektronen auf der äußersten Schale; sie sind für Was lässt sich aus der Gruppen-Nummer der Hauptgruppen im PSE ablesen?<br />
das chemische Verhalten verantwortlich.<br />
Wie viel Valenzelektronen besitzt a) C b) N c) K d) Br e) Ca?<br />
Elektronenkonfiguration<br />
Sie gibt die Elektronenverteilung entsprechend der<br />
Energiestufen in der Atomhülle an.<br />
Oktettregel Atome streben in chemischen Reaktionen eine stabile<br />
Edelgas-Elektronenkonfiguration an.<br />
Außer für Elemente der 1. Periode ist dies 8 Va-<br />
Periodensystem<br />
der Elemente<br />
(PSE)<br />
lenzelektronen.<br />
Elemente werden nach steigender Protonenzahl so<br />
angeordnet, dass Elemente mit ähnlichen Eigenschaften<br />
untereinander stehen.<br />
Hauptgruppen: senkrechte Spalten<br />
Perioden: waagrechte Reihen<br />
Welche Elektronenkonfiguration besitzen folgende Atome?<br />
H<br />
Be<br />
Ne<br />
Cl<br />
n=1 n=2 n=3 (Hauptschalen)<br />
Bilde von folgenden Elementen die Ionen und begründe, weshalb sie stabil sind.<br />
Na Mg S F N Al<br />
Wo sind im PSE folgende Elementgruppen zu finden?<br />
Alkalimetalle, Halogene, Sauerstoff-Gruppe?<br />
Welche Gemeins<strong>am</strong>keit in der Elektronenkonfiguration haben die Elemente der 4.<br />
Periode?
3 Salze, Metalle und molekular gebaute Stoffe<br />
Grundbegriffe Definitionen Anwendung (Beispiel-Fragen)<br />
Salze Sie sind aus Kationen und Anionen aufgebaut, die<br />
in einem Ionengitter regelmäßig angeordnet sind.<br />
Die Verhältnisformel eines Salzes gibt das Verhältnis<br />
n(Kationen) : n(Anionen) wieder.<br />
Hierdurch sind Salze stets elektrisch neutral.<br />
Ionenbindung Der Zus<strong>am</strong>menhalt erfolgt durch elektrostatische<br />
Anzie-hungskräfte zwischen den entgegengesetzt<br />
geladenen Ionen. Die Ionenbindung ist um so stärker,<br />
je höher die Ladung der Ionen und je kleiner<br />
deren Ionenradius ist.<br />
5/6<br />
Grundwissen Chemie 8. Kl.<br />
Welche Ionen liegen in folgenden Salzen vor? Formuliere die jeweilige Verhältnisformel.<br />
Eisen(III)-chlorid, Aluminiumbromid, Kupfer(I)-oxid, Calciumfluorid.<br />
In welchem Teilchen-Verhältnis müssen Aluminium- und Sauerstoff-Ionen stehen,<br />
d<strong>am</strong>it das Salz elektrisch neutral ist?<br />
Nenne typische Eigenschaften eines Salzes.<br />
Welche Ionen sind in folgenden Salzen enthalten?<br />
Li2O CaCl2 AlBr3 Mg3N2 (Magnesiumnitrid)<br />
Erläutere, wovon die Stärke einer Ionenbindung abhängt!
Grundbegriffe Definitionen Anwendung (Beispiel-Fragen)<br />
Ionengitter Anziehungskraft eines Ions wirkt in alle 3 Raumrichtungen<br />
(ungerichtet); daher bilden Kationen und<br />
Beschreibe das NaCl-Gitter.<br />
Anionen größere Verbände von Ionen in streng gesetzmäßiger<br />
Anordnung.<br />
Wodurch entsteht ein Kristall?<br />
Elektrolyse = Zerlegung eines Stoffes durch elektrischen Strom.<br />
Kationen wandern während einer Elektrolyse zur<br />
Kathode (= negativ geladene Elektrode),<br />
Anionen entsprechend zu Anode.<br />
Entladung Kationen an Kathode durch Aufnahme<br />
von Elektronen. Entladung Anionen an Anode durch<br />
Abgabe von Elektronen.<br />
Metallbindung Die Bindung der Atome in Metallen beruht auf der<br />
elektrostatischen Anziehung zwischen den Metall-<br />
Kationen und den sie umgebenden freien Valenzelektronen<br />
(„Elektronengas“).<br />
Atombindung<br />
= Elektronenpaar-<br />
Bindung<br />
= kovalente<br />
Bindung<br />
Die Bindung der Atome erfolgt über ein oder<br />
mehrere gemeins<strong>am</strong>e Elektronenpaare.<br />
(St<strong>am</strong>men beide Elektronen von einem Partner, so<br />
spricht man von koordinativer Bindung ).<br />
Die Polarität solcher Bindungen ist abhängig von<br />
der jeweiligen Elektronegativität der<br />
Bindungspartner.<br />
6/6<br />
Grundwissen Chemie 9. Kl.<br />
Warum ist die Aussage falsch, dass ein Na + -Ion und ein Cl - -Ion Kochsalz bilden?<br />
In welche Richtung wandern die Ionen einer Elektrolyse von Zinkbromid?<br />
Formuliere die Reaktionen an den Elektroden und die Ges<strong>am</strong>treaktion der<br />
Elektrolyse von Kupfer(II)-chlorid.<br />
Fertige eine beschriftete Skizze eines Metallgitters an.<br />
Nenne 3 typische Eigenschaften von Metallen.<br />
Skizziere das Wasser-Molekül mit allen Valenzelektronen, benenne den Bindungstyp<br />
und gib die Polaritätsverhältnisse an.<br />
Erstelle die Valenzstrichformeln für NH3, CH4, Cl2, CO2, SO2