Grundwissen Chemie - 9. Klasse - am Gymnasium Kirchheim
Grundwissen Chemie - 9. Klasse - am Gymnasium Kirchheim
Grundwissen Chemie - 9. Klasse - am Gymnasium Kirchheim
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
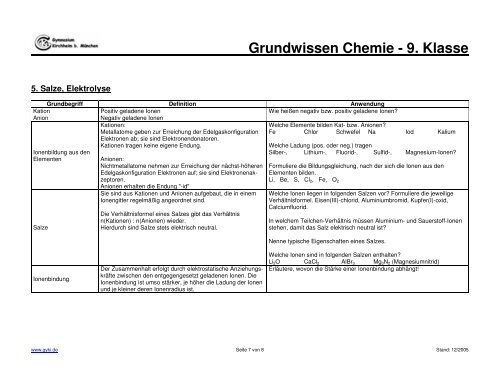
5. Salze, Elektrolyse<br />
Ionenbildung aus den<br />
Elementen<br />
Anionen:<br />
Nichtmetallatome nehmen zur Erreichung der nächst-höheren<br />
Edelgaskonfiguration Elektronen auf; sie sind Elektronenakzeptoren.<br />
Anionen erhalten die Endung "-id"<br />
<strong>Grundwissen</strong> <strong>Chemie</strong> - <strong>9.</strong> <strong>Klasse</strong><br />
Grundbegriff Definition Anwendung<br />
Kation<br />
Positiv geladene Ionen<br />
Wie heißen negativ bzw. positiv geladene Ionen?<br />
Anion<br />
Negativ geladene Ionen<br />
Kationen:<br />
Welche Elemente bilden Kat- bzw. Anionen?<br />
Metallatome geben zur Erreichung der Edelgaskonfiguration<br />
Elektronen ab; sie sind Elektronendonatoren.<br />
Fe Chlor Schwefel Na Iod Kalium<br />
Kationen tragen keine eigene Endung.<br />
Welche Ladung (pos. oder neg.) tragen<br />
Silber-, Lithium-, Fluorid-, Sulfid-, Magnesium-Ionen?<br />
Salze<br />
Ionenbindung<br />
Sie sind aus Kationen und Anionen aufgebaut, die in einem<br />
Ionengitter regelmäßig angeordnet sind.<br />
Die Verhältnisformel eines Salzes gibt das Verhältnis<br />
n(Kationen) : n(Anionen) wieder.<br />
Hierdurch sind Salze stets elektrisch neutral.<br />
Der Zus<strong>am</strong>menhalt erfolgt durch elektrostatische Anziehungskräfte<br />
zwischen den entgegengesetzt geladenen Ionen. Die<br />
Ionenbindung ist umso stärker, je höher die Ladung der Ionen<br />
und je kleiner deren Ionenradius ist.<br />
Formuliere die Bildungsgleichung, nach der sich die Ionen aus den<br />
Elementen bilden.<br />
Li, Be, S, Cl2, Fe, O2<br />
Welche Ionen liegen in folgenden Salzen vor? Formuliere die jeweilige<br />
Verhältnisformel. Eisen(III)-chlorid, Aluminiumbromid, Kupfer(I)-oxid,<br />
Calciumfluorid.<br />
In welchem Teilchen-Verhältnis müssen Aluminium- und Sauerstoff-Ionen<br />
stehen, d<strong>am</strong>it das Salz elektrisch neutral ist?<br />
Nenne typische Eigenschaften eines Salzes.<br />
Welche Ionen sind in folgenden Salzen enthalten?<br />
Li2O CaCl2 AlBr3 Mg3N2 (Magnesiumnitrid)<br />
Erläutere, wovon die Stärke einer Ionenbindung abhängt!<br />
www.gyki.de Seite 7 von 8 Stand: 12/2005
Fortsetzung: 5. Salze, Elektrolyse<br />
<strong>Grundwissen</strong> <strong>Chemie</strong> - <strong>9.</strong> <strong>Klasse</strong><br />
Grundbegriff Definition Anwendung<br />
Anziehungskraft eines Ions wirkt in alle 3 Raumrichtungen<br />
(ungerichtet); daher bilden Kationen und Anionen größere<br />
Beschreibe das NaCl-Gitter.<br />
Ionengitter<br />
Verbände von Ionen in streng gesetzmäßiger Anordnung. Wodurch entsteht ein Kristall?<br />
Gitterenthalpie<br />
Elektrolyse<br />
Die Ausbildung eines Ionengitters aus freien Ionen verläuft<br />
exotherm. Die hierbei frei werdende Energie ist die Gitte-<br />
renthalpie; Symbol ∆H G als negativer Wert<br />
Zerlegung eines Stoffes durch elektrischen Strom.<br />
Kationen wandern während einer Elektrolyse zur Kathode (=<br />
negativ geladene Elektrode),<br />
Anionen entsprechend zu Anode.<br />
Entladung Kationen an Kathode durch Aufnahme von<br />
Elektronen. Entladung Anionen an Anode durch Abgabe von<br />
Elektronen.<br />
Warum ist die Aussage falsch, dass ein Na + -Ion und ein Cl - -Ion Kochsalz<br />
bilden?<br />
Wie hängt die Stärke einer Ionenbindung mit der Gitterenthalpie zus<strong>am</strong>men?<br />
In welche Richtung wandern die Ionen einer Elektrolyse von Zinkbromid?<br />
Formuliere die Reaktionen an den Elektroden und die Ges<strong>am</strong>treaktion der<br />
Elektrolyse.<br />
www.gyki.de Seite 8 von 8 Stand: 12/2005