Kurzprotokoll CeTeG Studie - NeuroKopfZentrum - TUM
Kurzprotokoll CeTeG Studie - NeuroKopfZentrum - TUM
Kurzprotokoll CeTeG Studie - NeuroKopfZentrum - TUM
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Kurzprotokoll</strong> <strong>CeTeG</strong> <strong>Studie</strong><br />
<strong>Studie</strong>ntitel Phase III-<strong>Studie</strong> zur CCNU/Temozolomid<br />
Kombinationstherapie versus Standard-Temozolomidtherapie<br />
bei neudiagnostizierten Glioblastompatienten mit<br />
methyliertem MGMT-Promoter im Tumor(<strong>CeTeG</strong>)<br />
<strong>Studie</strong>nphase<br />
Clinical trials gov. ID<br />
Status<br />
Phase III <strong>Studie</strong><br />
NCT01149109<br />
In Vorbereitung<br />
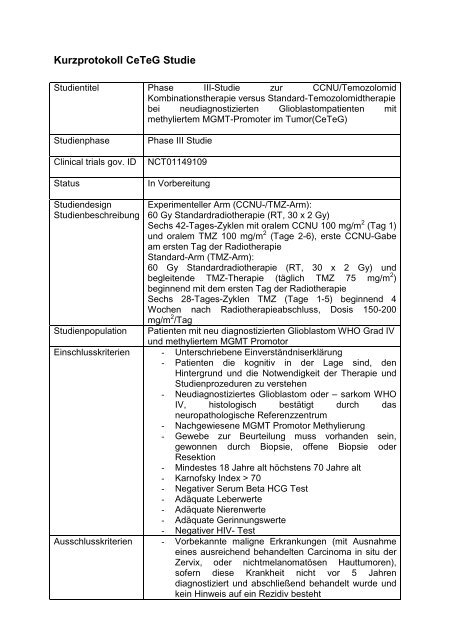
<strong>Studie</strong>ndesign<br />
<strong>Studie</strong>nbeschreibung<br />
<strong>Studie</strong>npopulation<br />
Experimenteller Arm (CCNU-/TMZ-Arm):<br />
60 Gy Standardradiotherapie (RT, 30 x 2 Gy)<br />
Sechs 42-Tages-Zyklen mit oralem CCNU 100 mg/m 2 (Tag 1)<br />
und oralem TMZ 100 mg/m 2 (Tage 2-6), erste CCNU-Gabe<br />
am ersten Tag der Radiotherapie<br />
Standard-Arm (TMZ-Arm):<br />
60 Gy Standardradiotherapie (RT, 30 x 2 Gy) und<br />
begleitende TMZ-Therapie (täglich TMZ 75 mg/m 2 )<br />
beginnend mit dem ersten Tag der Radiotherapie<br />
Sechs 28-Tages-Zyklen TMZ (Tage 1-5) beginnend 4<br />
Wochen nach Radiotherapieabschluss, Dosis 150-200<br />
mg/m 2 /Tag<br />
Patienten mit neu diagnostizierten Glioblastom WHO Grad IV<br />
und methyliertem MGMT Promotor<br />
Einschlusskriterien - Unterschriebene Einverständniserklärung<br />
- Patienten die kognitiv in der Lage sind, den<br />
Hintergrund und die Notwendigkeit der Therapie und<br />
<strong>Studie</strong>nprozeduren zu verstehen<br />
- Neudiagnostiziertes Glioblastom oder – sarkom WHO<br />
IV, histologisch bestätigt durch das<br />
neuropathologische Referenzzentrum<br />
- Nachgewiesene MGMT Promotor Methylierung<br />
- Gewebe zur Beurteilung muss vorhanden sein,<br />
gewonnen durch Biopsie, offene Biopsie oder<br />
Resektion<br />
- Mindestes 18 Jahre alt höchstens 70 Jahre alt<br />
- Karnofsky Index > 70<br />
- Negativer Serum Beta HCG Test<br />
- Adäquate Leberwerte<br />
- Adäquate Nierenwerte<br />
- Adäquate Gerinnungswerte<br />
- Negativer HIV- Test<br />
Ausschlusskriterien - Vorbekannte maligne Erkrankungen (mit Ausnahme<br />
eines ausreichend behandelten Carcinoma in situ der<br />
Zervix, oder nichtmelanomatösen Hauttumoren),<br />
sofern diese Krankheit nicht vor 5 Jahren<br />
diagnostiziert und abschließend behandelt wurde und<br />
kein Hinweis auf ein Rezidiv besteht
Beschreibung<br />
<strong>Studie</strong><br />
Kontakt<br />
der<br />
- Chemotherapien, lokale oder systemische Therapie<br />
mit DANN schädigenden Substanzen,<br />
Tyrosinkinaseinhibitoren, antiangiogenetische<br />
Therapien für jede Art von maligner Erkrankung<br />
- Strahlentherapie des Gehirns in der Vorgeschichte<br />
- Begleitende Anwendung jeglicher zusätzlicher<br />
Antitumortherapie, die nicht im <strong>Studie</strong>nprotokoll<br />
aufgeführt ist<br />
- Allergie oder anderweitige Unverträglichkeit gegen<br />
Temozolomid, Dacarbazine, CCNU oder andere<br />
Nitroseurea Derivate<br />
- Patienten die sich keiner MRT Untersuchung<br />
unterziehen können<br />
- Erkrankungen mit schlechter Prognose in der<br />
Anamnese, d.h. schwere KHK, Herzinsuffizienz,<br />
NYHA III/IV, schwerer nicht kontrollierter Diabetes<br />
mellitus, Immundefizienz, Defizite nach Apoplex,<br />
schwere geistige Behinderung oder andere schwere<br />
Begleiterkrankungen, die mit der Durchführung der<br />
<strong>Studie</strong> interferieren<br />
- HIV Infektion<br />
- Jegliche aktive Infektion<br />
- Schwangere oder stillende Patientinnen<br />
- Behandlung im Rahmen einer anderen klinischen<br />
<strong>Studie</strong> mit therapeutischer Intervention oder Einsatz<br />
einer experimentellen Substanz während der <strong>Studie</strong><br />
oder innerhalb von 30 Tagen vor Aufnahme in die<br />
<strong>Studie</strong><br />
In einer früheren nicht randomisierten bizentrischen Phase II<br />
<strong>Studie</strong> zeigte sich eine primäre Kombinationstherapie aus<br />
Lomustin (CCNU) und TMZ als hocheffektiv und der TMZ<br />
Monotherapie überlegen. (UKT 03 <strong>Studie</strong> Herrlinger at al)und<br />
drängt damit zu einer Bestätigung des Ergebnisses in einer<br />
weiterführenden <strong>Studie</strong>.<br />
Da in der Vorstudie Patienten mit methyliertem MGMT<br />
Promotor profitiert haben, werden in dieser <strong>Studie</strong> nur<br />
Patienten mit einem methyliertem MGMT Promotor<br />
aufgenommen<br />
PD Dr. F. Ringel florian.ringel@lrz.tum.de