Ausarbeitung der Vorlesung und Fragenkatalog - Bplaced.net
Ausarbeitung der Vorlesung und Fragenkatalog - Bplaced.net
Ausarbeitung der Vorlesung und Fragenkatalog - Bplaced.net
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
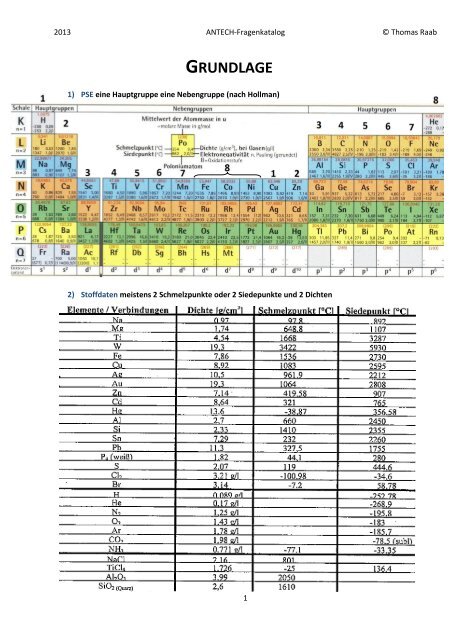
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabGRUNDLAGE1) PSE eine Hauptgruppe eine Nebengruppe (nach Hollman)2) Stoffdaten meistens 2 Schmelzpunkte o<strong>der</strong> 2 Siedepunkte <strong>und</strong> 2 Dichten1
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab1. ROHSTOFFE1.) Nennen Sie die 4 häufigsten Elemente <strong>der</strong> Erdkruste <strong>und</strong> ihre Gewinnung (für jedes Element wichtigsterRohstoff, Verfahrensprinzip <strong>der</strong> Herstellung des Elements, Herstellungsverfahren in Schlagworten)a) Sauerstoff (46%)m.p.: -219; b.p.: -183 Dichte: 1,42Rohstoff: Luft. Gewinnung durch Verflüssigen <strong>und</strong> Rektifikation.Linde Verfahren: Wirtschaftlich durch Claude: Luft auf 200 bar komprimiert erhitzt sich um 45 °C,mit Kühler wie<strong>der</strong> gekühlt, Staub, Kohlenwasserstoffen, Lachgas <strong>und</strong> gefiltert, entwässert, inGegenstrom mit nicht verflüssigter Luft geführt, (eventuell Abkühlung unterhalb <strong>der</strong>Inversionstemperatur) <strong>und</strong> entspannt nicht verflüssigte Luft wird zum Vorkühlen verwendetRektifikation: Mittel (5-6 bar)- <strong>und</strong> Nie<strong>der</strong>druckkolonne (0,5 bar) rektifiziert N 2 (Kopf)O 2 + Edelgase (Boden), welche separat abgetrennt werden.Alternativ Gewinnung über Elektrolyse gleich reiner Sauerstoff teuerDruckwechsel-Absorption (PSA)b) Silizium (28%)m.p.: 1410; b.p.: 2355; Dichte 2,33Rohstoff: SiO 2 (Quarz, Sand) durch Reduktion mit C im Lichtbogenofen (2300 °C)SiO 2 + 2 C → Si + 2 COEin Überschuss von C ist zu vermeiden, da ansonsten SiC entsteht. Entstandenes SiC reagiert nach2 SiC + SiO 2 → 3 Si + 2 COReinigung: Einkristalle nach Czochralski <strong>und</strong> Zonenschmelzenc) Aluminium (8,2%)m.p.: 660 b.p.: 2450 Dichte 2,70Rohstoff: Bauxit (AlO(OH), Al(OH) 3 )Bayer-Verfahren: Bauxit mit wässriger NaOH (250-300 g/l) 240-280 °C, 40-80 bar, 3 h Autoklav, 10 minStrömungsrohr aufgeschlossen, Aluminium als Aluminat in LösungAlO(OH) + NaOH + H 2 O → Na[Al(OH) 4 ]Abtrennung des Rotschlamms (Natronlauge wird rückgeführt → Kreislaufprozess),Kristallisation durch Impfung mit Al(OH) 3 -KeimNaAl(OH) 4 → Al(OH) 3 + NaOHEntwässerung in <strong>der</strong> Wirbelschicht / Drehrohrofen zu Al 2 O 3 (1100 °C)2 Na[Al(OH) 4 ] → 2 Al(OH) 3 + 2 NaOH -> Al 2 O 3 + 3 H 2 O↑ + 2 NaOHHall-Heroult-Verfahren: 2-8% Al 2 O 3 in Kryolith-Schmelze (Na 3 [AlF 6 ]) ∂=2,1, bei 940-980 °C, 4-5 V mitKohlenstoff-elektroden Kathode -> Al (∂= 2,3) abgesaugt, C-Anode (verbraucht sich)Zusätze: AlF 3 , CaF 2 senken eutektische Temperatur, LiF erhöht Leitfähigkeit + EnergieausbeuteEisen (5,6%)m.p.: 1535 b.p.: 2730 Dichte 7,86Rohstoff: Erze wie Hämatit (Fe 2 O 3 ), Mag<strong>net</strong>it (Fe 3 O 4 ), Si<strong>der</strong>it (FeCO 3 ),... Abbau: Tage/Untertagebau,zerkleinert (Walzen, Backenbrecher), Klassiert (Sieb), Sortiert (Mag<strong>net</strong>scheidung), vorgesinterte grobeBrocken in Hochofenprozess eingebracht mit Koks (C + O 2 CO 2 | CO 2 + C 2 CO) zu Roheisenreduziert. Verschiedene Zonen (v.u.n.o.) Roheisen, Schlacke, Schmelzzone, Kohlungszone, Reduktion,Vorwärmzone) alle paar St<strong>und</strong>en Roheisen <strong>und</strong> Schlacke entnommen.2
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabbeim Sintern CaO zugesetzt. Roheisengehalt ca. 95%.2.) Beispiele für feste, flüssige <strong>und</strong> gasförmige Rohstoffe. Gr<strong>und</strong>sätzlicheUnterschiede im Vorkommen, Konsequenzen für die Gewinnung.Feste Rohstoffe: Erze, Salz, Gesteine, Mineralien, gediegene ElementeGewinnung / Nutzbarkeit abhängig von Zugänglichkeit, Marktpreis, Mächtigkeit, Reinheit,Konzentration,...Kommen nur an bestimmen Stellen vorAbbau (Tag/Untertagabbau), Zerkleinern, Klassieren, Sortieren, AufbereitungFlüssige Rohstoffe: Wasser (<strong>und</strong> gelöste Salze), ErdölWasser: sehr häufig, aber bereits limitierter als gasförmige Rohstoffe. Gewinnung ortsabhängig,außerdem abhängig von weiteren Parametern wie z.B. Süß/Salzwasser, Qualität: Trinkwasser,Betriebswassergelöste Stoffe noch mehr ortsabhängig, ebenfalls abhängig von Konzentration etc.Erdöl: stark ortsabhängig oft schwer zugänglich TransportGasförmige Rohstoffe: Luft (O 2 , N 2 , Edelgase) <strong>und</strong> ErdgasLuft sehr häufig, kann fast überall <strong>und</strong> ohne großen Aufwand gewonnen werden.z.B. LuftverflüssigungErdgas: stark ortsabhängig, meist gemeinsam mit Erdöl, schwankende Konzentrationen(H 2 S Schwefelgewinnung), geför<strong>der</strong>t Bohrungen3.) Kriterien für die Abbauwürdigkeit <strong>der</strong> Lagerstätten für feste Rohstoffe- Marktpreis- ZugänglichkeitTransportwege (Infrastruktur) Abbau (Tagebau Untertagebau)- Mächtigkeit (Größe des Vorkommens)- Reinheit Konzentration (für Erze beson<strong>der</strong>s abhängig vom Marktpreis)Bei Erzen Grenze <strong>der</strong> Abbauwürdigkeit mit Marktpreis des Metalls korreliert. Als Faustregel:Preis (Eur.) * Grenzkonzentration (%) = const. An -/ Abwesenheit stören<strong>der</strong> Bestandteile4.) Gr<strong>und</strong>schritte <strong>der</strong> Erzaufbereitung (Verfahrensschritte von Abbau bis zum Erzkonzentrat); Beschreibung<strong>der</strong> Schritte in Stichworten, Aufzählung <strong>der</strong> Verfahrena) ErzabbauAbhängig von Lagerstätte (Tagbau /Untertagbau) & Art des Erzes (verschiedene Methoden)z.B.: Eisenb) ZerkleinerungFreilegen <strong>der</strong> Erzmineralpartikel (Mahlen des Gesteins auf Teilchengröße < Erzmineralsgröße) Grobzerkleinerung (bis 20 mm)- spröde Erze: Backen-, Kegel-, Walzenbrecher, (Mag<strong>net</strong>it, Hämatit, Ilmenit, ZnS)3
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab- weiche Erze: Schlagmühle Feinzerkleinerung (bis 0,1 mm)(Hämatit, Ilmenit, ZnS)- Kugel- o<strong>der</strong> Schwingmühlenmöglichst einheitliches Korn erwünscht (deshalb oft Austrag des Feingutes im Betrieb mitSiebkugelnmühlen, Auskleidung <strong>der</strong> Backen: Mn-Hartstahlc) KlassierenTrennen nach Teilchengröße da für das Sortieren allgemein gleiche Korngrößen nötig sindGrobes Korn (bis 0,5 mm) : Sieben, fest o<strong>der</strong> Rüttelsieb (Vibration),Schwingsieb (Gut aufgetragen, durch Exzenter hin <strong>und</strong> her bewegt -> Siebung + Transport desnicht gesiebten Gutes entlang des Siebes -> Grobgut am Ende aufgefangen <strong>und</strong> separatgesammelt)z.B.: Mag<strong>net</strong>it, Hämatit, Ilmenit, ZnSDarunter:Schlämmen, Zyklon (nass/trocken) (Gut mit Gasstrom spiralförmig eingebracht, Feingut im Strom –durch Tauchrohr ausgetragen, Grobgut wegen Fliehkraft unten ausgetragen) Windsichter (Gut auf Streuteller, Luftstrom v.u.n.o. normal zur Streurichtung, schwerePartikel in Trichter, leichtere über Wand unten ausgetragen)z.B.: ZnSd) SortierenTrennung des tauben Gestein <strong>und</strong> Erz Einzelsortierung- von Hand (Edelsteine),- automatisch (Reflexion, elektrische Leitfähigkeit, radioaktiv) Schwerkraftaufbereitung (pulsierende Wasserbewegung entmischt Schüttung)wichtig einheitliche Teilchengrößenz.B.: Goldwaschen Schwereflüssigkeitsaufbereitung (Sink-Schwimm Prozess) abhängig von <strong>der</strong> Dichte <strong>der</strong>Schwereflüssigkeit (liegt zwischen den zu trennenden Komponenten), gute Trennschärfe aberabhängig von Freilegungsgrad des Erzes.Labor: bromierte KWs | Salzlösungen; Praxis: Suspensionen z.B. Mag<strong>net</strong>it, Fero-Si, BleiglanzGrenze ist die Viskosität <strong>der</strong> Trübe.Geräte: Humbold (Kasten-), Wemco (Trommelschei<strong>der</strong>), Stamicarbon-Wedag (Waschzyklon)Beispiel: NaCl, Quarz, Mag<strong>net</strong>it, Ferrosilicium, Bleiglanz, Mag<strong>net</strong>scheidung im Mag<strong>net</strong>feld, Trennung: ferro- (Mag<strong>net</strong>it), para- (Ilmenit – FeTiO 3 , Hämatit),diamag<strong>net</strong>isches (Kalk, Quarz) Materialo Nass – ferromag<strong>net</strong>ischo Trocken – schwach mag<strong>net</strong>isch, viel feines Korn + starke Mag<strong>net</strong>fel<strong>der</strong> nötigMag<strong>net</strong>schei<strong>der</strong>typen:Bandschei<strong>der</strong> – immer trockenTrommelschei<strong>der</strong> – nass <strong>und</strong> trockenWalzenschei<strong>der</strong>4
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab elektrostatische Aufbereitung (Trennung aufgr<strong>und</strong> unterschiedlicher Oberflächenfähigkeiten) FlotationPrinzip: Trennung durch unterschiedliche Be<strong>net</strong>zbarkeitGraphit, MoS 2 sind natürlich hydrophob,- Sammler -> Erhöhung <strong>der</strong> Hydrophobität für an<strong>der</strong>e Mineralienanionenaktiv (Xanthogenate)kationenaktiv (org. primäre Amine, umgekehrte Flotation -> Gangart schwimmt auf)- Regler (pH-Abhängigkeit): über pH-Variation selektive Flotation möglich (Mineralsammlermuss unlöslicher sein als Mineral -> bei hohem pH -> Hydroxide unlöslich = keine Flotation;Stufenweise Senkung des pH Minerale nach einan<strong>der</strong> flotierbar).z.B.: H 2 SO 4 , NaOH- Schäumer (Terpene, Kresol) Bildung von luftgefülltem Schaum zum Austragen des Erzes,müssen oberflächenaktiv sein, dürfen aber nicht mit Sammler wechselwirken -> ohneSchäumer würden Blasen platzten <strong>und</strong> Teilchen wie<strong>der</strong> sinken.- Drücker (Cyanide, Na 2 Cr 2 O 7 ) wirken hyrophilierend, Be<strong>net</strong>zbarkeit unerwünschterBestandteile verän<strong>der</strong>bar.Beispiel: Pb/Zn-Erze: Pb flotiert bei pH 9,5; Zn-Erz mit Cyaniden <strong>und</strong> ZnSO 4 gedrückt, danndurch Aktivierung des Zn mit CuSO 4 bei pH 10,5 flotiert.Problem: Abwasser viele verschiedene Substanzen im Abwasser <strong>und</strong> teilweise giftig.e) chemische WeiterverarbeitungTeils kein Prozess <strong>der</strong> Erzaufbereitung, son<strong>der</strong>n <strong>der</strong> Metallherstellung Laugungwässrig (Salze), sauer (silikatische Gangart oft gekoppelt mit nachfolgen<strong>der</strong> Elektrolyse) alkalisch,cyanidisch, ammonalkalisch,z.B. Cyanidlaugung alter Abraumhalden von Cu-Minen Drucklaugungim Autoklaven, Bayer-Verfahren, oft nach Vorbehandlung. z.B. Bauxit mit NaOH RöstenOxidierendreduzierendSinterröstensulfphatisierendchlorierend(Sulfid → Oxid),(mit KW-haltigen Gasen)(mit alkalischen Zuschlägen)(Sulfid → Sulfat)(Zusatz von NaCl)z.B. CuS + 1,5 O 2 → CuO + SO 2 ; 2 CuO+ CuS → 3 Cu + SO 2TiO 2 + Cl 2 +C → TiCl 4 + CO; TiCl 4 + 2 Mg → Ti + 2 MgCl 2 ErzchlorierungChloride sind oft besser destillier- <strong>und</strong> sublimierbar (Trennung durch fraktionierte Destillationmöglich) bzw. laugbarSollte das Gleichgewicht ungünstig liegen, O 2 durch Reduktionsmittel (H 2 , C, S) rausfangenz.B.: TiO 2 + Cl 2 + C -> TiCl 4 + CO -> TiCl 4 Krollprozess5
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab IonentauschMit Chelat-Komplexbildner, z.B. für Edelmetalle, Cu Flüssig-flüssig Extraktionzur Anreicherung, zur Abtrennung stören<strong>der</strong> Elemente (Beispiel: Na 2 WO 4 -> (NH 4 ) 2 WO 4 )5.) Verfahrensschritte <strong>der</strong> Erzaufarbeitung vor dem Sortieren, Bezeichnung, Erklärung <strong>und</strong> Unterteilung<strong>der</strong> Schritte (mit Beispiel)siehe 46.) Unterschiede Sortieren / Klassieren (Erklärung, Aufzählung <strong>der</strong> Verfahren mit kurzer Beschreibung <strong>der</strong>Verfahrensprinzipien)siehe 47.) Stufen <strong>der</strong> Erzaufbereitung für a) mag<strong>net</strong>ische Erze, b) ZnS – haltige Erze.Beginnend bei Erzabbau, Begründung <strong>der</strong> Sortierverfahren.a) Mag<strong>net</strong>ische Erzez.B. Mag<strong>net</strong>it, Hämatit, Ilmenit (FeTiO3)- Abbau Tage o<strong>der</strong> Unterageabbau- Grobzerkleinerung mit Backen-, Kegel-, Walzenbrecher- Feinzerkleinerung mit Kugel- o<strong>der</strong> Schwingmühle- Klassieren mittels Schwing- o<strong>der</strong> Rüttelsieb- Sortieren durch Mag<strong>net</strong>scheidung- nass für Mag<strong>net</strong>it (da ferromag<strong>net</strong>isch),- trocken für Hämatit & Ilmenit (beide paramag<strong>net</strong>isch), feinere Körnung nötig- Erzaufarbeitungb) ZnS- haltiges Erz- Bis Klassieren wie bei mag<strong>net</strong>ischen Erzen + feinklassieren im Windsichter o<strong>der</strong> Zyklon- Sortieren durch Flotation, z.B.: mit Ethylxanthogenat, pH 11,58.) Trennung Erz-Gangart mit Schwereflüssigkeitsaufbereitung, Mag<strong>net</strong>scheidung, Flotation; physikalischeGr<strong>und</strong>lagen <strong>und</strong> Beschreibung <strong>der</strong> Methode (je 1Trennbeispiel)siehe 49.) Gruppen von Chemikalien, die bei Flotation zum Einsatz kommen <strong>und</strong> ihreWirkungsweisesiehe 410.) Chemische Aufbereitung (Weiterverarbeitung) von Erzen: kurze Beschreibung <strong>der</strong> unterschiedlichenMethoden, 1 Bsp.siehe 46
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab11.) Gewinnung von NaCl: Beschreibe die Abbau-/Gewinnungsmethoden (bis zum technischen Vorprodukt)Vorkommen (Steinsalz in Sedimentgestein, Meerwasser)a) BergbauDurch Sprengen, Schrämmen, falls NaCl-Gehalt < 98%, anschließend Schwereflüssigkeitsaufbereitungmit Fe 3 O 4 in gesättigter Soleb) LaugungHaselgebirge: günstig falls gestörte - reichhaltige Lager (z.B. Faltung <strong>der</strong> Alpen)Bohrlochsonden-Methode: 2 konzentrischen Rohren (Außen, Innen), Außen; heißes Wasser unter Druckeingepresst, Innen Sole(26,5%) ausgepumpt.Abtrennung <strong>der</strong> Schwebstoffe, Reinigung <strong>der</strong> Sole (Entfernung von Mg mit mittels Ca(OH) 2 als Mg(OH) 2 ,Ca durch CO 2 aus Rauchgasen (als CaCO 3 ) gefällt, o<strong>der</strong> mit Na 2 SO 4 / (NH 4 ) 2 SO 4 als CaSO 4 ), eindampfen(Vakuumverdampfung (Prinzip <strong>der</strong> Wärmepumpe: Verdampfen, Kondensieren, Wärmeeabfuhr = neueEnergie zum Verdampfen)) -> hoher Energiebedarf, zentrifugieren, trocknen mit Heißluft, Klassieren,Verpacken eventuell Iodierung durch besprühen mit KI-Lösungc) Aus dem Meerin heißen Zonen, Verdampfung des Wassers (Gehalt 2,7 – 3,0% Salz) mittels Sonnenenergie.große, flache Becken über 4 Stufen langsam eingedampft -> Verunreinigungen (Eisenoxid, Kalk, Gips)ausgefällt v. a. <strong>der</strong> 2.Stufe. Im Kristallisierteich (4. Stufe) bei zu hoher MgSO 4 -Konzentration fälltBittersalz aus. (nicht zu weit einengen), Salz-Kruste oben abgetragenRohsalz noch MgCl 2 -> mehrmaliges Anrühren mit Frischwasser (umkristallisieren)12.) Hauptverunreinigungen im Steinsalz <strong>und</strong> ihre EntfernungHauptverunreinigungen: Ca- & Mg-Verbindungen,an<strong>der</strong>e: Ton, Sandstein, Anhydrid, GipsReinigung erfolgt in Stahlbehältern, haben Korrosionsschicht + zusätzlich Schutzschicht (ausgefalleneSedimente (Gips)) die vor Korrosion geschützt sind.Rohsole mit Schlamm verunreinigt -> Filterpresse, Zugabe von Ca(OH) 2 -> Mg(OH) 2 fällt aus ->Filterpresse, Filtrat -> CO 2 <strong>und</strong> Na 2 SO 4 / (NH 4 ) 2 SO 4 -> Fällung CaCO 3 | CaSO 4 ,Ca(OH) 2 + Na 2 SO 4 + MgCl 2 -> 2 NaCl + CaSO 4 + Mg(OH) 2Ca(OH) 2 + (NH 4 ) 2 SO 4 + CO 2 -> CaSO 4 + + (NH 4 ) 2 CO 3 +H 2 OCaSO 4 + + (NH 4 ) 2 CO 3 -> CaCO 3 + (NH 4 ) 2 SO 4Verwendung: Speisesalz, Gewerbesalz (Streusalz, Viehsalz Konservierungsmittel), Industriesalz (Rohstofffür Chemie z.B.: Elektrolyse)7
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab13.) Gewinnung von N 2 , O 2 , Ar, He (BP), Herstellungsprinzipien, Anlagenbeschreibung.Weiters: Zusammensetzung <strong>der</strong> Luft, Prinzip <strong>der</strong> Luftverflüssigung (physikalische Erklärung)Luft: N 2 (78,09%) O 2 (20.95%) Ar (0,93%) CO 2 (0,033%) Rest (Ne, He, Kr H ² Xe) (0,002%)Stickstoff (b.p.: -195,6°C)• Luftverflüssigung: Nach Linde-VerfahrenWirtschaftlich durch Claude: Luft auf 200 bar komprimiert -> erwärmt sich um 45 °C, mit Kühler wie<strong>der</strong>gekühlt, Staub, Kohlenwasserstoffen, Lachgas <strong>und</strong> gefiltert, entwässert, in Gegenstrom mit nichtverflüssigter Luft geführt, (eventuell Abkühlung unterhalb <strong>der</strong> Inversionstemperatur) <strong>und</strong> entspannt ->nicht verflüssigte Luft wird zum Vorkühlen verwendetRektifikation: Mittel (5-6 bar)- <strong>und</strong> Nie<strong>der</strong>druckkolonne (0,5 bar) rektifiziert -> N 2 (Kopf) // O 2 +Edelgase (Boden, Sumpf), welche separat abgetrennt werden.Reinheit: sehr rein• Druckwechsel-Absorption (PSA): Luft unter Druck durch Adsorption an Zeolithen /Kohlenstoffmolsieben, zerlegt, H 2 O, O 2 <strong>und</strong> CO 2 zurückgehalten. (wird verwendet wenn Reinheitnicht so hoch sein muss -> billiger) zuerst absorbiert <strong>und</strong> dann mit Hitze regeneriert werden.immer 2 Absorber -> einer wird regeneriert• Membranverfahren: bestimmte Anteile <strong>der</strong> Luft schneller durch die Membran als N 2 (Anlegen vonDruckdifferenz) -> Anreicherungebenso nicht so hohe Reinheit, dafür aber leiser als DruckwechselabsorptionAnwendung: Schutzgas, Haber-Bosch (NH 3 -Synthese)a) Sauerstoff (b.p.: -183°C)Wie N 2 durch Luftzerlegung, teils auch durch H 2 O Elektrolyse, Adsorption nur für kleinere Einheiten beigeringerer Reinheit (
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabd) an<strong>der</strong>e Edelgasegenauso über NebenkolonnenAnwendung z.B.: Schutzgas, Laser, Glühbirnen usw.e) Physikalisches Prinzip <strong>der</strong> LuftverflüssigungJoule Thompson-Effekt: Joule-Thompson Koeffizient negativ (unterhalb <strong>der</strong> Inversionstemperatur) ->Gas o<strong>der</strong> Gasgemisch durch Drossel (isenthalpe Druckmin<strong>der</strong>ung) -> Temperaturän<strong>der</strong>ung weilströmendes Gas, expandiert hinter <strong>der</strong> Drossel -> vom Gas eingenommene Volumen nimmt zu ->mittlere Teilchenabstand erhöht sich = Temperatur sinkt14.) Wichtige Verfahren <strong>der</strong> Wasserstoffherstellung (Ausgangsmaterialien, Verfahrensprinzipien <strong>und</strong>Reaktionsbedingungen in Schlagworten, Gr<strong>und</strong>reaktionen, Vor- <strong>und</strong> Nachteile, Umweltrelevanz)a) H 2 O-ElektrolyseMit KOH ≈ 30% Leitfähigkeit erhöht, bei T≈70-90°C, ca. 2 V/Zelle, 2-3 kA/m 2 , teils Druck bis 30 bar. HoherEnergieaufwand, mit Chloralkali-Elektrolyse kombinierbarAnode: 4 OH - O 2 + 2 H 2 O + 4 e -Kathode: 4 H 2 O + 4 e - 2 H 2 + 4 OH -Vorteil: hohe Reinheit, generell kein CO 2 -AusstoßNachteil: hoher Energieverbrauch -> eventueller CO 2 -Ausstoß -> Wasserkraft wäre superb) aus Kohle bzw. KWs, KoksofengasPartielle Oxidation von KW bei 10-100 bar, 1200-1400°C z.B.: Shell-Verfahren(C n H 2n+2 + n/2 O 2 → n CO + (n + 1) H 2Ni-Kat. Reforming (C n H 2n+2 + n H 2 O -> n CO + 2n +1 H 2 daneben Wassergasshift (CO + H 2 O →CO 2 + H 2 )) 30-35 Atü, 900-950 °C, Ni-Katalysator, Röhrenspaltöfen: 30-500 Röhren, Material:Inody 800 (20 Ni, 25 Cr), Röhren mit Ni auf keramischen Träger gefüllt. Beheizung durch heißeAbgase von außen, enthaltener O 2 durch kat. Reaktion am Pt/Pd Kat. (H 2 + 0,5 O 2 → H 2 O)entfernt anschließend absorptive Entfernung des geb<strong>und</strong>en Wassers Kohlevergasung: LURGI-Verfahren Stadtgas (C + H 2 O → CO + H 2 ) bei ca. 1000 °CEndotherm, Beheizt durch Verbrennung <strong>der</strong> KohleCO-KonvertierungWassergasshift-Reaktion (CO + H 2 O → CO 2 + H 2 )Reaktion ist 2 stufig. 1 Stufe mit Fe 2 O 3 + Cr 2 O 3 -Kat bei ca. 400 °C, 2 Stufe bei ca. 250 °C mit ZnO<strong>und</strong> CuO. Das CO 2 wird anschließend physikalisch o<strong>der</strong> chemisch entferntexotherm, CO 2 -Problem.aus MeOHkat. Spaltung (endotherm) am Cu/Ni-Kat. MeOH häufig als Abfallprodukt vorhandenVerfahren abhängig von Reinheitsanfor<strong>der</strong>ungMeOH → 2 H 2 + COCO +H 2 O → H 2 CO 2Vorteil: billig, vor allem MeOH häufig als Abfallprodukt vorhandenNachteil: CO 2 -ProblemAnwendung: Chemische Synthese (Haber-Bosch, Hydrierung) Energieträger (Brennstoffzelle)9
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab15.) Frischwasser: Herkunft; Was ist Wasserhärte? Unterschied Trink- <strong>und</strong> Betriebswasser; wichtigsteVerunreinigungen <strong>und</strong> <strong>der</strong>en AbtrennungHerkunft: Gr<strong>und</strong>wasser (Quellwasser), Oberflächenwasser (Flüsse, Seen, Stauseen), Recycling vonAbwasser (Dicht bevölkerte Gebiete), Salzwasser• Quellwasser: Regen sickert durch den Berg, Anreicherung mit Mineralien, Tonschicht (kann nichtdurch), Austritt aus <strong>der</strong> Quelle.• Gr<strong>und</strong>wasser: ähnliches Prinzip: Regen sickert in den Boden, sickert bis zur Waser<strong>und</strong>urchlässigen Schicht (Ton, Mergel, Felsen). Staut sich dort auf. Durch Brunnen För<strong>der</strong>ung.Österreich hauptsächlich Quellwasser <strong>und</strong> Gr<strong>und</strong>wasser, Deutschland schon ca. 30% Oberflächenwasser,Briten ca. 75% Oberflächenwasser Wasserhärtenatürliches Wasser enthält gelöste Gase <strong>und</strong> Salze, sowie Trüb- <strong>und</strong> SchwebstoffeDie Wasserhärte gibt den Gehalt <strong>der</strong> im Wasser gelösten Ionen Ca, Mg-Salze an.1 ° deutscher Härte 10 mg CaO/l• temporäre Härte: Bicarbonate, beim Kochen zerstört -> Carbonate: Kesselstein• bleibende Härte: Sulfate, Chloride, Nitrate, Silikate; scheiden sich erst bei stärkerem EindampfenabTrinkwasser vs. Betriebswasser• Trinkwasser für menschlichen Bedarf, hohe chem. <strong>und</strong> bakteriologische Anfor<strong>der</strong>ungen, ggf.geklärt (Filtration, Sedimentation), entsäuert (Kalkwasser, Kalkmilch), entkeimt (Cl 2 , O 3 )• Betriebswasser je nach Verwendungszweck (sehr hohe Qualität für Pharmazie, Hohe für Galv. Ind,Farbindustrie, Mittel für Metallbau, nie<strong>der</strong> für Kühlung etc.)Verunreinigungen• Grobstoffe, Sandkörner -> Rechen, Sedimentation (Sandfang)• Fette & Öle -> Schwimmstoff-Abscheidung• absetzbare Stoffe –> Vorklärbecken• biologisch abbaubare & adsorbierte Stoffe -> biologische Reinigung• Bakterienschlamm -> Nachklärbecken• Phosphate -> Fällung mit Al & Fe-Salzen• Kolloide -> Flockung (z.B. FeCl 3 )• Sauer/alkalisch -> Neutralisation• Schwermetalle -> Fällung als Hydroxide• Cyanide -> oxidativ mit H 2 O 210
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab16.) Abwasserreinigung: Einteilung <strong>der</strong> Reinigungsprinzipien <strong>und</strong> Reinigungsverfahrena) Selbstreinigung:natürlicher, belebter Gewässer durch die darin lebende Tier- <strong>und</strong> Pflanzenweltb) Mechanisch (Siebung, Fällung, Filtration, Flockung)Rechenwerkabtrennen von GrobstoffenSandfangSandkörnernSchwimmstoff-Abscheidung abtrennen von Fetten <strong>und</strong> ÖlenAbsetzbecken (Sedimentation) Absetzbare Stoffe werden abgetrenntc) Biologisch (zuerst mechanisch dann Vorklärung → Belebung im Belebt-Becken → Nachklärung →Tropfkörperanlage)O 2 + organische Stoffe + Bakterien → CO 2 + H 2 O + BelebtschlammVerarbeitung des Schlamms: Verringern des Volumens (eindicken), Konditionieren, Filtrieren,Zentrifugieren, Verbrennen, Faulschlamm (Erzeugung von Gasen) -> Klärschlamm nach Analyse zureventuellen Düngungd) chemisch (Oxidation, Entkeimung, Belüftung, Adsorption, Ionentausch, Reversosmose)e) spezielle Abwasserreinigung Flockung(Entfernung von kolloidalen Lösungen durch Elektrolyte -> Mikroflocken -> Flockungsmittel ->Makroflocken) Neutralisation Schwermetallentfernung(Fällung durch Hydroxide im stark basischen Milieu, Ausnahme Cr -> Reduktion zu Cr 3+ mit Sulfitdann mit Base als Hydroxid fällbar) oxidative Abwasserreinigung(H 2 O 2 , O 3 HClO zB. CN - + H 2 O 2 + H 2 O -> NH 4 + HCO 3 - + OH - ) Verbrennung)11
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab18.) Schwefeldioxid-Gewinnungsverfahren: (Ausgangsmaterialien, Endprodukte, kurze Anlagenbeschreibung)a) Verbrennung aus elementarem S,rotieren<strong>der</strong> Schwefelofen: S aufgetragen <strong>und</strong> aufgeschmolzen, anschließend filtriert <strong>und</strong> in <strong>der</strong>Brennkammer mit Luft vermischt <strong>und</strong> zu SO 2 verbrannt – freiwerdende Hitze über Wärmetauscherrückgeführt um S aufzuschmelzen (reines O 2 würde zu große Hitze erzeugen deswegen Luft)b) rösten sulfidischer Erze• Etagenofen (3-45 Etagen 3-7 m lang , 800-900 °C), Elektrofilter (Cotrell-Entstaubung)• Drehrohrofen (bis 100 m lang 3-5 m Durchmesser, 800-900 °C, Reaktionsgut <strong>und</strong> Luft imGegenstrom), Röstgut in <strong>der</strong> Fe-Industrie einsetzbar• Wirbelschichtverfahren (800-900 °C, SO 2 Gas bis 40% Staub) Röstgut nicht verwendbar für Fe-Industrie, weil As, Sb; hohe OF, guter Kontakt, aber oft Sulfidreste (zu kurze Reaktionszeit)c) aus CaSO 4Müller-Kühne Verfahren, Rd. von Gips mit C im Drehrohrofen bei 1400°C,CaSO 4 + C → CaO + SO 2 + CO 2Folgereaktion:CaO + SiO 2 + Al 2 O 3 → Portlandzementd) FeSO 4 UmsetzungFeuchtes FeSO 4 aus Beizbetrieben <strong>und</strong> TiO 2 Gewinnung,Trocknung mit Sprühtrockner mit glühendem Koks umgesetzt, Abbrand in <strong>der</strong> Wirbelschicht zu FeO <strong>und</strong> SO 2e) aus Abfallschwefelsäurebeson<strong>der</strong>s Säureteer, mit glühendem Koks bzw. Generatorgas umgesetzt, anschließende RöstgasreinigungAs 2 O 3 , Sb 2 O 3 in 4 Stufen entferntVerwendung von reinem SO 2 : H 2 SO 4 -Herstellung, Erdölraffination, Weinbau (Desinfektion)19.) Schwefelsäuregewinnung (2 Verfahren alt | neu)Prinzipien, Anlagebeschreibung, Ausgangsprodukte, Endprodukte, Vor- <strong>und</strong> Nachteilea) alt: NO-Verfahren (Bleikammerverfahren), homogene Katalysenur mehr historisch, liefert keine hochkonz. Säure, weniger rein.Umsetzung von Nitrosylschwefelsäure mit Wasser <strong>und</strong> Schwefeldioxid zu SchwefelsäureSO 2 + 2 NOHSO 4 + 2 H 2 O → 3 H 2 SO 4 + 2 NONO + 0,5 O 2 → NO 2NO 2 + NO → N 2 O 3N 2 O 3 + 2 H 2 SO 4 → 2 NOHSO 4 + H 2 O---------------------------------------------------------------------SO 2 + 0,5 O 2 + H 2 O → H2SO 4Im Gloverturm wird HNO 3 mit Röstgasen ausgedampft, 78%ige H 2 SO 4 wird abgezogen. Die Röstgase mit denNitrosegasen kommen in die Pb-Kammern, Schutz durch PbSO 4 -Schicht (groß, da langsame Reaktion), tretenmit 100-110 °C (1. Kammer) ein, raus bei 40-45°C (4 – letzte Kammer) Wasser wird von oben zugespitzt.(Kammersäure: 70%)Gay-Lussac Turm erfolgt die HNO 3 Absorption mit kalter 78%iger Schwefelsäure.Vorteil: billig, SO 2 muss nicht so rein seinNachteil: nicht konz, weniger rein13
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabb) neu: Kontaktverfahren, heterogene Katalysevorgetrock<strong>net</strong>es SO 2, mit H 2 SO 4 endgetrock<strong>net</strong> (sonst H 2 SO 4 -Nebel) <strong>und</strong> am V 2 O 5 -Kat (+ K 2 O, Ag 2 O) (besser alsPt (400 °C) wegen Reaktionsgeschwindigkeit) bei 430 °C zu SO 3 oxidiert. (Gleichgewicht ist günstiger beiniedriger Temperatur)Wertigkeitswechsel V 4+ → V 5+ entscheidend.KVO 3 + SO 2 → KVO 2 .SO 3 → KVO 2 + SO 3KVO 2 + 0,5 O 2 → KVO 3In Hordenkontaktöfen mit Zwischenwärmetauschen (weil exotherme Reaktion)reine Gase (Staub <strong>und</strong> As frei -> Kat.-Gift) Abgas bis zu 1,5% SO 2 -> Doppelkatalyseverfahren SO 2 fast vollständig entfernt. Anschließend erfolgtdie Absorption des SO 3 mit konz. H 2 SO 4 <strong>und</strong> H 2 O (nur mit Wasser wäre Reaktion zu langsam)SO 3 + H 2 SO 4 → H 2 S 2 O 7H 2 S 2 O 7 + H 2 O → 2 H 2 SO 4 (98%)in mehreren Füllkörperkolonen im Gegenstrom (aus säurefesten Steinen o<strong>der</strong> PVC)Vorteil: Konz. Säure, auch Oleum-Herstellung möglich, Abgas fast annähernd SO 2 reinNachteil: Kat.-Gifte20.) Schwefelsäure: Konzentrierung von Dünnsäure, was ist Oleum? 100% SO 3 HerstellungProblematik: H 2 SO 4 = viskos -> erschwerte Dampfblasenbildung bei<strong>der</strong> Destillationa) Konzentrierung (2 Möglichkeiten)1. Konzentrierung nach Tauchbrenner-Verfahren:Über dem Kessel mit verd. Säure wird eine Brennkammer installiert -> verbrennt Öl o<strong>der</strong> Gas mit Luft liefert somit Energie zumVerdampfen von H 2 O 21-23% auf 65-68%2. Regeneration nach Pauling Verfahren (Abfallschwefelsäure)Schwefelsäure (72 %) wird in einem gusseisernen Kesselindirekt erhitzt -> Wasserdampf wird kondensiert ->entstehende Rauchgase werden über Rauchgaskolonne mitverd. Schwefelsäure gereinigt (69 %), dabei nimmt Säure anKonz. bis 96 % zub) Oleum: SO 3 in H 2 SO 4 gelöst, z.B. Oleum 25 = 25% SO 3 gelöstb) Reines SO 3 wird aus Oleum durch Destillation <strong>und</strong>Verflüssigung <strong>der</strong> Dämpfe gewonnen, wobei T > 27 °C seinmuss, da sonst SO 3 erstarrt (von konz. 30-36% auf 24-25%)TIPP: Zeichnung <strong>der</strong> Anlagen sind zum bessere Merken gedacht,nicht für die Prüfung, kann aber nicht schaden wenn man sie macht.14
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab21.) Gewinnung von Synthesegas (N 2 + 3 H 2 ) aus Kohle (Erklärung <strong>der</strong> Verfahrensschritte in Stichworten,verwendete Verfahren inkl. Reaktionsbedingungen)Prinzip: Wassergasshift-Reaktion: C + ½ O 2 → CO CO + H 2 O → H 2 + CO 2a) Kombi aus Generator – <strong>und</strong> Wassergasreaktion, heute ungebräuchlich• Heißblasen: C + ½ O 2 → CO• Kaltblasen: C + H 2 O → CO + H 2 ½b) Druckvergasung mit Luft (Synthesegas) o<strong>der</strong> O 2 , Koppers-Tatzeltgenerator1. Schritt: Vergasung mit Luft <strong>und</strong> Wasserdampf: entsteht hauptsächlich CO + N 2 ≈⅓ H 22. Schritt: Entschwefelung (Hydrierung von org. S-Komponenten zu H 2 S, Trocken - (Aktivkohle, LUX-Masse,ZnO-Absorption) o<strong>der</strong> Nassentschwefelung (Wäsche (Pottasche, Triethanolamin, Alkazidlösung)Rectisolverfahren)3. Schritt: Kompression (22 atm)4. Schritt: 2 Stufen Konvertierung von CO + H 2 O in H 2 in CO 2 , (Gleichgew-Reaktion mit Kat.)4.1. Stufe Fe 2 O 3 + Cr 2 O 3 bei 400°C, (Glgw. Noch 2% CO)4.2. Stufe ZnO + CuO bei 200-300°C(ZnO → vorgeschaltete Schutzschicht gegen S) (Glgw 0,2% CO)5. Schritt: CO 2 -Wäschephys.: Druckwasserwäsche mit H 2 O o<strong>der</strong> MeOH bei 25-30 Atü,chem.: Pottaschelösung (K 2 CO 3 ) 15-40%, 130-150 °C, mit H 2 O Dampf strippen)K 2 CO 3 + CO 2 + H 2 O → 2 KHCO 3Monoethanolamin (CO 2 bis auf 0,1% entfernt)6. Schritt: Kompression (130 atm)7. Schritt: Feinreinigung letzte Reste von CO entfernt -> rückgeführt• Cu-Laugenwäsche bei 300 bar 45°C dann Regeneration im Vakuum• Auswaschen mit flüssigem N 2• katalytisch mit H 2 <strong>und</strong> Ni Kat. Bei 300 – 350 °C))8. Schritt: Entfernung von CO 2 -Resten durch NaOH-Wäsche9. Schritt: Kompression (atm)22.) Gewinnung von Synthesegas (N 2 + 3 H 2 ) aus Erdgas (Erklärung <strong>der</strong> Verfahrensschritte in Stichworten,verwendete Verfahren inkl. Reaktionsbed.)1. part. Oxidation von Erdgas. (Gasspaltung) mit O 2 : Shell-Verfahren 10-100 bar 1200-1400 °CCH 4 (KW) + O 2 → CO + H 2 + H 2 O2 Stufen Konvertierung von CO + H 2 O in H 2 in CO 2 , (Gleichgew-Reaktion mit Kat.)1.Stufe Fe 2 O 3 + Cr 2 O 3 bei 400°C, (Glgw. Noch % CO)2.Stufe ZnO + CuO bei 200-300°C(ZnO → vorgeschaltetete Schutzschicht gegen S) (Glgw 0,2% CO)Monoethanolamin-Wäsche: CO 2 -Entfernung (o<strong>der</strong> K 2 CO 3 )NaOH Wäsche (entfernen von CO Reste)flüssig N 2 -Wäsche Entfernung von CH 4 -Resten (gleich nötige Menge N 2 für Haber-Bosch)Kompression für NH 3 -Synthese15
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab2. Schweröle: (nicht kat. partielle Oxidation)Teilverbrennung: -(CH 2 )- + ½ O 2 → CO + H 2oft Rußbildung → Rußwäsche3. Wasserdampfspaltung (Steam-Reforming)CH 4 + H 2 O → CO + 3 H 21. Leichtöle o<strong>der</strong> Erdgas müssen zuerst entschwefelt werden2. Röhrenspaltöfen 30-500 Röhren, 30-35 Atü, 900-950 °C, Material: Inody 800 (20 Ni, 25 Cr), Röhrenmit Ni auf keramischen Träger gefüllt. Beheizung durch heiße Abgase von außen3. CO-Konvertierung (wie oben beschrieben)4. Wenn noch CH 4 im Abgas → Luftteilverbrennung bei 750 °C (wird gleich N 2 eingebracht)23.) Haber-Bosch-Synthese: Prinzip, Reaktionsbedingungen, Reaktoren, Verfahrensablauf, Verwendung vonAmmoniaka) Syntesegleichgeicht: N 2 + 3 H 2 → 2 NH 3 (Katalysator nötig)b) günstiges Gleichgewicht bei hohem Druck, nie<strong>der</strong>er Temperatur,Reaktionsgeschwindigkeit bei hoher Temperatur <strong>und</strong> hohem Druck besser.Mittelweg: 150-230 atm, 400-500 °CKatalysator: alkalisiertes Fe 2 O 3 + Zusätze Al 2 O 3 , K 2 O, CaO, (MgO). erhöhen Stabilität gegen Kat.gifte (CO,CO 2 O 2 < 30 ppm - reversibel // S, X, P < 1 ppm - irreversibel)Lebensdauer 2-5 Jahre. Fe 2 O 3 mit Synthesegas zu Fec) Reaktor: besteht reinem Eisenkern (da Fe 3 C im Stahl sonst reduziert wird) umhüllt von C-freiemStahlrohr mit Entgasungslöchern (für Festigkeit), gewickelt.Haber-Bosch-Röhrenwärmetauscher,mehrere Reaktionszonen hintereinan<strong>der</strong>, Zwischenkühlung zum Wärmetausch, Radialflusskonverter.d) Gaskreislauf zur Abtrennung von NH 3 : NH 3 wird entspannt <strong>und</strong> flüssig abgeschieden. Nicht umgesetzterN 2 + H 2 wird komprimiert <strong>und</strong> vorgewärmt, in Kontaktreaktor umgesetzt,Kreislaufgase (Verunreinigungen: O 2 , CH 4 sowie Inertgas: max 2%) teilweise ausgeschiedene) 1) Harnstoff (Düngemittel, Kunststoffe, Schaumstoffe, Futtermittel)2) Salpetersäure (Düngerherstellung, Schädlingsbekämpfung, Kunststoffe)3) Weitere (Raketentreibstoffe, Soda, Wolframherstellung u.v.m)24.) Salpetersäure: Herstellung aus Ammoniak (Reaktionsgleichungen, Prinzipien <strong>der</strong> Teilschritte, kurzeAnlagenbeschreibung, Möglichkeiten für das Gesamtverfahren)a) OSWALD-Verfahren: Reaktionsgleichung4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O (Pt + 5-10% Rh als Kat) (1)stark exotherm, rasche Reaktion2 NO + O 2 ⇌ 2 NO 2 (2)2 NO 2 ⇌ N 2 O 4 (3)x 3 | N 2 O 4 + H 2 O → HNO 2 + HNO 3 (4)3 HNO 2 → HNO3 + 2 NO + H 2 O (5)2 NO + O 2 ⇌ N 2 O 4 (2,3)16
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabNebenprozesse5. Gipsdeponie (aus 4)6. Aufbereitung & Verarbeitung Chemiegips7. Prozess- <strong>und</strong> Kühlwasserrückgewinnung8. Gewinnung H 2 SiF 6Hauptteil <strong>der</strong> Flourgewinnung9. Synthetische Fluor-Produkte10. Uran-Rückgewinnung (U 3 O 8 )Hauptteil <strong>der</strong> Urangewinnungd) Unterschiedliche Verfahren:- Dihydratverfahren (PRAYON Verfahren) (< 80 °C): CaSO 4·2H 2 O - bis 30% P 2 O 4- Semihydratverfahren (NISSON) (80-100 °C): CaSO 4·0,5 H 2 O - bis 50% P 2 O 4- Semihydratverfahren + Gips (NISSON o<strong>der</strong> ALBATROS)Gips filtriert mit Bandfilter / Karusselfilter -> bessere Fällung mit aktivem SiO 2 (weil weniger Feinanteil)Ablauf: 30-34% Phosphorsäure (hoch viskos) + HF, beim Filtrieren Tücher ständig gut ausgewaschenPhosphorsäure durch Vakuumverdampfung auf 54% vorkonzentriert (500-1000 Torr mitDampfstrahlejektoren o<strong>der</strong> Zwangsumlaufverdampfer) HF aus Brüden mit Silikaten zu H 2 SiF 6Weitere Vakuumeindampfung zu Pyrophosphorsäure (80% P 2 O 5 ) für flüssige Mehrstoffdünger• Konzentrierung mittels Tauchbrenner (Heizgas in H 3 PO 4 eingeblasen) kommen von 30% auf 70%höher geht nicht da sonst Polyphosphatbildung <strong>und</strong> zu hohe Viskosität• Indirekt, wie Vakuumeindampfung aber schwierig, Heizmittel Downtherm,e) Abfallprodukte:1. Gips (nach Giulini-Verfahren) pro t P 2 O 5 - 4-5 t Gips (geringe Reinheit, F-Gehalt – nicht für Bauindustrie)• Gipsschwefelsäure (Müller-Kühne-Verfahren: Entsteht CaO <strong>und</strong> SO 2 )• Ammonsulfatherstellung,• Baustoffe zuerst Reinigung erfor<strong>der</strong>lich (Flotation <strong>und</strong> H 2 O-Wäsche ) -> Semihydrat im Autoklaven bei110 – 120 °C (Verunreinigungen ins Abwasser)2. Fluor:• Herstellung von Na 2 SiF 6 (H 2 SiF 6 mit NaCl umgesetzt, für Trinkwasserfluorierung <strong>und</strong>Mörtelabdichtung bei z.B. Schwimmbecken)• Al-Fluorid (Umsetzung von HF mit Al(OH) 3 , H 2 SiF 6 mit Al(OH) 3 bei 70°Cm zuerst AlF 3metastabil gelöst, dann SiO 2 abfiltriert, dann AlF 3·3H 2 O bei 98°C entwässert <strong>und</strong> kristallisiert.Verwendung als Kat o<strong>der</strong> zu Karies-Prophylaxe )• Kryolith (Na 3 [AlF 6 ]) wird für die Aluminium-Herstellung gebaucht H 2 SiF 6 Lösung mit NH 3 versetzten, SiO 2abfiltrieren, mit Natriumaluminat <strong>und</strong> NaOH umsetzen dabei entstehen<strong>der</strong> Ammoniak rückgeführtH 2 SiF 6 + 6 NH 3 + 2H 2 O → 6 NH 4 F + SiO 26 NH 4 F + 3 NaOH + Al(OH) 3 →Na 3 [AlF 6 ] + 6 NH 3 +6 H 2 O19
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab28.) Fluorverbindungen: Wo fallen Fluorverbindungen als Nebenprodukte an?Herstellung <strong>und</strong> Verwendung von drei wichtigen FluorverbindungenH 3 PO 4 (H 2 SO 4 -Aufschluss) & Superphosphatherstellung Abgase bis zu 25% H 2 SiF 6 , Hall-Heroult-, ODDA-Verfahren• Herstellung von Na 2 SiF 6 (H 2 SiF 6 mit NaCl umgesetzt, für Trinkwasserfluorierung <strong>und</strong>Mörtelabdichtung bei z.B. Schwimmbecken)• Al-Fluorid (Umsetzung von HF mit Al(OH) 3 , H 2 SiF 6 mit Al(OH) 3 bei 70°Cm zuerst AlF 3metastabil gelöst, dann SiO 2 abfiltriert, dann AlF 3·3H 2 O bei 98°C entwässert <strong>und</strong> kristallisiert.Verwendung als Kat o<strong>der</strong> zu Karies-Prophylaxe )• Kryolith (Na 3 [AlF 6 ]) wird für die Aluminium-Herstellung gebaucht H 2 SiF 6 Lösung mit NH 3 versetzten, SiO 2abfiltrieren, mit Natriumaluminat <strong>und</strong> NaOH umsetzen dabei entstehen<strong>der</strong> Ammoniak rückgeführtH 2 SiF 6 + 6 NH 3 + 2H 2 O → 6 NH 4 F + SiO 26 NH 4 F + 3 NaOH + Al(OH) 3 →Na 3 [AlF 6 ] + 6 NH 3 +6 H 2 O29.) Liebig „Gesetz des Minimums“, Erklärung <strong>und</strong> Zusammenhang Düngung/RentabilitätWichtigsten Nährstoffe: N, P, K, CaSpurenelemente: Fe, Cu, Zn, S, Mg, Na, Mn, B, MoDüngen eine Möglichkeit um die Ernährung für steigende Bevölkerung zu gewährleisten.An<strong>der</strong>e Möglichkeit: mehr anbauen = nicht optimal weil limitierter Platz bzw. müssen wir froh sein wenn <strong>der</strong>Ertrag durch die Trockenheit nicht weniger wird.Schädlingsschutz auch ein Möglichkeit = meist für Menschen auch nicht gut.Stoffe, die durch Ernten dem Boden entzogen werden, müssen wie<strong>der</strong> zugeführt werden.Wachstum nicht durch Element verhin<strong>der</strong>t welches die niedrigste Konzentration hat wie z.B.Spurenelemente son<strong>der</strong>n durch das Element welches benötigt wird aber am wenigsten da ist. (gilt nicht nurfür wichtigsten Nährstoffe son<strong>der</strong>n auch für Spurenelemente). Wenn kein B da ist wird nichts wachsen,genauso wenn <strong>der</strong> P o<strong>der</strong> N fehlt. Wichtig versch. Pflanzen haben unterschiedlichen Bedarf. (Vergleichbar miteinem Fass unterschiedlich hoher Dauben)max. Gewinn durch Düngung -> Mehrerlös mit Kosten korreliert werden.zu wenig → schlechter Ertragzu viel → unrentabel20
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab30.) Phosphateinzeldünger: Aufzählung <strong>der</strong> Dünger, Herstellung in Schlagworten, Vor- <strong>und</strong> Nachteile <strong>der</strong>einzelnen Düngera) Aufzählung:• wasserlösl. Phosphate (NH 4 -Phosphat, Mono-Ca-Phosphat, Super, Doppel, Tripelphosphat)• citratlösl. Phosphate (Bi-Ca-Phosphat, Schmelzphosphat)• NH4-citratlösl. (Thomasmehl, Rhenaniaphosphat)b) Herstellung in Schlagworten- Superphosphat (18% P 2 O 5 ): Apatit (= Ca 3 (PO 4 ) 2 x CaF 2 ) Aufschluss mit H 2 SO 4 , dann Zugabe bis zumMono-Ca-Phosphat.Reaktion in 2 Stufen:1. H 3 PO 4 + Mono-Ca-Phosphat (1 h)2. Reifung für 8 Wochen, Aufschluss Restapatit durch Zugabe H 3 PO 4 unter Bildung Di-Ca-Phosphat.Rohphosphat gut mahlen, nach Mischen mit 65-70% H 2 SO 4 erwärmen ruhen bis zum Erstarren (HFentsteht), zerkleinern Reifen auf Halden o<strong>der</strong> Silos- Doppelsuperphosphat (34-36% P 2 O 5 ):Aufschluss wie bei Superphosphat, aber mit Gemisch H 2 SO 4 + H 3 PO 4- Triple-Superphosphat (44-46% P 2 O 5 ): Aufschluss mit dünner H 3 PO 4 ( 28-39% P 2 O 5 ), dann2h in Trockentrommel trocknen. Wirtschaftliches Verfahren.- Thomas-Phosphat: Durch Verarbeitung phosphathaltiger Eisenerze, FeP (bis zu 2% im Erz) wird in<strong>der</strong> Thomasbirne (alkalische Ausmauerung) zu P 2 O 5 oxidiert <strong>und</strong> durch basische Zusätze (CaO) alsPhosphat geb<strong>und</strong>en. Schlacke als Düngemittel brauchbar (14-16% P 2 O 5 ), mittlerweile verschw<strong>und</strong>enwegen LD-Verfahren- Glühphosohat (Rhenaniaphosphat) Apatit + Soda + Sand im Drehrohrofen bei 1150-1200 °C erhitzt,es entsteht Gemisch aus CaNaPO 4 , Ca-Silikat, NaF (26-28% Phosphat)- Camaphos: Gebrannter Dolomit (MgO, CaO) mit Apatit gesintertc) Vor <strong>und</strong> Nachteile:- Superphosphat u.a.: Tripelphosphat sehr hoher P 2 O 5 -Anteil (im Vergleich zu Super- &Doppelphosphat), wasserlöslich -> d.h. gut zugänglich für Pflanze aber bei starken Regenauswaschen des Düngers (für schnell wachsende Pflanzen)- Thomasmehl: geringen P 2 O 5 -Anteil aber dafür NH 4 <strong>und</strong> citratlöslich <strong>und</strong> nicht wasserlöslich.z.B. starke Regenfälle = stabiler -> für langsam wachsende Pflanzen- Glühphosphat: ähnlich Thomasmehl- Camaphos: hauptsächlich citratlöslich21
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab31.) Herstellung von Superphosphat: Ausgangsprodukte, Anlagen, chemische Reaktionen, Diagramm zeitlicherAblaufa) Ausgangsprodukt: Apatit = Ca 5 [(F,Cl,OH)|(PO 4 ) 3 ]Apatit gut mahlen Aufschluss mit H 2 SO 4 , dann Zugabe bis zum Mono-Ca-Phosphat.Reaktion in 2 Stufen:1. H 3 PO 4 + Mono-Ca-Phosphat (1 h)2. Reifung für 8 Wochen, Aufschluss Restapatit durch Zugabe H 3 PO 4 unter Bildung Di-Ca-Phosphat.Rohphosphat gut mahlen, nach Mischen mit 65-70% H 2 SO 4 erwärmen ruhen bis zum Erstarren (HFentsteht), zerkleinern Reifen auf Halden o<strong>der</strong> Silosb) Broadfield-Anlage + Zeitlicher Verlaufc) Reaktionsgleichung:2 Ca 3 (PO 4 ) 2 + 6 H 2 SO 4 + 12 H 2 O → 4 H 3 PO 4 + 6 [CaSO 4·2H 2 O]Ca 3 (PO 4 ) 2 + 4 H 3 PO 4 → 3 Ca(H 2 PO 4 ) 2--------------------------------------------------------------------------------------------Ca 3 (PO 4 ) 2 + 2 H 2 SO 4 + 4 H 2 O → Ca(H 2 PO 4 ) 2 + 2 [CaSO 4·2H 2 O]32.) Stickstoffeinzeldünger: (5 Verbindungen), Herstellung in Schlagworten, Vor- <strong>und</strong> Nachteile <strong>der</strong> einzelnenDüngera) Herstellung in Schlagwortena) Ammoniumsulfat (NH 4 ) 2 SO 4 :- Neutralisation von NH 3 <strong>und</strong> 60-65% H 2 SO 4 im Sprühturm Apparatur aus Pb (weil PbS =Schutzschicht = korrodiert nicht), H 2 O verdampft → (NH 4 ) 2 SO 4- o<strong>der</strong> aus Gips: NH 3 + CO 2 → (NH 4 ) 2 CO 3 + CaSO 4 → CaCO 3 + (NH 4 ) 2 SO 4Vorteil: gut wasserlöslich, billigNachteil: wäscht sich im Regen schnell aus22
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabb) Ammoniumnitrat NH 4 NO 3 :theoretisch 35% N, prakt. 33%, Zerfall ab 170°C in N 2 O <strong>und</strong> H 2 O bzw. ab 260°C Explosion.Verwendung auch als Sicherheitssprengstoff.NH 3 <strong>und</strong> 45-50% HNO 3 unter Kühlung in Kolonne unter Druck umgesetzt, vakuumeingedampft auf 70-75% NH 4 NO 3 (nicht zu heiß 75°C -> Explosion)Vorteil: hoher N-Gehalt, gut wasserlöslichNachteil: explosionsgefährlich, wäscht sich ausc) Kalksalpeter: Kalkstein (CaCO 3 ) mit HNO 3 zu Ca(NO 3 ) 2 umgesetztIm Rührkessel, überschüssiges CaCO 3 filtriert, trocknen, eventuell noch NH 4 NO 3 zusetzbarVorteil: gut aufnehmbarNachteil: reizend, brandför<strong>der</strong>nd, wäscht sich ausd) Harnstoff: heute wichtigster Dünger <strong>und</strong> Auftausalz2 Stufen, hoher Drucka) NH 3 + CO 2 → NH 2 COONH 4 (Ammoncarbamat) (flüssig) schnell (erhöhter Druck)b) NH 2 COONH 4 → NH 2 CONH 2 + H 2 O langsamUmsetzung von flüssigem NH 3 (Überschuss) mit CO 2 bei 200 °C, 250 bar -> Austritt -> Carbamat zuNH 3 + CO 2 zerlegt -> rückführen -> Harnstoffumsetzung -> im Ausblasturm konzentriert, imSpritzraum kristallisiert, im Trockenturm getrock<strong>net</strong>, verpacktVorteil: hoher N-Gehalt, unbedenklich,Nachteil: schlecht löslich (bei den Asiaten Reisdünger), kann NH 3 ausgasene) Kalkstickstoff: CaO <strong>und</strong> C (Koks) im Lichtbogenofen (2300 °C flüssiges Carbid) mit Sö<strong>der</strong>berg-Elektrode (3 Elektroden wegen 3 Phasen die vom Kraftwerk kommen) zu CaC 2 hergestellt,gekörntes Carbid im Azotierofen zu Kalkstickstoff umgesetzt: CaC 2 + N 2 → CaCN 2 + CT < 1200 °C Regelung über N 2 -Strom -> sonst Zersetzung, Katalysator: CaF 2 InitialzündungZersetzung CaCN 2 = Ca + N 2 + CVorteil: löslich durch Hydrolyse, weitere Verwendung von CaC 2 (Wasser zu Acetylen reagieren =Grubenlampe, auch in Stahlindustrie zum Schwefelentfernen)Nachteil: Ges<strong>und</strong>heitsschädlich, hoher Stromverbrauch beim Herstellen von CaC 233.) Harnstoffsynthese: Ausgangsprodukte, Reaktionsgleichungen, Verfahrensschritte <strong>und</strong>Reaktionsbedingungen bis zum festen Granulat, Verwendunga) Ausgangsprodukt: CO 2 , NH 3f) Verfahren & Reaktionsgleichung: heute wichtigster Dünger <strong>und</strong> Auftausalz2 Stufen, hoher Druckc) NH 3 + CO 2 → NH 2 COONH 4 (Ammoncarbamat) (flüssig) schnell (erhöhter Druck)d) NH 2 COONH 4 → NH 2 CONH 2 + H 2 O langsamUmsetzung von flüssigem NH 3 (Überschuss) mit CO 2 bei 200 °C, 250 bar -> Austritt -> Carbamat zuNH 3 + CO 2 zerlegt -> rückführen -> Harnstoffumsetzung -> im Ausblasturm konzentriert, imSpritzraum kristallisiert, im Trockenturm getrock<strong>net</strong>, verpacktb) Verwendung: Dünger, Auftausalz, Kosmetik, Pharmazeutik23
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab34.) Herstellung von Kalkstickstoff: Beschreibung <strong>der</strong> Karbi<strong>der</strong>zeugung (Ausgangsprodukte,Verfahrensbeschreibung), Umsetzung zu Kalkstickstoff: (Anlage, Reaktionsgleichung, Reaktionsbedingungen)a) KarbidherstellungEdukte: CaO <strong>und</strong> C (Koks)Verfahren: CaO <strong>und</strong> C (Koks) im Lichtbogenofen (2300 °C flüssiges Carbid) mit Sö<strong>der</strong>berg-Elektrode (3Elektroden wegen 3 Phasen die vom Kraftwerk kommen) zu CaC 2 umgesetzt (hoher Stromverbrauch)b) Umsetzung zum Kalkstickstoffgekörntes Carbid im Azotierofen über Kohleheizstäben erhitzt & zum Kalkstickstoff umgesetzt: CaC 2 +N 2 → CaCN 2 + CT < 1200 °C Regelung über N 2 -Strom -> sonst Zersetzung, Katalysator: CaF 2 InitialzündungZersetzung CaCN 2 = Ca + N 2 + Cc) Anlage35.) Das ODDA-Verfahren: Ausgangsprodukte, wesentliche Verfahrensschritte mit Bedingungen, Endprodukte.Weiterverarbeitung eines Nebenprodukts zu NH 4 NO 3 (Prinzip <strong>und</strong> Verfahrensschritte)a) Edukte: Ca 5 (PO 4 ) 3 F, HNO 3Ca 5 (PO 4 ) 3 F + (10+x) HNO 3 –> 5 Ca(NO 3 ) 2 + 3 H 3 PO 4 + HF + x HNO 3b) Verfahren:Aufschluss des Apatits mit HNO 3• Temperatur im Reaktor (hoch = HNO 3 -Zersetzung, niedrig = lange Verweilzeit),• Apatit-Teilchengröße• VerweilzeitKühlung: Ca(NO 3 ) 2 kristallisiert, im Abgas bleiben HF, SiF 4 , NO x , CO 2 <strong>und</strong> H 2 O über.Endprodukte sind Ca(NO 3 ) 2 in Kombination mit H 3 PO 4 <strong>und</strong> HNO 3 .c) Weiterverarbeitung: Ca(NO 3 ) 2 + 2 NH 3 + CO 2 + H 2 O → CaCO 3 + 2 NH 4 NO 3CaCO 3 durch Bandfilter <strong>und</strong> 2 Waschstufen abgetrennt, NH 4 NO 3 Lösung auf 94% konzentriert, CaCO 3getrock<strong>net</strong> als Baustoff o<strong>der</strong> für Landwirtschaft.24
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab36.) Chlor-Alkali Elektrolyse: Erklärung <strong>der</strong> Schmelzflusselektrolyse, Vergleich mit <strong>der</strong> Amalgamzelle (Prinzipbei<strong>der</strong> Verfahren, verwendete Werkstoffe, Ausgangs- <strong>und</strong> Endprodukte, Vor- <strong>und</strong> Nachteile)a) Schmelzflusselektrolyse in „Downs-Zelle“NaCl → Na (l) + 0,5 Cl 2 (g) Kathode: Na + + e - -> Na Anode: 2 Cl - -> Cl 2 + 2 e -kein wässriger Elektrolyt (elektrochemische Spannungsreihe Erdalkalimetalle < H 3 O + )Anode: Graphit,Kathode: Fe (ringförmig) mit Draht<strong>net</strong>zdiaphragma aus Stahl von <strong>der</strong> restliche Zelle getrenntReaktion im Eisenkessel mit feuerfester Mauerung (Schamottsteine), Na schwimmt oben, in Rinnegesammelt, CaCl 2 -Zusatz Temperatur auf 600 °C erniedrigt (sonst Na fein in Schmelze verteilt)Edukte: NaCl, CaCl 2 , Anode KathodeProdukte: Na, Cl 2Vorteil: Na elementar, kann separat umgesetzt werdenNachteil: viel Energie nötigb) AmalgamzelleNaCl + xHg NaHg x + Cl 2 Kathode: Na + + Hg x + e - -> NaHg xNaHg x + H 2 O NaOH + x Hg + H 2 Anode: 2 Cl - -> Cl 2 + 2 e -Überspannung von H an Hg erlaubt Amalgambildung.Kathode: flüssiges HgAnode: Graphit mit Ti beschichtet. Große Anodenfläche, als Optimierung: Graphit brennt ab -> mit Ptaktivierte Ti-Anoden + Löcher für O 2 Abzugschmiedeeiserner Trog mit gummierten Wänden. Größe: 40 m² pro Zelle, 300.000 A pro ZelleEdukte: NaCl, Hg, H 2 OProdukte: NaOH (20-50%), Cl 2 , H 2 HgVorteil: räumliche Trennung von Cl 2 <strong>und</strong> H 2 , NaOH getrennt von NaCl, H 2 entsteht, wenig EnergieNachteil: Hg (Giftig), Hg-Spuren in Cl 2 <strong>und</strong> Lauge verschleppt, große Hg-Menge (3t), pro Jahr ca. 2 kgverloren, dazu H 2 -Entstehung durch zwangsweise Umsetzung von Na-Amalgam mit H 2 O für Hg-Rückgewinnung.37.) Chlor-Alkali-Elektrolyse: Erklärung <strong>der</strong> Diaphragma-Zelle, Vergleich mit Membranzelle (Prinzip bei<strong>der</strong>Verfahren, verwendete Werkstoffe, Ausgangs- <strong>und</strong> Endprodukte, Vor- <strong>und</strong> Nachteile)a) Diaphragma-ZelleKathode: Na + + OH - + 2 H + + 2e - NaOH + H 2Anode: 2 Cl - Cl 2 + 2e -Gesamt: NaCl + H 2 O NaOH + H 2Wasserhärte vermin<strong>der</strong>n, HCl-Zusatz (Neutralisation) -> verhin<strong>der</strong>t Rückdiffusion von NaOH (wenigerNebenprodukte wie Chlorate, Hypochlorite <strong>und</strong> O 2 )Anode: Graphit mit aktivierter Ti-Beschichtung (Pt)Kathode: StahlDiaphragma (Asbest o<strong>der</strong> PVC-Folie) trennt Kathoden-Anodenraum -> verhin<strong>der</strong>t Diffusion von Cl 2(Kathode) zur NaOH bzw H 2 (Anode)3,5 V AC bei 1200 A/cm²Edukte: NaCl, H 2 O, HCl25
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabProdukte: NaOH (11%), Cl 2 , H 2Vorteil: wenig KW/t NaOH für Elektrolyse, umweltfre<strong>und</strong>lichNachteil: NaOH (11% < als Membran mit 28%) & mit NaCl verunreinigt, Diaphragma aus Asbest, hoherEnergieverbrauch für Wasserverdampfungb) MembranzelleWeiterentwicklung <strong>der</strong> Diaphragma-ZelleAnode: Titananode (beschichtet)Kathode: EisenblechkathodeMit Teflon-Netz verstärkte Membran aus Nafion (Tetrafluorethanperfluorsulfaonylethylether)wirksamer als Diaphragma, lässt nur H 3 O + <strong>und</strong> Na + durch.Edukte: NaCl, H 2 O,Produkte: NaOH (28%), Cl 2 , H 2Vorteil: wenig Strom bei Wasserverdampfung, umweltfre<strong>und</strong>licher, reines Cl 2 , H 2, NaOH = NaCl-freiNachteil: Teuer → Membran geht schnell kaputt, mehr KW/t NaOH für Elektrolyse38.) Chlor-Alkali Elektrolyse: Erklärung Amalgamverfahren, Vergleich mit MembranzelleSiehe 36, 37 + Grafik39.) Chlor-Alkali Elektrolyse: Erklärung Membranzelle, Vergleich mit AmalgamzelleSiehe 38 + Grafik40.) Herstellung von Hypochlorit, Chlorit, Chlorat, Perchlorat (in Schlagworten)a) Hypochlorit: 2 NaOH + Cl 2 → NaClO + H 2 O + NaClBei nie<strong>der</strong>er Temperatur (30-40°C) Einleitung von Cl 2 in NaOH.(1 : 2 Cl 2 :NaOH ) elektrolyt. Herstellung möglich, nicht rentabelb) Chlorit 2 ClO 2 + 2 NaOH + H 2 O 2 → NaClO 2 + O 2 + 2 H 2 O (tech. Herstellung)elektrolyt. Herstellung noch nicht gelungenc) Chlorat: NaCl + 3 H 2 O → NaClO 3 + 3 H 2Herstellung durch Elektrolyse <strong>und</strong> Konvektion. C-Anoden 40-45°C, für Metall-Anoden 60-80°Cd) Perchlorat: NaClO 3 + H 2 O → NaClO 4 + 2H + + e -Elektrolyse meist Pt-Anoden, Stahl Kathoden 35-60°C; 5-7 V in Betontrog26
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab41.) Salzsäure: Herstellung (Prinzip, Beschreibung <strong>der</strong> Anlage, ZusammenhangDichte / Konzentration)1. Schritt Herstellung des Chlorwasserstoff-Gasesa) 2 Stufen:NaCl + H 2 SO 4 → HCl + NaHSO 4 20 °CNaCl + NaHSO 4 → HCl + Na 2 SO 4 800 °CNebenprodukt bei Sulfatherstellung im Sulfatofen mit Gasheizungbeheizter Kessel NaCl mit H 2 SO 4 umgesetzt → HCl Gasb) C 6 H 6 + Cl 2 → C 6 H 5 Cl + HClChlorierung von z.B. Benzol im Chlorierkesselc) Cl 2 + H 2 → 2 HClKochsalzelektrolyse chem. reine HCl.Es entsteht H 2 + Cl 2 <strong>und</strong> NaOH. Gas getrennt gefangen abgekühlt mit H 2 SO 4 (Chlor noch extra mitWasser) gewaschen <strong>und</strong> dann im Quarzrohrbrenner mit einem Brenner umgesetzt.2. Schritt Absorption von HCl mit Wasser zur SalzsäureAbsorptionsturmunten 100% HCl-Gas (0 °C), oben H 2 O (100 °C)im Gegenstrom -> unten 35% HCl (60 °C)Zusammenhang Dichte / KonzentrationDichte [g/cm³] 1,05 1,08 1,16 1,19Konzentration [%] 10 16 32 35zunehmen<strong>der</strong> Konzentration HCl im Wasser nimmtauch die Dichte <strong>der</strong> Lösung zu42.) Die 4 wichtigsten Metallchloride (keine Alkalien/Erdalkalien): Herstellungsverfahren, Weiterverarbeitung,Verwendung <strong>der</strong> Chloride <strong>und</strong> seiner Folgeprodukte1. AlCl 3 :USA: 2 Al + 3 Cl 2 → 2 AlCl 3 bei 800 °CBASF aus Bauxit + Phosgen in Wirbelschicht-Schachtofen, AlCl 3 von FeCl 3 durch sublimieren getrennt.(Al 2 O 3 + x Fe 2 O 3 + CO + Cl 2 → AlCl 3 + FeCl 3 )Verwendung: Organik (Friedel-Craft)2. FeCl 3 : 2 Herstellungsverfahren1) Schrott + Cl 2 im Schachtofen umgesetzt2 Fe + 3 Cl 2 → 2 FeCl 32) in wässriger FeCl 3 -Lösung Fe auflösen <strong>und</strong> danach oxidierenFeCl 3 + Schrott FeCl 22 FeCl 2 + Cl 2 2 FeCl 3sublimiert, gemahlen, gesiebt -> H 2 O reines FeCl 3Verwendung: Katalysator <strong>und</strong> als Flockungsmittel für die H 2 O-Reinigung27
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab3. TiCl 4 : Ilmenit (FeTiO 3 ) o<strong>der</strong> Rutil (TiO 2 ) mit Kohle gemischt <strong>und</strong> bei 700-1000°C mit Chlor umgesetzt.Verwendung: Im Krollprozess mit Mg-Metall, Herstellung von TiO 2 -Pigmenten durch Verbrennung.4. ZrCl 4 : Herstellung durch Behandlung von ZrO 2 o<strong>der</strong> ZrSiO 2 mit Kohle <strong>und</strong> Chlor bei 1000-1500°CVerwendung: Herstellung von Zirconium-organischen Verbindungen, Katalysator bei Friedel-Crafts-Reaktionen, Polymerisationen von Olefinen, Epoxiden <strong>und</strong> VinylmonomerenIst das wichtigste Zwischenprodukt bei <strong>der</strong> Zr-Metallgewinnung. Hf Abtrennung (bei Zr Brennelemten in<strong>der</strong> Kernenergie)5. SiCl 4 + SiHCl3:1) Cl 2 , SiO 2 + C (Schachtofen)2) FeSi, SiC <strong>und</strong> Cl 2 im Fließbettreaktor bei 500 – 1000°C3) Reaktion zweistufig1. SiO 2 + C→ Si +CO 2 (Lichtbogenofen)2. Si + HCl → SiCl 4 /SiHCl 3 (Wirbelschicht)Verwendung: Herstellung von SiO 2 -Herstellung (Aerosil), Herstellung hochreinem Halbleitersilicium43.) Soda nach Solvay: Verfahrensprinzip, Ausgangs- End-, <strong>und</strong> im Kreislauf geführte Produkte,Reaktionsgleichungen <strong>und</strong> Bedingungen <strong>der</strong> einzelnen Verfahrensschrittea) NaHCO 3 ist schwer löslich <strong>und</strong> daher leicht abtrennbar (ginge mit KHCO 3 nicht)1) Kalkstein im Schachtofen umgesetztCaCO 3 CaO + CO 2CO 2 gewaschen, CaO für Ammoniak-RückgewinnungNaCl in Wasser gelöst, gesättigte Sole filtriert• Absorber: NH 3 in gesättigter Sole gelöst• im Fälltugm mit CO 2 in Kontakt NaCl + NH 3 + H 2 O + CO 2 NaHCO 3 + NH 4 Cl• NaHCO 3 ist unlöslich, filtriert im Drehfilter• kalzinieren zu Soda 2 NaHCO 3 Na 2 CO 3 + H 2 O + CO 2• im Wärmetauscher: NH 3 rückgewonnen + rückgeführt• restlichen NH 4 Cl + hergestellte Kalkmilch (CaO + H 2 O) -> restlichen Ammoniak rückzugewonnen<strong>und</strong> als Nebenprodukt CaCl 2 -Lauge zu erhalten.b) Edukte: NH 3 , CO 2 , NaCl, CaCO 3 , H 2 O (NH 3 , H 2 O CO 2 wie<strong>der</strong>verwertet)Produkte: Na 2 CO 3 , (NaHCO 3 ) <strong>und</strong> CaCl 2c) Reaktionsgleichungen:NH 3 + CO 2 + H 2 O NH 2 HCO 3NaCl + NH 4 HCO 3 NaHCO 3 + NH 4 Cl2 NaHCO 3 Na 2 CO 3 + H 2 O + CO 2CaCO 3 CaO + CO 2 TCaO + H 2 O Ca(OH) 2 T2 NH 4 Cl + Ca(OH) 2 2 NH 3 + CaCl 2 + 2 H 2 O2 NaCl + CaCO 3 Na 2 CO 3 + CaCl 228
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab44.) Soda Herstellung (zwei aktuelle Verfahren): Für jedes Verfahren (Prinzip <strong>der</strong> Herstellung, wichtigeVerfahrensschritte, Ausgangs-, Kreislauf-, Endprodukte)a) Solvay-VerfahrenNaHCO 3 ist schwer löslich <strong>und</strong> daher leicht abtrennbar (ginge mit KHCO 3 nicht)Kalkstein im Schachtofen umgesetztCaCO 3 CaO + CO 2CO 2 gewaschen, CaO für Ammoniak-RückgewinnungNaCl in Wasser gelöst, gesättigte Sole filtriert• Absorber: NH 3 in gesättigter Sole gelöst• im Fälltugm mit CO 2 in Kontakt NaCl + NH 3 + H 2 O + CO 2 NaHCO 3 + NH 4 Cl• NaHCO 3 ist unlöslich, filtriert im Drehfilter• kalzinieren zu Soda 2 NaHCO 3 Na 2 CO 3 + H 2 O + CO 2• im Wärmetauscher: NH 3 rückgewonnen + rückgeführt• restlichen NH 4 Cl + hergestellte Kalkmilch (CaO + H 2 O) -> restlichen Ammoniak rückzugewonnen<strong>und</strong> als Nebenprodukt CaCl 2 -Lauge zu erhalten.Edukte: NH 3 , CO 2 , NaCl, CaCO 3 , H 2 O (NH 3 , H 2 O CO 2 wie<strong>der</strong>verwertet)Produkte: Na 2 CO 3 , (NaHCO 3 ) <strong>und</strong> CaCl 2b) Trona-VerfahrenEdukte: Roh-Trona (aus Bergwerken)Kreiskauf: Schwachlauge, MutterlaugeProdukt: Na 2 CO 329
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab45.) Was versteht man unter dem Begriff MetallUnter dem Begriff Metall sind „Elemente“ mitGuter Verformbarkeit (elastisch, plastisch)3. METALLURGIEhoher elektrischer Leitfähigkeit, abnehmend mit Temperaturerhöhung(Metalle sind Leiter 1.Klasse Ag -> Cu - > Au)hoher Wärmeleitfähigkeitmetallischem Glanz (Sichtbares Licht wir absorbiert <strong>und</strong> reemittiert außer Cu & Au <strong>und</strong> einigeLegierungen)Metalle sind in Wasser unlöslich. (Metallionen sind löslich)Bilden mit an<strong>der</strong>en Metallen Legierungen Manche Metalle sind ferromag<strong>net</strong>isch (Fe, Ni, Co, Gd, NFeB, SmCo 5 )Metalle brennenSchmelzpunkt: Hg (-39 °C) <strong>und</strong> W (3422 °C)Dichte (Li = 0,5 g/cm³ – Os = 22 g/cm³• metallischer Charakter nimmt im PSE nach links unten zu• Eigenschaften durch Valenzelektronen (Elektronengas, Energiebandmodell) sowie Kristallstruktur(Gefüge & Gefügebaufehler) bedingt.• nur s-Metalle -> rein metallische Bindungen• d-Metallen haben stark gerichtete Bindungen -> nicht mehr rein metallische Bindung son<strong>der</strong>n schonstark kovalent.46.) Nenne Sie die wesentlichen Auswahlkriterien für die Metallgewinnung <strong>und</strong> beschreiben Sie die formalenVoraussetzungen für die Reduktion eines Oxides.a) Welches Gewinnungsverfahren wird angewandt:hängt von ΔG(p,T) seiner Verbindungen ab. am WICHTIGSTEN (je negativer ΔG desto mehr Emuss reingesteckt werden.gefor<strong>der</strong>te DurchsatzleistungEnergieverfügbarkeit <strong>und</strong> Preis des ReduktionmittelsReinheit des zu gewinnenden Metallschemische <strong>und</strong> physikalische Beschaffenheit des Ausgangsstoffesgewünschte Nebenprodukte (z.B.: Tantal, Au bei Cu-Gewinnung)AbfallverwertungUmweltverträglichkeitb) ΔG des Produkts < ΔG des Edukts -> Reaktion findet nur dann stattM + ½ O ↔ MO ΔG 1 < 0R + ½ O ↔ RO ΔG 2 < 0 ΔG 2 < ΔG 1 R (Reduktionsmittel)MO + R ↔ M + RO ΔG < 0 (ΔG 2 - ΔG 1 )30
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab47.) Pyrometallurgische Reduktionsverfahren in <strong>der</strong> Metallgewinnung:Beschreibung <strong>der</strong> 5 Gr<strong>und</strong>typen (C, H2, Metallothermie, thermische Zersetzung, Röstreduktion) anhand vonBeispielen aus <strong>der</strong> industriellen Praxis; ReduktionsgleichungM + ½ O ↔ MO ΔG 1 < 0R + ½ O ↔ RO ΔG 2 < 0 ΔG 2 < ΔG 1 R (Reduktionsmittel)MO + R ↔ M + RO ΔG < 0 (ΔG 2 - ΔG 1 )a) Carbothermische ReduktionIndirekt: MO + CO ↔ M + CO 2 bis 900 °C (exotherm)Direkt: MO + C ↔ M + CO (endotherm)Boudouard-Gleichgewicht: CO 2 + C ↔ 2 COüber 900 °C wird CO 2 wie<strong>der</strong> zu CO reduziert.• Reduktionskraft des Kohlenstoffs steigt unter Vakuum.• mit manchen Metallen Carbidbildung (z.B.: Ti, V, W,…)• Chloride <strong>und</strong> Sulfide sind nicht reduzierbar• Durchführung in Schüttgutreaktoren, Schachtöfen, Drehrohröfen.z.B. Fe, Sn, Zn, As, Sb, Si,…b) Reduktion mit H 2Reduktionskraft abhängig von Feuchte (Reinheit), d.h. Verhältnis pH 2 zu pH 2 O. Je trockener desto besser.Nur bis 1450 °C - Cr 2 O 3 (trockenerer H 2 geht nicht)Ausgeführt in Drehrohröfen, Wirbelschicht,...z.B. Mo, W, Re, Ni, Fe, CoMO + H 2 → M + H 2 O31MCl 2 + H 2 → M + 2 HClc) MetallothermieFür schwer reduzierbare, kohlenstofffreie Son<strong>der</strong>metalle <strong>und</strong> Stahlveredler angewandt.Verdrängungsreaktion, bei <strong>der</strong> das Oxid/Halogenid durch ein unedleres Metall reduziert wird.Nachteil: Vakuum o<strong>der</strong> Schutzgas nötig, teures reduziertes Metall.z.B. Ti, Zr, Hf, UTiCl 4 + 2 Mg → Ti + 2 MgCl 2 (Kroll-Prozess)d) thermische ZersetzungBildung des Oxids ist nur wenn ΔG < 0. Me + O 2 → MeOΔG > 0, -> <strong>der</strong> Zersetzungsdruck höher als <strong>der</strong> Standarddruck -> Oxid zerfällt.Praktisch nur für Pt-Metalle + Hg + (Ag = nicht wirtschaftlich)Pt, Rh, Ir, Pd: 3 (NH 4 ) 2 MeCl 6 → Me + 2 NH 4 Cl + 16 HCl + 2 N 2 (330°C, N 2 )Hg: 2 HgO → Hg + O 2 2 HgS + O 2 → Hg + SO 2Ag: 2 Ag 2 O 2 Ag + O 2e) RöstreduktionMetalle die als sulfidische Erze vorkommen.Sulfid teils zu Oxid geröstet -> Oxid reagiert mit nicht umgesetztem Sulfid zum Rohmetall.Reduktionmittel: sulfidischer Schwefel S -> SO 2 oxidiert wird.z.B. Cu, Pb, Pd3 MeS + 3 O 2 → MeS + 2 MeO + 2 SO 2 MeS + 2 MeO → 3 Me + SO
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab48.) Richardson-Ellingham Diagramm: Erklären Sie an einer schematischen Zeichnung die wesentlichenZusammenhänge (ΔG, T) <strong>und</strong> erörtern Sie die Voraussetzung für eine carbothermische Reduktion.• Das Diagramm stellt eine Temperaturabhängigkeit <strong>der</strong> freien Reaktionsenthalpie dar.annähernd lineare Zusammenhänge erkennbar ΔG = ΔH - TΔS• Zersetzungsspannung zeigt, dass ALLE Elemente elektrochemisch herstellbar sind.ΔG° < 0; Oxide stabiler, steigende Temperatur -> Affinität zum nimmt Metall zu.Ausnahme: KohlenstoffVoraussetzung für die carbothermische Reduktion:• Affinität von C zu O nimmt zu• ΔG des Produkts < ΔG des Edukts -> Reaktion findet nur dann statt• ΔG° von 2 C + CO 2 ↔ 2 CO (Boudouard) < ΔG° Metalloxids• Metalloxide dessen Metall keine Carbide bildetz.B. Fe, Sn, Zn, As,…MO + CO → M + CO 2MO + C → M + CO• Mg könnte theoretisch auch reduziert werden• Es können auch Sulfide <strong>und</strong> Chloride in das Diagramm eingetragen werden.32
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab49.) Das Prinzip <strong>der</strong> carbothermischen Reduktion; direkte & indirekte Reduktion; Grenzen p,Ta) Carbothermische ReduktionIndirekt: MO + CO ↔ M + CO 2 bis 900 °C (exotherm)Direkt: MO + C ↔ M + CO (endotherm)Boudouard-Gleichgewicht: CO 2 + C ↔ 2 COüber 900 °C wird CO 2 wie<strong>der</strong> zu CO reduziert.• Reduktionskraft des Kohlenstoffs steigt unter Vakuum.• mit manchen Metallen Carbide-Bildung (z.B.: Ti, V, W,…)• Chloride <strong>und</strong> Sulfide sind nicht reduzierbar• Durchführung in Schüttgutreaktoren, Schachtöfen, Drehrohröfen.Beispiele: Fe, Sn, Zn, As, Sb, Si,…50.) Hydro- <strong>und</strong> elektrometallurgische Reduktionsverfahren in <strong>der</strong> Metallgewinnung mit Beispielen. Grenzen<strong>der</strong> Reduktion aus wässrigen Lösungen aus <strong>der</strong> Sicht <strong>der</strong> elektrochemischen Spannungsreihe <strong>und</strong>Reaktionski<strong>net</strong>ik (Überspannungen)1. Zementation: unedleres Metall (M1) verdrängt das edlere Metall aus <strong>der</strong> Lösung. E 0 von M 1 < M 2z.B. Zementation von Cu aus schwefelsaurer Lösung mit EisenblechschrottCu 2+ + Fe → Cu + Fe 2+2. Druckreduktion mit Wasserstoffhöhere pH-Werte <strong>und</strong> hoher H 2 -Druck steigern die Reduktionskraft des Wasserstoffs.z.B. Fällung aus ammoniakalischen Lösungen (Ni/Co-Trennung); Ni: 200°C, 20bar3. ReduktionselektrolyseDie an <strong>der</strong> Kathode zugeführten Elektronen reduzieren das Metall-Ion nachM z+ + z e - → M Den Zusammenhang liefert das Faraday’sche Gesetz.Für Leichtmetalle ist die elektrochemische Äquivalentmasse sehr nie<strong>der</strong>, was in einem hohenspezifischen Stromverbrauch resultiert. Die Zellspannung besteht dabei aus Zersetzungsspannung,Überspannung <strong>und</strong> Spannungsabfall durch den Badwi<strong>der</strong>stand, wobei Zersetzungsspannung von <strong>der</strong>Stromdichte unabhängig ist, Überspannung <strong>und</strong> Badwi<strong>der</strong>stand mit steigen<strong>der</strong> Stromdichte steigen3.1. SchmelzflusselektrolyseBei Standardpotentialen größer als -1V; vor allem Chlorid- <strong>und</strong> Fluoridschmelzen in Verwendung;wichtig ist hohe Leitfähigkeit <strong>der</strong> Schmelzen, Absenkung des m.p. da meist Arbeitstemperatur über m.p.des Metalls, auch muss <strong>der</strong> Dichteunterschied zur Abtrennung groß genug sein. Meist C-Anoden, daSenkung <strong>der</strong> Zersetzungsspannung durch teilweise Reduktion des Oxides <strong>und</strong> gute2 Elektroden. An <strong>der</strong> Kathode bildet sich das Metall, an <strong>der</strong> Anode wird Sauerstoff abgeschieden.Beispiele: Al, Na, Mg3.2. Elektrolyse in wässrigen Lösungentheoretisch nur für Metalle anwendbar, <strong>der</strong>en Standardpotential edler als -0,41V ist, ansonstenentsteht H 2 . Reaktion ist pH abhängig (Folien) bis max. – 0,824 (pH 14). Einige Metalle zeigen jedoch einehohe Überspannung für Wasserstoff, sodass das ganze bis auf ca. -0,8V verschiebbar ist. WässrigeReduktionselektrolysen verwenden Sulfat-Elektrolyten <strong>und</strong> Pb-Anoden, o<strong>der</strong> Ti-Elektroden mitEdelmetallbeschichtung zur Herabsetzung <strong>der</strong> Anodenüberspannung.33
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab51.) Die Reduktion mit H 2 : Grenzen für die pyro- <strong>und</strong> hydrometallurgische Reduktion.Pyrometallurgisch: MO + H 2 ↔ H 2 O + MDer Feuchtegrad ( 2 / 2) ist für die Reduktion wesentlich. Je trockener das Gas desto größer dieReduktionswirkung, bis 1450 °C Cr 2 O 3 (trockener geht es nicht)Wassergehalt wird in Form des Taupunkts angegeben.Voraussetzung: ΔG° H 2 O < ΔG° Oxid (Siehe auch Richardson-Ellingham Diagramm)HydrometallurgischHöhere pH-Werte <strong>und</strong> hoher H 2 -Druck steigern die Reduktionskraft des Wasserstoffs.Reduktion in wässrige-Lösung nur für Metalle bis Zn -> sonst H 2 -Bildungab einer Zersetzungsspannung von -0,41 V H 2 thermodynamisch stabil 2 H + + 2 e - → H 2tatsächlich aber durch Überspannung bis -0,8 V möglich.52.) Reinigungsverfahren für Rohmetalle: Beschreiben Sie die Verfahren anhand von Beispielen aus <strong>der</strong>industriellen Praxis.a) Selektive Oxidation <strong>der</strong> MetallschmelzeFür Stahlindustrie <strong>und</strong> pyrometallurgische Verarbeitung <strong>der</strong> Gebrauchtmetalle von Bedeutung. O 2 in Formvon Luft, Reinst-O 2 o<strong>der</strong> festen O 2 -Trägern (z.B. NaNO 3 ) eingebracht. Oxidationsprodukte sind gasförmig,o<strong>der</strong> bilden feste/flüssige Schlacken.Auch selektives Chlorieren (z.B. für Au) verwendet.Rohmetall Entfernte Elemente Oxidationsmittel ReaktorFe C, Si, Mn (P) O2, Spühlgas AusblaskonverterCu S, Fe, Zn, Co, Sn, Pb Luft Flammofen, Konverterb) FällungsreaktionMetallschmelze (enthält gelöst S, O) Zusatzstoffe: binden O bzw. SRohmetall Zusatz Entferntes ElementFe CaO, CaC 2 , CaSi, Mg Mn SFe Al, Mg, FeSi, CaSi OFür Desoxidation <strong>und</strong> Entschwefelung von Stählen. Dabei entstehen fein disperse Sulfide/Oxide, welcheverschlackt werden.Auch zur Fällung in intermetallischen Phasen.z.B. As, Sb-Entfernung aus Sn mit Al → AlSb, AlAsc) EntgasungArbeiten im Vakuum o<strong>der</strong> unter Schutzgas (Ar, N); vor allem Entfernung von H 2 , beim Sintern (Wolfram),Umschmelzen im Lichtbogen (Titan) o<strong>der</strong> Kupferraffination (SO 2 Entfernung)d) Seigerntemperaturabhängiger Entmischungsvorgänge um Metallschmelzen unterschiedlicher Dichte bzw.Erstarrung zu erhalten. Auch fraktioniertes Schmelzen möglich.z.B. Entfernung Fe (Smp 1538 °C) aus Roh-Sn (Smp. 232 °C), Entfernung Ag aus Roh-Pb34
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabe) Elektrolytische RaffinationAnode besteht aus Rohmetall -> Reinmetall wird selektiv abgeschieden.Edlere Metalle werden nicht gelöst <strong>und</strong> fallen als Anodenschlamm an, unedlere gehen in Lösung o<strong>der</strong> fallenals Verbindungen aus.Konzentrieren im Elektrolyten durch Elektrolytaufbereitung verhin<strong>der</strong>t.Rohmetall Elektrolyt entfernte ElementeCu Schwefelsaure Lösung Se, Te, Fe, Co, Zn, Sn, Pb,f) Destillation- Dampfdrücke <strong>der</strong> zu trennenden Metalle groß:einfache Destillation (Entfernung von Mg <strong>und</strong> MgCl 2 bei Roh-Titan)- Dampfdrücke klein:fraktionierte Destillation (Reinigung von Zn: Entfernung von Cd, Pb, Fe, Sn)Durch Vakuum bessere Verdampfungsleistung (z.B. Zn hat m.p. 906 °C)g) Stahlentgasungdurch das Vakuum entweichen die gelösten Gase N <strong>und</strong> H <strong>und</strong> CO wird freigesetzt (Aufkochen)die Konzentration des gelösten Gases ist proportional <strong>der</strong> Wurzel des Gasdrucks in <strong>der</strong> Atmosphäreh) ZonenreinigungArt des Umkristallisierens. Reinigung durch das Wan<strong>der</strong>n einer Schmelzzone. Das Rohmetall wird mitInduktionsspulen spontan aufgeschmolzen, die Verunreinigungen bleiben in Schmelze.z.B. hochreines W, Halbleitermaterialien wie Si (7 neuner rein), In, Ge (9 neuner rein),…i) Elektro-Schlacke-UmschmelzverfahrenCaF 2 -hältiges Schlackenbad erfolgt Entschwefelung <strong>und</strong> Entfernung von oxydischen Verunreinigungennur für Qualitäts- <strong>und</strong> Edelstählej) LichtbogenumschmelzenDas zu reinigende Metall wird im Vakuum im Abschmelzlichtbogen von Verunreinigungen (Gasen) befreit.3 gr<strong>und</strong>legende Ziele: S raus durch Schlacke, Oxide weg, Gerichtete Schlackez.B. Entfernung von Rest-H 2 aus Tik) Chemische Transportreaktionen (Van Arkel –De Boer Verfahren)Bildung flüchtiger Iodide/Carbonyle bei geringen Temperaturen + Zersetzung bei hohen Temperaturen,Verunreinigungen reagieren nicht mit dem Iodz.B. Reinigung von Ni von Ti <strong>und</strong> Co (Mond-Verfahren)auf <strong>der</strong> kalten Seite:2 I 2 (g) + Ti (s) TiI 4 (g)wan<strong>der</strong>n durch Diffusion zur warmen Seite:TiI 4 (g) Ti (s) + 2 I 2 (g)35
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab53.) Der Hochofenprozess zur Eisengewinnung: Erklären Sie die Wirkungsweise (mit schematischer Zeichnung),Ausgangsprodukte, Endprodukte, Temperaturverteilung• besteht aus einem Stahlpanzer mit feuerfestem Material, Gegenstromreaktor in Schachtbauweise• 20-40 m hoch, mit Übergicht bis zu 100 m.• von außen gekühlt, mit Sensoren versehen um Verän<strong>der</strong>ung sofort zu bemerken.Edukte:- Fein bzw. Feinsterze: müssen zu Stücken geformt werden, z.B. Drehteller zu Pellets, brennen, dannverschiffen (geschieht an <strong>der</strong> Lagerstätte) – Sinn = Wirtschaftlichkeit des Hochofens- Koks: wichtige Kenngrößen: Festigkeit (45 m Höhe aushalten), Feuchtigkeitsgehalt, Schwefelgehalt- Luft: mit 3-4 Win<strong>der</strong>hitzter auf 1000-1350 °C geheizt, Druck bei 3-5 bar mit ca. 20-200 m/sProdukte:- flüssiges Roheisen (Fe + C (4,5-4,7%)) -> Stahlverarbeitung- Schlacke (FeO, MnO, Al 2 O 3 , SiO 2 CaO, …) – durch Schlackenbil<strong>der</strong> begünstigt. (nimmt dieVerunreinigung auf) -> Baustoff- Gichtgas (CO, CO 2 , H 2, etwas N 2 ) -> BrennstoffReaktionen: (links CO rechts H 2 )3 Fe 2 O 3 + CO → 2 Fe 3 O 4 + CO 2 (Hämatit -> Mag<strong>net</strong>it) 3 Fe 2 O 3 + H 2 → 2 Fe 3 O 4 + H 2 OFe 3 O 4 + CO → 3 FeO + CO 2 (Mag<strong>net</strong>it - > Wüstit) Fe 3 O 4 + H 2 → 3 FeO + H 2 OFeO + CO → Fe + CO 2 (Wüstit -> elemt. Fe) FeO + H 2 → Fe + H 2 O36
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabBoudouard-Gleichgewicht:C + CO 2 ↔ 2 CO> 1000 °C: aus CO 2 + Koks entsteht CO, es sieht so aus als würde <strong>der</strong> feste Kohlenstoff das Erz direktreduzieren.Direkten Reduktion FeO + C → Fe + CO (endotherm)< 1000 °C: das Gleichgewicht stellt sich nicht mehr ein, d.h. das CO 2 wird nicht mehr zu CO reduziert. Das imÜberschuss entstandene CO reduziert das Eisenoxid→indirekte Reduktion (exotherm).- kurze Kontaktzeiten -> keine vollständige Einstellung <strong>der</strong> Gleichgewichte.Zusammensetzung des Feststoffes <strong>und</strong> des Gases wird durch die Ki<strong>net</strong>ik bestimmt.- Erzstück von außen nach innen reduziert, wodurch ein poröser Eisenschwamm entsteht.- Eisenschwamm (m.p. ~1540 °C) kohlt auf, erweicht (Eutektikum: 1147 °C), schmilzt <strong>und</strong>tropft durch die Koksschüttung. (3 Fe + 2 CO → Fe 3 C + CO 2 )- Kohlenstoff bei 2200-2300 °C zu CO 2 verbrannt welches sofort zum CO reagiertRoheisen (Fe, C, Mn, Si) besitzt ca. 1450 °CIm Kokskegel stellt sich permanent das Boudouard-Gleichgewicht ein = Direkte Reduktion. CO steigt dannauf <strong>und</strong> wirkt im Schaft dann als indirekte Oxidation.Koksfenster: stückweise Aufschichtung von Koks <strong>und</strong> Erz -> kommt zur Aufkohlung -> erreicht dannEutektikumTIPP: Bei <strong>der</strong> Prüfung reicht eine Kombination <strong>der</strong> 2 Bil<strong>der</strong>37
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab54.) Eisen: Vergleichen Sie den Hochofen mit alternativen Reduktionsverfahren: Prinzipien, Vorteile, NachteileReduktion im Hochofen hat einige Nachteile:- hohe Investitionskosten für Kokerei, Sinteranlagen <strong>und</strong> Hochofen- günstige Wirtschaftlichkeit nur für 5000 t/J Roheisen- große Abgasmengen- geeig<strong>net</strong>er Koks ist nur aus hochwertiger Kohle zu erhalten- höhere Anfor<strong>der</strong>ungen an den MöllerDaher alternative Verfahren mit folgenden Merkmalen:- günstige Wirtschaftlichkeit bei relativ kleiner Produktkapazität- vergleichsweise geringe Investitionskosten- Flexibilität in Bezug auf die Energieträger <strong>und</strong> Nutzung günstiger Reduktionsmittel- direkter Einsatz von Feinerz (keine Pelletierung)- direkter Anfall von Eisenschwamm bzw. Rohstahl (größter Vorteil weil KEIN bzw. wenigKohlenstoffaufnahme)a) DirektreduktionDirektreduktion: hier fällt Eisenschwamm an, mehr als 50 industriell eingesetzte Verfahren- Gasreduktion – meist Methan (Schachtofen, Wirbelschicht)Reaktionsgas (CO <strong>und</strong> H 2 2:3) reduziert hauptsächlich H 2 - z.B. Midrex-Verfahren- Feststoffreduktion (z.B. Braunkohle im Drehrohrofen)b) SchmelzreduktionSchmelzreduktion: erzeugt ein flüssiges Vorprodukt für die Stahlerzeugung, <strong>der</strong>zeit nur eingroßtechnisches Verfahren: COREX (österr. Verfahren)Beide Verfahren arbeiten ohne hochwertigen Koks. = billige Kohle55.) Corex-Verfahren zur Gewinnung von Roheisen: Ausgangsmaterialien, Verfahrensprinzip, Beschreibung<strong>der</strong> Anlage; Vorteile gegenüber HochofenEdukte: Eisenerz, (nicht verkoksbare) KohlePrinzip: Zweistufiges Schmelzreduktionsverfahren in getrennten Apparaten (Vermeidung <strong>der</strong> Kohäsivzone)• Reduktion des Erzes zu Eisenschwamm mit min<strong>der</strong>wertiger Kohle z.B. Braunkohle• Einschmelzen mit Reduktionsgasen (CO <strong>und</strong> H 2 )Ablauf:• Nicht verkoksbare Kohle wird dem Schmelzvergaser direkt zugesetzt.• Bei T = 1100-1150 °C (oben) wird die Kohle vergast, wobei unerwünschte Nebenprodukte wie Teer,Phenole o<strong>der</strong> polycyclische KWs in ihre Bestandteile (CO 2 , CO, H2) zersetzt werden <strong>und</strong> so die Umweltnicht belasten• O 2 wird in Schmelzvergaser eingeblasen -> hochwertiges Reduktionsgas mit 95% CO + H 2 <strong>und</strong> 3% CO 2entsteht. Die Temperatur liegt im Wirbelbett bei 1600 bis 1700 °C.• Gas wird auf 800-850 °C abgekühlt, in einem Zyklon entstaubt <strong>und</strong> dem Reduktionsschacht zugeführt woeine Reduktion des Eisenoxids erfolgt.• Das Eisen wird dann dem Schmelzvergaser über Schneckenför<strong>der</strong>ung zugesetzt• Abguss ähnlich wie beim Hochofen (1490 °C)• austretendes Topgas (übriges Reaktionsgas) -> gewaschen -> Verwendung: Heizen & Export38
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabVorteile:- Erz kann ohne Stückigmachen <strong>und</strong> Sinterung/Pelettierung eingesetzt werden- Gichtgas kann zur Direktreduktion (nach CO 2 -Entfernung) o<strong>der</strong> zur Gewinnung elektrischer Energieverwendet werden.- Keine Nebenprodukte wie Teer, Phenole, polycyclische KWs- Wirtschaftlich bei kleinen Mengen- Geringe Investitionskosten56.) Stahlerzeugungsverfahren: Prinzip <strong>der</strong> Verfahren; Entwicklung von <strong>der</strong> Bessemer-Birne zum LD-Konverter.ElektrostahlStahlerzeugung -> Herausfrischen (d.h. mit Luft Ausblasen) <strong>der</strong> Beimengungen (C, Si, Mn, P, S) aus demRoheisen <strong>und</strong> anschließendem Einstellen <strong>der</strong> Legierungszusammensetzung.a) Bessemer- <strong>und</strong> Thomas-Verfahren (veraltet):„Birne“ mit Roheisen gefüllt, Luft von unten geblasen.Bessemer-Birne: saure SiO 2 -Auskleidung (sauer, für P-armes Roheisen)Thomasbirne: basische Dolomit-Auskleidung (basisch, für P-reiches Roheisen)CaO.SiO 2 , CaO.P 2 O 5 <strong>und</strong> MnO bilden Schlacke. Exothermie <strong>der</strong> Oxidation genutzt. Kommen über den m.p.vom Eisen. 1-8 t /30 minC + O → COSi + O 2 + CaO → 2CaO*SiO 2Mn + O → [MnO]2 P + 5/2 O 2 + 3 CaO → 3 CaO * P 2 O 5S + CaO → CaS + Ob) Siemens-Martin-Ofen (=Herdfrischverfahren) (veraltet):kippbare beheizte Wannen (50 – 900t), von außen beheizt, kalte Luft vorgewärmt (1100-1300 °C) <strong>und</strong>dann eingeblasen, basisch o<strong>der</strong> sauer ausgekleidetAnwendung: für Roheisen, Eisenerz <strong>und</strong> Schrottweniger für die Stahlherstellung als zum Einschmelzen <strong>der</strong> SchrotteOxidationsmittel: FlämmgaseZeit: 8 hc) Sauerstoffaufblas-Konverter LD-Verfahren (fast ausschließe verwendet):Roheisen + Schrott <strong>und</strong> Kalk in einem Tiegel, einblasen von O 2 mit wassergekühlten Lanze,Temperatur 1350 °C von 1750 °C lokal auf bis zu 2000-2400 °C (über Zusatz von Kühlschrottgehaltkontrolliert)C-Gehalt bis auf 0.04-0.1% herausgefrischt, ca 1% Fe verdampft, anschließend Konverter umgelegt ->Stahl in Pfanne überführtBlasezeit: 12-20 min.Tiegel: früher offen heute geschlossen, Ausmauerung Dolomit o. Magnesit (bis 400 t), nur 15% gefülltExothermie kann so groß werden -> dass Kühlung erfor<strong>der</strong>lichLDAC: mit O 2 Kalkstaub dazu -> für P-reiches EisenThomasschlacke (20-25% P 2 O 5 ) abgeschlackt, Zweitschlacke (25-30% FeO) rückgeführt39
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabd) Elektrolichtbogenofen:Hauptsächlich als Einschmelzaggreagt für Schrotte bzw. Eisen-Schwamm, erzeugt hochwertigen StahlGeheizt über 3 Graphitelektroden, Temperaturen bis 8000 °C (Lichtbogen).ca. 150 Schmelzen durchgeführt dann Ofen neu ausgekleidetZeit: 0,8-2,5 h Leistung: bis 1000 kVA/t 150-300 V100% fester EinsatzFrischen ist durch eine Einblaselanze möglich.a) Induktionsofen:Einschmelzen von Schrott im Tiegel über Spule (über Wechselstromfeld wird Wärme durchWirbelströme erzeugt)gute Homogenisierung <strong>der</strong> Schmelze. Frequenzbereich (niedrig, mittel, hoch)57.) Erklären Sie das LD-Verfahren. Prinzip, Verfahrensablauf, Interpretation einer typischen Abbrandkurve.Roheisen + Schrott <strong>und</strong> Kalk in einem Tiegel, einblasen von O 2 mit wassergekühlten Lanze,Temperatur 1350 °C von 1750 °C lokal auf bis zu 2000-2400 °C (über Kühlschrott-Zusatz kontrolliert)C-Gehalt auf 0.04-0.1% herausgefrischt, ca. 1% Fe verdampft,Anschließend Konverter umgelegt -> Stahl in Pfanne überführtBlasezeit: 12-20 min.Tiegel: früher offen heute geschlossen, Ausmauerung Dolomit o. Magnesit (bis 400 t), nur 15% gefülltExothermie kann so groß werden -> dass Kühlung erfor<strong>der</strong>lichLDAC: mit O 2 Kalkstaub dazu -> für P-reiches EisenThomasschlacke (20-25% P 2 O 5 ) abgeschlackt, Zweitschlacke (25-30% FeO) rückgeführtAbbrandkurve:Zusammenhang zw. Schmelze + Blasezeitunedle Elemente (Si, Mn,…) brennenschneller ab als C.S <strong>und</strong> P durch Schlackebildner geb<strong>und</strong>en.Prozess zu Ende, wenn C gewünschteKonzentration erreicht hatAblauf40
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab58.) Stahlnachbehandlung: Erläutern Sie die Begriffe Desoxidation, Entschwefelung, Entgasung (Prinzip,Durchführung)Nachbehandlungen um jeweilige Reinheit bzw. Zusammensetzung zu erhalten.In Pfannen (Stahltiegel mit basischer Auskleidung; Fassungsvermögen: 300t) durchgeführta) Desoxidation: Al o<strong>der</strong> Ferrosilicium senken den O 2 -Gehalt auf 100 ppm (FeSi) bzw. 10 ppm (Al). DasAbscheiden <strong>der</strong> Oxide wird durch Zugabe von Ca o<strong>der</strong> CaO beschleunigt. Weiterverarbeitung unterLuftausschluss um Reoxidation zu verhin<strong>der</strong>n z.B. CaO-Schlacke (Entschwefelt auch noch)b) EntschwefelungCaC 2 o. CaO für Entschwefelung auf < 0.0001%, S-Ausscheidungen = Zähigkeitsvermin<strong>der</strong>nd.c) Entgasung im Vakuum C + O 2 -> CO, H 2 entfernt.59.) Fe-C-Diagramm (Zeichnung <strong>und</strong> kurze Phasenerklärung); Bedeutung des Eutektikums für die Eisen- <strong>und</strong>StahlgewinnungEutektikum: γ-Fe + C ↔ Schmelze 3 Phasen im Gleichgewicht.2 Eutektika Fe/C <strong>und</strong> Fe/Fe 3 C (1147 °C 4,3% )Eutektoid: γ-Fe ↔ α-Fe + Fe3C (723 °C, 0,8%)Peritektikum: γ-Fe ↔ δ-Fe + Schmelze (1493 °C, 0,2%)41
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabSchmelze: bezeich<strong>net</strong> die flüssige Fe-C-Legierung. Oberhalb <strong>der</strong> Liquiduslinie ist die gesamte Legierungflüssig, zwischen Liquidus- <strong>und</strong> Soliduslinie nur zum Teil.δ-Ferrit: liegt zwischen 1392 °C <strong>und</strong> 1536 °C vor; Mischkristallγ-Fe, Austenit: max. Löslichkeit von C von ca. 2.06%, Mischkristallα-Ferrit: liegt bei < 911 °C vor, MischkristallZementit: stöchiometrische Verbindung Fe 3 C 1320 °C, 6,67%Perlit: lamellar angeord<strong>net</strong>es Gefüge, Phasengemisch aus Ferrit <strong>und</strong> ZementitLedeburit: eutektisches Gefüge; Phasengemisch aus Austenit <strong>und</strong> ZemetitStahl = < 2.06% CKühlt man eine Fe-C-Schmelze mit < 2.06% C ab, so erhält man Austenit, welcher gut verformbar ist.Kühlt man eine Fe-C-Schmelze mit > 2.06% C-Gehalt ab so erhält man zum Teil eutektoidischeZusammensetzung, es entsteht brüchiges Gusseisen. Welches aus mehreren Phasen besteht (Ledeburit).(~Bedeutung des Eutektikums)Bedeutung des Eutektikumses kann <strong>der</strong> Eisenschwamm aufgekohlt werden bis zum Eutektikum (4,3% Fe 3 C) dadurch aufschmelzenbei 1147 statt 1536 °C60.) Aluminiumgewinnung: Ausgangsmaterialien, Bayer-Verfahren (Produkte, Reaktionsbedingungen);Schmelzflusselektrolyse (Beschreibung <strong>der</strong> Elektrolysezellen)42
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabBayer-Verfahren: Auflösung von Bauxit (Al(OH) 3 , AlO(OH), Eisenoxide, Kaolinit) mit NaOH unter Bildungvon Na-Aluminat:AlO(OH) + NaOH + H 2 O → Na[Al(OH) 4 ]240-280 °C, 40-80 bar, 3 h Autoklav, 10 min Strömungsrohrnach Abfiltrieren des Rotschlamms (Fe, Si, Ti) -> Filtrat verdünnt, abgekühlt <strong>und</strong> mit Al-Hydroxidangeimpft -> Ausfällung von Al(OH) 3 -> Filtration + waschen -> Entwässerung des Hydroxids(Drehrohröfen, Wirbelschichtaggregat (ca. 1100 °C)) 2 Al(OH) 3 → Al 2 O 3 + 3 H 2 O(Rotschlamms noch 20-30% an nicht aufgeschlossenem Al)Na[Al(OH) 4 ] → Al(OH) 3 + NaOH -> Natronlauge wird rückgeführt → Kreislaufprozess!Schmelzflusselektrolyse (Hall-Heroult)2-8% Al 2 O 3 in Kryolithschmelze (Na 3 [AlF 6 ]) gelöst (Dichte 2,1 g/cm³), 940-980 °C, Gleichstrom, 4-5 VC-Kathode (unten) scheidet sich flüssiges Al (Dichte 2,3 g/cm³) ab <strong>und</strong> wird abgesaugt.C-Anode wird durch Oxidation zu CO/CO 2 verbraucht (0,5 kg/kg Al).Zusätze von AlF 3 , CaF senken die eutektische Temperatur, LiF erhöht Leitfähigkeit <strong>und</strong> Energieausbeute.Elektrolysezelle: bewegliche Elektroden (Sö<strong>der</strong>berg-Elektrode o<strong>der</strong> gebrannter KalkStromausbeute: 85-95% Lebensdauer: 4 Jahre Abgase: HF (ca. 40% des F)AnodeKathodeAl 2 O 3 → 2 Al 3+ + 3 O 2-Al 3+ +3 e - → Al3 O 2- → 3/2 O 2 + 6 e -C + O 2 → CO 2C + CO 2 → 2 CO61.) Das Röstreaktionsverfahren zur Gewinnung von Kupfer; Prinzip des Schwebeschmelzens <strong>und</strong> Verblasensim Konverter.Prinzip: Cu-Sulfide über Flotation angereichert (auf 20-30% Cu) Kupferkies (CuFeS 2 ) -> chemische Energie gespeichert -> wird benutzt um das sulfidische Konzentrat(CuFeS 2 , Cu 2 S, FeS 2 ) in einer Teilröstung zu einer „Steinphase“ o<strong>der</strong> „Matte“ <strong>und</strong> diesauerstoffhaltigen Begleitelemente zu einer Schlackenphase aufzuschmelzen „Schwebeschmelzen“ exotherme Teilröstprozess für den endothermen Schmelzprozess genutzt Rösten mit Luft, beim Erschmelzen erfolgt Vorabtrennung des Eisens (höhere Affinität zum Sauerstoff–> selektive Oxidation), geht zum Teil in die SchlackeOutokumpu-Ofen:Erzkonzentrat getrock<strong>net</strong> (= keine zusätzliche Energie), vorgeheizte Luft mit Erz in Schacht eingeblasen ->treten mit starken Turbulenzen aus -> aber es entsteht gleichmäßige abwärts gerichtete Strömung.Während des kontinuierlichen Reaktionsablaufs liegen die schmelzflüssigen Teilchen als disperse Phase„schwebend“ in <strong>der</strong> heißen Gasphase als Dispersionmittel vor -> SchwebeschmelzenRöstreaktion: 2 CuFeS 2 + 13/2 O 2 → 2 CuO + Fe 2 O 3 + 4 SO 2 ΔH=-971 kJ43
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabKonzentrationen wichtig weil sonst Ofensau -> Ofen muss bergmännisch abgebaut werdenVerzettelung: Metalle die in alle 3 Phasen gehen: Stein (Matte), Schlacke, AbgaseVerblasen im Trommelkonverter: Luft seitlich eingeblasen, Blasen in die Steinphase (Cu, Rest-Fe, S, Au, Pt-Metalle) weil hier die Reaktionswärme entsteht.Konverter drehbar -> Steinphase immer weniger & Schlacke immer mehr -> zweistufig verblasen.1. Stufe: Eisen weitgehend entfernt (Schlackenblasen):Cu 2 O + FeS → Cu 2 S + FeO (Stein -> Spurstein)2 FeS + 3 O 2 -> 2 FeO + 2 SO 2 | 2 FeO + SiO 2 -> Fe 2 SiO 42. Stufe: Spurstein - Cu 2 S (80% Cu) zu Kupfer verblasen (Garblasen - Schwefel als Reduktionsmittel)Cu 2 S + 2 Cu 2 O -> 6 Cu + SO 2 -> flüssiges KupferGarblasen = eigentlich Röstreaktion (durch Optimierung exotherme betriebsweise möglich)62.) Die pyro- <strong>und</strong> hydrometallurgische Raffination des Rohkupfers (kurze Beschreibung <strong>der</strong> Prozessstufen)a) pyrometallurgische Raffination (in 3 Schritten)1. Feuerraffination: (selektive Oxidation)Wichtig um Elektrolyse zu entlasten, erfolgt in Flammöfen o<strong>der</strong> Trommelöfen,Begleitelemente werden nach folgen<strong>der</strong> Gleichung entfernt: Cu 2 O + Me → 2 Cu + MeOFe, Co, Zn, Sn, Pb verschlacken, Ni, As, Sb, Bi verzetteln, Se, Te bleiben im Kupfer.- Oxidationsperiode: „Braten“, Luft eingeblasen & Schwefel auf 50 ppm gedrückt (Überoxidation),Inkaufnahme von Cu 2 O-Bildung- Reduktionsperiode: „Polen“, Holzstämme (unter Kupferschmelze gedrückt) -> entweichen<strong>der</strong>Wasserdampf bewirkt gute Durchwirbelung + Zersetzungsgase wirken als ReduktionsmittelPolen in 2 Stufen:- Dichtpolen: SO 2 + Polgasen entweichen- Zähpolen: Polgase reduzieren Kupferoxid zum Kupfer44
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab2. Raffinationselektrolyse: 0,3V; 200-300 kWh/t CuCu zur Anode (99,2% Cu) gegossen, Elektrolyt (CuSO 4 -H 2 SO 4 -Lösung), Kathode (Feinkupferblech)Anode löst sich auf <strong>und</strong> bildet Anodenschlamm (Edelmetalle, Se, Te)Kathode scheidet sich 99,99% Kupfer ab. (Anodenreise 20-30 Tage, 170 – 380 kg))2 Cu + ↔ Cu 2+ + Cu 0 (Disproportionierung)2 Cu + + 2H + + ½ O 2 ↔ 2 Cu 2+ + H 2 O (Oxidation durch Luft, Verbrauch H 2 SO 4 )Cu 2 O + 2 H + ↔ 2 Cu + + H 2 O (Cu 2 O –Auflösung, Verbrauch H 2 SO 4 )3. Umschmelzen <strong>der</strong> Kathoden <strong>und</strong> Gießen in Formatenb) hydrometallurgische RaffinationVorteil: durch spezielle Anpassung, hohe Selektivität <strong>und</strong> Vermeidung <strong>der</strong> SO 2 -Bildung.Nachteil: durch schlechtere Ausbringung <strong>der</strong> Edelmetalle, sowie langsameren Lösungsvorgang.1. Röstung Erze werden oxidierend, sulfatisierend <strong>und</strong> chlorierend geröstetSO 2 + ½ O 2 ↔ SO 3MeO + SO 3 ↔ MeSO 4MeO + MeSO 4 ↔ MeO*MeSO 42. Laugungsverfahren- H 2 SO 4 (2-10%) für Oxide, Carbonate, Sulfate, Silikate- Eisen(III)-Salzlösung wenn sulfidischer Anteil vorhanden- ammoniakalische Lösung für oxydische Erze mit säurelöslicher Gangart.Wichtig ist die Regenerierbarkeit des Lösungsmittels.Laugung auch mit Hilfe von Bakterien (Thiobacillus thiooxidans) möglich3. Anreicherung mittels Extraktion schwefelsaure Cu-Lösungen werden mit einem Chelat-Komplexbildner (LIX 64) in eine organische Phase selektiv extrahiert <strong>und</strong> daraus rückextrahiert4. Zementation Lösungen sind schwefel- o<strong>der</strong> salzsauer, das Zementkupfer schwankt zwischen 60<strong>und</strong> 90% Cu5. Elektrolyse unlöslicher Anoden (Hartbleianoden o<strong>der</strong> Ti + Edelmetallbeschichtung wegen O 2Überspannung), Cu kathodisch an Cu-Blechen abgeschieden <strong>und</strong> umgeschmolzen. Reinheitsgradgleich, Stromverbrauch 10 x höher.63.) Titan-Herstellung: Ausgangsstoffe, Verfahrensschritte (Gleichungen, Bedingungen, Anlagen)Edukte: TiO 2 (Rutil), FeTiO 3 (Ilmenit)Chlorierung: TiO 2 + Cl 2 + 2 C → TiCl 4 + 2 CO exotherm ∆H= -771 kJbei 900-1200 °C (Wirbelschicht), Reaktoren mit Kohlenstoffsteinen ausgekleidet, zusätzlich beheizt(Reaktionswärme reicht nicht), Reaktionsgase: Cl 2 , CO, SiCl 4 , FeCl 3 VOCl 3 + Staub.Sprühkühlung mit flüssigem TiCl 4 (94%) -> Kondensation <strong>der</strong> schwerflüchtigen ChlorideReinigung: Vorwärmen, Filtration, Abtrennung leicht flüchtiger Chloride (< 136 °C) SiCl 4 (57 °C), SnCl 4(114 °C), Einrühren von Reduktionsmittel (Cu-Pulver, H 2 S, Ölsäure) -> V <strong>und</strong> Cr-Verbindungen in nichtflüchtigeVerbindungen (VOCl 3 -> VOCl 2 ), Rühren + Abscheiden bei 90 °C, Rektifikation TiCl 4 (136 °C),AlCl 3 (180 °C), FeCl 3 (319 °C)45
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabHerstellung eines Ti-Schwamms (KROLL-Verfahren):TiCl 4 (g) + 2 Mg (l) → Ti (s) + 2 Mg Cl 2 (l)∆H= - 450 kJ/Molzylindrischer gasbeheizter Reaktor mit oxidfreie Mg beschichtet + Schutzgas (Ar, He) auf 700 °C erhitzt,Mg schmilzt, von oben TiCl 4 eingetropft -> mit Mg zu Ti <strong>und</strong> MgCl 2 (T auf 850-900 °C), Titan bildet überMg-Schmelze einen festen Kuchen, geschmolzene MgCl 2 unter Mg abgezogen (Elektrolyse)Kapillarwirkung -> Mg durch den Kuchen an die Oberfläche regiert mit weiterem TiCl 4 .Lichtbogen mit Abschmelzelektrode:Titanschwamm geschnitten, gebrochen, hydraulisch verpresst,durch Elektronenstrahlschweißen (Plasmaschweißen) zuGroßelektroden verschweißt (können auch gleichLegierungselemente mit rein), im Lichtbogenofen im Vakuumumgeschmolzen, es entstehen Ti-Ingots, mehrmaligesumschmelzen (220 mm -> 350 mm -> 500 mm Ingots)Krollverfahren:44,4 kWh/kg Elektrolyse 25 kWh/kg Elektrolyse aufgr<strong>und</strong><strong>der</strong> verschiedeneren Wertigkeiten des Titan schwierig ->immer wie<strong>der</strong> Rekreationen64.) Wolfram-Herstellung: Ausgangsstoffe, Verfahrensschritte bis zum W-Pulver(Reaktionsgleichungen,Bedingungen, Raffination <strong>und</strong> Reduktion)Ausgangsstoffe: Scheelit (Ca[WO 4 ]), Wolframit ((Fe,Mn)WO 4 ) oxidierte Schrotte (WO 3 , Wolframate)Alkalischer Druckaufschluss: mit NaOH o<strong>der</strong> Na 2 CO 3 bei ~200 °C <strong>und</strong> 10-26 bar -> Na 2 WO 4 (unrein)(Fe, Mn)WO 4 + 2 NaOH → Na 2 WO 4 + (Fe, Mn)(OH) 2CaWO 4 + Na 2 CO 3 → Na 2 WO 4 + CaCO 3Reinigung durch Fällung: Zusatz von Al-Mg-Sulfat bei pH = 8-11, 20-80 °C -> Fällung <strong>der</strong> Anionen (Silikate,Phosphate Fluoride), Zusatz von Na 2 S + H 2 SO 4 auf pH= 2,5-3 -> Fällung d. Schwermetallsulfide z.B. MoFlüssig-flüssig Extraktion: Wolfram wird als Hexawolframatkomplex mit tert. Aminen in organischePhase überführt. Anschließend mit Ammoniak in wässrige Lösung reextrahiert.5 R 3 NH + + [HW 6 O 21 ] 5- → (R 3 NH) 5 HW 6 O 21 pH 2-3(R 3 NH) 5 HW 6 O 21 + 5 OH - → [HW 6 O 21 ] 5- + 5 R 3 NH + OH pH 9-10Kristallisation: erhitzen NH 3 + H 2 O entweichen -> Ammoniumparawolframat (APW) kristallisiert(NH 4 ) 10 [H 2 W 12 O 42 ]*4 H 2 O)Calzinierung: thermische Zersetzung des APW (Drehrohrofen, 400-800 °C) -> WO 3 (gelb), WO 3 -x (blau)(NH 4 ) 10 [H 2 W 12 O 42 ]*4 H 2 O) → 12 WO 3 + 10 NH 3 + 10 H 2 OReduktion: H 2 im Drehrohr- o<strong>der</strong> Drehschubofen.über mehrere Stufen von WO 3 zu W (bis 100 nm kleine Wolframkörner über die Schütthöhe erzeugbar)WO 3 + 3 H 2 → W + 3 H 2 O (800 °C)46
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab65.) Einteilung <strong>der</strong> Formgebungsverfahren in <strong>der</strong> Metallurgie: Aufzählung <strong>der</strong> MethodenA) Direkte Formgebung1) Gießen (-> Lunkerbildung -> beruhigter/unberuhigter Stahl -> Seigerung/Konzentrationsgradient)-Blockguss-Strangguss-Formguss:- Sandguss- Kokillenguss- Spritzguss- Schleu<strong>der</strong>guss- Hohlguss- Feinguss2) Pulvermetallurgie (Pulver reiner o<strong>der</strong> legierter Metalle o<strong>der</strong> Pulvergemische)B) UmformprozesseMatritzenpressenPulverspritzguss1) Warmverformung (spanlose Formgebung)- Schmieden - Strangpressen- Gesenkschmieden - Warmwalzen2) Kaltverformung (spanlose Formgebung)- Kaltwalzen - Ziehen - Blechumformung- Schrägwalzen - Tiefziehen - Drahtseilherstellung- Fließpressen - Richten - Explosionsumformung3) Spanende Formgebung- Drehen - Fräsen - Bohren66.) Metall-Gieß-Verfahren: Auflistung <strong>der</strong> Methoden, Vor- <strong>und</strong> Nachteile in Schlagwortena) Blockguss (Kokillenguss) statisch fallen<strong>der</strong> Guss (Kokille von unten verschlossen indem sie auf Platten gestellt wird,Schmelze wird von oben eingefüllt)Blockoberfläche schlechter, Arbeitsaufwand geringer, Ausbringung höher statisch steigen<strong>der</strong> Guss (Gespannplatten dienen als Aufstellungsort für die Kokillen, Schmelzewird durch Rinnen von unten in die Form gedrückt)Gegenteil fallen<strong>der</strong> Guss + gleichmäßige Befüllung aller Kokillen+ verschiedene Formen- Lunker-Bildung, stärker Steigung- Nachbearbeitungb) Stranggussin eine Kokille, bei <strong>der</strong> das Gussstück nach unten abgezogen wird. Dadurch kann ein theoretischunendlich langes Gussstück entstehen Vertikalanlagen: benötigen große Raumhöhe (40m), Anlage 20m Biege-Richt-Anlage: Block wird gebogen, anschließend gerichtet <strong>und</strong> getrennt. Kreisbogenanlage: Gekrümmte Kokille, Stützrollen biegen den Strang gerade. Horizontaler Austritt<strong>und</strong> trennen. Horizontalanlagen47
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab+ Automatisierung möglich+ Guss kleiner Teile erspart das teure Blockwalzwerk+ geringer Platzbedarf+ 15% höhere Ausbringung (keine Kopf-<strong>und</strong> Fußverluste)+ Primärgefüge auf Gr<strong>und</strong> schnellerer Erstarrung gleichmäßiger+ geringe Seigerung+ weniger nichtmetallische Einschlüsse- schwer auf an<strong>der</strong>e Form umrüstbar- Nachbearbeitungc) Formguss:+ führt direkt zum Werkstück, ohne wesentliche formgebende NachbearbeitungSandguss:+ für fast alle Legierungen verwendbar- Form nur 1x verwendbar- SchwindungKokillenguss:+ mehrere 1000 Abgüsse pro FormSchleu<strong>der</strong>guss: rotationssymmetrischer Gusstücke+ Lunkerfreiheit+ hohe Festigkeit+ große Stückzahlen+ Einsparung von Kernen- stärkere Verdichtung- Schwereseigerung (Schlacke reichert sich an Innenseite an)Spritzguss:+ hohe Maßgenauigkeit (Gewinde <strong>und</strong> Bohrungen können mitgegossen werden+ feinkörniges Gefüge mit erhöhter Festigkeit durch rasche Abkühlung- erst ab ~300 Stück wirtschaftlichHohlguss: Niedrigschmelzende Legierungen werden in Formen gegossen <strong>und</strong> nach Erstarrung<strong>der</strong> äußeren Schicht wird <strong>der</strong> noch flüssige Kern herausgegossen.+ geringes Gewicht+ keine Lunker- meist nur für Zierobjekte (Belastbarkeit fehlt)Feinguss: für sehr genaue <strong>und</strong> komplizierte Teile aus schwer bearbeitbaren Werkstoffen+ hervorragende OF-Beschaffenheit+ hohe Maßgenauigkeit- Aufwendig- Teuer- Hohlräume sind schwierig einzubringen48
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab67.) Metallguss: Erklärung <strong>der</strong> Begriffe Lunker-Bildung, Seigerung <strong>und</strong> beruhigter/unberuhigter Stahla) Lunker-Bildung: Erstarren -> Volumenkontraktion -> am oberen Ende des Gussblocks entsteht einHohlraum (= Lunker), abhängig von Kokillenform + gießen<strong>der</strong> LegierungBlockhauben verringern die Abkühlgeschwindigkeit -> weniger Lunker.b) Seigerung:Konzentrationsgradient von Verunreinigungen, die sich an Erstarrungsfront anreichern (bleiben inSchmelze gelöst, im Blockinneren <strong>und</strong> oben sind meist höhere Konzentrationen <strong>der</strong> Verunreinigungenc) Beruhigter/unberuhigter Stahl:Wenn im Stahl noch O 2 vorhanden, entsteht beim Erstarren CO -> bildet Gasblasen im Gussblock o<strong>der</strong> eskommt zum „Kochen“ (Gasblasen steigen auf).unberuhigten („viel“ O 2 ), halbberuhigten („weniger“ O 2 ) beruhigten Stahl (kaum O 2 )Beruhigen mit Al, Mg, FeSi, …68.) Blockguss <strong>und</strong> Strangguss: Allgemeine Vor- bzw. Nachteile. Beschreiben Sie die unterschiedlichen Typenbei<strong>der</strong> Verfahren, sowie ihre Vor- bzw. NachteileBlockguss:Vorteile: nicht-metallische, schädliche Anteile <strong>der</strong> Schmelze können in den oberen Teil des Gussblocksaufsteigen <strong>und</strong> sich dort sammeln, durch Abtrennen des Kopfes schließlich entferntNachteile: die Ausbringung bei <strong>der</strong> Weiterverarbeitung ist durch die Kopfseigerung gr<strong>und</strong>sätzlichgeringer als beim StranggussStrangguss:Vorteile ca. 15% größere Ausbringung als beim Blockgießen, weil „verlorene Köpfe“ wegfallendurch rasches Erstarren lassen sich Seigerung <strong>und</strong> Lunker-Bildung weitgehend vermeidenNachteile: bei stark oxidationsempfindlichen Schmelzen kommt es zur Bildung von Oxid-Häutchen, diezu Gussfehlern führena) Blockguss siehe Frage 66b) Strangguss siehe Frage 6669.) Feinguss: Prozessschritte bis zum fertigen Gussteil, Vor-bzw. NachteileEntwurf für das WerkstückHerstellen eines Wachs/Polystyrol-Modell, manuell o<strong>der</strong> automatischTauchen des Modells in einer flüssigen Keramikmasse, anschließen<strong>der</strong> SandüberzugAusschmelzen durch H 2 O-Dampf <strong>und</strong> anschließendes Brennen <strong>der</strong> KeramikGießen, solange die Maske noch glühtTrennen des Werkstücks von <strong>der</strong> Maske, Schleifen, PutzenÜberprüfung+ für sehr genaue <strong>und</strong> komplizierte Werkstücke aus schwer bearbeitbaren Werkstoffen+ Liefert hohe Maßgenauigkeit+ hervorragende Oberflächen- für jedes Werkstück muss eine Maske angefertigt werden- viel manuelle Arbeit- teuer- Hohlräume sind schwierig einzubringen49
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab70.) Fehlerbeseitigung bei Gussblöcken: Aufzählung <strong>und</strong> Prinzipien <strong>der</strong> einzelnen Verfahrena) Putzen: Beseitigt flächenhafte Fehler + Risse, lokal + für ganze Oberfläche geeig<strong>net</strong>.- spanend (Hobeln, Drehen, Schleifen, Fräsen) – entfernt Kanten, Graten- flämmend (mit Sauerstoff-Heizgasflamme wird die Oberfläche von warmen/kalten Stückennachbearbeitet) – entfernt Risse etc. Schichtförmiger Abtrag, auch für ganze Oberflächeb) Entzun<strong>der</strong>n: Entfernung von Oxidschichten (Zun<strong>der</strong>, Hammerschlag, Abbrand).- mechanisch (Bürsten, Trommeln, Strahlentzun<strong>der</strong>n, Hochdruckzun<strong>der</strong> mit Wasser)- chemisch (Beizen, elektrolytisches Beizen für Band <strong>und</strong> Drahtentzun<strong>der</strong>ung - kontinuierlich)erwünscht: Metall-Oxid + Säure -> MSalz + Wasserunerwünscht: M + Säure -> MSalz + H 271.) Pulvermetallurgie: Verfahrensschritte, Vorteile, Erklärung von Sinternzur Herstellung metallischer Werkstücke aus reinen, legierten <strong>und</strong> Metallpulvergemische.Herstellung des Pulvers durch Zerkleinerung fester, Zerstäubung flüssiger Metalle, o<strong>der</strong> durchReduktion von Oxidpulvern sowie thermische Zersetzung von Metallverbindungen.Mischen, granulieren zur Vorbereitung für FormgebungPulver in Pressformen (Matrizen) zu Formkörpern (Pressling = Grünling)Sintern (= Glühbehandlung) <strong>der</strong> Formkörper unter Schutzgas, Vakuum o<strong>der</strong> GasgemischSintertemperatur = 2/3 bis ¾ Schmelztemperatur.Sintern <strong>und</strong> Pressen in einem Schritt möglich (Heißpressen / Drucksintern)+ Maßgenaue Werkstücke aber auch Rohlinge lassen sich herstellen+ Hochschmelzende Metalle (W, Mo, Ta) -> kompaktiert werden+ hohe Stückzahl + Verb<strong>und</strong> von Stoffen möglich die mit Gussverfahren nicht herstellbar sind (z.B.Hartmetalle)Sintern:normalerweise reine Festkörperreaktion -> keine Schmelzphase (manchmal Aufschmelzen <strong>der</strong>Bestandteile), treibende Kraft: Grenzflächenenergie <strong>der</strong> PulverkörnerMechanismus -> Platzwechselvorgänge (Oberflächendiffusion, Volumendiffusion, Adhäsionskräfte)zunächst Halbbildungen an Berührungsstellen <strong>der</strong> Körner (Pulver hat große Oberfläche = viel Energie) ->Oberfläche + Oberflächenenergie verringert (Grenzfläche s/s hat weniger Energie als s/l)Lücken werden dann durch Platzwechselvorgänge an <strong>der</strong> Oberfläche aufgefüllt -> streben EnergieMinimum an -> Körper schrumpft (verdichtet), bei Einstoff-Systemen ab ca. 0,8 TSSintern DefinitionWärmebehandlungsverfahren, bei dem das nicht o<strong>der</strong> lose geb<strong>und</strong>ene Pulverhaufwerk ausreichendverdichtet <strong>und</strong> die gewünschte Zusammensetzung annimmt- Summe <strong>der</strong> vorwiegend physikalischen (od. chem.) Vorgänge, die zu teilweisen o<strong>der</strong> vollständigenAuffüllen des Porenraums führen- Wärmebehandlung unterhalb des Schmelzpunktes des Pulverhaufwerks (zumindest unter dem <strong>der</strong>Hauptkomponente)50
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab72.) Metallumformprozesse (spanlose Formgebung): Einteilung <strong>und</strong> Aufzählung <strong>der</strong> Verfahren, UnterschiedWarm- zu Kaltverformung.Unterschied:Kaltverformung = unterhalb <strong>der</strong> Rekristallisationstemperatur -> Kaltverfestigung, mit steigen<strong>der</strong>Verformung immer größer Kräfte nötig, muss irgendwann kristallisiert werden um weiter zu verformen-> sonst Bruch (immer mehr Versetzungen eingebracht), Gefüge -> deutliche Verformung, zurFestigkeitserhöhung, keine Verzun<strong>der</strong>ung, Verformungsdichte erhöhtWarmverformung = oberhalb <strong>der</strong> Rekristallisationstemperatur -> immer volle Verformungsfähigkeit, oftEntstehung grober Gefüge, Gefahr <strong>der</strong> Verzun<strong>der</strong>ungWarmverformung: Schmieden, Gesenkschmieden, Strangpressen, WarmwalzenKaltverformung: Kaltwalzen, Schrägwalzen, Fließpressen, Blechumformung, Richten, Ziehen, Tiefziehen,Explosionsumformung, Drahtseilherstellung73.) Herstellung von Rohren (5 Verfahren): Prinzipien <strong>der</strong> Herstellungsverfahren, Vor- <strong>und</strong> Nachteilea) Strangguss: Schmelze in Kokille gegossen -> Gussstück durch konischen Dorn nach unten abgezogen,theoretisch ein unendlich langes Gussstück möglich,d.h. ein Rohr wird geformt, dass durch Walzen weiter bearbeitet wird (z.B. im Durchmesser verringert)+ kontinuierliches Verfahren, unendlich lange Rohre, nahtlos, gleichmäßiges Abkühlen, hohe Qualität- Nachformung (Walzen, etc.)b) Schleu<strong>der</strong>guss:Schmelze wird in eine rotierende Kokille eingebracht. -> Zentrifugalkraft -> Schmelze nach außengeschleu<strong>der</strong>t <strong>und</strong> erstarrt dort -> nimmt Form <strong>der</strong> Kokille anWandstärke ist abhängig von <strong>der</strong> Menge <strong>der</strong> Schmelze+ für hohe Stückzahl geeig<strong>net</strong>, Lunker frei, hohe Festigkeit, nahtlos, kein Dorn nötig- Schwereseigerungc) Strangpressen:glühendes Ausgangsstück wird mittels hydraulischer Presse durch eine ringförmige Matrize gepresst.+ Simpel, nahtlos- Rohre ungenau in den Dimensionen, ergibt wellige, leicht verformbare Produkted) Schrägwalzen:2 doppelt-konischen Walzen, laufen gleichsinnig, beför<strong>der</strong>n Material zum Dorn, umfließt den Dorn,weil Walzen kegelförmig -> fließen äußere Schichten stärker -> HohlkörperbildungDer Dorn glättet die Innenoberfläche.dickwandige Rohre mit großem Durchmesser werden durch Ziehen über einen Dorn weiterverarbeitet.+ hohe Mengenleistung, hohe Stückfolge, hohe Form- <strong>und</strong> Maßgenauigkeit, nahtlos- meist Weiterverarbeitung nötig,e) Ziehen:Umformen unterhalb <strong>der</strong> Rekristallisationstemperatur -> Verfestigung. Das zu verformende Ziehgutwird durch eine Öffnung (Ziehhol o<strong>der</strong> Ziehmatrize) gezogen -> Querschnittsvermin<strong>der</strong>ung <strong>und</strong>Streckung+ hoher Durchsatz, hohe Präzision51
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab74.) Ziehen, Fließpressen, Tiefziehen, Explosionsumformung – beschreiben Sie diePrinzipien <strong>und</strong> die Einsatzbereiche dieser Verfahren.a) Ziehen:Umformen unterhalb <strong>der</strong> Rekristallisationstemperatur -> Verfestigung. Das zu verformende Ziehgut wirddurch eine Öffnung (Ziehhol o<strong>der</strong> Ziehmatrize) gezogen -> Querschnittsvermin<strong>der</strong>ung <strong>und</strong> StreckungAnwendung: Stangen, Profile, Präzisionsrohre, Drähteb) Fließpressen:Metallteile im kalten Zustand zum Fließen gebracht, mit einem Pressstempel in einen offenes Gesenkgepresst wobei das Material mit o<strong>der</strong> gegen die Stempelbewegung fließen kann.Anwendung: Tuben, Hülsen, Becher, Dosen, - aus Materialien guter Verformbarkeit (Cu, Al, Pb … )c) Tiefziehen:Bleche in einen Ziehring eingespannt <strong>und</strong> durch den Druck eines Stempels zu Hohlkörper verformt,oft mehrstufige Verformungen mit Zwischenglühungen notwendig.Anwendung: Hülsen, Näpfe, Behälterd) Explosionsumformung:ähnlich dem Tiefziehen, Umformung durch die Druckwelle einer Explosion (Luft o<strong>der</strong> H 2 O als Medium)für Teile komplexer Geometrie + hohem Bedarf an Genauigkeit, wirtschaftlich bei geringen Stückzahlen.Anwendung: Luftfahrtindustrie, Raketenbau52
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab4. GLAS, BAUSTOFFE, KERAMIK75.) Erläutern Sie den Begriff Bindemittel <strong>und</strong> <strong>der</strong>en Einteilung, nennen Sie je 1 BeispielBindemittel: pulverförmige, anorganisch-nichtmetallische Stoffe, die beim Anmachen mit Wasser + festenZuschlagstoffen einen Mörtel o<strong>der</strong> Beton bilden, <strong>der</strong> zunächst formbar ist <strong>und</strong> nach einer gewissen Zeitsteinartig erhärtet.Sie können gröbere <strong>und</strong> feinere Körner verkittenMörtel < 4mmBeton > 4 mmEinteilung:a) Temperaturbehandlung bei <strong>der</strong> Herstellung• in natürlicher Form: Ton, Lehm• bis zur Entwässerung (ca. 200 °C): Gips• bis zur Entsäuerung (ca. 1000 °C) Kalk• bis zur Sinterung (ca. 1500 °C): Portlandzement• bis zur Schmelze (ca. 1900 °C): Schmelzzementb) Art <strong>der</strong> Erhärtung & Eigenschaften <strong>der</strong> erhärteten Bindemittel• Nichthydraulisch (Luftbin<strong>der</strong>)• selbstständige Erhärtung (Baugipse, Lehm), Härtung durch austrocknen -> Lehmchemische Reaktion des Bindemittels mit dem Anmachwasser (Gips)• unselbständige Erhärtung (Luftkalk, Magnesiumbin<strong>der</strong>)Reaktionskomponente von außen nötig z.B. CO 2 beim Luftkalk.• Hydraulisch• An-sich-hydraulische Erhärtung (Portlandzement, Tonerdezement) reagieren sofort mitWasser <strong>und</strong> bilden wasserbeständige Hydrate <strong>und</strong> Hydroxide• Latent-hydraulische Härtung (Hydraulische Kalke, Hüttenzement, Vulkan- <strong>und</strong> Flugasche)benötigen Anreger als Zusatz (alkalisch -> Kalk bzw. sulfatisch -> Gips) zum Aushärten.76.) Kalk: a) Definition, Vorkommenb) Erläuterung <strong>der</strong> Herstellung <strong>und</strong> Reaktionen, nennen Sie mind. 2 Brennaggregatea) Definition: technischer Qualität CaO & Ca(OH) 2Vorkommen: CaCO 3 (Calzit), CaMg(CO 3 ) 2 (Dolomit), Marmor/Kreide.b) Abbau - > bergmännisch -> erfolgt durch Sprengung, anschließend wird das Material gebrochen,gesiebt, gewaschen <strong>und</strong> klassiert. Durch das Brennen entsteht Branntkalk.CaCO 3 →CaO + CO 2 (T > 900 °C)• Brenntemperatur abhängig von Verunreinigungen• Eigenschaften hängen von Brenntemperatur & Verweilzeit im Ofen ab• lange Verweilzeiten + hoher Temperatur -> Festphasenreaktionen -> weniger reaktionsfähigenKalk (=totgebrannter Kalk) -> CaOgebrannter Kalk wird gesiebt, gemahlen (Prall-, Hammer-, Rollenmühlen).für Bauzwecke wird er gelöscht (mit H 2 O umgesetzt)53
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabEinteilung: stark exotherme ReaktionCaO + H 2 O -> Ca(OH) 2 (-1200 kJ/kg)• Trockenlöschen so viel Wasser zugegeben, -> die chemische Umwandlung in Ca(OH) 2liegt aber als Pulver vor (bis 300 °C)• Nasslöschen stöchiometrischer Überschuss an Wasser -> entsteht ein Kalkbrei o<strong>der</strong> Kalkmilch,-> direkter Einsatz als Mörtel (CaO + H 2 O → Ca(OH) 2 ) - optimale Temperatur < 100 °CGeschwindigkeit ist abhängig von OF, Struktur, Schutzschichten, Temperatur, Zusätze (verzögern -Gips, Sulfat, NaOH bzw. beschleunigen - Chloride)Abbinden: gelöschter Kalk nimmt CO 2 aus <strong>der</strong> Luft auf -> fester, harter Kalk entstehtBrennaggregate:Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O (langsam)• Schachtofen: Koksbeheizter Schachtofen: Koks <strong>und</strong> Kalkstein gemischt <strong>und</strong> oben aufgetragen,von unten Luft im Gegenstrom dazu, CO 2 entweicht <strong>und</strong> geht oben ab, Branntkalk wird untenentnommenNachteil: wenig energieeffizient• Gleichstrom-Gegenstrom-Regenerativofen (energiesparendster Typ) 90-95% <strong>der</strong> therm. Energiewird genutzt: Luft im einen Schacht im Gleichstrom, im an<strong>der</strong>en im Gegenstrom geführt,Kalkstein ca. 15 min im Gleichstrom, dann im Gegenstrom gebrannt• Drehrohrofen: für alle Kalkqualitäten, schwefelreiche & aschereiche Brennstoffe verwendbar• Ringschachtofen (für weichgebrannten Kalk, zwei Brennerebenen, nicht so gut wieDrehrohrofen)77.) Kalk: a) Beschreiben Sie die Begriffe Kalklöschen <strong>und</strong> Abbinden. Was ist dabei zu beachten?b) Nennen Sie mindestens 4 Verwendungsmöglichkeiten von Kalk.a) Kalklöschen bezeich<strong>net</strong> das Umsetzen von CaO mit H 2 O zu Ca(OH) 2 , -> für Bauzwecke notwendigstark exotherme Reaktion, Ca(OH) 2 -> basisch -> kann spritzen -> VerätzungCaO + H 2 O -> Ca(OH) 2 (-1200 kJ/kg)• Trockenlöschen so viel Wasser zugegeben, -> die chemische Umwandlung in Ca(OH) 2liegt aber als Pulver vor (bis 300 °C)• Nasslöschen stöchiometrischer Überschuss an Wasser -> entsteht ein Kalkbrei o<strong>der</strong> Kalkmilch,-> direkter Einsatz als Mörtel (CaO + H 2 O → Ca(OH) 2 ) - optimale Temperatur < 100 °CGeschwindigkeit ist abhängig von OF, Struktur, Schutzschichten, Temperatur, Zusätze (verzögern -Gips, Sulfat, NaOH bzw. beschleunigen - Chloride)Abbinden: gelöschter Kalk nimmt CO 2 aus <strong>der</strong> Luft auf -> fester, harter Kalk entstehtCa(OH) 2 + CO 2 → CaCO 3 + H 2 O (langsam)b) Baustoffindustrie (Zementproduktion, Gasbeton, Mörtel)Umweltschutz (Wasserreinigung, Abgasreinigung)Chemische Industrie (billige Base)Eisen <strong>und</strong> Stahlindustrie (Schlackebildung, Roheisen <strong>und</strong> Stahlerzeugung)54
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab78.) Gips: a) Welche Ausgangsprodukte werden verwendet, Erläuterungb) Herstellung <strong>der</strong> abbinde fähigen Produkte (2 Brennaggregate <strong>und</strong> mind. 2 Produkte)c) Erläuterung des Abbinde-Mechanismus, Verwendung von Gipsa) Ausgangsprodukte:• Naturgips: Rohgips aus bergmännischem Abbau (CaSO 4 )• Chemiegips: Nebenprodukt bei industriellen Prozessen z.B. Phosphor-, Flusssäureherstellung• Rauchgasgips: Entschwefelungsanlagen von Rauchgas (fossile Kraftstoffe, Reaktion von SO 2 mitCaCO 3 / Ca(OH) 2b) Herstellung:Abbau:• Naturgips im Übertagebau abgebaut, Lagerstätten meist gestört, Gips wird gebrochen,vorzerkleinert, klassiert (10 – 20 cm) zum Brennen in den Ofen• Chemierohgips kann hingegen sofort in die Ofenabteilung.Brennaggregate:• Drehrohrofen: Rohgips, Beheizung (Gleichstrom), Abluft entstaubt , Produkt mahlen, sichten• Großkocher: nasses Ausgangsmaterial, von unten beheizt (100 °C), Wasserdampf oben abgezogen,Produkt: Stuckgips: β-Halbhydrat• Rostbrandofen: Rohgips in versch. Korngrößen, nimmt im Ofen nach oben hin zu, von oben beheizt,-> oben heiß <strong>und</strong> trocken, <strong>und</strong> feuchter weniger heiß, 300-900 °CProdukt: Mehrphasengips• Autoklav: Natur- o<strong>der</strong> Chemiegips im Autoklaven bei 150°C, 4 bar über 4 St<strong>und</strong>en unterNassdampfatmosphäre hergestellt. getrock<strong>net</strong> bei 105 °CProdukt: α-Hydratgips -> Formgips- α-Hydratgips: Natur- o<strong>der</strong> Chemiegips im Autoklaven bei 150°C, 4 bar über 4 St<strong>und</strong>en unterNassdampfatmosphäre hergestellt. getrock<strong>net</strong> bei 105 °C = CaSO 4 ◦2H 2 O- Stuckgips: β-Halbhydrat aus Naturgips, im Drehrohr, Großkocher, trockenes Brennverfahren zw.120 <strong>und</strong> 180°C -> härtet schnell -> Fassadenstuck, Gipskarton = CaSO 4 ◦½ H 2 O- Putzgips: Mehrphasengips trock<strong>net</strong> bei 200-800 °Cam Rostbandofen - > härtet nicht so schnell ->länger Verarbeitung möglich -> Innenputzc) Abbinde-Mechanismus Halbhydrat + Anhydrid unter Wasseraufnahme -> Dihydratentstehen Kristallnadeln -> verwachsen & verfilzen, Keimbildung & Keimwachstum wichtige Rolle.CaSO 4 + ½ H 2 O -> CaSO 4 ◦½ H 2 OCaSO 4 ◦½ H 2 O + 3/2 H 2 O -> CaSO 4 ◦2H 2 OAlterung: gebrannte Gipse nehmen aus <strong>der</strong> Luft Wasser auf -> Eigenschaften än<strong>der</strong>t sich -> deswegenkünstliche Alterung -> vor dem Brennen wird CaCl 2 0,2 wt% zugesetzt -> Eigenschaften bleiben beimLagern gleich.Verwendung• chemischen Industrie: Herstellung von Portlandzement, Ammoniumsulfat <strong>und</strong> Müller-Kühne-Verfahren (SO 2 -> Kontaktverfahren -> Schwefelsäure)• Gipskartonplatten, Verputzen, Lebensmittelindustrie (Tofu-Herstellung), Weißpigment55
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab79.) Gips: a) Definition von Gips,b) mindestens 3 Baugipsartenc) Reaktion bei Dehydrationa) DefinitionGips ist ein nichthydraulischer, mineralischer Bau bzw. Mörtelstoff <strong>der</strong> aus CaSO 4 mit unterschiedlichenMengen an Kristallwasser besteht.Man unterscheidet das Dihydrat, das Halbhydrat <strong>und</strong> das Anhydrid (3 Formen: I, II, III).- α-Hydratgips: Natur- o<strong>der</strong> Chemiegips im Autoklaven bei 150°C, 4 bar über 4 St<strong>und</strong>en unterNassdampfatmosphäre hergestellt. getrock<strong>net</strong> bei 105 °C- Stuckgips: β-Halbhydrat aus Naturgips, im Drehrohr, Großkocher, trockenes Brennverfahren zw.120 <strong>und</strong> 180°C -> härtet schnell -> Fassadenstuck, Gipskarton- Putzgips: Mehrphasengips trock<strong>net</strong> bei 200-800 °Cam Rostbandofen - > härtet nicht so schnell ->länger Verarbeitung möglich -> Innenputzc) Reaktionen bei Dehydrationstufenweise Dehydration: Dihydrat → Halbhydrat → Anhydrid III → Anhydrid II- Halbhydrat <strong>und</strong> Anhydrid III sind metastabil -> unter 40 °C mit Wasser zu Dihydrat- Umwandlung zu Gips erfolgt sehr langsam, da Anhydrid sich gegenüber Wasser als weitgehendstabil erweist- Dihydrat unter trockener Luft o<strong>der</strong> Vakuum zu β-Halbhydrat bei 45-200 °CWasserabspaltung:Phasenumwandlung:CaSO 4 ◦2 H 2 O -> CaSO 4 ◦1/2 H 2 O + 3/2 H 2 OCaSO 4 ◦1/2 H 2 O -> CaSO 4 + 1/2 H 2 OAnhydrit III -> Anhydrit IICaSO 4 -> CaO + SO 3(ca. 100 °C)(ca. 200 °C)(400 °C)(ab 800 °C)80.) Zement: a) Definition, Rohstoffe, Brennprozess (Anlagenbeschreibung), Kühlung, Mahlungb) Beschreibung <strong>der</strong> Klinkerphasen (Name, Formel, wichtigstes Merkmal)a) Definition: Feingemahlenes, hydraulisches Bindemittel für Mörtel <strong>und</strong> Beton, das im Wesentlichenaus Verbindungen von CaO mit SiO 2 , Al 2 O 3 <strong>und</strong> Fe-Oxid besteht, die durch Sintern o<strong>der</strong> Schmelzenentstanden sind.Zement erhärtet mit Wasser angemacht sowohl an Luft als auch unter Wasser <strong>und</strong> bleibt fest. Er mussraumbeständig sein <strong>und</strong> eine bestimmte Zugfestigkeit aufweisen können.Rohstoffe: Kalkstein, Ton (o<strong>der</strong> Gemenge aus Kalk <strong>und</strong> Ton = Mergel), CaO, SiO 2 , Al 2 O 3 <strong>und</strong> Fe-OxidBrennprozess:Drehrohrofen mit Zyklonvorwärmer bei 1450 °C, Drehrohrofen ist zum Kühler hin abfallend gelagert.Heißluft im Gegenstrom <strong>und</strong> oxidieren<strong>der</strong> Ofenatmosphäre -> Zementklinker / brauner Klinker ->geringe FestigkeitBeheizung: Erdgas, Steinkohle-, Braunkohlestaub, Schweröl, Reifen, Tiermehl o<strong>der</strong> Kunststoffabfällen56
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabKühlung: Portlandzementklinker aus Ofen auf 100-300°C abgekühlt. entscheiden<strong>der</strong> Schritt,- zu langsame Abkühlung: Alit -> Belit (unerwünscht -> eingefrorenes Schmelzgleichgewicht)- zu schnelle Abkühlung: Spannungsrisse = leichteres Mahlen, Festigkeitsverlust.Mahlung: in Kugelmühlen, Zementklinker mit etwas Gips <strong>und</strong> hydraulisch wirksamen Stoffen(Hüttensand, Flugasche) <strong>und</strong>/o<strong>der</strong> Kalkstein fein gemahlen <strong>und</strong> in Silos zwischengelagert.b) Beschreibung <strong>der</strong> Klinkerphasen (Name, Formel, wichtigstes Merkmal)• Alit: Tricalciumsilicat C 3 S (3 CaO x SiO 2 ) mit Fremdoxiden MgO, Al 2 O 3 , Fe 2 O 3 , TiO 2 ; Fremdoxidebeeinflussen hauptsächlich Eigenschaften wie Festigkeit. Er entsteht bei <strong>der</strong> Sinterung zwischen1250 <strong>und</strong> 1450° C unter 1250 °C -> C + C 2 S• Belit: Dicalciumsilicat C 2 S (2 CaO x SiO 2 ) mit Fremdoxiden. In Klinker mit hohem Kalkanteil wenigvorhanden, weniger fest als Alit. Übergang von β-C 2 S → γ-C 2 S führt zu Volumenszunahme um biszu 10% <strong>und</strong> somit zum Zerrieseln des Klinkers. Kann durch rasches Kühlen o<strong>der</strong> Fremdionenverhin<strong>der</strong>t werden.• Aluminatphase: C 3 A (3 CaO x Al 2 O 3 ) (Celit), hohe Reaktivität, die durch Alkalien noch erhöht wird.Gebremst durch Gipszugabe als Erstarrungsverzögerung.• Ferritphase: keine konst. chemische Zusammensetzung, Mischkristalle, häufig C 4 AF (4 CaO xAl 2 O 3 x Fe 2 O 3 ), farbgebend für Zement81.) Zement: a) Chemische Umsetzung bei thermischen Behandlung von Portlanzement unterBerücksichtigung <strong>der</strong> Temperatur beim Vorwärmen, Brennen <strong>und</strong> Abkühlenb) Beschreibung <strong>der</strong> einzelnen Klinkerphasenb) siehe Frage 80 b)57
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab82.) Zement: a) Erläuterung <strong>der</strong> Rohstoffe, <strong>und</strong> <strong>der</strong> 3 Gesamtverfahren.b) 4 Zementarten mit den wichtigsten Merkmalena) Rohmehl: aus gemahlenen Kalkstein, Ton, Hüttensand Gips erhalten.• Nassverfahren: nass vermahlenes Rohmehl mit 30-40% Wassergehalt.Nachteil: höhere Energieeinsatz um das Wasser zu verdampfen.• Halbtrockenverfahren: trocken gemahlenes Rohmehl durch H 2 O-Zusatz zu Formlingenverarbeitet o<strong>der</strong> Nassschlamm entwässert.• Trockenverfahren mit Vorwärmer: größte Bedeutung, energiesparend.Rohstoffe werden getrock<strong>net</strong>, zerkleinert, homogenisiert <strong>und</strong> vorgeheizt, dann bei 1000°C imGegenstrom ins Drehrohr eingebracht.b) Zementarten:• Hüttenzement: Portlandzement + Hüttensand & Gips• Eisenportlandzement: Portlandzement <strong>und</strong> 30% Hüttensand• Hochofenzement: > 30% Hüttensand• Tonerdezement: Kalkstein <strong>und</strong> Bauxit (für die Festigkeit)• Weißzement: Portlandzement mit geringem Fe-Anteil83.) Glas: a) Definition, Eigenschaften, chemischer Aufbau <strong>und</strong> Strukturb) Erläutern Sie die Begriffe Netzwerkbildner <strong>und</strong> Netzwerkwandler.a) Definition, Eigenschaften, chemischer Aufbau <strong>und</strong> StrukturGlas umfasst jene Stoffe, die strukturell einer Flüssigkeit ähneln, <strong>der</strong>en Viskosität jedoch beiUmgebungstemperaturen so hoch ist, dass sie als feste Körper anzusehen sind.Überbegriff = VitroideEigenschaften:• Glas ist spröde (besteht aus ionischen Bindungen, dadurch nicht so gut verformbar -> Brüche geheneine kleinen <strong>und</strong> kleinsten Oberflächenverletzungen Kerbstellen als Rissauslöser aus), kann durchAbätzen o<strong>der</strong> Druckvorspannung verhin<strong>der</strong>t werden• optisch: gute optische Eigenschaften – Bezug auf BrechungsindexAbbe‘sche Zahl: < 50 Flintgläser (gute Dispersion)> 50 Krongläser (schlechte Dispersion)enthalten oft La 2 O 3 , ThO 2 , Nb 2 O 5 , Ta 2 O 5 sind aber sehr weich somit zerkratzbar• elektrisch: im festen <strong>und</strong> trockenen Zustand ein ausgezeich<strong>net</strong>es Dielektrikum <strong>und</strong> Isolator• chemisch: gegen Chemikalien sehr wi<strong>der</strong>standsfähig, nur HF <strong>und</strong> Alkalischmelzen lösen Glas, H 2 Ohingegen laugt es aus.• thermische:Kalknatronglas a = 8-9 ppm/KDuranglas a= 3,3 ppm/KAlkalioxdide -> setzten Wärmeausdehnung hinaufB 2 O 3 setzt sie herab58
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabchemischer Aufbau:• keine definierte chemische Zusammensetzung• keinen definierten Schmelzpunkt• strukturell: unterkühlte, eingefrorene Flüssigkeit -> Neigung zur Kristallisation -> Entglasung ->Keimbildung• aus Oxiden zusammengesetzt (meist 3 Gruppen)1.Gruppe: Anionenoxide o<strong>der</strong> Netzwerkbil<strong>der</strong>, welche aus <strong>der</strong> Schmelze glasartig erstarren,z.B. B 2 O 3 , Al 2 O 3 , SiO 2 , P 2 O 3 ,…2.Gruppe: Alkalioxide als Flussmittel <strong>und</strong> um den m.p. zu erniedrigen, z.B. Na 2 O, K 2 O, Li 2 O3.Gruppe: Erdalkalioxide als Stabilisatoren, wodurch Gläser unlöslich werden (Wasser kannes nichtmehr auslaugen) z.B. MgO, CaO, BaO, Al 2 O 32 + 3 Gruppe werden Netzwerkwandler genanntGläser: Nahordnung aber keine FernordnungAufbau von SiO 4 -Tetrae<strong>der</strong>a. periodischer Aufbau des Bergkristallsb. fehlende Fernordnung beim Aufbau des Kieselglasc. Aufbruch des Netzwerks durch Netzwerkwandlerz.B Natronkieselsäureglasb) Netzwerkbildner, NetzwerkwandlerNetzwerkbildner: erstarren glasig-amorph & bilden dreidimensionale Netzwerke,häufigster Netzwerkbildner ist SiO 2 , das ein ungeord<strong>net</strong>es, dreidimensionales Netzwerkeckenverknüpfter SiO 4 -Tetraeter bildet.Netzwerkwandler: „brechen“ das Netzwerk auf -> verän<strong>der</strong>n Gefüge & Eigenschaftenim Falle <strong>der</strong> vierwertigen Si-Ionen wirken an<strong>der</strong>e an sich <strong>net</strong>zwerkbildende Ionen wie Bor, Aluminiumo<strong>der</strong> Phosphor als Netzwerkwandler.je kleiner <strong>der</strong> Ionenradius, desto stärker die Aufspaltung auf die Ordnung <strong>der</strong> SiO 4 -Tetrae<strong>der</strong>84.) Erläutern Sie die Begriffe Färben, Entfärben <strong>und</strong> TrübenFärben: Beruht auf Lösung o<strong>der</strong> chemischer Bindung von Metalloxiden im Glas o<strong>der</strong> auf Ausbildungkolloidaler Teilchen im Glas = Anlauffarben.Farbe hängt auch von <strong>der</strong> Oxidationsstufe & <strong>der</strong> Art <strong>der</strong> Ofenatmosphäre (red./ox.)(Fe(II) – Blau, Fe(III) – Gelb -> Mischung: Grün) abAnlauffarben: bei Temperaturen um 550 °C erzeugt, haben färbende Oxide bei rascher Abkühlung keineZeit zum Auskristallisieren.Entfärben: Verfärbung von Weißgläser wegen Fe-Oxiden (leichten blaugrün) FeO = blau; Fe 2 O 3 = gelb)Entfärbung in 2 Schritten:1. Schritt: Oxidation zu Fe(III), (FeO -> Fe 2 O 3 ) dadurch nur leichter Gelbstich (chemische Entfärbung)2. Schritt: restlose Entfärbung durch Komplementärfarben (physikalische Entfärbung), Se rosa, CoOblau. entfärbte Gläser sind lichtempfindlich -> Rückfärbung -> Stabilisation PbOTrüben: Einlagerung von heterogenen, kleinen Teilchen, z.B. NaF, CaF 2 , SnO 2 , TiO 2Scheiden sich erst beim Abkühlen ausAnwendung: Beleuchtungsglas, Wandplatten.59
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab85.) Glas: a) Erläuterung <strong>der</strong> kontinuierlichen Glasherstellung (Rohstoffe, Glasschmelzstufen, Wannenofen,Glaskühlung)b) Nennen Sie die 5 traditionellen Glastypen <strong>und</strong> <strong>der</strong>en Verwendung.a) Rohstoffe:• Quarzsand (SiO 2 )• saure Glasoxide (Kieselsäure als Quarzsand, Borsäure, H 3 PO 4 )• basische Glasoxide (Soda, Pottasche, Kalk, BaCO 3 , Al 2 O 3 , ZnO, CdO, TiO 2 ,…)• Zuschlagstoffe (Färbung, Trübung)• Läuter-, Fluss- <strong>und</strong> Entfärbemittel• Glasscherben (Einglasscherben – Glasbruch, Altglas) 10-60%1. Gemengenherstellung- Quarzsand, Kalk, Soda- fein gemahlen <strong>und</strong> vermischt- bis zum 50% Glasscherben (Grünglas 90%)2. Schmelzvorgang- in Schmelzöfen bei ca. 1540-1600°C- Läuterung <strong>und</strong> Homogenisierung3. Formgebung- Glasschmelze auf 1000°C abkühlen um Glas zu formen- unterschiedlichste Verfahren <strong>der</strong> Formgeb<strong>und</strong>4. KühlenSchmelzprozess in 5 Stufen: 1-2 Rauschmelze 3-4 Feinschmelze1. Silikatbildung:Hydrate, Hydroxide Nitrate, Carbonate, Sulfate in dieser Reihenfolge unter Gasentwicklungzersetzt. Zersetzungsprodukte reagieren miteinan<strong>der</strong> -> silikatische Eutektika, Zersetzung durchWasser begünstigt800-900 °C bei soda- <strong>und</strong> Na 2 SO 4 -haltigen Gemengen deutlich höher2. Glasbildung: bereits während <strong>der</strong> Silikatbildungübriger Quarz löst sich in den geschmolzenen Silikaten, die Glasmasse ist inhomogen, 1200°CDauer -> bestimmt das GrößtkornGlasbildung durch Auflösgeschwindigkeit <strong>der</strong> festen Bestandteile in <strong>der</strong> Schmelze bestimmtje kleiner das Korn desto kürzer die LösezeitProblem: Glasmasse von Blasen durchsetzt <strong>und</strong> nicht homogen3. Läuterung: Temperaturerhöhung (1400 °C) -> Zähigkeit verringert -> Löslichkeit sinkt ->restlichen Gase ausgetriebenZugabe von Na 2 SO 4 , As 2 O 3 , Sb 2 O 3 <strong>und</strong> CeO 2 (begünstigen Läuterung durch Verdampfen) o<strong>der</strong> O 2 -Zugabe -> gelöstes Gas -> herausgestrippt, physikalisch mit NaCl, Bubbling4. Homogenisierung: Verweilen <strong>der</strong> Glasmasse bei hoher Temperatur um Ausgleich <strong>der</strong> chem.Zusammensetzung, Aufsteigende Blasen homogenisieren die Schmelze, Blasen werden großteilsabgebaut (einblasen von Luft o<strong>der</strong> rühren)5. Konditionieren (Abstehen) Schmelze ist für Formgebung zu flüssig, abkühlen auf 1200°C)6.60
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabWannenofen/Glasschmelzwanne früher dis-, heute kontinuierlicher Betrieb alle fünf Phasen spielen sich gleichzeitig ab Wanne 0,6-1,5 m tief <strong>und</strong> fast randvoll gefüllto Gemenge wird auf einer Seite aufgegeben = Schmelzwanneo Glasschmelze auf einer an<strong>der</strong>en entnommen = Arbeitswanneo Trennung durch Siphon o<strong>der</strong> Trennwand Betrieb bei 1500-1600°C in <strong>der</strong> Läuterzone Beheizung mit Erdgas, Erdöl o<strong>der</strong> elektrisch Auskleidung: Schamotte, schmelzgegossene Steine, Magnesiasteine, Zirkonsteine Temperaturmessung per Thermoelement o<strong>der</strong> PyrometerGlaskühlung: gleichmäßige, langsame Abkühlung -> Vermeidung von Spannungen durchunregelmäßige WärmeausdehnungIm Entspannungsbereich (400-600°C) können die Spannungen vom Glas selbst abgebaut werden.Trotz langsamer Abkühlung (Tage bis Monate) bleibt eine Restspannung zurück.b) Nennen Sie die 5 traditionellen Glastypen <strong>und</strong> <strong>der</strong>en Verwendung.• Alkali-Erdalkali-Silikatgläser: 72% SiO 2 , 13% Na 2 O, 6.5% K 2 O, 6.5% CaO, Al 2 O 3 , MgO, BaOVerwendung: Behälter-, Wirtschafts-, Flachglas.• Borosilikatgläser: 78% SiO 2 , 12.5% B 2 O 3 , 5.5% Na 2 O, 3 % Al 2 O 3Verwendung: chemisch technologisches Hohlglas, Rohrleitungen, techn. Anlagen• Bleisilikatgläser: 61.5% SiO 2 , 24% PbO, 14.5% K 2 O, 0.5% Al 2 O 3Verwendung: Wirtschaftsglas (Bleikristall), Schmuckglas• Alumosilikatgläser: 34% SiO 2 , 14% Al 2 O 3 , 7.5% B 2 O 3 , 22% CaOVerwendung: Glasseide, für hohe Einsatztemperaturen• Kieselglas („Quarzglas“): 100% SiO 2Verwendung: optische Industrie z.B. Küvetten.86.) Glas: Erläuterung <strong>der</strong> Formgebungsverfahren mit Anwendungsbeispielen.a) FlachglasZiehglasverfahren: Zylin<strong>der</strong>glasverfahren (lange Glaszylin<strong>der</strong> geblasen, aufgeschnitten <strong>und</strong>gebogen) wenig Bedeutung,• Fourcault-Verfahren (rechteckige, langgestreckte Keramikdüsen, Glas wird auf Oberflächegedrückt <strong>und</strong> quillt hervor, über Walzen gezogen nur für Dünngläser),• Pittsburghverfahren (Glas wird aus freier Oberfläche gezogen, unter <strong>der</strong> Ziehflächebalkenförmige Keramikkörper um die Kühlwirkung <strong>der</strong> Wasserkühler zu verstärken),• Libby-Owens (zuerst vertikal, dann horizontal, ohne Ziehstein)Floatglasverfahren: Glasschmelze auf Metallbad aufgegeben, Sn-Bad bis zu 60m lang, 600-1000 °C,höhere Dichte als die Glasschmelze, reagiert nicht mit Glas.z.B. Fensterglas verwendet für ca. 95% aller Flachgläser61
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabGussglasverfahren: Glas fließt aus Wanne zwischen ein Walzenpaar <strong>und</strong> wird zu einem endlosenBand geformt. Zur Herstellung von Ornamentglas o<strong>der</strong> DrahtglasSpiegelglasverfahren: Schleifen, Polieren von Flachglas, verdrängt von Floatverfahrenb) Hohlglas• Flaschenglas: früher m<strong>und</strong>geblasen, heute maschinell, Vor- & Fertigform, Vorform: Kübel besitzt ingroben Zügen die Endform, Glas wird tropfenförmig zugeführt, in <strong>der</strong> Vorform festgeblasen <strong>und</strong>anschließend vorgeblasen -> überführt in Fertigform, rückerhitzt <strong>und</strong> ausgeblasen.• Pressglas: wirtschaftliche Herstellung,Hohlglas = Kalk/Natronsilicatgläser mit geringem Borsäurezusatzgefärbt = Cr 2 O 3 -> grün & Kohle -> braun (stark UV-absorbierend)Glas in metallische Hohlform gepresst dann mit Pressstempel geformt = Vorform -> dann in Endformaufgeblasen z.B. Autoscheinwerfer, Konservenglas• Beleuchtungs- <strong>und</strong> Wirtschaftsglasheute noch viel Handarbeit (Kelche, Vasen)Veredelung durch Schleifen <strong>und</strong> Polieren, Bemahlen, Bedrucken, Ätzen• Rohre <strong>und</strong> Stangen- Vello-Verfahren: mit Ziehdorn -> zuerst vertikal, dann horizontaler Umlenkung.- Danner-Verfahren: Glas fließt auf einer drehende Pfeiffe <strong>und</strong> wird anschließend zuGlühlampenkolben o<strong>der</strong> Laborglas gezogen.• Optische Gläserhochreine Ausgangstoffe (Fe, Cr) in Häfen aufgeschmolzen, heute auch in Pt-TiegelFlint <strong>und</strong> Krongläser• Glasfasern o<strong>der</strong> –wolle- Düsenblasverfahren: Düse aus Pt mit ca. 50-70 Nippel mit Dampfgebläse- Schleu<strong>der</strong>verfahren: Ausgeschleu<strong>der</strong>t <strong>und</strong> einem Gasstrom ausgesetzt- Düsenziehverfahren: Faden wird aus Düsen durch rotierende Trommel gezogen• LichtleitfasernInnen hochbrechendes optische Glas -> Kern – Außen niedrigbrechendes Glas -> Mantelsoll homogen sein <strong>und</strong> geringe Lichtabsorption aufweisen- Stabrohrverfahren: 2 Stäbe ineinan<strong>der</strong> gesteckt- Doppeltiegelverfahren: direkt; Schmelzen werden kombiniert- Ionenaustauschverfahren87.) Keramik a) Definition b) Eigenschaften c) Werkstoffgruppen + Erläuterunga) DefinitionKeramik ist ein Zweig <strong>der</strong> chemischen Technologie o<strong>der</strong> Hüttenk<strong>und</strong>e, <strong>der</strong> sich mit <strong>der</strong>Herstellung keramischer Werkstoffe <strong>und</strong> Weiterverarbeitung bis zum keramischen Erzeugnisbefasst. Keramische Werkstoffe sind anorganisch, nichtmetallisch, in Wasser schwer löslich <strong>und</strong> zuwenigstens 30% kristallin.62
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabb) Eigenschaftenspröde, hoch temperaturbeständig, hohe Härte, hohe Festigkeit bei hohen Temperaturen, guteIsolatoren, gute chemische Beständigkeit, gute tribologische Eigenschaften, aber schlechteTemperaturwechselbeständig, geringe Zugbelastungc) Einteilung nach WerkstoffgruppenSilikatkeramiken:• großteils aus natürlichen Rohstoffen hergestellt (Tone, Schamotte, Kaolin, Feldspat,Speckstein als Silikatträger)• Beispiele: Stealit, Cordierit, PorzellanOxidkeramiken:• synthetische Rohstoffe mit hohem Reinheitsgrad• hohe Sintertemperaturen• Beispiele: Al 2 O 3 , ZrO 2 , MgONichtoxidkeramiken:• synthetische Rohstoffe mit hohem Reinheitsgrad• hoher Anteil an kovalenten Bindungen, daher sehr gute mechanische Eigenschaften• Beispiele: SiC, Si 3 N 4 , AlN, B 4 C88.) Ziegel: a) Erläutern Sie Rohstoffe, Formgebung <strong>und</strong> Trocknung.b) Welche Vorgänge laufen beim Brand im Tunnelofen ab.a) Rohstoffe:• Ton, Mergelton, Tonstein, Schieferton, Lehm, Löss, Sand, alle Arten <strong>der</strong> Tonmineralien(Schichtsilikate)• Ca-, Fe-, Mg-Anteile• für Klinker zumeist Schiefer <strong>und</strong> Steinzeugtone• Zusatzstoffe: Polystyrol, Sägemehl, Papierschlamm, Braunkohle für Porosität <strong>und</strong>Energiegewinnung beim Brand, Kalkstein, Fe 2 O 3 zur FärbungFormgebung:• Trockenpressen: 7-9 wt% Wasser, beim Befüllen <strong>der</strong> Matrize auf gute Entlüftung achten• Nasspressen: Masse muss plastische Eigenschaften haben• Steifpressen: gut plastische Massen <strong>und</strong> Schiefertonen, hohe Drücke.Vorteil: direkte Stapelung möglich,Nachteil: dünnwandige <strong>und</strong> hohe Produkte nicht möglich.• Strangpressen: Schneckenpresse mit Vakuumschritt dazwischen.Vorteil: kontinuierliches Verfahren mit hohen DurchsätzenNachteil: Texturbildung mit Trockenrissen• Stempelpressen: für Dachziegel <strong>und</strong> Bodenplatten (Fliesen)Trocknung Anmachwasser entfernt -> Schwindungzu schnell getrock<strong>net</strong> -> Verziehen & RissbildungAggregate: Kammer <strong>und</strong> Tunneltrockner63
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raabb) Vorgänge beim Brand im Tunnelofenbis 120 °C: austreiben mech. geb. Wasser (bis 300 °C Wasserdampfaustritt problematisch)450-650°C: Zerfall <strong>der</strong> Tonminerale (Kristallwasser weg), Quarzsprung (α -> β Volumsausdehnung)700-900 °C langsam erhitzen, -> entweichenden Gasen brauchen Zeit (Kohle, Pflanzenreste, …)800 °C: Beginn <strong>der</strong> Verfestigung (Grenzflächenreaktionen)1000 °C: Erstes Auftreten von Schmelzphase1000-1500 °C: Verdichtung durch Bildung eine Schmelzphase (je nach Reinheit)> 1200 °C Schmelzen (je nach Reinheit)Garbrand: Bildung typische Eigenschaften des Ziegels -> Spitzentemperatur,Mauerziegel: sollen porös sein -> Einbau von Kalk -> darf aber nicht über 1060 °C -> Ausbildung vonCa-Silikaten (niedrig Schmelzend)Farbe: rot, Glasuren an <strong>der</strong> Oberfläche o<strong>der</strong> gefärbt mit Fe 2 O 3 , Ofenatmosphäre, mit MnO 2 etc.verschiedene Farben möglich89.) Porzellan: a) Definition, Beson<strong>der</strong>heit des Porzellans, Unterschied zum Steingut.b) physikalische Eigenschaftenc) Erläuterung von mindestens 4 Porzellantypen mit Anwendungsbeispielena) Porzellan ist das edelste feinkeramische Erzeugnis unter den tonkeramischen Produkten. Es istgekennzeich<strong>net</strong> durch dichte, weiß verglaste Scherben, sowie bei dünnen Wandstärken durchdurscheinend transparentes Auftreten. (Beson<strong>der</strong>heit <strong>und</strong> Unterschied zu Steingut).physikalische Eigenschaften :• Weißgrad (abhängig von den Rohstoffen),• Wärmeausdehnungskoeffizient (beeinflusst durch die Modifikationsän<strong>der</strong>ung von Quarz)• elektrischer Isolator• hohe Härte• Transparenz.b) 4 Porzellantypen mit Anwendungsbeispielen• Weichporzellan: 25% Kaolin, 30% Feldspat, 45% Quarz; Flussmittel erhöht. z.B. für französischesWeichporzellan, Sanitärporzellan, asiatischen Porzellan• Hartporzellan: 50% Kaolin, 25% Feldspat, 25% Quarz, vor allem fürAnwendungen, die Stabilität erfor<strong>der</strong>n -> Geschirr• Tonerdeporzellan: hohe Festigkeit, Al 2 O 3 statt Quarz• Knochenporzellan: zusätzlich zur normalen Zusammensetzung 52% verglühteKnochenasche; gilt als das Edelste, für Kunst <strong>und</strong> Ziergegenstände• Zahnporzellan: hohe Feldspatgehalte• Frittenporzellan: unechtes Porzellan, kein Kaolin enthalten,Hauptbestandteil: Sand, Salpeter, NaCl, Soda64
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab90.) Porzellan: Rohstoffe, Herstellung, Brand, DekorationRohstoffe:• Kaolin: weiße Brennfarbe, Bildsamkeit, hohe Reinheit (Weißgrad), aufbereitete Kaoline (vonQuarzen, Feldspäten <strong>und</strong> Glimmer befreit) -> definierte Rohstoffzusammensetzung; chemischeFormel Al 2 O 3 *2 SiO 2 *2 H 2 O• Feldspat Kalifeldspat bevorzugt -> Schmelzverhalten, Viskosität <strong>und</strong> Temperaturabhängigkeit;bildet höher viskose Schmelzen; Natronfeldspat für Glasuren, FlussmittelKalifeldspat = K[AlSi 3 O 8 ] (Gerüstsilikat)Arkosen = feldspatreiche Sande (gleichzeitiges Einbringen von Feldspat <strong>und</strong> Quarz)• Quarz: begünstigt Trocknung, erhöht Viskosität beim Brand, Quarzsande <strong>und</strong> Gangquarte,Reinigung wichtig!• sonstige Rohstoffe: für technische Porzellane bis 40% Tonerde, Zirkonsand für hochfeuerfesteProdukte, Knochenasche, CalicumphosphatHerstellungRohrstoffe werden gemahlen, in Suspension überführt <strong>und</strong> entwe<strong>der</strong> als Gießmasse verflüssigt o<strong>der</strong> alsDrehmasse entwässert, Formgebung durch Schlickerguss, Strangpressen, Trockenpressen, Garnieren).Das Trocknen erfolgt in Feuchträumen <strong>und</strong> das Gut wird im Anschluss glasiert <strong>und</strong> schließlich gebrannt.Brand: dient dem Dichtsintern <strong>und</strong> Aufschmelzen <strong>der</strong> Glasurteilweise zweifach gebrannt, dabei wechselt die Atmosphäre (oxidierend / reduzierend).Je nach Porzellan (Hart- o<strong>der</strong> Weichporzellan) erfolgt <strong>der</strong> Brand an<strong>der</strong>s.1.Brand = Glühbrand: 900-1000 °C oxidieren<strong>der</strong> Atmosphäre2.Brand = Glattbrand: 1200-1450 °C wobei Atmosphäre von Porzellan abhängig istHartporzellan - Aufheizperiode 20-900 ◦C oxidierend(verrauchte Scherben Kohlenstoffreste)- Oxidationsperiode 900-1000 ◦C oxidierend(restlicher Kohlenstoff verbrennt)- Scharffeuerperiode 1000-1450 ◦C reduzierend(nur solange wie die Poren offen sind)- Abkühlperiode neutral o<strong>der</strong> oxidierend (Für Elektroporzellan -> braune Farbe)Weichporzellan durchwegs oxidierende AtmosphäreSchwindung: bis zu 20%Dekoration:• Reliefaufbringen beim Gießen o<strong>der</strong> Drehen• Färben mit Metalloxiden (Atmosphäre beim Brennen sehr wichtig)• Unterglasdekor: unter Glasur VT: vor je<strong>der</strong> Art von Angriff geschützt, NT: Farbe mussTemperatur beim Brennen aushalten• Aufglasdekor: Aufbringen nach Scharfbrand, VT: unbegrenzte Farbauswahl, NT: Farbenicht so gut geschützt• Inglasurdekor: Glasur erweicht bei 1300 °C <strong>und</strong> Farbe sinkt in Glasur sein• Schnellbranddekor: wie Inglasurdekor, bei ca. 1250 °C, Einbrennzeit auf 60-90 Min, sodass sichnicht die gesamte Farbe auflöst65
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab• Metalldekor: Auftragen <strong>und</strong> einbrennen von Gold o<strong>der</strong> Platin, poliert.91.) Porzellan: a) Definition <strong>und</strong> Eigenschaftenb) Unterschied zwischen Hart-<strong>und</strong> Weichporzellana) DefinitionPorzellan ist das edelste feinkeramische Erzeugnis unter den tonkeramischen Produkten. Es istgekennzeich<strong>net</strong> durch dichte, weiß verglaste Scherben, sowie bei dünnen Wandstärken durchdurscheinend transparentes Auftreten.Eigenschaften :• Siehe Frage 89b) Der Unterschied zwischen Hartporzellan <strong>und</strong> Weichporzellan• Hartporzellan: 50% Kaolin, je 25% Quarz <strong>und</strong> Feldspat bei 1380 - 1460 °C gebranntHöhere TWB, härter, höhere Schlagbiegung,Anwendung: Geschirr, Figuren• Weichporzellan: 45% Quarz, 30% Feldspat <strong>und</strong> 25% Kaolin bei 1200-1300 °C gebranntEmpfindlicher gegen Temperaturschwankung, deutlich Stoßempfindlicher,Anwendung: Sanitärporzellan, asiatisches Porzellan66
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab5. RECYCLING92.) Erklären Sie die Begriffe <strong>und</strong> den Unterschied zwischen den Begriffen Recycling, Up-Cycling, Down-Cycling, Wie<strong>der</strong>verwerten.a) Recycling: Stoffliche Verwertung eines Altproduktes zur Herstellung eines Einsatzstoffes in einenan<strong>der</strong>en Prozessschritt o<strong>der</strong> zur Herstellung eines Sek<strong>und</strong>ärrohstoff (Recycling-Alu).(Verschiedene)Güter werden auf die (selbe) stoffliche Ebene gebracht.Aufwand• Sammeln (verschiedene Güter)• Aufbereiten• Trennen (von Verunreinigungen, an<strong>der</strong>en Stoffen)• Reinigen auf Rohstoffqualität (evt. geringere Qualität als Primär-Rohstoff: Down-Cycling)Wirtschaftliche Triebfe<strong>der</strong>• Gesetzliche Norm (Verpackungsverordnung)• Energie/Primärrohstoff-Ersparnis (Kostenersparnis)b) Wie<strong>der</strong>verwendenVerwerten eines Produktes in <strong>der</strong>selben Funktion nach Behandlung bzw. Reparatur (Pfandflaschen,Second-hand Ersatzteile).Aufwand• Sammeln (gleiche Güter)• Konditionieren (Reinigen, Reparieren,..)• Wie<strong>der</strong>einsatzWirtschaftliche Triebkraft• z.B. PfandRecycling unterscheitet sich von Wie<strong>der</strong>verwertung im Einsatzgebiet <strong>und</strong> <strong>der</strong> Wie<strong>der</strong>nutzbarmachung.Während Recycling einen Rohstoff o<strong>der</strong> Prozessstrom liefert, ergibt Wie<strong>der</strong>verwertung dasselbe Produkterneut gebrauchsfertig.c) Up-CyclingGewinnung eines höherwertigen Produktes aus verschiedenen Prozessströmen o<strong>der</strong> gebrauchtenAltprodukten (REA Gips)d) Down-CyclingStoffliche Verwertung eines Altproduktes zur Herstellung eines Sek<strong>und</strong>ärrohstoffes o<strong>der</strong>Sek<strong>und</strong>ärproduktes geringerer QualitätDown-Cycling unterscheidet sich von Up-Cycling in <strong>der</strong> Qualität des Ergebnisses: Ein down-gecyceltesProdukt weißt min<strong>der</strong>e Qualität (Wert) als das Ausgangsprodukt auf, Up-Cycling läuft umgekehrt.93.) Was ist <strong>der</strong> Unterschied zwischen Recyclinganteil <strong>und</strong> Recyclingquote?Recyclinganteil (Sammelrate) S/A= Anteil des in <strong>der</strong> Zeiteinheit aus <strong>der</strong> Gesellschaft ausgeschiedenen Stoffflusses, <strong>der</strong> einerWie<strong>der</strong>verwertung zugeführt wirdEinflüsse auf Sammelrate:• Sammelmoral• Initiative zur Sammlung (Pfand o.ä.)=> für viele Materialien über die Zeit fast konstant67
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabRecyclingquote (Recyclingrate) R s /V= Anteil des rezyklierten Sek<strong>und</strong>ärrohstoffs am Gesamtverbrauch in einer ZeiteinheitEinflüsse auf die Recyclingrate:• Rohstoffbedarf/preis• Vorhandene (akkumulierte) Altstoffmenge=> steigt für viele Materialien an weil <strong>der</strong> Altstoff zu Verfügung steht94.) Warum gibt es Grenzen für Recycling?Voraussetzung <strong>der</strong> stofflichen Verwertung:• Material erlaubt erneuten Einsatz in Primärproduktion• Gewinnung marktfähiger Produkte aus dem recycelten Material• getrennte Sammlung des Altstoffes• geringer Störstoffanteil des Materialstromes• ökonomisch konkurrenzfähig zum Primärrohstoff• ökologisch sinnvollGrenzen <strong>der</strong> stofflichen Verwertung:• Primärrohstoff ist wesentlich billiger• Emissionen aus Sammlung, Transport <strong>und</strong> Behandlung sind höher als beim Einsatz vonPrimärrohstoff• Offenaber: rechtliche Rahmenbedingungen können dennoch stoffliche Verwertung for<strong>der</strong>n!68
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab95.) Was ist <strong>der</strong> Inhalt <strong>der</strong> Verpackungsverordnung <strong>und</strong> des Abfallwirtschaftsgesetzes?Erläuterung des Begriffes Abfall• bewegliche Sachen (auch unbewegliche, wie belastete Böden)• Entledigungsabsicht (subjektiver Abfallbegriff) Einbringen in Container, Übergabe an Mistplatz• Behandlungsbedarf (objektiver Abfallbegriff) wenn <strong>der</strong>en Erfassung <strong>und</strong> Behandlung im öffentlichen Interesse geboten ist- Gefährdung <strong>der</strong> menschlichen Ges<strong>und</strong>heit <strong>und</strong>/o<strong>der</strong> Umwelt- Brand- o<strong>der</strong> Explosionsgefahr- Störung <strong>der</strong> öffentlichen Sicherheit- Erhebliche Beeinträchtigung des Orts- <strong>und</strong> LandschaftsbildesGr<strong>und</strong>sätze des Abfallwirtschaftsgesetztes (AWG)1) Abfallvermeidung (qualitativ <strong>und</strong> quantitativ)2) Abfallverwertung (stofflich, thermisch)• ökologisch sinnvoll• technologisch möglich• ökonomisch nicht unverhältnismäßig3) Abfallentsorgung (Vorbehandeln, geord<strong>net</strong> Ablagern)Verpackungsverordnung• regelt den Umgang mit Verpackungen, die Vermeidung <strong>und</strong> Verwertung vonVerpackungsabfällen <strong>und</strong> die Einrichtung von Sammel- <strong>und</strong> Verwertungssystemen.• betrifft alle Wirtschaftsbereiche (Hersteller, Verpacker, Abfüller, Importeur, Letztvertreiber)• Betriebe verpflichtet Verpackungen zurückzunehmen - schwer realisierbar -> Gründung <strong>der</strong> ARA„Inverkehr-Setzer“ hat folgende Möglichkeiten:• Sicherstellen, dass Vorlieferanten od. K<strong>und</strong>en die Verpackungen bei einemSammel-, <strong>und</strong> Verwertungssystem entpflichten• Sicherstellen, dass die Verpackungen von den Vorlieferanten od. den K<strong>und</strong>engesammelt <strong>und</strong> einer zulässigen Verwertung zugeführt werden• Die Verpackungen selbst bei einem Sammel-, <strong>und</strong> Verwertungssystementpflichten• Die Verpackungen selbst sammeln <strong>und</strong> einer zulässigen Verwertung zuführen96.) Erklären Sie die Aufgaben <strong>und</strong> Funktionen des ARA Systems in Österreich!Das ARA ist arbeitsteilig organisiert <strong>und</strong> besteht aus <strong>der</strong> Altstoff Recycling Austria AG <strong>und</strong> 2wirtschaftlich selbstständigen Unternehmen (Branchenrecycling- Gesellschaften, BRG). Waren mal 8,die an<strong>der</strong>en 6 sind 2008 mit <strong>der</strong> ARA AG verschmolzen=> ARA hebt Lizenzentgelte ein <strong>und</strong> schließt Entsorgungsverträge mit BRG ab.Lizenzpartner -> ARA – Dachgesellschaft -> BRG -> Entsorger, Verwerter, Gebietskörperschaft• Organisiert Verpackungssammlungen aus Betrieben <strong>und</strong> privaten Haushalten• Sammlung <strong>und</strong> Verwertung von Verpacksungsabfällen laut AWG(Verpackungsordnung• Initiativen zu Abfallvermeidung (ARA-Lectures)69
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab97.) Verwertungs- <strong>und</strong> Behandlungsverfahren für Kunststoffabfälle.Hauptprobleme bei <strong>der</strong> Kunststoffaufarbeitung sind Materialvielfalt <strong>und</strong> Verb<strong>und</strong>werkstoffe.für stoffliche Verwertung durch z.B. Umschmelzung sind nur sortenreine Materialien einsetzbar.für Mischmaterialien sind Aufbereitungsverfahren nicht wirtschaftlich <strong>und</strong> Neukunststoff ist billiger alsRecyclingmaterial.1) Materialrecycling• stofflichen Recycling (Makromoleküle unverän<strong>der</strong>t)- gemischten Kunststoffen -> Fertigprodukte- sortierten Kunststoffen -> Regranulate.• Rohstoffrecycling: (Makromoleküle zerlegt)- Hydrolyse, Solvolyse -> Monomere- Hydrierung, Gaserzeugung, Pyrolyse -> Gase, Öle, Syncrude2) thermische -> verbrennen -> Dampf -> Strom98.) Recycling von Aluminium: Technologie, Verfahrensschritte, Raffinationsmöglichkeiten fürUmschmelzaluminium.Raffinationsmöglichkeiten:• Sprühgasbehandlung (Inertgase/Reaktivgase) Entfernung von Li, Na, Mg, Ca, Si, Zn, Oxiden,Nitriden, Carbiden – mit Spülstein o<strong>der</strong> Impeller• Salzraffination Entfernen von Li, Na, Ca, Sr, Oxiden = NaCl / HCl / MgCl 2 / CaF 2• Vakuumdestillation Entfernen von Mg, Zn• Zusätzen von Primäraluminium Verdünnen aller Begleitelemente• Zusatz von Al-Legierungen Verschneiden, Verdünnen einzelner Begleitelemente•70
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas RaabSpülgas: auch zur H 2 -Entgasung <strong>der</strong> Schmelze, Cl 2 kann auch AlCl 3 bilden,Impeller: über Hohlwelle direkt am Rotor aufgetragen• extrem kleine Bläschen, intensive Mischung• viel schnellere WirkungSpülstein: poröse Spülsteine aus z.B. MgO ->erleichtern Bildung von kleinen Blasen -> Spülgasüber gasdurchlässige Spülsteine in die Pfannegeleitet.99.) Erläuterung <strong>der</strong> Recyclingkette für Autoabgaskatalysatorenenthalten 2-3 g PGM (Platin-Gruppen-Metalle, Pt, Pd, Rh) auf keramischem TrägerVerfahren: Stahlgehäuse aufgeschnitten, Katalysatorkeramik entnommen, PGM hydrometallurgisch (Säure)o<strong>der</strong> pyrometallurgisch (einschmelzen mit Sammlermaterial, meistens Cu) gewonnenRecyclingkette: Stoffstrom: 41% Fahrzeuge -> Verwerter,in Deutschland 57% unbekannter Verbleib (Export)4% gebraucht Wagen (end of lifetime)2% gestohlen 4% Verlust (Schred<strong>der</strong>) Sammler 33% < 100 in Deutschland 1-2% Verlust Entmantler: 31% < 10 in Deutschland 1-2% Verlust Scheidung: 30% < 10 Schmelzer/Raffinieren (weltweit) 1% Verlust29% PGM recyclet, 71% Verlustgrößter Verlust durch Export in Regionen ohne Recyclinginfrastruktur <strong>und</strong> Bewusstsein.Wichtig -> Recyclingmetalle sind chemisch ident mit Primärmetalle (kein Downcycling)100.) Raffination <strong>und</strong> Feindarstellung <strong>der</strong> Platinmetalle – welche technologischen Verfahren könneneingesetzt werden?HydrometallurgiePGM Metalle mit starken Säuren / Laugen vom Träger herausgelöst <strong>und</strong> dann aus <strong>der</strong> Lösung abgetrennt.Nachteil: hoher Edelmetallverlust, großen Mengen an Abwasser <strong>und</strong> Laugungsrückständen.heute keine Bedeutung mehr.Pyrometallurgieeinschmelzen <strong>der</strong> Kat.- Keramik, Keramik wird verschlackt, PGM am Sammlermetall (Fe, Ni, Cu) legiertNach einigen Trenn- <strong>und</strong> Raffinationsschritten liegen die Edelmetalle in großer Reinheit vor.Hochtemperatur-Elektroöfen• ca. 1700 °C, Kalk als Flussmittel• Energie über Bodenelektrode (Anode) & Graphitelektrode im Ofendeckel (Kathode• Ofenschlacke an Kupferhüten abgegeben• Cu mit PGM als Wertkupfer abgestochen71
2013 ANTECH-<strong>Fragenkatalog</strong> © Thomas Raab101.) a) Edelmetallabscheidung - Technologie, Verfahrensschritteb) Erklären Sie das Wesen <strong>der</strong> Fällungskristallisation <strong>und</strong> <strong>der</strong> Solventextraktion <strong>und</strong> <strong>der</strong>enUnterschiede im Rahmen <strong>der</strong> Edelmetallabscheidung.a) siehe Frage 100Fällungskristallisation: Fällung von v.a. Pt & Pd als Ammonium-Chlorokomplexe mit NH 4 ClH 2 [PtCl 6 ] + 2 NH 4 Cl -> (NH 4 ) 2 [PtCl 6 ] + 2 HCl(gelöst in Königswasser / HCl, Cl 2 )Löslichkeit ist abhängig von Temperatur <strong>und</strong> NH 4 Cl-KonzentrationSolventextraktion: Extraktion mit organischem LM (nicht mit <strong>der</strong> Lösung mischbar / PGM verteilen sichlaut Gleichgewicht in beiden Phasen -> abhängig von HCl/Cl 2 - Konzentration)typischen Extraktionsmittel: Tri-n-butylenphsophat (TBP): für Pt, IrTrioctylamin (TOA): für Pt, Ir, Pd (je nach Cl - in org. o<strong>der</strong> wäss. Phase)Metallgewinnung + thermische Zersetzung:3 [(NH 4 ) 2 PtCl 6 ] -> 3 Pt + NH 4 Cl + 16 HCl + 2 N 272