Modulhandbuch des Fachbereichs Physik Studiengänge
Modulhandbuch des Fachbereichs Physik Studiengänge
Modulhandbuch des Fachbereichs Physik Studiengänge
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
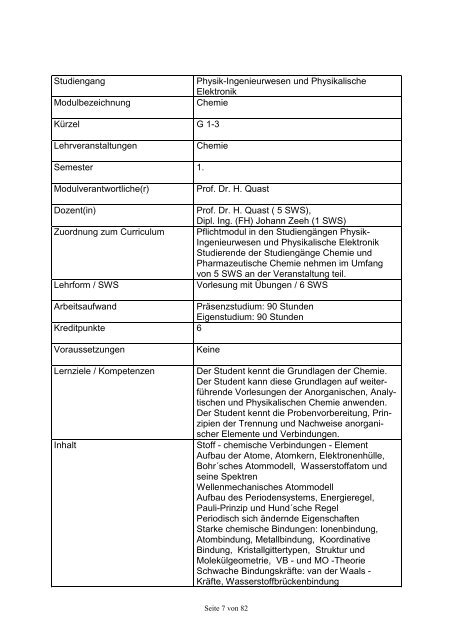
Studiengang<br />
Modulbezeichnung<br />
Kürzel<br />
Lehrveranstaltungen<br />
Semester<br />
Modulverantwortliche(r)<br />
<strong>Physik</strong>-Ingenieurwesen und <strong>Physik</strong>alische<br />
Elektronik<br />
Chemie<br />
G 1-3<br />
Chemie<br />
1.<br />
Prof. Dr. H. Quast<br />
Dozent(in) Prof. Dr. H. Quast ( 5 SWS),<br />
Dipl. Ing. (FH) Johann Zeeh (1 SWS)<br />
Zuordnung zum Curriculum Pflichtmodul in den <strong>Studiengänge</strong>n <strong>Physik</strong>-<br />
Ingenieurwesen und <strong>Physik</strong>alische Elektronik<br />
Studierende der <strong>Studiengänge</strong> Chemie und<br />
Pharmazeutische Chemie nehmen im Umfang<br />
von 5 SWS an der Veranstaltung teil.<br />
Lehrform / SWS<br />
Vorlesung mit Übungen / 6 SWS<br />
Arbeitsaufwand<br />
Kreditpunkte<br />
Voraussetzungen<br />
Präsenzstudium: 90 Stunden<br />
Eigenstudium: 90 Stunden<br />
6<br />
Keine<br />
Lernziele / Kompetenzen Der Student kennt die Grundlagen der Chemie.<br />
Der Student kann diese Grundlagen auf weiterführende<br />
Vorlesungen der Anorganischen, Analytischen<br />
und <strong>Physik</strong>alischen Chemie anwenden.<br />
Der Student kennt die Probenvorbereitung, Prinzipien<br />
der Trennung und Nachweise anorganischer<br />
Elemente und Verbindungen.<br />
Inhalt Stoff - chemische Verbindungen - Element<br />
Aufbau der Atome, Atomkern, Elektronenhülle,<br />
Bohr´sches Atommodell, Wasserstoffatom und<br />
seine Spektren<br />
Wellenmechanisches Atommodell<br />
Aufbau <strong>des</strong> Periodensystems, Energieregel,<br />
Pauli-Prinzip und Hund´sche Regel<br />
Periodisch sich ändernde Eigenschaften<br />
Starke chemische Bindungen: Ionenbindung,<br />
Atombindung, Metallbindung, Koordinative<br />
Bindung, Kristallgittertypen, Struktur und<br />
Molekülgeometrie, VB - und MO -Theorie<br />
Schwache Bindungskräfte: van der Waals -<br />
Kräfte, Wasserstoffbrückenbindung<br />
Seite 7 von 82