Asymmetriche Epoxidierung nach Sharpless und Jacobsen 1 ...
Asymmetriche Epoxidierung nach Sharpless und Jacobsen 1 ...
Asymmetriche Epoxidierung nach Sharpless und Jacobsen 1 ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Asymmetrische <strong>Epoxidierung</strong> <strong>nach</strong> <strong>Sharpless</strong> <strong>und</strong> <strong>Jacobsen</strong> 11.01.2008 M. Schinkel, N. Hocke<br />
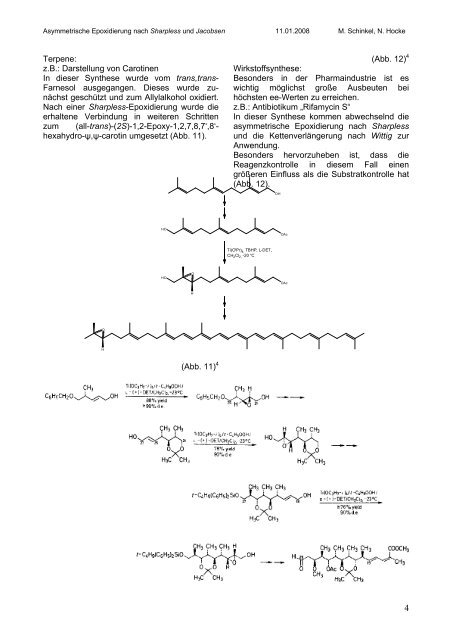
Terpene:<br />
z.B.: Darstellung von Carotinen<br />
In dieser Synthese wurde vom trans,trans-<br />
Farnesol ausgegangen. Dieses wurde zunächst<br />
geschützt <strong>und</strong> zum Allylalkohol oxidiert.<br />
Nach einer <strong>Sharpless</strong>-<strong>Epoxidierung</strong> wurde die<br />
erhaltene Verbindung in weiteren Schritten<br />
zum (all-trans)-(2S)-1,2-Epoxy-1,2,7,8,7‘,8‘hexahydro-ψ,ψ-carotin<br />
umgesetzt (Abb. 11).<br />
O<br />
H<br />
HO<br />
HO<br />
O<br />
H<br />
(Abb. 11) 4<br />
(Abb. 12) 4<br />
Wirkstoffsynthese:<br />
Besonders in der Pharmaindustrie ist es<br />
wichtig möglichst große Ausbeuten bei<br />
höchsten ee-Werten zu erreichen.<br />
z.B.: Antibiotikum „Rifamycin S“<br />
In dieser Synthese kommen abwechselnd die<br />
asymmetrische <strong>Epoxidierung</strong> <strong>nach</strong> <strong>Sharpless</strong><br />
<strong>und</strong> die Kettenverlängerung <strong>nach</strong> Wittig zur<br />
Anwendung.<br />
Besonders hervorzuheben ist, dass die<br />
Reagenzkontrolle in diesem Fall einen<br />
größeren Einfluss als die Substratkontrolle hat<br />
(Abb. 12).<br />
Ti(O i Pr) 4, TBHP, L-DET,<br />
CH 2 Cl 2, -20 °C<br />
OH<br />
OAc<br />
OAc<br />
4