Versuchsprotokoll: Fehling-Glucose - ChidS
Versuchsprotokoll: Fehling-Glucose - ChidS
Versuchsprotokoll: Fehling-Glucose - ChidS
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Versuchsprotokoll</strong>: <strong>Fehling</strong>-<strong>Glucose</strong><br />
Zeitaufwand:<br />
Vorbereitung: 5 Minuten<br />
Durchführung: 10 Minuten<br />
Abbau/Entsorgung: 5 Minuten (bei angesetzten Lösungen)<br />
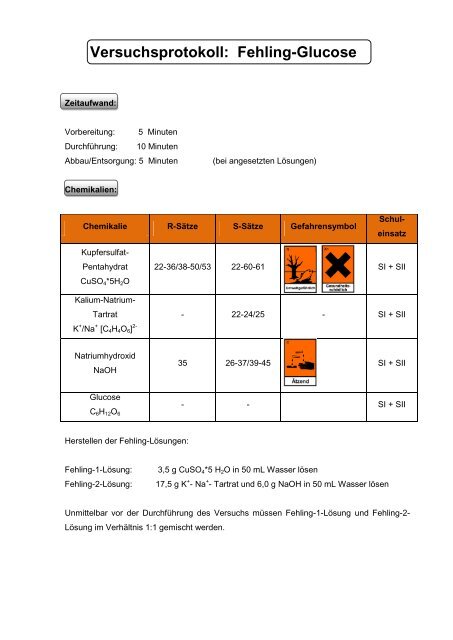
Chemikalien:<br />
Chemikalie R-Sätze S-Sätze Gefahrensymbol<br />
Kupfersulfat-<br />
Pentahydrat<br />
CuSO4*5H2O<br />
Kalium-Natrium-<br />
Tartrat<br />
K + /Na + [C4H4O6] 2-<br />
Natriumhydroxid<br />
NaOH<br />
<strong>Glucose</strong><br />
C6H12O6<br />
Herstellen der <strong>Fehling</strong>-Lösungen:<br />
22-36/38-50/53 22-60-61<br />
<strong>Fehling</strong>-1-Lösung: 3,5 g CuSO4*5 H2O in 50 mL Wasser lösen<br />
<strong>Fehling</strong>-2-Lösung: 17,5 g K + - Na + - Tartrat und 6,0 g NaOH in 50 mL Wasser lösen<br />
Unmittelbar vor der Durchführung des Versuchs müssen <strong>Fehling</strong>-1-Lösung und <strong>Fehling</strong>-2-<br />
Lösung im Verhältnis 1:1 gemischt werden.<br />
Schul-<br />
einsatz<br />
SI + SII<br />
- 22-24/25 - SI + SII<br />
35 26-37/39-45<br />
SI + SII<br />
- - SI + SII
Materialien:<br />
- Heizplatte<br />
- Becherglas (2x)<br />
- Reagenzgläser (2x)<br />
<strong>Versuchsprotokoll</strong>: <strong>Fehling</strong>-<strong>Glucose</strong><br />
- Schliffflaschen (2x) (für die <strong>Fehling</strong>-Lösungen)<br />
- Reagenzglasgestell<br />
Versuchsaufbau:<br />
heißes Wasser<br />
2. Lösen in heißem Wasser 2. Zugabe von <strong>Fehling</strong>-Lösung<br />
Abb.1 Aufbau des Versuchs<br />
<strong>Glucose</strong> Blindprobe<br />
<strong>Fehling</strong>-Lösung<br />
(1+2 gemischt)<br />
2
Durchführung:<br />
<strong>Versuchsprotokoll</strong>: <strong>Fehling</strong>-<strong>Glucose</strong><br />
In eines der beiden Reagenzgläser wird etwas <strong>Glucose</strong> gegeben. Das zweite Reagenzglas<br />
bleibt leer und dient im diesem Versuch als Blindprobe. In beide Reagenzgläser wird nun<br />
heißes Wasser gefüllt und die Probe anschließend geschüttelt. Nun können die beiden Flüs-<br />
sigkeiten in den Reagenzgläsern mit <strong>Fehling</strong>-Lösung untersucht werden. Dazu werden zu<br />
den zu untersuchenden Lösungen 5-10 mL der zuvor gemischten <strong>Fehling</strong>-Lösung gegeben.<br />
Sicherer ist es mit kalten Lösungen zu arbeiten und diese dann in ein warmes Wasserbad zu<br />
stellen. Die oben genannte Variante eignete sich jedoch besser zum Filmen.<br />
Entsorgung:<br />
Die mit <strong>Fehling</strong>-Lösung untersuchten Zuckerlösungen werden neutral in den Schwermetall-<br />
abfall entsorgt.<br />
Beobachtung:<br />
Die Lösung von <strong>Glucose</strong> färbt sich nach der Zugabe von <strong>Fehling</strong>-Lösung von blau über gelb-<br />
lich-braun nach orange-rot, während bei der Blindprobe keine Farbveränderung zu erkennen<br />
ist.<br />
Abb.2 Beobachtung des Versuchs<br />
3
Auswertung:<br />
1. <strong>Fehling</strong>-Probe<br />
<strong>Versuchsprotokoll</strong>: <strong>Fehling</strong>-<strong>Glucose</strong><br />
Der Nachweis der <strong>Fehling</strong>-Probe beruht auf der leichten Oxidierbarkeit von Aldehyden, die<br />
durch <strong>Fehling</strong>-Reagenz zu Carbonsäuren oxidiert werden. Um die Aldehyd-Gruppe zu oxi-<br />
dieren, sind sowohl Kupfer(II)-Ionen wie auch Hydroxid-Ionen nötig. Es kann aber nicht mit<br />
alkalischen Kupfersalzlösungen gearbeitet werden, da in solchen Lösungen Kupferhydroxid<br />
ausfallen würde. Aus diesem Grund werden den Kupfer-Ionen der <strong>Fehling</strong>-2-Lösung Tartrat-<br />
Ionen zugegeben. Tartrat ist das Salz der Weinsäure. Zwei Tartrat-Ionen sind dazu in der<br />
Lage, zwei Kupfer(II)-Ionen zu komplexieren (s. Abb.3). 1<br />
O<br />
H 2<br />
O<br />
H 2<br />
O -<br />
Dieser Komplex ist auch für die blaue Farbe des Gemisches der beiden <strong>Fehling</strong>-Lösungen<br />
verantwortlich. Es handelt sich dabei um Charge-Transfer-Komplexe zwischen den Kupfer-<br />
Ionen und den Tartrat-Ionen in dem entstandenen Komplex. 2<br />
Werden die Kupfer(II)-Ionen im Laufe der Reaktion jedoch zu Kupfer(I) reduziert, so können<br />
die Kupfer(I)-Ionen nicht mehr durch die Tartrat-Ionen komplexiert werden und es entsteht<br />
ein roter CuO2-Niederschlag.<br />
Cu 2+<br />
OH<br />
O -<br />
OH<br />
O<br />
O<br />
Cu 2+<br />
1 RÖMPP Online, Stichwort “<strong>Fehling</strong>sche Lösung” (letzter Zugriff 12.02.10)<br />
2 Holleman A. F. & Wiberg, E. (1995) S.1335<br />
O<br />
OH<br />
Abb.3 Kupfer 2+ -Tartrat-Komplex<br />
O<br />
OH<br />
-<br />
O<br />
O -<br />
OH 2<br />
OH 2<br />
4
Oxidation:<br />
R<br />
+I<br />
O<br />
<strong>Versuchsprotokoll</strong>: <strong>Fehling</strong>-<strong>Glucose</strong><br />
Reduktion: Cu 2+ + H2O +2e - Cu2O + 2 H +<br />
+II<br />
+I<br />
+I<br />
Gesamt: (aq) + 2 Cu 2+ (aq) + 4 OH - O<br />
O<br />
+II<br />
+I<br />
(aq) +III +Cu2O + 2H2O(l)<br />
R<br />
2. Warum ist der Nachweis mit <strong>Glucose</strong> positiv?<br />
Wie bereits beschrieben und an den Reaktionsgleichungen erkennbar, ist für den positiven<br />
Nachweis der Zucker das Vorliegen einer Aldehydfunktion entscheidend. Wie durch Rönt-<br />
genstrukturanalysen bewiesen wurde, kristallisiert <strong>Glucose</strong> ausschließlich als α-D-<strong>Glucose</strong><br />
aus. 3 In dieser ringförmigen <strong>Glucose</strong> existiert keine Aldehydgruppe und der Nachweis würde<br />
negativ ausfallen. Wird die <strong>Glucose</strong> jedoch in Lösung gegeben, so stellt sich ein Gleichge-<br />
wicht zwischen α- und β-Form der ringförmigen <strong>Glucose</strong>, sowie einer kleinen Menge des<br />
offenkettigen Aldehyds ein. 4<br />
HO<br />
H<br />
HO<br />
Abb.5 Die drei in Lösung vorkommenden Konformationen der <strong>Glucose</strong><br />
3 Vollhardt, K.P.C. & Schore, N.E. (2005) S. 1267<br />
4 Vollhardt, K.P.C. & Schore, N.E. (2005) S. 1268<br />
H<br />
H<br />
+ H 2 O<br />
R<br />
+III<br />
Abb.4 Ablaufende Redoxreaktion der <strong>Fehling</strong>-Probe<br />
OH<br />
O<br />
H<br />
H<br />
H<br />
OH<br />
*<br />
H OH<br />
�-D-<strong>Glucose</strong><br />
36,4<br />
O<br />
H OH<br />
HO H<br />
H OH<br />
H OH<br />
OH<br />
Aldehydform<br />
0,003 %<br />
O<br />
OH<br />
rot<br />
+ H +<br />
2 +<br />
R<br />
2 e-<br />
OH<br />
HO<br />
H<br />
HO<br />
OH<br />
O<br />
H<br />
H<br />
OH<br />
*<br />
OH<br />
H H<br />
�-D-<strong>Glucose</strong><br />
63,6 %<br />
5
<strong>Versuchsprotokoll</strong>: <strong>Fehling</strong>-<strong>Glucose</strong><br />
Wie in Abb. 5 zu erkennen ist, kommt in Lösung auch das offenkettige Aldehyd zu einem<br />
geringen Anteil von 0,003 % vor. Dieser geringe Anteil an offenkettiger <strong>Glucose</strong> reicht für<br />
den positiven <strong>Fehling</strong>-Nachweis von <strong>Glucose</strong> aus, da nach der Oxidation dieses Aldehyds<br />
zur Carbonsäure nach dem Prinzip von Le Chatelier weitere ringförmige <strong>Glucose</strong> in die of-<br />
fenkettige Aldehydform übergeht.<br />
Der Mechanismus, nach der die ringförmige <strong>Glucose</strong> gebildet wird, ist der einer reversiblen<br />
cyclischen Halbacetalbildung. 5<br />
H<br />
H<br />
OH<br />
HO<br />
OH<br />
H<br />
H OH<br />
D-<strong>Glucose</strong><br />
(1)<br />
(2)<br />
OH<br />
H<br />
O<br />
H<br />
H<br />
OH<br />
HO<br />
Abb.6 Cyclische Halbacetalbildung am Beispiel <strong>Glucose</strong><br />
5 Bruice, P.Y. (2007) S. 935<br />
H +<br />
+<br />
OH H<br />
H<br />
H OH<br />
H<br />
H<br />
OH<br />
HO<br />
OH<br />
H<br />
H<br />
H OH<br />
H<br />
H<br />
OH<br />
HO<br />
OH<br />
O +<br />
OH H H<br />
O OH<br />
H<br />
OH H<br />
H<br />
HO<br />
H<br />
+<br />
-<br />
* *<br />
OH<br />
OH<br />
H<br />
H OH<br />
OH<br />
H<br />
O +<br />
H OH<br />
H +<br />
O -<br />
+<br />
H<br />
H<br />
O H<br />
*<br />
H<br />
OH H *<br />
HO<br />
H<br />
�-D-<strong>Glucose</strong><br />
H<br />
H<br />
OH<br />
HO<br />
OH<br />
H OH<br />
�-D-<strong>Glucose</strong><br />
H OH<br />
OH<br />
OH<br />
(2)<br />
(1)<br />
C +<br />
OH<br />
H<br />
H<br />
OH<br />
6
<strong>Versuchsprotokoll</strong>: <strong>Fehling</strong>-<strong>Glucose</strong><br />
Abb.6 zeigt, dass der nucleophile Angriff des Sauerstoffatoms von zwei Seiten erfolgen<br />
kann, wodurch sowohl α- als auch β-D-<strong>Glucose</strong> entstehen kann.<br />
Diese zyklischen Halbacetale sind stabiler als die Hydroxycarbonylverbindungen, aus denen<br />
sie gebildet wurden. Trotzdem handelt es sich bei der Bildung von intramolekularen Halb-<br />
acetalen, wie oben beschrieben, um eine Gleichgewichtsreaktion, weshalb der Zucker zu<br />
einem kleinen Anteil auch in der offenkettigen Form vorliegt.<br />
In der Reaktion mit dem <strong>Fehling</strong>-Reagenz wird nun diese offenkettige Form der <strong>Glucose</strong> zur<br />
Gluconsäure oxidiert (Abb.7).<br />
Didaktische Auswertung:<br />
Einordnung in den Lehrplan:<br />
Im Lehrplan ist dieser Versuch in der Qualifikationsphase im Bereich „Kohlenstoffchemie II:<br />
Technisch und biologisch wichtige Kohlenstoffverbindungen“ einzuordnen. In diesem Bereich<br />
ist das Thema Kohlenhydrate ein genannter Schwerpunkt. Unter anderem soll auch auf<br />
Nachweisreaktionen der Kohlenhydrate eingegangen werden.<br />
Die <strong>Fehling</strong>-Probe könnte schon im Bereich „Kohlenstoffchemie I: Kohlenstoffverbindungen<br />
und funktionelle Gruppen“ beim Thema Carbonylverbindungen/Alkanale behandelt werden.<br />
Zum Verständnis dieser Nachweisreaktion ist das Verstehen von Redoxreaktionen, die in der<br />
Einführungsphase E1 als fakultativer Unterrichtsinhalt behandelt werden, Voraussetzung.<br />
Einordnung des Versuchs:<br />
+I O<br />
HO<br />
+III<br />
H OH<br />
HO H<br />
H OH<br />
H OH<br />
OH<br />
Der apparative Aufwand dieses Versuchs ist relativ gering, die Durchführung ist einfach und<br />
auch die verwendeten Chemikalien müssten an der Schule vorhanden sein. Laut „Hess-<br />
Giss“-Datenbank dürfen alle verwendeten Chemikalien uneingeschränkt von den Schülern<br />
O<br />
H OH<br />
HO H<br />
H OH<br />
H OH<br />
Abb. 7 Oxidation der <strong>Glucose</strong> zur Gluconsäure<br />
OH<br />
+ 2 e-<br />
7
<strong>Versuchsprotokoll</strong>: <strong>Fehling</strong>-<strong>Glucose</strong><br />
verwendet werden, so dass dieser Versuch auch als Schülerversuch durchgeführt werden<br />
kann.<br />
Mit diesem Versuch der <strong>Fehling</strong>-Probe an dem Monosaccharid <strong>Glucose</strong> kann für die Schüler<br />
eine Brücke zwischen einem Nachweis einer bekannten funktionellen Gruppe, den Aldehy-<br />
den und dem „neuen“ Stoff <strong>Glucose</strong> geschlagen werden. So kann anhand dieses Versuchs<br />
die Struktur von Zuckermolekülen erarbeitet werden. Des Weiteren kann anhand dieses Ver-<br />
suchs das Thema Redoxchemie wiederholt und gefestigt werden.<br />
Literaturangaben:<br />
Bruice, P.Y. (2007). Organische Chemie (5. Auflage). München: Pearson Education<br />
Deutschland GmbH.<br />
Mortimer C.E. & Müller U. (2003). Das Basiswissen der Chemie (8. Auflage). Stuttgart:<br />
Georg Thieme Verlag.<br />
Vollhardt, K.P.C. & Schore, N.E. (2005). Organische Chemie (4. Auflage). Weinheim: Wiley-<br />
VCH GmbH & Co KGaA.<br />
Elektronische Quellen:<br />
Hessisches Gefahrstoffinfomationssystem Schule „HessGISS“- 2008/2009, Version 13.0<br />
Abbildungsverzeichnis:<br />
Alle Abbildungen dieses Protokolls wurden selbst angefertigt.<br />
.<br />
8