GIÁO TRÌNH HÓA VÔ CƠ 12 (ÔN TẬP) - GV: LÊ THỊ THU HÀ
https://app.box.com/s/6931t6ce29ybbglpydr4y28pu058daax
https://app.box.com/s/6931t6ce29ybbglpydr4y28pu058daax
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Ấ ẠO G Ử - Ệ G Ầ OÀ – LI KẾ ÓA Ọ<br />
A. CẤU TẠO NGUYÊN TỬ<br />
I.T À Ầ Ấ ẠO ỦA G Ử<br />
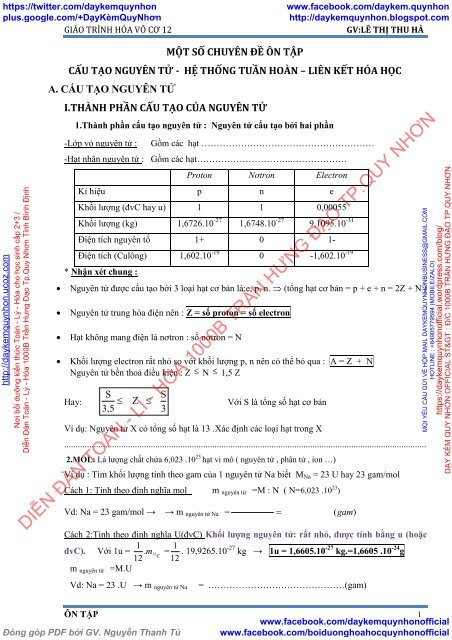
1.Thành phần cấu tạo nguyên tử : Nguyên tử cấu tạo bởi hai phần<br />
-Lớp vỏ nguyên tử :<br />
Gồm các hạt …………………………………………………<br />
-Hạt nhân nguyên tử : Gồm các hạt…………………………..………………<br />
Proton Nơtron Electron<br />
Kí hiệu p n e<br />
Khối lượng (đvC hay u) 1 1 0,00055<br />
Khối lượng (kg) 1,6726.10 -27 1,6748.10 -27 9,1095.10 -31<br />
Điện tích nguyên tố 1+ 0 1-<br />
Điện tích (Culông) 1,602.10 -19 0 -1,602.10 -19<br />
* Nhận xét chung :<br />
Nguyên tử được cấu tạo bởi 3 loại hạt cơ bản là:e, p, n. (tổng hạt cơ bản = p + e + n = 2Z + N )<br />
<br />
<br />
<br />
Nguyên tử trung hòa điện nên : Z = số proton = số electron<br />
Hạt không mang điện là nơtron : số nơtron = N<br />
Khối lượng electron rất nhỏ so với khối lượng p, n nên có thể bỏ qua : A = Z + N<br />
Nguyên tử bền thoả điều kiện : Z N 1,5 Z<br />
Hay:<br />
S S<br />
Z Với S là tổng số hạt cơ bản<br />
3,5 3<br />
Ví dụ: Nguyên tử X có tổng số hạt là 13 .Xác định các loại hạt trong X<br />
...............................................................................................................................................................<br />
2.MOL: Là lượng chất chứa 6,023 .10 23 hạt vi mô ( nguyên tử , phân tử , ion …)<br />
Ví dụ : Tìm khối lượng tính theo gam của 1 nguyên tử Na biết M Na = 23 U hay 23 gam/mol<br />
Cách 1: Tính theo định nghĩa mol m nguyên tử =M : N ( N=6,023 .10 23 )<br />
Vd: Na = 23 gam/mol → → m nguyên tử Na = <br />
( gam)<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Cách 2:Tính theo định nghĩa U(đvC) Khối lượng nguyên tử: rất nhỏ, được tính bằng u (hoặc<br />
1<br />
đvC). Với 1u = . m <strong>12</strong> = 1<br />
C<br />
<strong>12</strong> <strong>12</strong> . 19,9265.10-27 kg → 1u = 1,6605.10 -27 kg.=1,6605 .10 -24 g<br />
=M.U<br />
m nguyên tử<br />
Vd: Na = 23 .U → m nguyên tử Na<br />
= ………………………………………(gam)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
<strong>ÔN</strong> <strong>TẬP</strong> 1<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Cách tính bán kính th c của m t nguyên tử dạng khối c u :<br />
- Bán kính 1 nguyên tử: V =<br />
4<br />
3 π R3 => R = 3V 3 4<br />
M<br />
-1 nguyên tử nặng gam m<br />
nt<br />
(gam) (N= 6,023.10 23 ; M là nguyên tử lượng)<br />
N<br />
V m => V= Hay V=<br />
D<br />
Th c tế, nguyên tử cấu tạo rỗng, ph n tinh thể chỉ chiếm a%. Nên :<br />
a%.V =<br />
4<br />
3 M a%<br />
3 π R3 => R = 3 4 π N D<br />
1A° = 10 -8 cm = 10 -10 m<br />
3 M U a%<br />
3<br />
(cm) Hay R =<br />
4 π D (cm)<br />
Ví dụ : Ở 20 0 C , khối lượng riêng của Fe là 7,85 g/cm 3 .Giả thiết trong tinh thể,các nguyên tử Fe là<br />
những hình c u chiếm 75% thể tích tinh thể,ph n còn lại là các khe rỗng, khối lượng nguyên tử của<br />
Fe là 55,85 đvC hay 55,85g/mol thì bán kính g n đúng của m t nguyên tử Fe ở nhiệt đ này là bao<br />
nhiêu ?<br />
3<br />
0<br />
R = =.........................(cm) =.............(A )<br />
3. Ký hiệu nguyên tử : để biểu diễn nguyên tử :<br />
A: số khối Z: số hiệu nguyên tử X: kí hiệu hóa học của nguyên tố<br />
27<br />
Ví dụ: Nhôm có ký hiệu nguyên tử là Al Al có Số p =……Số n =……Số e =………<br />
13<br />
Số khối A =………Điện tích hạt nhân Z+ =……………Số đơn vị điện tích hạt nhân Z= ………<br />
II. NGUYÊN TỐ <strong>HÓA</strong> HỌC & ĐỒNG VỊ<br />
1. Nguyên tố hóa học : Là tập hợp các nguyên tử có cùng ………………………………<br />
2. Đồng vị : Những nguyên tử có cùng số hạt………., khác số hạt……… gọi là những đồng vị.<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
3. Tính khối lượng nguyên tử trung bình<br />
Nếu A1 , A2 , A3 là số khối của mỗi đồng vị.<br />
x 1 , x 2 , x 3 là tỷ lệ số nguyên tử hay % số nguyên tử tương ứng mỗi đồng vị<br />
x1A 1+x2A 2+x3A 3<br />
...<br />
Thì : KLNT trung bình M=<br />
x + x + x ...<br />
1 2 3<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2 <strong>ÔN</strong> <strong>TẬP</strong><br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Vd: Clo có 2 đồng vị tìm nguyên tử lượng trung bìnhcủa Clo<br />
37<br />
<br />
17Cl<br />
x1<br />
25%<br />
<br />
M =<br />
35<br />
17Cl<br />
x2<br />
75%<br />
Vd: : Trong t nhiên, nguyên tố đồng có hai đồng vị là 63<br />
a) Tìm nguyên tử khối trung bình của đồng<br />
b) Tìm % khối lượng đồng vị<br />
63<br />
29 Cu có trong Cu 2 O<br />
29 Cu (chiếm 27% về số lương) ) và 65<br />
29 Cu .<br />
..................................................................................................................................................................................<br />
..................................................................................................................................................................................<br />
..................................................................................................................................................................................<br />
..................................................................................................................................................................................<br />
..................................................................................................................................................................................<br />
III. CẤU TRÚC ELECTRON TRONG VỎ NGUYÊN TỬ<br />
Cấu hình electron của nguyên tử Là cách biểu diễn s phân bố electron trên các lớp và phân lớp.<br />
* Nguyên lí vững bền: ở trạng thái cơ bản, trong nguyên tử các electron chiếm l n lượt các obitan<br />
có mức năng lượng từ thấp lên cao : 1s - 2s 2p - 3s 3p 4s 3d - 4p 5s 4d 5p - 6s …<br />
Cách nhớ trật t các mức năng lượng từ thấp đến cao theo quy t c Klescoski:<br />
Đọc các m i tên theo chiều từ trên uống và từ gốc đến ngọn .<br />
L p 1 K 2<br />
1s<br />
:<br />
L p 2<br />
L p<br />
L p 4<br />
L p 5<br />
L p 6<br />
L p 7<br />
2<br />
L 2s :<br />
2<br />
M 3s :<br />
2<br />
N 4s :<br />
2<br />
O 5s :<br />
2<br />
P 6s :<br />
2<br />
Q 7s :<br />
*Viết cấu hình electron theo các bước sau:<br />
<br />
2p<br />
3p<br />
4p<br />
5p<br />
6p<br />
7p<br />
Bư c 1:Viết theo thứ t mức năng lượng<br />
2 2 6 2 6 2 10 6 2 10 6 2 14 10 6 2 2<br />
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5s ...<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
<br />
Bư c 2: Nếu Z > 20 ếp lại theo thứ t lớp từ trong ra ngoài<br />
Bư c : M t số trư ng hợp đặc biệt ở các nguyên tố nhóm V B và B:<br />
6<br />
6<br />
6<br />
6<br />
6<br />
6<br />
3d<br />
4d<br />
5d<br />
6d<br />
7d<br />
10<br />
10<br />
10<br />
10<br />
10<br />
4f<br />
5f<br />
6f<br />
7f<br />
14<br />
14<br />
14<br />
14<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
<strong>ÔN</strong> <strong>TẬP</strong> 3<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
̉<br />
̉<br />
̀<br />
̀<br />
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
ạng<br />
n<br />
1 d ns<br />
4 2<br />
→<br />
n<br />
1 d ns<br />
5 1<br />
(Cơ cấu bán bảo hoà bền d 5 )<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Ví dụ: Viết cấu hình electron của Cr Z 24<br />
Theo mức năng lượng:<br />
Theo cấu hình electron:<br />
Chuyển về cấu hình electron đúng nhất:<br />
ạng<br />
n<br />
1 d ns<br />
9 2<br />
→<br />
Ví dụ: Viết cấu hình electron của Cu Z<br />
Theo mức năng lượng: Cu Z<br />
Theo cấu hình electron: Cu Z<br />
2 2 6 2 6 2 4<br />
Cr Z 24 : 1s 2s 2p 3s 3p 4s 3d .<br />
2 2 6 2 6 4 2<br />
Cr Z 24 : 1s 2s 2p 3s 3p 3d 4s .<br />
Chuyển về cấu hình electron đúng nhất: Cu Z<br />
2 2 6 2 6 5 1<br />
Cr Z 24 : 1s 2s 2p 3s 3p 3d 4s .<br />
0 1<br />
n 1 d ns<br />
( Cơ cấu bảo hoà bền d 10 )<br />
29 …………………………………………<br />
29 ……………………………………………………<br />
29 ……………………………………………………<br />
29 ……………………………………<br />
Có thể viết cấu hình thu gọn theo khí hiếm Ne(Z=10) Ar( = 18) Kr(Z-36)…<br />
Ví dụ: Al(Z=13): 1s 2 2s 2 2p 6 3s 2 3p 1 Hay: .................................................................<br />
K (Z=19): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 Hay: ........................................................................<br />
Fe(Z=26): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 Hay: ...................................................................<br />
Cr(Z=24): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1<br />
B. HỆ THỐNG TUẦN HOÀN<br />
I. Ị L Ầ OÀ<br />
Hay:....................................................<br />
«Tính chất các đơn chất cũng như dạng và tính chất của các hợp chất thay đổi tuần hoàn theo<br />
chiều tăng điện tích hạt nhân nguyên tử của các nguyên tố »<br />
II. G Ắ Ắ XẾ Á G RO G BẢ G HTTH<br />
Ba nguyên tắc<br />
* Các nguyên tố được s p ếp theo thứ t tăng d n của số điện tích hạt nhân Z.<br />
* Các nguyên tố có tính chất giống nhau (có cùng electron hoá trị) được ếp trong cùng m t c t.<br />
* Các nguyên tố có cùng số lớp vỏ nguyên tử ếp chung m t hàng gọi là chu kỳ Mỗi chu kỳ được<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
b t đ u bằng kim loại kiềm và kết thúc bằng khí trơ .(trừ chu kỳ 1)<br />
III. Ấ ẠO BẢ G Ầ OÀ<br />
1. Ô nguyên tố ố th t c a i nguyên tố bằng số hiệu nguyên tử c a nguyên tố đó.<br />
ô Z e p<br />
2. Chu kỳ Số th t chu kỳ = số l p electron<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
4 <strong>ÔN</strong> <strong>TẬP</strong><br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Chu kỳ I (chu kỳ đặc biệt) : có.............. nguyên tố họ s.<br />
Chu kỳ II, III (2 chu kỳ nhỏ) có ............ nguyên tố gồm ….. nguyên tố họ s và …. nguyên tố họ p.<br />
Chu kỳ IV, V (2 chu kỳ lớn) : có ........... nguyên tố gồm …… nguyên tố họ s, ….. nguyên tố họ p<br />
và…… nguyên tố họ d<br />
Chu kỳ VI (chu kỳ hoàn hảo): có 32 nguyên tố gồm … nguyên tố họ s, ….. nguyên tố họ p ……<br />
nguyên tố họ d và…….. nguyên tố họ f<br />
Chu kỳ VII (chu kỳ dở dang) gồm có 2 nguyên tố họ s, 14 nguyên tố họ f và m t số nguyên tố họ d.<br />
3. Nhóm<br />
Nhóm là c t dọc các nguyên tố có có số electron hóa trị giống nhau nên tính chất hóa học tương t<br />
nhau<br />
Mỗi nhóm được chia thành 2 phân nhóm :<br />
Phân nhóm chính (A): ( A→ V A)<br />
gồm các nguyên tố họ ………và họ………Có ………..phân nhóm chính(có ………c t)<br />
Phân nhóm phụ (B) : ( B→V B)<br />
gồm các nguyên tố họ ………và họ …….. . Có ……… phân nhóm phụ (có ………c t)<br />
(b t đ u từ chu kỳ…… có nguyên tố họ d, b t đ u từ chu kỳ ………. có nguyên tố họ f )<br />
4. C ch x c định vị trí nguyên tố trong HTTH<br />
Viết đúng cấu hình electron, từ đó suy ra vị trí của m t nguyên tố theo ba ý sau đây:<br />
a) ố th t nguyên tố = (bằng số proton trong hạt nhân và bằng số electron ở ph n vỏ).<br />
b) ố th t c a chu kì = số lớp electron.<br />
c) Số th t Nhó :<br />
*Nếu electron cuối cùng điền vào phân lớp s hoặc p thì thu c nhóm A. (nguyên tố họ s họ p)<br />
TT nhó<br />
A<br />
số electron l p ngoài c ng (đó c ng là số electron hóa trị).<br />
*Nếu electron cuối cùng điền vào phân lớp d thì thu c nhóm B.<br />
STT nhóm B c n d a vào tổng số electron ở hai phân lớp<br />
Nếu x y 8 thì số thứ t nhóm x y. Ví dụ : [Ar] 3d 3 4s 2 nhóm :………………………………<br />
Nếu x y 8,9,10 thu c nhóm V B Ví dụ : [Ar] 3d 6 4s 2 nhóm :………………………………<br />
Nếu x y 11 thu c nhóm B Ví dụ : [Ar] 3d 10 4s 1 nhóm :……………………………..<br />
Nếu x y <strong>12</strong> thu c nhóm B Ví dụ : [Ar] 3d 10 4s 2 nhóm :……………………………..<br />
Ví dụ: Viết cấu hình e ác định vị trí các nguyên tố sau trong HTTH:<br />
x y<br />
1 d ns<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Na(Z=11) .......................................................................................................................................<br />
<strong>ÔN</strong> <strong>TẬP</strong> 5<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
n<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
K(Z=19) ........................................................................................................................................<br />
Ca(Z=20) .......................................................................................................................................<br />
Al(Z=13) .......................................................................................................................................<br />
Cl(Z=17) .......................................................................................................................................<br />
Br(Z=35) .......................................................................................................................................<br />
S(Z=16) .........................................................................................................................................<br />
O(Z=8) ..........................................................................................................................................<br />
P(Z=15) .........................................................................................................................................<br />
N(Z=7) ..........................................................................................................................................<br />
Si(Z=14) ........................................................................................................................................<br />
C (Z=6)..........................................................................................................................................<br />
Fe(Z=26) .......................................................................................................................................<br />
Fe 3+ (Z=26) ....................................................................................................................................<br />
Cr(Z=24) .......................................................................................................................................<br />
Cr 2+ (Z=24) ....................................................................................................................................<br />
Cu(Z=29).......................................................................................................................................<br />
Cu + (Z=29) .....................................................................................................................................<br />
III.BIẾN ĐỔI TUẦN HOÀN CÁC TÍNH CHẤT THEO CHU KÌ & NHÓM<br />
Khi Z<br />
Tăng<br />
Chu kì<br />
Nhóm<br />
O it cao<br />
nhất<br />
Hợp chất<br />
với hidro<br />
Hợp chất<br />
hidroxit<br />
Tính<br />
Kim loai<br />
Tính<br />
Phi kim<br />
Đ<br />
âm điện<br />
BKNT<br />
Hóa trị<br />
Với O i<br />
Oxit & hidroxit<br />
Axit<br />
IV. ông thức Oxit cao nhất và hợp chất khí với hydro<br />
IA IIA IIIA IVA VA VIA VIIA<br />
RO RO<br />
2<br />
2 3<br />
RH<br />
ră n<br />
ROH<br />
RH<br />
ră n<br />
2<br />
R OH<br />
2<br />
RO<br />
2<br />
RH<br />
ră n<br />
3<br />
R OH H RO<br />
3<br />
2 3<br />
RO<br />
2 5<br />
RH<br />
4<br />
3<br />
RO<br />
3<br />
RH RH<br />
2<br />
(HNO )<br />
3<br />
H RO H RO<br />
2 4<br />
3 4<br />
Oxyt cao nhất: R 2 O n (n là số thứ t của nhóm A)<br />
Hợp chất khí v i hydro : RH có n + = 8<br />
Ba ơ<br />
RO RO<br />
2 7<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
RH<br />
HRO<br />
4<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
6 <strong>ÔN</strong> <strong>TẬP</strong><br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
%R 2M<br />
%R 2M<br />
R O <br />
= R vd :R O <br />
= R<br />
2 n %O 16n 2 3<br />
%O 16.3<br />
%R M<br />
%R M<br />
RH <br />
= R vd :RH <br />
= R<br />
m %H m 4<br />
%H 4<br />
Ví dụ 1: O it cao nhất của nguyên tố R có công thức RO 3 . Hợp chất khí của nó với hiđro có 5,88 %<br />
hiđro về khối lượng. Tìm R.<br />
...............................................................................................................................................................<br />
...............................................................................................................................................................<br />
Ví dụ 2: Hợp chất khí với hiđro của nguyên tố R là RH 4 . Trong o it cao nhất của R có 53,3 % o i<br />
về khối lượng. Tìm R.<br />
...............................................................................................................................................................<br />
...............................................................................................................................................................<br />
Ví dụ3: Nguyên tố R thu c nhóm VA. Tỉ lệ về khối lượng giữa hợp chất khí với hiđro và o it cao<br />
nhất của R là 17 : 71. Xác định tên R.<br />
........................................................................................................................................................................................<br />
........................................................................................................................................................................................<br />
.......................................................................................................................................................................................<br />
Định nghĩa<br />
Đặc điểm<br />
Liên kết<br />
Đặc điểm<br />
ng tố<br />
Đặc điểm<br />
hiệu số đ<br />
âm điện<br />
Mục đích<br />
liên kết<br />
Liên kết cộng ho trị<br />
LK CHT không c c LK CHT có c c<br />
C.LI KẾ OÁ Ọ<br />
Liên kết hóa học hình thành do các cặp<br />
electron chung<br />
Cặp e chung không<br />
bị lệch về phía nào<br />
Các nguyên tử phi<br />
kim giống nhau<br />
Ví dụ :<br />
H 2 ,Cl 2 ,N 2 ……<br />
Cặp e chung bị lệch về<br />
phía nguyên tử có đ<br />
âm điện lớn hơn<br />
Các nguyên tử phi kim<br />
khác nhau<br />
Ví dụ :<br />
HCl,NH 3 ,H 2 S….<br />
Liên kết ion<br />
Liên kết hình thành do l c hút tĩnh điện<br />
giữa 2 ion mang điện tích trái dấu<br />
KL ion dương + ne<br />
PK + me ion âm<br />
Hai ion trái dấu hút nhau<br />
Nguyên tử kim loại và nguyên tử phi<br />
kim điển hình<br />
Ví dụ :CaCl,CaBr 2 ,K 2 S…….<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
< 0,4 0,4 ≤ < 1,7 ≥ 1,7<br />
Các nguyên tử liên kết với nhau để đạt tới cấu trúc electron của khí hiếm g n nó nhất ,<br />
bền hơn cấu trúc của từng nguyên tử đứng riêng rẽ<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
<strong>ÔN</strong> <strong>TẬP</strong> 7<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
<br />
Liên kết phối trí:.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
Liên kết ki loại:..........................................................................................................................<br />
…………………………………………………………………………………………………………<br />
<br />
Liên kết hydro:................................................................................................................................<br />
…………………………………………………………………………………………………………<br />
(Chất tạo được liên kết hydro thư ng có nhiệt đ sôi cao hơn và tan nhiều trong nước hơn so với chất<br />
không tạo được liên kết hydro)<br />
Ví dụ : Viết CTCT của các hợp chất sau:<br />
SO 2 H 2 SO 4<br />
SO 3<br />
CO<br />
Cl 2 O 3<br />
Cl 2 O 7<br />
HNO 3<br />
H 3 PO 4<br />
HClO 4<br />
HClO<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
8 <strong>ÔN</strong> <strong>TẬP</strong><br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
 BẰ G ÓA Ọ - Ả Ứ G<br />
A. Ả Ứ G<br />
1. Kh i niệ<br />
o Tốc đ phản ứng là đại lượng đặc trưng cho đ biến thiên nồng đ của m t trong các chất<br />
tham gia phản ứng hoặc sản phẩm tạo thành trong m t đơn vị th i gian .<br />
o Công thức tính tốc đ trung bình của phản ứng :<br />
V=<br />
C<br />
t<br />
mol/(l.s) (V 0 ) t = th i gian sau (t 2 ) – th i gian đ u (t 1 )<br />
• Đối với chất tham gia (nồng đ giảm d n ) : C = Cđ u – C sau<br />
• Đối với chất sản phẩm (nồng đ tăng d n ) : C = Csau – C đ u<br />
Đối với phản ứng tổng quát dạng : a A + b B c C + d D<br />
V =<br />
<br />
C A<br />
at<br />
=<br />
<br />
C B<br />
bt<br />
=<br />
<br />
C C<br />
ct<br />
=<br />
<br />
C D<br />
dt<br />
Ví dụ : Cho phản ứng: A + 2B → C Nồng đ ban đ u của A là 0,8 mol/l, của B là 1 mol/l..Sau 10<br />
phút, nồng đ của B còn 0,6 mol/l. Tìm nồng đ mol/l của các chất sau 10 phút phản ứng .Tính<br />
tốc đ trung bình của pư theo A, theo B, theo C. pư<br />
A + 2B → C<br />
Bđ:..........................................................................................................................................................<br />
pư: .........................................................................................................................................................<br />
Sau 10 phút...........................................................................................................................................<br />
......................................................................................................................................................................<br />
......................................................................................................................................................................<br />
......................................................................................................................................................................<br />
2. C c yếu tố ảnh hưởng đến tốc độ phản ng<br />
o Ảnh hưởng của nồng độ : Tốc đ phản ứng tỉ lệ thuận với nồng đ các chất tham gia phản ứng<br />
.<br />
o Ảnh hưởng của áp suất : (Đối với phản ứng có chất khí tham gia ) : Khi áp suất tăng , tốc đ<br />
phản ứng tăng (hoặc ngược lại )<br />
o Ảnh hưởng của diện tích bề mặt : (Đối với phản ứng có chất r n tham gia) : Khi diện tích bề<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
mặt tăng , tốc đ phản ứng tăng .<br />
o Ảnh hưởng của chất xúc tác : Chất úc tác là chất làm tăng tốc đ phản ứng , nhưng không bị<br />
tiêu hao trong phản ứng<br />
o .Ảnh hưởng của nhiệt độ : khi nhiệt đ tăng , tốc đ phản ứng tăng (hoặc ngược lại ) .<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
<strong>ÔN</strong> <strong>TẬP</strong> 9<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Thông thường , khi tăng nhiệt đ lên 10 0 C thì tốc đ phản ứng tăng từ 2 đến 4 l n . Số l n tăng đó<br />
gọi là hệ số nhiệt đ ( ).<br />
(V 1 và V 2 là tốc đ phản ứng ở nhiệt đ t 1 và t 2 )<br />
Ví dụ : Khi tăng nhiệt đ từ 140 o C lên 180 o C thì tốc đ của phản ứng thay đổi như thế nào? Biết cứ<br />
tăng 10 o C thì tốc đ hản ứng tăng lên 2 l n<br />
Hệ số nhiệt : γ =................t 1 = ..............(ứng với V 1 ).......t 2 =.................... (ứng với V 2 )<br />
............................................................................................................................................................<br />
............................................................................................................................................................<br />
............................................................................................................................................................<br />
B. Â BẰ G ÓA Ọ<br />
1. hản ứng một chiều: Là phản ứng chỉ xảy ra theo một chiều xác định (không có chiều<br />
ngược lại)<br />
a A + b B c C + d D<br />
2.Phản ng thuận nghịch: Là phản ứng mà trong điều kiện ác định có thể đồng th i ảy ra<br />
theo hai chiều ngược nhau <br />
(chiều thuận và chiều nghịch )<br />
a A + b B<br />
(1)<br />
<br />
(2)<br />
c C + d D<br />
3.Cân bằng hóa học: Là trạng thái của hệ phản ứng thuận nghịch , tại đó tốc đ phản ứng<br />
thuận và nghịch bằng nhau và nồng đ các chất không thay đổi nữa . Cân bằng hóa học là<br />
m t cân bằng đ ng .<br />
4.Biểu th c vận tốc phản ng aA (k) + bB (k) cC(k) + dD (k)<br />
<br />
C<br />
<br />
D<br />
V K A B (1) Tốc đ của phản ứng thuận<br />
T<br />
T<br />
C<br />
<br />
<br />
D<br />
V K C D (2) Tốc đ của phản ứng nghịch<br />
N<br />
N<br />
Khi hệ đạt trạng thái cân bằng :<br />
k : Hằng số tốc đ của phản ứng.<br />
V T = V N<br />
Đối với hệ dị thể ,vận tốc pư chỉ phụ thu c nồng đô chất khí<br />
Ví dụ : C (R N ) + O 2 ( KH ) → CO 2(KH ) V = K .[ O 2 ]<br />
Ví dụ : Cho phản ứng thuận nghịch: 2SO 2 + O 2 2SO 3 .<br />
a/ Khi tăng nồng đ của SO 2 lên 2 l n thì V 1 tăng lên<br />
A. 8l n B. 2 l n C. 3 l n . 4 l n<br />
V 1 = K. SO<br />
2<br />
V<br />
V<br />
. O<br />
Khi tăng nồng đ của SO 2 lên 2 l n thì:<br />
2 2<br />
t2 t 1<br />
10<br />
<br />
V 2 = K. 2 2<br />
2<br />
1<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2 SO<br />
2<br />
. O 2 =2 V<br />
1<br />
= 4 V1<br />
(Tăng 4 l n)<br />
b/ Khi tăng thể tích bình gấp 2 l n thì V 1 giảm<br />
A. 2 l n B. 4 l n C. 6 l n . 8 l n<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
10 <strong>ÔN</strong> <strong>TẬP</strong><br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
5.Hằng số cân bằng c a phản ng thuận nghịch (K c ) :<br />
Đối với hệ phản ứng thuận nghịch đồng thể (hệ chỉ gồm chất khí hoăc chất tan trong dung dịch )<br />
tổng quát dạng :<br />
<br />
a A + b B<br />
(1)<br />
<br />
(2)<br />
V T = V N (1) = (2)<br />
K<br />
K T<br />
C K N<br />
(Trong đó A B,<br />
C<br />
,<br />
D<br />
= c<br />
<br />
d<br />
C D<br />
A a<br />
B b<br />
c C + d D<br />
, là nồng đ mol/l của các chất A , B , C , ở trạng thái cân bằng ) .<br />
Đối với hệ phản ứng thuận nghịch dị thể (hệ gồm chất r n và khí) hoặc (hệ gồm chất r n và chất<br />
tan trong dung dịch ) thì nồng đ của chất r n được coi là hằng số (không có trong biểu thức tính K )<br />
Thí dụ : C (r) + CO 2(k)<br />
CaCO 3(r)<br />
(1)<br />
(2)<br />
(1)<br />
2CO (k) K c = <br />
2<br />
CO<br />
(2)<br />
CO<br />
<br />
CaO (r) + CO 2(k) K c = [CO 2 ]<br />
Hằng số cân bằng của m t phản ứng ác định chỉ phụ thu c vào nhiệt đ .<br />
Đối với m t phản ứng ác định , nếu thay đổi hệ số các chất trong phản ứng thì giá trị hằng số<br />
cân bằng c ng thay đổi .<br />
Thí dụ : N 2(k) + 3H 2(k)<br />
1/2N 2(k) + 3/2 H 2(k)<br />
(1)<br />
<br />
(2)<br />
2 NH 3(k) Kc 1 =<br />
Kc 1 Kc 2 và Kc 1 = (Kc 2 ) 2<br />
2<br />
NH<br />
3<br />
<br />
N<br />
H<br />
3<br />
(1)<br />
NH 3(k) Kc 2 =<br />
NH<br />
3<br />
<br />
(2)<br />
2<br />
N<br />
1/<br />
H<br />
3 / 2<br />
6. chuyển dịch cân bằng hóa học<br />
a. Khái niệm : S chuyển dich cân bằng là s phá vỡ trạng thái cân bằng c để chuyển sang trạng<br />
thái cân bằng mới do các yếu tố bên ngoài (nồng đ , nhiệt đ , áp suất ) tác đ ng lên cân bằng .<br />
b. Nguyên lí chuyển dịch cân bằng (Lơ satơliê) : M t phản ứng thuận nghịch đang ở trạng thái cân<br />
bằng , khi chịu m t tác đ ng từ bên ngoài như biến đổi nồng đ , nhiệt đ , áp suất , cân bằng sẽ<br />
chuyển dịch theo chiều làm giảm tác đ ng bên ngoài đó .<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
c. Các yếu tố ảnh hưởng đến cân bằng hóa học<br />
‣ Ảnh hưởng của nồng độ<br />
o Khi tăng nồng đ m t chất , cân bằng chuyển dịch theo chiều làm giảm nồng đ chất đó<br />
o Khi giảm nồng đ m t chất , cân bằng chuyển dịch theo chiều làm tăng nồng đ chất đó<br />
<strong>ÔN</strong> <strong>TẬP</strong> 11<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
2<br />
2<br />
2<br />
2<br />
2<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
‣ Ảnh hưởng của nhiệt độ<br />
Đối với các phản ứng có hiệu ứng nhiệt : H 0<br />
: Là phản ứng thu nhiệt<br />
H 0 : Là phản ứng toả nhiệt<br />
Nếu phản ứng thuận là tỏa nhiệt thì phản ứng nghịch là phản ứng thu nhiệt (và ngược lại )<br />
Nh : TĂNG –<strong>THU</strong>-GIẢM –TOẢ<br />
Khi tăng nhiệt đ của hệ , cân bằng chuyển dịch theo chiều thu nhiệt ( H 0<br />
).<br />
Khi giả nhiệt đ của hệ , cân bằng chuyển dịch theo chiều tỏa nhiệt ( H 0<br />
).<br />
‣ Ảnh hưởng của Áp suất: (pư pha khí)<br />
o Khi tăng áp suất của hệ , cân bằng chuyển dịch theo chiều làm giảm tổng số mol phân tử khí .<br />
o Khi giảm áp suất của hệ , cân bằng chuyển dịch theo chiều làm tăng tổng số mol phân tử khí<br />
tử khí .<br />
Đối với hệ phản ứng thuận nghịch mà có số phân tử khí ở phản ứng thuận bằng số phân tử khí ở<br />
phản ứng nghịch , thì áp suất không làm chuyển dịch cân bằng .<br />
Ví dụ :<br />
0<br />
V2O 5,450 C<br />
2SO 2 (k) + O 2 (k) 2SO 3 (k) H = -198 KJ.<br />
Để nâng cao hiệu suất phản ứng tổng hợp SO 3 (phản ứng dịch chuyển chiều thuận) ta phải:<br />
Nồng đ :.............................................................................................................................................<br />
Áp suất:...............................................................................................................................................<br />
Nhiệt đ :...............................................................................................................................................<br />
‣ Ảnh hưởng của xúc tác:<br />
Chất úc tác không có tác dụng làm chuyển dịch cân bằng , nó làm tăng vận tốc pư thuận đồng<br />
th i làm tăng vận tốc phản ứng nghịch do đó chỉ có tác dụng làm cho phản ứng nhanh chóng đạt<br />
đến trạng thái cân bằng .<br />
Nh :<br />
III.Tính pH dung dịch:<br />
K C chỉ phụ thu c vào nồng đ , nhiệt đ , áp suất không phụ thu c vào xúc tác<br />
Tính pH dd axit mạnh, bazơ<br />
ạnh:<br />
C<strong>ÔN</strong>G THỨC<br />
pH = -lg [H + ]<br />
pOH = -lg [OH - ]<br />
[H + ].[OH - ] =<br />
pH + pOH =<br />
pH = a [H + ] = 10 -a<br />
pOH = b [OH - ] = 10 -b<br />
MÔ TRƯỜNG<br />
pH < 7 M i trường axit<br />
pH > 7 M i trường bazơ<br />
pH = 7 M i trường trung tính<br />
[H + ] càng l n pH càng nhỏ<br />
[OH - ] càng l n pH càng l n<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ví dụ 1 : pH = 3[H + ] = 10 -3 (mol/l)<br />
[OH - ] = 10 -4 (mol/l) pOH = 4 pH = 14 – 4 = 10<br />
<strong>12</strong> <strong>ÔN</strong> <strong>TẬP</strong><br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Ví dụ 2 :Tr n 250 ml dung dịch hỗn hợp gồm HCl 0,08M và H 2 SO 4 0,01M với dung dịch NaOH<br />
aM thu được 500 ml dung dịch có pH=<strong>12</strong>. Tính aM.<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
Ví dụ 3 : Tính thể tích dung dịch Ba(OH) 2 0,025M c n cho vào 100 ml dung dịch gồm HNO 3 và<br />
HCl có pH=1 để pH của hỗn hợp thu được bằng 2.<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
Ví dụ 4 : 20ml dd HCl có pH = 1 phải cho vào thêm bao nhiêu ml H 2 O thu được dd có pH =2<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
1- Tính pH c a dd axit yếu HA:<br />
pH = – 1 2 (lg K a + lgC a ) hoặc pH = –lg( C a )<br />
2- Tính pH c a dd bazo yếu BOH:<br />
pOH = – 1 2 (lg K b + lgC b ) hoặc pH = –lg( C b )<br />
(V i là độ điện li c a axit trong dung dịch.)<br />
Nh :<br />
Lưu ý: công th c này đúng khi C a không quá nhỏ (C a > 0,01M)<br />
3- Mối liên quan giữa C M , α, Ka<br />
<br />
<br />
pH+ pOH=14<br />
K a .K b = 10 -14<br />
<br />
2 CM<br />
K a 1 Nếu α
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
..................................................................................................................................................................<br />
..................................................................................................................................................................<br />
Ví dụ 5:Tính đ điện ly của a it HCOOH nếu dung dịch 0,46% (d=1g/ml) của ait có pH=3.<br />
..................................................................................................................................................................<br />
..................................................................................................................................................................<br />
..................................................................................................................................................................<br />
4-Tính pH c a dd h n hợp gồm axit yếu HA (C a )và muối NaA (C muối )( CT GẦN ĐÚNG)<br />
Ví dụ 6:<br />
(pK a = - lgK a )<br />
Cho dung dịch X chứa hỗn hợp gồm CH 3 COOH 0,1M và CH 3 COONa 0,1M.<br />
Biết ở 25 o C, Ka của CH 3 COOH là 1,75.10 -5<br />
X ở 25 o C là<br />
và bỏ qua s phân li của nước. Giá trị pH của dung dịch<br />
A. 2,88. B. 4,76. C. 1,00. D. 4,24.<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
..................................................................................................................................................................<br />
Ví dụ 7:<br />
của NH 3 là 1,75.10 -5<br />
K .C A<br />
pH lg a<br />
Cmuoi<br />
K .C B<br />
pOH lg B<br />
Cmuoi<br />
ung dịch X gồm NH 3 0,1M; NH 4 Cl 0,1M. pH của dd X có giá trị là: (cho K b<br />
) AD:CT tính pOH<br />
A. 9,24 B. 4,76 C. 8,8 D. 9,42<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
Ví dụ 8: Biết hằng số phân li a it của NH 4<br />
+<br />
là Ka = 5.10 -5 . ung dịch gồm NH 4 Cl 0,2M và NH 3<br />
0,1M có giá trị pH g n đúng nhất là bao nhiêu ? (Gợi ý K a .K b = 10 -14 )<br />
A. 1 B. 2 C. 4 D. 5<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
14 <strong>ÔN</strong> <strong>TẬP</strong><br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
huyên đề: ẠI ƯƠ G KI LOẠI<br />
BÀI: GIỚI IỆ G<br />
I.VỊ TRÍ CỦA KIM LOẠI TRONG BẢNG TUẦN HOÀN<br />
- Nhóm IA (trừ H), nhóm IIA và m t ph n của các nhóm IIIA(trừ B), VA, VA, V A.(Gồm các<br />
nguyên tố họ s họ p)<br />
- Các nhóm B (từ B đến V B). (Gồm các nguyên tố họ d )<br />
- Họ Lantan và Actini. (Gồm các nguyên tố họ )<br />
II.CẤU TẠO CỦA KIM LOẠI<br />
1.Cấu tạo nguyên tử<br />
Nguyên tử kim loại đều có ít electron ở lớp ngoài cùng (1, 2 hoặc 3e).<br />
Bán kính nguyên tử lớn,Năng lượng ion hoá nhỏ hơn so với các phi kim cùng chu kỳ<br />
2.Cấu tạo tinh thể<br />
cho e n<br />
M M ne<br />
Cation<br />
→ do đó đặc trưng của kim loại là tính khử<br />
Ở nhiệt đ thư ng, trừ Hg ở thể lỏng, còn các kim loại khác ở thể r n và có cấu tạo tinh thể.<br />
a)Mạng tinh thể lục phương :Be, Mg, Zn…<br />
Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và ba nguyên<br />
tử, ion nằm phía trong của hình lục giác.<br />
Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 74%,<br />
b)Mạng tinh thể lập phương tâ<br />
diện : Cu, Ag, Au, Al,…<br />
Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt<br />
của hình lập phương.<br />
Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 74%,<br />
M t ô mạng tinh thể có 4 nguyên tử do :<br />
8 đỉnh .1/8 nguyên tử = 1 nguyêntử<br />
6 mặt .1/2 nguyên tử = 3 nguyên tử<br />
c)Mạng tinh thể lập phương tâ<br />
khối : Li, Na, K, V, Mo,…<br />
Các nguyên tử,ion kim loại nằm trên các đỉnh và tâm của hình lập phương.<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiếm 68%,<br />
M t ô mạng tinh thể có 2 nguyên tử do :<br />
8 đỉnh .1/8 nguyên tử = 1 nguyêntử<br />
1 tâm . 1 nguyên tử = 1 nguyên tử<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
ĐẠI CƯƠNG KIM LOẠI 15<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
.Liên kết ki<br />
loại<br />
Là liên kết được hình thành do l c hút tĩnh điện giữa các nguyên tử , ion kim loại và các electron<br />
t do có trong mạng tinh thể kim loại<br />
III.TÍNH CHẤT VẬT LÝ CỦA KIM LOẠI<br />
1)Tính d o(dể d t ỏng) :<br />
Kim loại có tính dẻo là vì các ion dương trong mạng tinh thể kim loại có thể trượt lên nhau dễ dàng<br />
mà không tách r i nhau nh những electron t do chuyển đ ng dính kết chúng với nhau.<br />
2)Tính dẫn điện:<br />
Khi đặt m t hiệu điện thế vào hai đ u dây kim loại, những electron chuyển đ ng t do trong kim<br />
loại sẽ chuyển đ ng thành dòng có hướng từ c c âm đến c c dương, tạo thành dòng điện.<br />
Ở nhiệt đ càng cao thì tính dẫn điện của kim loại càng giảm do ở nhiệt đ cao, các ion dương dao<br />
đ ng mạnh cản trở dòng electron chuyển đ ng.<br />
)Tính dẫn nhiệt<br />
Các electron trong vùng nhiệt đ cao có đ ng năng lớn, chuyển đ ng hỗn loạn và nhanh chóng sang<br />
vùng có nhiệt đ thấp hơn, truyền năng lượng cho các ion dương ở vùng này nên nhiệt đ lan truyền<br />
được từ vùng này đến vùng khác trong khối kim loại.<br />
Thư ng các kim loại dẫn điện tốt c ng dẫn nhiệt tốt.<br />
4)Ánh kim<br />
Các electron t do trong tinh thể kim loại phản xạ h u hết những tia sáng nhìn thấy được, do đó kim<br />
loại có vẻ sáng lấp lánh gọi là ánh kim.<br />
Kết luận: Tính chất vật lí chung của kim loại gây nên bởi sự có mặt của các electron tự do trong<br />
mạng<br />
Những cái nhất của kim loại<br />
- Kim loại d o nhất là Au, sau đó đến Ag, Al, Cu, Sn,…<br />
- Kim loại dẫn điện, dẫn nhiệt tốt nhất là Ag, sau đó đến Cu, Au, Al, Fe,…<br />
- Kim loại có khối lượng riêng D < 5 gam/cm 3 là kim loại nhẹ, như : Na, Li, Mg, Al,…<br />
- Kim loại có khối lượng riêng D > 5 gam/cm 3 là kim loại nặng như :Cr,Fe,Zn, Pb, Ag, Hg,…<br />
- Kim loại nhẹ nhất là Li, kim loại nặng nhất là Os.<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
- Kim loại dễ nóng chảy nhất là Hg (-39 o C).<br />
- Kim loại khó nóng chảy nhất là W (3410 o C).<br />
- Kim loại mềm nhất là Cs, kim loại cứng nhất là Cr.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
16 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
1)Ki<br />
IV. Í Ấ OÁ Ọ G ỦA KI LOẠI : Í K Ử<br />
Tính chất hóa học chung của kim loại là tính khử (dể bị o y hoá):<br />
loại t c dụng phi ki<br />
M → M n+ + ne (n=1,2,3)<br />
Kim lọai khử phi kim thành ion âm, kim loại bị o i hóa thành ion dương<br />
Cu + Cl 2<br />
Al + O 2<br />
Al + S<br />
thấp hơn.<br />
Sn + Cl 2<br />
o<br />
t<br />
………………………… Fe + Cl 2<br />
o<br />
t<br />
…………………………. Fe + S<br />
o<br />
t<br />
…………………………. Hg + S<br />
o<br />
t<br />
……………………. Sn + O 2<br />
ĐẠI CƯƠNG KIM LOẠI 17<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
o<br />
t<br />
…………………………<br />
t<br />
o<br />
……………………………..<br />
t o thuong<br />
…………………..<br />
o<br />
t<br />
………………………….<br />
Các kim loại mạnh (Li → Al,Zn ) khử được N 2 , P ,C ,Si ở nhiệt đ cao:<br />
Zn + P<br />
Al + C<br />
Ca + C<br />
2)Ki<br />
o<br />
t<br />
………………………… Mg + N 2<br />
o<br />
t<br />
………………………. Al + Si<br />
o<br />
o<br />
t<br />
……………………… Li + N 2<br />
loại t c dụng axit<br />
Axit HCl,H 2 SO 4 loãng<br />
o<br />
t<br />
…………………………<br />
t<br />
……………………………<br />
tothuong<br />
……………………<br />
-Nhiều kim loại có thể khử được H + trong dung dịch HCl, H 2 SO 4 loãng thành hiđro t do:<br />
n<br />
2<br />
<br />
n<br />
M nH M H2<br />
-Các kim loại đứng sau H trong d y điện hóa như Cu Ag Hg…không thể khử được H +<br />
Ví dụ : Zn + 2HCl → ZnCl 2 + H 2 ption thu gọn: Zn + 2H + → Zn 2+ + H 2<br />
Axit có tính oxy ho<br />
ạnh (HNO 3 , H 2 SO 4 đặc)<br />
H u hết kim loại (trừ Au, Pt) khử được N +5<br />
<br />
của HNO 3 , khử được S<br />
6<br />
của H 2 SO 4 đặc đến số o i hóa<br />
KL+ H 2 SO 4 đặc → Muối + spk { O 2 (↓2) , (↓6), H 2 (↓8) } + H 2 O<br />
KL+ HNO 3 đặc → Muối + spk {NO 2 (↓1) , NO(↓ ), N 2 (↓10) , N 2 O(↓8) ,NH 4 NO 3 (↓8) } + H 2 O<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ví dụ:<br />
Cu + 4HNO 3 → Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O<br />
Zn + 2H 2 SO 4 đặc → ZnSO 4 + SO 2 + 2H 2 O<br />
2Fe + 6H 2 SO 4 đặc nóng→ Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
)Ki loại t c dụng H 2 O<br />
Ở nhiệt đ thư ng: Những kim loại khử mạnh như kim loại kiềm (Li,Na, K,Rb,Cs), kiềm thổ<br />
(Ca, Sr, Ba) khử nước dễ dành ở t o thư ng, tạo dung dịch kiềm.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
cao Ví dụ:<br />
M + 2nH 2 O → M(OH) n + n 2 H 2<br />
Ở nhiệt đ cao: M t số kim loại có tính khử trung bình (Fe, Zn…) khử được hơi nước ở nhiệt đ<br />
3Fe nóng đỏ + 4H 2 O hơi<br />
o o<br />
t < 570 C<br />
Fe 3 O 4 + 4H 2<br />
Những kim loại có tính khử yếu (Cu, Ag, Hg,…) không khử được nước, dù ở nhiệt đ cao<br />
4)Ki loại t c dụng dd uối<br />
-Trừ kim loại kiềm, kiềm thổ, các kim loại khác có thể khử được ion của kim loại khác trong dung<br />
dịch thành kim loại t do<br />
Ví dụ: Fe + CuSO 4 → FeSO 4 + Cu ption thu gọn:…………………………………<br />
Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag ption thu gọn:…………………………………<br />
-Nếu là kim loại kiềm hay kiềm thổ (K,Na,Ca,Ba,Li…) thì kim loại pư với H 2 O trước tạo dd kiềm<br />
sau đó dd kiềm pư với dd muối.<br />
Ví dụ: Cho K vào dd Al 2 (SO 4 ) 3 xảy ra các pư sau<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………..<br />
5)Ki<br />
loại t c dụng dd kiề<br />
Ví dụ: 2Al + 2NaOH + 2H 2 O → 2NaAlO 2 + 3H 2 → ption thu gọn:…………………………….<br />
Zn + 2NaOH → Na 2 ZnO 2 + H 2 → ption thu gọn:…………………………….<br />
C c chú ý quan trọng:<br />
1. Với kim loại có nhiều hóa trị (như Fe, Cr), nếu dùng dư axit sẽ tạo muối hóa trị 3 của kim loại (Fe 3+ , Cr 3+ ); nếu<br />
axit dùng thiếu, dư kim loại sẽ tạo muối hóa trị 2 (Fe 2+ , Cr 2+ ), hoặc có thể tạo đồng th i 2 loại muối.<br />
Fe + Fe 2 (SO 4 ) 3 → 3FeSO 4<br />
Fe + 2Fe (NO 3 ) 3 → 3Fe (NO 3 ) 2<br />
Fe + 2Fe 3+ → 3Fe 2+<br />
Vd1: Tính số mol HNO 3 tối thiểu có thể hoà tan hết 5,6 gam Fe biết sau pư tạo khí NO<br />
………………………………………………………………………………………………………………<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
………………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………….<br />
Vd2: m gam hổn hợp Fe và Cu tác dụng với V litdd HNO 3 2M sau pư thu được 2,4 gam hổn hơp 2 kim<br />
loại và 2,24lít khí NO(đkc).Tìm V và m.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
18 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………..<br />
Vd3:Cho Fe tác dụng hết với H 2 SO 4 đặc nóng thu được khí A và 11,04 gam muối.Tính số gam Fe pư biết<br />
rằng số mol Fe pư bằng 37,5% số mol H 2 SO 4 phản ứng<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………..<br />
2. Nhiều kim loại tác dụng dd a it thì kim loại có tính khử mạnh hơn ưu tiên pư trước<br />
Vd4: Cho hổn hợp Mg và Fe tác dụng dd HCl<br />
vì tính khử Mg > Fe nên Mg pư trước khi Mg pư hết thì Fe mới phản ứng<br />
3. Au,Pt,Al,Fe,Cr không tác dụng HNO 3 đặc ngu i,H 2 SO 4 đặc ngu i<br />
4. Au tan được trong nước cư ng toan (3V HCl :1V HNO3 )<br />
Au + 3HCl + 1HNO 3 → ……………+ NO + ………………………………………..<br />
5. Kim loại có tính khử càng mạnh thì khử càng sâu tức là tạo sản phẩm khử có số o y hoá càng thấp<br />
Thông thư ng chỉ có những kim loại mạnh như Al,Zn ,Mg mới có thể tạo các sản phẩm khử như N 2,<br />
N 2 O , NH 4 NO 3 .<br />
6. Kim loại tan trong nước (Na, K, Ba, Ca,…) tác dụng với dd a it chứa H + : có 2 trư ng hợp<br />
- Nếu dung dịch a it dùng dư: chỉ có phản ứng của kim loại với axit<br />
- Nếu axit thiếu thì ngoài phản ứng giữa kim loại với axit (xảy ra trước) còn có phản ứng kim loại dư tác<br />
dụng với nước trong dung dịch<br />
Vd5: 3,9 gam K tác dụng 100 ml dd H 2 SO 4 0,1M .Tính V khí H 2 thoát ra ở đkc và khối lượng chất tan có<br />
trong dd sau phản ứng<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………..<br />
7. Tính o y hoá của ion NO 3<br />
:<br />
Trong môi trư ng trung tính ion NO <br />
3<br />
không có tính oxy hoá<br />
Trong môi trư ng ba o ion NO 3<br />
có tính o y hoá yếu tác dụng được với Al,Zn tạo spk là NH 3<br />
…Al + … NO 3<br />
+ … OH + ……… → … AlO 2<br />
+ … NH 3 (Tăng 3-giảm 8)<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
…Zn + … NO 3<br />
+ … OH →…<br />
Trong môi trư ng a it ion NO 3<br />
có tính o y hoá mạnh :<br />
2<br />
ZnO 2<br />
+ … NH 3 + …………… (Tăng 2-giảm 8)<br />
…Cu + …H + + … NO 3<br />
→ … Cu 2<br />
+ …NO + …H 2 O (Tăng 2-giảm 3)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
ĐẠI CƯƠNG KIM LOẠI 19<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Vd6: Cho hỗn hợp gồm 1,<strong>12</strong> gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm<br />
H 2 SO 4 0,5M và NaNO 3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí<br />
NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu<br />
được là lớn nhất. Giá trị tối thiểu của V là:<br />
A. 360 ml B. 240 ml C. 400 ml D. <strong>12</strong>0 ml<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
8. Khi cho các kim loại mạnh như Al,Zn,Mg…tác dụng HNO 3 sau pư ngoài sản phẩm khử là khí có thể<br />
có NH 4 NO 3 trong dung dịch ( đề cho dư dữ kiện hoăc n e cho > n e nhận để tạo khí hoặc dd sau pư tác<br />
dụng dd kiềm tạo khí)<br />
Vd7: Cho 2,16g Mg tác dụng với dd HNO 3 dư, sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít<br />
khí NO (đkc) và dung dịch X .Tính khối lượng muối khan thu được khi làm bay hơi dung dịch X?<br />
……………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………..<br />
……………………………………………………………………………………………………………<br />
Vd8: .Hoà tan hoàn toàn 13,92 gam Mg vào dung dịch HNO 3 thu được dung dịch A và 1,344 lít hỗn<br />
hợp khí X gồm N 2 và N 2 O (ở 0 0 C, 2 atm). Thêm m t lượng dư KOH vào dung dịch A, đun nóng thì<br />
có 0,224 lit khí thoát ra ở đkc Tính % thể tích mỗi khí trong hỗn hợp X?<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
Công th c giải nhanh : Kim loại tác dụng HNO 3 ,H 2 SO 4 đặc<br />
1. Kim loại tác dụng HNO 3<br />
- Khi cho Kim loại tác dụng HNO 3 ta c n nhớ các bán phản ứng sau:<br />
HNO + e NO<br />
-<br />
+ NO + H O (giam )<br />
3 3 2 2<br />
HNO + e NO<br />
-<br />
+ NO + H O (giam )<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
3 3 2<br />
HNO + e NO<br />
-<br />
+ N O + H O (giam )<br />
3 3 2 2<br />
HNO + e NO<br />
-<br />
+ N + H O (giam )<br />
3 3 2 2<br />
HNO + e NO<br />
-<br />
+ NH NO + H O (giam )<br />
3 3 4 3 2<br />
Từ đó ta có công thức sau:<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
20 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
Sản phẩm khử NO 2 NO N 2 O N 2 NH 4 NO 3<br />
n 2n NO2 4n NO 10n N2 O <strong>12</strong>n N2 10n NH4 NO<br />
HNO 3<br />
3<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
n n NO2 3n NO 8n N2 O 10n N2 8n NH4 NO 3<br />
NO<br />
-<br />
3<br />
n e = n NO3 - (trong muối)<br />
m muối = m kim loại + 62n NO3 - (trong muối)<br />
-Nếu hỗn hợp gồm cả kim loại và o it kim loại phản ứng với HNO 3 (và giả sử tạo ra khí NO) thì:<br />
n HNO3 (pư) = 4n NO + 2n O (trong oxit KL)<br />
Do O (trong oxit KL) + 2HNO 3 → H 2 O<br />
2. Kim loại tác dụng H 2 SO 4 đặc<br />
2<br />
H SO + e SO<br />
-<br />
+ SO + H O (giam )<br />
2 4 4 2 2<br />
H SO + e SO<br />
-<br />
+ S + H O (giam )<br />
2<br />
2 4 4 2<br />
H SO + e SO<br />
-<br />
+ H S + H O (giam )<br />
2<br />
2 4 4 2 2<br />
Sản phẩm khử SO 2 S H 2 S<br />
n 2n SO2 4n S 5n H2 S<br />
H SO<br />
2 4<br />
n n SO2 3n S 4n H2 S<br />
SO<br />
2-<br />
4<br />
n e = 2n SO4<br />
2-(trong muối)<br />
m muối = m kim loại + 96 n SO4<br />
2-(trong muối)<br />
-Nếu hỗn hợp gồm cả kim loại và o it kim loại phản ứng với HNO 3 (và giả sử tạo ra khí SO 2 ) thì:<br />
n<br />
H SO<br />
2 4<br />
= 2n SO2 + n O (trong oxit KL)<br />
Do O (trong oxit KL) + H 2 SO 4 → H 2 O<br />
Vd1 : Cho 4,8 g m t kim loại R hóa trị tan hoàn toàn trong dung dịch HNO 3 lo ng thu được 1,<strong>12</strong> lít khí<br />
NO duy nhất (đktc). Kim loại R là<br />
A. Zn.<br />
C. Fe.<br />
B. Mg.<br />
D. Cu.<br />
Vd2 : Cho 3,2 g Cu tác dụng với dung dịch HNO 3 đặc, dư thì thể tích khí NO 2 (đktc) thu được là<br />
A. 1,<strong>12</strong> lít.<br />
C. 3,36 lít.<br />
B. 2,24 lít.<br />
D. 4,48 lít.<br />
Vd3 : Cho 21,6 g m t kim loại chưa biết hóa trị tác dụng hết với dung dịch HNO 3 lo ng thu được 6,72 lít<br />
N 2 O duy nhất (đktc). Kim loại đó là<br />
A. Na.<br />
C. Mg.<br />
B. Zn.<br />
D. Al.<br />
Vd4 : Cho 2,4 g Mg tác dụng với dung dịch HNO 3 lo ng, dư thì thu được a gam Mg(NO 3 ) 2 và b gam<br />
NH 4 NO 3 . Giá trị (a+b) là<br />
A. 14,80 B. 16,80<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
ĐẠI CƯƠNG KIM LOẠI 21<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
C. <strong>12</strong>,80 D. 8,40<br />
Vd5 :Hòa tan m gam Al vào dd HNO 3 rất lo ng chỉ thu được hỗn hợp khí gồm 0,015 mol N 2 O và 0,01<br />
mol NO. Giá trị m là<br />
A. 13,5 g.<br />
B. 1,35 g.<br />
C. 0,81 g.<br />
D. 8,1 g.<br />
Vd6 :Cho 3,445g Cu, Zn, Al tác dụng với HNO 3 (lo ng, dư) thu được 1,<strong>12</strong> lít NO (đktc, sản phẩm khử<br />
duy nhất) và a gam muối. Giá trị của a là<br />
A. <strong>12</strong>,745<br />
B. 11,745<br />
C. 13,745<br />
D. 10,745<br />
Vd7 :Cho 3,2 g Cu tác dụng với dung dịch H 2 SO 4 đặc nóng, dư thì thể tích khí SO 2 (đktc) thu được là<br />
A. 1,<strong>12</strong> lít.<br />
C. 3,36 lít.<br />
B. 2,24 lít.<br />
D. 4,48 lít.<br />
Vd8 :Hòa tan hoàn toàn 1,84 gam hỗn hợp Fe và Mg trong lượng dư dung dịch HNO 3 thấy thoát ra<br />
0,04 mol khí NO duy nhất. Số mol Fe và Mg trong hỗn hợp l n lượt là<br />
A. 0,01 và 0,01.<br />
C. 0,02 và 0,03.<br />
B. 0,03 và 0,03.<br />
D. 0,03 và 0,02.<br />
Vd9 :Hòa tan hết hỗn hợp A gồm mol Fe và y mol Ag bằng dung dịch hỗn hợp HNO 3 và H 2 SO 4 , có<br />
0,062 mol khí NO và 0,047 mol SO 2 thoát ra. Đem cô cạn dung dịch sau phản ứng thì thu được<br />
22,164 gam hỗn hợp các muối khan. Trị số của x và y là:<br />
A.x = 0,07; y = 0,02<br />
B. x = 0,08; y = 0,03<br />
C. x = 0,09; y = 0,01<br />
D.x = 0,<strong>12</strong>; y = 0,02<br />
Vd10 :Hòa tan Fe trong HNO 3 dư thấy sinh ra hỗn hợp khí gồm 0,03 mol NO 2 và 0,02 mol NO. Khối<br />
lượng Fe bị hòa tan là<br />
A. 0,56 gam.<br />
C. 1,68 gam.<br />
B. 1,<strong>12</strong> gam.<br />
D. 2,24 gam.<br />
Vd11 :Hoà tan hoàn toàn m gam hỗn hợp X (Cu, Ag) trong dung dịch chứa HNO 3 và H 2 SO 4 thu được<br />
dung dịch Y chứa 7,06 gam muối và hỗn hợp khí Z chứa 0,05 mol NO 2 và 0,01 mol SO 2 . Giá trị<br />
của m là?<br />
...........................................................................................................................................................<br />
...........................................................................................................................................................<br />
Vd<strong>12</strong> :Cho <strong>12</strong>,9 gam hỗn hợp Al và Mg phản ứng với 100 ml dung dịch hỗn hợp HNO 3 và H 2 SO 4 thu<br />
được 0,1 mol mối khí SO 2 , NO, N 2 O. Cô cạn dung dịch thu được sau phản ứng được bao nhiêu<br />
gam muối khan?<br />
...........................................................................................................................................................<br />
...........................................................................................................................................................<br />
Vd13 :Hòa tan hoàn toàn 8g hỗn hợp kim loại bằng dung dịch HNO 3 dư thu được hỗn hợp sản phẩm<br />
khử gồm 0,1mol NO và 0,2 mol NO 2 ,0,1 mol NH 4 NO 3 .Tìm gam muối và số mol axit phản ứng<br />
..........................................................................................................................................................<br />
...............................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Vd14 :Cho tan hoàn toàn 60g hỗn hợp A gồm Zn,Al,trong dung dịch H 2 SO 4 đặc thu được 0,15 mol<br />
SO 2 0,05mol H 2 S Tìm gam muối và số mol axit phản ứng<br />
..........................................................................................................................................................<br />
...............................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
22 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Vd15 :<br />
(ĐH2015)Cho 7,65 gam hỗn hợp X gồm Al và Al 2 O 3 (trong đó Al chiếm 60% khối lượng) tan<br />
hoàn toàn trong dung dịch Y gồm H 2 SO 4 và NaNO 3 , thu được dung dịch Z chỉ chứa 3 muối trung<br />
hòa và m gam hỗn hợp khí T (trong T có 0,015 mol H 2 ). Cho dung dịch BaCl 2 dư vào Z đến khi<br />
các phản ứng xảy ra hoàn toàn, thu được 93,2 gam kết tủa. Còn nếu cho Z phản ứng với NaOH thì<br />
lượng NaOH phản ứng tối đa là 0,935 mol. Giá trị của m gần giá trị nào nhất sau đây?<br />
A.2,5. B.3,0. C.1,5. D.1,0<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………..<br />
3. ạng toán oxy hoá 2 l n bởi HNO 3 , H 2 SO 4 đặc :<br />
Fe + O 2 h n hợp A (FeO, Fe 2 O 3 , Fe 3 O 4 , Fe dư)<br />
HNO 3<br />
Hoặc: Fe + O 2 h n hợp A (FeO, Fe 2 O 3 , Fe 3 O 4 , Fe dư)<br />
Công th c tính nhanh: m Fe = 0,7 m hhA + 5,6 n e/trao đổi<br />
Suy ra khối lượng muối = (m Fe /56). M muối Fe(NO 3 ) 3<br />
Suy ra khối lượng muối = (m Fe /56)./2 M muối Fe 2 (SO 4 ) 3<br />
Fe(NO 3 ) 3 + SPK + H 2 O<br />
2 4<br />
<br />
H SO<br />
Fe 2 (SO 4 ) 3 + SPK + H 2 O<br />
Vd1 : Đốt m gam s t trong o i thu được 3 gam chất r n X . Hòa tan hết X với HNO 3 lo ng dư giải phóng<br />
0,56 lít khí NO ( đktc) . Tìm m ?Tìm số mol HNO 3 pư<br />
Cách1 :.............................................................................................................................................<br />
Cách 2..............................................................................................................................................<br />
..........................................................................................................................................................<br />
Vd2 : Hòa tan hết 11,36 gam chất r n X gồm Fe, FeO, Fe 2 O 3 , Fe 3 O 4 trong dd H 2 SO 4 đặc nóng dư thu được<br />
m gam muối và 1,344 lít khí SO 2 (đktc)là sản phẩm khử duy nhất .Tìm m ?Tìm số mol H 2 SO 4<br />
pư.....................................................................................................................................................................<br />
.............................................................................................................................................................<br />
Vd3 : Đốt cháy mol Fe bởi o i dư thu được 5,04 gam hỗn hợp A gồm các o it s t. Hoà tan hoàn toàn A<br />
trong dung dịch HNO 3 thu được 0,035 mol hỗn hợp Y gồm NO, NO 2 . Tỉ khối của Y đối với H 2 là 19.<br />
Tính .Côcạn dung dịch sau phản ứng được bao nhiêu gam muối khan?Tìm số mol HNO 3 pư<br />
.........................................................................................................................................................................<br />
.........................................................................................................................................................................<br />
.........................................................................................................................................................................<br />
............................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
ĐẠI CƯƠNG KIM LOẠI 23<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Vd4 :<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
(ĐH2015) Cho 8,16 gam hỗn hợp X gồm Fe, FeO, Fe 3 O 4 và Fe 2 O 3 phản ứng hết với dung dịch<br />
HNO 3 loãng (dung dịch Y), thu được 1,344 lít NO (đktc) và dung dịch Z. Dung dịch Z hòa tan tối<br />
đa 5,04 gam Fe, sinh ra khí NO. Biết trong các phản ứng, NO là sản phẩm khử duy nhất của N +5 .<br />
Số mol HNO 3 có trong Y là<br />
A.0,54 mol. B. 0,78 mol. C. 0,50 mol. D. 0,44 mol.<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
I. CẶP OXI <strong>HÓA</strong>- KHỬ<br />
BÀI: DÃ IỆ ÓA ỦA KI LOẠI<br />
Ion kim loại có thể nhận electron để tr thành nguyên tử kim loại, ngược lại nguyên tử kim loại có<br />
thể như ng electron để trở thành ion dương kim loại<br />
Ví dụ: Fe 2+ + 2e → Fe<br />
Cu 2+ + 2e → Cu<br />
Chất oxi hóa<br />
Tính o i hóa tăng<br />
Tính khử giảm<br />
Fe → Fe 2+ + 2e<br />
Cu → Cu 2+ + 2e<br />
Chất khử<br />
Mỗi chất oxi hóa và chất khử của cùng m t nguyên tố kim loại tạo nên cặp oxi hóa- khử.<br />
Ví dụ:<br />
Fe 2+ /Fe là cặp oxy hoá khử của nguyên tố Fe<br />
Cu 2+ /Cu là cặp oxy hoá khử của nguyên tố Cu<br />
II. DÃY ĐIỆN <strong>HÓA</strong><br />
1.Dãy điện hóa<br />
y điện hóa của kim loại là tập hợp những cặp oxi hóa- khử của kim loại được s p xếp theo chiều<br />
tăng d n tính chất oxi hóa của các ion kim loại và chiều giảm d n tính khử của các kim loại.<br />
Li + K + Ba 2+ Ca 2+ Na + Mg 2+ Al 3+ Mn 2+ Zn 2+ Cr 3+ Fe 2+ Cd 2+ Ni 2+ Sn 2+ Pb 2+ H + Cu 2+ Fe 3+ Hg + Ag + Hg 2+ Pt 2+ Au 3+<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Cd Ni Sn Pb H Cu Fe 2+ Hg Ag Hg + Pt Au<br />
2.Ý nghĩa<br />
y điện hóa của kim loại cho phép ta d đoán được chiều của phản ứng giữa 2 cặp oxi hóa- khử.<br />
Phản ứng giữa 2 cặp oxi hóa- khử chỉ xảy ra theo chiều:<br />
chất oxi hóa mạnh sẽ oxi hóa chất khử mạnh sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
24 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Phản ứng giữa 2 cặp oxi hóa – khử là Cu 2+ / Cu và Ag + /Ag sẽ xảy ra theo chiều Ag + oxi hóa<br />
Cu, tạo thành ion Cu 2+ và Ag<br />
2 Ag + + Cu → 2Ag + Cu 2+<br />
Chất oxi<br />
hóa mạnh<br />
Quy t c anpha:<br />
Ví dụ: Cho d y các cặp o yhóa-khử sau : Fe 3+ /Fe 2+ ;Ag + /Ag.Zn 2+ /Zn ;Fe 2+ /Fe ; Cu 2+ /Cu ; Viết<br />
các phản ứng ảy .<br />
Viết lại theo thứ t d y điện hoá:<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
………………………………………………………………................................................................<br />
..............................................................................................................................................................<br />
CÁC DẠNG BÀI <strong>TẬP</strong> KIM LOẠI TÁC DỤNG DUNG DỊCH MUỐI<br />
Dạng 1: Nếu có nhiều kim loại tác dụng dung dịch chứa m t muối thì kim loại có tính khử mạnh hơn<br />
phản ứng trước<br />
Ví dụ : Cho hh kim loại Zn ,Mg tác dụng dd chứa muối AgNO 3<br />
Tính khử Mg > Zn →Mg pư trước<br />
………………………………………………………………………………………………….................<br />
Dạng 2: Nếu có 1 kim loại tác dụng dung dịch chứa hổn hợp nhiều muối thì ion kim loại nào có tính<br />
oxy hoá mạnh hơn phản ứng trước<br />
Ví dụ : Cho kim loại Zn tác dụng dd chứa hh muối AgNO 3 và Cu(NO 3 ) 2<br />
Tính oxyhoá Ag + > Cu 2+ →Ag + pư trước<br />
…………………………………………………………………………………………………….............<br />
Dạng 3: M t kim loại tác dụng với dd chứa m t muối<br />
‣ Cho m t thanh kim loại tác dụng dd chứa m t muối,sau pư thấy thanh kim loại bị tăng khối lượng có<br />
nghĩa là kim loại tạo thành nặng hơn kim loại pư tan ra<br />
∆m↑= m kl (sau) - m kl (trư c)<br />
Vd: Ngâm đinh Fe vào dd CuSO 4, Fe tan ra Cu tạo thành bám lên cây đinh Fe<br />
Fe + CuSO 4 → FeSO 4 + Cu<br />
x mol<br />
m Fe tan = ……… (gam)<br />
Chất khử<br />
mạnh<br />
x mol<br />
Chất khử<br />
yếu<br />
Chất oxi hóa yếu<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
m Cu tạo thành<br />
= ……….(gam) >……….<br />
o đó sau pư đinh Fe bị tăng khối lượng<br />
∆m↑= …………= 8 x (gam)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
ĐẠI CƯƠNG KIM LOẠI 25<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
‣ Cho m t thanh kim loại tác dụng dd chứa m t muối,sau pư thấy thanh kim loại bị giảm khối lượng có nghĩa<br />
là kim loại tạo thành nhẹ hơn kim loại pư tan ra<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
∆m↓= m kl (trư c) - m kl (sau)<br />
Vd:Ngâm thanh Zn vào dd CuSO 4, Zn tan ra Cu tạo thành bám lên cây thanh Zn<br />
Zn<br />
x mol<br />
+ CuSO 4 → ZnSO 4 + Cu<br />
m Zn tan = ………… (gam)<br />
x mol<br />
m Cu tạo thành<br />
= …………(gam)< ……………<br />
o đó sau pư thanh Zn bị giảm khối lượng<br />
∆m↑= ………………….=<br />
x (gam)<br />
Dạng 4: Nhiều kim loại tác dụng dd ch a nhiều muối<br />
Cho hỗn hợp Y gồm 2,8 gam Fe và 0,81 gam Al vào 200 ml dung dịch AgNO 3 và Cu(NO 3 ) 2 . Kết thúc<br />
phản ứng thu được dung dịch và 8,<strong>12</strong> gam chất r n (E) gồm 3 kim loại. Cho E tác dụng với HCl dư<br />
ta thu được 0,672 lít khí H 2 (đktc). Tính nồng đ mol/lit của dung dịch AgNO 3 và Cu(NO 3 ) 2 ban đ u.<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
...................................................................................................................................................................<br />
..................................................................................................................................................................<br />
Dạng 5: Fe tác dụng dd muối AgNO 3<br />
Khi cho b t Fe tác dụng AgNO 3 pư ảy ra theo 2 giai đoạn:<br />
Gđ1: Fe + 2AgNO 3 Fe(NO 3 ) 2 + 2Ag (1)<br />
Gđ1: AgNO 3 + Fe(NO 3 ) 2 Fe(NO 3 ) 3 + Ag (2)<br />
Fe Fe Ag<br />
<br />
2+ 3+ +<br />
2+<br />
Fe Fe Ag<br />
(1)+ (2) : Fe + 3AgNO 3 Fe(NO 3 ) 3 + 3Ag<br />
Nếu biết tỉ lệ mol của Ag + và tỉ lệ mol của Fe ta biết được muối tạo thành sau pư<br />
Vd1:Cho 1,68 gam b t Fe vào 400ml dd AgNO 3 0,175 M. K.lượng kim loại thu được khi pư kết<br />
thúc :<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
Vd2:Cho 2,24 g b t Fe td hoàn toàn với dd 150 ml AgNO 3 0,2 M. K.lượng bạc thu được:<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
Vd3:Cho 28g Fe vào dd chứa 1,1 mol AgNO 3 . Kết thúc pư, khối lượng muối khan thu được là<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
Vd4:Cho 11,2 g b t Fe vào 450 ml dd AgNO 3 1M, l c đều đến khi phản ứng kết thúc, khối lượng<br />
kim loại thu được là<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
26 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
Vd5:Cho 3,08 g b t Fe vào 150 ml dd AgNO 3 1M, l c kĩ đến khi phản ứng xảy ra hoàn toàn,thu<br />
được m gam chất r n. Giá trị của m là<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
Vd6:Cho 1,68 gam b t Fe vào 400ml dd AgNO 3 0,175 M. Số mol chất tan có trong dd sau phản<br />
ứng:<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
Vd7 : Cho 400ml dd FeCl 2 0,1M vào 300ml dd AgNO 3 0,4M. Phản ứng xảy ra hoàn toàn, kết thúc<br />
phản ứng thu được bao nhiêu gam chất r n?<br />
…………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………<br />
I. KHÁI NIỆM<br />
BÀI: Ă Ò KI LOẠI VÀ G Ă Ò KI LOẠI<br />
Ăn mòn kim loại là s phá hủy kim loại hoặc hợp kim do tác dụng của các chất trong môi<br />
trư ng<br />
II .HAI DẠNG ĂN MÒN KIM LOẠI<br />
M → M n+ + ne<br />
1. Ăn òn hóa học (không phát sinh dòng điện)<br />
- Ăn mòn hóa học là quá trình o i hóa – khử, trong đó kim loại phản ứng tr c tiếp với các<br />
chất o i hóa trong môi trư ng<br />
- Ăn mòn hóa học thư ng ảy ra ở những b phận của thiết bị lò đốt hoặc những thiết bị<br />
thư ng uyên tiếp úc với hơi nước và khí o i…nhiệt đ càng cao tốc đ ăn mòn càng cao.<br />
Ví dụ: 3Fe + 4H 2 O Fe 3 O 4 + 4H 2<br />
2Fe + 3Cl 2 2FeCl 3<br />
3Fe + 2O 2 Fe 3 O 4<br />
2. Ăn òn điện hóa học ( phát sinh dòng điện)<br />
Ăn mòn điện hoá là s phá huỷ kim loại hoặc hợp kim do kim loại<br />
tiếp úc tr c tiếp với môi trư ng điện ly tạo nên dòng điện<br />
a) Thí nghiệm: Rót dung dịch H 2 SO 4 lo ng vào cốc thủy tinh rồi<br />
c m hai thanh kim loại khác nhau, ví dụ m t thanh Zn và m t thanh Cu<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
vào cốc. Nối hai thanh kim loại bằng m t dây dẫn có m c nối tiếp với m t điện kế<br />
b) Hiện tượng: - Khi chưa nối dây dẫn, thanh Zn bị hòa tan và bọt Hiđro thoát ra ở bề mặt<br />
thanh Zn<br />
- Khi nối dây dẫn, thanh Zn bị ăn mòn nhanh chóng trong dung dịch điện li, kim điện kế bị<br />
ĐẠI CƯƠNG KIM LOẠI 27<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
lệch, bọt khí H 2 thoát ra ở cả thanh Cu<br />
a. Giải thích:<br />
- Khi chưa nối dây dẫn, Zn bị ăn mòn hóa học do phản ứng:<br />
Zn + 2H + → Zn 2+ + H 2<br />
nên bọt khí H 2 sinh ra trên bề mặt thanh Zn<br />
- Khi nối hai thanh Cu và Zn bằng m t dây dẫn, m t pin điện hóa Zn – Cu được hình thành<br />
, trong đó Zn đóng vai trò c c âm. Các electron đ di chuyển từ c c âm (Zn) đến c c<br />
dương (Cu) tạo ra dòng điện m t chiều làm kim điện kế bị lệch và làm tăng mật đ<br />
electron trên thanh Cu. Nh đó m t ph n H + đến nhận electron trên thanh Cu và bị khử<br />
thành H 2 làm sủi bọt khí trên thanh Cu: 2H + + 2e → H 2<br />
- Phản ứng điện hóa Zn + 2H + → Zn 2+ + H 2<br />
Vậy ăn òn điện hóa học là qu trình oxi hóa – khử, trong đó ki loại bị ăn òn do<br />
t c dụng c a dung dịch chất điện li và có s xuất hiện dòng điện<br />
c) Điều kiện xảy ra ăn òn điện hóa học: đồng th i cả 3 điều kiện sau:<br />
- Cặp kim loại khác nhau hoặc kim loại – phi kim khi đó kim loại có tính khử mạnh hơn là c c<br />
âm bị ăn mòn<br />
- Các kim loại phải tiếp úc tr c tiếp hoặc gián tiếp với nhau qua dây dẫn<br />
- Các kim loại cùng tiếp úc với dung dịch chất điện li<br />
d) Ví dụ : Ăn mòn điện hóa học hợp kim của sắt (gang, thép) trong không khí ẩm<br />
- Gang, thép là hợp kim Fe – C gồm những tinh thể Fe tiếp úc tr c tiếp với tinh thể C<br />
- Không khí ẩm có chứa H 2 O, CO 2 , O 2 …tạo ra lớp dung dịch chất điện li phủ lên bề mặt<br />
gang, thép làm uất hiện vô số pin điện hóa mà Fe là c c âm, C là c c dương<br />
- Ở c c âm ảy ra s o i hóa: Fe → Fe 2+ + 2e<br />
- Ở c c dương ảy ra s khử: 2H + + 2e → H 2 và O 2 + 2H 2 O + 4e → 4OH -<br />
- Tiếp theo: Fe 2+ + 2OH - → Fe(OH) 2<br />
4Fe(OH) 2 + O 2(kk) + 2H 2 O → 4Fe(OH) 3<br />
- Theo th i gian Fe(OH) 3 sẽ bị mất nước tạo ra gỉ s t có thành ph n chủ yếu là Fe 2 O 3 .xH 2 O<br />
III. PHƯƠNG PHÁP CHỐNG ĂN MÒN KIM LOẠI<br />
1. Phương ph p bảo vệ bề ặt<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Phương pháp bảo vệ bề mặt là phủ lên bề mặt kim loại m t lớp sơn, d u mỡ, chất dẻo hoặc<br />
tráng, mạ bằng m t kim loại khác. Nếu lớp bảo vệ bị hư, kim loại sẽ bị ăn mòn<br />
Ví dụ: S t tây là s t tráng thiếc dùng làm h p đ ng th c phẩm vì thiếc là kim loại khó bị o i<br />
hóa ở nhiệt đ thư ng, màng o it thiếc mỏng và mịn c ng có tác dụng bảo vệ thiếc và thiếc o it<br />
không đ c lại có màu tr ng bạc khá đẹp. Thiếc là kim loại mềm, dễ bị sây sát. Nếu vết sây sát sâu<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
28 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
tới lớp s t bên trong thì sẽ ảy ra ăn mòn điện hóa học, kết quả là s t bị ăn mòn nhanh<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
2. Phương ph p điện hóa<br />
Phương pháp bảo vệ điện hóa là dùng m t kim loại có tính khử mạnh hơn làm vật hi sinh để<br />
bảo vệ vật liệu kim loại. Vật hi sinh và kim loại c n bảo vệ hình thành m t pin điện, trong đó vật hi<br />
sinh đóng vai trò c c âm và bị ăn mòn<br />
Ví dụ: Để bảo vệ vỏ tàu biển bằng thép, ngư i ta g n chặt những tấm kẽm vào ph n vỏ tàu ngâm<br />
trong nước biển. Vì khi g n miếng Zn lên vỏ tàu bằng thép sẽ hình thành m t pin điện, ph n vỏ tàu<br />
bằng thép là c c dương, các lá Zn là c c âm và bị ăn mòn theo cơ chế:<br />
- Ở anot (c c âm): Zn → Zn 2+ + 2e<br />
- Ở catot (c c dương): 2H 2 O + O 2 + 4e → 4OH -<br />
Kết quả là vỏ tàu được bảo vệ, Zn là vật hi sinh, nó bị ăn mòn<br />
Nh :<br />
3 điều kiện ảy ra ăn mòn điện hoá:<br />
- 2 kim loại khác nhau hoặc kim loại với phi kim,kim loại mạnh là c c âm bị ăn mòn<br />
- 2 kim loại phải tiếp úc nhau hoặc tiếp úc qua dây dẫn<br />
- 2 kim loại cùng tiếp úc chất điện ly<br />
Cơ chế:<br />
Kim loại mạnh hơn đóng vai trò c c âm bị o y hoá tức là bị ăn mòn<br />
Kim loại yếu hơn đóng vai trò c c dương không bị ăn mòn (lúc đó môi trư ng điện ly bị o y<br />
hoá)<br />
Hợp kim Zn –Cu để ngoài không khí ẩm:xảy ra ăn mòn điện hoá<br />
C c âm là Zn: Zn bị ăn mòn<br />
Zn → Zn 2+ + 2e<br />
C c dương là Cu : Cu không bị ăn mòn<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2H + + 2e → H 2 hoặc O 2 + 2H 2 O + 4e → 4OH -<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
ĐẠI CƯƠNG KIM LOẠI 29<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
A.NGUYÊN TẮC ĐIỀU CHẾ KIM LOẠI<br />
BÀI: I Ế KI LOẠI<br />
Trong t nhiên chỉ có m t số rất ít kim loại ở trạng thái t do, h u hết các kim loại tồn tại ở<br />
dạng ion trong các hợp chất hóa học. Muốn chuyển hóa những ion này thành kim loại ta th c hiện<br />
qu trình khử ion ki loại: M n+ + ne → M<br />
1. Cao lanh: Al 2 O 3 .2SiO 2 .2H 2 O<br />
2. Boxit : Al 2 O 3 .nH 2 O<br />
3. Criolit :Na 3 AlF 6<br />
4. Cacnalit: KCl.MgCl 2 .6H 2 0<br />
5. Dolomit:MgCO 3 .CaCO 3<br />
6. Anotit: CaO.Al 2 O 3 .2SiO 2<br />
7. Pirit :FeS 2 (pirit s t)<br />
8. Xementit: Fe 3 C<br />
9. Hematit : Fe 2 O 3<br />
B.PHƯƠNG PHÁP ĐIỀU CHẾ<br />
Một số loại quặng d ng điều chế kim loại:<br />
10. Hematit nâu: Fe 2 O 3 .nH 2 O<br />
11. Xiderit : FeCO 3<br />
<strong>12</strong>. Manhetit: Fe 3 O 4<br />
13. Pirit đồng:CuFeS 2<br />
14. Photphorit: Ca 3 (PO 4 ) 2<br />
15. apatit: 3Ca 3 (PO 4 ) 2 .CaF 2<br />
16. Xinvinit: NaCl.KCl<br />
17. Canxit: CaCO 3<br />
18. Magiezit: MgCO 3<br />
I.Phương ph p th y luyện ( ùng kim loại có tính khử mạnh khử ion kim loại ra khỏi dd muối)<br />
- Phương pháp thủy luyện được dùng để điều chế những kim loại có đ hoạt đ ng hóa học<br />
thấp như Au, Ag, Hg, Cu…<br />
Ví dụ : Zn + 2Ag + → Zn 2+ + 2Ag<br />
II.Phương ph p nhiệt luyện ( ùng các chất khử mạnh như C,CO,H 2 ,Al …khử ion kim loại ra<br />
khỏi o yt ở nhiệt đ cao)<br />
CO CO 2 (1)<br />
H 2 + KL-O<br />
toC<br />
KL + H 2 O (2)<br />
Al Al 2 O 3 (3)<br />
C hh CO, CO 2 (4)<br />
Điều kiện:<br />
- KL phải đứng sau Al trong d y hoạt điện hóa ( riêng CO, H 2 khó khử được ZnO)<br />
K, Ba, Ca, Na, Mg, Al, Zn, Fe....<br />
PbO + H 2 Pb + CO Fe 2 O 3 + 3CO 2Fe + 3CO 2<br />
3Fe 3 O 4 + 8Al 9Fe + 4Al 2 O 3 Cr 2 O 3 + 2Al 2Cr + Al 2 O 3<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MgO + H 2 Không phản ứng Al 2 O 3 + H 2 Không phản ứng<br />
- Riêng phản ứng (3) gọi là phản ứng nhiệt nhôm<br />
*Phản ng nhiệt nhôm: Là phản ứng của nhôm với các oxyt kim loại pư này toả nhiều nhiệt<br />
thư ng dùng để hàn kim loại hàn đư ng ray xe lửa (Hổn hợp tecmit có trong que hàn là hh gồm:<br />
Fe 2 O 3 và Al)<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
30 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
3M x O y + 2y Al → 3 M + yAl 2 O 3<br />
Tổng quát: M x O y + (CO , H 2 , C , Al) → M +( CO 2 , H 2 O , CO , Al 2 O 3 )<br />
Đối với những kim loại kém hoạt đ ng như Hg, Ag chỉ c n đốt cháy quặng c ng thu được kim loại mà<br />
không c n dùng chất khử<br />
HgS + O 2 Hg + SO 2 Ag 2 S + O 2 2Ag + SO 2<br />
III.Phương ph p điện phân<br />
1)Định nghĩa s điện phân:<br />
S điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt điện c c, dưới tác dụng của dòng điện m t<br />
chiều chạy qua chất điện li ở trạng thái nóng chảy hay dung dịch.<br />
Khi có dòng điện m t chiều đi qua :<br />
Cation (ion dương) chạy về catot (điện c c âm), tại đó ion dương nhận electron để tạo ra sản phẩm.<br />
→ Ở CATOT xảy ra Ự KHỬ<br />
Anion (ion âm) về anot (điện c c dương), tại đó ion âm như ng electron (chất khử) để tạo ra<br />
sản phẩm.<br />
→ Ở ANOT xảy ra Ự OXYHOÁ<br />
2)C ch viết sơ đồ điện phân<br />
b1: Viết pt điện ly của chất điện phân<br />
b2: Viết pt electron ảy ra ở các điện c c : ion dương chạy về catot ( - )nhận e<br />
ion âm chạy về atot ( + ) như ng e<br />
b3: Tổng hợp 2 quá trình cho và nhận e suy ra phương trình điện phân dạng phân tử<br />
3)C c phương ph p điện phân(điện c c trơ):<br />
a.Điện phân các chất nóng chảy:<br />
ùng điều chế các kim loại mạnh như Na,K,Mg,Ca,Al...<br />
Bằng cách điên phân nóng chảy muối halogenua,o yt hoặc hydro yt tương ứng<br />
Ví dụ 1: Điện phân nóng chảy muối NaCl<br />
nc<br />
NaCl Na + + Cl -<br />
Catôt(-) :.....................................................<br />
Anôt (+) :...................................................<br />
Ví dụ 2: Điện phân nóng chảy muối CaBr 2<br />
nc<br />
CaBr 2 <br />
Catôt(-) :...........................................................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Anôt (+) :........................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Phương trình điện phân:<br />
NaCl<br />
dpnc<br />
<br />
Phương trình điện phân:<br />
CaBr 2<br />
dpnc<br />
<br />
ĐẠI CƯƠNG KIM LOẠI 31<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
Ví dụ 3: Điện phân nóng chảy KOH<br />
KOH<br />
nc<br />
<br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
Ví dụ 4: Điện phân nóng chảy Al 2 O 3<br />
Al 2 O 3<br />
nc<br />
<br />
http://daykemquynhon.ucoz.com<br />
Catôt(-) :.........................................<br />
Anôt (+) :.........................................<br />
Phương trình điện phân:<br />
dpnc<br />
KOH <br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Catôt(-) :.........................................<br />
Anôt(+) :.........................................<br />
Phương trình điện phân:<br />
dpnc<br />
Al 2 O 3 <br />
b.Điện phân dung dịch : ùng để điều chế tất cả các kim loại đứng sau Al đây là pp tạo ra kim<br />
loại có đ tinh khiết cao<br />
Thứ t nhận electron ở catot(c c âm)<br />
Ở cực âm có các ion H + (H 2 O) cation kim loại : ion có tính oxyhoá mạnh hơn ưu tiên nhận elctron<br />
trước theo chiều mũi tên<br />
Li + K + Ba 2+ Ca 2+ Na + Mg 2+ Al 3+ (H 2 O) Zn 2+ Fe 2+ Ni 2+ Sn 2+ Pb 2+ H + Cu 2+ Fe 3+ Ag + Hg 2+ Pt 2+ Au 3+<br />
Ion<br />
dương<br />
Chạy<br />
về<br />
Catot<br />
Ion<br />
âm<br />
Chạy<br />
về<br />
Anot<br />
Thứ t như ng electron ở anôt(c c dương)<br />
Ở cực dương có các anion có tính khử mạnh hơn ưu tiên nhường electron trước theo thứ tự:<br />
I - > Br - > Cl - > S 2- > CH3COO - > OH - > O 2- 2<br />
(H2O) > SO ,NO<br />
Li + K + Ba 2+ Ca 2+ Na + Mg 2+ Al 3+ (H 2 O) Zn 2+ Fe 2+ Ni 2+ Sn 2+ Pb 2+ H + Cu 2+ Fe 3+ Ag + Hg 2+ Pt 2+ Au 3+<br />
H 2 O nhận electron tức là H 2 O bị<br />
khử<br />
2H O 2e 2OH H<br />
<br />
2 2<br />
on dương kim loại nhận e theo thứ t m i tên<br />
Ví dụ : hh dd chứa Ag + và Cu 2+<br />
Gđ1: Ag + + 1 e → Ag<br />
Gđ2: Cu 2+ + 2e → Cu<br />
SO4 2- , NO - 3<br />
(H 2 O) OH - CH 3 COO - S 2- Cl - Br - I -<br />
H 2 O như ng electron tức là H 2 O<br />
bị o y hoá<br />
1<br />
H2O 2H O<br />
2<br />
2e<br />
2<br />
on âm gốc a it như ng e theo thứ t m i tên<br />
2Cl - → Cl 2 + 2e<br />
S 2- → S + 2e<br />
<br />
4 3<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2CH3COO - → CH 3 – CH 3 + 2CO 2<br />
2OH - (bazơ) →½ O 2 + H 2 O+ 2e<br />
+ 2e<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
32 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
Ví dụ 1: Điện phân dung dịch muối NaCl NaCl Na + + Cl -<br />
Catôt(-) :........................................................<br />
Anôt(+) :.............................................................<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
......................................................................<br />
Phương trình điện phân: NaCl + H 2 O<br />
Nếu không có màn ngăn:<br />
..........................................................................<br />
có mn<br />
.........................................................................<br />
............................................................................................................................................................<br />
...............................................................................................................................................................<br />
Tương t viết phương trình điện phân các dung dịch<br />
CaCl 2 + H 2 O<br />
KBr + H 2 O<br />
dpdd<br />
……………………………………………………………………<br />
dpdd<br />
……………………………………………………..........................<br />
Vậy :Điện phân muối halogenua của kim loại mạnh từ Li →Al tạo ra: ba o + H 2 + Halogen (X 2 )<br />
Ví dụ 2: Điện phân dung dịch muối CuCl 2 CuCl 2 ..............................................................<br />
Catôt(-) :.....................................................<br />
...................................................................<br />
Anôt(+) :.......................................................<br />
.......................................................................<br />
dpdd<br />
Phương trình điện phân: CuCl 2 ............................................................................................<br />
Tương t viết phương trình điện phân các dung dịch<br />
ZnCl 2<br />
FeCl 2<br />
dpdd<br />
………………………………………………………………………………….<br />
dpdd<br />
……………………………………………………………………………………<br />
Vậy :Điện phân muối halogenua của kim loại sau Al tạo ra: kim loại + Halogen (X 2 )<br />
Ví dụ 3: Điện phân dung dịch muối CuSO 4 CuSO 4 ....................................................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Catôt(-) :.........................................<br />
Anôt(+) :.........................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
........................................................<br />
Phương trình điện phân: CuSO 4 + H 2 O<br />
........................................................<br />
dpdd<br />
……………………………………………………<br />
ĐẠI CƯƠNG KIM LOẠI 33<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
Tương t viết phương trình điện phân các dung dịch<br />
AgNO 3 + H 2 O<br />
dpdd<br />
………………………………………………………………………….<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Fe SO 4 + H 2 O<br />
Vậy :Điện phân muối<br />
dpdd<br />
…………………………………………………………………………..<br />
SO ,NO<br />
2<br />
<br />
4 3<br />
Ví dụ 4: Điện phân dung dịch muối K 2 SO 4 K 2 SO 4<br />
………………………………………<br />
Catôt(-) :.........................................<br />
........................................................<br />
của kim loại sau Al tạo ra: kim loại + O 2 + Axit<br />
Anôt(+) :...............................................................<br />
..............................................................................<br />
Phương trình điện phân: .......................................................................................................................<br />
Tương t viết phương trình điện phân các dung dịch Na 2 SO 4 ,. KNO 3....... Th c chất là .........................<br />
Ví dụ 5: Điện phân dung dịch KOH,NaOH.. KOH ....................................................<br />
Catôt(-) :.........................................<br />
........................................................<br />
Anôt(+) :...............................................................<br />
.............................................................................<br />
Phương trình điện phân: ......................................................................................................................<br />
Tương t viết phương trình điện phân các dung dịch,NaOH,Ba(OH) 2 ...Th c chất là ........................<br />
Ví dụ 6: Điện phân dung dịch HNO 3, H 2 SO 4.... HNO 3 ............................................................<br />
Catôt(-) :.........................................<br />
........................................................<br />
<br />
Anôt(+) :...............................................................<br />
..............................................................................<br />
Phương trình điện phân: .......................................................................................................................<br />
Tương t viết phương trình điện phân các dung dịch HNO 3, H 2 SO 4....... Th c chất là ..........................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Vậy : Điện phân các dung dịch sau đây th c chất là nước điện phân do đó càng điện phân nồng đ<br />
dung dịch càng tăng , giải phóng H2 (ở catot) và O 2 (ở anot)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2<br />
<br />
Điện phân muối SO<br />
4<br />
,NO3<br />
của kim loại mạnh từ Li→Al<br />
Điện phân dung dịch kiềm NaOH,KOH,Ba(OH) 2...<br />
34 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Điện phân dung dịch a it mạnh có chứa o i HNO 3,H 2 SO 4, HClO 4...<br />
c.Điện phân dung dịch điện c c tan là bằng ki loại (anot tan)<br />
Catot: Qúa trình ảy ra giống điện c c trơ<br />
Anot: Kim loại làm điện c c có tính khử mạnh nên như ng e tức là bị o y hóa tan ra<br />
Phương pháp này dùng để mạ kim loại :Vật muốm mạ là catot ,kim loại dùng để mạ làm anot<br />
Vd1: Điện phân dd AgNO 3 với điện c c làm bằng Ag<br />
................................................................................................................................................................<br />
................................................................................................................................................................<br />
................................................................................................................................................................<br />
...............................................................................................................................................................<br />
Vd1: Điện phân dd AgNO 3 với điện c c làm bằng Cu<br />
................................................................................................................................................................<br />
................................................................................................................................................................<br />
................................................................................................................................................................<br />
4.Tính khối lượng sản phẩ<br />
Áp dụng công thức Faraday:<br />
Vd: Cu có A=64, n=2 ; Clo có A=35,5 , n=1<br />
m: khối lượng chất giải phóng ở điện c c (gam)<br />
A: khối lượng mol<br />
n: số electron trao đổi ở điện c c (là hoá trị của A)<br />
: cư ng đ dòng điện (A)<br />
t: th i gian điện phân (s)<br />
F = 96500<br />
Ý nghĩa hằng số Faraday:<br />
điện phân thu được: Chỉ tính khối lượng đơn chất<br />
AIt<br />
m= 96500n<br />
+ F: hằng số Faraday là điện tích c a 1 ol electron hay điện lượng c n thiết để 1 mol electron<br />
chuyển d i trong mạch ở catot hoặc ở anot (F = 1,602.10 -19 .6,022.10 23 ≈ 96500 C.mol -1 )<br />
Khi có 96500C tải qua mạch thì có 1 mol e cho hoặc nhận:<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
96500 C 1mol electron<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Q = It n e = ?<br />
ĐẠI CƯƠNG KIM LOẠI 35<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
Vậy số mol e nhận ở catot = số mol e như ng ở anot<br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
It<br />
n=<br />
e<br />
96500<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Chú ý - Khối lượng catot tăng chính là khối lượng kim loại tạo thành sau điện phân bám vào<br />
- m (dung dịch sau điện phân) = m (dung dịch trước điện phân) – (m kết tủa + m khí)<br />
- Đ giảm khối lượng của dung dịch: Δm = (m kết tủa + m khí)<br />
- Có thể có các phản ứng phụ ảy ra giữa từng cặp: chất tạo thành ở điện c c, chất tan trong dung<br />
dịch, chất dùng làm điện c c.<br />
Ví dụ:<br />
Điện phân nóng chảy Al 2 O 3 với anot làm bằng than chì thì điện c c bị ăn mòn d n do chúng<br />
cháy trong o i mới sinh<br />
C +O 2 → CO 2<br />
2C +O 2 → 2CO<br />
+ Phản ứng giữa a it trong dung dịch với kim loại bám trên catot sẽ ảy ra khi qu trình điện<br />
dpdd<br />
1<br />
phân kết thúc 2 AgNO 3 + H 2 O 2Ag + 2HNO 3 + O 2<br />
2<br />
3 Ag+ 4HNO 3 3AgNO 3 + NO +2 H 2 O<br />
Vd1: Điện phân với điện c c trơ dd muối sun at kim loại hóa trị với cư ng đ dòng điện 3A.Sau<br />
1930 giây,thấy khối lượng catot tăng 1,92g Xác định tên kim loại.<br />
. Catot: M 2+ + 2e M n e = It/96500 =<br />
......................................................................................................................................................................<br />
......................................................................................................................................................................<br />
Vd2: Điện phân 200 ml dd CuSO 4 với các điện c c trơ bằng dòng điện m t chiều I = 19,3A. Khi<br />
khí b t đ u thoát ra ở cả hai điện c c thì ngừng điện phân. Thể tích khí sinh ra ở anot là 1,<strong>12</strong> lít (đktc)<br />
1. Khối lượng kim loại (gam) sinh ra ở catot là :<br />
A. 0,32 B. 0,64 C. 3,2 D. 6,4<br />
Catot: Cu 2+ + 2e Cu Anot:<br />
1<br />
H2O 2H O<br />
2<br />
2e<br />
2<br />
.................................................................<br />
(Hoặc 2O 2- → O 2 + 4e)<br />
m Cu = ..................................................... .................................................................................<br />
...................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2. Th i gian điện phân (s) là:<br />
A. 1000 B. 2000 C. 100 D. 200<br />
n e = t/96500 → t = ......................................................................................................................<br />
...................................................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
36 ĐẠI CƯƠNG KIM LOẠI<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
3. Nồng đ (M) của dd CuSO 4 là:<br />
A. 0,25 B. 2,5 C. 0,1 D. 0,5<br />
nCuSO 4 = nCu 2+ = .........................................................................................................................<br />
Vd3: Cho dòng điện có cư ng đ 10A đi qua bình điện phân chứa 500 ml dung dịch NaOH 45%<br />
( =1,05g/ml). Hỏi sau m t th i gian bao lâu dung dịch trong bình đạt nồng đ 50%.<br />
......................................................................................................................................................................<br />
......................................................................................................................................................................<br />
......................................................................................................................................................................<br />
......................................................................................................................................................................<br />
Vd4: Có 200 ml dd CuSO 4 (d = 1,25g/ml) (dd A). Sau khi điện phân dd A, khối lượng của dd giảm đi 8<br />
gam. Mặt khác, để làm kết tủa hết lượng CuSO 4 dư sau phản ứng điện phân phải dùng hết 1,<strong>12</strong> lít H 2 S<br />
(đktc). Nồng đ % và nồng đ mol của dd CuSO 4 trước khi điện phân là:<br />
A. 9,6; 0,75 B. 50; 0,5 C. 20; 0,2 D. 30; 0,55<br />
.........................................................................................................................................................................<br />
.........................................................................................................................................................................<br />
.........................................................................................................................................................................<br />
Vd5: Th c hiện phản ứng điện phân dd chứa m gam hh CuSO 4 và NaCl với điện c c trơ, bình điện phân<br />
có màng ngăn, cư ng đ dòng điện = 5A đến khi nước bị điện phân tại cả 2 điện c c thì ngừng điện<br />
phân. ung dịch sau khi điện phân hoà tan vừa đủ 1,6 gam CuO và ở anot có 448 ml khí (đktc) thoát ra.<br />
Catot :<br />
.........................................................................................................................................................................<br />
.........................................................................................................................................................................<br />
Anot :<br />
.........................................................................................................................................................................<br />
.........................................................................................................................................................................<br />
1. m nhận giá trị là<br />
A. 5,97<br />
B. 3,785<br />
2. Khối lượng dd giảm đi trong quá trình điện phân là:<br />
C. 4,8<br />
D. 4,95<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
A. 2,59 B. 2,45 C. 3,15 D. 2,95<br />
3. Th i gian điện phân là<br />
A. 19’6’’ B. 9’8’’ C. 18’16’’ . 19’18’<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
ĐẠI CƯƠNG KIM LOẠI 37<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
nhóm IA<br />
C : KI LỌAI KI – KI LỌAI KI Ổ - NHÔM<br />
I. ĐẶC ĐIỂM NGUYÊN TỬ<br />
BÀI: KI LỌAI KI ( Ó IA) Li, a, K, Rb, s, Fr<br />
Kim loại kiềm gồm:Liti (Li), Natri (Na), Kali (K), Rubiđi (Rb), Xesi (Cs), Franxi (Fr). Thu c<br />
Cấu hình electron: ns 1<br />
là những nguyên tố s, đều có 1e ở lớp ngoài cùng,bán kính nguyên tử lớn,<br />
dễ như ng electron o đó kim lọai nhóm IA là chất khử mạnh nhất.<br />
Li (Z=3) 1s 2 2s 1 hay [He]2s 1<br />
Na (Z=11) 1s 2 2s 2 2p 6 3s 1 hay [Ne]3s 1<br />
K (Z=19) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 hay [Ar]4s 1<br />
II. TÍNH CHẤT VẬT LÝ<br />
Chất r n màu tr ng bạc và chuyển thành màu ám khi để trong không khí dó tác dụng các chất có<br />
trong không khí.<br />
Nhẹ, mềm, dẫn điện và nhiệt tốt.Nhiệt đ nóng chảy, nhiệt đ sôi thấp giảm từ Li Cs )<br />
Khối lượng riêng nhỏ. (tăng từ Li Cs ).<br />
Có mạng tinh thể lập phương tâm khối (kiểu mạng kém đặc khít).<br />
Màu ngọn lửa đặc trưng của đơn chất và hợp chất: đưa kim loại kiềm (hoặc hợp chất của kim loại<br />
kiềm ) vào ngọn lửa đèn khí không màu, ta có:<br />
Kim loại Li Na K Rb Cs<br />
Màu ngọn lửa Đỏ tía Vàng Tím Đỏ huyết Xanh lơ<br />
Nhận biết ki loại kiề và hợp chất c a nó bằng ngọn lửa kh ng àu<br />
III.TÍNH CHẤT <strong>HÓA</strong> HỌC CHUNG<br />
Tính khử: M M n+<br />
+ ne<br />
1.T c dụng v i phi ki (Halogen X 2 , O 2 )<br />
a.V i halogen<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ví dụ: 2Na + Cl 2 ..................................................................................................<br />
b.V i oxi:<br />
Nhiệt đ thư ng: 4Na + O 2 .................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
38 KIM LOẠI NHÓM IA<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
t<br />
Khi đốt nóng trong khí o i: 2Na + O 2 Na 2 O 2(r n) (Natripeoxit)<br />
t<br />
Khi đốt nóng trong khí o i: K + O 2 KO 2 (Kalisupeoxit).<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
2.T c dụng dung dịch axit HCl, H 2 SO 4 loãng Muối + H 2<br />
Ví dụ: 2Na + 2HCl ..................................................................................................<br />
.T c dụng v i H 2 O ở nhiệt độ thường (Li, Na, K, Rb, Cs)<br />
Ví dụ: 2Na + 2H 2 O ..................................................................................................<br />
4.T c dụng v i dung dịch uối<br />
2Na + 2H 2 O (trong dung dịch muối) ..................................................................<br />
Tạo : 3NaOH + AlCl 3 ......................................................<br />
Và tan: NaOH + Al(OH) 3 .........................................................<br />
Tạo : NaOH + NH 4 Cl ..........................................................................<br />
5.T c dụng v i Hidro<br />
Kim lọai kiềm nóng chảy có thể tác dụng cho hydro.<br />
t,p<br />
Ví dụ: 2Na + H 2 2NaH (Natri hidrua)<br />
6.Na bị cacbonat hóa trong kh ng khí<br />
Bình thư ng Na có m t lớp tạp chất do Na bị o i hóa (Na 2 O), hút ẩm (NaOH) và cuối cùng bị<br />
cacbonat hóa (Na 2 CO 3 ) 4Na + O 2 ......................................................<br />
IV.ĐIỀU CHẾ<br />
Na 2 O + 2H 2 O ......................................................<br />
2 NaOH + CO 2 ......................................................<br />
1.Nguyên tắc: khử ion kim lọai kiềm thành kim loại t do M + + e M<br />
2. Phương ph p: điện phân nóng chảy muối halogenua hay hidroxit ở dạng khan.<br />
2NaCl<br />
4NaOH<br />
dpnc<br />
......................................................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
dpnc<br />
......................................................<br />
V.ỨNG DỤNG: Na, K: làm chất trao đổi nhiệt trong lò phản ứng.<br />
Cs: dùng chế tạo tế bào quang điện.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
KIM LOẠI NHÓM IA 39<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
BÀI: MỘT Ố HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM<br />
A.NaOH (NATRI HIDROXIT)<br />
I.Tính chất vật lý<br />
Chất r n, màu tr ng, không màu, hút ẩm, dễ nóng chảy (322 o C).<br />
ễ hút ẩm và chảy rửa, tan nhiều trong nước , dễ ăn da và tỏa nhiệt mạnh.<br />
II.Tính chất hóa học<br />
ung dịch ba ơ mạnh: NaOHNa + +OH - (làm anh quỳ tím, làm hồng Phenolphtalein).<br />
1.T c dụng v i dung dịch axit:NaOH + HCl ...............................................................<br />
2.T c dụng v i oxit axit: t y tỉ lệ số ol NaOH : CO 2<br />
Nếu tỉ lệ 2:1 2NaOH + CO 2 …………………….( 2OH - + CO 2 CO 3<br />
2-<br />
+ H 2 O.)<br />
Nếu tỉ lệ 1: 1 NaOH + CO 2 …………………… ( OH - + CO 2 HCO 3 2- )<br />
3.T c dụng v i dung dịch uối 2NaOH + CuSO 4 Na 2 SO 4 + Cu(OH) 2<br />
4.T c dụng v i ki lọai (Al, Zn…) Cr: Kh ng phản ng dd NaOH loãng,dd NaOH đặc<br />
2NaOH + Zn ……………………<br />
5.Tác dụng v i oxit lưỡng tính<br />
2NaOH + ZnO ……………………<br />
2NaOH + Al 2 O 3 …………………<br />
2NaOH + Cr 2 O 3 ………………<br />
III.Điều chế<br />
NaOH + Al + H 2 O ……………………<br />
6.T c dụng v i hidroxit lưỡng tính<br />
2NaOH + Zn(OH) 2 ……………………<br />
NaOH + Al(OH) 3<br />
……………………<br />
NaOH + Cr(OH) 3 ……………………<br />
Phương pháp 1: điện phân dung dịch NaCl có vách ngăn ốp giữa 2 điện c c trơ.<br />
dpdd<br />
Phương trình điện phân: 2NaCl + 2H 2 O 2NaOH + H 2 + Cl 2 .<br />
Nếu không có màn ngăn ốp giữa 2 điện c c thì Cl 2 sẽ phản ứng với dung dịch NaOH:<br />
Nếu dung dịch lo ng thu được nước javen:<br />
2NaOH + Cl 2 ……………………<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Nếu dung dịch đặc, nóng thu được Natri clorat:<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
6NaOH + 3Cl 2<br />
o<br />
100 C<br />
<br />
……………………<br />
40 KIM LOẠI NHÓM IA<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Phương pháp 2: cho ođa tác dụng với nước vôi:<br />
Na 2 CO 3 + Ca(OH) 2 ……………………<br />
B.NaCl (NATRI CLORUA)<br />
Chất r n, màu tr ng, dễ tan trong nước, nhiệt đ nóng chảy 800 o C.Th c phẩm quan trọng cho ngư i và<br />
gia súc. Nguyên liệu để điều chế nhiều hóa chất quan trọng như: Cl 2 , HCl, NaOH….<br />
Được khai thác từ nước biển, quặng muối.<br />
C.Na 2 CO 3 (NATRI CACBONAT)<br />
D.NaHCO 3 (NATRI HIDROCACBONAT)<br />
-Chất r n, màu tr ng, dễ tan trong nước, nhiệt -Chất r n, màu tr ng, ít tan trong nước<br />
đ nóng chảy 850 o C. (Na 2 CO 3 .10H 2 O.)<br />
-Là hợp chất lưỡng tính. Có pư kiềm yếu pH > 7<br />
-Natri cacbonat có pư kiềm pH > 7<br />
-<br />
HCO<br />
2-<br />
-<br />
CO 3 + HOH HCO 3 + OH - 3 + HOH H 2 CO 3 + OH -<br />
Bền v i nhiệt kh ng bị phân h y<br />
Na 2 CO 3<br />
t<br />
<br />
không bị nhiệt phân<br />
T c dụng dd axit ạnh: CO 2 .<br />
Na 2 CO 3 + 2HCl …………………<br />
Lưu ý: Cho từ từ dd a it (H + ) vào dung dịch<br />
muối CO 3 2- (hoặc hỗn hợp CO 3<br />
2-<br />
và HCO - 3 )<br />
Giai đoạn 1: CO 3<br />
2-<br />
Nếu A it dư thì<br />
+ H + HCO 3 - .<br />
Giai đoạn 2: HCO 3 - + H + H 2 O + CO 2 .<br />
Hiện tượng: Ban đ u không có khí ,sau đó có<br />
khí CO 2 bay lên<br />
T c dụng v i dung dịch<br />
kết t a và khí CO 2<br />
uối Al 3+ , Fe 3+ tạo<br />
3Na 2 CO 3 + 3H 2 O + Al 2 (SO 4 ) 3 2Al(OH) 3<br />
+ 3CO 2 + 3Na 2 SO 4 .<br />
Bền ở nhiệt độ thường, bị phân h y ở nhiệt độ<br />
cao<br />
t<br />
2NaHCO 3 Na 2 CO 3 + CO 2 + H 2 O.<br />
T c dụng v i dung dịch axit<br />
NaHCO 3 + HCl NaCl + CO 2 + H 2 O<br />
→khí CO 2 lập tức bay lên<br />
T c dụng v i kiề<br />
Với NaOH:<br />
NaHCO 3 + NaOH Na 2 CO 3 + H 2 O.<br />
Với KOH:<br />
2NaHCO 3 +2KOHNa 2 CO 3 + K 2 CO 3 + 2H 2 O<br />
Dung dịch NaHCO 3 là hợp chất lưỡng tính<br />
T c dụng v i dung dịch<br />
uối<br />
NaHCO 3 + NaHSO 4 Na 2 SO 4 + H 2 O+CO 2 .<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2NaHCO 3 + + 2 KHSO 4 Na 2 SO 4 + K 2 SO 4<br />
+ 2 H 2 O+ 2 CO 2 .<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
KIM LOẠI NHÓM IA 41<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Lưu ý bài to n nhỏ từ từ H + -<br />
vào dd hổn hợp gồ HCO3<br />
và<br />
2-<br />
CO3<br />
và ngược lại<br />
‣ Cho từ từ dd a it (H + ) vào dung dịch muối CO 2- 2-<br />
3 (hoặc hỗn hợp CO 3 và HCO - 3 )Ban đ u không<br />
có khí ,sau đó có khí CO 2 bay lên, pư ảy ra theo cơ chế<br />
2-<br />
Giai đoạn 1: CO 3 + H + HCO - 3 .<br />
Giai đoạn 2: HCO 3<br />
-<br />
(c và mới) + H + H 2 O + CO 2 .<br />
Nếu đề bài cho H + không dư tức là n + n 2n<br />
2<br />
khi đó dễ thấy n n + n 2<br />
H HCO3 CO3<br />
CO2 H CO3<br />
Vd1: 100ml dd X gồm Na 2 CO 3 1,5M và KHCO 3 1M .Nhỏ từ từ từng giọt cho đến hết 250ml dd<br />
HCl1M vào sinh ra V lit khí (đkc).Tìm V<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
2-<br />
‣ Cho từ từ dd hỗn hợp CO 3 và HCO - 3 vào dung dịch chứa a it (H + ) : ảy ra đồng th i 2 phản ứng<br />
tạo khí CO 2 lập tức<br />
2-<br />
CO 3 + 2H + H 2 O + CO 2 .<br />
x 2x x<br />
HCO 3<br />
-<br />
+ H + H 2 O + CO 2 .<br />
y y y<br />
2-<br />
Do mỗi giọt dd hỗn hợp nhỏ uống đều chứa CO 3 và HCO - 3 với số mol ion tỉ lệ tương ứng với số<br />
mol ion ban đ u của mỗi ion nên để tính số mol khí CO 2 ta c n tìm tổng ( +y)<br />
x n 2-<br />
CO3<br />
=<br />
y n -<br />
HCO3<br />
<br />
2x + y = n<br />
H<br />
+<br />
n<br />
Gỉai hệ ta tìm được CO2<br />
= x + y<br />
Vd2: Nhỏ từ từ từng giọt 100ml dd X gồm Na 2 CO 3 1,5M và KHCO 3 1M cho đến hết vào 250ml dd<br />
HCl1M vào sinh ra V lit khí (đkc).Tìm V<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
Vd3:Cốc A đ ng 0,3 mol Na 2 CO 3 và 0,2 mol NaHCO 3 .Cốc B đ ng 0,4 mol HCl . Đổ từ từ cốc A vào cốc<br />
B số mol khí CO 2 thoát ra có giá trị nào ?<br />
A. 0,2 B. 0,25 C. 0,4 . 0,5<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Vd4: Cốc A đ ng 0,3 mol Na 2 CO 3 và 0,2 mol NaHCO 3 .Cốc B đ ng 0,4 mol HCl . Đổ từ từ cốc B vào<br />
cốc A,số mol khí CO 2 thoát ra có giá trị nào ?<br />
A. 0,25 B. 0,1 C. 0,4 . 0,5<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
42 KIM LOẠI NHÓM IA<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Lưu ý bài to n NaOH tác dụng v i axit photphoric H 3 PO 4 ,tác dụng CO 2 , SO 2<br />
n<br />
n<br />
NaOH<br />
H3PO4<br />
n<br />
<br />
n<br />
NaH 2 PO 4 ,<br />
H 3 PO 4 dư<br />
( P 2 O 5 → 2P ; Ba(OH) 2 → 2OH - )<br />
Caâu 1: Cho dung dịch chứa 5,88g H 3 PO 4 vào dung dịch chứa 8,4g KOH. Sau phản ứng, trong dung<br />
dịch muối tạo thành là muối gì khối lượng bao nhiêu gam?<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………….<br />
Caâu 2: Cho 100 ml dung dịch H 3 PO 4 1M tác dụng với 5 lít dung dịch Ba(OH) 2 0,02M, sau phản ứng ta<br />
thu được muối gì khối lượng bao nhiêu gam ?<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
Caâu 3: 14,2 gam P 2 O 5 tác dụng 300 ml dd NaOH 1,2M sau phản ứng thu thu được muối gì khối lượng<br />
bao nhiêu gam ?<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………..<br />
<br />
ản<br />
Phẩm<br />
OH<br />
Nếu M 2+ là Ca 2+ hay Ba 2+ thì xảy ra phản ứng tạo kết tủa như sau:<br />
Nếu đề bài cho số mol OH - và số mol kết tủa thì số mol CO 2 có 2 trư ng hợp<br />
<br />
n<br />
CO<br />
= n (1muoi)<br />
2<br />
<br />
-<br />
<br />
n<br />
CO<br />
= n - n (2muoi)<br />
2 OH<br />
P<br />
1<br />
NaH 2 PO 4<br />
,Na 2 HPO 4<br />
Hay<br />
CO OH HCO<br />
<br />
<br />
2 3<br />
<br />
2<br />
2<br />
<br />
3<br />
<br />
2<br />
CO 2OH CO H O<br />
CO M MCO <br />
2<br />
2<br />
3 3<br />
KIM LOẠI NHÓM IA 43<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
<br />
<br />
<br />
<br />
n = n (1muoi)<br />
CO<br />
CO<br />
2-<br />
2 CO3<br />
n = n - n (2 muoi)<br />
2- -<br />
3 OH<br />
Caâu 4: Hấp thụ hết 0,4 mol CO 2 vào dung dịch chứa 0,5 mol Ca(OH) 2 . Tính khối lượng kết tủa thu<br />
được.<br />
A. 40 gam B. 15 gam C. 20 gam D. 30 gam<br />
2<br />
Na 2 HPO 4,<br />
Na 3 PO 4<br />
NaH 2 PO 4 Na 2 H PO 4 Na 3 PO 4<br />
CO<br />
3<br />
2<br />
Na 3 PO 4, NaOHdư<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Caâu 5: ung dịch A chứa NaOH 1M và Ca(OH) 2 0,01M. Sục 2,24 lít khí CO 2 vào 400 ml dung dịch A<br />
ta thu được m t kết tủa có khối lượng là bao nhiêu?<br />
A. 1,5 g B. 10 g C.4 g D.0,4 g<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
Caâu 6: Hấp thụ V lít CO 2 (đktc) vào 300 ml dung dịch Ba(OH) 2 1M được 19,7 gam kết tủa. Tìm V:<br />
A. 0,448 và 0,896 B. 2,24 và 11,2 C. 2,24 và 0,448 D. 11,2 và 1,344<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Caâu 7: X là dung dịch chứa a mol Ca(OH) 2 . Hấp thụ hết 0,3 mol CO 2 vào X được 2b mol kết tủa, còn<br />
hấp thụ hết 0,4 mol CO 2 vào X được b mol kết tủa. Vậy giá trị a,b l n lượt là:<br />
A. 0,25và 0,1 B. 0,15và 0,1 C. 0,2 và 0,1 D. 0,25và 0,15<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………….<br />
………………………………………………………………………………………………………………<br />
Caâu 8: Hấp thụ hoàn toàn 2,688 lít CO 2 (đktc) vào 2,5 lít dung dịch Ba(OH) 2 nồng đ a mol/l được<br />
15,76 gam kết tủa. Giá trị của a là:<br />
A. 0,032 B. 0,048 C. 0,06 D. 0,04<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
Caâu 9: Có 2 thí nghiệm :<br />
+ Hấp thụ hết a mol CO 2 vào dung dịch chứa b mol Ca(OH) 2 được 20 gam kết tủa.<br />
+ Hấp thụ hết 2a mol CO 2 vào dung dịch chứa b mol Ca(OH) 2 được 30 gam kết tủa<br />
Tìm các giá trị a và b<br />
A. 0,2 và 0,3 B. 0,2 và 0,5 C. 0,2 và 0,6 D. 0,2 và 0,35<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
Caâu 10: Sục 9,52 lít SO 2 (đktc) vào 200 ml dung dịch hỗn hợp: NaOH 1M – Ba(OH) 2 0,5M – KOH<br />
0,5M. Kết thúc phản ứng thu được m gam kết tủa. Trị số của m là:<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
A. 16,275 gam<br />
B. 21,7 gam<br />
C. 14,775 gam<br />
D. 17,975 gam .<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
44 KIM LOẠI NHÓM IA<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
BÀI: KIM LOẠI KIỀM THỔ NHÓM IIA (Be, Mg, Ca, r, Ba, Ra)<br />
I. ĐẶC ĐIỂM CẤU TẠO<br />
Thu c nhóm IIA gồm các nguyên tố: beri (Be), magie (Mg), canxi (Ca), stronti (Sr) ,bari (Ba).<br />
Cấu hình electron: ns 2 là những nguyên tố s, bán kính nguyên tử lớn ,có 2 electron ở lớp ngoài<br />
cùng,l c liên kết trong mạng tinh thể yếu.<br />
o đó kim lọai nhóm IIA là chất khử mạnh (yếu hơn kim lọai kiềm).<br />
Be (Z=4) 1s 2 2s 2 hay [He]2s 2<br />
Mg (Z=<strong>12</strong>) 1s 2 2s 2 2p 6 3s 2 hay [Ne]3s 2<br />
Ca (Z= 20) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 hay [Ar]4s 2<br />
II. TÍNH CHẤT VẬT LÝ<br />
Nhiệt đ nóng chảy và nhiệt đ sôi thấp ( trừ Be)Khối lượng riêng tương đối nhỏ.<br />
Cứng hơn kim lọai kiềm, nhưng vẫn là kim lọai mềm.<br />
Be, Mg dạng lục phương.<br />
Ca và Sr lục phương tâm diện.<br />
Ba và Ra lục phương tâm khối.<br />
III.TÍNH CHẤT <strong>HÓA</strong> HỌC<br />
1. T c dụng v i phi ki<br />
a. Phản ng v i oxi<br />
Tính khử: M M 2+ + 2e<br />
Trong không khí (ở nhiệt đ thư ng), Be và Mg bị oxi hóa chậm thành màng oxi bền bảo vệ cho<br />
kim loại. Ca, Sr, Ba tác dụng với oxi của không khí mạnh hơn. Khi bị đốt nóng chứng cháy sáng trong<br />
không khí tạo oxit<br />
2M + O 2<br />
0<br />
t<br />
b.Phản ng tốt v i halogen tạo<br />
M + Cl 2<br />
c.Phản ng v i c c phi ki<br />
Ca + 2C<br />
Ba + S<br />
............................................................................................<br />
0<br />
t<br />
2.T c dụng v i dung dịch axit :<br />
uối halogenua<br />
............................................................................................<br />
yếu hơn (C, , P…) khi nung đến nhiệt độ cao<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
0<br />
t<br />
..............................................................................................<br />
0<br />
t<br />
............................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
KIM LOẠI NHÓM IIA 45<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
a.V i HCl, H 2 SO 4 loãng: giải phóng H 2<br />
M + 2HCl ............................................................................................<br />
b.V i H 2 SO 4 đặc, HNO 3 :<br />
o các kim loại nhóm A (thư ng gặp Mg) có tính khử mạnh vì vậy có thể khử N của dd HNO 3<br />
lo ng uống số o i hóa thấp như N (N 2 O), N (N 2 ), và đặc biệt là (NH 4 NO 3 )<br />
M + HNO 3( rất lo ng) …………….. + NH 4 NO 3 + ………………………………….<br />
.T c dụng v i nư c ở nhiệt độ thường:<br />
Be không phản ứng.Mg khử H 2 O rất chậm (ở nhiệt đ thư ng g n như không phản ứng ).Ca, Sr,<br />
Ba phản ứng m nh liệt<br />
Ví dụ:<br />
Ca + 2H 2 O ....................................................................................<br />
4.T c dụng dd uối:<br />
o Ca, Sr, Ba tác dụng với dd muối CuCl 2 dung dịch muối NH 4 Cl<br />
Ba + 2H 2 O ...................................................................................<br />
Ba(OH) 2 + CuCl 2 .........................................................................<br />
Ba(OH) 2 + 2NH 4 Cl .....................................................................<br />
o Mg tác dụng với dd muối<br />
Mg + CuSO 4 ............................................................................................<br />
Chú ý: Mg + 2FeCl 3 ............................................................................................<br />
Nhưng: Mg + FeCl 2 ............................................................................................<br />
IV. ỨNG DỤNG<br />
Be: tạo hợp kim cứng, bền, đàn hồi dùng làm vỏ tàu….<br />
Mg: tạo hợp kim nhẹ, bền dùng chế tạo máy bay, tên lửa…<br />
V. ĐIỀU CHẾ<br />
+1<br />
Nguyên t c: Khử ion kim lọai nhóm A thành kim lọai M 2+<br />
Phương pháp: điện phân nóng chảy muối halogenua MX 2 .<br />
0<br />
N 3<br />
+5<br />
+ 2e M<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MX 2<br />
dpnc<br />
............................................................................................<br />
46 KIM LOẠI NHÓM IIA<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
BÀI: MỘT Ố HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI CANXI<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. CaO – CANXI OXIT (<strong>VÔ</strong>I SỐNG)<br />
1)Lý tính: chất rắn,<br />
2)Hóa tính: Là oxit bazơ<br />
a.T c dụng v i nư c<br />
àu trắng, nhiệt độ nóng chảy 2585 o C<br />
CaO + H 2 O ..............................................phản ứng toả nhiệt<br />
b.T c dụng v i dung dịch axit: CaO + 2HCl .............................................<br />
c.T c dụng v i oxit axit CaO + CO 2 .............................................<br />
Điều chế: phân h y đ v i ở nhiệt độ cao<br />
CaCO 3<br />
0<br />
t<br />
.............................................<br />
Muốn tăng hiệu suất c n: tăng t o 900 o C và giảm nồng đ khí CO 2 .<br />
Ứng dụng: d ng trong c ng nghiệp, xây d ng ,n ng nghiệp...<br />
NHỚ<br />
1- Tính tan trong nước , : CaO tan ,BaO tan, SrO tan, MgO không tan.<br />
2- Tác dụng với nước dung dịch ba ơ kiềm: (chỉ có CaO, SrO và BaO tác dụng)<br />
3- Tác dụng với CO 2 muối: (chỉ có CaO, SrO và BaO tác dụng)<br />
II. Ca(OH) 2 – CANXI HIDROXIT (NƯỚC <strong>VÔ</strong>I)<br />
1.Lý tính: chất rắn,<br />
àu trắng, ít tan trong nư c<br />
2.Hóa tính: là 1 dung dịch bazơ (yếu hơn dd NaOH)<br />
a. T c dụng dung dịch axit<br />
Ca(OH) 2 + 2HCl ...................................................................................<br />
b. T c dụng v i oxit axit<br />
ẫn CO 2 vào dung dịch nước vôi trong, dd có kết tủa tr ng:<br />
Ca(OH) 2 + CO 2 .......................................................(1)<br />
Thêm tiếp CO 2 cho đến dư, kết tủa bị hòa tan, dd trong suốt trở lại:<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
CaCO 3 + H 2 O + CO 2 .............................................(2)<br />
Từ (1) và (2), ta có: Ca(OH) 2 + 2CO 2 .............................................<br />
c. T c dụng v i dd uối<br />
Ca(OH) 2 + Na 2 CO 3 ..................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
KIM LOẠI NHÓM IIA 47<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
1:1<br />
Chú ý: Ca(OH) 2 + NaHCO 3 CaCO 3 + NaOH + H 2 O.<br />
1:2<br />
Ca(OH) 2 + 2NaHCO 3 CaCO 3 + Na 2 CO 3 + 2H 2 O.<br />
III. CaCO 3 - CANXI CACBONAT (ĐÁ <strong>VÔ</strong>I)<br />
1.Lý tính: chất rắn trắng, kh ng tan trong nư c<br />
2.Hóa tính: là<br />
a. T c dụng dung dịch axit<br />
uối c a axit yếu và kh ng bền.<br />
CaCO 3 + 2HCl ...................................................<br />
CaCO 3 + 2CH 3 COOH .............................................<br />
b. Ở nhiệt độ thấp bị hòa tan dần trong nư c có ch a CO 2<br />
CaCO 3 + H 2 O + CO 2 .............................................(1)<br />
Ca(HCO 3 )<br />
0<br />
<br />
t CaCO 3 + H 2 O + CO 2 (2)<br />
(1) & (2) giải thích s âm th c của nước mưa đối với núi đá vôi và giải thích s tạo thành thạch<br />
nh trong hang đ ng<br />
c. Bị phân h y ở nhiệt độ cao (900 o C)<br />
CaCO 3 .............................................<br />
Ứng dụng Làm vật liệu ây d ng: sản uất vôi sống.Làm nguyên liệu sản uất imăng, đất đèn…<br />
IV. CaSO 4 - CANXI SUNFAT (THẠCH CAO)<br />
Chất r n, màu tr ng, tan ít trong nước.Tùy lượng nước kết tinh, có 3 lọai thạch cao<br />
Thạch cao sống CaSO 4 .2H 2 O bền ở nhiệt đ thư ng dùng sản uất i măng<br />
Thạch cao nung CaSO 4 .H 2 O hoặc Ca O 4 .0,5H 2 O dùng đúc tượng, bó ương g y...<br />
Thạch cao khan CaSO 4 không tan trong nước<br />
Ứng dụng<br />
Thạch cao nung CaSO 4 .H 2 O hoặc Ca O 4 .0,5H 2 O dùng để đúc tượng, bó ương g y, làm phấn<br />
viết bảng, làm chất kết dính trong vật liệu ây d ng<br />
I. ĐỊNH NGHĨA<br />
0 0<br />
160 c 1000 c<br />
4 2<br />
<br />
4 2 4 2<br />
<br />
4<br />
CaSO .2H O CaSO .H O (CaSO .0,5H O) CaSO<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
BÀI : NƯỚC CỨNG<br />
Nước có chứa nhiều ion Ca 2+ và Mg 2+ gọi là nước cứng.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
48 KIM LOẠI NHÓM IIA<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
Nước không chứa hay chứa rất ít ion Ca 2+ và Mg 2+ gọi là nước mềm<br />
II. PHÂN LOẠI: Phân loại nư c c ng d a vào ion â<br />
có trong nư c c ng<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Nước cứng tạm th i ngoài Ca 2+ và Mg 2+ còn chứa ion HCO <br />
: Ca(HCO 3 ) 2 hay Mg(HCO 3 ) 2 .<br />
Nước cứng vĩnh cửu ngoài Ca 2+ và Mg 2+ 2<br />
còn chứa Cl ,SO 4 : CaSO 4 , MgSO 4 , CaCl 2 và MgCl 2 .<br />
Nước cứng toàn ph n là tổng c ng 2 đ cứng trên: CaSO 4 , MgSO 4 , CaCl 2 và MgCl 2<br />
Ca(HCO 3 ) 2 ,Mg(HCO 3 ) 2 .<br />
III. TÁC HẠI CỦA NƯỚC CỨNG<br />
• Làm mất tính tẩy rửa của à phòng, làm vải sợi mau mục nát:<br />
2C 17 H 35 COONa + Ca 2+ (C 17 H 35 COO) 2 Ca + 2Na + .<br />
• Tạo lớp cặn trong nồi hơi gây l ng phí chất đốt, bịt kín ống dẫn chất đốt<br />
Ca(HCO 3 ) 2<br />
0<br />
t<br />
.............................................<br />
• Làm th c phẩm lâu chín và giảm mùi vị.<br />
IV. PHƯƠNG PHÁP LÀM MỀM NƯỚC CỨNG<br />
Nguyên t c: giảm nồng đ ion Ca 2+ và Mg 2+ bằng cách chuyển chúng vào hợp chất không tan hay<br />
thay thế chúng bằng ion khác. M 2+ + CO 3<br />
2-<br />
1. Phương ph p kết t a<br />
MCO 3 <br />
a) Đun nóng trước khi dùng để làm mềm nước cứng tạm th i:<br />
M(HCO 3 ) 2<br />
0<br />
t<br />
.............................................<br />
b) Dùng dd Ca(OH) 2 vừa đ sẽ làm mềm nước cứng tạm th i:<br />
Ca(OH) 2 + M(HCO 3 ) 2 .............................................<br />
c) Dùng Na 2 CO 3 sẽ làm mềm nước cứng tạm th i và vĩnh cửu:<br />
M(HCO 3 ) 2 + Na 2 CO 3 MCO 3 + 2NaHCO 3<br />
MCl 2 + Na 2 CO 3 .............................................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MSO 4 + Na 2 CO 3 .............................................<br />
- Ta có thể dùng muối K 2 CO 3 , Na 3 PO 4 , K 3 PO 4 ….để làm mềm nước cứng.<br />
2. Phương ph p trao đổi ion: cho nước cứng chảy qua chất trao đổi ion (ionit), ion Ca 2+ và<br />
Mg 2+ sẽ bị hấp thụ và thế vào đó là các ion như Na + , H + …. Ta được nước mềm.<br />
3<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
KIM LOẠI NHÓM IIA 49<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. VỊ TRÍ, CẤU TẠO NGUYÊN TỬ<br />
Khối lượng nguyên tử: 27<br />
BÀI: NHÔM ( Al = 27 )<br />
Cấu hình electron:Al(Z=13) 1s 2 2s 2 2p 6 3s 2 3p 1 nguyên tố họ p , số thứ t 13, chu kì 3, nhóm A.<br />
II. TÍNH CHẤT VẬT LÝ<br />
Chất r n, màu tr ng bạc, nhẹ ( = 2.7 g/cm 3 )Nhiệt đ nóng chảy 660 o C; nhiệt đ sôi 2060 o C.<br />
ễ dát mỏng, dễ kéo sợi. ẫn điện, nhiệt tốt.<br />
III. TÍNH CHẤT <strong>HÓA</strong> HỌC<br />
1.T c dụng v i phi ki<br />
Tính khử: Al Al 3+ + 3e<br />
Nhiệt đ thư ng: Al kết hợp với o i tạo lớp o it mỏng, bền bảo vệ Al không bị o i hóa tiếp.<br />
2Al + 3O 2<br />
2Al + 3Cl 2<br />
0<br />
t<br />
.............................................<br />
0<br />
t<br />
.............................................<br />
HO 2<br />
2Al + 3I 2 .............................................<br />
2.T c dụng v i dung dịch axit<br />
• Với HCl, H 2 SO 4 loãng: 2Al + 6HCl 2AlCl 3 + 3H 2 <br />
• Với H 2 SO 4 và HNO 3 đặc ngu i: Al không phản ứng.<br />
• Với HNO 3 loãng, HNO 3 và H 2 SO 4 đặc, nóng:<br />
Al + 4HNO 3 loãng ……………… + NO +…………………….<br />
Al + 6HNO 3 đặc, nóng ………………… + 3NO 2 +……………………………<br />
2Al + 6H 2 SO 4 đặc, nóng …………………+ 3SO 2 + …………………………..<br />
o Al có tính khử mạnh vì vậy có thể khử<br />
0<br />
(N 2 O), N (N 2 ), và đặc biệt là (NH 4 NO 3 )<br />
N 3<br />
của dd HNO 3 lo ng uống số o i hóa thấp như<br />
8Al + 30HNO 3 loãng ……………… + 3NH 4 NO 3 + ………………………………..<br />
3.T c dụng v i oxit ki lọai M X O Y (pư nhiệt nh )<br />
+5<br />
N<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
+1<br />
N<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2yAl + 3M x O y<br />
0<br />
t<br />
yAl 2 O 3 + 3xM<br />
Hỗn hợp Tec it có trong que hàn gồ Al và Fe 2 O 3<br />
50 NHÔM<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
Vd: 2Al + Fe 2 O 3<br />
0<br />
t<br />
.............................................<br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
4.T c dụng v i H 2 O<br />
Lớp o it Al 2 O 3 bảo vệ Al không tác dụng với nước ở bất kỳ nhiệt đ nào.<br />
Nếu phá bỏ lớp bảo vệ, Al tác dụng với nước ở nhiệt đô thư ng:<br />
2Al + 6H 2 O 2Al(OH) 3 + 3H 2 <br />
Phản ứng dừng lại vì lớp Al(OH) 3 bảo vệ không cho Al tiếp úc với nước.<br />
Kết luận: Trên th c tế Al và các vật dụng bằng nhôm không phản ứng với nước ở nhiệt đô thư ng<br />
5.T c dụng v i Bazơ<br />
Với dung dịch ba ơ kiềm:<br />
Al + H 2 O + NaOH ……………………………<br />
Zn + 2NaOH ……………………………<br />
Chú ý :Al,Zn đều tác dụng với dung dịch bazơ, dung dịch axit nhưng không gọi Al,Zn là chất<br />
lưỡng tính<br />
ùng pư này giải thích vì sao Al tác dụng dễ dàng với nước trong dung dịch kiềm<br />
• ung dịch NaOH phá hủy lớp Al 2 O 3 ở lớp ngòai:<br />
2NaOH + Al 2 O 3 ……………………………<br />
• Al sẽ phản ứng với nước: 2Al + 6H 2 O 2Al(OH) 3 + 3H 2 (1)<br />
• ung dịch NaOH phá hủy lớp bảo vệ Al(OH) 3 :<br />
NaOH + Al(OH) 3 NaAlO 2 + 2H 2 O.(2)<br />
Kết luận: dung dịch NaOH giữ vai trò hòa tan màng bảo vệ Al 2 O 3 ,Al(OH) 3 tạo điều kiện cho Al<br />
khử H 2 O dễ dàng.<br />
Từ (1) và (2), ta có: 2Al + 2H 2 O + 2NaOH 2NaAlO 2 + 3H 2 <br />
6.T c dụng v i Muối<br />
Chú ý:<br />
2Al + 3CuSO 4 .............................................<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Al + 3FeCl 3 .............................................<br />
Sau pư nếu Al dư : 2Al + 3FeCl 2 .............................................<br />
IV. ỨNG DỤNG<br />
Làm vật liệu hàng không, ây d ng, trang trí nhà cửa…<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
NHÔM 51<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
ùng làm dây dẫn cao thế, thiết bị nhiệt.<br />
Chế tạo hợp kim tecmit (Al,Fe 2 O 3 )dùng trong phản ứng nhiệt nhôm,hàn đư ng ray, hàn kim loại<br />
Giấy nhôm dùng gói th c phẩm.<br />
V. SẢN XUẤT NHÔM<br />
1. Nh trong t nhiên: chỉ hiện diện ở dạng hợp chất như:<br />
Đất sét: Al 2 O 3 .2SiO 2 .2H 2 O.<br />
Boxit: Al 2 O 3 .nH 2 O.<br />
Mica: Al 2 O 3 .K 2 O.6SiO 2 .<br />
Criolit: 3NaF.AlF 3 .(Na 3 AlF 6 )<br />
2. Nguyên tắc sản xuất Al: điện phân nóng chảy Al 2 O 3 khan trong criolit<br />
Giai đọan 1<br />
Chuẩn bị chất điện li nóng chảy ta tr n lẫn Al 2 O 3 khan với Criolit(3NaF .AlF 3 )nóng chảy nhằm:<br />
• Hạ đ nóng chảy của Al 2 O 3 (khỏang 900 o C) , tiết kiệm năng lượng.<br />
• Tạo chất lỏng có tính dẫn điện cao hơn.<br />
• Tạo hỗn hợp lỏng không cho Al nóng chảy bị o i hóa trong không khí.<br />
Giai đọan 2: thiết bị điện phân<br />
C c âm (than chì): khử Al 3+ thành Al.<br />
Al 3+ + 3e Al.<br />
C c dương: (thỏi than chì) o i hóa O 2- thành O 2 .<br />
2O 2- O 2 + 4e<br />
(O 2 tạo ra đốt cháy than chì tạo khí CO ,CO 2 )do đó sau m t th i gian phải thay thế<br />
c c dương C + O 2 → CO 2<br />
2C + O 2 →2CO<br />
Phương trình điện phân: 2Al 2 O 3<br />
<br />
4Al + 3O 2 <br />
Ví dụ : Tính khối lượng o yt nhôm và lượng than chì c n dùng để sản uất 5,4 tấn nhôm cho rằng lương<br />
than chì bị o y thoát ra ở c c dương o y hoá hết thành CO 2 .Cho hiệu suất mỗi pư đều đạt 80%<br />
………………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………………<br />
dpnc<br />
criolit<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
52 NHÔM<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
BÀI: MỘT Ố HỢP CHẤT QUAN TRỌNG CỦA NHÔM<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. NHÔM OXIT Al 2 O 3<br />
1)Lý tính<br />
Chất r n, không tan và không tác dụng với nước, t nc = 2050 o C.Có trong quặng mỏ (bo it), đá quý (Rubi,<br />
Saphia… )<br />
2)Hóa tính<br />
a. Là hợp chất lưỡng tính<br />
Tác dụng với dd a it: Al 2 O 3 + 6HCl .............................................<br />
Tác dụng với dd kiềm:<br />
2NaOH + Al 2 O 3 .............................................<br />
b. Là hợp chất rất bền v i nhiệt:kh ng bị khử bởi : H 2 ,C, CO…tạo Al<br />
2000 C<br />
Trong lò điện: 2Al 2 O 3 + 9C Al 4 C 3 + 6CO.<br />
)Điều chế<br />
t<br />
Nhiệt phân 2Al(OH) 3 .............................................<br />
t<br />
2Al(NO 3 ) 3 .............................................<br />
II. NHÔM HIDROXIT Al(OH) 3<br />
1. Lý tính: Kết t a keo trắng, kh ng tan trong nư c<br />
2. Hóa tính<br />
a. Tính lưỡng tính<br />
Tác dụng với dd a it: Al(OH) 3 + 3HCl .............................................<br />
Tác dụng với dd kiềm: NaOH + Al(OH) 3 .............................................<br />
b. Tính ké bền v i nhiệt<br />
900 C<br />
2Al(OH) 3 .............................................<br />
c. V i dung dịch a oniac<br />
Al(OH) 3 không phản ứng dung dịch amoniac (không tan trong dd NH 3 )<br />
Zn(OH) 2 ,Cu(OH) 2 , Ni(OH) 2 ,AgCl …tan trong dung dịch amoniac do tạo phức<br />
3. Điều chế<br />
o<br />
Nhỏ từ từ cho tới dư dung dịch NH 3 vào dung dịch muối Al 3+<br />
AlCl 3 + 3NH 3 + 3H 2 O .............................................<br />
o<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
NHÔM 53<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Nhỏ từ từ vừa đủ dung dịch NaOH vào dung dịch muối Al 3+ (không làm ngược lại)<br />
AlCl 3 + 3NaOH .............................................<br />
Nhỏ từ từ dung dịch HCl lo ng vừa đủ vào dung dịch muối AlO 2<br />
-<br />
NaAlO 2 + HCl + H 2 O .............................................<br />
ẫn CO 2 từ từ cho tới dư vào dung dịch muối AlO 2 - :<br />
NaAlO 2 + 2H 2 O + CO 2 .............................................<br />
III. NHÔM SUNFAT Al 2 (SO 4 ) 3<br />
Phèn chua K 2 SO 4 .Al 2 (SO 4 ) 3 .24H 2 O. hay KAl(SO 4 ) 2 .<strong>12</strong>H 2 O.<br />
Phèn nhôm M 2 SO 4 .Al 2 (SO 4 ) 3 .24H 2 O. hay MAl(SO 4 ) 2 .<strong>12</strong>H 2 O.( M là Li,K,Na hoặc NH 4 )<br />
- Ứng dụng: làm trong nước.<br />
K 2 SO 4 .Al 2 (SO 4 ) 3 .24H 2 O 2K + + 2Al 3+ + 4SO 4<br />
2-<br />
Al 3+ + 3H.OH <br />
Al(OH) 3 + 3H + .<br />
+ 24H 2 O.<br />
- Al(OH) 3 khi kết tủa dạng keo sẽ gom tụ các vẩn đục trong nước l ng uống làm nước trong.<br />
IV. NHÔM CLORUA AlCl 3<br />
- ùng làm chất úc tác trong công nghiệp tổng hợp hữu cơ<br />
V. CACBUA NHÔM Al 4 C 3<br />
Al 4 C 3 + <strong>12</strong>H 2 O .............................................<br />
Al 4 C 3 + <strong>12</strong>HCl .............................................<br />
Phản ng nhiệt nh<br />
2yAl + 3M x O y<br />
TOÁN NHIỆT NHÔM<br />
:là phản ứng của Al với o it kim lọai sau Al ở nhiệt đ cao:<br />
yAl 2 O 3 + 3xM<br />
- Nếu phản ứng không hoàn toàn (H< 100%) thì sau phản ứng sẽ chứa hh 4 chất r n :<br />
Al dư (phản ứng với dd NaOH. tạo khí )<br />
<br />
t<br />
<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Al 2 O 3 tạo thành ( tan trong dung dịch a it, kiềm nhưng không tạo khí)<br />
M tạo thành( phản ứng với dd a it.tạo khí )<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
<br />
M x O y dư ( tan trong dd a it nhưng không tạo khí)<br />
- Nếu phản ứng hoàn toàn (H =100%) thì sau phản ứng sẽ chứa :<br />
54 NHÔM<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
<br />
<br />
<br />
TH1: Al dư ,Al 2 O 3 và kim loại M tạo thành M tạo thành<br />
TH2: M x O y dư ,Al 2 O 3 và kim loại M tạo thành M tạo thành<br />
TH3: M x O y và Al phản ứng vừa đủ sau pư chỉ có Al 2 O 3 và kim loại M tạo thành<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
-Hiệu suát phản ứng nhiệt nhôm:<br />
n<br />
Al<br />
pu 2 3pu<br />
H<br />
(Al)<br />
= 100 H<br />
(Fe2O 3)<br />
= 100<br />
n<br />
Al<br />
bd 2 3bd<br />
Câu 1 : Tr n 5,4 gam b t Al với 17,4g b t Fe 3 O 4 rồi tiến hành phản ứng nhiệt Al(giả sử chỉ xảy ra<br />
phản ứng khử Fe 3 O 4 thành Fe) .Hòa tan hoàn toàn hh chất r n sau phản ứng bằng dd H 2 SO 4 lo ng, dư<br />
thì thu được 5,376 lít H 2 (đktc). Hiệu suất phản ứng là.<br />
A. 62,5 % B. 20% C. 60% D. 80%<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
…………………………………………………………………………………………………………..<br />
Câu 2 : Hh X gồm Al và Fe 2 O 3 . Lấy 85,6gam X đem nung nóng để th c hiện phản ứng nhiệt nhôm,<br />
sau m t th i gian thu được m gam chất r n Y. Chia Y làm 2 ph n bằng nhau:<br />
- Ph n 1: Hòa tan trong dd NaOH dư thấy thoát ra 3,36lít khí (đktc) và còn lại m 1 gam chất không tan.<br />
- Ph n 2: Hòa tan hết trong dd HCl thấy thoat ra 10,08 lít khí (đktc).<br />
Ph n trăm khối lượng Fe trong Y là?<br />
A. 18% B. 39,25% C. 19,6% D. 40%<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Câu 3 : Cho hh A khối lượng m gam b t Al và FexOy. Tiến hành phản ứng nhiệt nhôm hỗn hợp A<br />
trong điều kiện không có o i được hh B .Nghiền nhỏ và tr n đều rồi chia làm haiph n<br />
Ph n I có khối lượng 14,49 gam được hoà tan hết trong dd HNO3 đun nóng đượcdd C và 3,696 lít khí<br />
NO đktc .<br />
Ph n II tác dụng với lượng dư dd NaOH đun nóng thấy thoát ra 0,336 lít khí đktc vàcòn lại 2,52 gam<br />
chất r n không tan .các phản ứng xảy ra hoàn toàn .Xác định công thức của oxit s t<br />
NHÔM 55<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
n<br />
n<br />
Fe O<br />
Fe O<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………….....<br />
...................................................................................................................................................................<br />
Câu 4 : (ĐH 2015)Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03 mol Cr 2 O 3 ; 0,04 mol FeO và a<br />
mol Al. Sau m t th i gian phản ứng, tr n đều, thu được hỗn hợp chất r n Y. Chia Y thành hai ph n<br />
bằng nhau. Ph n m t phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M (loãng). Ph n hai phản ứng<br />
với dung dịch HCl lo ng, nóng (dư), thu được 1,<strong>12</strong> lít khí H 2 (đktc). Giả sử trong phản ứng nhiệt<br />
nhôm, Cr 2 O 3 chỉ bị khử thành Cr. Ph n trăm khối lượng Cr 2 O 3 đ phản ứng là<br />
A. 20,00% . B. 66,67% . C. 33,33% . D. 50,00% .<br />
Giải<br />
-Hiểu rằng: Crom, Crom(III)oxit không phản ứng với dung dịch NaOH loãng<br />
Tính oxyhóa của Fe 2+ >Cr 3+ nên FeO pư trước vì Cr 2 O 3 đ pư nên FeO đ bị khử hết thành Fe<br />
Chất r n Y + dung dịch NaOH<br />
Al dư , Al 2 O 3 + NaOH NaAlO 2 n Alban đầu = n NaOH = 0,08 (mol)<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………….…<br />
……………………………………………………………………………………………………………<br />
………………………………………………………………………………………………………...<br />
Câu 5 : Cho<br />
gam Al và y gam FeO đem nung nóng th c hiện phản ứng nhiệt nhôm trong điều kiện<br />
không có không khí ta được chất r n A ,đem A hòa tan trong dd NaOH dư thu được V lít H2 đkc và m<br />
gam r n B.Tìm s liên quan giữa x,y và m.Biết các phản ứng xảy ra hoàn toàn<br />
x y-m V<br />
A. = +<br />
9 8 11,2<br />
x y-m V<br />
B. = +<br />
27 16 22,4<br />
V<br />
m V<br />
C. x + y = m + D. x + y = +<br />
22,4 56 22,4<br />
Gợi ý: Quy đổi hh ban đ u thành Fe,O,Al rồi dùng bảo toàn e<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………<br />
……………………………………………………………………………………………………………..<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
56 NHÔM<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
C<strong>ÔN</strong>G THỨC GIẢI NHANH MUỐI NHÔM,MUỐI KẼM<br />
I. Khi cho dung dịch kiề OH - vào hh dd ch a Al 3+ hoặc dd ch a H + và Al 3+<br />
Gọi a là mol Al 3+ , b số mol kết tủa tan bớt là Kết tủa còn lại là (a-b) (n↓đề cho)<br />
H + + OH - → H 2 O Al 3+ + 3 OH - → Al(OH) 3 Al(OH) 3 + OH - → AlO - 2 + 2H 2 O<br />
Tính lượng NaOH cần cho vào dung dịch Al 3+ để thu được lượng kết t a theo yêu cầu (Dạng<br />
này có 2 kết quả)<br />
C ng th c:<br />
n OH = 3n - <br />
n OH - = 4n Al 3+ - n <br />
Tính lượng NaOH cần cho vào h n hợp dung dịch Al 3+ và H + để thu được lượng kết t a theo<br />
yêu cầu (Dạng này có 2 kết quả)<br />
C ng th c: n = n 3n<br />
OH - H <br />
+ n OH - = n +<br />
H 4n Al 3+ - n <br />
II. Khi cho dung dịch axit H + vào hh dd ch a AlO - 2 hoặc dd ch a OH - và AlO - 2<br />
Gọi a là mol AlO - 2 , b số mol kết tủa tan bớt là Kết tủa còn lại là (a-b) (n↓đề cho)<br />
H + + OH - → H 2 O H + + AlO - 2 + H 2 O → Al(OH) 3 3H + + Al(OH) 3 → Al 3+ + 3H 2 O<br />
Tính lượng HCl cần cho vào dung dịch NaAlO 2 để thu được lượng kết t a theo yêu cầu<br />
(Dạng này có 2 kết quả)<br />
C ng th c:<br />
n = 4n - 3 n <br />
n <br />
H<br />
= n hoặc +<br />
H AlO<br />
- 2<br />
Tính lượng HCl cần cho vào h n hợp dd NaAlO 2 hoặc dd NaOH vàNaAlO 2 thu được lượng<br />
kết t a theo yêu cầu (Dạng này có 2 kết quả)<br />
C ng th c: n = n + - n<br />
H OH hoặc n = n + 4n - 3n<br />
OH<br />
- AlO<br />
- 2<br />
III. Khi cho dung dịch kiề OH - vào hh dd Zn 2+ hoặc dd ch a H + và Zn 2+<br />
H <br />
Gọi a là mol Zn 2+ , b số mol kết tủa tan bớt là Kết tủa còn lại là a-b (n↓đề cho)<br />
H + + OH - → H 2 O Zn 2+ + 2 OH - →Zn(OH) 2 Zn(OH) 2 + 2OH - 2<br />
→ ZnO + 2H 2 O<br />
Tính lượng NaOH c n cho vào dung dịch Zn 2+ để thu được lượng kết tủa theo yêu c u (Dạng này<br />
có 2 kết quả):<br />
C ng th c:<br />
n = 2n hoặc n = 4n - 2n<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
OH -<br />
<br />
OH- Zn2+<br />
Tính lượng NaOH c n cho vào hỗn hợp dung dịch Zn 2+ và H + để thu được lượng kết tủa theo yêu c u<br />
(Dạng này có 2 kết quả)<br />
C ng th c: n = n + + 2n hoặc n = n + + 4n - 2n<br />
OH -<br />
H<br />
<br />
OH- H Zn2+<br />
<br />
<br />
2<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
NHÔM 57<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
1/ C n cho m t thể tích dung dịch NaOH 1M lớn nhất là bao nhiêu vào dung dịch chứa đồng th i 0,6mol<br />
AlCl 3 và 0,2mol HCl để uất hiện 39gam kết tủa.<br />
..........................................................................................................................................................................<br />
..........................................................................................................................................................................<br />
2/ C n cho bao nhiêu lít dung dịch HCl 1M vào dung dịch chứa 0,7mol NaAlO 2 để thu được 39 gam kết<br />
tủa<br />
..........................................................................................................................................................................<br />
..........................................................................................................................................................................<br />
3/ Thể tích dung dịch HCl 1M c c đại c n cho vào dung dịch chứa đồng th i 0,1mol NaOH và 0,3mol<br />
NaAlO 2 là bao nhiêu để uất hiện 15,6gam kết tủa?<br />
..........................................................................................................................................................................<br />
..........................................................................................................................................................................<br />
4/ Cho dd chứa 0,1 mol NaAlO 2 , tác dụng với dd HCl . Sau phản ưng thu được 6,24 gam kết tủa . Tìm<br />
số mol HCl đ phản ứng<br />
..........................................................................................................................................................................<br />
..........................................................................................................................................................................<br />
5/ Cho V lít dung dịch NaOH 2M vào dung dịch chứa 0,1 mol Al 2 (SO 4 ) 3 và 0,1 mol H 2 SO 4 đến khi<br />
phản ứng hòan toàn, thu được 7,8 gam kết tủa. Giá trị lớn nhất của V để thu được lượng kết tủa trên là:<br />
A. 0,45 B. 0,35<br />
C. 0,25 D.0,05<br />
6/ Cho dung dịch chứa 2,8 gam NaOH tác dụng với dung dịch chứa 3,42 gam Al 2 (SO 4 ) 3 . Sau phản ứng<br />
khối lượng kết tủa thu được là:<br />
A. 3,<strong>12</strong> gam. B. 2,34 gam.<br />
C. 1,56 gam. D. 0,78 gam.<br />
7/ Cho a mol AlCl 3 vào 200g dung dịch NaOH 4% thu được 3,9g kết tủa. Giá trị của a là:<br />
A. 0,05 B. 0,0<strong>12</strong>5<br />
C. 0,0625 D 0,<strong>12</strong>5<br />
8/ Hoà tan hoàn toàn 0,3 mol hỗn hợp gồm Al và Al 4 C 3 vào dung dịch KOH (dư), thu được a mol hỗn<br />
hợp khí và dung dịch X. Sục khí CO2 (dư) vào dung dịch X, lượng kết tủa thu được là 46,8 gam. Giá trị<br />
của a là<br />
A. 0,55. B. 0,60.<br />
C. 0,40. D. 0,45.<br />
9/ Nhỏ từ từ 0,25 lít dung dịch NaOH 1,04M vào dung dịch gồm 0,024 mol FeCl 3 ; 0,016 mol Al 2 (SO 4 ) 3<br />
và 0,04 mol H2SO4 thu được m gam kết tủa. Giá trị của m là<br />
A. 2,568. B. 1,560.<br />
C. 4,<strong>12</strong>8. D. 5,064.<br />
10/ Rót từ từ 400 ml dung dịch HCl 2M vào 200 ml dung dịch NaAlO 2 1M. Tính khối lượng kết tủa thu<br />
được?<br />
A.15,6 gam<br />
B.7,8 gam<br />
C.11,7 gam<br />
D.3,9 gam<br />
11/ Cho 2,7 gam Al vào 100 ml dung dịch NaOH 2,0 M thu được dung dịch A. Thêm dung dịch chứa<br />
0,45 mol HCl vào dung dịch A thì lượng kết tủa thu được là:<br />
A.3,90 gam.<br />
B.1,30 gam.<br />
C.7,80 gam.<br />
D.2,34 gam<br />
<strong>12</strong>/ Khi cho 100 ml dd HCl 0,2 M vào 200 ml dd NaAlO 2 0,075 M khối lượng kết tủa thu được là:<br />
A.3,<strong>12</strong> gam.<br />
B.0,52 gam.<br />
C.1,17 gam.<br />
D.0 gam<br />
13/ Cho 200 ml ddNaOH vào 200 ml dung dịch 200 ml dung dịch AlCl 3 2M, thu được m t kết tủa, nung<br />
kết tủa đến khối lượng không đổi được 5,1 gam chất r n. Nồng đ mol/lít của dung dịch NaOH là:<br />
A.1,5 M và 7,5 M B.1,5 M và 3M.<br />
C.1M và 1,5 M.<br />
D.2M và 4M<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
58 NHÔM<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
14/ Cho 3,42 gam Al 2 (SO 4 ) 3 vào 50ml dung dịch NaOH, thu đợc 1,56 gam kết tủa và dung dịch X. Nồng<br />
đ mol/lớt của dung dịch NaOH là:<br />
A. 0,6 mol/lit B.1,2 mol/lit<br />
C.2,4mol/lit<br />
D.3,6 mol/lit<br />
15/ Cho V lít dung dịch NaOH 1M vào dung dịch chứa 0,1 mol Al 2 (SO 4 ) 3 và 0,1 mol H 2 SO 4 đến khi<br />
phản ứng hoàn toàn, thu đợc 7,8 gam kết tủa. Giá trị lớn nhất của V để thu được lượng kết tủa trên là:<br />
A.0, 5 lít<br />
B.0,7 lít<br />
C. 0,9 lít D.1,2 lít<br />
16/ Cho V lit dung dịch NaOH 0,35 M tác dụng với 2 lit dung dịch AlCl 3 0,1 M, lượng kết tủa thu đợc là<br />
7,8 gam, giá trị V lớt lớn nhất là:<br />
A.2,0 lít B.1,0 lít<br />
C.1,5 lít<br />
D. 3,0 lít<br />
17/ Cho V lít dung dịch HCl 0,5 M vào 2lít dung dịch KAlO 2 0,2 M thu đợc 15,6 gam kết tủa keo. giá trị<br />
V lít lớn nhất là:<br />
A.2,0 lít<br />
B. 5,0 lít<br />
C. 1,5 lít D.2,5 lít<br />
18/ Cho 200ml dung dịch H 2 SO 4 0,25 M vào 4lít dung dịch KAlO 2 0,1 M thu đợc a gam kết tủa. Giá trị<br />
của a gam là:<br />
A.7,8 gam<br />
B.1,56 gam<br />
C. 2,34 gam D.1,17 gam.<br />
19/ Tr n dd chứa mol AlCl 3 với dd chứa y mol NaOH. Để thu đợc kết tủa c n cú tỷ lệ<br />
A. x:y=1:4 B. x:y1:4<br />
20/ M t dung dịch hỗn hợp chứa a mol NaAlO 2 và a mol NaOH tác dụng với m t dung dịch chứa b mol<br />
HCl. Điều kiện để thu được kết tủa sau phản ứng là:<br />
A.a = b B.a = 2b.<br />
C.b = 5a.<br />
D.a < b < 5a<br />
21/ Thêm m gam kali vào 300ml dung dịch chứa Ba(OH) 2 0,1M và NaOH 0,1M thu được dung dịch X.<br />
Cho từ từ dung dịch X vào 200ml dung dịch Al 2 (SO 4 ) 3 0,1M thu được kết tủa Y. Để thu được lượng kết<br />
tủa Y lớn nhất thì giá trị của m là<br />
A. 1,59. B. 1,17.<br />
C. 1,71. D. 1,95.<br />
22/ Hoà tan hoàn toàn m gam ZnSO 4 vào nước được dung dịch X. Nếu cho 110 ml dung dịch KOH 2M<br />
vào X thì thu được 3a gam kết tủa. Mặt khác, nếu cho 140 ml dung dịch KOH 2M vào X thì thu được 2a<br />
gam kết tủa. Giá trị của m là<br />
A. 17,71. B. 16,10.<br />
C. 32,20. D. 24,15.<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
NHÔM 59<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
huyên đề: Ắ - CROM -<br />
BÀI: ẮT ( Fe = 56 )<br />
Ồ G<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. VỊ TRÍ, CẤU TẠO NGUYÊN TỬ<br />
S t ở ô thứ 26, nhóm VIIIB, chu kì 4<br />
Cấu hình electron: Fe (Z=26): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 hay [Ar]3d 6 4s 2<br />
II. TÍNH CHẤT VẬT LÝ<br />
Fe 2+ : [Ar]3d 6 Fe Fe 2+ + 2e Fe 2+ có ……e ngoài cùng<br />
Fe 3+ : [Ar]3d 5 Fe Fe 3+ + 3e Fe 3+ có ……….e ngoài cùng<br />
S t nguyên chất là kim loại có màu tr ng hơi ám, dẻo, dễ rèn, nhiệt đ nóng chảy 1540 o C<br />
S t có tính nhiễm từ khí bị nam châm hút.<br />
ẫn điện kém và giảm d n :Ag > Cu > Au > Al > Fe<br />
III. TÍNH CHẤT <strong>HÓA</strong> HỌC<br />
Fe có tính khử trung bình<br />
Nguyên tử Fe có thể bị oxi hóa thành ion Fe 2+ hay Fe 3+ tùy thu c vào chất o i hóa đ tác dụng với<br />
Fe. Chất oxi hóa mạnh như Cl 2 , HNO 3 , H 2 SO 4 đặc nóng…o i hóa Fe thành Fe 3+ ; chất oxi hóa yếu<br />
hơn như HCl, H 2 SO 4 loãng, m t số dung dịch muối…o i hóa Fe thành Fe 2+<br />
1.T c dụng v i phi ki<br />
t<br />
2Fe + 3Cl 2 …………………………………………. …………..<br />
Fe + Br 2<br />
Fe + I 2<br />
Fe + S<br />
t<br />
3Fe + 2O 2 <br />
2.T c dụng v i axit<br />
• Với HCl, H 2 SO 4 lo ng: tạo muối Fe (II) + H 2<br />
0<br />
t<br />
0<br />
<br />
0<br />
t<br />
<br />
0<br />
t<br />
<br />
0<br />
…………………………………………………………<br />
…………………………………………………………..<br />
………………………………………………………….<br />
……………………………………………………..<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ví dụ: Fe + H 2 SO 4<br />
Fe + 2HCl<br />
………………………………………………………………….<br />
…………………………………………………………………<br />
• Với H 2 SO 4 và HNO 3 đặc ngu i: Fe không phản ứng.<br />
60 SẮT<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
• Với HNO 3 loãng, HNO 3 và H 2 SO 4 đặc, nóng:<br />
Fe + 4HNO 3 loãng ………………………………………………………………….<br />
Fe + 6HNO 3 đặc, nóng ………………………………………………………………<br />
2Fe + 6H 2 SO 4 đặc, nóng ……………………………………………………………….<br />
Nếu sau phản ng Fe dư , Fe khử tiếp Fe 3+ tạo uối Fe 2+<br />
Fe dư + 2H 2 SO 4 đặc<br />
……………………………………………………………….<br />
3Fe dư + 8HNO 3 loãng …………………………………………………………………<br />
Đề bài cho Fe tác dụng với lượng tối thiểu H 2 SO 4 ,HNO 3 hoặc cho Fe dư tác dụng với lượng<br />
H 2 SO 4 ,HNO 3 thì sau phản ứng đều tạo muối Fe 2+<br />
3.Tác dụng v i dung dịch muối: Fe khử được ion c a các kim loại đ ng sau nó.<br />
Ví dụ: Fe + CuSO 4<br />
Fe + Fe 2 (SO 4 ) 3<br />
4.T c dụng v i H 2 O<br />
Ở nhiệt đ thư ng s t không khử nước<br />
…………………………………………………………..<br />
…………………………………………………………..<br />
Ở nhiệt đ cao khi bị nung nóng đỏ Fe khử được hơi nước:<br />
t 570 C<br />
Ví dụ: Fe + H 2 O ………………………………………………………<br />
t 570 C<br />
Fe + H 2O ……………………………………………………….<br />
* Đặc biệt : Ở t 0 thư ng s t không bị o i hóa trong khí o i khô , khí clo khô và nước không hòa tan<br />
o i , clo. Nhưng trong không khí ẩm hay trong nước có hòa tan o i , s t dễ dàng bị o i hóa thành Fe 3+<br />
tạo gỉ s t nâu đỏ<br />
4Fe + 3O 2 + 6H 2 O ……………………………………………………<br />
I. HỢP CHẤT SẮT (II)<br />
BÀI: MỘT Ố HỢP CHẤT QUAN TRỌNG CỦA ẮT<br />
Tính chất hóa học đặc trưng của hợp chất s t (II) là tính khử (dễ bị oxi hóa) ngoài ra hợp chất<br />
s t (II) còn có tính oxy hoá<br />
1. Tính khử (đặc trưng)<br />
a. ắt (II) oxit: FeO<br />
0 0<br />
0 0<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ví dụ: 3FeO + 10HNO 3 loãng<br />
0<br />
t<br />
……………………………………………………………<br />
SẮT 61<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
4 FeO + O 2 …………………………………………………………………….<br />
b. ắt (II) hidroxit: Fe(OH) 2<br />
4Fe(OH) 2 + O 2 + 2H 2 O<br />
<br />
……………………………………………………………<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
2Fe(OH) 2 + O 2<br />
3Fe(OH) 2 + 10HNO 3<br />
c. Muối sắt (II)<br />
…………………………………………………………………<br />
……………………………………………………………<br />
2FeCl 2 + Cl 2 …………………………………………………………… …….<br />
FeSO 4<br />
FeSO 4<br />
+ KMnO 4 + H 2 SO 4 ………………………………………………….<br />
+ K 2 Cr 2 O 7 + H 2 SO 4 …………………………………………………<br />
FeS + H 2 SO 4 đặc ……………………………………………………………<br />
FeS 2 + H 2 SO 4 đặc …………………………………………………………..<br />
FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2<br />
FeS 2 + 18HNO 3<br />
……………………………………………………………….<br />
FeS + 6HNO 3 ……………………………………………………………….....<br />
FeCO 3 + 4HNO 3<br />
… ……………………………………………………………<br />
2FeCO 3 + 4H 2 SO 4 đặc …………………………………………………………..<br />
FeS<br />
+ HNO 3 …………………………………………………………………………………………<br />
Fe(NO 3 ) 2 + AgNO 3 …………………………………………………………………………………….<br />
FeCl 2 + HCl + NaNO 3 … ………………………………………………………………………………<br />
FeSO 4 + H 2 SO 4 + KNO 3 ........................................................................<br />
Phương trình ion thu gọn:<br />
<br />
3Fe 2+ + NO 3 - + 4H +<br />
………………………………………………………<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Chú ý: FeO , Fe(OH) 2 khi tác dụng với HCl hay H 2 SO 4 loãng tạo muối s t (II)<br />
Ví dụ: FeO + 2HCl …………………………………………………………..<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Fe(OH) 2 + 2HCl ………………………………………………………<br />
Nhưng FeCl 2 , FeO , Fe(OH) 2 khi tác dụng với HNO 3 hay H 2 SO 4 đặc tạo muối s t (III) và sản phẩm<br />
62 SẮT<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
khử<br />
FeO + HNO 3<br />
…………………………………………………………………..<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Fe(OH) 2 + HNO 3 …………………………………………………………………..<br />
Fe(NO 3 ) 2 + HNO 3 ………………………………………………………………….<br />
2. Tính oxi hóa<br />
t<br />
FeO + CO ……………………………………………………………………………<br />
FeSO 4 + Zn ……………………………………………………………………….<br />
II. HỢP CHẤT SẮT (III) : Hợp chất sắt (III) chỉ có tính oxi hóa<br />
1. Sắt (III) oxit: Fe 2 O 3<br />
- Là oxit bazơ: tác dụng với axit tạo muối s t (III) và nước.<br />
Ví dụ:<br />
Fe 2 O 3 + 6HCl ………………………………………………………………………<br />
Fe 2 O 3 + 6HNO 3 ……………………………………………………………………<br />
- Bị CO, H 2 , Al khử thành Fe ở nhiệt đ cao pư ảy ra theo nhiều giai đoạn:<br />
Fe 2 O CO<br />
3 0 Fe 3 O 4 CO<br />
CO<br />
FeO Fe<br />
0<br />
0<br />
t<br />
Ví dụ: Fe 2 O 3 + CO<br />
0<br />
t<br />
…………………………………………………………..<br />
t<br />
Fe 3 O 4 + CO 0<br />
………………………………………………………………<br />
FeO 3 + CO<br />
0<br />
t<br />
……………………………………………………………….<br />
t<br />
Vậy : Fe 2 O 3 + CO 0<br />
dư ……………………………………………….<br />
Điều chế: phân hủy Fe(OH) 3 ở nhiệt đ cao.<br />
Ví dụ: 2Fe(OH) 3<br />
0<br />
t<br />
0<br />
t<br />
……………………………………………………………<br />
2. Sắt (III) hidroxit: Fe(OH) 3 Tác dụng với axit: tạo muối và nước<br />
t<br />
Ví dụ: Fe(OH) 3 + 3H 2 SO 0<br />
4 …………………………………………………..<br />
Điều chế: cho dung dịch kiềm tác dụng với muối s t (III).<br />
t<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
FeCl 3 + 3NaOH …………………………………………………………………….<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
SẮT 63<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
3. Muối sắt (III): Có tính oxi hóa (dễ bị khử)<br />
Ví dụ: Fe + 2FeCl 3 ………………………………………………………………...<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Cu + 2FeCl 3 …………………………………………………………………<br />
Hợp chất s t( ) o i hoá m t số hợp chất có tính khử :<br />
2FeCl 3 + 2KI ………………………………………………………………………..<br />
FeCl 3 +<br />
H 2 S ……………………………………………………………………….<br />
FeCl 3 dư + Mg ………………………………………………………………………..<br />
FeCl 3 + Mg dư ………………………………………………………………………….<br />
Chú ý : Fe 3 O 4 ( em như là hỗn hợp FeO.Fe 2 O 3 ). Là chất r n màu nâu, không tan trong nước.<br />
- Tính bazơ: Fe 3 O 4 + 8HCl ……………………………………………………………<br />
Fe 3 O 4 + 4H 2 SO 4 loãng ……………………………………………………………………..<br />
- Tính khử: 2Fe 3 O 4 + 10H 2 SO 4 đặc ……………………………………………………<br />
Fe 3 O 4 + 10HNO 3 ………………………………………………………<br />
- Tính oxi hoá: Thể hiện khi tác dụng với các chất khử thông thư ng như C, CO, H 2 , Al:<br />
Fe 3 O 4 + 4CO<br />
0<br />
t<br />
……………………………………………………………<br />
TỔNG QUÁT VỀ PHẢN ỨNG CỦA Fe x O y VỚI AXIT<br />
FeO + 2HCl → FeCl 2 + H 2 O<br />
3FeO + 10HNO 3 loãng → 3Fe(NO 3 ) 3 + NO + 5H 2 O<br />
FeO + 4HNO 3 đặc<br />
o<br />
t<br />
Fe(NO 3 ) 3 + NO 2 + 2H 2 O<br />
FeO + H 2 SO 4 loãng → FeSO 4 + H 2 O<br />
2FeO + 4H 2 SO 4 đặc<br />
o<br />
t<br />
Fe 2 O 3 + 6HCl → 2FeCl 3 + 3H 2 O<br />
Fe 2 (SO 4 ) 3 + SO 2 + 4H 2 O<br />
Fe 2 O 3 + 6HNO 3 → 2Fe(NO 3 ) 3 + 6H 2 O<br />
Fe 2 O 3 + 3H 2 SO 4 → Fe 2 (SO 4 ) 3 + 3H 2 O<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Fe 3 O 4 + 8HCl → FeCl 2 + 2FeCl 3 + 4H 2 O<br />
3Fe 3 O 4 + 28HNO 3 loãng → 9Fe(NO 3 ) 3 + NO + 14H 2 O<br />
Fe 3 O 4 + 10HNO 3 đặc<br />
o<br />
t<br />
3Fe(NO 3 ) 3 + NO 2 + 5H 2 O<br />
Fe 3 O 4 + 4H 2 SO 4 loãng → FeSO 4 + Fe 2 (SO 4 ) 3 + 4H 2 O<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
64 SẮT<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
2Fe 3 O 4 + 410H 2 SO 4 đặc<br />
Tổng quát:<br />
o<br />
t<br />
3Fe 2 (SO 4 ) 3 + SO 2 + 10H 2 O<br />
Fe x O y + 2y HCl x FeCl 2y/x + y H 2 O)<br />
3Fe x O y<br />
Fe x O y<br />
2Fe x O y<br />
+ (<strong>12</strong>x - 2y) HNO 3 3x Fe(NO 3 ) 3 + (3x – 2y) NO + (6x – y) H 2 O<br />
+ (6x - 2y) HNO 3 x Fe(NO 3 ) 3 + (3x – 2y) NO 2 + (3x – y) H 2 O<br />
+ (6x - 2y) H 2 SO 4 x Fe 2 (SO 4 ) 3 + (3x – 2y) SO 2 + (3x – y) H 2 O<br />
Nhận xét: m t oxit s t tác dụng với m t axit có tính oxi hóa mạnh, thì hệ số cân bằng của pt đối với<br />
khí sinh ra luôn là (3x – 2y). Như vậy, với Fe 2 O 3 (tức x= 2, y=3) thì hệ số (3x – 2y) = 0, tức là<br />
không có khí sinh ra.<br />
Tóm lại, Fe 2 O 3 tương tác với axit oxi hóa theo quy luận của m t o it ba ơ với m t a it bình thư ng<br />
chỉ cho ra muối và nước.<br />
Nhiệt phân hợp chất sắt II: Th ng thường có 2 giai đoạn<br />
Giai đoạn 1: nhiệt phân<br />
Giai đoạn 2: tương tác giữa các sản phẩm tạo thành (nếu có)<br />
Ví dụ: nhiệt phân Fe(NO 3 ) 2 đến khối lượng không đổi ta thu được Fe 2 O 3<br />
GĐ : 4 Fe(NO 3 ) 2<br />
GĐ2: 4 FeO + O 2<br />
4 Fe(NO 3 ) 2<br />
0<br />
t<br />
……………………………………………………………………<br />
0<br />
t<br />
0<br />
t<br />
…………………………………………………………………<br />
…………………………………………………………………….<br />
Vậy nhiệt phân Fe(NO 3 ) 2 có hay không có mặt không khí đều tạo Fe 2 O 3<br />
Ví dụ: Nung Fe(OH) 2 trong không khí đến khối lượng không đổi, ta thu được Fe 2 O 3<br />
GĐ : Fe(OH) 2<br />
GĐ2: 4 FeO + O 2<br />
4 Fe(OH) 2 + O 2<br />
o<br />
t<br />
khong co kk<br />
<br />
0<br />
t<br />
…………………………………………………………………….<br />
……………………………………………………………………….<br />
0<br />
t<br />
kk<br />
…………………………………………………………………….<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ví dụ: Nung Fe(OH) 2 trong không khí ẩm đến khối lượng không đổi, ta thu được Fe 2 O 3<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
GĐ : 4 Fe(OH) 2 + O 2 + 2 H 2 O → 4 Fe(OH) 3<br />
GĐ2: 4 Fe(OH) 3<br />
0<br />
t<br />
2 Fe 2 O 3 + 4 H 2 O<br />
SẮT 65<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
4 Fe(OH) 2 + O 2<br />
0<br />
t<br />
kk<br />
2 Fe 2 O 3 + 4 H 2 O<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Ví dụ: Nung FeCO 3 trong không khí đến khối lượng không đổi, ta có:<br />
GĐ1: FeCO 3<br />
GĐ2: 4 FeO + O 2<br />
0<br />
t<br />
kk<br />
4 FeCO 3 + O 2<br />
…………………………………………………………………….<br />
0<br />
t<br />
kk<br />
…………………………………………………………………….<br />
…………………………………………………………………….<br />
Ví dụ: Nung Fe(OH) 3 có hay không có mặt không khí đều tạo Fe 2 O 3<br />
2Fe(OH) 3<br />
Fe 2 O 3 + 3 H 2 O<br />
Nhiệt phân uối nitrat có trường hợp:<br />
uối nitrat<br />
c a KL<br />
o<br />
t<br />
<br />
o<br />
t<br />
<br />
Trư c Mg<br />
Li K Ca Na<br />
Từ Mg→Cu<br />
Sau Cu<br />
Hg , Ag, Pt , Au<br />
Sản phẩm muối nitrit +O 2 Oxyt + NO 2 + O 2 Kim loại + NO 2 + O 2<br />
Vd: t<br />
NaNO 0<br />
t<br />
3 NaNO 2 +O 2 Cu(NO 3 ) 0<br />
t<br />
2 CuO + AgNO 3 0<br />
Ag +<br />
2NO 2 + ½ O 2 NO 2 + ½ O 2<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
66 SẮT<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
BÀI: ẢN XUẤT GANG<br />
Gang:Là hợp kim c a Fe và C trong đó C chiếm 2%-5% ngoài ra còn có lượng nhỏ Mn,S,Si..<br />
I. SẮT TRONG TỰ NHIÊN<br />
M t số quặng s t<br />
- Quặng hematit có : Hematit đỏ : . . . . . . . . . .<br />
- Quặng manhetit : . . . . . . . . . .<br />
- Quặng iderit : . . . . . . . . . .<br />
- Quặng Pirit s t : . . . . . . . . . .<br />
II.SẢN XUẤT GANG :<br />
1. Nguyên liệu<br />
Hematit nâu : . . . . . . . . . .<br />
o Quặng s t : Chứa 30% s t trở lên, có ít P,S.<br />
o Than cốc : cung cấp nhiệt, tạo chất khử, tạo gang.<br />
o Chất chảy : chất chảy CaCO 3 , hoặc SiO 2 .<br />
o Không khí : Đốt cháy than cốc tạo chất khử CO và cung cấp nhiệt lượng<br />
2. Nguyên tắc sản xuất gang<br />
Khử o it s t bằng chất khử CO ở nhiệt đ cao (Phương pháp nhiệt luyện). Trong lò cao s t có số<br />
o i hóa cao bị khử d n uống số o i hóa thấp<br />
+ 8<br />
3 3<br />
+2 0<br />
Fe O F e O FeO Fe<br />
2 3 3 4<br />
3. Những phản ng xảy ra trong qu trình sản xuất gang<br />
a. Phản ng tạo chất khử CO : Ở trên nồi lò<br />
- Không khí nóng cháy với C : C + O 2 → . . . . .<br />
- CO 2 đi lên gặp C : CO 2 + C → . . . . .<br />
b. C c phản ng khử Oxit sắt<br />
- Ở ph n trên thân lò ở 400 o 400<br />
C : 3Fe 2 O 3 + CO C . . . . . . + . . . . .<br />
- Ở giữa thân lò 500 - 600 o 500<br />
C : Fe 3 O 4 + CO <br />
600<br />
<br />
C . . . . . + . . . . .<br />
- Ở ph n dưới thân lò 700 - 800 o 700<br />
C: FeO + CO <br />
800<br />
<br />
C . . . . ……….+ . . . . .<br />
Ở đây c ng có phản ứng phân hủy CaCO 3 và tạo ỉ CaSiO 3<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
c. tạo thành gang<br />
S t r n từ thân lò uống bụng lò có t 0 = 1.500 o C. S t nóng chảy hòa tan m t ph n C và m t lượng<br />
nhỏ: Mn, Si, ... tạo thành gang.<br />
0<br />
0<br />
0<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
SẮT 67<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
BÀI: ẢN XUẤT THÉP<br />
Thép :Là hợp kim c a Fe và C trong đó C chiếm 0,01%- 2% ngoài ra còn có lượng nhỏ Mn,Cr,Si,Ni..<br />
I. NGUYÊN LIỆU ĐỂ SẢN XUẤT THÉP<br />
- Gang tr ng, gang ám hoặc s t thép phế liệu.<br />
- Không khí hoặc o i.<br />
- Nhiên liệu : d u ma ut hoặc khí đốt.<br />
- Chất chảy : CaO hoặc SiO 2 .<br />
II. NGUYÊN TẮC SẢN XUẤT THÉP<br />
O i hóa các nguyên tố trong gang (Si, Mn, C, S, P) thành o it, nhằm làm giảm hàm lượng của<br />
chúng ,ta được thép.<br />
III. Những phản ng hóa học xảy ra trong quá trình luyện gang thành thép<br />
1. Phản ng tạo thép<br />
Không khí giàu o i hoặc o i sẽ o i hóa các tạp chất trong gang : trước hết Mn và Si bị o i hóa.<br />
Si + O 2 ......................................................................................................................<br />
Mn + O 2<br />
........................................................................................................................<br />
Tiếp đến C bị o i hóa thành CO ở 1.200 o C. : 2C + O 2 ..........................................<br />
Rồi đến S bị o i hóa thành SO 2 . : S + O 2 .......................................<br />
Sau đó đến P 4P + 5O 2 ........................................<br />
Sau cùng m t ph n Fe bị o i hóa thành FeO : 2Fe + O 2 .............................<br />
- Mn khử lại FeO thành Fe : Mn + FeO . . . . . . . . . . . ..<br />
- Gia tăng m t lượng C nhất định trong s t nóng chảy để được loại thép có hàm lượng C mong<br />
muốn.<br />
2. Phản ng tạo xỉ<br />
Ở nhiệt đ cao các o it a it như SiO 2 , P 2 O 5 tác dụng các o it ba ơ như CaO tạo ỉ Silicat, Photphat<br />
dễ nóng chảy, tỉ khối nhỏ ,<br />
3CaO + P 2 O 5 Ca 3 (PO 4 ) 2<br />
CaO + SiO 2 CaSiO 3<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
68 SẮT<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I.VỊ TRÍ – CẤU HÌNH ELECTRON<br />
BÀI: RO VÀ Ợ Ấ ỦA RO<br />
Cấu hình electron: Cr (Z=24): 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 hay [Ar]3d 5 4s 1<br />
Ô thứ 24, thu c nhóm VIB, chu kì 4nguyên tố họ d<br />
Cr 2+ : [Ar]3d 4 Cr 3+ : [Ar]3d 3<br />
II.TÍNH CHẤT <strong>HÓA</strong> HỌC: Tính khử mạnh hơn s t, các số oxi hóa thư ng gặp của crom là: +2 ,<br />
+3 , +6<br />
1. Tác dụng với phi kim:<br />
t<br />
- Tác dụng với o i: 4Cr + 3O 2 dư<br />
..........................................................<br />
0<br />
t<br />
- Tác dụng với halogen: 2Cr + 3Cl 2<br />
................................................................<br />
2. Tác dụng với axit<br />
- Tác dụng với dung dịch a it HCl và H 2 SO 4 loãng Muối crom( ) + H 2 :<br />
Cr + 2HCl .....................................................................................................................<br />
Cr + H 2 SO 4 loãng ........................................................................................................<br />
0<br />
Nếu có mặt o i không khí, muối Cr( ) chuyển thành muối Cr( ):<br />
2CrCl 2 + O 2 + 2HCl .................................................................................................<br />
2CrSO 4 + O 2 + H 2 SO 4 ...............................................................................................<br />
- ung dịch H 2 SO 4 đặc, nóng:<br />
2Cr + 6H 2 SO 4<br />
0<br />
t<br />
…………………………………………………………… ……<br />
- ung dịch HNO 3 : Cr tác dụng với dung dịch HNO 3 tạo thành Cr(NO 3 ) 3 , nước và các sản phẩmb<br />
ứng với số o i hoá thấp hơn của nitơ (NH 4 NO 3 ; N 2 ; N 2 O ; NO ; NO 2 ).<br />
Ví dụ:<br />
Cr + 6HNO 3 (đặc)<br />
0<br />
t<br />
………………………………………………………………<br />
Chú ý: *Cr không tan trong dung dịch HNO 3 đặc ngu i ,dung dịch H 2 SO 4 đặc ngu i<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
*Cr không tan trong dung dịch NaOH dù đặc hay loãng<br />
*Cr 2 O 3 chỉ tan trong dd kiề đặc .<br />
*Cr(OH) 3 tan trong dd kiềm<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
CROM 69<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
III.Hợp chất c a Cro :<br />
I.HỢP CHẤT CROM (II) :<br />
Có tính khử<br />
-CrO là oxit bazo<br />
-Cr(OH) 2 Hydroxyt là ba ơ<br />
1. Crom (II) oxit CrO :<br />
-Là m t oxit bazơ tác dụng với HCl , H 2 SO 4<br />
lo ng tạo thành muối crom( )<br />
CrO +2HCl ………………………<br />
-CrO có tính khử : trong kk<br />
4CrO +O 2 .......................................<br />
2. Crom (II) hydroxyt Cr(OH) 2<br />
-là chất r n,màu vàng,điều chế từ<br />
CrCl 2 + 2NaOH………………………<br />
- Cr(OH) 2 có tính khử , trong không khí<br />
Cr(OH) 2 bị o y hóa thành Cr(OH) 3 :<br />
4Cr(OH) 2 + O 2 +2H 2 O ...........................<br />
- Cr(OH) 2 là một bazơ :<br />
Cr(OH) 2 + HCl .......................<br />
3. Muối cro (II) : Muối crom ( ) có tính khử<br />
mạnh:<br />
4CrCl 2 + 4HCl + O 2 .................................<br />
2CrCl 2 + Cl 2 .................................<br />
2CrSO 4 + 2H 2 SO 4 (đặc) Cr 2 (SO 4 ) 3 + SO 2 +<br />
2H 2 O<br />
Phèn cromkali:<br />
K 2 SO 4 .Cr 2 (SO 4 ) 3 .24H 2 O<br />
hoặc KCr(SO 4 ) 2 .<strong>12</strong>H 2 O<br />
Phèn crom- kali có màu anh tím , được dùng để<br />
thu c da , làm chất c m màu trong ngành nhu m<br />
vải .<br />
II.HỢP CHẤT CROM (III) :<br />
Có tính khử và tính o yhóa<br />
-Cr 2 O 3 oxit lưỡng tính<br />
-Cr(OH) 3 Hydroxyt lưỡng tính<br />
1. Crom (III) oxit Cr 2 O 3 : Cr 2 O 3 là m t oxit<br />
lưỡng tính , tan trong a it và kiềm đặc<br />
Cr 2 O 3 +6HCl……………………………..<br />
Cr 2 O 3 + NaOH…………………………….<br />
(natri cromit)<br />
- Cr 2 O 3 màu lục thẫm được dùng tạo màu lục cho<br />
đồ sứ , đồ thủy tinh.<br />
2.Crom(III)hydroxyt Cr(OH) 3<br />
-- là chất r n ,màu anh điều chế<br />
CrCl 3 + 3NaOH………………………………..<br />
-Cr(OH) 3 là hydroxyt lưỡng tính tan trong dd kiềm<br />
,tan trong axit<br />
Cr(OH) 3 +NaOH ..........................<br />
Cr(OH) 3 + HCl ............................<br />
. Muối cro (III):<br />
-Vừa thể hiện tính khử vừa thể hiện tính o i hoá:<br />
- Zn khử muối Cr(III) thành muối Cr(II) .<br />
CrCl 3 + Zn ……………………………..<br />
- Trong môi trường kiềm , Br 2 oxi hóa muối Cr(III)<br />
thành Cr(VI) .<br />
NaCrO 2 + Br 2 + NaOH ……………………<br />
CrO 2<br />
-<br />
+ Br 2 + OH - CrO 4 2- +<br />
Br - + H 2 O<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Cr 3+ + Br 2 + OH - CrO 4 2- + Br - + H 2 O<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
70 CROM<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
III.HỢP CHẤT CROM (VI)<br />
Có tính oxyhóa<br />
Oxit CrO 3 , hiđro it H 2 Cr 2 O 7 , H 2 CrO 4 là axit<br />
1.Crom (VI) oxit CrO 3<br />
CrO 3 là chất r n màu đỏ thẫm. CrO 3 có tính o i hóa mạnh. M t số chất vô cơ và hữu cơ như S, P, C,<br />
NH 3 , C 2 H 5 OH ...bốc cháy t khi thiếp úc với CrO 3 , đồng th i CrO 3 bị khử thành Cr 2 O 3 .<br />
CrO 3 + NH 3 ..................................................................................................................<br />
CrO 3 + S .........................................................................................................................<br />
CrO 3 + P ....................................................................................................................<br />
CrO 3 + C ....................................................................................................................<br />
CrO 3 + C 2 H 5 OH ........................................................................................................<br />
CrO 3 là m t o it a it, tác dụng với nước tạo thành hỗn hợp a it cromic H 2 CrO 4 và a it đicromic<br />
H 2 Cr 2 O7<br />
CrO 3 + H 2 O ......................................................................................................................<br />
2CrO 3 + H 2 O .....................................................................................................................<br />
Hai a it này không tách được ở dạng t do, chỉ tồn tại trong dung dịch. Nếu tách khỏi dung dịch,<br />
chúng sẽ bị phân hủy trở thành CrO 3<br />
2.Muối cro at và đicro at: bền<br />
Giữa các ion CrO 4 2 và ion Cr 2 O 7 2 có s chuyển hóa lẫn nhau theo cân bằng hóa học :<br />
Cr 2 O 7<br />
2<br />
2CrO 4<br />
2<br />
+ 2H +<br />
+ 2OH 2CrO 4<br />
2<br />
+ H 2 O<br />
(da cam) ( vàng )<br />
2CrO 4<br />
2<br />
+ 2H + Cr 2 O 7<br />
2<br />
( vàng ) (da cam)<br />
+ H 2 O<br />
<br />
<br />
Cr 2 O 7<br />
2<br />
+ H 2 O<br />
- Các muối cromat và đicromat có tính oxi hóa mạnh , đặc biệt trong môi trư ng a it , muối<br />
Cr(V ) bị khử thành muối Cr( )<br />
K 2 Cr 2 O 7 + SO 2 + H 2 SO 4 ……………………………………………………….<br />
K 2 Cr 2 O 7 + KI+<br />
H 2 SO 4 ……………………………………………………….<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
K 2 Cr 2 O 7 + H 2 S+ H 2 SO 4 …………………………………………………….<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
K 2 Cr 2 O 7 +<br />
HCl…………………………………………………….<br />
CROM 71<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I.VỊ TRÍ – CẤU HÌNH ELECTRON<br />
Ô thứ 29, thu c nhóm IB, chu kì 4,nguyên tố họ d<br />
BÀI: Ồ G VÀ Ợ Ấ ỦA Ồ G<br />
Cấu hình electron: Cu (Z=29) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 hay [Ar]3d 10 4s 1<br />
II.TÍNH CHẤT <strong>HÓA</strong> HỌC<br />
Cu 2+ : [Ar]3d 9 Cu Cu 2+ + 2e Cu 2+ có ……e ngoài cùng<br />
Cu + : [Ar]3d 10 Cu Cu + + 1e Cu + có ……….e ngoài cùng<br />
Là kim loại kém hoạt đ ng, có tính khử yếu.<br />
1.Tác dụng v i phi kim<br />
Ví dụ: 2Cu + O 2<br />
0<br />
t<br />
.....................................................................................................................<br />
CuO + Cu .............................................................................................................<br />
Cu + Cl 2 ..............................................................................................................<br />
Cu + S ............................................................................................................<br />
2.Tác dụng v i axit<br />
a.V i axit HCl và H 2 SO 4 loãng: Cu không phản ng<br />
Nhưng: 2Cu + 4HCl + O 2 ...........................................................................................<br />
Cu + H 2 SO 4 + O 2 .............................................................................................................<br />
b.V i axit HNO 3 , H 2SO 4 đặc, nóng<br />
t<br />
Cu + 2H 2 SO 0<br />
4 đặc .........................................................................................................<br />
Cu + 4HNO 3 đặc<br />
0<br />
t<br />
...................................................................................................................<br />
t<br />
3Cu + 8HNO 0<br />
3 loãng .................................................................................................................<br />
III.HỢP CHẤT CỦA ĐỒNG<br />
1.Đồng (II) oxit<br />
CuO là chất r n màu đen.<br />
Là oxit bazơ: tác dụng với axit và oxit axit<br />
CuO + H 2 SO 4 .........................................................................................................................<br />
Có tính oxi hóa: dễ bị H 2 , CO , C khử thành Cu kim loại. :<br />
CuO + H 2<br />
o<br />
t<br />
o<br />
t<br />
o<br />
t<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
0<br />
t<br />
..............................................................................................................................<br />
o<br />
t<br />
CuO + CO .....................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
72 ĐỒNG<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
3CuO + 2NH 3 ................................................................................................................<br />
CuO được điều chế bằng cách nhiệt phân Cu(OH) 2 , Cu(NO 3 ) 2 , CuCO 3 .Cu(OH) 2 ,...<br />
2Cu(NO 3 ) 2 .........................................................................................................<br />
CuCO 3 .Cu(OH) 2 ............................................................................................<br />
(Đông cacbonat bazo)<br />
2.Đồng (II) hidroxit<br />
- Là m t bazơ chất r n màu anh tác dụng với axit tạo muối và nước.<br />
- Dễ bị nhiệt phân: Cu(OH) 2<br />
Cu(OH) 2 + 2HCl ..........................................................................<br />
0<br />
t<br />
...................................................................................<br />
- Cu(OH) 2 tan dễ dàng trong dung dịch NH 3 tạo ra dung dịch có màu anh thẫm gọi là nước Svayde<br />
3.Đồng (II) sunfat, Cu O 4<br />
Cu(OH) 2 + 4NH 3 [Cu(NH 3 ) 4 ](OH) 2<br />
CuSO 4 ở dạng khan là chất r n màu tr ng. Khi hấp thụ nước tạo thành muối hiđrat CuSO 4 .5H 2 O là<br />
tinh thể màu anh trong suốt. o vậy CuSO 4 khan được dùng để phát hiện dấu vết của nước trong các<br />
chất lỏng.<br />
o<br />
t<br />
o<br />
t<br />
o<br />
t<br />
CuSO 4 + 5 H 2 O CuSO 4 .5H 2 O<br />
tinh thể màu tr ng<br />
VI.ỨNG DỤNG CỦA ĐỒNG<br />
1. Hợp kim của đồng có nhiều ứng dụng trong CN:<br />
a) Đồng thau: là hợp kim Cu-Zn (Zn chiếm 45%).<br />
b) Đồng bạch: là hợp kim Cu-Ni (Ni chiếm 25%).<br />
c) Đồng thanh là hợp kim Cu-Sn.<br />
d) Hợp ki Cu-Au (2:1) “Vàng tây”<br />
tinh thể màu anh<br />
2. Đơn chất đồng ứng dụng d a vào tính dẽo, dẫn điện, tính bền.<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
ĐỒNG 73<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
BÀI: Ơ LƯỢ V KI LOẠI K Á<br />
TÍNH CHẤT VẬT LÝ CỦA Ni, Zn, n, Pb, Ag, Au<br />
NIKEN KẼM BẠC THIẾC VÀNG CHÌ<br />
Kí hiệu Ni(Z=28) Zn(Z=30) Ag (Z=47) Sn(Z=50) Au(Z=79) Pb(Z=82)<br />
Vị trí<br />
Cấu<br />
hình<br />
electron<br />
ố oxi<br />
hóa<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Tính<br />
chất<br />
Vật lý<br />
- Ô 28<br />
- Chu kì 4<br />
-Nhóm VIIIB<br />
[Ar]<br />
3d 8 4s 2<br />
1) NIKEN<br />
:<br />
+2 (phổ biến)<br />
+3<br />
- K.loại nặng<br />
- Rất cứng<br />
- Màu tr ng<br />
bạc<br />
t nc =1455C<br />
- Ô 30<br />
- Chu kì 4<br />
- Nhóm IIB<br />
[Ar]<br />
3d 10 4s 2<br />
- Ô 47<br />
- Chu kì 5<br />
- Nhóm IB<br />
[Kr]<br />
4d 10 5s 1<br />
+2 (phổ biến) +1 (phổ biến)<br />
+2 ; +3<br />
- K.loại nặng<br />
- Giòn ở nhiệt<br />
đ phòng; ẻo<br />
(100-150C)<br />
-Màu lam nhạt<br />
- t nc =419,5C<br />
- t sôi =906C<br />
- K.loại nặng<br />
- Mềm, dẻo<br />
-Màu tr ng<br />
- ẫn điện, dẫn<br />
nhiệt tốt nhất<br />
- t nc =960,5C<br />
- Ô 50<br />
- Chu kì 5<br />
- Nhóm IVA<br />
[Kr]<br />
4d 10 5s 2 5p 2<br />
+2 (phổ<br />
biến)<br />
+4<br />
- K.loại nặng<br />
- ẻo<br />
-Màu tr ng<br />
bạc<br />
- t nc =232C<br />
- t sôi =2620C<br />
- Ô 79<br />
- Chu kì 6<br />
- Nhóm IB<br />
[Xe]<br />
4f 14 5d 10 6s 1<br />
+3(phổbiến)<br />
+1<br />
- K.loại nặng<br />
- Mềm, dẻo<br />
-Màu vàng<br />
- ẫn điện,<br />
dẫn nhiệt<br />
tốt nhất<br />
(Au< Ag, Cu)<br />
t nc =1063C<br />
TÍNH CHẤT <strong>HÓA</strong> HỌC CỦA Ni, Zn, n, Pb, Ag, Au<br />
2Ni + O 2<br />
2NiO<br />
TCHH<br />
tC<br />
Ni + Cl 2 NiCl 2<br />
ễ tan trong a it nitric đặc nóng :<br />
Ni + 6HNO 3<br />
0<br />
2) KẼM 2Zn + O 2 <br />
tC 2ZnO<br />
) THIẾC<br />
0<br />
500 C<br />
<br />
0<br />
0<br />
tC<br />
Ni(NO 3 ) 3 + 3NO 2 + 3H 2 O<br />
tC<br />
Zn+ Cl 2 ZnCl 2<br />
Zn + 4HNO 3(đ) Zn(NO 3 ) 2 + 2NO 2 + 2H 2 O<br />
3Zn + 8HNO 3(loãng) 3Zn(NO 3 ) 2 + 2NO + 4H 2 O<br />
T NH KHỬ : Zn > Ni > Sn<br />
0<br />
0<br />
tC<br />
Sn + O 2 SnO 2<br />
0<br />
tC<br />
Sn + Cl 2 SnCl 4<br />
0<br />
tC<br />
Sn + 2S SnS 2<br />
Axit HCl, H 2 SO 4 loãng tạo muối Sn 2+ (PƯ chậm)<br />
Sn + 2HCl SnCl 2 + H 2<br />
- Ô 82<br />
- Chu kì 6<br />
- Nhóm IVA<br />
[Xe]<br />
4f 14 5d 10 6s 2 6p 2<br />
+2(phổbiến)<br />
+4<br />
- K.loại nặng<br />
- ẻo<br />
-Màu tr ng<br />
hơi anh<br />
t nc =327,4C<br />
t sôi =1745C<br />
Ghi chú<br />
Ở tC thư ng Ni<br />
bền với H 2 O, 1<br />
số dd a it, không<br />
khí do màng oxit<br />
bảo vệ<br />
Ở tC thư ng Zn<br />
bền với H 2 O,<br />
không khí do<br />
màng o it hoặc<br />
cacbonat baz<br />
bảo vệ<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ở tC thư ng Sn<br />
không bị không<br />
khí oxi hóa do<br />
màng o it bảo vệ<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
74 MỘT SỐ KIM LOẠI KHÁC<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
4) CHÌ<br />
Sn + H 2 SO 4(loãng) SnSO 4 + H 2<br />
Axit HNO 3 , loãng, tạo muối Sn 2+.<br />
3Sn + 8HNO 3(loãng) 3Sn(NO 3 ) 2 + 2NO + 4H 2 O<br />
Axit HNO 3 đặc, H 2 SO 4 đặc tạo hợp chất Sn 4+.<br />
Sn + 4HNO 3(đ) H 2 SnO 3 + 4NO 2 + H 2 O<br />
Axit metastanic<br />
(không tan trong a it và kiềm)<br />
Sn tan trong dd kiềm đặc:<br />
Sn + 2KOH + 2H 2 O K 2 [Sn(OH) 4 ] + H 2<br />
T NH KHỬ : Zn > Ni > Sn >Pb<br />
Axit HCl, H 2 SO 4 loãng : không phản ứng do muối chì không<br />
tan bao bọc Pb.<br />
Pb tan trong nước, khi có mặt không khí<br />
2Pb + 2H 2 O + O 2 2Pb(OH) 2<br />
Pb tan nhanh trong Axit H 2 SO 4 đặc tạo muối tan :<br />
Pb + 3H 2 SO 4(đ) Pb(HSO 4 ) 2 + SO 2 + 2H 2 O<br />
Pb tan nhanh trong dd HNO 3 , tan chậ trong HNO 3 đặc:<br />
3Pb + 8HNO 3(loãng) 3Pb(NO 3 ) 2 + 2NO + 4H 2 O<br />
Pb + 4HNO 3(dặc) Pb(NO 3 ) 2 + 2NO 2 + 2H 2 O<br />
Ở tC thư ng Pb<br />
bền với H 2 O,<br />
không khí do<br />
màng o it bảo vệ<br />
5) Bạc T NH KHỬ : Zn > Ni > Sn >Pb > Ag Ag bền trong<br />
Axit HCl, H 2 SO 4 loãng : không phản ứng<br />
không khí ngay<br />
cả ở nhiệt đ cao<br />
Axit HNO 3 đặc, H 2 SO 4 đặc, nóng tạo hợp chất Ag +.<br />
6) Vàng<br />
I.BẠC<br />
tC<br />
Ag + 2HNO 3(đ) AgNO 3 + NO 2 + H 2 O<br />
Ag có màu đen khi tiếp úc với KK hoặc nước có mặt hydro<br />
sunfua<br />
4Ag + 2H 2 S + O 2 2Ag 2 S + 2H 2 O<br />
Bị oxi hóa bởi O 3<br />
2Ag + O 3 → Ag 2 O + O 2<br />
T NH KHỬ : Zn > Ni > Sn >Pb > Ag > Au<br />
Au chỉ tan trong nước cư ng toan<br />
Au + HNO 3 + 3HCl AuCl 3 + NO + 2H 2 O<br />
tC<br />
Au-Hg Hg + Au<br />
(hỗn hống) -chất r n màu tr ng<br />
tC<br />
Au + NaCN Na[Au(CN) 2 ]<br />
ỨNG DỤNG<br />
Bạc tinh khiết được dùng để chế tạo đồ trang sức, vật trang trí, mạ bạc cho những vật bằng kim loại,<br />
chế tạo m t số linh kiện trong kỹ thuật vô tuyến, chế tạo c quy ( c quy Ag – Zn có hiệu điện thế<br />
1,85 V)<br />
Chế tạo hợp kim, ví dụ hợp kim Ag – Cu, hợp kim Ag – Au. Những hợp kim này dùng làm đồ trang<br />
sức, b đồ ăn, đúc tiền,...<br />
0<br />
0<br />
0<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ion Ag + (dù nồng đ rất nhỏ chỉ khoảng 10 -10 mol/ lít) có khả năng sát trùng, diệt khuẩn<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỘT SỐ KIM LOẠI KHÁC 75<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
II.VÀNG<br />
Vàng được dùng để chế tạo đồ trang sức, mạ vàng cho những vật trang trí. Ph n lớn vàng dùng chế<br />
tạo hợp kim: Au – Cu, Au – Ag, Au – Ni,...<br />
III.NIKEN<br />
Ph n lớn Ni dùng chế tạo hợp kim. Ni có tác dụng làm tăng đ bền, chống ăn mòn và chịu nhiệt đ<br />
cao. Ví dụ:<br />
- Hợp kim Inva Ni – Fe không dãn nở theo nhiệt đ , được dùng trong kỹ thuật vô tuyến, rơle nhiệt<br />
- Hợp kim đồng bạch Cu – Ni có tính bền vững cao, không bị ăn mòn dù trong môi trư ng nước<br />
biển, dùng chế tạo chân vịt tàu biển, tuabin cho đ ng cơ máy bay phản l c<br />
M t ph n nhỏ Ni được dùng:<br />
- Mạ lên các kim loại khác, có tác dụng chống ăn mòn.<br />
- Làm chất xúc tác ( b t Ni) trong nhiều phản ứng hóa học<br />
- Chế tạo c quy Cd – Ni (có hiệu điện thế 1,4V), c quy Fe – Ni<br />
VI.KẼM<br />
Ph n lớn Zn dùng để bảo vậ bề mặt các vật bằng s t thép chống ăn mòn như dây thép, tấm lợp, thép<br />
lá. Kẽm dùng để chế tạo hợp kim như hợp kim Cu – Zn (đồng thay), hợp kim Cu – Zn – Ni, hợp<br />
kim<br />
Cu – Al – Zn,...những hợp kim này có tính chất bền cao, chống ăn mòn, được dùng chế tạo các chi<br />
tiết máy, đồ trang sức và trang trí...Kẽm được dùng chế tạo pin điện hóa như pin Zn- Mn là loại pin<br />
được dùng phổ biến nhất hiện nay ( pin Văn Điển, pin Con Thỏ...); pin không khí- kẽm. M t số hợp<br />
chất của kẽm được dùng trong y học<br />
V.THIẾC<br />
Thiếc dùng để tráng lên bề mặt các vật bằng s t thép, vỏ h p đ ng th c phẩm, nước giải khác, có<br />
tác dụng chống ăn mòn, tạo vẻ đẹp và không đ c hại. Thiếc được dùng để chế tạo các hợp kim, thí<br />
dụ hợp kim Sn – Sb – Cu có tính chịu ma sát, dùng chế tạo ổ trục quay. Hợ kim Sn – Pb có nhiệt<br />
đ c nóng chảy thấp (180 o C) dùng chế tạo thiếc hàn.<br />
VI.CHÌ<br />
Chì được sử dụng r ng rãi trong công nghiệp điện: làm vỏ dây cáp, vỏ bình c quy, chế tạo các điện<br />
c c trong c uy chì. Chì được dùng chế tạo các thiết bị sản xuất a it sun uric, như tháp hấp thụ, ống<br />
dẫn a it...Chì được dùng chế tạo các hợp kim không mài mòn các trục quay, nên được dùng làm ổ<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
trục. Hợp kim chì dùng chế tạo que hàn. Chì có tác dụng hấp thụ tia gamma, nên dùng để ngăn cản<br />
chất phóng xạ<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
76 MỘT SỐ KIM LOẠI KHÁC<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Ca c da ng ba i ta p đo thi cơ ba n trong ho a ho c<br />
Dạng 1: hổi từ từ khí O2 đến dư vào dung dịch chứa a mol a(O )2 hoặc Ba(O )2. au phản<br />
ứng thu được b mol kết tủa.<br />
CO 2 + Ca(OH) 2 CaCO 3 + H 2 O CO 2 + H 2 O + CaCO 3 Ca(HCO 3 ) 2<br />
a n <br />
2 n <br />
Ca( OH ) n 2<br />
CaCO max<br />
b n<br />
Ca<br />
CaCO <br />
3 3<br />
Số mol kết tủa<br />
a<br />
b<br />
x a y 2a Số mol CO 2<br />
Theo đồ thị<br />
Theo CT giải nhanh<br />
Số mol CO 2 đ phản ứng là: x = b (mol) n = n<br />
<br />
(2 trư ng hợp) y = 2a - b (mol). n<br />
CO<br />
= n - n<br />
<br />
CO 2<br />
2<br />
OH<br />
-<br />
Caâu 1: Thổi khí CO 2 vào 100g dung dịch Ca(OH) 2, ta được kết quả như đồ thị bên.Tìm nồng đ<br />
ddCa(HCO 3 ) 2 tạo thành sau phản ứng?<br />
Caâu 2:<br />
Thổi khí CO 2 vào dung dịch Ba(OH) 2, ta được kết quả như đồ thị bên.Tìm x<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Caâu 3:<br />
Thổi khí CO 2 vào dung dịch Ba(OH) 2, ta được kết quả như đồ thị bên.Tìm x<br />
77 PHỤ LỤC<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Caâu 4: Thổi khí CO 2 vào dung dịch Ba(OH) 2, ta được kết quả như đồ thị bên.Tìm x<br />
Caâu 5: Thổi khí CO 2 vào dung dịch Ba(OH) 2, ta được kết quả như đồ thị bên.Tìm x<br />
.<br />
Caâu 6: Hòa tan hoàn toàn 11,2 gam CaO và H 2 O thu được dung dịch A. Sục khí CO 2 vào dung dịch A, qua<br />
quá trình khảo sát ngư i ta lập đồ thị của phản ứng như sau:Giá trị của x,y,t là:<br />
Số mol kết t a<br />
kết t a<br />
0,06<br />
a<br />
t x y<br />
Câu 6 : Thổi khí CO 2 vào dd Ca(OH) 2 được đồ thị sau .Tìm a,b<br />
Số mol kết tủa<br />
Số mol CO 2<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
b<br />
0,24 0,48 Số mol CO 2<br />
78 www.facebook.com/daykemquynhonofficial<br />
PHỤ LỤC<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Dạng 2: Rót từ từ dung dịch kiềm đến dư vào dung dịch chứa a mol muối Al3+ . au phản ứng<br />
thu được b mol kết tủa.<br />
Al 3+ + 3 OH - Al(OH) 3<br />
Al(OH) 3 + OH - AlO 2 - + 2 H 2 O<br />
a n 3 n ( ) max b n<br />
Al<br />
Al OH Al( OH ) <br />
3 3<br />
Số mol kết tủa Al(OH) 3<br />
a<br />
b<br />
Số mol OH -<br />
x 3a y 4a<br />
Theo đồ thị<br />
Theo CT giải nhanh<br />
Số mol OH - đ phản ứng là: x = 3b (mol) n = 3n<br />
<br />
(2 trư ng hợp) y = 4a - b (mol). n = 4n 3 -n<br />
Caâu 7: Khi nhỏ từ từ dung dịch KOH đến dư vàodung dịch AlCl 3 được đồ như sau,tìm<br />
Caâu 8:<br />
OH<br />
OH<br />
-<br />
Al<br />
A.0,<strong>12</strong> B.0,14 C.0,15 D.0,2<br />
Khi nhỏ từ từ dung dịch KOH đến dư vàodung dịch AlCl 3 được đồ như sau,tìm<br />
A.0,4<strong>12</strong> B.0,456 C.0,515 D.0,546<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Caâu 9:<br />
Khi nhỏ từ từ dung dịch KOH đến dư vàodung dịch AlCl 3 được đồ như sau,tìm<br />
A.0,426 B.0,415 C.0,4<strong>12</strong> D.0,405<br />
PHỤ LỤC www.facebook.com/daykemquynhonofficial 79<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Caâu 10: Khi nhỏ từ từ dung dịch NaOH đến dư vàodung dịch AlCl 3 được đồ như sau,tìm<br />
A.0,17 B.014 C.0,15 D.0,18<br />
Caâu 11: Khi nhỏ từ từ dung dịch NaOH đến dư vàodung dịch AlCl 3 được đồ như sau,tìm<br />
A.0,80 B.0,86 C.0,84 D.0,82<br />
Caâu <strong>12</strong>: Nhỏ từ từ dd NaOH đến dư vàodung dịch AlCl 3 được đồ như sau,tìm biểu thức liên hệ giữa và y<br />
A.3y - x=1,44 B.3y - x=1,24 C.3y+x=1,24 D.3y+x=1,44<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Caâu 13: Khi nhỏ từ từ dung dịch NaOH đến dư vàodung dịch AlCl 3 được đồ như sau,tìm tỉ lệ :y<br />
A. 5:4<br />
B. 6:7<br />
C. 4:5<br />
D. 7:6<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
80 www.facebook.com/daykemquynhonofficial<br />
PHỤ LỤC<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Dạng3: Rót từ từ dung dịch kiềm đến dư vào dung dịch chứa a mol muối Al 3+ và H + . au phản<br />
ứng thu được b mol kết tủa.<br />
H + + OH - H 2 O Al 3+ + 3 OH - Al(OH) 3 Al(OH) 3 + OH - AlO 2 - + 2 H 2 O<br />
a<br />
b<br />
Số mol kết tủa Al(OH) 3<br />
Số mol OH -<br />
c x 3a y 4a<br />
Theo đồ thị<br />
Theo CT giải nhanh<br />
* Số mol OH - đ phản ứng là: x = c + 3b (mol) n = n - + + 3n <br />
(2 trư ng hợp) y = c + 4a - b (mol). n - = n + + 4n 3 -n<br />
<br />
OH<br />
max<br />
min<br />
H<br />
OH H Al<br />
Caâu 14: Khi nhỏ từ từ dung dịch NaOH đến dư vào dung dịch chứa a mol HCl và b mol AlCl 3 được đồ như<br />
sau,tìm tỉ lệ a:b và tìm số mol NaOH(t mol) tối thiểu để kết tủa tan hếtA.2:1và 3,2 B.1:1 và<br />
3,6 C.2:3và 3,6 D.4:3và 3,2<br />
Sè mol Al(OH) 3<br />
0,4<br />
0,8 2,0 2,8 t Sè mol OH -<br />
Caâu 15: Khi nhỏ từ từ dung dịch NaOH đến dư vào hổn hợp dung dịch chứa HCl và AlCl 3 được đồ như<br />
sau,tìm tỉ lệ : a<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
81 www.facebook.com/daykemquynhonofficial<br />
PHỤ LỤC<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
b<br />
a<br />
A.5,0 B.5,2 C.4,8 D.5,4<br />
Dạng 4: Rót từ từ dung dịch kiềm đến dư vào dung dịch chứa a mol muối Zn 2+ . au phản ứng<br />
thu được b mol kết tủa.<br />
Zn 2+ + 2 OH - Zn(OH) 2 (1)<br />
Zn(OH) 2 + 2OH - <br />
Số mol Zn(OH) 2<br />
ZnO + 2 H 2 O (2)<br />
2-<br />
2<br />
a n 2 n ( ) max b n<br />
Zn<br />
Zn OH Zn( OH ) <br />
2 2<br />
x 2a y 4a<br />
Theo đồ thị<br />
Theo CT giải nhanh<br />
* Số mol OH- đ phản ứng là: x = 2b (mol) n = 2n<br />
OH - <br />
(2 trư ng hợp) y = 4a - 2b (mol)<br />
Caâu 16:<br />
Caâu 17:<br />
ChoKOH vào dd ZnCl 2 được kết quả như hình vẽ .Tìm<br />
Cho KOH vào dd ZnCl 2 được kết quả như hình vẽ .Tìm<br />
n OH- = 4n Zn2+<br />
- 2n <br />
Số mol OH -<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
82 www.facebook.com/daykemquynhonofficial<br />
PHỤ LỤC<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Caâu 18:<br />
Caâu 19:<br />
Cho NaOH vào dd ZnCl 2 được kết quả như hình vẽ .Tìm<br />
Cho NaOH vào dd ZnCl 2 được kết quả như hình vẽ .Tìm<br />
Dạng 5: Rót từ từ dung dịch axit đến dư vào dung dịch chứa a mol muối AlO2-<br />
hoặc ZnO2 2-. au phản ứng thu được b mol kết tủa.<br />
a) Nhỏ từ từ H + vào dd muối aluminat H + + AlO 2 - +H 2 O Al(OH) 3 (1)<br />
a<br />
b<br />
Số mol Al(OH) 3<br />
Al(OH) 3 + 3 H +- Al 3+ + 3 H 2 O (2)<br />
a n n b n<br />
AlO<br />
Al( OH ) max Al( OH ) <br />
2<br />
3 3<br />
x a y 4a<br />
Theo đồ thị<br />
Số mol H +<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Theo CT giải nhanh<br />
* Số mol H + đ phản ứng là: x = b (mol)<br />
n = n<br />
H <br />
(2 trư ng hợp) y = 4a - 3b (mol). n = 4n - 3n<br />
2 <br />
b) Nhỏ từ từ H + vào dd muối zincat<br />
2H + +<br />
2<br />
ZnO - 2<br />
Zn(OH) 2 Zn(OH) 2 + 2H +- Zn 2+ + 2 H 2 O<br />
PHỤ LỤC www.facebook.com/daykemquynhonofficial 83<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
H<br />
+<br />
AlO<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
a n n b n<br />
ZnO<br />
2 Zn( OH ) max Zn( OH ) <br />
2<br />
2 2<br />
Số mol Zn(OH) 2<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
a<br />
b<br />
b<br />
x 2a y 4a<br />
Theo đồ thị<br />
Số mol H +<br />
Theo CT giải nhanh<br />
* Số mol H + đ phản ứng là: x = 2b (mol) n = 2n<br />
(2 trư ng hợp) y = 4a - 2b (mol). n <br />
2<br />
H<br />
= 4n ZnO<br />
- 2n<br />
2 <br />
Caâu 20: Nhỏ từ từ đến dư KOH vào dung dịch hỗn hợp gồm a mol HCl và x mol ZnSO 4 ta quan sát hiện<br />
tượng theo đồ thị hình bên (số liệu tính theo đơn vị mol). Giá trị của x (mol) là:<br />
Caâu 21: Cho đồ thị biểu diễn mối liên hệ giữa lượng ion H + và lượng kết tủa Al(OH)3 trong phản ứng của dung dịch<br />
chứa ion H + với dung dịch chứa ion AlO - 2 . như sau :<br />
Với x là nồng đ mol/l của dung dịch HCl. Khối lượng kết tủa trong 2 trư ng hợp đều là a (gam). D a vào đồ thị, giá<br />
trị của a là<br />
A. 0,78. B. 0,936. C. 1,95. D. 0,468.<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
H<br />
<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
84 www.facebook.com/daykemquynhonofficial<br />
PHỤ LỤC<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
Dạng đặc biệt : CO2 tác dụng dd Ca(OH)2 ,Ba(OH)2,NaOH,KOH<br />
Gđ 1:ĐỒ <strong>THỊ</strong> ĐI <strong>LÊ</strong>N<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Gđ 2 ,3 :ĐỒ <strong>THỊ</strong> ĐI NGANG<br />
Gđ4 : ĐỒ <strong>THỊ</strong> ĐI XUỐNG<br />
Caâu 1: Dung dịch A chứa a mol Ba(OH) 2 ,cho m gam NaOH vào dd A sau đó thổi khí CO 2 dư vào ta<br />
được đồ thị như hình vẽ .Tìm giá trị (a+m)<br />
Caâu 2: X là dung dịch chứa NaOH và 0,15 mol Ba(OH) 2 . Sục từ từ CO 2 vào X, lượng kết tủa tạo thành<br />
được mô tả trong đồ thị dưới đây<br />
A. 0,2 B. 0,4 C. 0,3 D. 0,15<br />
Số mol NaOH ban đ u là bao nhiêu?<br />
Caâu 3:<br />
Thổi khí CO 2 vào dd chứa hổn hợp Ca(OH) 2 và NaOH ta được đồ thị bên,Tìm giá trị của x<br />
A.0,64 B.0,58 C.0,68 D.0,74<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
PHỤ LỤC www.facebook.com/daykemquynhonofficial 85<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Caâu 4: Thổi khí CO 2 vào dd chứa hổn hợp Ca(OH) 2 và KOH ta được đồ thị bên,Tìm giá trị của x<br />
A.0,<strong>12</strong> B.0,11 C.0,13 D,0,10<br />
Caâu 5: Thổi khí CO 2 vào dd chứa hổn hợp Ca(OH) 2 và KOH ta được đồ thị bên,Tìm giá trị của x<br />
A.0,45 B.0,42 C.0,48 D.0,60<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
86 PHỤ LỤC<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
NGUYÊN TẮC SO SÁNH NHIỆT ĐỘ SÔI CỦA HỢP CHẤT HỮU <strong>CƠ</strong><br />
*Nguyên tắc 1.<br />
*Nguyên tắc 2.<br />
Hai hợp chất có c ng khối lượng hoặc khối lượng xấp xỉ nhau thì hợp chất nào có liên kết hiđro bền<br />
hơn sẽ có nhiệt độ s i cao hơn.<br />
Ví dụ 1:So sánh nhiệt đ sôi của CH 3 COOH và C 3 H 7 OH.<br />
- Cả hai đều có khối lượng phân tử bằng 60. Nhưng CH 3 COOH có liên kết hiđro bền hơn liên kết hiđro<br />
trong C 3 H 7 OH. Nên nhiệt đ sôi của CH 3 COOH cao hơn nhiệt đ sôi của C 3 H 7 OH.<br />
Hai hợp chất có cùng khối lượng hoặc khối lượng xấp xỉ nhau thì hợp chất nào có liên kết hiđro sẽ có nhiệt<br />
độ sôi cao hơn.<br />
*Nguyên tắc 2:<br />
Ví dụ 2 : So sánh nhiệt đ sôi của CH 3 OH và CH 3 CHO.- CH 3 OH có M=32. CH 3 CHO có M=44.<br />
CH 3 OH có liên kết hiđro, CH 3 CHO không có liên kết hiđro, nên CH 3 OH có nhiệt đ sôi cao hơn CH 3 CHO.<br />
M càng l n nhiệtt độ s i càng cao<br />
Hai hợp chất cùng kiểu liên kết hiđro, hợp chất nào có khối lượng lớn hơn sẽ có nhiệt đ sôi cao hơn.<br />
Ví dụ 1: So sánh nhiệt đ sôi của CH 3 OH và C 2 H 5 OH.<br />
- Cả hai đều có cùng kiểu liên kết hidro, nhưng khối lượng của C 2 H 5 OH=46> khối lượng của CH 3 OH=32.<br />
nên C 2 H 5 OH có nhiệt đ sôi cao hơn CH 3 OH.<br />
Ví dụ 2:So sánh nhiệt đ sôi của C 2 H 6 và C 3 H 8 .<br />
- Cả hai đều không có liên kết hiđro, khối lượng của C 3 H 8 lớn hơn khối lượng của C 2 H 6 nên C 3 H 8 có nhiệt<br />
đ sôi lớn hơn.<br />
*Nguyên tắc .<br />
*Nguyên tắc 4:<br />
*Nguyên tắc 5:<br />
*Nguyên tắc 6:<br />
Đồng phân cis có nhiệt độ s i cao hơn đồng phân trans<br />
Ví dụ: nhiệt đ sôi của cis but-2-en cao hơn trans but-2-en.<br />
Mạch C kh ng phân nh nh có nhiệt độ s i cao hơn<br />
ạch C có phân nh nh<br />
Ví dụ: nhiệt đ sôi của ancol butylic cao hơn nhiệt đ sôi ancol isobutylic<br />
Hai hợp chất có khối lượng xấp xỉ nhau, hợp chất nào có liên kết ion sẽ có nhiệt độ sôi cao hơn.<br />
Ví dụ : So sánh nhiệt đ sôi của CH 3 COONa và CH 3 COOH.<br />
-CH 3 COONa không có liên kết hiđro nhưng là hợp chất ion nên nhiệt đ sôi của CH 3 COONa cao hơn.<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Hai hợp chất hữu cơ đều kh ng có liên kết hiđro, có khối lượng xấp xỉ nhau thì hợp chất nào có tính<br />
phân c c hơn sẽ có nhiệt độ s i cao hơn.<br />
Ví dụ: So sánh nhiệt đ sôi của HCHO và C 2 H 6.<br />
- Hai hợp chất trên đều không có liên kết hiddro và khối lượng bằng nhau, nhưng HCHO có tính phân c c<br />
hơn nên có nhiệt đ sôi cao hơn.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
PHỤ LỤC 87<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
I.Nhận biết Cation:<br />
huyên đề: PHÂN BIỆT M S CHẤ <strong>VÔ</strong> Ơ<br />
Mẫu<br />
Thuốc thử Hiện tượng Phản ng<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
thử<br />
Na +<br />
K +<br />
Rb +<br />
Li +<br />
NH 4<br />
+<br />
Dùng dây Pt<br />
nhúng vào dd<br />
muối ,đem đốt<br />
trên<br />
ngọn lửa không<br />
màu<br />
d kiềm<br />
Khí mùi khai, làm quì<br />
tím ẩm hóa anh<br />
Ba 2+ Dd H 2 SO 4 dư tr ng không tan trong<br />
a it dư<br />
Dd K 2 CrO 4<br />
Dd K 2 Cr 2 O 7<br />
màu vàng tươi<br />
Al 3+ d kiềm mạnh tr ng, tan trong kiềm<br />
dư tạo dd không màu<br />
Cr 3+ d kiềm mạnh anh, tan trong kiềm<br />
dư tạo dd màu anh<br />
Fe 3+ d kiềm nâu đỏ, không tan<br />
trong kiềm dư<br />
Dd SCN -<br />
Ion thioxianat<br />
on phức màu đỏ máu<br />
Fe 2+ d kiềm tr ng anh, không tan<br />
trong kiềm dư ; trong<br />
không khí chuyển sang<br />
vàng rồi thành màu nâu<br />
đỏ<br />
Ngọn lửa có màu vàng chói<br />
Ngọn lửa có màu tím hồng<br />
Ngọn lửa có màu đỏ huyết<br />
Ngọn lửa có màu đỏ tía<br />
NH 4<br />
+<br />
+ OH - NH 3 + H 2 O<br />
Ba 2+ + SO 4<br />
2-<br />
BaSO 4 <br />
Ba 2+ + CrO 4<br />
2-<br />
BaCrO 4 <br />
2Ba 2+ + Cr 2 O 7<br />
2-<br />
+ H 2 O 2BaCrO 4 + 2H +<br />
Al 3+ + 3OH - → Al(OH) 3 <br />
Al(OH) 3 + OH - → AlO - 2 + 2H 2 O<br />
Cr 3+ + 3OH - → Cr(OH) 3 <br />
Cr(OH) 3 + OH - → CrO - 2 + 2H 2 O<br />
3<br />
<br />
Fe OH Fe OH<br />
3 ( ) 3<br />
<br />
3<br />
<br />
Fe SCN Fe SCN<br />
3 ( ) 3<br />
2<br />
<br />
Fe 2 OH Fe( OH )<br />
2<br />
<br />
4 Fe( OH ) O 2H O 4 Fe( OH )<br />
2 2 2 3<br />
Dd MnO 4 (mt Dd MnO 4 mất màu tím MnO 2 2 3<br />
4<br />
5Fe 8H Mn 5Fe 4H2O<br />
axit)<br />
hồng<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Cu 2+<br />
Màu<br />
d kiềm mạnh<br />
xanh lam, không tan<br />
trong kiềm dư<br />
2<br />
<br />
Cu OH Cu OH<br />
2 ( ) 2<br />
<br />
88 PHỤ LỤC<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
xanh<br />
lam<br />
Dd<br />
NH 3<br />
xanh lam, tan trong dd<br />
NH 3 dư (do tạo phức)<br />
2<br />
<br />
Cu 2NH3 2H2O 2 NH4 Cu( OH )<br />
2<br />
<br />
Cu OH NH Cu NH OH<br />
2<br />
( )<br />
2<br />
4<br />
3<br />
[ (<br />
3) 4] 2<br />
<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Dd Ni 2+<br />
Màu<br />
xanh lá<br />
cây<br />
Pb 2+<br />
Dd<br />
d kiềm mạnh<br />
NH 3<br />
anh lục, không tan<br />
trong kiềm dư<br />
anh lục, tan trong dd<br />
NH 3 dư (do tạo phức)<br />
2<br />
<br />
Ni OH Ni OH<br />
2 ( ) 2<br />
<br />
2<br />
<br />
Ni 2NH3 2H2O 2 NH4 Ni( OH )<br />
2<br />
<br />
Ni OH NH Ni NH OH<br />
2<br />
( )<br />
2<br />
6 3<br />
[ (<br />
3) 6] 2<br />
PbS đen Pb 2+ + S 2 PbS <br />
Hg 2+ HgS đỏ Hg 2+ + S 2 HgS <br />
Fe 2+ FeS đen Fe 2+ + S 2 FeS <br />
Cu 2+ Na 2 S, H 2 S CuS đen Cu 2+ + S 2 CuS <br />
Cd 2+ CdS vàng Cd 2+ + S 2 CdS <br />
Ni 2+ NiS đen Ni 2+ + S 2 NiS <br />
Mn 2+ MnS hồng nhạt Mn 2+ + S 2 MnS <br />
Cu 2+ xanh, tan trong dd NH 3 dư Cu(OH) 2 + 4NH 3 [Cu(NH 3 ) 4 ](OH) 2<br />
Zn 2+ dd NH 3 tr ng, tan trong dd NH 3 dư Zn(OH) 2 + 4NH 3 [Zn (NH 3 ) 4 ](OH) 2<br />
Ag + tr ng, tan trong dd NH 3 dư AgCl + 2NH 3 [Ag (NH 3 ) 2 ]Cl<br />
Chú ý :<br />
-CuS,PbS,Ag 2 S : đen không tan trong nước không tan trong axit<br />
-ZnS,FeS …không tan trong nước nhưng tan trong a it<br />
-Al(OH) 3 , Cr(OH) 3 Zn(OH) 2 , Pb(OH) 2 ,Sn(OH) 4 là các hydro yt lưỡng tính tan được trong dd axit<br />
,dd kiềm<br />
- Zn(OH) 2 , Cu(OH) 2 ,AgCl ,Ni(OH) 2 các kết tủa này tan được trong dd NH 3 do tạo phức chất<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
PHỤ LỤC 89<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
II.NHẬN BIẾT ANION:<br />
Mẫu<br />
thử<br />
Cl <br />
Br <br />
I 3<br />
Thuốc thử Hiện tượng Phản ng<br />
AgNO 3<br />
tr ng<br />
vàng nhạt<br />
vàng đậm<br />
Cl + Ag +<br />
ánh sáng)<br />
Br + Ag +<br />
ánh sáng)<br />
I + Ag +<br />
sáng)<br />
AgCl (hóa đen ngoài<br />
AgBr (hóa đen ngoài<br />
AgI (hóa đen ngoài ánh<br />
PO vàng<br />
PO 3<br />
+ 3Ag + 4<br />
Ag 3 PO 4 <br />
4<br />
S 2<br />
đen S 2 + 2Ag + Ag 2 S<br />
CO tr ng<br />
CO 2<br />
+ Ba 2+ 3<br />
BaCO 3 (tan trong HCl)<br />
3<br />
2<br />
SO tr ng SO 2<br />
+ Ba 2+ 3<br />
3<br />
BaSO 3 (tan trong HCl)<br />
BaCl 2<br />
2<br />
+ Ba 2+ BaSO<br />
tr ng<br />
4 (không tan trong<br />
SO 2<br />
SO <br />
4<br />
4<br />
HCl)<br />
2<br />
CrO vàng tươi CrO 2<br />
+ Ba 2+ 4<br />
BaCrO 4 <br />
4<br />
2<br />
* Các ion CO 3 , PO 3 4 , SO 2 3 , HPO 2 4 cũng tạo kết tủa trắng với ion Ba 2<br />
, nhưng các kết<br />
tủa đó đều tan trong axit HCl và HNO 3 loãng riêng BaSO 4 không tan.<br />
S 2<br />
Pb(NO 3 ) 2 đen S 2 + Pb 2+ PbS<br />
CO Sủi bọt khí CO 2<br />
+ 2H + 3<br />
CO 2 + H 2 O (không mùi)<br />
3<br />
2<br />
SO Sủi bọt khí SO 2<br />
+ 2H + 3<br />
3<br />
SO 2 + H 2 O (mùi h c)<br />
HCl<br />
Sủi bọt khí S + 2H + H 2 S (mùi trứng thối)<br />
S 2<br />
2<br />
SiO keo<br />
SiO 2<br />
+ 2H + 3<br />
H 2 SiO 3 <br />
3<br />
2<br />
HCO t<br />
2 HCO<br />
Đun nóng Sủi bọt khí<br />
0<br />
2<br />
CO 2 + CO <br />
+ H 2 O<br />
3<br />
3<br />
3<br />
Hoặc cho<br />
2<br />
HSO t<br />
Ba(OH) 2 C <br />
2 HSO SO<br />
Sủi bọt khí<br />
0<br />
2<br />
2 + SO <br />
+ H 2 O<br />
3<br />
3<br />
3<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
NO <br />
3<br />
Vụn Cu,<br />
H 2 SO 4<br />
Khí màu nâu<br />
3Cu + 8 H + +2NO - 3 3Cu 2+ + 2NO+4H 2 O<br />
2NO + O 2 2NO 2 <br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
90 PHỤ LỤC<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
III.NHẬN BIẾT KHÍ:<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Khí Thuốc thử Hiện tượng Phản ng<br />
SO 2<br />
Cl 2<br />
- Quì tím ẩm Hóa hồng<br />
- dd Br 2<br />
- dd KMnO 4 Mất màu<br />
SO 2 + Br 2 + 2H 2 O 2HBr + H 2 SO 4<br />
SO 2 + 2KMnO 4 + 2H 2 O 2H 2 SO 4 + 2MnSO 4 + K 2 SO 4<br />
- nước vôi trong Làm đục SO 2 + Ca(OH) 2 CaSO 3 + H 2 O<br />
- Quì tím ẩm<br />
- dd (KI+hồ tinh<br />
b t)<br />
Lúc đ u xuất hiện màu<br />
đỏ sau đó mất màu<br />
Không màu xám<br />
Cl 2 + H 2 O HCl + HClO<br />
HClO HCl + [O] ; [O] O 2<br />
Cl 2 + 2KI 2KCl + I 2<br />
Hồ tinh b t + I 2 dd màu xanh tím<br />
dd Br 2 Mất màu 5Cl 2 + Br 2 + 6H 2 O 2HBrO 3 + 10HCl<br />
O 3 dd KI/quỳ tím quỳ tím hoá xanh<br />
KI + O 3 + H 2 O I 2 + 2KOH + O 2<br />
KOH + quỳ tím xanh<br />
N 2 - Que diêm đỏ Que diêm t t<br />
- Quì tím ẩm Hóa xanh<br />
NH 4<br />
NH 3 -dd phenolphtalein Hóa hồng<br />
+ OH NH 3 + H 2 O<br />
- khí HCl Tạo khói tr ng NH 3 + HCl NH 4 Cl<br />
NO - Oxi không khí Không màu nâu 2NO + O 2 2NO 2<br />
NO 2 - Khí màu nâu, mùi h c, làm quì tím hóa đỏ 3NO 2 + H 2 O 2HNO 3 + NO<br />
CO 2<br />
- nước vôi trong Làm đục CO 2 + Ca(OH) 2 CaCO 3 + H 2 O<br />
- quì tím ẩm Hóa hồng<br />
CO<br />
- dd PdCl 2 đỏ, bọt khí CO 2 CO + PdCl 2 + H 2 O Pd + 2HCl + CO 2<br />
- CuO (t 0 ) Màu đen đỏ<br />
t<br />
CO + CuO (đen) <br />
0<br />
Cu (đỏ) + CO 2<br />
- Đốt cho sản phẩm vào CuSO 4 khan không<br />
màu tạo thành màu xanh<br />
CuSO 4 + 5H 2 O CuSO 4 .5H 2 O<br />
H 2<br />
- CuO (t 0 0<br />
) CuO (đen) Cu (đỏ) H 2 + CuO (đen) <br />
t Cu (đỏ) + H 2 O<br />
O 2 - Que diêm đỏ Bùng cháy<br />
HCl<br />
H 2 S<br />
- Quì tím ẩm Hóa đỏ<br />
- AgNO 3 Kết tủa tr ng HCl + AgNO 3 AgCl+ HNO 3<br />
- Quì tím ẩm Hóa hồng<br />
- O 2<br />
Cl 2<br />
SO 2<br />
Kết tủa vàng<br />
FeCl 3<br />
KMnO 4<br />
2H 2 S + O 2 2S + 2H 2 O<br />
H 2 S + Cl 2 S + 2HCl<br />
2H 2 S + SO 2 3S + 2H 2 O<br />
H 2 S + 2FeCl 3 2FeCl 2 + S + 2HCl<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
3H 2 S+2KMnO 4 2MnO 2 +3S+2KOH+2H 2 O<br />
5H 2 S+2KMnO 4 +3H 2 SO 4 2MnSO 4 +5S+K 2 SO 4 +8H 2 O<br />
- PbCl 2 Kết tủa đen H 2 S + Pb(NO 3 ) 2 PbS+ 2HNO 3<br />
dd Br 2 Mất màu H 2 S + 4Br 2 + 4H 2 O 8HBr + H 2 SO 4<br />
H 2 O(Hơi) CuSO 4 khan Tr ng hóa xanh CuSO 4 + 5H 2 O CuSO 4 .5H 2 O<br />
as<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
PHỤ LỤC 91<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Một số lý thuyết cần ghi nh :<br />
1. Công thức và tên gọi tương ứng của :<br />
a) Muối Iot: Muối ăn + ( K hoặc KIO 3 )<br />
b) Diêm tiêu Natri: NaNO 3<br />
c) NitroPhotka: (NH 4 ) 2 HPO 4 và KNO 3<br />
d) Amophot: (NH 4 ) 2 HPO 4 và NH 4 H 2 PO 4<br />
e) Tecmit: Al, Fe 2 O 3 ( que hàn )<br />
f) Phèn chua:K 2 SO 4 .Al 2 (SO 4 ) 3 .24H 2 O = KAl(SO 4 ) 2 .<strong>12</strong>H 2 O<br />
g) Phèn nhôm:M 2 SO 4 .Al 2 (SO 4 ) 3 .24H 2 O ( với M làLi + , Na + , NH 4 + )<br />
h) Phèn Crom-Kali:K 2 SO 4 .Cr 2 (SO 4 ) 3 .24H 2 O = KCr(SO 4 ) 2 .<strong>12</strong>H 2 O<br />
i) Phèn s t amoni:(NH 4 )2SO 4 .Fe 2 (SO 4 ) 3 .24H 2 O<br />
j) Thach cao sống: CaSO 4 .2H 2 O<br />
k) Thạch cao nung: CaSO 4 .H 2 O hoặc CaSO 4 .0,5H 2 O(dùng đúc tượng,bó ương)<br />
l) Thạch cao khan: CaSO 4<br />
m) Thép (Chứa 0,01 – 2% C) Gang (Chứa 2 – 5% C)<br />
2. Các loại tinh thể:<br />
Khái<br />
niệm<br />
Đặc tính<br />
Vd:<br />
Liên kết<br />
Tinh thể ion Tinh thể nguyên tử Tinh thể phân tử Tinh thể kim loại<br />
Hình thành từ ion<br />
mang điện tích trái<br />
dấu<br />
Bền, khó nóng<br />
chảy, khó bay hơi<br />
NaCl…<br />
LK ion<br />
Hình thành từ các<br />
nguyên tử<br />
Nhiệt đ nóng chảy<br />
và nhiệt đ sôi cao<br />
Kim cương,Than<br />
chì…<br />
LK c ng hoá trị<br />
Hình thành từ các<br />
phân tử<br />
Nhiệt đ nóng<br />
chảy và nhiệt đ<br />
sôi thấp,kém bền<br />
Nước đá, iot,P<br />
tr ng…..<br />
L c tương tác yếu<br />
giửa các phân tử<br />
Hình thành từ ion<br />
kim loại và e t do<br />
Ánh kim, dẫn điện<br />
và dẫn nhiệt tốt,<br />
dẻo<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Kim loại<br />
LK kim loại<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
92 PHỤ LỤC<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
- Các kim loại có kiểu mạng tinh thể lục phương: Mg, Be, Zn.<br />
- Lập phương tâm diện: Ca, Sr, Al, Cu.<br />
- Lập phương tâm khối: Li, Na, K, Rb,Cs, Ba, Cr.<br />
3. Quy luật biến đổi :<br />
- Axit hipocloro (HClO) HClO HClO 2 HClO 3 HClO 4 : Tính a it tăng , Tính o y hoá giảm<br />
- Axit cloro (HClO 2 )<br />
- Axit cloric (HClO 3 )<br />
- Axit pecloric (HClO 4 ) HF HCl HBr HI: Tính a it tăng,Tính khử tăng<br />
4. PP sun at để điều chế HX:<br />
NaX + H 2 SO 4 đặc → HX + NaHSO 4 (X là F, Cl , NO 3 không là Br , I)<br />
5. Nhiệt phân muối nitrat có 3 trư ng hợp:<br />
muối nitrat<br />
của KL<br />
Trước Mg<br />
Li K Ca Na<br />
Từ Mg→Cu<br />
Sau Cu<br />
Hg , Ag, Pt , Au<br />
Sản phẩm muối nitrit +O 2 Oxyt + NO 2 + O 2 Kim loại + NO 2 + O 2<br />
Vd: t<br />
NaNO 0<br />
t<br />
3 NaNO 2 +O 2 Cu(NO 3 ) 0<br />
t<br />
2 CuO + AgNO 3 0<br />
Ag +<br />
2NO 2 + ½ O 2 NO 2 + ½ O 2<br />
6. Tính chất vật lý kim loại<br />
a) Tính dẻo: Kim loại có tính dẻo nhất Au, Ag, Al, Cu, Sn<br />
b) Tính dẫn điện: Kim loại cótính dẫn điện tốt Ag, Cu, Al, Fe<br />
c) Tính dẫn nhiệt: Kim loại có tính dẫn nhiệt tốt Ag, Cu, Al, Fe<br />
d) Khối lượng riêng: Lớn nhất Osimi (Os), nhỏ nhất Liti (Li)<br />
e) Nhiệt đ nóng chảy: Thấp nhất Hg, cao nhất Vonfam (W)<br />
f) Tính cứng: Cứng nhất Crom (Chỉ thua Kim cương) thấp nhất Cs<br />
7. M t số pư hay quên:<br />
2Ag + O 3 Ag 2 O ( đen) +O 2<br />
4Ag + 2H 2 S + O 2 2Ag 2 S (đen) + 2H 2 O<br />
Au + HNO 3 + 3HCl AuCl 3 + 2H 2 O + NO<br />
2Ni + O<br />
2<br />
2NiO<br />
Ni + Cl 2<br />
NiCl 2<br />
t<br />
0<br />
Sn + HNO 3 lo ng →Sn(NO 3 ) 2 + NO + H 2 O<br />
Sn + HNO 3 đặc →Sn(NO 3 ) 4 + NO 2 + H 2 O<br />
Sn + 2HCl → SnCl 2 + H 2<br />
o<br />
500 C<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
PHỤ LỤC 93<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Sn +O 2 → SnO 2<br />
Na 2 S 2 O 3 + H 2 SO 4 S↓ + SO 2 + Na 2 SO 4 + H 2 O<br />
8. Các nhận định sau đây đều đúng :<br />
a) Các chất, ion tác dụng được với axit và bazo: HCO 3 - , H 2 PO 4 - , HPO 4 2- , HS - ,H 2 NRCOOH,<br />
,H 2 NRCOOR ,Al, Al 2 O 3 , Al(OH) 3 , Zn,ZnO, Zn(OH) 2 , Be, BeO, Be(OH) 2 , Pb,Pb(OH) 2 , Sn, Sn(OH) 2 ,<br />
Cr 2 O 3 , Cr(OH) 3 .<br />
b) Al, Zn không phải là kim loại lưỡng tính.<br />
c) Những chất tác dụng được với kiềm đặc, nóng: Cr 2 O 3 , Si, SiO 2 , SnO 2 , Pb(OH) 2 , Pb, Sn, Sn(OH) 2<br />
d) Các ion tạo kết tủa sau đó kết tủa tan được trong dung dịch NH 3 dư: Ag + , Ni 2+ ,Cu 2+ ,Zn 2+<br />
e) Các muối sun ua không tan trong nước nhưng tan trong a it :FeS,ZnS,MgS…<br />
Các muối sun ua không tan trong nước không tan trong axit :PbS,CuS,Ag 2 S…<br />
f) Các polime được điều chế từ pư trùng ngưng là: nilon-6, nilon-7,lapsan, nilon-6,6 (đồng trùng<br />
ngưng),nh a novolac, rezol.<br />
g) Các polime được điều chế từ pư trùng hợp: tất cả (trừ các polime điều chế từ pư trùng ngưng ở<br />
trên). Ví dụ: buna, PVC, PE, PVA….Lưu ý: tơ visco, a etat được điều chế từ pư thông thư ng<br />
(không trùng ngưng, c ngnhư trùng hợp).<br />
9. Chú ý :<br />
-Tính a it H 2 S < H 2 CO 3 < H 2 SO 3<br />
-Tính a it HCl < CH 3 COOH < H 2 CO 3 < C 6 H 5 OH < H 2 O< C 2 H 5 OH<br />
-Tính a it H 2 CO 3 mạnh hơn HClO, C 6 H 5 OH ,H 2 SiO 3 , Al(OH) 3 (HAlO 2 .H 2 O ) nên có thể đẩy các a it<br />
này ra khỏi muối<br />
Vd: CO 2 + H 2 O + NaAlO 2 Al(OH) 3 + NaHCO 3<br />
2CO 2 +2 H 2 O + Na 2 SiO 3 H 2 SiO 3 + 2NaHCO 3<br />
CO 2 + H 2 O + NaClO HClO + NaHCO 3<br />
CO 2 + H 2 O + C 6 H 5 ONa C 6 H 5 OH + NaHCO 3<br />
Tính bazo: Amin no bậc 2 > amin no bậc1 > NH 3 > Amin thơm<br />
10. Polime được hình thành các Monome<br />
Nilon-6: a it ε-aminocaproic:H 2 N(CH 2 ) 5 COOH. (trùng ngưng) hoặc trùng hợp vòng caprolactam<br />
Nilon-7: a it ω-aminoenantoic: H 2 N (CH 2 ) 6 COOH.<br />
Lapsan: đồng trùng ngưng a it terephtalic p-HOOC-C 6 H 4 -COOH và etylenglycol C 2 H 4 (OH) 2 .<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Nilon-6,6: đồng trùng ngưng a it adipic HOOC-(CH 2 ) 4 -COOH và hexamylendiamin:<br />
H 2 N(CH 2 ) 6 NH 2 .<br />
Thủy tinh hữu cơ: trùng hợp monome: CH 2 =C(CH 3 )COOCH 3 hoặc CH 2 =CH-COOCH 3<br />
11. Cấu trúc polyme:<br />
Các chất có cấu trúc mạch phân nhánh: amilopectin và glycogen.<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
94 PHỤ LỤC<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>TRÌNH</strong> <strong>HÓA</strong> <strong>VÔ</strong> <strong>CƠ</strong> <strong>12</strong><br />
www.facebook.com/daykem.quynhon<br />
http://daykemquynhon.blogspot.com<br />
<strong>GV</strong>:<strong>LÊ</strong> <strong>THỊ</strong> <strong>THU</strong> <strong>HÀ</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Không gian: cao su lưu hóa, nh a bakelit (hay rezit).<br />
Không phân nhánh (mạch thẳng): còn lại, ví dụ: buna, PE, PVC…<br />
<strong>12</strong>. Những chất làm mất màu dung dịch brom: axit không no, andehit, ancol không no, ete không<br />
no, phenol, catechol, re o inol, hidroquinon,anilin, styren và đồng đẳng…., SO 2 , Cl 2 , xicloankan<br />
vòng ba cạnh, Br 2 , Fe 2+ ,HCOOH, este của axit fomic,muối của a it omic…..<br />
13. Các chất tác dụng brom khan: Xeton,ben en,toluen (đều là loại pư thế)<br />
14. Những chất tác dụng Cu(OH) 2 :<br />
Các axit<br />
Các ancol đa có 2 nhóm OH kế cận,Gluco ,Fructo o,Saccaro ,Manto<br />
Các andehyt (↓ đò gạch)<br />
Cac peptit trừ đipeptit,protein (pư màu biure tạo phức màu tím anh)<br />
Oligopeptit 2- 10 gốc α- amino axit .Polipeptit: 11-50 gốc α- amino axit<br />
15. Khả năng thế trên vòng ben en phụ thu c vào nhóm thế X<br />
16. Thuỷ phân cacbohydrat:<br />
Các monosaccarit không bị thủy phân là: glucozo, fructozo.<br />
X đẩy e : thế o-,p- và dể thế nhất (ankyl,OH,NH 2 Halogen…)<br />
X rút e : thế m- khó thế nhất (-COOH,-CHO,-NO 2 …… )<br />
Các disaccarit bị thủy phân: mantozo(tạo 2 gốc α-glucoz), saccarozo (tạo 2 gốc α-gluco và β-<br />
fructoz)<br />
Các polisaccarit bị thủy phân: tinh b t (tạo α-glucoz), xenlulozo(tạo β-glucoz)<br />
17. Tinh b t được tạo bởi : amilozo (mạch thẳng ,tan trong nước,liên kết α-1,4glicozit) và<br />
amilopectin (mạchphân nhánh ,không tan trong nước, liên kết α-1,4glicozit và liên kết α-1,4glicozit)<br />
18. Các chất cho pư tráng gương : RCHO,HCOOH,HCOOR,HCOONH 4, Glucozo,Fructozo,Mantoz<br />
.Trong đó Andehit HCHO, HCOOH, HCOONH 4 tác dụng với AgNO 3 /NH 3 tạo ra muối vô cơ:<br />
(NH 4 ) 2 CO 3 . Còn tất cả các andehit còn lại tạo muối R(COONH 4 )a.<br />
19. 5 loại thuốc nổ :TNT,TNB,TNG,XENLULO TR N TRAT, 2,4,6-TRI NITRO PHENOL<br />
20. 5 LOẠ CAO SU :Caosu buna,cao su clopren,caosu isopren.caosubuna-S,caosu buna-N<br />
21. Tên m t số hợp chất thơm hay quên<br />
Cumen :C 6 H 5 -CH(CH 3 ) 2<br />
DIỄN ĐÀN TOÁN - LÍ - <strong>HÓA</strong> 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Xilen: CH 3 -C 6 H 4 -CH 3<br />
Crezol: HO-C 6 H 4 -CH 3<br />
axit picric: (2,4,6-tri nitro phenol)<br />
H C C CH<br />
2 2<br />
Alen<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
PHỤ LỤC 95<br />
www.facebook.com/daykemquynhonofficial<br />
Đóng góp PDF bởi <strong>GV</strong>. Nguyễn Thanh Tú www.facebook.com/boiduonghoahocquynhonofficial