You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
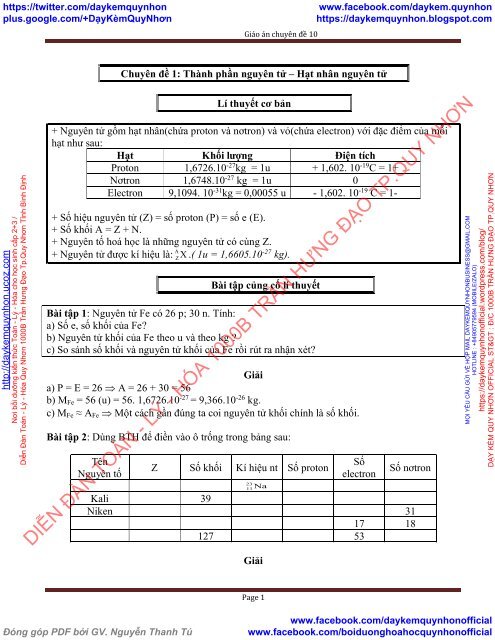
Chuyên <strong>đề</strong> 1: Thành phần nguyên tử – Hạt nhân nguyên tử<br />
Lí thuyết cơ bản<br />
+ Nguyên tử gồm hạt nhân(chứa proton và nơtron) và vỏ(chứa electron) với đặc điểm của mỗi<br />
hạt như sau:<br />
Hạt Khối lượng Điện tích<br />
Proton 1,6726.<strong>10</strong> -27 kg = 1u + 1,602. <strong>10</strong> -19 C = 1+<br />
Nơtron 1,6748.<strong>10</strong> -27 kg = 1u 0<br />
Electron 9,<strong>10</strong>94. <strong>10</strong> -31 kg = 0,00055 u - 1,602. <strong>10</strong> -19 C = 1-<br />
+ Số hiệu nguyên tử (Z) = số proton (P) = số e (E).<br />
+ Số khối A = Z + N.<br />
+ Nguyên tố hoá học là những nguyên tử có cùng Z.<br />
+ Nguyên tử được kí hiệu là: .( 1u = 1,6605.<strong>10</strong> -27 kg).<br />
A<br />
X Z<br />
Bài tập củng cố lí thuyết<br />
Bài tập 1: Nguyên tử Fe có 26 p; 30 n. Tính:<br />
a) Số e, số khối của Fe?<br />
b) Nguyên tử khối của Fe theo u và theo kg ?<br />
c) So s<strong>án</strong>h số khối và nguyên tử khối của Fe rồi rút ra nhận xét?<br />
Giải<br />
a) P = E = 26 A = 26 + 30 = 56<br />
b) M Fe = 56 (u) = 56. 1,6726.<strong>10</strong> -27 = 9,366.<strong>10</strong> -26 kg.<br />
c) M Fe ≈ A Fe Một cách gần đúng ta coi nguyên tử khối chính là số khối.<br />
Bài tập 2: Dùng BTH để điền vào ô trống trong bảng sau:<br />
Tên<br />
Nguyên tố<br />
Z Số khối Kí hiệu nt Số proton<br />
23<br />
Na 11<br />
Số<br />
electron<br />
Số nơtron<br />
Kali 39<br />
Niken 31<br />
17 18<br />
127 53<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Giải<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page 1<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Tên<br />
Số<br />
Z Số khối Kí hiệu nt Số proton<br />
Nguyên tố<br />
electron<br />
Số nơtron<br />
Natri 11 23<br />
23<br />
11 11 11 12<br />
Kali 19 39<br />
39<br />
19 19 19 20<br />
Niken 28 59<br />
59<br />
28 28 28 31<br />
Clo 17 35<br />
35<br />
17 17 17 18<br />
Iot 53 127<br />
127<br />
53 53 53 74<br />
Bài tập 3: Trong 1 nguyên tử của nguyên tố X có tổng số hạt mang điện = 26; khối lượng hạt nhân<br />
= 27 u. Tính số P, N, E và số khối A của X? X là nguyên tố gì? Viết phản ứng của X với dd HCl,<br />
NaOH. ĐS: X là Al.<br />
Giải<br />
+ Theo giả thiết ta có hệ: P = 13 và N = 14<br />
2P = 26<br />
P + N = 27<br />
+ X là nhôm (Al)<br />
+ Phản ứng của X:<br />
2Al + 6HCl ⎯⎯→ 2AlCl 3 + 3H 2 ↑<br />
Al + NaOH + H 2 O ⎯⎯→ NaAlO 2 + 1,5H 2 ↑<br />
Bài tập 4: Tính tổng số hạt mang điện và không mang điện trong H 3 PO 4 biết các nguyên tử tạo nên<br />
axit trên lần lượt là: ; ;<br />
Ta có bảng:<br />
1<br />
H 1<br />
16<br />
O 8<br />
31<br />
P 15<br />
? ĐS: <strong>10</strong>0 và 48 hạt.<br />
1<br />
H 1<br />
Giải<br />
16<br />
O 8<br />
H3PO4<br />
P = E 1 8 15 50<br />
N 0 8 16 <strong>10</strong>0<br />
(P+E) 2 16 30 48<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
31<br />
P 15<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page 2<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Bài tập nâng cao<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Ghi nhớ<br />
+ Tổng số hạt trong 1 nguyên tử: Q = N + P + E = 2P + N(vì P = E).<br />
+ Tổng số hạt mang điện = P + E = 2P =2E.<br />
Q Q<br />
+ Với nguyên tố không phóng xạ(bền có Z ≤ 82) ta có: P<br />
<br />
3,5244 3<br />
Q<br />
<br />
+ Với nguyên tố có Q ≤ 60 thì P = <br />
3<br />
<br />
<br />
Bài tập 1: Tổng số hạt của nguyên tử nguyên tố X = 21.<br />
1. Tìm số proton và tên của X?<br />
2. Gọi tên X và hoàn thành phản ứng sau:<br />
a) Cu + HXO 3 loãng → b) CaCO 3 + HXO 3 →<br />
c) FeS 2 + HXO 3 đặc → d) MgO + HXO 3 loãng →<br />
Giải<br />
1. Ta có: P X =<br />
21<br />
<br />
3 <br />
<br />
= 7 X là nitơ.<br />
2. Phản ứng xảy ra:<br />
a) 3Cu + 8HNO 3 loãng → 3Cu(NO 3 ) 2 + 2NO↑ + 4H 2 O<br />
b) CaCO 3 + 2HNO 3 → Ca(NO 3 ) 2 + CO 2 ↑ + H 2 O<br />
c) FeS 2 + 18HNO 3 đặc → Fe(NO 3 ) 3 + 2H 2 SO 4 + 15NO 2 ↑ + 7H 2 O<br />
d) MgO + 2HNO 3 → Mg(NO 3 ) 2 + H 2 O<br />
Bài tập 2: Tổng số hạt của X là 52. M và X tạo thành hợp chất MX 3 trong hợp chất này có tổng số<br />
P = 77.<br />
1. Tìm M, X, MX 3 ?<br />
2. Viết phản ứng của dd MX 3 với M, Cu, dd NaOH; dd Na 2 CO 3 và Na 2 S?<br />
Giải<br />
52<br />
1. Ta có P X = <br />
3 <br />
= 17 X là clo P M = 77 – 3.17 = 26 M là Fe MX 3 là FeCl 3 .<br />
2. Phản ứng xảy ra:<br />
a) 2FeCl 3 + Fe → 3FeCl 2<br />
b) 2FeCl 3 + Cu → 2FeCl 2 + CuCl 2<br />
c) FeCl 3 + 3NaOH → Fe(OH) 3 ↓ + 3NaCl<br />
d) 2FeCl 3 + 3Na 2 CO 3 + 3H 2 O → 2Fe(OH) 3 + 6NaCl + 3CO 2 ↑<br />
e) 2FeCl 3 + 3Na 2 S → 2FeS↓ + 6NaCl + S↓<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page 3<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài tập 3: Tổng số hạt cơ bản trong nguyên tử nguyên tố X là 115. Trong đó số hạt mang điện<br />
nhiều hơn số hạt không mang điện là 25. Tìm tên và kí hiệu của X ? ĐS: X là Br(Z = 35).<br />
Giải<br />
+ Theo giả thiết ta có hệ: <br />
2P + N = 115<br />
P = 35 và N = 45<br />
2P − N = 25<br />
+ Tên của X: Brom.<br />
+ Kí hiệu:<br />
80<br />
Br 35<br />
Bài tập 4: Tổng số hạt cơ bản trong nguyên tử nguyên tố A là 40.<br />
1. Tìm tên và kí hiệu của A?<br />
2. Hoàn thành phản ứng:<br />
a) A + NaOH + H 2 O → b) A(OH) 3 + NaOH →<br />
c) Fe 3 O 4 + A → d) NaAO 2 + HCl + H 2 O →<br />
ĐS: A là Al.<br />
Giải<br />
1. + Theo giả thiết ta có: P A =<br />
40<br />
<br />
3 <br />
<br />
= 13 X là nhôm (Al)<br />
2. Phản ứng của A:<br />
a) Al + NaOH + H 2 O ⎯⎯→ NaAlO 2 + 1,5H 2 ↑<br />
b) Al(OH) 3 + NaOH ⎯⎯→ NaAlO 2 + 2H 2 O<br />
c) 3Fe 3 O 4 + 8Al 9Fe + 4Al 2 O 3<br />
d) NaAlO 2 + HCl + H 2 O ⎯⎯→ NaCl + Al(OH) 3 ↓<br />
có thể có phản ứng: Al(OH) 3 + 3HCl ⎯⎯→ AlCl 3 + 3H 2 O<br />
0<br />
t<br />
⎯⎯→<br />
Bài tập 5: X và Y là 2 kim loại. Tổng số hạt trong cả X vàY = 122. Số N của Y hơn của X là 16,<br />
số P trong X = 1 nửa số P trong Y, số khối của X bé hơn Y là 29 u.<br />
1. Tìm X, Y?<br />
2. Cho m gam hh X vàY pư với dd HCl dư thì được 8,96 lít H 2 ở đktc. Cũng cho m gam hh trên pư<br />
với dd NaOH dư thì được 6,72 lít H 2 ở đktc. Tính khối lượng của X và Y trong m gam hh?<br />
ĐS: 1. X, Y là Al, Fe. 2. khối lượng Al =5,4 gam; Fe = 5,6 gam.<br />
Giải<br />
(2P + N) + (2P' + N') = 122<br />
<br />
N' − N = 16 2P P' P 13<br />
1. Theo giả thiết ta có hệ: P'<br />
<br />
=<br />
<br />
=<br />
<br />
P =<br />
<br />
2<br />
P' − P = 13 P' = 26<br />
(P' + N') − (P + N) = 29<br />
+ Vậy X là Al và Y là Fe.<br />
<br />
+ HCl<br />
<br />
Al : x ⎯⎯⎯→ H<br />
2<br />
: 0,4<br />
2. Sơ đồ: <br />
1,5x + y = 0,4 và 1,5x = 0,3<br />
+ NaOH<br />
Fe : y ⎯⎯⎯⎯→ H<br />
2<br />
: 0,3<br />
x = 0,2 và y = 0,1 Al = 5,4 gam và Fe = 5,6 gam.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page 4<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài tập 6: Tổng số hạt P, N, E trong 2 kim loại A và B là 142 trong đó tổng số hạt mang điện nhiều<br />
hơn tổng số hạt không mang điện là 42. Số hạt mang điện của B nhiều hơn của A là 12.<br />
1. Tìm A, B?<br />
2. Viết pư điều chế A từ muối cacbonat của A và điều chế B từ 1 oxit của B?<br />
ĐS: A, B là Ca, Fe.<br />
Giải<br />
(2P + N) + (2P' + N') = 142 P = 20 <br />
A = Ca<br />
1. Theo giả thiết ta có hệ: (2P + 2P') − (N + N') = 42 <br />
2P' − 2P = 12 P' = 26 <br />
B = Fe<br />
2. Điều chế:<br />
+ 2HCl<br />
® pnc<br />
a) CaCO ⎯⎯⎯→ CaCl ⎯⎯⎯→ Ca + Cl<br />
b) Fe 2 O 3 + 3CO<br />
3 2 2<br />
0<br />
t<br />
⎯⎯→ 2Fe + 3CO 2<br />
Bài tập 7: Tổng số hạt P, N, E trong nguyên tử nguyên tố M là 40 trong đó tổng số hạt mang điện<br />
nhiều hơn tổng số hạt không mang điện là 12 hạt.<br />
1. Tìm P, N, A của M?<br />
2. Y tạo với M hợp chất MY 3 . Tổng số P trong MY 3 = 64. Tìm Y, MY 3 ?<br />
3. Hoàn thành sơ đồ:<br />
(1) + KOH + NaOH CO2 H2O<br />
(5)<br />
M ⎯⎯→ MY ⎯⎯⎯→ A ⎯⎯⎯→ B ⎯⎯⎯⎯→ + + A ⎯⎯→ MY<br />
3 (2) (3) (4)<br />
3<br />
Giải<br />
1. Theo giả thiết ta có hệ: P = 13 và N = 14 M là Al<br />
2. Hợp chất MY 3 là AlY 3 13 + 3P Y = 64 P Y = 17 Y là Cl.<br />
3. Sơ đồ:<br />
2P + N = 40<br />
2P − N = 12<br />
+ Cl2 3KOH NaOH + CO2 + 2H2O<br />
3HCl<br />
Al ⎯⎯⎯→ AlCl ⎯⎯⎯→ + Al(OH) ⎯⎯⎯→ + NaAlO ⎯⎯⎯⎯⎯→ A(OH) ⎯⎯⎯→<br />
+ AlCl<br />
−3KCl −2H2O −NaHCO 3 −3H2O<br />
3 3 2 3 3<br />
Bài tập 8: Nguyên tử X có điện tích hạt nhân là 3,04.<strong>10</strong> -18 C; trong X số hạt mang điện nhiều hơn<br />
số hạt mang điện là 18. Tìm tên và kí hiệu X? ĐS: X là<br />
+ Vì 1 proton có điện tích = 1,6.<strong>10</strong> -19 C nên P X =<br />
Giải<br />
Page 5<br />
3,04. <strong>10</strong><br />
−<br />
1,6. <strong>10</strong><br />
39<br />
K 19<br />
−18<br />
19<br />
= 19 X là Kali.<br />
+ Số hạt mang điện = 19.2 = 38 số hạt không mang điện là 38 – 18 = 20<br />
số khối A = 19 + 20 = 39<br />
+ Kí hiệu: 39<br />
19 K<br />
Bài tập 9: Cho hai nguyên tử X và Y. Số hạt mang điện của Y hơn của X là 4. Tổng số proton trong<br />
hợp chất XY 2 là 22. Tìm X, Y ? Viết pư của XY 2 với dd NaOH ? ĐS : XY 2 là CO 2 .<br />
Giải<br />
+ Theo giả thiết ta có hệ : <br />
2P' − 2P = 4<br />
P = 6 ; P’ = 8 X là Cacbon ; Y là Oxi.<br />
P + 2P' = 22<br />
+ XY 2 chính là CO 2 . Phản ứng xảy ra :<br />
CO 2 + 2NaOH → Na 2 CO 3 + H 2 O<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
CO 2 + NaOH → NaHCO 3<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài tập <strong>10</strong>: Tổng số hạt trong nguyên tử X là 82<br />
1. Hỏi số proton trong X nằm trong khoảng nào?<br />
2. Tổng số proton trong hợp chất XY 3 = 77. Tìm X, Y?<br />
ĐS: 1. P X = 24, 25, 26, 27. 2. X là Fe, Y là Clo.<br />
Giải<br />
Q Q 82 82<br />
1. Đặt : Q = 2P + N ; ta có : P<br />
P 24 P 27 .<br />
3,5244 3 3,5244 3<br />
2. Ta có: P + 3P’ = 77. Vì 24 P 27 nên ta có bảng<br />
P 24 25 26 27<br />
P’ 17,67 17,33 17 16,67<br />
KL Loại Loại OK Loại<br />
+ Vậy X là Fe và Y là Cl thỏa mãn <strong>đề</strong> bài.<br />
Bài tập 11: Tổng số hạt mang điện trong hợp chất X(OH) 2 là 148. Số nơtron của X là 81. Tìm tên<br />
và kí hiệu của X? ĐS: X là<br />
137<br />
Ba 56<br />
Giải<br />
+ Theo giả thiết ta có : 2P X + 2(8.2 + 1.2) = 148 P X = 56 X là Ba.<br />
+ Mặt khác ta có : N X = 81 A = P X + N X = 137<br />
+ Kí hiệu :<br />
137<br />
Ba 56<br />
Bài tập 12: Tổng số hạt trong nguyên tử X = 180. Tìm tên và kí hiệu của X biết số hạt mang điện<br />
gấp 1,4324 lần số hạt không mang điện. ĐS: X là<br />
Giải<br />
+ Theo giả thiết ta có hệ : P = 53 ; N = 74 X là Cacbon<br />
+ Mặt khác : A = 53 + 74 = 127 kí hiệu của X là<br />
2P + N = 180<br />
2P = 1,4324P'<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
127<br />
I 53<br />
127<br />
53 I<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page 6<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Chuyên <strong>đề</strong> : Thành phần nguyên tử – Hạt nhân nguyên tử<br />
Ghi nhớ<br />
1. Biết % và khối lượng tính A : Dựa vào công thức:<br />
x<br />
1.A1 + x<br />
2.A<br />
2<br />
x<br />
1.A1 + x<br />
2.A 2<br />
+ ... + x<br />
n.A<br />
n<br />
A = hoặc A = .<br />
<strong>10</strong>0<br />
<strong>10</strong>0<br />
2. Biết A tính % đồng vị: Gọi x 1 , x 2 lần lượt là % của đồng vị A 1 , A 2 ta có hệ:<br />
x1+ x2<br />
= <strong>10</strong>0<br />
<br />
x<br />
1.A1 + x<br />
2.A<br />
từ hệ ta tính được x<br />
2<br />
1 , x 2 .<br />
= A<br />
<strong>10</strong>0<br />
Hoặc: Gọi x là % đồng vị A 1 suy ra % đồng vị A 2 = <strong>10</strong>0 – x. Ta có:<br />
Bài tập 0: Oxi có 3 đồng vị là<br />
nhiêu loại phân tử H 2 O ?<br />
Bài tập 1: Cho<br />
Bài tập 2: Cho<br />
63<br />
Cu 29<br />
<strong>10</strong><br />
(70%) và<br />
5 B (19,78%) và<br />
Bài tập 3: Bo có 2 đồng vị<br />
<strong>10</strong><br />
x.A + (<strong>10</strong>0 −x).A<br />
<strong>10</strong>0<br />
16 17 18<br />
8 8 8<br />
1 2<br />
= A<br />
x = …<br />
Bài tập<br />
O; O; O ; hiđro có 3 đồng vị là<br />
65<br />
Cu 29<br />
5 B và<br />
Bài tập 4: Oxi có 3 đồng vị là<br />
11<br />
B 5<br />
16<br />
O 8<br />
11<br />
B 5<br />
,<br />
(30%). Tính<br />
(80,22%). Tính<br />
. Biết<br />
17<br />
O 8<br />
thoản mãn: x 1 = 15x 2 ; x 1 – x 2 = 21x 3 . Tính<br />
,<br />
18<br />
O 8<br />
ACu ? ĐS: 63,6 u.<br />
H; H; H<br />
1 2 3<br />
1 1 1<br />
AB ? ĐS: <strong>10</strong>,8022 u.<br />
AB = <strong>10</strong>,81 u. Tính % mỗi đồng vị ? ĐS:%<br />
. Hỏi có tối đa bao<br />
<strong>10</strong><br />
5 B =19%.<br />
với % số lượng các đồng vị tương ứng là x 1 , x 2 , x 3<br />
Aoxi ? ĐS: x 1 = 90%; x 2 = 6%; x 3 = 4% 16,14u.<br />
Bài tập 5: Mg có 2 đồng vị là X, Y. Đồng vị X có A = 24u, đồng vị Y hơn X 1 nơtron. Số nguyên<br />
tử X & Y có tỉ lệ 3 : 2. Tính A Mg ? ĐS: 24,4u.<br />
Bài tập 6: A, A’ là 2 nguyên tử có số khối t/ứ là 79; 81. Hiệu số giữa N và P trong A =9; A’ = 11.<br />
1. A và A’ có phải là đồng vị của nhau không?<br />
2. Trộn lẫn A và A’ theo tỉ lệ A)A’ = <strong>10</strong>9/91 thì tập hợp các nguyên tử thu được có A bằng bao<br />
nhiêu? ĐS: 1. P A =P A’ =35; N A = 44, N A’ = 46. 2. 79,91u.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài tập 7: X và Y là 2 nguyên tử có A tương ứng là 35 và 37. Hiệu N và P trong X = 1; Y = 3.<br />
1. Tính số P, N của X ,Y ? X và Y có phải là đồng vị của nhau không?<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page 7<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
2. Tính A của hh X và Y biết X chiếm 75,77%; Y chiếm 24,23%.<br />
ĐS: 1. X có 17p và 18n; Y có 17p và 20n X, Y là đồng vị của nhau. 2. 35,4846.<br />
Bài tập 8: a) Nguyên tố X có 2 đồng vị là X 1 và X 2 . Đồng vị X 1 có tổng số hạt là 18, đồng vị X 2 có<br />
tổng số hạt là 20. Biết % các đồng vị bằng nhau. Tính khối lượng nguyên tử trung bình của X.<br />
b) Đồng có 2 đồng vị là 63 Cu và 65 Cu. Khối lượng nguyên tử trung bình của đồng là 63,54. Tính<br />
thành phần % của mỗi loại đồng vị.<br />
ĐS: a) 13. B) 63 Cu = 73% và 65 Cu = 27%.<br />
Bài tập 9: Khối lượng nguyên tử trung bình của brom là 79,91. Brom có hai đồng vị bền là<br />
và . Biết chiếm 54,5 %. Tìm A? ĐS: A = 81.<br />
79<br />
Br 35<br />
A<br />
Br 35<br />
79<br />
Br 35<br />
Bài tập <strong>10</strong>: Khối lượng nguyên tử trung bình của Ag là <strong>10</strong>7,87(u), trong tự nhiên bạc có hai đồng<br />
vị, trong đó đồng vị chiếm hàm lượng 44%. Xác định số khối của đồng vị còn lại. ĐS: <strong>10</strong>7<br />
<strong>10</strong>9<br />
Ag 47<br />
Bài tập 11: Hoà tan 4,84 gam Mg kim loại bằng dd HCl thấy thoát ra 0,4 gam khí hiđro.<br />
a) Xác định nguyên tử lượng của Mg.<br />
b) Cho kim loại Mg trên gồm hai đồng vị trong đó có đồng vị . Xác định số khối của đồng vị<br />
thứ hai, biết tỷ số của hai loại đồng vị là 4:1.<br />
ĐS: a) 24,2 u. b) 25.<br />
24<br />
Mg 12<br />
Bài tập 12*: Cho M là kim loại tạo ra 2 muối MCl x ; MCl y và 2 oxit MO 0,5x ; M 2 O y . Tỉ lệ về khối<br />
lượng của Clo trong 2 muối = 1 : 1,173; của oxi trong 2 oxit = 1: 1,352.<br />
1. Tìm nguyên tử khối của M?<br />
2. Cho biết trong các đồng vị 55 M; 56 M; 57 M; 58 M. Đồng vị nào phù hợp với tỉ lệ: P/N = 13.15.<br />
ĐS: 1. M = 55,743u. 2. .<br />
56<br />
Fe 26<br />
Bài 13: Một nguyên tố X có hai đồng vị mà số nguyên tử có tỷ lệ 27:23. hạt nhân thứ nhất có 35<br />
proton và 44 nơtron. Hạt nhân của đồng vị thứ hai hơn đồng vị thứ nhất 2 notron. Tính khối lượng<br />
nguyên tử trung bình của X. ĐS: 79,92u.<br />
Bài 14: Một nguyên tố có 3 đồng vị: A X (92,3%), B X (4,7%), C Z Z Z<br />
X (3,0%). Biết tổng số khối của 3<br />
đồng vị là 87. Tổng khối lượng của 200 đồng vị nguyên tử X là 5621,4. Mặt khác số nơtron trong<br />
B<br />
X nhiều hơn A Z Z<br />
X 1 đơn vị.<br />
1. Tìm các số khối A, B, C. 2. Biết A Z<br />
X có số proton bằng số nơtron. Viết kí hiệu X?<br />
ĐS: 1. A = 28; B = 29; C = 30 2. 28 Si . 14<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 15: Đồng có hai đồng vị là 63 Cu và 65 Cu. Khối lượng nguyên tử trung bình của đồng là 63,546.<br />
Tính phần trăm hàm lượng của đồng vị 63 Cu trong CuSO 4 (cho O=16, S=32). ĐS: 28,7%.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page 8<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 16: Cho 4,12g muối NaX tác dụng với dd AgNO 3 được 7,52g kết tủa.<br />
a) Tính khối lượng nguyên tử của X. ĐS: Brom<br />
b) Nguyên tố X có 2 đồng vị. Xác định số khối của mỗi loại đồng vị, biết rằng<br />
Đồng vị thứ hai có số n trong hạt nhân nhiều hơn trong đồng vị thứ nhất là 2.<br />
Phần trăm của các đồng vị bằng nhau. ĐS: 79 và 81.<br />
Bài 17: X là một kim loại hoá trị hai. Hoà tan hết 6,082 g X vào HCl dư được 5,6 lit H 2 (đktc).<br />
1. Tìm KLNT và tên nguyên tố X.<br />
2. X có ba đồng vị. Biết tổng số khối của 3 đồng vị là 75. Số khối của đồng vị thứ nhì bằng trung<br />
bình cộng số khối của hai đồng vị kia. Đồng vị thứ nhất có số p bằng số e. Đồng vị thứ ba chiếm<br />
11,4% số nguyên tử và có số n nhiều hơn đồng vị thứ hai là một đơn vị<br />
a) Tìm số khối và số n của mỗi loại đồng vị.<br />
b) Tìm % về số nguyên tử của hai đồng vị còn lại<br />
3. Khi có 50 nguyên tử của đồng vị thứ hai thì có bao nhiêu nguyên tử của các đồng vị còn lại<br />
Bài 18: Hiđro có ba đồng vị là:<br />
các loại phân tử nước?<br />
H, H, H<br />
1 2 3<br />
1 1 1<br />
. Oxi có ba đồng vị là<br />
16<br />
O 8<br />
,<br />
17<br />
O 8<br />
,<br />
17<br />
O 8<br />
. Viết công thức<br />
Bài 19: Trong tự nhiên oxi có ba đồng vị , , . Cacbon có hai đồng vị . Hỏi có<br />
thể có bao nhiêu loại phân tử khí cacbonic? Viết CTPT và tính PTK của chúng? ĐS: 12.<br />
16<br />
O 8<br />
17<br />
O 8<br />
17<br />
O 8<br />
C, C<br />
12 13<br />
6 6<br />
Bài 20: Nhận định nào sau đây đúng khi nói về 3 nguyên tử: 26 55<br />
13 X, 26 Y, 26 12 Z?<br />
X và Z có cùng số khối. B. X, Z là 2 đồng vị của cùng một nguyên tố hoá học.<br />
C. X, Y thuộc cùng một nguyên tố hoá học. D. X và Y có cùng số nơtron.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page 9<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>Giáo</strong> <strong>án</strong> <strong>chuyên</strong> <strong>đề</strong> <strong>10</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Chuyên <strong>đề</strong> 3: Bài tập về các hạt trong hợp chất<br />
Ghi nhớ<br />
+ Ion là phần tử tạo thành khi nguyên tử cho hoặc nhận e.<br />
+ Nếu nguyên tử nhận e thì sẽ được ion âm( anion). Điện tích của ion âm = số e nhận.<br />
VD1: S có 16e S 2- có 16 + 2 = 18e.<br />
-<br />
VD2: NO 2 có 7 + 3.8 = 31e NO 2 có 31 + 1 = 32e.<br />
+ Nếu nguyên tử cho e thì sẽ được ion dương( cation). Điện tích của ion dương = số e cho.<br />
VD1: Al có 13e Al 3+ có 13 – 3 = <strong>10</strong>e. VD2: Mg 2+ có <strong>10</strong>e Mg có 12e<br />
+ Số P, N của ion luôn bằng nguyên tử.<br />
+ Tổng quát: ion X n+ ; Y m- có tổng số hạt lần lượt là: 2P X + N X – n và 2P Y + N Y + m.<br />
+ Vì khối lượng của e rất nhỏ nên khối lượng của nguyên tử bằng khối lượng của ion.<br />
Bài tập<br />
Bài tập 0:<br />
1. Tổng số hạt trong ion X 3+ bằng 79 trong đó số hạt mang điện nhiều hơn số hạt không mang<br />
điện là 19 hạt. Tìm X?<br />
2. Tính số hạt mang điện trong CO 2- 3 ; SO 2- 4 ; PO 3- 4 ; NH + 4 .<br />
3. Xác định tổng số hạt trong: O 2 ; S 2- ; SO 2 ; SO 2- - 4 ; HSO 3 cho ; .<br />
16<br />
O 8<br />
O; H<br />
32 1<br />
16 1<br />
Bài tập 1: Trong hợp chất MX 3 có:<br />
+ Tổng số hạt = 196 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 60.<br />
+ Số khối của M nhỏ hơn số khối của X là 8.<br />
+ Tổng số hạt trong X - lớn hơn trong M 3+ là 16.<br />
1. Tìm số P, N của M và X rồi gọi tên chúng?<br />
2. Hoà tan MX 3 vào nước. Hỏi dd thu được có thể tồn tại những ion nào?<br />
3. Hoàn tành phản ứng theo sơ đồ:<br />
(1): MX 3 + Ag 2 SO 4 → (A) ↓ + (B). (2): (B) + NaOH → (C) ↓ + H 2 O.<br />
(3): (C) + KOH → (D) + H 2 O. (4): (D) + H 2 O + H 2 SO 4 → (B) +…<br />
(5): (D) + HCl → (C) +…<br />
Giải<br />
1. Ta có hệ:<br />
2PM + NM + 3.(2PX + N<br />
X) = 196 PM<br />
+ 3PX<br />
= 64<br />
2PM + 6PX − NM − 3NX<br />
= 60<br />
NM<br />
+ 3NX<br />
= 68<br />
<br />
(PX + N<br />
X) − (PM + N<br />
M) = 8<br />
PX<br />
− PM<br />
= 4<br />
<br />
(2PX + NX + 1) − (2PM + NM<br />
− 3) = 16 <br />
PX + NX − PM − NM<br />
= 8<br />
2. Dd có Al 3+ ; Al(OH) 2+ ; Al(OH) + 2 ; H + ; Cl - .<br />
P = 13<br />
M<br />
<br />
X<br />
=<br />
P 17<br />
MX 3 = AlCl 3 .<br />
N = 14<br />
M<br />
<br />
X<br />
=<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
N 18<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Page <strong>10</strong><br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài tập 2: Hai nguyên tố X, Y tạo thành hợp chất XY 2 có tổng số proton bằng 32. Hiệu số nơtron<br />
của X và Y bằng 8. Trong các nguyên tử X, Y <strong>đề</strong>u có số proton = số nơtron. Xác định số lượng mỗi<br />
loại hạt của X và Y.<br />
Giải<br />
PX<br />
+ 2PY<br />
= 32 PX<br />
= 16<br />
NX<br />
− NY<br />
= 8<br />
PY<br />
= 8<br />
XY 2 = SO 2 .<br />
PX<br />
= NX<br />
NX<br />
= 16<br />
<br />
PY<br />
= NY<br />
<br />
NY<br />
= 8<br />
Bài tập 3: Hợp chất MX có tổng số hạt = 86 trong đó số hạt mang điện nhiều hơn số hạt không<br />
mang điện là 26. Số khối của X hơn của M là 12. Tổng số hạt của X - hơn của M + là 20.<br />
1. Xác định tên M và X?<br />
2. Hoàn thành phản ứng sau:<br />
(1): MX + H 2 O ⎯⎯⎯→(A) + (B) + (X). (2): (B) + (X) ⎯⎯→ (D).<br />
(3): (D) + (A) ⎯⎯→ MX + H 2 O. (4): (X) + (A)<br />
(5): (X) + KOH<br />
ĐS:MX là NaCl.<br />
Giải<br />
dpmn<br />
M M X X<br />
<br />
M<br />
+<br />
X<br />
−<br />
M<br />
−<br />
X<br />
=<br />
0<br />
70 C<br />
⎯⎯⎯→ …+…+…<br />
2P + N + 2P + N = 86<br />
2P 2P N N 26<br />
<br />
(P + N ) − (P + N ) = 12<br />
X X M M<br />
<br />
X<br />
+<br />
X<br />
+ −<br />
M<br />
+<br />
M<br />
− =<br />
(2P N 1) (2P N 1) 20<br />
<br />
P + P = 28<br />
M X<br />
<br />
M<br />
+<br />
X<br />
=<br />
N N 30<br />
<br />
P − P = 6<br />
X M<br />
<br />
X<br />
+<br />
X<br />
−<br />
M<br />
−<br />
M<br />
=<br />
P N P N 12<br />
<br />
0<br />
t thuong<br />
⎯⎯⎯⎯→ MX + … + …<br />
P = 11<br />
M<br />
<br />
X<br />
=<br />
P 17<br />
<br />
N = 12<br />
M<br />
<br />
X<br />
=<br />
N 18<br />
MX = NaCl<br />
Bài tập 4: Trong hợp chất M 2 X có:<br />
+ Tổng số hạt = 116 trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36.<br />
+ Số khối của M nhỏ hơn số khối của X là 9.<br />
+ Tổng số hạt trong X 2- lớn hơn trong M + là 17.<br />
Tìm M 2 X?<br />
Giải<br />
4PM + 2N<br />
M<br />
+ (2PX + N<br />
X) = 116 2PM<br />
+ PX<br />
= 38<br />
PM<br />
= 11<br />
4PM + 2PX − 2NM − NX<br />
= 36<br />
2NM<br />
+ NX<br />
= 40 PX<br />
= 16<br />
M 2 X = Na 2 S.<br />
(PX + N<br />
X) − (PM + N<br />
M) = 9<br />
PX<br />
− PM<br />
= 5<br />
NM<br />
= 12<br />
<br />
(2PX + NX + 2) − (2PM + NM<br />
− 1) = 17 <br />
PX + NX − PM − NM<br />
= 9 <br />
NX<br />
= 16<br />
Bài tập 5: Một kim loại M có số khối A=56. Tổng số các hạt cơ bản trong ion M +2 là 80.<br />
1. Tìm M? 2. Viết pư khi cho M và MSO 4 pư với Cl 2 , Zn, AgNO 3 , HNO 3 đặc nóng, M 2 (SO 4 ) 3<br />
ĐS: M là Fe.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài tập 6: Ba nguyên tố X, Y, Z có tổng số điện tích hạt nhân bằng 16, hiệu điện tích hạt nhân X<br />
và Y là 1, tổng số electron trong ion X 3 Y - là 32. Tìm tên 3 nguyên tố X, Y, Z.<br />
ĐS: X = oxi; Y = nitơ; Z = hiđro<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài tập 7: Hợp chất A được tạo thành từ ion M + và ion X 2- . Tổng số 3 loại hạt trong A là 140. Tổng<br />
số các hạt mang điện trong ion M + lớn hơn tổng số hạt mang điện trong ion X 2- là 19. Trong nguyên<br />
tử M, số hạt proton ít hơn số hạt nơtron 1 hạt; trong nguyên tử X, số hạt proton bằng số hạt nơtron.<br />
Tìm A?<br />
Giải<br />
2(2PM + N<br />
M) + 2PX + NX<br />
= 140<br />
PM<br />
= 19<br />
(2PM<br />
−1) − (2PX<br />
+ 2) = 19 4PM + 2(PM + 1) + 2PX + PX<br />
= 140<br />
PX<br />
= 8<br />
− A là K 2 O.<br />
PM<br />
+ NM<br />
= 1<br />
2PM<br />
− 2PX<br />
= 22<br />
NM<br />
= 20<br />
<br />
PX<br />
− NX<br />
= 0<br />
<br />
NX<br />
= 8<br />
Bài tập 8: Một hợp chất tạo bởi ion M + và X 2- 2 . Trong đó phân tử M 2 X 2 có tổng số hạt cơ bản là<br />
164, số hạt mang điện nhiều hơn số hạt không mang điện là 52. Số khối của M lớn hơn của X là<br />
23. Tổng số hạt proton và nơtron trong M + 2-<br />
nhiều hơn trong X 2 là 7 hạt. Tìm M 2 X 2 ?<br />
Giải<br />
4P + 2N + 4P + 2N = 164<br />
M M X X<br />
<br />
M<br />
+<br />
X<br />
−<br />
M<br />
−<br />
X<br />
=<br />
4P 4P 2N 2N 52<br />
<br />
(P + N ) − (P + N ) = −23<br />
X X M M<br />
<br />
X<br />
+<br />
X<br />
−<br />
M<br />
+<br />
M<br />
= −<br />
(2P 2N ) (P N ) 7<br />
<br />
P + P = 27<br />
M X<br />
<br />
M<br />
+<br />
X<br />
=<br />
N N 28<br />
<br />
P + N = 39<br />
M M<br />
<br />
X<br />
+<br />
X<br />
=<br />
P N 16<br />
<br />
P = 19<br />
M<br />
<br />
M<br />
=<br />
N 20<br />
<br />
P = 8<br />
X<br />
<br />
X<br />
=<br />
N 8<br />
(giải hệ ra Math error)<br />
Hợp chất đã cho là K 2 O 2 .<br />
Bài tập 9: Hợp chất M tạo nên bởi anion Y - và cation X + . Tỉ khối giữa Y - :X + = 31:9. A là nguyên<br />
tố có trong cả Y - và X + có tổng các hạt trong nguyên tử là 21. Trong M chỉ có hai nguyên tử A;<br />
trong X + có 5 nguyên tử của hai nguyên tố còn trong Y - có 4 nguyên tử của hai nguyên tố. Tìm M<br />
biết khối lượng của X + < 20?<br />
Giải<br />
+ Ta có: P A = 21:3 = 7 A là nitơ X + +<br />
là NA 4 và Y - -<br />
là NB 3 do đó ta có:<br />
14 + 3B 31<br />
=<br />
14 + 4A 9<br />
27B = 308 + 124A (1)<br />
+ Mặt khác ta có: 14 + 3A < 20 A = 1 (2)<br />
+ Từ (1, 2) suy ra: B = 16 = oxi M là NH 4 NO 3 .<br />
+<br />
Bài <strong>10</strong>: Tổng số hạt mang điện trong ion XY 4 là 21. Số proton của X hơn số proton của Y là 6<br />
hạt. Tìm X, Y? ĐS: NH + 4 .<br />
Bài 11: Tổng số proton trong hợp chất XY 2 bằng 38; % khối lượng của X trong XY 2 bằng 15,8%.<br />
Tìm X, Y biết trong X, Y số proton bằng số nơtron?<br />
Giải<br />
2PX<br />
Ta có: P X + 2P Y = 38 (1) và = 0,158 P X = 6; P Y 16 XY 2 là CS 2 .<br />
2P + 4P<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
X<br />
Y<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Bài 12: X, Y là hai phi kim, trong X và Y có số hạt mang điện nhiều hơn số hạt không mang điện<br />
lần lượt là 14 và 16. X và Y tạo thành hợp chất XY n trong đó: X chiếm 15,0486% về khối lượng;<br />
tổng số proton là <strong>10</strong>0; tổng số nơtron là <strong>10</strong>6. Tìm X, Y, XY n ? ĐS: PCl 5 .<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 13: Cho hợp chất A có dạng MX 2 có các đặc điểm sau:<br />
+ Tổng số hạt trong A là 140 trong đó số hạt không mang điện ít hơn số hạt mang điện là 44.<br />
+ Khối lượng nguyên tử của M nhỏ hơn của X là 11.<br />
+ Tổng số hạt trong X - nhiều hơn tổng số hạt trong M 2+ là 19<br />
ĐS:A là MgCl 2 .<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Chuyên <strong>đề</strong> 4: Cấu hình electron<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Lí thuyết cơ bản<br />
+ Trật tự các mức năng lượng như sau:<br />
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p.(*)<br />
+ Qui tắc viết<br />
- Bước 1: Xác định số e của nguyên tử.<br />
- Bước 2: Điền e vào các phân lớp theo (*) theo nguyên tắc: điền từ trái qua phải; số e tối đa điền<br />
vào s, p, d, f là 2, 6, <strong>10</strong>, 14.<br />
- Bước 3: Sắp xếp lại nếu cần(Z > 20)<br />
+ Cấu hình e thu gọn là cấu hình e có các phân lớp bên trong được thay thế bằng khí hiếm<br />
VD: Cấu hình e thu gọn của Na là [Ne]3s 1 .<br />
+ Nếu phân lớp cuối cùng của 1 nguyên tố(khi chưa sx lại) là s, p, d, f thì nguyên tố đó tương ứng<br />
được gọi là nguyên tố s, p, d, f.<br />
+ Số e ngoài cùng của 1 lớp = tổng số e của các phân lớp cao nhất.<br />
+ Số e lớp ngoài cùng = 1, 2, 3 kim loại(trừ H, He, B); = 5, 6, 7 phim kim; = 8 khí hiếm<br />
(trừ He).<br />
Bài tập củng cố lí thuyết<br />
Bài tập 1: Viết cấu hình e của 3 nguyên tố A, B, C có số e tương ứng là: 20; 25; và 35 ở dạng đầy<br />
đủ và thu gọn?<br />
Bài tập 2: Viết cấu hình của Na(z = 11), S(z = 16), Ca(z = 20), As(z =33), Zn(z = 30) rồi cho<br />
biết: + Nguyên tố nào là nguyên tố s, p, d, f?<br />
+ Số e lớp ngoài cùng của mỗi nguyên tố?<br />
Bài tập 3: Viết cấu hình của 4 nguyên tố X, Y, Z, T có số e tương ứng là 17, 18, 19, 31 rồi cho<br />
biết:<br />
a) X, Y, Z, T là nguyên tố s, p, d hay f?<br />
b) X, Y, Z, T là kim loại, pk hay khí hiếm?<br />
Bài tập 4: Tổng số hạt p, n, e trong nguyên tử nguyên tố X, Y lần lượt là 52 và 60.<br />
1. Tìm số e của X, Y?<br />
2. Viết cấu hình e của X, Y đầy đủ và thu gọn?<br />
3. X, Y là nguyên tố s, p, d hay f? là KL, PK hay KH?<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 5 : Tổng số hạt mang điện trong hợp chất MX 2 bằng 116.<br />
a) Tìm M, X biết tổng số hạt trong X là 48.<br />
b) Viết cấu hình e của M, X dạng đầy đủ và thu gọn ?<br />
c) Cho biết X, Y là nguyên tố s, p, d hay f? là KL, PK hay KH?<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Qui tắc chuyển cấu hình dạng chữ sang ô lượng tử.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ Thay thế phân lớp s, p, d, f bằng 1, 3, 5, 7 ô vuông<br />
+ Điền e vào mỗi ô vuông theo nguyên tắc: điền từng phân lớp một, điền từ trái qua phải, điền e<br />
quay lên trước rồi mới điền e quay xuống.<br />
Chú ý:<br />
Khi không <strong>đề</strong> cập đến năng lượng của e thì ta biểu diễn các ô lượng tử ngang hàng nhau và<br />
tách riêng các phân lớp trong 1 lớp.<br />
Nếu 1AO có 2e thì 2e đó gọi là e ghép đôi, nếu có 1e thì 1e đó gọi là e độc thân.<br />
Nếu các phân lớp s, p, d, f có số e tương ứng là 2, 6, <strong>10</strong>, 14 thì chúng được gọi là phân lớp<br />
bão hòa và ngược lại.<br />
Bài tập 1: A, B, C, D, E là 5 nguyên tố có số e là những số nguyên liên tiếp. Tổng số e của cả 5<br />
nguyên tố = 90.<br />
a) Tìm số e của 5 nguyên tố biết số e của A < B < C < D < E.<br />
b) Viết cấu hình A, B, C, D, E ở dạng chữ và ô lượng tử.<br />
c) Trong 5 nguyên tố trên nguyên tố nào là kim loại, phi kim, khí hiếm.<br />
Bài tập 2: Viết cấu hình e của Fe (z = 26) ở 3 dạng:<br />
a) Đầy đủ. b) Thu gọn. c) Ô lượng tử.<br />
Bài tập 3: Tổng số proton của 2 nguyên tố A và B là 37 trong đó số proton của A hơn của B là 3.<br />
1. Tính số p, e của A, B?<br />
2. Viết cấu hình e của A, B ở dạng chữ đầy đủ và ô lượng tử.<br />
3. A, B là kim loại hay phi kim? Vì sao? A, B có mấy e độc thân?<br />
ĐS: A là Caxi, B là Clo.<br />
Bài tập 4: Hợp chất M 2 X có tổng số proton = 54. Số proton của M hơn X là 3 proton.<br />
1. Tính số e của M, X?<br />
2. Viết cấu hình e của M, X ở dạng chữ đầy đủ và ô lượng tử.<br />
3. Gọi tên M, X, M 2 X và co biết M, X là kim loại hay phi kim?<br />
ĐS: M là Kali, X là Lưu huỳnh.<br />
Bài tập 5: Tổng số hạt trong nguyên tử M và N lần lượt là 122 và 80 trong đó số hạt mang điện<br />
nhiều hơn số hạt không mang điện tương ứng là 26 và 20.<br />
1. Tìm số e của M, N?<br />
2. Viết cấu hình e của M, N dạng chữ, ô lượng tử đầy đủ và thu gọn?<br />
3. M, N là kim loại hay phi kim? Nguyên tố s, p, d hay f? Tính số e độc thân ở M, N?<br />
ĐS: M là Rubiđi; N là Mangan.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài tập 6: Cho 3 nguyên tố X, Y, Z có tổng số proton là 90. Tổng số proton của X và Z gấp đôi<br />
số proton của Y. Số proton của Y hơn của X là 2.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
1. Tìm X, Y, Z?<br />
2. Viết cấu hình của X, Y, Z dạng đầy đủ và thu gọn? Viết cấu hình của Z dạng ô lượng tử rồi tính<br />
số e độc thân?<br />
3. X, Y, Z là KL, PK hay KH?<br />
ĐS: X là Ni, Y là Zn, Z là Ge<br />
Bài tập 7: Tổng số hạt trong nguyên tử nguyên tố M là 82, trong hạt nhân của M có số hạt mang<br />
điện ít hơn số hạt mang điện là 4.<br />
1. Tìm M?<br />
2. Viết cấu hình của M dạng ô lượng tử? Cho biết M là KL, PK hay KH?<br />
Viết cấu hình e đặc biệt<br />
Bài tập tình huống: Viết cấu hình e của Cu(Z=29) rồi so s<strong>án</strong>h với cấu hình e trong BTH?<br />
Phương pháp viết<br />
+ Cấu hình bền: là cấu hình mà phân lớp d, f đạt bão hòa tức là đạt d <strong>10</strong> ; f 14 hoặc nửa bão hòa tức<br />
là đạt d 5 ; f 7 .<br />
+ Qui tắc sớm bão hòa và nửa bão hòa: “Khi trong cấu hình của 1 nguyên tố có d 4 ; d 9 ; f 6 ; f 13 thif 1<br />
e ở phân lớp sát ngoài sẽ chuyển vào để nguyên tố này đạt được cấu hình bền”<br />
Bài tập 1: Viết cấu hình của<br />
a) Cu(Z=29) b) Cr(Z=24)<br />
Bài tập 2: Viết cấu hình của<br />
a) Ag(Z=47) b) Mo(Z=42)<br />
Bài tập 3: Nguyên tố X có cấu hình lớp ngoài cùng là 4s 1 .<br />
1. Viết cấu hình đầy đuur và gọi tên X?<br />
2. Lấy 2,8 gam oxit của X cho pư vừa đủ với 50 ml HCl 1,4M. Tìm X?<br />
ĐS: X là Cu<br />
Bài tập 4: Tổng số hạt trong nguyên tử nguyên tố X bằng 92 trong đó số hạt mang điện hơn số<br />
hạt không mang điện 24 hạt. Viết cấu hình e của X?<br />
Bài tập 5: Tổng số hạt mang điện trong X 2 O 3 hơn số hạt mang điện trong ion cacbonat là 82.<br />
1. Tìm X?<br />
2. Viết cấu hình e của X dạng thu gọn và ô lượng tử?<br />
ĐS: X là Crom.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Viết cấu hình đầy đủ khi biết cấu hình e lớp ngoài cùng.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ Các phân lớp bên trong phân lớp ngoài cùng phải bền tức là phải đạt bão hòa(hoặc nửa bão hòa<br />
với d, f) ứng với: s 2 ; p 6 ; d <strong>10</strong> ; f 14 ; d 5 ; f 7 .<br />
+ Điền e vào các phân lớp còn thiếu ta được cấu hình đầy đủ.<br />
Bài tập 1:<br />
1. Viết cấu hình e dạng chữ đầy đủ và ô lượng tử của các nguyên tố có cấu hình e lớp ngoài cùng<br />
như sau:<br />
A. 2s 2 2p 4 . B. 3s 2 3p 1 . C. 3d 5 4s 2 . D. 3s 2 3p 6 .<br />
2. Cho biết A, B, C, D là KL, PK hay KH? Tính số e độc thân của mỗi nguyên tố?<br />
Bài tập 2: X, Y có cấu hình e lớp ngoài cùng là ns 2 np 5 .<br />
1. X, Y là KL hay PK?<br />
2. Viết cấu hình e đầy đủ của X và Y biết chúng có n tương ứng là 2 và 4?<br />
Bài tập 3: X có phân lớp ngoài cùng là 5p 5 và có N/Z = 1,3962. Số N trong X gấp 3,7 lần số N<br />
trong Y. Cho 1,0725 gam Y pư với X dư thu được 4,565 gam sản phẩm có công thức XY.<br />
1. Viết cấu hình e của X?<br />
2. Xác định số proton; số khối và tên X, Y?<br />
3. X, Y là KL, PK hay KH?<br />
ĐS: X là iot; Y là kali<br />
Bài tập 4: A, B có cấu hình e phân lớp ngoài cùng là 3s x và 3p 5 .<br />
1. A, B là kim loại hay phi kim?<br />
2. Xác định cấu hình đầy đủ của a, B biết 2 nguyên tử có số e độc thân bằng nhau?<br />
Bài tập 5: X, Y có phân lớp ngoài cùng lần lượt là 3s 2 và 4p y (y>2)<br />
1. Tìm X, Y biết số e lớp ngoài cùng của X bằng số e độc thân của Y?<br />
2. X, Y là kim loại hay phi kim?<br />
Bài tập 6: Nguyên tố X có cấu hình lớp ngoài cùng là 4s 1 .<br />
1. Viết cấu hình đầy đủ và gọi tên X?<br />
2. Lấy 2,8 gam oxit của X cho pư vừa đủ với 50 ml HCl 1,4M. Tìm X?<br />
ĐS: X là Cu<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
Viết cấu hình e của ion<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ Nguyên tắc chung: để viết cấu hình e của ion đầu tiên ta phải viết cấu hình của nguyên tử trước.<br />
Từ cấu hình vừa viết xong ta bỏ hoặc <strong>thêm</strong> vào số e mà nguyên tử cho hoặc nhận<br />
+ Với các nguyên tố có Z ≤ 20: từ số e của nguyên tử ta tính số e của ion. Dựa vào số e của ion ta<br />
viết cấu hình e.<br />
+ Để viết cấu hình e của nguyên tử khi biết cấu hình e của ion ta cần bỏ bớt hay <strong>thêm</strong> vào số e mà<br />
nguyên tử đã nhận hay cho<br />
Bài 1: Cho hai nguyên tố A, B tổng số hạt mang điện là 82. Số proton của A bằng 68% số proton<br />
của B.<br />
1. Viết cấu hình của A, B dạng chữ đầy đủ và dạng ô lượng tử?<br />
2. A, B là KL hay PK? Là nguyên tố s, p, d hay f?<br />
3. Viết cấu hình e của A - ; B 2+ ; B 4+ dạng chữ và ô lượng tử?<br />
ĐS: A là Clo; B là Mangan.<br />
Bài 2: Cho A, B 2+ ; C + ; D 2- ; E - <strong>đề</strong>u có cấu hình e lớp ngoài cùng là 3s 2 3p 6 .<br />
1. Viết cấu hình e của A, B, C, D, E?<br />
2. Xác định loại nguyên tố của chúng?<br />
Bài 3: X, Y, Z có số e tương ứng là 20, 26 và 28.<br />
1. Viết cấu hình của X, Y, Z dạng đầy đủ và ô lượng tử?<br />
2. Viết cấu hình e của X 2+ ; Y 2+ ; Y 3+ ; Z 2+ ?<br />
3. X, Y, Z là nguyên tố s, p, d hay f?<br />
Bài 4: Cho hai ion A 3+ và B 3- <strong>đề</strong>u có 2 phân lớp e ngoài cùng là 2s 2 2p 6 .<br />
1. Viết cấu hình e của A, B dạng đầy đủ và ô lượng tử?<br />
2. Xác định số e độc thân của A, B?<br />
Bài 5: Viết cấu hình e của chất đầu và sản phẩm trong mỗi TH sau<br />
a) Cu 2+ (Z=29) nhận 2e b) Fe 2+ (Z=26) cho 1e<br />
c) Br(Z=35) nhận 1e d/ Hg(Z=80) cho 2e<br />
Bài 6(A_2011): Cấu hình electron của ion Cu 2+ ; và Cr 3+ lần lượt là<br />
A. [Ar]3d 9 và [Ar]3d 1 4s 2 . B. [Ar]3d 7 4s 2 và [Ar]3d 3 .<br />
C. [Ar]3d 9 và [Ar]3d 3 . D. [Ar]3d 7 4s 2 và [Ar]3d 1 4s 2 .<br />
Bài 7(A_07): Dãy gồm các ion X + , Y - và nguyên tử Z <strong>đề</strong>u có cấu hình electron 1s 2 2s 2 2p 6 là:<br />
A. Na + , Cl - , Ar. B. Li + , F - , Ne. C. Na + , F - , Ne. D. K + , Cl - , Ar.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
CHƯƠNG 2: BẢNG TUẦN HOÀN VÀ ĐỊNH LUẬT TUẦN HOÀN<br />
Chuyên <strong>đề</strong> 1: XÁC ĐỊNH VỊ TRÍ CỦA 1 NGUYÊN TỐ TRONG BTH<br />
Phương pháp giải<br />
- Vị trí = ô + chu kì + nhóm(A, B)<br />
- Cách xác định:<br />
+ Bước 1: Viết cấu hình rồi xác định nguyên tố s, p, d, f để sau này xác định nhóm A, B<br />
+ Bước 2: Xác định vị trí:<br />
STT của ô = Z = P = E<br />
STT của chu kì = số lớp e<br />
STT của nhóm = số e hóa trị<br />
* Nếu là nguyên tố s, p thì là nhóm A<br />
* Nếu là nguyên tố d thì là nhóm B<br />
* Nếu là nguyên tố f thì thuộc nhóm IIIB<br />
* Nếu số e hóa trị là 9, <strong>10</strong> thì thuộc nhóm VIIIB.<br />
Bài tập<br />
Bài 1: Cho 4 nguyên tố X, Y, Z, T có số e tương ứng là 13, 17, 21, 26. Viết cấu hình e và xác<br />
định vị trí của chúng trong BTH?<br />
Bài 2: Tổng số hạt trong nguyên tử nguyên tố X, Y lần lượt là 36 và 40.<br />
1. Xác định vị trí của X, Y trong BTH?<br />
2. Có hh kim loại X, Y, Cu, Ag. Hãy tách riêng chúng ra khỏi hh?<br />
Bài 3: A, B, C có cấu hình e lớp ngoài cùng lần lượt là: 3s 2 3p 1 ; 4s 2 4p 5 và 4s 1 .<br />
1. Viết cấu hình đầy đủ của A, B, C?<br />
2. Xác định vị trí của A, B, C trong BTH?<br />
Bài 4: Cho 3 nguyên tố A, B, C có tổng số e bằng 99. Tổng số e của A và C gấp đôi số e của B. C<br />
có số e hơn A là 6.<br />
1. Tìm A, B, C?<br />
2. Xác định vị trí của A, B, C trong BTH? A, B, C là KL; PK hay KH?<br />
3. D là nguyên tố t/m: E D + E C = 2E A . Xác định vị trí của D trong BTH?<br />
ĐS: A là Zn; B là As; C là Kr; D là Cr.<br />
Bài 5: Tổng số hạt mang điện của A và B là 90. Số proton của A bằng 1,8125 lần số e của B. Viết<br />
cấu hình và xác định vị trí của A, B trong BTH?<br />
ĐS A là đồng; B là lưu huỳnh.<br />
Bài 6: Ion X 2- ; Y 2+ và nguyên tử Z <strong>đề</strong>u có cấu hình e lớp ngoài cùng là 3s 2 3p 6 .<br />
1. Viết cấu hình của X, Y, Z?<br />
2. Xác định vị trí của X, Y, Z trong BTH?<br />
Bài 7: X có cấu hình e dạng: .......5f 3 6d 1 7s 2 . Không viết cấu hình hãy xác định vị trí của X trong<br />
BTH?<br />
Bài 8: Cation M 3+ có cấu hình lớp vỏ ngoài cùng là 2p 6 . Xác định cấu hình của M, sơ đồ obitan.<br />
Xác định vị trí của X trong bảng HTTH?<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 9: Nguyên tử nguyên tố X có tổng số các loại hạt là 93 trong đó số hạt mang điện nhiều hơn số<br />
hạt không mang điện là 23. Xác định số hiệu nguyên tử, số khối. Viết cấu hình electron của X, X +<br />
và X 2+ . Xác định vị trí của X trong bảng HTTH?<br />
ĐS: X là Cu.<br />
Bài <strong>10</strong>: Một kim loại M có số khối A=56. Tổng số các hạt cơ bản trong ion M +2 là 80. Hãy xác<br />
định vị trí của X trong bảng HTTH. ĐS: M là Fe<br />
Bài 11: Một nguyên tố phi kim R có hai đồng vị X và Y. Cho kim loại Fe tác dụng với X, Y ta<br />
lần lượt được hai muối X’ và Y’ có tỷ lệ khối lượng phân tử là 293.299. Biết rằng tỷ số số nguyên<br />
tử X và Y trong R bằng <strong>10</strong>9/91 và tổng số n của X và Y bằng 4,5 lần số hiệu nguyên tử của<br />
nguyên tố ở chu kỳ 4, nhóm A nhóm hai. Mặt khác khi cho muối NaR tác dụng vừa đủ với 40/3<br />
gam dd AgNO 3 25,5% ta được 3,7582 gam muối bạc ( hiệu suất <strong>10</strong>0%).<br />
1. Xác định khối lượng nguyên tử R.<br />
2. Xác định số khối của X và Y.<br />
3. Viết cấu hình e của R. Vị trí của R trong bảng HTTH.<br />
Chuyên <strong>đề</strong> 2: Bài tập về vị trí tương đối của hai nguyên tố<br />
Phương pháp giải<br />
Nếu 2 nguyên tố X và Y cùng nhóm A và thuộc hai chu kì liên tiếp thì P Y – P X = 2, 8, 18, 32.<br />
Nếu 2 nguyên tố X và Y liên tiếp trong 1 chu kì thì P Y – P X = 1.<br />
Nếu 2 nguyên tố X và Y cách nhau n trong 1 chu kì thì P Y – P X = n +1.<br />
Nếu một nguyên tố nhận e tạo ra ion âm thì nó là phi kim và ngược lại nếu một nguyên tố cho<br />
e tạo ra ion dương thì nó là kim loại.<br />
Số e cho hay nhận phải thỏa mãn đk là tạo thành ion có cấu hình bền.<br />
Bài tập<br />
Bài 1: X, Y là hai nguyên tố ở cùng một nhóm A và thuộc hai chu kỳ liên tiếp trong bảng HTTH.<br />
Tổng số hạt proton trong hai hạt nhân X và Y là 32. Hãy viết cấu hình của X và Y và các ion mà X<br />
và Y có thể tạo thành?<br />
Bài 2: Tương tự với các cặp nguyên tố có tổng số e bằng:<br />
a) 26(Flo và Clo) b) 30(Natri và Kali) c) 44(Al và Ga) d/ 50(S và Se)<br />
Bài 3: A, B là hai nguyên tố thuộc hai ô liên tiếp trong 1 chu kì. Tổng số hạt mang điện của A, B<br />
là 66.<br />
1. Tìm A, B có Z B >Z A ? 2. Viết cấu hình e và xác định vị trí của A, B trong BTH?<br />
ĐS: S và Cl<br />
Bài 4: X và Y là hai nguyên tố ở hai nhóm A liên tiếp trong bảng HTTH. Y thuộc nhóm V; ở trạng<br />
thái đơn chất X và Y không phản ứng với nhau. Tổng số hạt proton trong hạt nhân của nguyên tử<br />
hai nguyên tố là 23.<br />
a) Viết cấu hình của X và Y.<br />
b) Từ các đơn chất X và Y cùng các hoá chất cần thiết hãy viết các phương trình phản ứng điều chế<br />
hai axit trong đó X và Y có số oxi hoá dương cao nhất.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
ĐS: X là lưu huỳnh; Y là nitơ.<br />
Bài 5: X, Y là 2 nguyên tố trong cùng 1 nhóm A, thuộc 2 chu kì liên tiếp trong hệ thống tuần hoàn.<br />
1. Tổng số hạt proton, nơtron và electron có trong một loại nguyên tử Y là 54, trong đó số hạt mang<br />
điện nhiều hơn số hạt không mang điện 1,7 lần. Tính số hiệu nguyên tử và số khối của Y.<br />
2. Viết cấu hình e của Y, xác định vị trí (chu kì, nhóm, phân nhóm) và tên gọi của nguyên tố Y.<br />
3. Cho biết nguyên tố X có thể là nguyên tố gì? Xác định tên gọi đúng của X, nếu xảy ra phản ứng<br />
sau: Y 2 + 2NaX = X 2 + 2NaY<br />
Bài 6: Hai nguyên tố A, B thuộc 2 chu kì liên tiếp, có thể tạo thành các anion A 2- và B 2- (<strong>đề</strong>u có cấu<br />
hình electron của khí trơ). Hãy tìm A, B biết Z A -Z B = 18 và có 1 nguyên tố thuộc CK nhỏ?<br />
Bài 7: X và Y <strong>đề</strong>u ở nhóm A. X tác dụng với HCl giải phóng ra khí H 2 . Số electron lớp ngoài cùng<br />
của nguyên tử Y bằng số lớp electron của nguyên tử X. Số hiệu của nguyên tử X bằng 7 lần số hiệu<br />
của nguyên tử Y.<br />
1. Tìm X, Y?<br />
2. X và Y có thể tạo được 2 hợp chất M và N viết CTCT và giải thích liên kết trong M và N. Nêu<br />
cách phân biệt M và N.<br />
Bài 8: Phân tử X 2 Y có tổng số proton là 23. Biết X, Y ở hai nhóm A liên tiếp trong cùng một chu<br />
kì. Tìm X 2 Y? ĐS: NO 2 .<br />
Bài tập nâng cao<br />
Bài 0: Hợp chất M được tạo thành từ cation X + và anion Y 2- . Mỗi ion <strong>đề</strong>u do năm nguyên tử của<br />
hai nguyên tố tạo nên. Tổng số proton trong X + là 11, tổng số electron trong Y 2- là 50. Xác định<br />
công thức phân tử và gọi tên của M biết hai nguyên tố trong Y 2- thuộc cùng một nhóm và hai chu<br />
kì liên tiếp trong BTH. ĐS: amoni sunfat<br />
Bài 1: Hợp chất A tạo thành từ X + và Y 2- . Trong X + có 5 hạt nhân của hai nguyên tố và có <strong>10</strong>e.<br />
Trong Y 2- có 4 hạt nhân của hai nguyên tố trong cùng một chu kì và cách nhau một ô trong BTH.<br />
Tổng số e trong Y 2- là 32. Tìm A?<br />
ĐS: amoni cacbonat.<br />
Bài 2: Cho hai ion X + và Y - . Trong X + có 4 nguyên tử của hai nguyên tố và có tổng số e là <strong>10</strong>.<br />
Tổng số hạt trong Y - là 53. Tìm hai ion trên biết Y - là ion đơn nguyên tử? ĐS: H 3 O + và Cl - .<br />
Bài 3: Hợp chất M tạo bởi X + và Y 3- , cả 2 ion <strong>đề</strong>u do 5 nguyên tử của 2 nguyên tố tạo nên. Tổng<br />
số proton của X + là 11; trong X + có nguyên tố P; Y 3- có nguyên tố Q trong đó P và Q là hai nguyên<br />
tố thuộc cùng một nhóm và hai chu kì liên tiếp. Khối lượng phân tử của M là 149. Tìm M.<br />
ĐS: amoni photphat.<br />
2-<br />
Bài 4: Cho biết tổng số electron trong ion AB 3 là 42, trong các hạt nhân nguyên tử của nguyên<br />
tố A cũng như nguyên tố B số hạt proton bằng số hạt nơtron. Tìm A, B? ĐS: SO 2- 3 .<br />
Ta có: P + 3P’ = 40 P’ = (40-P)/3< 13,3. Vì B tạo anion và có P’ < 13,3 nên B là phi kim<br />
thuộc chu kì 2 B là F; O; N; C tương ứng A là…<br />
Bài 5: Hợp chất A có công thức là MX x trong đó M chiếm 46,67% về khối lượng; M là kim loại,<br />
X là phi kim ở chu kì 3. Trong hạt nhân của M có n-p=4; của X có n’=p’. Tổng số proton trong<br />
MX x là 58. Xác định tên, số khối của M, X. Viết cấu hình electron và xác định vị trí của chúng<br />
trong bảng HTTH. ĐS: MX x là FeS 2 .<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 6: Một hợp chất ion cấu tạo từ M + và X 2- . Trong phân tử M 2 X có tổng số các loại hạt là 140<br />
hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt. Số khối của ion M + lơn<br />
hơn số khối của ion X 2- là 23. Tổng số các loại hạt trong ion M + nhiều hơn tổng số các loại hạt trong<br />
ion X 2- là 31.<br />
a) Viết cấu hình electron của các ion M + và X 2- ; của M và X.<br />
b) Xác định vị trí của M và X trong bảng HTTH. ĐS: M 2 X là K 2 O<br />
Bài 7: Hợp chất A được tạo thành từ ion M + và ion X 2- . Tổng số 3 loại hạt trong A là 140. Tổng số<br />
các hạt mang điện trong ion M + lớn hơn tổng số hạt mang điện trong ion X 2- là 19. Trong nguyên<br />
tử M, số hạt proton ít hơn số hạt nơtron 1 hạt; trong nguyên tử X, số hạt proton bằng số hạt nơtron.<br />
Viết cấu hình electron của M + và X 2- và gọi tên chất A.<br />
Bài 8: Trong phân tử A 2 B gồm ion A + và B 2- có tổng số các hạt là 140, trong đó số hạt mang điện<br />
nhiều hơn số hạt không mang điện là 44. Mặt khác, người ta biết số khối của ion A + lớn hơn trong<br />
ion B 2- là 23. Tổng số hạt trong ion A + nhiều hơn trong ion B 2- là 31. Hãy:<br />
* Xác định điện tích hạt nhân của A và B.<br />
* Viết cấu hình electron của các ion A + và B 2- .<br />
+ KL riêng: D =<br />
m<br />
V<br />
+ Thể tích hình cầu: V =<br />
Chuyên <strong>đề</strong> 3: Bài tập xác định b<strong>án</strong> kính nguyên tử<br />
4 r<br />
3<br />
3 <br />
Phương pháp giải<br />
+ 1 mol một chất X bất kì <strong>đề</strong>u có N A = 6,02.<strong>10</strong> 23 nguyên tử X.<br />
+ Độ đặc khít: lập phương tâm khối = 68%; lập phương tâm diện = 74%.<br />
Bài tập<br />
Bài 1: Kim loại crôm có cấu trúc tinh thể với phần rỗng trong tinh thể chiếm 32%. Khối lượng<br />
riêng của crôm là d=7,19g/cm 3 . Hãy tính b<strong>án</strong> kính nguyên tử tương đối của crôm. Cho Cr=52.<br />
ĐS: 1,25.<strong>10</strong> -8 cm 3 .<br />
Bài 2: Nếu thừa nhận rằng nguyên tử Ca và Cu <strong>đề</strong>u có dạng hình cầu, sắp xếp đặc khít bên cạnh<br />
nhau thì thể tích chiếm bởi các nguyên tử kim loại bằng 74% so với toàn khối tinh thể. Hãy tính<br />
b<strong>án</strong> kinh nguyên tử tương đối của Ca và Cu theo đơn vị anstron. Biết khối lượng riêng của chúng<br />
ở thể rắn tương ứng là 1,55g/cm 3 và 8,9g/cm 3 . Cho Ca=40,08 và Cu=63,546u<br />
ĐS: Ca = 1,96.<strong>10</strong> -8 cm; Cu = 1,28.<strong>10</strong> -8 cm.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 3: Tính b<strong>án</strong> kính nguyên tử của Fe và của Au ở 20 0 C, biết ở nhiệt độ đó khối lượng riêng của<br />
Fe là 7,87g/cm 3 và của Au là 19,32g/cm 3 . Với giả thiết trong tinh thể nguyên tử Fe hay Au là những<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
hình cầu chiếm 75% thể tích của tinh thể, phần còn lại là khe rỗng giữa các quả cầu. Cho Fe=55,85<br />
và Au= 196,97. ĐS: Fe = 1,29.<strong>10</strong> -8 cm; Au = 1,44.<strong>10</strong> -8 .<br />
Bài 4: (A_2011)Khối lượng riêng của canxi kim loại là 1,55 g/cm 3 . Giả thiếtt rằng, trong tinh thể<br />
canxi các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Cho<br />
Ca = 40, tính b<strong>án</strong> kính nguyên tử canxi tính theo lí thuyết:<br />
A. 0,185 nm. B. 0,196 nm. C. 0,155 nm. D. 0,168 nm.<br />
Bài 5: Nhôm có b<strong>án</strong> kính là 1,43 ăngtron và có M = 27u. Tính khối lượng riêng của Al biết trong<br />
tinh thể Al có 26% rỗng? ĐS: 2,7 gam/cm 3 .<br />
Chuyên <strong>đề</strong> 4: Giải bài tập bằng phương pháp trung bình<br />
Ghi nhớ<br />
+ Phương pháp trung bình là phương pháp chuyển hh hai hay nhiều chất tương tự nhau về một chất duy<br />
nhất gọi là chất trung bình.<br />
+ Vì số chất giảm xuống nên số phản ứng và số ẩn cũng giảm. Từ các giá trị của chất trung bình ta có thể<br />
suy ra được các chất cần tìm<br />
+ Khối lượng và số mol của chất trung bình bằng tổng khối lượng và tổng số mol của các chất ban đầu.<br />
+ Phương pháp trung bình thường dùng cho các chất kế tiếp.<br />
Bài tập<br />
Bài 1: Cho 6,4 gam hh 2 kim loại thuộc hai chu kì liên tiếp trong nhóm IIA tác dụng với HCl dư<br />
thì thu được 4,48 lít khí hiđro (đktc). Tìm hai kim loại đã cho? ĐS: Mg = Ca = 0,1 mol.<br />
Bài 2: Hòa tan 20,2 (g) hh 2 kim loại nằm ở hai chu kỳ liên tiếp thuộc nhóm IA vào nước thu được<br />
6,72 (l) khí (đkc) và dd A.<br />
a) Tìm tên và khối lượng hai kim loại kiềm.<br />
b) Tính thể tích dd H 2 SO 4 2 (M) cần dùng để trung hòa dd A.<br />
ĐS: a. Na = 0,2 mol; K = 0,4 mol. b. 0,15 lít.<br />
Bài 3: X,Y là 2 halogen (thuộc nhóm VIIA) ở 2 chu kì liên tiếp. Hòa tan 16,15 gam hh NaX và<br />
NaY vào nước sau đó cho tác dụng với dd AgNO 3 dư thu được 33,15 gam hh kết tủa. Xác định tên<br />
của X,Y và phần trăm khối lượng mỗi muối trong hh đầu. ĐS: NaCl = NaBr = 0,1 mol.<br />
Bài 4: Hòa tan hết 2,84 gam hh hai muối cacbonat của hai kim loại nhóm IIA thuộc hai chu kì liên<br />
tiếp bằng dd HCl dư thu được dd X và 0,672 lít CO 2 ở đktc. Tìm công thức và khối lượng mỗi<br />
muối? ĐS: MgCO 3 = 0,01 mol; CaCO 3 = 0,03 mol.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 5: Để hòa tan <strong>10</strong>,4 gam hh hai kim loại liên tiếp trong nhóm IIA cần 600 ml dd HCl 2M. Tìm<br />
tên và khối khối lượng mỗi kim loại đã cho?<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 6: Hh X gồm hai muối cacbonat của hai kim loại kiềm thổ liên tiếp. Cho 14,2 gam X pư với dd<br />
HCl dư được 3,36 lít CO 2 ở đktc. Tìm tên và KL của mỗi kim loại?<br />
Bài 7: Hh A gồm hai muối cacbonat của hai kim loại nhóm IIA thuộc hai chu kì liên tiếp trong<br />
BTH. Cho 7,2 gam A tan hết vào dd HCl dư được khí B. Hấp thụ hết B bởi 450 ml dd Ba(OH) 2<br />
0,2M thu được 15,76 gam kết tủa. Tìm tên và khối lượng mỗi muối trong A?<br />
Bài 8: Cho 1,9 gam hh muối cacbonat và hiđrocacbonat của kim loại kiềm M pư với dd HCl dư<br />
được 0,448 lít khí CO 2 ở đktc. Tìm M? ĐS: M là Na<br />
Chuyên <strong>đề</strong> 5: Vận dụng các qui luật trong BTH<br />
Bài tập vận dụng qui luật biến đổi R, I, <br />
Ghi nhớ<br />
+ Trong 1 chu kì khi Z thì R; I 1 ; <br />
+ Trong 1 nhóm A khi Z thì R; I 1 ; <br />
+ Với các ion và nguyên tử có số e bằng nhau thì R tỉ lệ nghịch với Z.<br />
Bài 1: X, Y, Z là ba nguyên tố thuộc ba ô liên tiếp trong một chu kì có tổng số hạt mang điện là 96.<br />
1. Tìm tên và vị trí của X, Y, Z trong BTH cho P X < P Y < P Z .<br />
2. So s<strong>án</strong>h b<strong>án</strong> kính và độ âm điện của: Na, X, Y, Z?<br />
3. So s<strong>án</strong>h b<strong>án</strong> kính của: X 3- ; Y 2- , Z - , Ar và K + .<br />
ĐS: X là photpho; Y là lưu huỳnh; Z là clo.<br />
Bài 2: Cho hai nguyên tố X, Y cùng một nhóm A và hai chu kì liên tiếp có tổng số proton là 24(P X<br />
< P Y ). Cho hai nguyên tố Z, T kế tiếp nhau trong một chu kì. Tổng số khối của chúng là 51; số nơ<br />
tron của T hơn của Z là 2; số e của Z = số nơtron của Z.<br />
1. Tìm X, Y, Z, T?<br />
2. So s<strong>án</strong>h b<strong>án</strong> kính và độ âm điện của X, Y, Z, T?<br />
3. Y, Z, T tạo ra các ion nào? So s<strong>án</strong>h b<strong>án</strong> kính của các ion đó?<br />
ĐS: 1. X là oxi; Y là lưu huỳnh; Z là Magie; T là nhôm.<br />
Bài 3: Tổng số hạt của hai nguyên tố A, B lần lượt là 24 và 46. Tìm A, B? So s<strong>án</strong>h R, độ âm điện<br />
của A, B? ĐS: A là oxi; B là photpho.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 4: Viết tên các nguyên tố được mô tả như sau:<br />
1. KLK thổ với 2e hóa trị ở lớp n = 5(Sr)<br />
2. Nguyên tố với obitan 6p nửa bão hòa(Bitmut)<br />
3. Nguyên tố có I 1 min; X max?<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
4. Nguyên tố ở chu kì 3 có 2 electron p ngoài cùng chưa ghép đôi?<br />
5. Nguyên tố có cấu hình e: [Khí hiếm](n-1)d x ns 1 .<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 5: Cho 3 nguyên tố X, Y, Z có e cuối cùng ứng với 4 số lượng tử như sau:<br />
n l m m s<br />
X 3 0 0 +1/2<br />
Y 3 0 0 -1/2<br />
Z 4 0 0 +1/2<br />
1. Viết cấu hình và gọi tên của chúng biết chúng <strong>đề</strong>u thuộc nhóm A?<br />
2. So s<strong>án</strong>h R, X, I 1 của ba nguyên tố trên?<br />
ĐS: X là Na; Y là Mg; Z là Kali.<br />
Bài 6: Sắp xếp có giải thích các hạt vi mô dưới đây theo chiều R.<br />
1. Rb + (Z=37); Y 3+ (Z=39); Kr(Z=38); Br(Z=35); Se 2- (Z=34) và Sr 2+ (Z=38).<br />
2. Na, Na + ; Mg 2+ ; Mg; Al; Al 3+ ; F - ; O 2- .<br />
Bài 7: Phân tử MX 2 có tổng số hạt bằng 186 trong đó số hạt mang điện nhiều hơn số hạt không<br />
mang điện là 54. Số khối của M 2+ hơn X - là 21.Tổng số hạt trong M 2+ lớn hơn trong X - là 27.<br />
1. Tìm MX 2 ? Viết cấu hình e của M 2+ ; M 3+ ?<br />
2. So s<strong>án</strong>h R, độ âm điện của X, selen và flo?<br />
Giải<br />
1. Theo giả thiết ta có hệ:<br />
2P + N + 4P ' + 2N ' = 186<br />
2P + 4P ' − N − 2N ' = 54<br />
<br />
P + N − P ' − N ' = 21<br />
<br />
(2P + N − 2) − (2P ' + N ' + 1) = 27<br />
<br />
P + 2P ' = 60<br />
P − P ' = 9<br />
<br />
N + 2N ' = 66<br />
<br />
N − N ' = 12<br />
2. R của Se > Cl > F; độ âm điện của Se < Cl < F.<br />
Bài 8: X, Y thuộc chu kì 3 có năng lượng ion hóa như sau:<br />
<br />
P = 26<br />
P ' = 17<br />
<br />
N = 30<br />
<br />
N ' = 18<br />
FeCl 2 .<br />
I1 I2 I3 I4 I5 I6<br />
X(kJ/mol) <strong>10</strong>12 1903 29<strong>10</strong> 4956 6287 22230<br />
Y(kJ/mol) 577 1816 2744 11576 14829 18375<br />
Viết cấu hình của X, Y dạng ô lượng tử?<br />
ĐS: X là photpho = 1s 2 2s 2 2p 6 3s 2 3p 3 ; Y là Mg là 1s 2 2s 2 2p 6 3s 2 .<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài tập vận dụng qui luật biến đổi tính kim loại, phi kim, hóa trị, tính axit – bazơ.<br />
Bài 1: So s<strong>án</strong>h tính chất hóa học của các nguyên tố sau mà không dùng BTH?<br />
a) Cl(Z=17); P(Z=15); S(Z=16).<br />
b) A(Z=12); B(Z=19); C(Z=20) và D(Z=13).<br />
c) Li(Z=3); Na(Z=11); K(Z=19).<br />
Bài 2: Dùng BTH hãy sắp xếp các nguyên tố sau:<br />
1. Theo chiều tính kim loại yếu dần:<br />
a) Mg; K; Ca; Al; Rb b) Cs; Rb; Sr; Ca.<br />
2. Theo chiều tăng dần tính phi kim.<br />
a) Sb; Te; Br; Cl. b) As; Se; S; Cl; F.<br />
Bài 3: Cho ba nguyên tố X, Y, Z có tổng số proton là 44 (X>Y>Z) trong đó Y và Z thuộc hai ô liên<br />
tiếp trong chu kì. Tổng số hạt mang điện của X hơn Y là 12.<br />
1. Tìm X, Y, Z?<br />
2. So s<strong>án</strong>h tính chất hóa học của X, Y, Z?<br />
ĐS: X= Kali; Y = Nhôm; Z= Magie<br />
Bài 4: X thuộc chu kì 3 và có 2e độc thân ở trạng thái cơ bản; tính phi kim của X mạnh hơn photpho;<br />
Y là nguyên tố thuộc nhóm IA có b<strong>án</strong> kính nhỏ hơn b<strong>án</strong> kính của Rb và có độ âm điện lớn nhỏ hơn<br />
Li. Tìm X, Y?<br />
Phương pháp viết công thức của hiđroxit cao nhất<br />
I. KN.<br />
+ Hiđroxit là hợp chất có nhóm HO và một nguyên tố khác.<br />
VD: NaOH; HClO; H 2 SO 4 .<br />
+ Phân loại: có hai loại<br />
Bazơ: là hiđroxit của kim loại như NaOH, KOH, Mg(OH) 2 , Al(OH) 3 ,..., M(OH) n .<br />
Axit có oxi: H 2 SO 4 = SO 2 (OH) 2 ; H 2 CO 3 = CO(OH) 2 ;...<br />
+ Điều kiện tồn tại của hiđroxit: số H 3 và số O 4.<br />
II/ Phương pháp viết.<br />
+ Gọi X là nguyên tố cần viết công thức hiđroxit; gọi n là hóa trị cao nhất của X thì công thức<br />
hiđroxit cao nhất của X là X(OH) n .<br />
+ Nếu n 3 thì ta giữ nguyên công thức trên.<br />
+ Nếu n > 3 thì X(OH) n không tồn tại do đó ta phải trừ đi từng phân tử nước một đến khi thỏa mãn<br />
thì dừng lại sau đó ta đưa H lên trước.(trường hợp đặc biệt là HNO 3 )<br />
VD: Viết công thức của hiđroxit cao nhất ứng với Na, Mg, Al, C, P, S và Cl.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Giải<br />
+ Với Na: hóa trị cao nhất là 1 NaOH.<br />
+ Với Mg: hóa trị cao nhất là 2 Mg(OH) 2 .<br />
+ Với Al: hóa trị cao nhất là 3 Al(OH) 3 .<br />
−H2O<br />
+ Với C: hóa trị cao nhất là 4 C(OH) 4 ⎯⎯⎯→ CO 3 H 2 hay H 2 CO 3 .<br />
−H2O<br />
+ Với P: hóa trị cao nhất là 5 P(OH) 5 ⎯⎯⎯→ PO 4 H 3 hay H 3 PO 4 .<br />
−H2O<br />
−H2O<br />
+ Với S: hóa trị cao nhất là 6 S(OH) 6 ⎯⎯⎯→ SO 5 H 4 ⎯⎯⎯→ SO 4 H 2 hay H 2 SO 4 .<br />
−H2O<br />
−H2O<br />
−H2O<br />
+ Với Cl: hóa trị cao nhất là 7 Cl(OH) 7 ⎯⎯⎯→ ClO 6 H 5 ⎯⎯⎯→ ClO 5 H 3 ⎯⎯⎯→ ClO 4 H hay<br />
HClO 4 .<br />
Bài tập<br />
Bài 1: Viết công thức của oxit cao nhất; hiđroxit cao nhất; hợp chất với hiđro của các nguyên tố<br />
sau: kali; brom; selen; asen; bari; mangan?<br />
Bài 2: X có tổng số hạt là 48.<br />
1. Tìm vị trí của X trong BTH?<br />
2. Tìm hóa trị lớn nhất của X và hóa trị với hiđro từ đó viết công thức của oxit cao nhất; hợp chất<br />
với hiđro và hiđroxit cao nhất.<br />
Bài 3: X có 3e độc thân thuộc phân lớp 3p.<br />
1. Tìm vị trí của X trong BTH?<br />
2. Viết và gọi tên của oxit cao nhất, hiđroxit cao nhất và hợp chất với hiđro<br />
Bài 4: X là nguyên tố thuộc nhóm A. Tổng số hạt trong X là 115.<br />
1. Tìm X biết X có 1 e độc thân ở trạng thái cơ bản?<br />
2. Xác định vị trí của X trong BTH?<br />
3. Viết công thức của oxit; hiđroxit cao nhất; hợp chất với hiđro?<br />
ĐS: 32,9 P 38,3 P = 33, 34, 35, 36, 37, 38. Vì X có 1 e độc thân nên X có P = 35.<br />
Bài 5: Tổng số hạt của nguyên tử nguyên tố X bằng 82.<br />
1. Tìm X biết ở trạng thái cơ bản X có tổng spin = +2.<br />
2. Tính tổng spin trong các ion X 2+ và X 3+ ?<br />
ĐS: X là Fe.<br />
Bài 6: X, Y là hai nguyên tố thuộc hai chu kì liên tiếp trong một nhóm A. Tổng số hạt mang điện<br />
trong cả X và Y là <strong>10</strong>0.<br />
1. Tìm X, Y? 2. So s<strong>án</strong>h tính phi kim của X, Y, Cl?<br />
3. Viết công thức của hiđroxit cao nhất ứng với X, Y rồi so s<strong>án</strong>h tính axit của chúng? Nhận xét về<br />
thành phần và tính chất của hợp chất tương ứng với X và Y?<br />
ĐS: X là S, Y là Se.<br />
Bài 7: Cho 4 nguyên tố A, B, C, D có tổng số hạt mang điện là 124<br />
1. Tìm A, B, C, D biết chúng thuộc 4 ô liên tiếp trong một chu kì và Z A < Z B < Z C < Z D .<br />
2. Viết công thức của oxit, hiđroxit cao nhất và hợp chất với hiđro ứng với 4 nguyên tố đó?<br />
3. Các hiđroxit trên có tính axit hay bazơ? So s<strong>án</strong>h tính chất đó?<br />
ĐS: A = Si; B = P; C = S; D = Cl<br />
Bài 8: Oxit cao nhất của R là RO 3 . Trong hợp chất của R với hiđro có %m R = 94,1176%.<br />
1. Tìm R? Viết công thức của hiđroxit cao nhất ứng với R?<br />
2. So sanh tính axit của hiđroxit trên với HClO 4 và H 2 SeO 4 ?<br />
ĐS: R là S<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 9: X, Y là hai nguyên tố thuộc một nhóm A và hai chu kì liên tiếp. X có 6e lớp ngoài cùng;<br />
hợp chất của X với hiđro %m H = 11,11%. Tìm X, Y?<br />
ĐS: X là oxi; Y là lưu huỳnh;<br />
Bài <strong>10</strong>: Hợp chất khí của nguyên tố X với H là XH 3 . %m X trong oxit cao nhất là 43,662%.<br />
1. Tìm X?<br />
2. Viết công thức của hiđroxit cao nhất và so s<strong>án</strong>h tính axit của nó với H 2 SO 4 ?<br />
+ Zn<br />
H2O O2 H2O<br />
3. Hoàn thành sơ đồ sau: X ⎯⎯⎯→ X1 ⎯⎯⎯→ + XH3 ⎯⎯⎯→ + X +<br />
2<br />
⎯⎯⎯→ X3<br />
ĐS: X là photpho.<br />
Bài 11: X là nguyên tố thuộc nhóm IIA. %m X trong oxit cao nhất = 60%.<br />
1. Tìm X? Nêu tính chất hóa học cơ bản của X?<br />
2. So s<strong>án</strong>h tính bazơ của: KOH; Ca(OH) 2 và hiđroxit của X?<br />
ĐS: X là Mg.<br />
Bài 12: Hợp chất khí của X với H là HX. %m X trong oxit cao nhất = 38,8%.<br />
1. Tìm X? 2. Nêu tính chất hóa học cơ bản của X?<br />
ĐS: X là Clo<br />
Bài tập tổng hợp<br />
Bài 1: Tỉ số %m của nguyên tố R trong oxit cao nhất và trong hợp chất khí với hiđro là 0,6994.<br />
Tìm R biết R là phi kim? ĐS: R là iot<br />
Bài 2: X, Y là hai nguyên tố thuộc nhóm A trong BTH. X có 2e lớp ngoài cùng; hợp chất của X<br />
với hiđro chứa %m X = 98,56%. Y có 7e hóa trị; B là hợp chất của Y với hiđro. Cho 200 gam dd B<br />
7,3% pư vừa đủ với 27,8 gam hợp chất của X với hiđro thu được khí D và dd E.<br />
1. Tìm X, Y, D?<br />
2. Tính C% của chất tan trong E?<br />
ĐS: X là bari; Y là clo; C% = 18,33%.<br />
Bài 3: Nguyên tố X có hóa trị cao nhất bằng hóa trị với hiđro. KLPT của oxit cao nhất bằng 1,875<br />
lần KLPT của hợp chất với hiđro. Tìm X?<br />
Bài 4: Hòa tan hết 6,9 gam kim loại kiềm X vào 93,4 gam nước thu được 3,36 lít hiđro ở đktc và<br />
dd Y.<br />
1. Tìm X? 2. Tính C% của chất tan trong Y?<br />
ĐS: X là Na<br />
Bài 5: Hợp chất M được tạo thành từ cation X + và anion Y - . Phân tử M có 9 nguyên tử của ba<br />
nguyên tố phi kim. Tỉ lệ số nguyên tử của 3 nguyên tố = 2:3:4. Tổng số proton trong M là 42. Trong<br />
Y - có hai nguyên tố thuộc chùng chu kì và hai nhóm A liên tiếp. Tìm M<br />
Bài 6: Hòa tan hết 46 gam hh Ba và hai kim loại kiềm liên tiếp thu được 11,2 lít hiđro ở đktc.Nếu<br />
cho 0,18 mol Na 2 SO 4 vào dd trên thì chưa kết tủa hết Ba 2+ còn nếu cho 0,21 mol Na 2 SO 4 vào thì<br />
còn dư Na 2 SO 4 . Tìm hai kim loại đã cho?ĐS: Na và K<br />
Bài 7: X, Y là hai nguyên tố thuộc nhóm A. X có hai e lớp ngoài cùng, P là hợp chất của X với<br />
hiđro có 4,76% khối lượng hiđro. Y có 7e lớp ngoài cùng. Gọi Q là hợp chất của Y với hiđro. Biết<br />
16,8 gam P pư vừa đủ với 200 gam dd Q 14,6% cho khí hiđro và dd Z.<br />
1. Tìm X, Y? 2. Tính C% chất tan trong Z?<br />
Bài 8: R là nguyên tố thuộc nhóm IIA. %KL của R trong oxit cao nhất bằng 71,43%.<br />
1. Tìm R?<br />
2. Cho 16 gam R pư với nước dư. Tính KL hiđroxit, thể tích khí thu được ở đktc?<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Chương 3: LIÊN KẾT HÓA HỌC<br />
Bài 1: LIÊN KẾT ION<br />
Ghi nhớ<br />
+ ĐN: Là liên kết hình thành do lực hút tĩnh điện giữa hai ion trái dấu.<br />
+ ĐK hình thành: KL điển hình(IA, IIA) với PK điển hình(VIA, VIIA)<br />
+ Sự hình thành qua hai giai đoạn:<br />
Gđ1: KL cho và PK nhận e<br />
Gđ2: Các ion hút nhau tạo thành liên kết.<br />
+ Qui tắc bát tử: Khi liên kết với nhau các nguyên tử có xu hướng đạt được cấu hình e<br />
bền vững giống khí hiếm với 8e lớp ngoài cùng(Riêng He là 2e)<br />
+ Cơ sở so s<strong>án</strong>h t 0 nc; độ bền và khả năng tan trong nước của hợp chất ion: Hai ion hút<br />
nhau càng mạnh thì càng khó tách ra do đó t 0 nc; độ bền càng cao; khả năng tan trong<br />
nước giảm. Vì vậy có hai yếu tố ảnh hưởng đến các yếu tố trên là:<br />
Điện tích ion: Khi điện tích của ion tăng thì t 0 nc; độ bền tăng; khả năng tan giảm<br />
B<strong>án</strong> kính ion: Khi R thì t 0 nc; độ bền giảm; khả năng tan .<br />
Bài 1: Tổng số hạt mang điện của A và B là 54 trong đó số hạt mang điện của A hơn của B là 22.<br />
1. Tìm A, B?<br />
2. Khi A liên kết với B thì A, B cho hay nhận e? Cho – nhận bao nhiêu e? Biểu diễn sự cho nhận<br />
đó? ĐS: A là Kali; B là Oxi.<br />
Bài 2: Cho ba nguyên tố X, Y, Z thuộc một chu kì; Y cách X hai ô; Z cách Y hai ô. Tổng số<br />
proton của X, Y, Z = 42.<br />
1. Tìm X, Y, Z biết P X < P Y < P Z .<br />
2. Trong ba nguyên tố X, Y, Z cặp nguyên tố nào tạo ra liên kết ion? Vì sao?<br />
3. Xác định trạng thái của các chất tạo nên từ các cặp nguyên tố trên?<br />
ĐS: X là natri; Y là silic và Z là clo.<br />
Bài 3: Cho 3 nguyên tố X, Y, Z có e cuối cùng ứng với số lượng tử như sau:<br />
n l m m s<br />
X 2 1 0 -1.2<br />
Y 3 0 0 +1.2<br />
Z 3 1 -1 -1.2<br />
1. Tìm X, Y, Z?<br />
2. Liên kết giữa hai nguyên tố nào trong ba nguyên tố trên thuộc loại liên kết ion?<br />
ĐS: X là flo; Y là natri; Z là lưu huỳnh.<br />
Bài 4: So s<strong>án</strong>h độ bền, t 0 nc và khả năng tan trong nước của KCl, KBr,KI.<br />
Giải<br />
+ Ta thấy các ion tạo nên ba chất đã cho có điện tích bằng nhau do đó khi so s<strong>án</strong>h ta chỉ cần xét<br />
b<strong>án</strong> kính ion.<br />
+ Vì b<strong>án</strong> kính của: I - > Br - > Cl - nên lực hút giữa các ion trong KI < KBr < KCl. Do đó:<br />
Độ bền và nhiệt độ nóng chảy của: KCl > KBr > KI<br />
Độ tan của: KCl < KBr < KI.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ Thật vậy thực nghiệm xác định được:<br />
KCl KBr KI<br />
T 0 nc: 770 0 C 734 0 C 681 0 C<br />
Độ tan: 34,3 65,2 144,5<br />
Bài 5: So s<strong>án</strong>h độ bền, t 0 nc và khả năng tan trong nước của các cặp chất sau:<br />
a) NaCl và KCl b) CsCl và NaCl c) NaI và LiF d/ NaCl và MgCl 2 e/ MgO và BaO<br />
Bài 6: X thuộc nhóm IA; Y thuộc nhóm IIA. So s<strong>án</strong>h nhiệt độ sôi và độ tan của XCl và YO.<br />
Bài 2: LIÊN KẾT CỘNG HÓA TRỊ<br />
Ghi nhớ<br />
+ ĐN: Là liên kết hình thành giữa hai nguyên tử bằng 1 hoặc nhiều cặp e chung<br />
+ ĐK hình thành: giữa hai phi kim<br />
+ Liên kết cho – nhận: Là liên kết cộng hóa trị đặc biệt mà đôi e chung do một phía cung<br />
cấp.<br />
+ Phân loại:<br />
Liên kết CHT không phân cực: 0 ≤ ∆X < 0,4<br />
Liên kết CHT phân cực: 0,4 ≤ ∆X < 1,7<br />
+ ∆X càng lớn thì độ phân cực của liên kết càng cao.<br />
Bài 1: Cho 4 nguyên tố X, Y, Z, T trong đó X, Y, Z là ba nguyên tố thuộc ba ô liên tiếp trong một<br />
chu kì. Tổng số proton của X, Y, Z = 21. Z và T là hai nguyên tố thuộc một nhóm A và hai chu kì<br />
liên tiếp.<br />
1. Tìm X, Y, Z, T biết P X nhỏ nhất?<br />
2. Liên kết giữa X, Y, Z, T với hiđro thuộc loại liên kết nào? Viết CT e và CTCT của hợp chất<br />
giữa X, Y, Z, T với hiđro.<br />
3. Viết CT e và CTCT của XZ 2 ; TZ 2 và XT 2 ?<br />
ĐS: X là cacbon; Y là nitơ; Z là oxi; T là lưu huỳnh.<br />
Bài 2: Tổng số hạt của hai nguyên tố X, Y là 98. X, Y thuộc một chu kì và cách nhau một ô. Số<br />
nơtron của B hơn A là 2. Số hạt mang điện của X hơn số hạt không mang điện của Y là 12.<br />
1. Tìm X, Y? 2. Viết công thức e; CTCT của XY 3 và XY 5 rồi cho nhận xét?<br />
ĐS: X là photpho; Y là clo.<br />
Bài 3: A, B, C có công thức lần lượt là C n H 2n+2 ; C n H 2n và C n H 2n-2 (n có giá trị như nhau trong ba<br />
chất). Tỉ khối của A so với hiđro là 15.<br />
1. Tìm A, B,C? 2. Viết CT e và CTCT của A, B,C? 3. Viết pư cháy của A, B, C?<br />
ĐS: A là etan; B là etilen; C là axetilen.<br />
Bài 4: Cho ba nguyên tố X, Y, Z trong đó:<br />
+ Z là nguyên tố tạo ra được ion Z 2- . Tổng số hạt trong Z 2- là 50.<br />
+ Y và Z thuộc hai ô liên tiếp trong một chu kì; độ âm điện của Y > Z.<br />
+ X tạo thành ion X + ; tổng số hạt trong X là 58.<br />
1. Tìm X, Y, Z? 2. Liên kết giữa X với Y; X với Z; Y với Z thuộc loại liên kết nào?<br />
3. Viết CT e và CTCT của ZY 2 và ZO 2 ?<br />
ĐS: X là kali; Y là clo và Z là lưu huỳnh.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 5: Cho ba nguyên tố A, B, C trong đó:<br />
+ A, B <strong>đề</strong>u có hai e độc thân ở TTCB<br />
+ Tổng số hạt trong A, B tương ứng là 18 và 24.<br />
+ B và C là hai nguyên tố thuộc một nhóm và hai chu kì liên tiếp<br />
1. Tìm A, B,C?<br />
2. Viết CT e; CTCT của AB; AB 2 và CB 2 ?<br />
ĐS: A là cacbon; B là oxi; C là lưu huỳnh.<br />
Phương pháp viết công thức electron<br />
+ Bước 1: Tính tổng số e hóa trị của phân tử hoặc ion.<br />
+ Bước 2: Xác định thứ tự liên kết.<br />
Xác định nguyên tử trung tâm: Là nguyên tử có độ âm điện thấp nhất(trừ hiđro)<br />
hoặc cần số e lớn nhất để đạt bão hòa. Nguyên tử trung tâm nằm ở giữa.<br />
Hiđro bao giờ cũng ở ngoài cùng xa nguyên tử trung tâm nhất: đầu hay cuối.<br />
Viết công thức e sơ bộ với giả thiết là giữa hai nguyên tử chỉ có một cặp e chung<br />
+ Bước 3: Tính tổng số e hóa trị còn lại = tổng số e – số e đã dùng.<br />
+ Bước 4: Lấy số e còn lại điền vào nguyên tử có độ âm điện max sao cho nguyên tử<br />
này đủ 8e, nếu còn dư e thì điền tất cả e còn lại vào nguyên tử trung tâm.<br />
+ Bước 5: Nếu nguyên tử trung tâm chưa đủ 8e thì phải chuyển các e không liên kết<br />
của nguyên tử có độ âm điện max thành đôi e dùng chung với nguyên tử trung tâm.<br />
Chú ý: CT electron phải nằm trong ngoặc [] n+ hoặc [] n- .<br />
+ TH đặc biệt là HClO x (x>1) thì nguyên tử trung tâm là clo.<br />
Bài 1: Viết CT e và CTCT của các chất và ion sau:<br />
HCN; CH 2 O; HNO 3 ; H 2 CO 3 ; H 2 SO 4 ; HNO 2 ; H 2 SO 3 ; HClO; HClO 2 ; HClO 3 ; HClO 4 ; H 3 O + ; NH + 4 ;<br />
SO 2- 4 , H 3 PO 4 ?<br />
Bài 2: X thuộc nhóm VIA; hợp chất của M với hiđro chứa 11,11% m H .<br />
1. Tìm X? Viết CT e, CTCT của M rồi cho biết liên kết trong M thuộc loại liên kết nào?<br />
2. Hợp chất Q chứa ba nguyên tố X, Y, Z trong đó:<br />
+ X và Y thuộc một nhóm và hai chu kì liên tiếp<br />
+ Y và Z thuộc hai ô liên tiếp trong một chu kì và P Z > P Y .<br />
a) Tìm Y, Z?<br />
b) Cho M Q = 135u trong Q có m X : m Y : m Z = 1:1:2,22. Tìm Q? Viết pư của Q với nước?<br />
c) Viết CT e, CTCT của Q và YX 2 ?<br />
ĐS: X là oxi; M là nước; Y là lưu huỳnh; Z là clo; Q là SO 2 Cl 2 với 2 liên kết cho nhận: S→O.<br />
Bài 3: Giải thích tại sao nitơ tương đối trơ ở nhiệt độ thường? Viết CTCT của NH 3 , HNO 3 ,<br />
NH 4 Cl?<br />
Bài 4: X, Y là hai nguyên tố thuộc cùng một nhóm A và hai chu kì liên tiếp. Y và Z là hai nguyên<br />
liên tiếp trong một chu kì. X có 6e lớp ngoài cùng, hợp chất của X với hiđro chứa 11,11%m H .<br />
Hợp chất M có công thức XZ 2 trong đó các nguyên tố <strong>đề</strong>u thỏa mãn qui tắc bát tử. Tìm M?<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Viết CTCT và xác định loại liên kết trong hợp chất<br />
+ Cách 1(tương đối): Dựa vào loại nguyên tố<br />
Liên kết ion: KL điển hình- phi kim điển hình<br />
Liên kết CHT phân cực: hai phi kim khác nhau; KL yếu – phi kim<br />
Liên kết CHT không phân cực: hai phi kim giống nhau.<br />
+ Cách 2: Dựa vào ∆X<br />
Liên kết ion: ∆X ≥ 1,7<br />
Liên kết CHT phân cực: 0,4 ≤ ∆X < 1,7<br />
Liên kết CHT không phân cực: 0 ≤ ∆X < 0,4 .<br />
+ Để biết độ phân cực (độ lệch của đôi e chung)của một liên kết ta phải dựa<br />
vào hiệu độ âm điện. Nếu ∆X càng lớn thì liên kết càng phân cực và ngược<br />
lại<br />
+ Trong một hợp chất có 2 nguyên tố thì thường chỉ có 1 loại liên kết, với<br />
hợp chất có > 2 nguyên tố thường có nhiều liên kết. Liên kết cho – nhận<br />
thường có trong SO 2 ; SO 3 ; SO 2- 4 ; NO 2 ; NO - 3 ; CO; NH + 4 .<br />
Cách viết CTCT:<br />
Viết công thức của hiđroxit: các hiđroxit thường viết được dưới dạng (HO) n XO m .<br />
Nếu có liên kết cho – nhận thì có thể thay bằng liên kết đôi.<br />
+<br />
NH 4 là liên kết ion<br />
Bài 1: Cho các chất: LiF; K 2 O; N 2 O; NH 3 ; Cl 2 ; N 2 ; HCl;H 2 O; Cs 2 O; CH 4 .<br />
1. Dựa vào độ âm điện hãy xác định loại liên kết trong mỗi chất.<br />
2. Chất nào là chất rắn? Lỏng? Khí? Sắp xếp các chất trên theo chiều tăng dần độ phân cực?<br />
Giải<br />
1. LiF = 3,98 – 0,98 = 3,0 Liên kết ion<br />
K2O = 3,44 – 0,82 = 2,62 liên kết ion<br />
N2O = 3,44 – 3,04 = 0,4 liên kết CHT phân cực<br />
NH3 = 3,04 – 2,2 = 0,84 liên kết CHT phân cực<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Cl2 = 3,16 – 3,16 = 0,0 liên kết CHT không phân cực<br />
N2 = 3,04 – 3,04 = 0,0 liên kết CHT không phân cực<br />
HCl = 3,16 – 2,2 = 0,96 liên kết CHT phân cực<br />
H2O = 3,44 – 2,2 = 1,24 liên kết CHT phân cực<br />
Cs2O = 3,44 – 0,79 = 2,65 liên kết ion<br />
CH4 = 2,55 – 2,2 = 0,35 liên kết CHT không phân cực<br />
2. Chất rắn gồm: LiF; K 2 O; Cs 2 O; chất lỏng gồm H 2 O; chất khí gồm: N 2 O, NH 3 , Cl 2 , N 2 , HCl,<br />
CH 4 .<br />
+ Độ phân cực trong:<br />
N 2 = Cl 2 < CH 4 < N 2 O < NH 3 < HCl < H 2 O < K 2 O < Cs 2 O < LiF.<br />
Bài 2: Cho các chất sau: H 2 O 2 ; Mg(NO 3 ) 2 ; Ca(OH) 2 ; NH 4 NO 3 ; NH 3 ; AgF; SO 2 . Chỉ rõ các loại<br />
liên kết trong mỗi chất.<br />
Bài 3: Hiđro peoxit (nước oxi già) được dùng để rẳ vết thương. Hiđro peoxit là hợp chất của<br />
hiđro và oxi với số nguyên tử H = O.<br />
1. Tìm CTPT của hiđro peoxit biết tỉ khối hơi của hiđro peoxit có tỉ khối hơi so với hiđro là 17?<br />
2. Viết CTe, CTCT của hiđro peoxit có những loại liên kết nào?<br />
Bài 4: Dựa vào độ âm điện hãy sắp xếp theo chiều tăng độ phân cực của liên kết giữa hai nguyên<br />
tử trong phân tử các chất sau biết rằng độ phân cực tỉ lệ thuận với hiệu độ âm điện: CaO; MgO;<br />
AlN; N 2 ; NaBr; BCl 3 ; AlCl 3 ; CH 4 . Phân tử nào chứa liên kết CHT phân cực, không phân cực,<br />
ion?<br />
BÀI TẬP XÁC ĐỊNH DẠNG HÌNH HỌC VÀ KIỂU LAI HÓA<br />
I/ Phương pháp xác định.<br />
1. Đặt vấn <strong>đề</strong>.<br />
Tại sao CO 2 và SO 2 có dạng tương tự nhau nhưng CO 2 có dạng thẳng và SO 2 có dạng chữ V<br />
ngược như sau:<br />
O C O<br />
2. Nguyên tử trung tâm và phối tử của một phân tử.<br />
+ Nguyên tử trung tâm: Trong phân tử nhiều nguyên tử thì nguyên tử trung tâm là nguyên tử cần<br />
nhiều e nhất để đạt bão hòa. Nếu có hai nguyên tử cần số e như nhau thì nguyên tử trung tâm là<br />
nguyên tử có độ âm điện nhỏ hơn.<br />
+ VD:<br />
NH 3 có nguyên tử trung tâm là N<br />
H 2 O có nguyên tử trung tâm là O<br />
SO 2 có nguyên tử trung tâm là S(vì độ âm điện của S nhỏ hơn)<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
O<br />
S<br />
O<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ Phối tử: là nguyên tử còn lại trong phân tử và đôi e tự do của nguyên tử trung tâm(nếu có)<br />
+ Kí hiệu:<br />
Nguyên tử trung tâm: A<br />
Phối tử là nguyên tử: X<br />
Phối tử là e tự do của nguyên tử trung tâm: E<br />
3. Kí hiệu phân tử.<br />
Một phân tử hợp chất cộng hóa trị bất kì <strong>đề</strong>u được kí hiệu là AX n E m . Trong đó:<br />
A: Nguyên tử trung tâm.<br />
X: Phối tử là nguyên tử.<br />
E: Phối tử là e tự do của nguyên tử trung tâm.<br />
n: số nguyên tử X<br />
m: số cặp e tự do.<br />
+ VD1: trong NH 3 thì A là N; X là H; E là đôi e tự do; n = 3 và m = 1 NH 3 được kí hiệu là<br />
AX 3 E. (ta chỉ cần tìm n và m)<br />
+ VD2: trong H 2 O thì A là O; X là H; E là đôi e tự do; n = 2 và m = 2 H 2 O được kí hiệu là<br />
AX 2 E 2 .<br />
+ BT: Viết kí hiệu của các phân tử sau: SO 2 ; CH 4 ; SF 4 ; CO 2 ?<br />
ĐS: AX 2 E; AX 4 E 0 ; AX 4 E; AX 2 E 0 .(E 0 thì không cần thiết phải viết)<br />
4/ Xác định dạng hình học của phân tử.<br />
a) Cơ sở: “Trong phân tử X và E được sắp xếp xung quanh A sao cho khoảng cách giữa chúng<br />
là xa nhau nhất tức là đẩy nhau ít nhất”<br />
b) Vận dụng vào các trường hợp cụ thể.<br />
Tổng (n+m) Mô tả dạng hình học Hình dạng<br />
2 A, X, E nằm trên đường thẳng trong đó<br />
Thẳng<br />
A nằm giữa<br />
3 X và E nằm ở đỉnh của tam giác <strong>đề</strong>u; Tam giác <strong>đề</strong>u<br />
A nằm ở tâm tam giác<br />
4 X và E nằm ở đỉnh của tứ diện <strong>đề</strong>u; A<br />
Tứ diện<br />
nằm ở tâm tứ diện<br />
5 X và E nằm ở các đỉnh của hai hình Lưỡng tháp tam giác<br />
chóp tam giác chung đáy; A nằm ở tâm<br />
6 X, E nằm ở đỉnh của hình bát diện; A<br />
nằm ở tâm.<br />
Bát diện<br />
Bài tập:<br />
Bài 1: Cho ba nguyên tố X, Y, Z trong đó:<br />
+ X và Y là hai nguyên tố thuộc hai chu kì liên tiếp và thuộc một nhóm. Tổng số proton của X và<br />
Y là 26(P X < P Y ).<br />
+ Z và X thuộc cùng một chu kì và cách nhau hai ô.<br />
1. Tìm X, Y, Z?<br />
2. Xác định dạng hình học(có vẽ hình) của ZH 4 ; AlY 3 ; BeX 2 ; PY 5 và SX 6 .<br />
ĐS: X = flo; Y = clo; Z = cacbon; ZH 4 = tứ diện; AlY 3 = tam giác; BeX 2 = thẳng; PY 5 = lưỡng<br />
tháp tam giác; SX 6 = bát diện<br />
Ghi chú: Trong trường hợp có E khi xét dạng hình học thì ta sẽ xác định hình chính xác sau đó<br />
loại bỏ E ra khỏi hình đã xác định phần còn lại là hình cần tìm.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 2: Cho hai chất khí H 2 X và XO 2 trong đó H 2 X có tỉ khối so với hiđro là 17.<br />
1. Tìm hai chất đã cho?<br />
2. Viết công thức electron và xác định dạng hình học của chúng?<br />
3. Y và X thuộc cùng một nhóm và hai chu kì liên tiếp. Xác định dạng hình học của H 2 Y?<br />
ĐS: H 2 X = H 2 S; XO 2 = SO 2 . Cả H 2 S và SO 2 <strong>đề</strong>u có dạng chữ V ngược (hay gấp khúc)<br />
Bài 3: Cho hai chất XH 3 ; YCl 3 trong đó tỉ khối của XH 3 so với hiđro sunfua bằng 0,5. Tổng số<br />
hạt của X là 16.<br />
1. Tìm X, Y?<br />
2. Viết công thức e và xác định dạng hình học của các chất trên?<br />
ĐS: XH 3 = NH 3 = tứ diện không <strong>đề</strong>u (ba hiđro ở ba đỉnh; nitơ ở đỉnh còn lại); YCl 3 = BCl 3 =<br />
dạng tam giác<br />
Bài 4: Cho hai chất XH 3 ; HXO 3 và ion NH 4<br />
+<br />
trong đó tổng số hạt của X là 21.<br />
1. Tìm X? Viết CTCT của chất và ion trên?<br />
2. Y và X thuộc cùng một nhóm và hai chu kì liên tiếp. Xác định dạng hình học của YH 3 ; XH 4 + ;<br />
YCl 3 ?<br />
Chú ý: Trong trường hợp m ≠ 0 thì góc liên kết sẽ nhỏ hơn giá trị chuẩn vì đám mây e không liên<br />
kết chiếm vùng không gian lớn hơn sẽ làm dịch chuyển đám mây e của liên kết dịch lại gần nhau<br />
hơn.<br />
Bài 5: Giải thích tại sao góc HOH = <strong>10</strong>4,5 0 trong nước < HNH = <strong>10</strong>7 0 trong NH 3 < <strong>10</strong>9 0 28’?<br />
HSH = 92 0 15 ’ < HOH?<br />
Bài 6: Cho biết dạng hình học và so s<strong>án</strong>h góc liên kết của các phân tử sau:<br />
1. F 2 O; NH 3 ; BF 3 . 2. PH 3 ; PCl 3 ; PF 3 .<br />
XÁC ĐỊNH TRẠNG THÁI LAI HÓA CỦA NGUYÊN TỬ TRUNG TÂM<br />
I/ Khái niệm<br />
+ Lai hóa là sự tổ hợp n các obitan khác nhau để tạo ra n obitan giống nhau nhưng định hướng<br />
khác nhau trong không gian.<br />
+ Có 6 kiểu lai hóa cơ bản sau:<br />
sp sp 2 sp 3 sp 3 d sp 3 d 2<br />
gọi là lai hóa: thẳng tam giác tứ diện<br />
+ Các bước xác định kiểu lai hóa của nguyên tử trung tâm:<br />
Bước Nội dung VD với SO 2 VD với H 2 O<br />
1 Chuyển chất cần xác định về dạng AX n E m SO 2 có dạng<br />
AX 2 E<br />
H 2 O có dạng<br />
AX 2 E 2<br />
2<br />
Tính tổng (n+m) để xác định kiểu lai hóa theo<br />
qui ước sau:<br />
(m+n) = 3 S<br />
có kiểu lai hóa<br />
(m+n) = 4 O<br />
có kiểu lai hóa<br />
(n+m): 2 3 4 5 6<br />
sp 2 .<br />
sp 3 .<br />
Kểu lai hóa: sp sp 2 sp 3 sp 3 d sp 3 d 2<br />
Vì bằng : 1+1 1+2 1+3 1+3+1 1+3+2<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
II/ Bài tập.<br />
Bài 1: Xác định kiểu lai hóa của các nguyên tử trung tâm trong: metan; cacbonic; sunfurơ; nước;<br />
amoniac; photpho pentaclorua; lưu huỳnh hexaflorua; bo triflorua; clo triflorua.<br />
Chất Ngtử trung tâm Dạng Tổng (n+m) TT lai hóa<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
CH4 C AX4 4 sp 3<br />
CO2 C AX2 2 sp<br />
SO2 S AX2E 3 sp 2<br />
H2O O AX2E2 4 Sp 3<br />
NH3 N AX3E 4 Sp 3<br />
PCl5 P AX5 5 sp 3 d<br />
SF6 S AX6 6 sp 3 d 2<br />
BF3 B AX3 3 sp 2<br />
ClF3 Cl AX3E2 5 sp 3 d<br />
Bài 2: A, B thuộc một nhóm và hai chu kì nhỏ liên tiếp, tổng số proton của chúng bằng 24.<br />
1. Tìm A, B biết Z A < Z B ?<br />
2. Cho biết dạng hình học và kiểu lai hóa của nguyên tử trung tâm trong H 2 A; BCl 2 ; BA 2 ; BA 3 ?<br />
Bài 3: Cho hai chất khí H 2 A và BH 3 có KLPT bằng nhau. A là nguyên tố mà e cuối cùng có n =<br />
3; l = 1; m = -1; m s = -1.2. 1. Tìm H 2 A; BH 3 ?<br />
2. Xác định hình dạng của H 2 A; BH 3 và kiểu lai hóa của A, B trong hai chất trên?<br />
Bài 4: Cho 5 nguyên tố A, B, C, D, E trong đó:<br />
+ A, B, C là ba nguyên tố thuộc ba ô liên tiếp trong một chu kì có tổng số e = 48.<br />
+ A và E; C và D cùng một nhóm<br />
1. Tìm A, B, C, D, E biết Z của E < D < A < B < C.<br />
2. Xác định dạng hình học và kiểu lai hóa của nguyên tử trung tâm trong BD 6 ; AC 5 ; AC 3 ; EH 3 ?<br />
Bài 5:Cho 3 nguyên tố X, Y, Z được xác định như sau: Nguyên tử X mất 1 electron thu được<br />
proton. Nguyên tử Y có tổng điện tích hạt nhân là +9,6.<strong>10</strong> -19 (C). Tổng số hạt trong Z bằng 24.<br />
a) Tìm tên X, Y, Z.<br />
b) Xác định trạng thái lai hóa của nguyên tử trung tâm trong các phân tử X 4 Y 2 , YZ 2 , X 2 Z, YX 4 và<br />
cho biết hình dạng của chúng.<br />
Chương 4: PHẢN ỨNG HÓA HỌC<br />
Chuyên <strong>đề</strong>: Xác định số oxi hóa và hóa trị<br />
I/ Các qui tắc:<br />
+ Số oxi hóa của đơn chất = 0<br />
+ Trong một phân tử tổng số oxi hóa của các nguyên tố = 0<br />
+ Trong hợp chất số oxi hóa của O = -2; H = +1(trừ peoxit và hiđrua)<br />
+ Số oxi hóa của ion đơn = điện tích của ion<br />
+ Tổng số oxi hóa của các nguyên tố trong ion đa nguyên tử = điện tích của ion<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
II/ Bài tập<br />
Bài 1: Tính số oxi hóa trong hợp chất có H, O<br />
+ Tính số oxi hóa của N trong: N 2 ; NH 3 ; NO; NO 2 ; N 2 O 5 ; HNO 3 ; N 2 H 4 ; HNO 2 .<br />
+ Tính số oxi hóa của S trong: S, H 2 S, SO 3 ; SO 2 ; H 2 SO 3 ; H 2 SO 4 .<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ Tính số oxi hóa của P trong: PH 3 ; H 3 PO 3 ; H 3 PO 4 ; H 3 PO 2 ; HPO 3 .<br />
+ Tính số oxi hóa của Mn trong: MnO 2 ; HMnO 4 ; H 2 MnO 4 .<br />
+ Tính số oxi hóa của Fe trong: FeO; Fe 2 O 3 ; Fe 3 O 4 ; Fe(OH) 2 ; Fe(OH) 3 .<br />
+ Tính số oxi hóa của Cl trong: HCl; HClO 4 ; HClO 3 ; HClO; Cl 2 O 7 .<br />
Bài 2: Tính số oxi hóa của ion:<br />
+ Tính số oxi hóa của nitơ trong: NO - 3 ; NO - 2 ; NH + 4 .<br />
+ Tính số oxi hóa của S trong: S 2- ; SO 2- 3 ; SO 2- 4 ; HSO - 3 .<br />
+ Tính số oxi hóa của P trong: P 3- ; PO 3- 4 ; HPO 2- 3 ; H 2 PO - 4 .<br />
+ Tính số oxi hóa của Cl trong: Cl - ; ClO - 4 ; ClO - 3 ; ClO - 2 .<br />
Bài 3: Tính số oxi hóa của các kim loại trong các chất sau và cho nhận xét?<br />
a) NaOH, Na 2 O; KOH, Li 2 O.<br />
b) CaO; Mg(OH) 2 ; Ba(OH) 2 ; MgO.<br />
c) Al 2 O 3 ; Al(OH) 3 .<br />
NX:<br />
+ Kim loại luôn có số oxi hóa dương<br />
+ Số oxi hóa của kim loại trong nhóm A = STT nhóm = hóa trị Kim loại nhóm IA, IIA, IIIA có<br />
số oxi hóa tương ứng là +1; +2; +3 không cần tính số oxi hóa của các kim loại trong các hợp<br />
chất mà công nhận ngay = hóa trị của kim loại đó.<br />
Bài 4: Tính số oxi hóa của N, S, P trong:<br />
a) K 2 SO 4 ; NaHSO 3 ; MgSO 4 ; Al 2 (SO 4 ) 3 ; K 2 S; .<br />
b) K 3 P; KH 2 PO 4 ; Na 3 PO 4 , Ca 3 (PO 4 ) 2 ; KH 2 PO 4 ; K 2 HPO 3 .<br />
c) AlN; Ca(NO 3 ) 2 ; KNO 2 ; Al(NO 3 ) 3 ; Fe(NO 3 ) 2 .<br />
Bài 5: Tính số oxi hóa của S, N, Cl trong các chất sau và cho nhận xét?<br />
a) H 2 S và H 2 SO 4 . b) NH 3 và HNO 3 . c) KCl và HClO 4 .<br />
NX:<br />
+ Số oxi hóa của phi kim có thể âm hoặc dương.<br />
+ Số oxi hóa max = STT nhóm<br />
+ Số oxi hóa max – số oxi hóa âm (min ) = 8.<br />
Bài 6: X là nguyên tố có tổng số proton và nơtron < 35. Tổng số oxi hóa max và 2 lần số oxi hóa<br />
âm = -1.<br />
1. Tìm X biết X là chất rắn ở đkt?<br />
2. Xác định số oxi hóa của X trong HXO 3 ; H 3 XO 4 ; H 4 X 2 O 7 . Viết pư của chúng với NaOH rồi cho<br />
nhận xét?<br />
Ghi chú: Phương pháp tìm số oxi hóa của 1 nguyên tố.<br />
+ Với kim loại số oxi hóa dương và = hóa trị.<br />
+ Với phi kim số oxi hóa âm = số e nhận đạt bão hòa, số oxi hóa dương = số e độc thân ở trạng<br />
thái cơ bản hoặc kích thích(chỉ e hóa trị mới bị kích thích)<br />
+ VD: Số oxi hóa của Clo = -1; 0; +1; +3; +5; +7.<br />
Bài 7: 1. Dựa vào cấu hình e lớp ngoài cùng của clo hãy xác định số oxi hóa của clo?<br />
2. Tính số oxi hóa của clo trong các chất sau để minh họa: HCl; NaClO; KClO 3 ; Ba(ClO 4 ) 2 ;<br />
HClO 2 .<br />
Bài 8: 1. Hãy xác định số oxi hóa của P và S?<br />
2. Tính số oxi hóa của P và S trong: Ca(H 2 PO 4 ) 2 ; Ba(HSO 3 ) 2 ; Na 2 S; Ca 3 P 2 ; KHSO 4 ?<br />
Bài 9: Xác định hóa trị và số oxi hóa của các nguyên tố trong các chất sau: Al 2 O 3 ; NH 3 ; CaO;<br />
CH 4 ; CO 2 ; Na 2 O; KF; CaCl 2 .<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Chú ý: Số oxi hóa của một số nguyên tố chỉ được xác định dựa vào CTCT. VD: CaOCl 2 ; C 3 H 6 …<br />
Bài <strong>10</strong>: Tính số oxi hóa của các nguyên tố trong các chất sau bằng cách ghi số oxi hóa phía trên<br />
CTCT: H 2 O 2 ; H 2 ; FeS 2 ; CaH 2 ; C 3 H 8 ; C 2 H 5 OH; OF 2 ; Na 2 O 2 ?<br />
Bài 11: Xác định số oxi hóa trung bình của cacbon trong các chất sau: etilen; propen; axetilen;<br />
benzen; etanol; glucozơ? Viết CTCT và xác định số oxi hóa của mỗi nguyên tử cacbon riêng rẽ?<br />
Bài 12: Xác định số oxi hóa của các nguyên tố Cl, N, Mn, C trong các chất sau:<br />
a. HCl, Cl 2 , HClO, HClO 2 , HClO 3 , HClO 4<br />
b. NH 3 , N 2 , N 2 O, NO, N 2 O 3 , NO 2 , N 2 O 5<br />
c. KMnO 4 , K 2 MnO 4 , MnO 2 , MnSO 4 , Mn<br />
d. C, CO 2 , Na 2 CO 3 , CO, Al 4 C 3 , CaC 2 , CH 2 O<br />
Hãy nhận xét về số oxi hóa của một nguyên tố?<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Chuyên <strong>đề</strong>: CÂN BẰNG PƯ THEO PHƯƠNG PHÁP THĂNG BẰNG ELECTRON<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 1: Cân bằng pư oxi hóa – khử thông thường.<br />
Ví dụ:<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
1. S + HNO 3 → H 2 SO 4 + NO 2 + H 2 O<br />
2. P + HNO 3 + H 2 O → H 3 PO 4 + NO.<br />
3. 3Na 2 SO 3 + 2KMnO 4 + H 2 O → 3Na 2 SO 4 + 2KOH + 2MnO 2 .<br />
4/ HNO 3 + H 2 S → NO + S + H 2 O<br />
5/ HClO3 + H2S → HCl + H2SO4<br />
6/ SO2 + KClO4 + H2O → KCl + H2SO4<br />
Bài tập:<br />
1. 3Cu + 8HCl + 2NaNO 3 → 3CuCl 2 + 2NO + 2NaCl + 4H 2 O<br />
2. CrCl 3 + NaOH + NaClO → Na 2 CrO 4 + NaCl + H 2 O<br />
3. K 2 S + KMnO 4 + H 2 SO 4 → K 2 SO 4 + + MnSO 4 + S + H 2 O<br />
4/ 8Al + 5NaOH + 3NaNO 3 + 2H 2 O → 8NaAlO 2 + 3NH 3 .<br />
5/ 4Zn + 7NaOH + NaNO 3 → 4Na 2 ZnO 2 + NH 3 + 2H 2 O<br />
6/ K 2 SO 3 + KMnO 4 + H 2 SO 4 → K 2 SO 4 + MnSO 4 + H 2 O<br />
7/ C + HNO 3 → CO2 + NO + H2O<br />
8/ P + H2SO4 → H3PO4 + SO2 + H2O<br />
9/ PH 3 + KMnO 4 + H 2 SO 4 → H 3 PO 4 + K 2 SO 4 + MnSO 4 + H 2 O<br />
Bài 2: Cân bằng pư có hệ số khác 1<br />
VD1: Fe 3 O 4 + CO → Fe + CO 2 .<br />
VD2: C 12 H 22 O 11 + H 2 SO 4 → CO 2 + SO 2 + H 2 O<br />
VD3: CrCl 3 + Br 2 + NaOH → Na 2 CrO 4 + NaBr + NaCl + H 2 O<br />
VD4: PH 3 + O 2 → P 2 O 5 + H 2 O<br />
Bài tập:<br />
1. Fe 2 O 3 + CO → Fe + CO 2 2. Al + Fe 3 O 4 → Al 2 O 3 + Fe<br />
3. C 6 H 12 O 6 + H 2 SO 4 → 4/ Cl 2 + H 2 S + H 2 O →<br />
5/ CrCl 3 + Br 2 + NaOH → Na 2 CrO 4 + NaBr + NaCl + H 2 O<br />
6/ NH 3 + O 2 → NO + H 2 O 7/ H 2 S + O 2 →<br />
8/ SO 2 + Br 2 + H 2 O → 9/ NO + K 2 Cr 2 O 7 + H 2 SO 4 → HNO 3 +…<br />
<strong>10</strong>/ H 2 SO 4 + HI → H 2 S + I 2 + H 2 O 11. H 2 S + Cl 2 + H 2 O →<br />
12. C 12 H 22 O 11 + H 2 SO 4 đặc → 13. C 12 H 22 O 11 + 16HNO 3 → 12CO 2 + 16NO + 19H 2 O<br />
Bài 3: Cân bằng pư có chất oxi hóa làm môi trường sau đó tính tỉ lệ giữa số mol axit làm chất oxi<br />
hóa và số mol axit làm môi trường.<br />
1. Fe + HNO 3 loãng → 2. Cu + HNO 3 loãng →<br />
3. Mg + HNO 3 loãng → N 2 +… 4/ FeCO 3 + HNO 3 loãng →<br />
5/ Fe 3 O 4 + HNO 3 loãng → 6/ Cu + H 2 SO 4 đặc →<br />
7/ Al + H 2 SO 4 đặc → 8/ Mg+ H 2 SO 4 đặc → H 2 S<br />
9/ Fe 3 O 4 + H 2 SO 4 đặc → <strong>10</strong>/ FeO + + H 2 SO 4 đặc →<br />
11. FeCO 3 + H 2 SO 4 đặc → 12. Zn + + HNO 3 loãng → N 2 O<br />
13. Mg + HNO 3 loãng → NH 4 NO 3 +… 14/ MnO 2 + HCl →<br />
15/ KMnO 4 + HCl → 16/ K 2 Cr 2 O 7 + HCl →<br />
Bài 4: Cân bằng pư có hệ số bằng chữ<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
1. Fe x O y + HNO 3 đặc → 2. Fe x O y + HNO 3 loãng →<br />
3. Fe x O y + H 2 SO 4 đặc → 4/ Al + HNO 3 → N x O y +…<br />
5/ M + HNO 3 → NO + … 6/ M2(CO3)n + HNO3 đặc →<br />
7/ FeO + HNO 3 → N x O y +… 8/ Fe 3 O 4 + HNO 3 → N x O y +…<br />
9/ M + HNO 3 → N x O y +… <strong>10</strong>/ M + HNO 3 → N 2 +…<br />
11. M 2 O x + HNO 3 → M(NO 3 ) 3 + NO<br />
Bài 5: Cân bằng pư có hai chất khử<br />
Chú ý: khi có hai chất khử trong cùng một chất thì ta viết gộp chung lại. VD<br />
FeS 2 → Fe +3 + 2S +6 + 15e<br />
1. FeS 2 + O 2 → 2. FeS2 + HNO3 đặc →<br />
3. FeS2 + HNO3 loãng → 4/ CuS + HNO3 đặc →<br />
5/ CuS + HNO3 loãng → 6/ FeS + HNO3 đặc →<br />
7/ FeS + HNO 3 loãng → 8/ FeS + KNO 3 → Fe 2 O 3 +<br />
9/ Cr2S3 + Mn(NO3)2 + K2CO3 → K2CrO4 + K2MnO4 + CO2 + NO + K2SO4.<br />
<strong>10</strong>/ As2S3 + HNO3 → H3AsO4 + NO2 + H2O + H2SO4.<br />
11. As2S3 + HNO3 loãng →<br />
12. CuFeS2 + Fe2(SO4)3 + O2 + H2O → FeSO4 + CuSO4 + H2SO4.<br />
13. FeS2 + HNO3 → N2Ox + …<br />
Bài 6: Cân bằng pư có 1 nguyên tố tăng hay giảm số oxi hóa ở nhiều mức<br />
1. Al + HNO3 → NO + NO2 + … với số mol NO : NO2 = 3:5<br />
2. Al + HNO3 → NO + NO2 + … với số mol NO : NO2 = x:y<br />
3. Fe + HNO3 → NO + NO2 + … với số mol NO : NO2 = a:b<br />
4/ Cho Al pư với HNO3 tạo ra hh khí X gồm NO và NO2. Viết pư xảy ra trong hai trường hợp:<br />
a. dX/H2 = 19 b. dX/H2 = 21<br />
Bài 7: Cân bằng pư oxi hóa – khử của chất hữu cơ.<br />
1. C2H4 + KMnO4 + H2O → 2. C2H5OH + KMnO4 + H2O → CH3COOH<br />
3. C6H5-CH3 + KMnO4 + H2O → 4/ C3H8 + O2 →<br />
Bài 8: Cân bằng pư theo phương pháp đại số<br />
Các bước cân bằng:<br />
Đặt a, b, c, d, … là hệ số các chất cần cân bằng<br />
Lập hệ dựa vào ĐLBT nguyên tố<br />
Giải hệ trên bằng cách cho 1 ẩn bất kì một giá trị sau đó giải các ẩn còn lại<br />
1. FeS2 + O2 → 2. Cu + HNO3 → NO + …<br />
3. FeS2 + HNO3 đặc → 4/ MnO 2 + HCl →<br />
Bài 9: Cân bằng pư oxi hóa - khử đặc biệt<br />
1. KOH + Cl2 → KClO3 + KCl + H2O 2. KClO3 → KCl + KClO4<br />
3. NO2 + H2O → HNO3 + NO 4. NO2 + NaOH → NaNO3 + NaNO2 + H2O<br />
5. HNO2 → HNO3 + NO + H2O 6. S + NaOH → Na2SO4 + Na2S + H2O<br />
7. Br2 + NaOH → NaBr + NaBrO3 + H2O 8. K2MnO4 + H2O → MnO2 + KMnO4 + KOH<br />
9. NaNO3 → NaNO2 + O2 <strong>10</strong>. KClO3 → KCl + O2<br />
11. NH4NO2 → N2 + H2O<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
DỰ ĐOÁN SẢN PHẨM CỦA PHẢN ỨNG OXI HÓA – KHỬ<br />
A) Phương pháp dự đo<strong>án</strong><br />
1. Xác định chất oxi hóa và chất khử khi chưa biết sản phẩm.<br />
+ Nếu một chất chứa nguyên tố có số oxi hóa lớn nhất thì trong pư số oxi hóa của nguyên tố đó chỉ có thể<br />
giảm tức là nó chỉ có tính oxi hóa.<br />
VD: HNO3; H2SO4; KMnO4; K2Cr2O7, F2, Fe 3+ .<br />
+ Nếu một chất chứa nguyên tố có số oxi hóa nhỏ nhất thì trong pư số oxi hóa của nó chỉ có thể tăng tức<br />
là nó chỉ có tính khử<br />
VD: Kim loại, NH3, H2S, HI, HCl…<br />
+ Nếu một chất có số oxi hóa trung gian thì có thể là chất oxi hóa có thể là chất khử phụ thuộc vào chất<br />
pư với nó tức là chất đó vừa có tính oxi hóa vừa có tính khử.<br />
VD: SO2; S; Br2, Fe 2+ , H2O2….<br />
BT: Cho các chất và ion sau: Zn; Cl2; FeO; Fe2O3; SO2; Fe 2+ ; Cu 2+ ; Ag + . Hãy cho biết có bao nhiêu phân tử<br />
và ion<br />
a. Có tính oxi hóa? b. Có tính khử? c. Vừa có tính oxi hóa vừa có tính khử?<br />
2. Phương pháp dự đo<strong>án</strong>:<br />
+ Trong một pư oxi hóa – khử bao giờ cũng có chất tăng và chất giảm số oxi hóa. Nếu không có chất tăng<br />
thì không có chất giảm.<br />
+ Dự đo<strong>án</strong> mức tăng giảm để viết chất phù hợp từ đó viết các sản phẩm phụ khác.<br />
VD1:<br />
FeO + HNO3 → NO + ….<br />
Fe2O3 + HNO3 →<br />
VD2: Hoàn thành các pư sau:<br />
1) H 2 S + SO 2 → ... + H 2 O 2) S + H 2 SO 4 → ….+ H 2 O<br />
3) FeCl 3 + Cu → FeCl 2 + … 4) FeCl 3 + H 2 S → S + …<br />
5) FeSO 4 + KMnO 4 + H 2 SO 4 → MnSO 4 + … 6) SO 2 + H 2 O + Br 2 → H 2 SO 4 + ...<br />
7) M2On + HNO3 → NO + …<br />
3. Giới thiệu một số chất oxi hóa thông dụng<br />
a) Kali pemanganat = KMnO4 = thuốc tím.<br />
+ Trong MT axit thì Mn +7 → Mn +2 :<br />
KMnO4 + H + (H2SO4) + …→ K + (K2SO4) + Mn 2+ (MnSO4) + H2O+ …<br />
+ Trong MT trung tính thì Mn +7 → Mn +4 : KMnO4 + H2O + …→ KOH + MnO2 nâu đen + …<br />
+ Trong MT bazơ thì Mn +7 → Mn +6 : KMnO4 + OH - + …→ K2MnO4 kali manganat + H2O+…<br />
b) Kali đicromat = K2Cr2O7.<br />
+ Trong MT axit thì Cr +6 → Cr +3 : K2Cr2O7 + H + + …→ K + + Cr 3+ + H2O+ …<br />
+ Trong MT trung tính thì Cr +6 → Cr +3 : K2Cr2O7 + H2O + …→ KOH + Cr(OH)3 xanh rêu + …<br />
c) HNO3 và H2SO4 đặc: Có tính oxi hóa mạnh khi pư với chất khử thì tạo ra sản phẩm ứng với số oxi hóa<br />
cao nhất. Khi HNO3 đặc thì cho NO2; loãng thì thường cho NO, có thể có N2, N2O..<br />
B) Bài tập<br />
Bài 0: Viết các phương trình phản ứng oxi hóa - khử sau theo phương pháp thăng bằng electron:<br />
1) H 2 S + SO 2 → ... + H 2 O<br />
2) Al + HNO 3 (loãng) → ... + NO + H 2 O<br />
3) SO 2 + H 2 O + Br 2 → H 2 SO 4 + ...<br />
4) FeSO 4 + HNO 3 → ... + NO 2 + ...<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
5) S + H 2 SO 4 → ... + H 2 O<br />
6) KMnO 4 + K 2 SO 3 + KOH → K 2 SO 4 + ... +...<br />
7) K 2 Cr 2 O 7 + HCl<br />
o<br />
t<br />
⎯⎯→ CrCl 3 + ... + ... + ...<br />
t<br />
8) P + HNO 3 (đặc) ⎯⎯→ NO 2 + ... + ...<br />
9) Mg + HNO 3 → ... + NH 4 NO 3 + ...<br />
<strong>10</strong>) M 2 O n + HNO 3 → ... + NO 2 + ...<br />
o<br />
Bài 1: Hoàn thành các pư sau:<br />
1. FeSO 4 + KMnO 4 + H 2 SO 4 → 2. KMnO 4 + SO 2 + H 2 O →<br />
3. SO2 + H2O2 + H2O → 4/ Fe(NO3)2 + HNO3 đặc →<br />
5/ FeO + HNO3 loãng → 6/ Fe3O4 + HNO3 loãng →<br />
7/ Mg + HNO3 → N2 + … 8/ FeO + H2SO4 đặc →<br />
9/ Fe3O4 + H2SO4 đặc → <strong>10</strong>/ Fe2O3 + H2SO4 đặc →<br />
11. FexOy + HNO3 loãng → 12. FexOy + H2SO4 đặc →<br />
Bài 2: Hoàn thành các pư sau:<br />
1. FexOy + HNO3 loãng → 2. FexOy + H2SO4 đặc →<br />
3. FexOy + HNO3 đặc → 4/ FexOy + H2SO4 loãng →<br />
5/ FeS2 + HNO3 → NO2 + H2SO4 + .. 6/ M2(CO3)n + HNO3 → NO + …<br />
Bài 3: Hoàn thành các pư sau:<br />
1. KMnO 4 + K 2 SO 3 + H 2 O→ 2. KMnO 4 + K 2 SO 3 + H 2 SO 4 →<br />
3. KMnO4 + K2SO3 + KOH→ 4/ K2Cr2O7 + FeSO4 + H2SO4 →<br />
5/ KMnO4 + C2H2O4 + H2SO4→ 6/ FeSO4 + H2SO4 đặc →<br />
7/ KNO2 + KMnO4 + ….→ MnSO4 + ….<br />
GIẢI BÀI TẬP BẰNG ĐLBT ELECTRON<br />
I/ Phương pháp giải<br />
+ Nội dung ĐL: Tổng số mol e cho bằng tổng số mol e nhận.(nếu có nhiều chất cho, nhận e thì phải cộng<br />
lại)<br />
+ Các bước:<br />
Bước 1: Viết quá trình cho – nhận e rồi tính số mol e cho, e nhận từ đó lập phương trình dựa vào<br />
ĐLBT e<br />
Bước 2: Dựa vào dữ kiện khác để lập <strong>thêm</strong> phương trình nếu có<br />
Bước 3: Giải hệ (nếu có) để tìm nghiệm<br />
VD: Cho m gam Cu pư hết với dd HNO3 loãng dư thu được 6,72 lít NO duy nhất ở đktc. Tính m?<br />
Giải<br />
+ Ta có: Cu 0 + HN +5 O3 → Cu +2 (NO3)2 + N +2 O + H2O<br />
+ Đặt x là số mol Cu ta có:<br />
Cu → Cu +2 + 2e N +5 + 3e → N +2 .<br />
Mol: x 2x Mol: 0,9 0,3<br />
2x = 0,9 x = 0,45 m = 28,8 gam.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
II. Bài tập<br />
Bài 1: Cho m gam Al pư hết với dd HNO 3 thu được 4,48 lít (đktc) khí NO duy nhất. Tính m?<br />
Bài 2: Cho m gam Cu pư hết với dd HNO 3 thu được 2,24lít (đktc) khí NO 2 duy nhất. Tính m?<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 3: Cho m gam Al pư hết với dd HNO 3 thu được 1 muối và hh khí gồm 0,2 mol NO và 0,2<br />
mol N 2 O. Tính m?<br />
Bài 4: Cho m gam Fe pư hết với dd HNO 3 loãng dư thu được một muối và hh khí gồm 0,2 mol<br />
NO + 0,3 mol NO 2 . Tính m?<br />
Bài 5: Cho m gam Cu pư hết với dd HNO 3 thu được 8,96 lít (đktc) hh khí NO và NO 2 có khối<br />
lượng là 15,2g. Tính m.<br />
Bài 6: Cho 2,16g kim loại Al tác dụng hết với dd HNO 3 loãng thu được x mol hh khí N 2 và N 2 O<br />
có KL 0,996 gam. Tìm x. ĐS: 0,027 mol.<br />
Bài 7: Cho hh gồm 0,2 mol Fe và 0,3 mol Ag pư hết với HNO 3 dư thu được hai muối và V lít NO<br />
duy nhất ở đktc. Tính V?<br />
Bài 8: Cho hh gồm 2,7 gam Al + 32,4 gam Ag + 5,6 gam Fe pư hết với HNO 3 đặc nóng dư được<br />
V lít NO 2 duy nhất ở đktc. Tính V?<br />
Bài 9: Cho hh gồm 11,2 gam Fe và x gam Cu + HNO 3 dư thu được 6,72 lít NO duy nhất ở đktc.<br />
Tính x?<br />
Bài <strong>10</strong>: Hh X gồm Al và Fe. Cho 11 gam X + HCl dư thu được 8,96 lít hiđro ở đktc. Tính KL<br />
mỗi kim loại?<br />
Bài 11: Hh Y gồm Fe và Cu. Cho 15,2 gam Y + HNO 3 dư→ 4,48 lít NO duy nhất ở đktc. Tính<br />
KL mỗi kim loại? ĐS: Fe = 5,6 g; Cu = 9,6 g.<br />
Bài 12: Hh Z gồm Fe và Cu. Cho 12 gam Y + HNO 3 → 11,2 lít NO 2 duy nhất ở đktc. Tính KL<br />
mỗi kim loại? ĐS: Fe = Cu = 0,1 mol.<br />
Bài 13: Cho 11,2 gam Fe + HNO 3 dư thu được 1 muối và V lít hh khí gồm NO và NO 2 có khối<br />
lượng 16,8 gam ở đktc. Tính V(không tạo NH 4 NO 3 )?<br />
Bài 14: Hh X gồm Al và Zn. Cho 9,2 gam X pư hết với HNO 3 thu được hai muối và hh khí gồm<br />
0,05 mol NO + 0,04375 mol N 2 O. Tính khối lượng mỗi kim loại? ĐS: Al = 2,7 g; Zn = 6,5 g.<br />
Bài 15: Hh X gồm Fe và Cu có khối lượng 12 gam. Cho 12 gam X pư với HNO 3 dư thu được hai<br />
muối và 6,72 lít hh khí Y gồm NO 2 và NO có KL là 12,2 gam. Tính KL Fe và Cu(không tạo<br />
NH 4 NO 3 )?<br />
Bài 16: Cho m(g) hh 2 kim loại Fe và Cu được chia làm 2 phần bằng nhau:<br />
- Phần 1: hòa tan hết vào dd HCl dư thu được 5,6 lít H 2 (đktc).<br />
- Phần 2: hòa tan hết vào dd HNO 3 dư thu được <strong>10</strong>,08 lít NO (đktc).<br />
Tìm m(không tạo NH 4 NO 3 ). ĐS: m = 66,4.<br />
Bài 17:Chia m gam hh bột Al, Fe thành 2 phần bằng nhau:<br />
- Phần 1: tan hoàn toàn trong dd HCl ta thu được 7,28 lít H 2 (đktc).<br />
- Phần 2: tác dụng với dd HNO 3 loãng nóng đến khi tan hết thu được 5,6 lít khí (đktc).<br />
Tính thành phần % theo khối lượng các kim loại trong hh.<br />
Bài 18: M là kim loại hóa trị III. Cho 8,1 gam M pư hết với HNO 3 thu được hh khí gồm 0,1 mol<br />
NO và 0,075 mol N 2 O. Tìm M(không tạo NH 4 NO 3 )?<br />
Bài 19: M là kim loại chưa biết hóa trị. Cho 25,6 gam M pư hết với HNO 3 thu được hh khí gồm<br />
0,2 mol NO và 0,2 mol NO 2 . Tìm M(không tạo NH 4 NO 3 )? ĐS: Cu.<br />
Bài 20: Có một hh A gồm Fe và kim loại M hóa trị không đổi, khối lượng hh là 15,06g. Chia hh<br />
làm 2 phần bằng nhau:<br />
- Phần 1: hòa tan hết vào dd HCl dư thu được 3,696 lít H 2 (đktc).<br />
- Phần 2: hòa tan hết vào dd HNO 3 dư thu được 3,36 lít NO (đktc).<br />
Tìm kim loại M.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 21: Cho ag hỗn hợp A gồm FeO, CuO, Fe3O4 (có số mol bằng nhau) tác dụng vừa đủ với 250ml<br />
dung dịch HNO3 thu được dung dịch B và 3,136 lit hỗn hợp NO2 và NO có tỉ khối so với hiđro là<br />
20,143. Tính a và CM của HNO3.<br />
Bài 22: Cho 15,2 gam hh Cu và Mg pư hết với HNO 3 thu được 6,72 líthh khí NO và NO 2 có tỉ<br />
khối so với hiđro là 19 + dd chứa hai muối. Tính KL mỗi kim loại và tổng KL hai muối?<br />
Bài 23: Cho hh gồm 5,6 gam Fe và 12,8 gam Cu pư với HNO 3 dư thu được dd chứa hai muối + V<br />
lít hh khí ở đktc gồm NO và NO 2 có tỉ lệ mol tương ứng là 2:1. Tính V? ĐS: 6,72 lít<br />
Bài 24: Cho 15,4 gam hh Mg và Zn + dd HNO 3 vừa đủ thu được dd chứa hai muối và 3,08 lít hh<br />
khí NO + N 2 O ở đktc có d H2 = 16,91. Tính KL mỗi kim loại và số mol HNO 3 pư?<br />
ĐS: Mg = 2,4 gam và Zn = 13 gam.<br />
I/ Phương pháp giải<br />
+ Kí hiệu: d<br />
+ Biểu thức tính<br />
Tỉ khối của khí A so với khí B<br />
dA)B =<br />
M<br />
M<br />
A<br />
B<br />
<br />
MA<br />
<br />
dA/H2<br />
=<br />
2 <br />
MA<br />
dA/KK<br />
=<br />
29<br />
MA<br />
dA/O2<br />
=<br />
32<br />
TỈ KHỐI CỦA CHẤT KHÍ<br />
Tỉ khối của hh khí so với một khí<br />
Giả sử hh khí X có hai khí là A = a mol; B = b mol thì<br />
d<br />
X/H2<br />
a.M<br />
A<br />
+ b.M<br />
=<br />
2(a + b)<br />
B<br />
và<br />
d<br />
X/KK<br />
a.M<br />
A<br />
+ b.M<br />
=<br />
29(a + b)<br />
II/ Bài tập<br />
Bài 1: X thuộc nhóm VA. Hợp chất của X so với không khí bằng 0,5862. Tìm X?<br />
Bài 2: Cho 8,96 lít hh khí X gồm SO 2 và O 2 có tỉ khối so với hiđro là 28. Tính số mol mỗi khí?<br />
Bài 3: Cho 6,72 lít hh khí X gồm NO 2 và NO có tỉ khối so với hiđro là 19. Tính số mol mỗi khí?<br />
Bài 4: Cho m gam Al pư hết với dd HNO 3 thu được 8,96l (đktc) hh khí NO và N 2 O có tỉ khối hơi<br />
so với H 2 bằng 18,5. Tính m?<br />
Bài 5: Cho 15,2 gam hh Mg và Cu + HNO 3 dư → hai muối + 6,72 lít hh khí gồm NO và NO 2 ở<br />
đktc có tỉ khối so với hiđro là 19. Tính KL Mg, Cu? ĐS: Mg = 0,1 mol; Cu = 0,2 mol.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
B<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 6: Cho 15,4 gam hh Mg và Zn + HNO 3 dư → hai muối + 3,08 lít hh khí gồm NO và N 2 O ở<br />
đktc có tỉ khối so với hiđro là 16,91. Tính KL Mg, Zn? ĐS: Mg = 0,1 mol; Zn = 0,2 mol.<br />
Bài 7: Cho <strong>10</strong>,8 gam Al + HNO 3 dư → một muối + 13,44 lít hh khí NO và NO 2 ở đktc.<br />
1. Tính số mol mỗi khí? 2. Tính d X/H2 ?<br />
Bài 8: Hoà tan 2,64 gam hh Fe và Mg bằng dd HNO3 loãng, dư, thu được sản phẩm khử là 0,896 lít<br />
(ở đktc) hh khí gồm NO và N2, có tỷ khối so với H2 bằng 14,75. Thành phần<br />
% theo khối lượng của sắt trong hh ban đầu là<br />
A. 61,80%. B. 61,82%. C. 38,18%. D. 38,20%.<br />
GIẢI BÀI TẬP BẰNG PHƯƠNG PHÁP QUI ĐỔI<br />
I/ Phương pháp giải<br />
+ KN: Qui đổi là pp thay thế hh nhiều chất bằng hh ít chất hơn hoặc bằng một chất duy nhất<br />
+ Vì số chất trong hh giảm nên số ẩn sẽ giảm do đó việc giải bài tập sẽ dễ và nhanh hơn<br />
+ Các ĐLBT thường được áp dụng là: ĐLBTe, ĐLBT nguyên tố, ĐLBT điện tích<br />
+ Hh thường áp dụng pp qui đổi là Fe, FeO, Fe 3 O 4 , Fe 2 O 3 . Khi gặp hh bốn chất này thì ta thường<br />
thay thế bằng hh hai chất bất kì trong bốn chất đó.<br />
+ Khi qui đổi nếu ra kết quả âm ta vẫn lấy bình thường.<br />
II/ Bài tập VD:<br />
Bài 1: Để m gam phôi bào sắt ngoài không khí, sau 1 thời gian biến thành hh B có khối lượng<br />
12g gồm Fe và các oxit FeO, Fe 3 O 4 , Fe 2 O 3 . Cho B tác dụng hoàn toàn với dd HNO 3 thấy sinh ra<br />
2,24 l NO duy nhất ở đktc. Tính m?<br />
Giải<br />
Cách 1: Thay thế 4 chất trong hh B bằng hh Fe và FeO; đặt a là số mol Fe ban đầu; x và y là<br />
số mol Fe và FeO trong B ta có sơ đồ:<br />
0<br />
+O<br />
Fe : x mol<br />
2<br />
+HNO3<br />
+ 3<br />
Fe: a mol ⎯⎯⎯→ 12 gam ⎯⎯⎯→ Fe (NO<br />
2<br />
3) 3+ 0,1 mol NO<br />
+<br />
Fe O: y mol<br />
+ Theo giả thiết và ĐLBTNT; ĐL BTE ta có hệ: 56x + 72y =12; a = x + y; 3x+y = 0,1.3<br />
x = 0,06 mol; y = 0,12 mol; a = 0,18 mol m = 56a = <strong>10</strong>,08 mol.<br />
Cách 2: Thay thế 4 chất trong hh B bằng hh Fe và Fe 2 O 3 .<br />
Cách 3: Thay thế 4 chất trong hh B bằng hh FeO và Fe 2 O 3 .<br />
Cách 4: Sử dụng pp bảo toàn e<br />
Bài 2: Nung m gam bột sắt trong oxi, thu được 3 gam hh chất rắn X. Hòa tan hết hh X bằng dd HNO 3 dư, thu<br />
được 0,56 lít khí NO (sản phẩm khử duy nhất). Tính m.<br />
Bài 3: Nung 8,4 gam Fe trong không khí, sau pư thu được m gam chất rắn X gồm Fe, Fe 2 O 3 , Fe 3 O 4 , FeO. Hòa<br />
tan m gam hh X vào dd HNO 3 dư thu được 2,24 lít khí NO 2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:<br />
A. 11,2 gam. B. <strong>10</strong>,2 gam. C. 7,2 gam. D. 6,9 gam.<br />
Bài 4: Nung 50,4 gam Fe trong kk thu được 64,8 gam hh Fe và ba oxit. Hòa tan hh này trong HNO 3 loãng dư<br />
thu được V lít NO duy nhất ở đktc. Tính V? ĐS : 6,72 lít.<br />
Bài 5: Hòa tan hết m gam hh X gồm FeO, Fe 2 O 3 , Fe 3 O 4 bằng HNO 3 đặc nóng thu được 4,48 lít khí NO 2 (đktc).<br />
Cô cạn dd sau phản ứng thu được 145,2 gam muối khan giá trị của m là<br />
A. 35,7 gam. B. 46,4 gam. C. 15,8 gam. D. 77,7 gam.<br />
Bài 6: Hòa tan hết 23,2 gam hh X gồm FeO, Fe 2 O 3 , Fe 3 O 4 bằng HNO 3 đặc nóng thu được 2,24 lít khí NO 2<br />
(đktc). Cô cạn dd sau phản ứng thu được m gam muối khan. Giá trị của m là<br />
A. 35,7 gam. B. 72,6 gam. C. 15,8 gam. D. 77,7 gam.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 7: Nung m gam Cu trong oxi thu được 24,8 gam hh chất rắn X gồm Cu, CuO, Cu 2 O. Hòa tan hết X trong<br />
H 2 SO 4 đặc nóng thoát ra 4,48 lít SO 2 duy nhất ở đktc. Tính m? ĐS: 22,4 gam<br />
Bài 8: Cho 11,36 gam hh gồm Fe và 3 oxit của nó pư với HNO 3 loãng dư thu được 1,344 lít NO duy nhất ở<br />
đktc và dd X. Cô cạn X thu được bao nhiêu gam muối khan? ĐS: 38,72 gam<br />
Bài 9: Đốt cháy 6,72 gam Fe thu được m gam hh X gồm 4 chất. Để hòa tan X cần 225 ml dd HNO 3 2M thu<br />
được V lít NO 2 duy nhất ở đktc. Giá trị của m và V là:<br />
A. 8,88 và 2,016 B. 8,40 và 5,712 C. 16,08 và 2,016 D. <strong>10</strong>,08 và 5,712.<br />
Bài <strong>10</strong>: Cho khí CO đi qua m gam oxit Fe 2 O 3 đốt nóng, ta được 13,92 gam hh Y (gồm 4 chất rắn). Hh X hoà<br />
trong HNO 3 đặc dư được 5,824 lít NO 2 (đktc). Tính m?<br />
ĐS: 16 gam<br />
Chương 5: HALOGEN<br />
Bài 1: Hoàn thành sơ đồ pư sau:<br />
®pmn<br />
⎯⎯⎯→ (A) + (B) + (C) (2): (B) + (C)<br />
as<br />
⎯⎯→<br />
(1): NaCl + H 2 O<br />
(D)<br />
(3): (D) + (A) → NaCl + ? (4): (B) + Fe → (E)<br />
(5): (E) + (A) → (F) + NaCl (6): KMnO 4 + (D) → (B) + ? + ? + H 2 O<br />
(7): (F)<br />
0<br />
t<br />
⎯⎯→<br />
(9): (B) + KOH<br />
(G) + H 2 O<br />
0<br />
t<br />
⎯⎯→<br />
0<br />
t<br />
⎯⎯→<br />
(H) + (I) + H 2 O.<br />
(8): (B) + (A) → nước Gia-ven<br />
(1): MnO 2 + HCl (A) + (B) + (C)<br />
(2): (B) + NaBr → (D) + (E)<br />
(3): (B) + (F) → (D) (4): (B) + (G) → HCl<br />
(5): (F) + (C) → (H) + (G) (6): (B) + (H) → (D) + ? + (C)<br />
(1): (A) + (B) + SO 2 → (C) + (D) (2): Cu + (D) đặc → CuSO 4 + SO 2 + (B)<br />
(3): KMnO 4 + (C) → (F) + (G) + (A) + (B) (4): (A) + KOH<br />
0<br />
t ,xt<br />
⎯⎯⎯→<br />
(5): (H)<br />
(7): (F) + (B)<br />
0<br />
t<br />
⎯⎯→<br />
(F) + O 2 (6): (H) + (C) → (F) + ? + ?<br />
®pmn<br />
⎯⎯⎯→ ? + ? + (I) (8): (I) + O 2 → (B)<br />
0<br />
t ,xt<br />
⎯⎯⎯→<br />
®pnc<br />
⎯⎯⎯→<br />
(1): KClO 3 (A) + (B)<br />
(2): (A) (D) + (G)<br />
(3): (D) + H 2 O → (E) + H 2 (4): (G) + (E) → ? + ? + ?<br />
(5): (G) + (E)<br />
0<br />
t<br />
⎯⎯→<br />
? + ? + ?<br />
(1): Cl 2 + (A) → B (2): (B) + Fe → (C) + (A)<br />
(3): (C) + Cl 2 → (D) (4): (D) + (E) → (F) + NaCl<br />
(5): (F)<br />
0<br />
t<br />
⎯⎯→ (G) + (H)<br />
(6): (G) + (A)<br />
0<br />
t<br />
⎯⎯→ Fe + (H)<br />
(H) + (F) + (B)<br />
Bài 2: Hoàn thành các sơ đồ phản ứng sau:<br />
a) HCl → Cl 2 → KClO 3 → KCl → KOH → Cu(OH) 2 .<br />
+ Cl 2 + ?<br />
b) S → SO 2 ⎯⎯⎯→ H 2 SO 4 → FeSO 4 → FeCl 2 ⎯⎯→<br />
⎯ FeCl 3 .<br />
c) MnO 2 → Cl 2 → FeCl 3 → NaCl → → NaOH → NaCl → HCl → CuCl 2 → AgCl →Ag<br />
d) KMnO 4 → Cl 2 → HCl → FeCl 2 →FeCl 3 → KCl →Cl 2 → Br 2 .<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
e) Cl 2 → KClO 3 → KCl → KOH → KClO → Cl 2 → Ca(OCl) 2 → CaCl 2 → Cl 2 .<br />
Bài 3:<br />
1. Hoàn thành các sơ đồ sau biết A là muối ăn.<br />
2.<br />
A<br />
Fe<br />
A 1<br />
A 2<br />
A 3<br />
A 4<br />
A A A A<br />
B B 1 2<br />
B 3<br />
FeCl 2<br />
FeCl 3<br />
Fe(OH) 2<br />
B 4<br />
Fe(OH) 3<br />
Fe 2<br />
O 3<br />
Fe<br />
3. Viết pư có thể xảy ra khi:<br />
a. Cho clo pư với dd KOH. b. Đpdd NaCl không màng ngăn.<br />
c. Sục clo lần lượt vào dd SO 2 ; dd Na 2 CO 3 . d. Cho K 2 Cr 2 O 7 vào dd HCl đặc.<br />
Bài 4: So s<strong>án</strong>h<br />
a. Tính phi kim, tính oxi hóa, độ âm điện, b<strong>án</strong> kính của flo, clo, brom, iot<br />
b. Tính axit của HF, HCl, HBr, HI.<br />
Bài 5: X thuộc nhóm VIIA. Trong hiđroxit cao nhất của X có %m X = 35,32%(%m X trong HX =<br />
97,26%).<br />
1. Tìm X?<br />
2. X có những số oxi hóa nào? Vì sao?<br />
3. Viết pư của X với dd KI, Fe, FeCl 2 , dd KOH?<br />
4. Để điều chế 6,72 lít X ở đktc cần đpdd có bao nhiêu gam muối ăn biết H = 60%?<br />
Bài 6: Tổng số hạt trong nguyên tử X là 52<br />
1. Tìm X biết X thuộc nhóm VIIA.<br />
2. Viết pư của X với dd NaOH, dd SO 2 , dd NaBr, CH 4 và dd Na 2 CO 3 ?<br />
Bài 7: Cho các chất KMnO 4 ; MnO 2 ; K 2 Cr 2 O 7 và KClO 3 lần lượt pư với dd HCl đặc dư<br />
1. Viết pư xảy ra?<br />
2. So s<strong>án</strong>h thể tích clo thu được nếu dùng các chất trên với<br />
a) KL bằng nhau. b) Số mol bằng nhau.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 8: Hoàn thành các pư sau<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
a. Cl 2 + SO 2 + H 2 O → b. Cl 2 + FeCl 2 →<br />
c. KClO 3 + HCl → d. H 2 O 2 + HCl →<br />
Bài 9: Đốt cháy 6,4 gam S trong oxi dư. Khí SO 2 sinh ra pư vừa đủ với lượng Cl 2 (có mặt nước)<br />
sinh ra khi cho m gam thuốc tím pư với HCl đủ thu được dd X.<br />
1. Tính m? 2. Tính V dd NaOH 1M cần trung hòa A?<br />
ĐS: m = 12,64 g. 2. 0,8 lít.<br />
Bài <strong>10</strong>: Cho 40,3 gam hh X gồm KMnO 4 và MnO 2 pư với dd HCl đặc, dư, đun nóng thu được<br />
13,44 lít Cl 2 ở đktc.<br />
1. Tính khối lượng mỗi chất trong X?<br />
2. Cho toàn bộ lượng clo ở trên pư với dd KOH đun nóng vừa đủ. Tính tổng KL muối thu được?<br />
ĐS: 1. KMnO 4 = 31,6 gam; MnO 2 = 8,7 gam. 2. 99 gam.<br />
Bài 11: Hh X gồm Al và Fe. Cho m gam X pư với dd HCl dư thu được 8,96 lít hiđro ở đktc. Cũng<br />
cho m gam trên pư vừa đủ với V lít clo ở đktc thì thu được 42,95 gam muối.<br />
1. Tính m và V?<br />
2. Để điều chế V lít clo trên người ta phải cho x gam hh KMnO 4 và MnO 2 + dd HCl dư đun nóng.<br />
Tính x biết số mol MnO 2 gấp đôi số mol thuốc tím?<br />
ĐS: 1. m = 11 gam; V = <strong>10</strong>,08 lít.<br />
2. x = 33,2 gam.<br />
Bài 12: Cho 9,6 gam kim loại M pư với clo vừa đủ thu được 20,25 gam muối. Tìm M?<br />
ĐS: Cu<br />
Bài 13: Hh X gồm Al và kim loại M hóa trị II không đổi. Cho 7,8 gam X pư với clo dư thu được<br />
36,2 gam muối. Tìm M biết số mol Al gấp đôi số mol M? ĐS: M là Mg<br />
Bài 14: Hh X gồm Mg và Fe. Cho m gam X pư với HCl dư được 0,2 mol hiđro. Cũng m gam trên<br />
pư vừa đủ với 0,25 mol clo.<br />
1. Tính m?<br />
2. Tính KL muối ăn cần đpdd có mn cần để điều chế 0,25 mol clo trên cho H = 80%?<br />
ĐS: 1. m = 8 gam. 2. NaCl = 36,5625 gam.<br />
Bài 15: Có 5,56 gam hh A gồm Fe và kim loại M (hoá trị III). Chia A làm hai phần bằng nhau:<br />
Phần 1: Hoà tan hết trong dd HCl được 1,568 lít khí H 2 (đktc).<br />
Phần 2: Tác dụng vừa đủ với 2,016 lít khí Cl 2 (đktc).<br />
Xác định tên và %m của M trong A? ĐS: M là Al = 19,42%.<br />
Bài 16: Cho <strong>10</strong>,8 gam kim loại M (hoá trị n) tác dụng hết với Cl 2 thu được 53,4 gam muối clorua.<br />
1- Xác định kim loại M.<br />
2- Tính khối lượng MnO 2 và khối lượng dd HCl 36,5% để điều chế lượng Cl 2 cần dùng cho phản<br />
ứng trên?<br />
3- Cho toàn bộ lượng khí Cl 2 trên tác dụng với dd KOH đặc ở 70 o C. Tính khối lượng muối kali<br />
clorat thu được.<br />
ĐS: 1. M là Al. 2. MnO 2 = 52,2 g; m dd HCl = 240 g. 3. 24,5 g.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 17: Cho 69,6 gam MnO 2 pư với dd HCl đặc, dư, đun nóng. Lượng khí clo thu được cho đi qua<br />
500 ml dd NaOH 4M ở nhiệt độ thường thu được dd A. Tính C M các chất trong A.<br />
ĐS: NaCl = NaClO = 1,6M; NaOH = 0,8M.<br />
Bài 18: Hh khí A gồm clo và oxi. A phản ứng vừa hết với hh gồm 4,8 gam magie và 8,1gam nhôm<br />
tạo ra 37,05 gam hh các muối clorua và oxit. Thành phần % thể tích của oxi và clo trong hh A là<br />
A. 26,5% và 73,5%. B. 45% và 55%. C. 44,44% và 55,56%. D. 25% và 75%.<br />
Bài 19: Cho 11,2 lít hh khí A gồm clo và oxi phản ứng vừa hết với 16,98 gam hh B gồm magie và<br />
nhôm tạo ra 42,34 gam hh các muối clorua và oxit hai kim loại. %m của Mg và Al trong hh B là A.<br />
48% và 52%. B. 77,74% và 22,26%. C. 43,15% và 56,85%. D.75% và 25%.<br />
Bài 20: Lập bảng so s<strong>án</strong>h tính chất của các nhóm sau:<br />
1. flo, clo, brom, iot<br />
2. HF, HCl, HBr, HI<br />
3. HClO, NaClO, CaOCl 2 , KClO 3 .<br />
Câu 21: Nhiệt phân 31,6 gam KMnO4 một thời gian thu được 30 gam chất rắn. Lấy toàn bộ lượng<br />
chất rắn này pư với dd HCl đặc, nóng, dư thu được khí X. Nếu đem tất cả khí X điều chế clorua vôi<br />
thì thu được tối đa bao nhiêu gam clorua vôi (chứa 30% tạp chất)?<br />
A. 72,57 gam. B. 83,52 gam. C. 50,8 gam. D. 54,43 gam.<br />
ĐS: Cl 2 = 0,4 mol.<br />
Câu 22: Đốt cháy hh kim loại gồm 1,92 gam Mg và 4,48 gam Fe với hh khí X gồm clo và oxi, sau<br />
pư chỉ thu được hh Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng<br />
vừa đủ 120 ml dd HCl 2M, thu được dd Z. Cho AgNO 3 dư vào dd Z, sau pư xảy ra hoàn toàn thu<br />
được 56,69 gam kết tủa. Phần trăm thể tích khí clo trong hh X là<br />
A. 56,36%. B. 58,68%. C. 36,84%. D. 53,85%.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài tập HCl<br />
Bài 1: Chọn 8 chất thỏa mãn phương trình sau rồi viết pư xảy ra: X + HCl → Cl 2 + ….<br />
ĐS: KMnO 4 ; MnO 2 ; K 2 MnO 4 ; NaClO; KClO 3 ; CaOCl 2 ; K 2 Cr 2 O 7 ; HClO; PbO 2 .<br />
Bài 2: Oxit cao nhất của R có dạng R 2 O 7 . Hợp chất khí của R với hiđro chứa 2,74% hiđro về KL.<br />
1. Tìm R?<br />
2. Cho 0,25 mol đơn chất R pư với hiđro vừa đủ được chất khí X. Hòa tan X vào nước thu được<br />
200 gam axit. Tính C% của dd axit này?<br />
ĐS: 1. R là clo. 2. C% = 9,125%<br />
Bài 3: Cho 5,6 gam Fe pư với 75 gam dd HCl 14,6% thu được dd A và V lít khí ở đktc.<br />
1. Tính V và C% các chất tan trong A?<br />
2. Sục clo dư vào A được dd B, cô cạn B được m gam muối khan. Tính m?<br />
ĐS: 1. V = 22,4 lít; m dd = 80,4 g HCl = 4,54%; FeCl 2 = 15,8%.<br />
Bài 4: Cho <strong>10</strong>,0 lít H 2 và 6,72 lít Cl 2 (đktc) pư với nhau rồi hoà tan sản phẩm vào 385,40 gam nước<br />
ta thu được dd A. Lấy 50,0 gam A tác dụng với dd AgNO3 dư thu được 7,175 gam kết tủa. Tính hiệu<br />
suất phản ứng giữa H 2 và Cl 2 ? ĐS: 66,67%<br />
Bài 5: Cho một lượng dư KMnO 4 vào 25 ml dd HCl thu được 1,4 lít khí (đktc). Tính C M của dd HCl?<br />
ĐS: 8M<br />
Bài 6: Cho 44,5 gam hh bột Zn, Mg tác dụng với dd HCl dư thấy có 22,4 lít khí H 2 bay ra (đktc). Khối<br />
lượng muối clorua tạo ra là? ĐS: 115,5 gam.<br />
Bài 7: Để hòa tan hết m gam hh Zn và ZnO cần <strong>10</strong>0,8 ml dd HCl 36,5% (D = 1,19 g/ml) thu được<br />
8,96 lít khí (đktc). Tính %m ZnO ? ĐS: 38,4%.<br />
Bài 8: Cho <strong>10</strong>,3 gam hh Cu, Al, Fe vào dd HCl dư thu được 5,6 lít khí (đktc) và 2 gam chất rắn không<br />
tan. Tính %m của từng chất trong hh ban đầu? ĐS: 19,4%, 26,2%, 54,4%.<br />
Bài 9*: Cho từ từ 0,25 mol HCl vào dd A chứa 0,2 mol Na2CO3 và 0,1 mol NaHCO3. Tính V CO2<br />
(đktc) ĐS: 1,12 lít.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài <strong>10</strong>*: Cho 200 ml dd AgNO3 1M + với <strong>10</strong>0 ml dd FeCl2 0,1 M thu được m gam kết tủa. Tính m?<br />
ĐS: 3,95 gam.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 11: Hòa tan 57,7 gam hh MnO 2 ; KMnO 4 vào dd HCl đặc dư, đun nóng được 17,92 lít clo ở<br />
đktc. Tính %KL mỗi chất trong hh ban đầu? ĐS: MnO 2 = 45,23%.<br />
Bài 12: Có một dd chứa đồng thời HCl và H 2 SO 4 . Cho 200 gam dd đó pư với dd BaCl 2 dư thì tạo<br />
thành 46,6 gam kết tủa. Lọc bỏ kết tủa rồi thu lấy phần nước lọc. Để trung hòa nước lọc phải dùng<br />
500 ml dd NaOH 1,6M. Tính C% mỗi axit trong dd ban đầu?<br />
ĐS: H 2 SO 4 = 9,8%; HCl = 7,3%.<br />
Bài 13*: Nung 15,8 gam KMnO 4 một thời gian thu được 14,84 gam hh chất rắn. Cho 14,84 gam<br />
hh đó pư với dd HCl đặc dư, đun nóng được V lít khí clo ở đktc. Tính V? ĐS: 4,256 lít.<br />
Bài 14: Cho 17,4 gam MnO 2 pư hết với dd HCl. Toàn bộ khí sinh ra được hấp thụ hết vào 145,8<br />
gam dd NaOH 20% ở nhiệt độ thường tạo ra dd A. Tính C% mỗi chất trong A?<br />
ĐS: KL dd = 160 gam NaCl = 7,3125%; NaClO = 9,3125%; NaOH = 8,225%.<br />
Bài 15: 1. Cho 4,8 gam kim loại R pư hết với dd HCl thu được 4,48 lít hiđro ở đktc. Tìm R?<br />
2. Cho 4,8 gam trên vào 200 gam dd HCl 20% thu được dd X. Tính C% của dd X?<br />
Bài 16: Cho 11 gam hh Fe, Al pư vừa đủ 200 gam dd HCl 14,6% thu được dd X.<br />
1. Tính khối lượng mỗi kim loại? 2. Tính C% của X?<br />
ĐS: 1. Al = 5,4; Fe = 5,6 gam. 2. AlCl 3 = 12,7%.<br />
Bài 17: Để trung hòa hết 16 gam một hiđroxit của một kim loại nhóm IA cần 500 ml dd HCl 0,8M.<br />
Tìm hiđroxit đã cho? ĐS: NaOH<br />
Bài 18: Cho <strong>10</strong>0 ml dd KOH 1M vào <strong>10</strong>0 ml dd HCl thu được dd có chứa 6,525 gam chất tan. Tính<br />
C M của dd HCl đã dùng? ĐS: 0,5M.<br />
Bài 19: Cho V ml dd NaOH 1M pư với <strong>10</strong>0 ml dd HCl 1M. Sau pư thu được dd chứa 7,85 gam<br />
chất tan. Tính V? ĐS: 150 ml.<br />
Bài 20: Cho 1,2 gam kim loại R có hóa trị không đổi pư vừa đủ với 200 gam dd HCl a% được<br />
201,1 gam dd X. Tìm R, a và C% mỗi chất trong X? ĐS: R là Mg; a = 1,825%; C% = 2,362%.<br />
Bài 21: Hòa tan hết 1,7 gam gam hh X gồm Zn và kim loại R ở nhóm IIA vào dd HCl được 0,672<br />
lít hiđro ở đktc. Mặt khác 1,9 gam R thì pư không hết 200 ml dd HCl 0,5M. Tìm R?<br />
ĐS: X là canxi.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 22: Cho 31,125 gam hh NaCl và KCl pư với H 2 SO 4 đặc, dư ở 450 0 C thu được 36,75 gam muối<br />
+ V lít khí HCl ở đktc. Tính khối lượng mỗi muối clorua và V?<br />
ĐS: NaCl = 8,775 gam; V = <strong>10</strong>,08 lít.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 23: Cho 35 gam hh Na 2 CO 3 và K 2 CO 3 pư với dd HCl dư thu được 6,72 lít CO 2 ở đktc. Tính<br />
KL mỗi muối cacbonat? ĐS: Na 2 CO 3 = 21,2 gam.<br />
Bài 24: Cho m gam CaCO 3 có lẫn 20% khối lượng tạp chất trơ pư với dd HCl dư; dẫn CO 2 sinh ra<br />
vào dd Ba(OH) 2 dư được 49,25 gam kết tủa. Tính m? ĐS: m = 31,25 gam.<br />
Bài 25: Hỗn hợp X gồm Fe 3 O 4 và Al 2 O 3 . Để hòa tan 33,4 gam X cần 2,8 lít dd HCl 0,5M.<br />
1. Tính KL mỗi chất trong X?<br />
2. Để pư vừa đủ với 33,4 gam trên cần V lít dd NaOH 2M. Tính V?<br />
ĐS: 1. Fe 3 O 4 = 23,2 gam. 2. V = 0,1 lít.<br />
Câu 26: Cho 3,834 gam một kim loại M vào 360 ml dung dịch HCl, làm khô hh sau phản ứng thu<br />
được 16,614 gam chất rắn khan. Thêm tiếp 240 ml dung dịch HCl trên vào rồi làm khô hh sau phản<br />
ứng thì thu được 18,957 gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn, bỏ qua sự thủy phân<br />
của các ion trong dung dịch. Kim loại M là<br />
A. Al. B. Ca. C. Mg. D. Be.<br />
Giải bài tập halogen bằng phương pháp trung bình<br />
Bài 1: Cho 0,03 mol hh 2 muối NaX và NaY (X, Y là 2 halogen thuộc 2 chu kì liên tiếp) tác dụng với<br />
AgNO3 dư được 4,75 gam kết tủa. X và Y là<br />
A. F và Cl. B. Cl và Br. C. Br và I. D. I và At.<br />
Bài 2: Cho dd chứa 6,03 gam hh gồm hai muối NaX và NaY (X, Y là hai nguyên tố có trong tự nhiên,<br />
ở hai chu kì liên tiếp thuộc nhóm VIIA, số hiệu nguyên tử ZX < ZY) vào dd AgNO3 (dư), thu được<br />
8,61 gam kết tủa. Phần trăm khối lượng của NaY trong hh ban đầu là<br />
A. 52,8%. B. 58,2%. C. 47,2%. D. 41,8%.<br />
Bài 3: Dung dịch A chứa 9,6 gam hai hiđroxit của hai kim loại kiềm liên tiếp. Để trung hòa A cần<br />
200 ml dd HCl 1M được dd B.<br />
1. Tìm tên và KL hai hiđroxit đã cho?<br />
2. Đpdd B có mn với H = <strong>10</strong>0%. Tính thể tích clo thu được ở 0 0 C và 2atm?<br />
ĐS: NaOH = 4,0 g; KOH = 5,6 g. 2. 1,12 lít.<br />
Bài 4: Cho 16,2 gam Al pư vừa đủ với 117,3 gam hh hai halogen thuộc hai chu kì liên tiếp.<br />
1. Tìm hai halogen đã cho? 2. Tính %m mỗi halogen?<br />
ĐS: clo = 0,2 mol; brom = 0,6 mol.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 5: Cho 6,2 gam hh hai kim loại kiềm pư vừa đủ với a gam clo thu được 13,3 gam hh hai muối.<br />
1. Tính a? 2. Tìm tên và KL hai kim loại đã cho biết chúng thuộc hai CK liên tiếp?<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 6: Sục 23,5 gam hh hai khí HX và HY vào 1 lít dd chứa NaOH 0,1M và KOH 0,3M. Sau pư<br />
nhúng giấy quì tím vào dd thấy quì tím không đổi màu. Tìm X, Y biết chúng là các halogen liên<br />
tiếp?<br />
Bài 7: Hòa tan <strong>10</strong>,4 gam hh hai kim loại thuộc nhóm IIA và hai chu kì liên tiếp vào dd HCl dư thu<br />
được 6,72 lít hiđro ở đktc. Tìm tên và KL của hai kim loại đã cho?<br />
ĐS: Mg = 2,4 gam; Ca = 8 gam.<br />
Bài 8: Cho 31,84 gam hỗn hợp NaX, NaY (X, Y là hai halogen ở 2 chu kỳ liên tiếp) vào dung dịch<br />
AgNO 3 dư, thu được 57,34 gam kết tủa.<br />
a) Tìm công thức của NaX, NaY. b) Tính khối lượng mỗi muối.<br />
Bài 9: X, Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong hệ thống tuần hoàn. Hỗn hợp<br />
A có chứa 2 muối của X, Y với natri.<br />
a) Để kết tủa hoàn toàn 2,2 gam hỗn hợp A, phải dùng 150 ml dung dịch AgNO 3 0,2M. Tính khối<br />
lượng kết tủa thu được?<br />
b) Xác định hai nguyên tố X, Y.<br />
Bài <strong>10</strong>: Hỗn hợp X gồm hai halogen liên tiếp trong BTH. Hỗn hợp Y gồm Al và Mg có tỉ lệ mol<br />
2:1. Để pư vừa đủ với 7,8 gam Y cần 37,3 gam X. Tìm tên và KL mỗi halogen trong X?<br />
ĐS: clo = 0,3 mol và brom = 0,1 mol<br />
Bài 0: Hoàn thành sơ đồ sau:<br />
Bài tập halogen tổng hợp<br />
ĐS: A = KClO3; B = MnO2; C = KMnO4; D = K2Cr2O7; E = NaCl; Y = H2O; F = Fe; G = FeCl3; H =<br />
AgNO3; J = CaOCl2; M = Fe2O3 hoặc Fe(OH)3; N = KBr; O = Br2; P = KI; Z = Na; R = H2SO4 đặc.<br />
Bài 1: Sục Cl2 vào dung dịch KOH loãng thu được dung dịch A, hòa tan I2 vào dung dịch KOH loãng thu<br />
được dung dịch B (tiến hành ở nhiệt độ phòng).<br />
1) Viết phương trình hóa học xảy ra.<br />
2) Viết phương trình hóa học xảy ra khi cho lần lượt các dung dịch: hỗn hợp HCl và FeCl2, Br2, H2O2, CO2<br />
vào dung dịch A (không có Cl2 dư, chỉ chứa các muối).<br />
ĐS: 2FeCl2 + 2KClO + 4HCl → 2FeCl3 + Cl2 + 2KCl + 2H2O.<br />
Br2 + 5KClO + H2O → 2HBrO3 + 5KCl<br />
H2O2 + KClO → H2O + O2 + KCl<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 2: Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dd KOH ở <strong>10</strong>0 0 C. Sau khi pư xảy ra hoàn toàn,<br />
thu được 37,25 gam KCl. Dd KOH trên có nồng độ là<br />
A. 0,24M. B. 0,48M. C. 0,4M. D. 0,2M.<br />
Bài 3: Cho m gam hỗn hợp tinh thể gồm NaBr, NaI tác dụng vừa đủ với H 2 SO 4 đặc ở điều kiện<br />
thích hợp, thu được hỗn hợp khí X ở điều kiện thường. Ở điều kiện thích hợp hỗn hợp X tác dụng<br />
vừa đủ với nhau tạo thành 9,6 gam chất rắn màu vàng và một chất lỏng không làm đổi màu quì tím.<br />
Giá trị của m là<br />
A. 260,6. B. 240. C. 404,8. D. 50,6.<br />
Bài 4: Biết độ tan của NaCl trong <strong>10</strong>0 gam nước ở 90 0 C là 50 gam và ở 0 0 C là 35 gam. Khi làm<br />
lạnh 600 gam dung dịch NaCl bão hòa ở 90 0 C về 0 0 C làm thoát ra bao nhiêu gam tinh thể NaCl?<br />
A. 45 gam. B. 55 gam. C. 50 gam. D. 60 gam.<br />
Bài 5: Sục từ từ 3,36 lít clo ở đktc vào dd chứa 0,2 mol NaBr và 0,2 mol NaI. Sau khi pư xảy ra<br />
hoàn toàn được dd X. Cô cạn X được m gam muối khan. Tính m? ĐS: 27,85 gam.<br />
Bài 6: Đun nóng m gam MnO 2 với axit HCl đặc, dư thu được một chất khí A. Trộn khí A với 5,6<br />
(l) H 2 dưới tác dụng của <strong>án</strong>h s<strong>án</strong>g để pư xảy ra. Khí A còn dư sau pư cho tác dụng với dd KI vừa<br />
đủ thì thu được 63,5 (g) I 2 . Tính m, biết các thể tích khí <strong>đề</strong>u đo ở đkc? ĐS: m = 43,5 gam.<br />
Bài 7: Dd A chứa 4,82 gam hh NaF, NaCl và NaBr. Sục khí clo vừa đủ vào A rồi cô cạn dd sau pư<br />
thu được 3,93g muối khan. Lấy 1.2 lượng muối khan này + dd AgNO 3 dư thì thu được 4,305g kết<br />
tủa. Tính %m các muối trong hh ban đầu.<br />
Giải<br />
+ Đặt x, y, z lần lượt là số mol NaF, NaCl và NaBr. Ta có: 42x + 58,5y + <strong>10</strong>3z = 4,82 (I)<br />
+ Khi sục clo vào dd A ta sẽ thu được hai muối là NaCl và NaF do đó:<br />
42x + 58,5y + 58,5z = 3,93 (II)<br />
+ Khi cho pư với AgNO 3 dư thì chỉ có một kết tủa do đó ta có: y + z =<br />
+ Giải (I, II, III) được: x = 0,01 mol; y = 0,04 mol và z = 0,02 mol<br />
%KL của NaF = 8,7%; NaCl = 48,55%.<br />
4,305.2<br />
143,5<br />
= 0,06 (III)<br />
Bài 8: Đốt cháy hh gồm 1,92 gam Mg và 4,48 gam Fe với hh khí X gồm clo và oxi, sau pư chỉ thu<br />
được hh Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120<br />
ml dd HCl 2M, thu được dd Z. Cho AgNO 3 dư vào dd Z, thu được 56,69 gam kết tủa. %V clo trong<br />
hh X là:<br />
A. 51,72%. B. 76,70%. C. 53,85%. D. 56,36%.<br />
Bài 9: Đốt 16,2 gam hh X gồm Al và Fe trong khí Cl 2 thu được hh chất rắn Y. Cho Y vào nước dư,<br />
thu được dd Z và 2,4 gam kim loại. Dd Z pư được với tối đa 0,21 mol KMnO4 trong dd H2SO4<br />
(không tạo ra SO2). Phần trăm khối lượng của Fe trong hh X là<br />
A. 72,91%. B. 64,00%. C. 66,67%. D. 37,33%<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài <strong>10</strong>: Dung dịch X chứa a gam hh: NaI và NaBr. Cho Br 2 vừa đủ vào X được dd Y có b gam<br />
muối. Cho Cl 2 vừa đủ vào Y được dd Z có c gam muối. Biết 2b = a + c. Phần trăm khối lượng của<br />
NaBr trong hh ban đầu là: A. 7,3% B. 4,5% C. 3,7% D. 6,7%<br />
Bài 11: Dd A chứa 6,23 gam 3 muối halogenua của natri. Sục clo vừa đủ vào A rồi cô cạn hoàn<br />
toàn dd sau pư được 3,0525 gam muối khan B. Lấy ½ B + dd AgNO 3 dư thì thu được 3,22875 gam<br />
kết tủa. Tìm công thức và %m các muối?<br />
Giải<br />
+ Gọi 3 muối cần tìm là NaX, NaY, NaZ với X < Y < Z. Theo giả thiết ta có sơ đồ:<br />
NaX<br />
MNaY ⎯⎯⎯→ 3,0525 gam B 0,0225.2 mol AgCl<br />
(1)<br />
⎯⎯⎯⎯→ <br />
NaF(co the co)<br />
(2)<br />
<br />
NaZ<br />
6,23 gam + Cl 2<br />
NaCl<br />
+ AgNO3<br />
+ Từ quá trình (2) trong sơ đồ ta có:<br />
AgNO 3 + NaCl → AgCl↓ + NaNO 3 .<br />
Mol: 0,045 0,045<br />
Suy ra m NaCl = 0,045.58,5 = 2,6325 gam < 3,0525 gam B B phải có NaF với số mol =<br />
3,0525 − 2,6325<br />
42<br />
0,01 mol Chắc chắn hh M ban đầu có 0,01 mol NaF<br />
+ Dựa vào kết quả trên ta viết lại quá trình (1) trong sơ đồ như sau:<br />
N<br />
Cl<br />
6,23 M aF: 0,01 mol + 2<br />
NaCl: 0,045 mol<br />
gam <br />
⎯⎯⎯→ B<br />
(1)<br />
<br />
NaM: a mol<br />
NaF:0,01<br />
mol<br />
+ Từ sơ đồ trên suy ra: M = <strong>10</strong>6,11 phải có một halogen là iot, halogen còn lại là Cl hoặc Br.<br />
+ Xét TH1: X là Cl, Y là I ta có :<br />
NaF: 0,01 mol<br />
<br />
+ Cl 2<br />
NaCl: 0,045 mol 0,01.42 + 58,5a + 150b = 6,23<br />
6,23 gam MNaCl: a mol ⎯⎯⎯→ B<br />
(1)<br />
<br />
NaF:0,01 mol a + b = 0,045<br />
NaI: b mol<br />
a = 0,0<strong>10</strong>3 mol; b = 0,0347 mol trường hợp này thỏa mãn. Từ đó suy ra %KL = …<br />
+ Xét TH2: X là Br, Y là I ta có :<br />
NaF: 0,01 mol<br />
<br />
+ Cl 2<br />
NaCl: 0,045 mol 0,01.42 + <strong>10</strong>3a + 150b = 6,23<br />
6,23 gam M NaBr: a mol ⎯⎯⎯→ B<br />
(1)<br />
<br />
NaF:0,01 mol a + b = 0,045<br />
NaI: b mol<br />
a = 0,02 mol; b = 0,025 mol trường hợp này thỏa mãn. Từ đó suy ra %KL = …<br />
Vậy có hai kết quả thỏa mãn.<br />
Bài 12: Hh A gồm MgCl 2 , NaBr và KI. Cho 93,4 gam A pư với 700 ml dd AgNO 3 2M được dd D<br />
và 179,6 gam kết tủa B. Dung dịch D pư vừa đủ với 0,2 mol Cu.<br />
1. Tính số mol mỗi chất trong A?<br />
2. Hòa tan A vào nước được dd X. Dẫn V lít clo ở đktc vào X, cô cạn dd sau pư được 66,2 gam<br />
chất rắn. Tính V?<br />
ĐS: 1. MgCl 2 = 0,2 mol ; NaBr = 0,4 mol và KI = 0,2 mol.<br />
2. V = 4,48 lít(clo đẩy iot trước, NaBr dư)<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 13: Hòa tan hết 0,02 mol KClO3 trong lượng dư dd HCl đặc, thu được dd Y và khí Cl2. Hấp thụ hết<br />
toàn bộ lượng khí Cl2 vào dd chứa 0,06 mol NaBr, thu được m gam Br2 (giả thiết Cl2 và Br2 <strong>đề</strong>u pư không<br />
đ<strong>án</strong>g kể với H2O). Các pư <strong>đề</strong>u xảy ra hoàn toàn. Giá trị của m là<br />
A. 4,80. B. 3,20. C. 3,84. D. 4,16.<br />
(clo dư pư tiếp với brom mới tạo ra)<br />
Bài tập nhận biết halogen<br />
I. Phương pháp nhận biết halogen<br />
+ Nhận biết là pp dùng các pư và tính chất đặc trưng để tìm ra các chất trong nhóm chất đã cho.<br />
+ Điều kiện để pư được dùng làm pư nhận biết: có hiện tượng quan sát được như tạo kết tủa; tạo<br />
bọt khí bay lên; tạo chất có màu; làm mất màu; tạo chất có mùi…. Ngoài ra ta còn dùng tính chất<br />
vật lí như tính tan: với chất rắn không tan thì sẽ vẩn đục hoặc tạo kết tủa; với chất lỏng không tan<br />
thì sẽ phân lớp.<br />
+ Để nhận biết các chất ta thường dùng bảng tính tan làm công cụ hỗ trợ<br />
+ Thuốc thử là chất đã biết hoặc là chất mới nhận ra được cho pư để tìm các chất đã cho.<br />
+ Một thuốc thử hay dùng<br />
Quì tím: là chất có màu tím khi gặp axit = đỏ; bazơ = xanh; muối = xanh, đỏ, tím<br />
PP: không màu chỉ hóa đỏ trong môi trường bazơ.<br />
NaOH; KOH: thường dùng để nhận biết các chất sau<br />
Kim loại và oxit: Al, Zn; Al 2 O 3 ; ZnO.<br />
Nhiều dd muối (9 dd sau): MgCl 2 ; AlCl 3 ; ZnCl 2 ; CrCl 3 ; FeCl 2 ; FeCl 3 ; CuCl 2 ; AgNO 3 ;<br />
NH 4 Cl.<br />
+ Để nhận biết được ta phải tìm được những tính chất vật lí hóa học khác nhau giữa các chất sau<br />
đó dùng tính chất đó để phân biệt<br />
Nhận biết Halogen<br />
+ Đơn chất:<br />
Dựa vào màu sắc.<br />
Dựa vào pư đặc trưng: iot tạo sp màu xanh đen với hồ tinh bột; brom và clo pư vơi SO 2 cho<br />
H 2 SO 4 .<br />
+ Nhận biết ion halogenua: dùng AgNO 3 khi đó…<br />
Trình bày một bài nhận biết:<br />
+ VD: nhận biết 3 dung dịch sau NaCl; BaCl 2 , MgCl 2 .<br />
Phương pháp dùng lời:<br />
Lấy mỗi dung dịch một lượng cần thiết để nhận biết.<br />
Cho 3 dung dịch pư với dd NaOH ta nhận ra MgCl 2 vì tạo kết tủa trắng:<br />
MgCl 2 + 2NaOH → Mg(OH) 2 + 2NaCl<br />
Cho 2 dung dịch còn lại pư với H 2 SO 4 , dd nào cho kết tủa trắng là BaCl 2 . Còn lại là NaCl<br />
BaCl 2 + H 2 SO 4 → BaSO 4 + 2HCl<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Phương pháp kẻ bảng: Lấy mỗi dung dịch một lượng cần thiết rồi tiến hành nhận biết ta có kết quả ở<br />
bảng sau:<br />
Chất NaCl BaCl2 MgCl2<br />
NaOH - - ↓ trắng<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
H2SO4 - ↓ kết tủa trắng X<br />
Ghi chú: kí hiệu (-) có nghĩa là không pư hoặc không hiện tượng, kí hiệu (X) có nghĩa là đã nhận ra.<br />
Pư xảy ra: MgCl 2 + 2NaOH → Mg(OH) 2 + 2NaCl<br />
BaCl 2 + H 2 SO 4 → BaSO 4 + 2HCl<br />
Phương pháp sử dụng sơ đồ:<br />
II/ Bài tập<br />
Bài 1: Phân biệt 2 dung dịch sau:<br />
a) AlCl 3 và MgCl 2 . b) CuSO 4 và CuCl 2 . c) NH 4 Cl và NaCl<br />
d/ FeSO 4 và Fe 2 (SO 4 ) 3 e/ Ba(NO 3 ) 2 và KNO 3 . f/ AlCl 3 và Al(NO 3 ) 3 .<br />
g/ NaCl và BaCl 2 . h/ Ba(NO 3 ) 2 và CaCl 2 . i/ CuSO 4 và MgSO 4 .<br />
Bài 2: Dùng ít nhất 2 cách để phân biệt 2 dung dịch sau<br />
a) CuSO 4 và AlCl 3 . b) NaCl và Mg(NO 3 ) 2 . c) FeCl 3 và FeSO 4 .<br />
Bài 3: Hãy phân biệt các dung dịch sau:<br />
1. NaCl, NaOH, Na 2 SO 4 , NaNO 3 . 2. BaCl 2 , KCl, CuCl 2 .<br />
3. K 2 SO 4 , KCl, KNO 3 . 4/ CuSO 4 , K 2 SO 4 , ZnSO 4 , MgSO 4 .<br />
Bài 4: Nhận biết các dd<br />
1. NaCl, NaF, NaI, NaBr chỉ dùng dd AgNO 3 .<br />
2. HCl, HBr, NaI, NaCl, NaF chỉ dùng hai thuốc thử.<br />
Bài 5: Dùng thuốc thử thích hợp để nhận biết các dung dịch sau đây:<br />
a) BaCl 2 , KBr, HCl, KI, KOH b) KI, HCl, NaCl, H 2 SO 4<br />
c) HCl, HBr, NaCl, NaOH d) NaF, CaCl 2 , KBr, Mgl 2 .<br />
Bài 6: Nhận biết các dd sau chỉ dùng 1 thuốc thử?<br />
a) 4 chất rắn sau: FeS, MnO 2 , Ag 2 O, Fe 3 O 4 .<br />
b) 4 dung dịch: NaCl, KF, NaBr, HI.<br />
c) BaCl 2 ; HCl; H 2 SO 4 ; NaCl; Ba(OH) 2 .(quì tím hoặc PP)<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
CHUYÊN ĐỀ: OXI – OZON – HIĐROPEOXIT<br />
Các phản ứng cần nhớ<br />
+ Pư của ozon:<br />
O 3 + 2Ag → Ag 2 O + O 2<br />
O 3 + 2KI + H 2 O → I 2 + 2KOH + O 2<br />
+ Phản ứng của H 2 O 2 :<br />
H 2 O 2 + NaNO 2 → NaNO 3 + H 2 O<br />
H 2 O 2 + K 2 SO 3 → K 2 SO 4 + H 2 O<br />
4H 2 O 2 + PbS → PbSO 4 + 4H 2 O<br />
5H 2 O 2 + 2KMnO 4 + 3H 2 SO 4 → K 2 SO 4 + 2MnSO 4 + 5O 2 + 8H 2 O<br />
H 2 O 2 + Ag 2 O → 2Ag + O 2 + H 2 O<br />
Bài 1: Hoàn thành sơ đồ phản ứng sau:<br />
a.<br />
b.<br />
(1) (2) (3)<br />
2 3 2 + HO<br />
O ⎯⎯→ O ⎯⎯→ Ag O ⎯⎯⎯⎯→ ?<br />
2 2<br />
(1) (2) (3)<br />
2 2 ⎯⎯→ 2 ⎯⎯→ 2 5 ⎯⎯→ 3 4<br />
H O O P O H PO<br />
c. KClO 3 → KCl → KOH → KClO 3 .<br />
Bài 2: Hoàn thành pư sau:<br />
(1): A + S → C (2): B + S → C<br />
(3): A + Ag → Ag 2 O + B (4): A + H2 → D<br />
(5): B + H2 → D (6): A + KI+ D → E + F + B.<br />
t<br />
0<br />
⎯⎯→<br />
(7): F + Cl2 G + H + D<br />
(8): H G + B<br />
(9): I + D → K + B. (<strong>10</strong>): G + D → Cl2 + K + H2.<br />
ĐS: A là ozon; B là oxi<br />
Bài 3: Hợp chất A tạo nên bởi hai nguyên tố X, Y trong đó số nguyên tử X = Y = 2. Tổng số<br />
proton trong A = 18. Số proton của Y hơn của X là 7.<br />
1. Tìm CTPT, CTCT và tên A ?<br />
2. Viết pư của A với dd KI, dd KMnO 4 /H 2 SO 4 , PbS?<br />
Bài 4: Nhận biết các khí sau<br />
a. oxi và ozon bằng hai cách. b. H 2 , CO 2 , O 3 , O 2 .<br />
c. HCl, HBr, CO, O 2 . d. Cl 2 , H 2 , CO, H 2 O.<br />
Bài 5: Hỗn hợp A gồm CO và CO 2 có tỉ khối so với oxi bằng 1.<br />
1. Tính %V các khí trong A?<br />
2. Đốt cháy m gam C trong V lít oxi ở đktc để được 8,96 lít A(đktc). Tính m và V?<br />
t<br />
0<br />
⎯⎯→<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
ĐS: 1. CO = 75%; CO 2 = 25%. 2. M = 4,8 gam; V = 5,6 lít.<br />
Bài 6: X là hh oxi và ozon có tỉ khối so với hiđro là 19,2.<br />
1. Tính %V các khí trong X?<br />
2. Tính số mol oxi và ozon trong 20 lít X ở 2,46 atm và 27 0 C.<br />
3. Cho toàn bộ X ở phần 2 pư với Ag dư thì thu được bao nhiêu gam oxit?<br />
ĐS: 1. oxi = 60%; ozon = 40%. 2. 1,2 mol oxi và 0,8 mol ozon. 3. 185,6 gam.<br />
Bài 7: Sục 3,36 lít oxi và ozon có tỉ lệ mol = 1:1 ở 0 0 C và 2 atm vào dd KI vừa đủ thu được V lít<br />
khí oxi thoát ra (ở 27 0 C và 1 atm) và m gam iot. Tính V và m? ĐS: V = 7,38 lít; m = 38,1 gam.<br />
Bài 8: Đốt cháy hết m gam cacbon trong V lít oxi ở đktc được hh A gồm hai khí có tỉ khối so với<br />
oxi là 1,25.<br />
1. Tính %V mỗi khí trong A?<br />
2. Tính m và V biết cho A vào dd Ca(OH) 2 dư được 12 gam kết tủa.<br />
ĐS:<br />
TH1: A có CO và CO 2 : CO = 25%; m = 1,92 g; V = 3,136 lít.<br />
TH2: A có O 2 và CO 2 : O 2 = 33,33%; m = 1,44 g; V = 4,032 lít.<br />
Bài 9: Hỗn hợp A ở dạng hơi gồm oxi và chất B với số mol bằng nhau.<br />
1. Tính M B biết tỉ khối của A so với hiđro là 16,5.<br />
2. B có dạng H 2 X 2 . Tìm B?<br />
3. Cho 2 mol A sục vào dd KMnO 4 dư trong H 2 SO 4 loãng. Tính V O2 thoát ra ở 0 0 C và 2atm.<br />
Bài <strong>10</strong>: Hỗn hợp A gồm oxi và ozon có tỉ khối so với hiđro là 20. Hỗn hợp B có CO và H 2 có tỉ<br />
khối so với hiđro là 6,2. Tính số mol A cần để đốt cháy hết 1 mol B?<br />
Bài 11: Trộn V ml hh A gồm CO và H 2 với V ml oxi rồi đốt. Sau khi A cháy hết được 750 ml khí<br />
B. Làm lạnh B để ngưng tụ hết hơi nước còn V 1 lít khí C có tỉ khối so với metan là 2,409.<br />
1. Tính V, V 1 biết các khí đo ở cùng đk?<br />
2. Tính %V mỗi khí trong A và C?<br />
ĐS: 1. V = 500 ml; V 1 = 550 ml. 2. A có 60%CO; C có 54,55%CO 2 .<br />
Bài 12(SGK): So s<strong>án</strong>h thể tích khí oxi thoát ra ở cùng điều kiện khi phân hủy kali pemanganat;<br />
kali clorat; kali nitrat và hiđro peoxit trong hai trường hợp sau:<br />
a. Cùng khối lượng. B. Cùng số mol.<br />
Bài 13(96.II): Có hai bình A, B dung tích bằng nhau ở 0 0 C. Bình A có 1 mol oxi; bình B có 1 mol<br />
clo. Trong mỗi bình <strong>đề</strong>u có <strong>10</strong>,8 gam kim loại M hóa trị n duy nhất. Nung nóng bình đến pư hoàn<br />
toàn rồi làm lạnh đến 0 0 C thấy tỉ lệ áp suất trong bình A so với bình B là 7/4. Tìm M?<br />
ĐS: M là Al.<br />
Bài 14: Cho m gam cacbon pư hết với V lít oxi ở đktc được 11,2 lít hh hai khí ở đktc có tỉ khối so<br />
với hiđro là 16. Tìm m, V? ĐS: CO 2 = 0,125 mol; CO = 0,375 mol m = 6,0 gam; V = 7,0 lít.<br />
Bài 15: Nhiệt phân 4,385 gam hỗn hợp X gồm KClO 3 và KMnO 4 , thu được O 2 và m gam chất rắn<br />
gồm K 2 MnO 4 , MnO 2 và KCl. Toàn bộ lượng O 2 tác dụng hết với cacbon nóng đỏ, thu được 0,896<br />
lít hỗn hợp khí Y (đktc) có tỉ khối so với H 2 là 16. Thành phần % theo khối lượng của KMnO 4 trong<br />
X là<br />
A. 74,92%. B. 27,94%. C. 62,76%. D. 72,06%.<br />
Bài 16: Oxi hóa hoàn toàn 23,2g hỗn hợp (Fe, Cu) bằng lượng oxi dư, sau thời gian phản ứng thu<br />
được 31,2 g hỗn hợp rắn X. Cho X tan vừa hết trong V lít dd HCl 1M thì thu được m gam muối.<br />
Tính m và V? ĐS: V = 1,0 lít và m = 58,7 gam.<br />
Bài 17: Cho 8,9 g hỗn hợp (Mg, Zn) pư vừa đủ V lít oxi (đktc) thu được m g hỗn hợp rắn X. Cho<br />
X cho pư hết với 400ml HCl 1M thì thu được x gam muối. Tính V, m và x?<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
ĐS: V = 2,24 lít; m = 12,1 gam và x = 23,1 gam.<br />
Bài 18: Oxi hóa hoàn toàn m gam hỗn hợp (Fe, Zn, Mg, Cu) bằng V lit oxi vừa đủ (đktc) thu được<br />
(m + 1,6) g hỗn hợp rắn X. X pư vừa hết với 200ml HCl aM. Tính V và a?<br />
ĐS: V = 1,12 lít; a = 1M.<br />
Bài 19: Cho 19,5 gam kim loại R (hóa trị II, không đổi) tác dụng với 0,05 mol oxi được hỗn hợp<br />
rắn X. Cho X pư vừa hết trong <strong>10</strong>0 ml dung dịch HCl aM thì thu được m gam muối và 0,2 mol khí<br />
H 2 .<br />
Câu 20: Chia 9,16 gam hh Mg, Al, Zn thành 2 phần bằng nhau. Phần 1 + HCl dư, thu được 5,824<br />
lít H 2 (đktc). Phần 2 cho pư với O 2 dư, thu được m gam 3 oxit. Tính m? ĐS: 8,74 gam.<br />
Câu 21: Cho 14,3 gam hh Mg, Al, Zn tan hết trong dd gồm H 2 SO 4 và HCl, thu được V lít H 2 (đktc).<br />
Cũng cho 14,3 gam trên pư với O 2 dư, thu được 22,3 gam gam 3 oxit. Tìm V? ĐS: 11,2 lít<br />
Câu 22: Cho 14,2 gam hh Cu, Al, Mg pư với oxi dư được 22,2 gam oxit. Để pư vừa đủ với 22,2<br />
gam trên cần dd chứa x mol HCl. Tính x?<br />
ĐS: x = 1 mol<br />
I. KIẾN THỨC CẦN NẮM VỮNG.<br />
BÀI TẬP: KIM LOẠI PƯ VỚI LƯU HUỲNH<br />
+ Cho kim loại M pư với S ta có: 2M + nS → M 2 S n . (1)<br />
+ Gọi X là hh sau pư ta có:<br />
Nếu pư (1) xảy ra không hoàn toàn thì X có: M 2 S n ; M dư và S dư khi X pư với HCl thì ta<br />
có<br />
M 2 S n + 2nHCl → 2MCl n + nH 2 S↑<br />
2M + 2nHCl → 2MCl n + nH 2 ↑<br />
S + HCl → không pư<br />
chất rắn không tan trong dd HCl là lưu huỳnh.<br />
Nếu pư (1) xảy ra hoàn toàn thì X chắc chắn có M 2 S n ; có thể có M hoặc S dư.<br />
+ NX: Ta luôn có KL hh(M+S) bằng KL hh X; đốt cháy X chính là đốt cháy hh ban đầu.<br />
II. BÀI TẬP<br />
Bài 1: Đun nóng hh gồm 11,2 gam sắt và 1,6 gam lưu huỳnh đến pư hoàn toàn thu được hỗn hợp<br />
chất rắn A. Cho A pư vừa hết với V ml dung dịch HCl 1M thì thu được hỗn hợp khí B có tỉ khối so<br />
với hiđro bằng x. Tính V và x? ĐS: V = 400 ml và x = 5.<br />
Bài 2: Đun nóng hỗn hợp gồm 5,6 gam sắt và 3,2 gam lưu huỳnh được hỗn hợp A. Cho A tác dụng<br />
với dung dịch HCl dư thu được 2,24 lit hỗn hợp khí B ở đktc có tỉ khối so với hiđro là 13 và m gam<br />
chất rắn C.<br />
a) Tính %V mỗi chất trong B.<br />
b) Tính hiệu suất của phản ứng sắt và lưu huỳnh; tính giá trị của m.<br />
ĐS: a. H2S = 75%; H2 = 25%. b. H = 75%; m = 0,8 gam.<br />
Bài 3: Hòa tan hoàn toàn 20 gam hỗn hợp A gồm Fe và FeS trong m gam dung dịch H 2 SO 4 loãng<br />
5% thì thu được 0,3 mol hỗn hợp khí B.<br />
a. Tính khối lượng các chất trong A?<br />
b. Tính m biết H 2 SO 4 dùng dư 20% so với thực tế?<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
ĐS: a. Fe = 0,2 mol = 11,2 g; FeS = 0,1 mol = 8,8 g. b. m = 705,6 g.<br />
Bài 4: Cho 8,4 gam kim loại R pư vừa đủ với 4,8 gam S được m gam muối sunfua. Xác định R và<br />
tính khối lượng muối sunfua? ĐS: R là Fe.<br />
Bài 5: Hòa tan hoàn toàn 11,2 gam hỗn hợp A gồm Mg và FeS thì cần 73 gam dung dịch HCl 20%<br />
thu được m gam muối và V lít hỗn hợp khí B (đktc) có tỉ khối so với hiđro là x. Tính m, V và x?<br />
ĐS: Mg = FeS = 0,1 mol m = 22,2 g; V = 4,48 lít và x = 9.<br />
Bài 6: Cho 3,6 gam kim loại R có hóa trị II pư với 0,05 mol S thì thu được hỗn hợp rắn A. Hh A<br />
tan hết trong dd HCl dư thì thu được 0,1 mol khí H 2 . Xác định kim loại R? ĐS: R là Mg.<br />
Bài 7: Trộn 5,6 gam sắt với 2,4 gam lưu huỳnh rồi nung nóng (trong điều kiện không có không<br />
khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp<br />
khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O 2 (ở<br />
đktc). Giá trị của V là<br />
A. 2,80. B. 3,36. C. 3,08. D. 4,48.<br />
Bài 8: Đun nóng đến pư hoàn toàn hỗn hợp bột gồm sắt và lưu huỳnh. Đem hoà tan chất rắn sau<br />
phản ứng trong dung dịch HCl dư thấy có 4,48 lit khí thoát ra. Nếu đem hết lượng khí này cho<br />
vào dung dịch Pb(NO 3 ) 2 dư thì còn lại 2,24 lit khí. Các thể tích <strong>đề</strong>u đo ở đktc.Tính % khối lượng<br />
của sắt và lưu huỳnh trong hỗn hợp đầu và tính khối lượng kết tủa tạo thành trong dung dịch<br />
Pb(NO 3 ) 2 ?<br />
ĐS:<br />
Bài 9: Hỗn hợp X gồm bột lưu huỳnh và một kim loại M hóa trị II. Nung 25,9 g X đến pư hoàn<br />
toàn thu được chất rắn A. Cho A pư với dd HCl dư thấy A tan hết tạo ra 6,72 lít hỗn hợp khí B ở<br />
đktc có tỉ khối với khí hiđro 11,666. Tìm M và khối lượng S và M trong hỗn hợp X?<br />
ĐS: M là Zn = 0,3 mol; S = 0,2 mol.<br />
Bài <strong>10</strong>: Cho m gam hỗn hợp bột Fe và S với tỉ lệ số mol sắt bằng 2 lần số mol lưu huỳnh, rồi đem<br />
nung (không có oxi), thu được hỗn hợp A. Hòa tan A bằng dung dịch HCl dư thu được 0,4 gam<br />
chất rắn B, dung dịch C và khí D. Sục khí D từ từ qua dung dịch CuCl 2 dư thấy tạo ra 4,8 gam kết<br />
tủa đen.<br />
a) Tính hiệu suất phản ứng tạo thành hỗn hợp A (theo S). Tính m.<br />
b) Cho C tác dụng với H 2 SO 4 đặc, nóng dư. Tính thể tích khí thoát ra ở điều kiện tiêu chuẩn.<br />
ĐS : a. H = 80% . b. 1,4 lít.<br />
+ Pư của S với H 2 SO 4 đặc và HNO 3 :<br />
S + 2H 2 SO 4 → 3SO 2 ↑ + 2H 2 O<br />
S + 6HNO 3 → H 2 SO 4 + 6NO 2 ↑ + 2H 2 O<br />
3S + 6HNO 3 → 3H 2 SO 4 + 6NO↑<br />
Ghi nhớ<br />
+ Khi gặp bài to<strong>án</strong> có hh: M, S, M 2 S n pư với H 2 SO 4 đặc hoặc HNO 3 thì ta qui đổi về hh M và S.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài tập 1: Hòa tan hết 30,4 gam hỗn hợp X gồm Cu, CuS, Cu 2 S và S bằng dung dịch HNO 3 dư<br />
thu được 20,16 lít khí NO duy nhất ở đktc và dung dịch Y. Thêm Ba(OH) 2 dư vào Y được m gam<br />
kết tủa. Tính m?<br />
Giải<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ Qui đổi hỗn hợp đã cho thành hỗn hợp Cu và S ta có sơ đồ:<br />
2+<br />
Cu : x mol<br />
<br />
HNO<br />
Cu : x mol<br />
Cu(OH)<br />
3 Ba(OH) 2<br />
2: x mol<br />
+ <br />
+ <br />
30,4 gam ⎯⎯⎯→ 0,9 mol NO + ⎯⎯⎯⎯→<br />
2-<br />
<br />
S: y mol <br />
SO BaSO<br />
4<br />
: y mol<br />
4: y mol<br />
64x + 32y = 30,4<br />
+ Theo ĐLBT e và giả thiết ta có hệ: x = 0,3 mol và y = 0,35 mol<br />
2x + 6y = 0,9.3<br />
m = 0,3.98 + 0,35.233 = 1<strong>10</strong>,95 gam.<br />
Bài 2(Đề thi HSG <strong>Hóa</strong> <strong>10</strong> – Vĩnh Phúc – 20<strong>10</strong>): Cho 20,8 gam hỗn hợp Fe, FeS, FeS 2 , S pư với<br />
H 2 SO 4 đặc nóng dư thu được V lít SO 2 ở đktc và dung dịch A. Cho A + NaOH dư thu được 21,4<br />
gam kết tủa. Tính thể tích dung dịch thuốc tím 1M cần dùng để pư vừa đủ với V lít trên?<br />
Giải<br />
+ Qui đổi hỗn hợp ban đầu thành hỗn hợp Fevà S ta có:<br />
Fe : x mol<br />
Fe : x mol<br />
3+<br />
<br />
+ H2SO<br />
<br />
4<br />
+ NaOH<br />
20,8 gam ⎯⎯⎯⎯→ z mol SO<br />
2<br />
+ ⎯⎯⎯→ Fe(OH) 2-<br />
3: x mol<br />
S : y mol<br />
SO<br />
4<br />
: y mol<br />
+ Theo ĐLBT e và giả thiết ta có hệ:<br />
<br />
56x + 32y = 20,8<br />
<br />
<strong>10</strong>7x = 21,4<br />
+ Áp dụng ĐLBT electron ta có: 2z = 3x + 6y z = 1,2 mol<br />
số mol KMnO 4 = 1,2.2.5 = 0,48 mol V dd KmnO4 = 0,48 lít.<br />
x = 0,2 mol và y = 0,3.<br />
Bài 3(HSG11 – Vĩnh Phúc - 20<strong>10</strong>)Cho 20,8 gam hh X gồm Fe, FeS, FeS 2 , S pư với dd HNO 3 đặc<br />
nóng dư thu được V lít NO 2 (là sp duy nhất ở đktc) và dung dịch A. Cho A pư với dd Ba(OH) 2 dư<br />
thu được 91,3 gam kết tủa.<br />
1. Viết pư xảy ra dạng ion thu gọn?<br />
2. Tính V và số mol HNO 3 cần dùng để oxi hóa hoàn toàn X?<br />
ĐS: Dùng pp qui đổi thu được V = 53,76 lít và số mol HNO3 = 3 mol.<br />
Bài 4: Hòa tan 25,6 gam chất rắn X gồm Fe, FeS, FeS 2 và S bằng dd HNO 3 loãng dư thu được V<br />
lít NO duy nhất ở đktc và dd Y. Thêm Ba(OH) 2 dư vào Y thu được 126,25 gam kết tủa. Giá trị<br />
của V là:<br />
A. 17,92. B. 19,04. C. 24,64. D. 27,58.<br />
Bài 5: Hỗn hợp X gồm Mg, MgS và S. Hòa tan m gam X trong dd HNO 3 dư thu được 2,912 lít<br />
nitơ duy nhất ở đktc và dd Y. Thêm Ba(OH) 2 dư vào Y thu được 46,55 gam kết tủa. Giá trị của m<br />
là:<br />
A. 4,8. B. 7,2. C. 9,6. D. 12,0.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
CHUYÊN ĐỀ: SO2 và H2S<br />
Một số phản ứng cần ghi nhớ<br />
t<br />
H2S + ½ O2 thiếu → S + H2O<br />
H2S + 3.2 O2 dư ⎯⎯→ SO2 + H2O<br />
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl<br />
5H2S + 2KMnO4 + 3H2SO4→ K2SO4 + 2MnSO4 + 5S + 8H2O<br />
H2S + 2FeCl3 → 2FeCl2 + S↓ + 2HCl<br />
SO2 + NaOH → NaHSO3 (natri hiđrosunfit)<br />
SO2 + 2NaOH → Na2SO3 + H2O (natri sunfit)<br />
SO2 + Br2 + 2H2O → H2SO4 + 2HBr<br />
H2SO4.nSO3 + nH2O → (n+1)H2SO4 .<br />
2FexOy + 2yH2SO4 → xFe2(SO4)2y/x + 2yH2O<br />
2FeCO 3 + 4H 2 SO 4 → Fe 2 (SO 4 ) 3 + 2CO 2 + SO 2 + 4H 2 O<br />
2FeS + <strong>10</strong>H2SO4 → Fe2(SO4)3 + 9SO2 + <strong>10</strong>H2O<br />
Bài 1: Hoàn thành sơ đồ sau:<br />
X<br />
+ H 2 +B<br />
+ O + O 2 2 + D<br />
B<br />
E<br />
(2)<br />
(3)<br />
(4)<br />
(1)<br />
A<br />
(5)<br />
X + D<br />
+ O 2 + Br 2<br />
+ D<br />
B<br />
(6) (7)<br />
+ Fe + Y or Z<br />
C<br />
(8) (9)<br />
Y + Z<br />
A + G<br />
Bài 2: Hoàn thành các pư sau:<br />
(1): A 1 + A 2 → A 3 + A 4 . (4): A 3 + hiđro → A 1 .<br />
(2): A 1 + A 2 → A 5 + A 4 . (5): A 3 + A2 → A5.<br />
(3): A 1 + A 5 → A 3 + A 4 . (6): A 5 + Br 2 + A 4 → A 6 + A 7 .<br />
Cho A 5 có dạng XO 2 có tỉ khối so với oxi bằng 2.<br />
(1): S + A → X (5): X + D + E → U + V<br />
(2): S + B → Y (6): Y + D + E → U + V<br />
(3): Y + A → X + E (7): Z + E → U + V<br />
(4): X + D → Z Z là SO 2 Cl 2 .<br />
Bài 3: Hoàn thành sơ dồ sau:<br />
a. ZnS → H 2 S → S → SO 2 → SO 3 → H 2 SO 4 → HCl → Cl 2 → KClO 3 → O 2 → S → H 2 S → SO 2<br />
→ Na 2 SO 3 → Na 2 SO 4 → NaCl → Cl 2 .<br />
b. FeS → H 2 S → SO 2 → NaHSO 3 → Na 2 SO 3 → SO 2 → H 2 SO 4 → K 2 SO 4 → KCl → KOH →<br />
KClO 3 → SO 2 → S → H 2 S → H 2 SO 4 .<br />
Bài 4: A và B là hai chất khí tương ứng có dạng H 2 X và XO 2 có dA)B = 0,53125.<br />
1. Tìm A, B và xác định trạng thái lai hóa của X trong A, B?<br />
2. Viết pư có thể xảy ra khi cho A, B lần lượt pư với:<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
0<br />
Y<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
a. dd NaOH. b. nước clo. c. oxi.<br />
Bài 5: 1. Hoàn thành pư sau:<br />
(1): FeS + HCl → khí A + …<br />
0<br />
t<br />
(2): KClO 3 ⎯⎯→ khí B + …<br />
(3): Na 2 SO 3 + HCl → khí C<br />
2. Cho A, B, C pư với nhau từng đôi một. Viết pư xảy ra?<br />
Bài 6: 1. Hoàn thành pư sau:<br />
(1): Na 2 SO 3 + H 2 SO 4 → khí A + …<br />
(2): Na 2 S + H 2 SO 4 → khí B + …<br />
(3): KMnO 4 + HCl → khí C<br />
2. Viết pư xảy ra khi:<br />
a. Sục A vào dd có B. b. Sục C vào dd có A, B.<br />
c. Cho A, B lần lượt pư với oxi. d. Cho C pư với dd NaOH.<br />
Bài 7: Nhận biết các<br />
a. Các dd: NaCl, Na 2 CO 3 , Na 2 SO 3 , Na 2 S mà chỉ dùng một thuốc thử.<br />
b. Các chất bột: Na 2 SO 4 , Na 2 CO 3 , BaCO 3 , BaSO 4 , K 2 SO 3 mà chỉ dùng hai thuốc thử.<br />
Bài 8: Nhận biết các cặp chất khí sau<br />
a. oxi và ozon. b. hiđro sunfua và sunfurơ c. sunfurơ và cacbonic<br />
Bài 9*: Hoàn thành các pư sa(nếu có)<br />
1. FeS + HCl → 2. FeS + O 2 → 3. FeS + H 2 SO 4 đặc →<br />
4. CuS + HCl → 5. CuS + O 2 → 6. CuS + H 2 SO 4 đặc →<br />
7. H 2 S + FeSO 4 → 8. H 2 S + CuSO 4 → 9. H 2 S + Cl 2 + H 2 O →<br />
<strong>10</strong>. H 2 S + FeCl 3 → 11. K 2 S + FeSO 4 → 12. K 2 S + Fe 2 (SO 4 ) 3 →<br />
13. K 2 S + Al 2 (SO 4 ) 3 + H 2 O→ 14. H 2 S + KMnO 4 + H 2 SO 4 →<br />
Bài tập SO2, H2S pư với dd bazơ<br />
Bài 1: Hấp thụ hoàn toàn 6,72 lít SO 2 ở đktc vào 400 ml dd KOH 1M thu được dd X. Tính khối<br />
lượng mỗi chất tan trong X? ĐS: KHSO 3 = 0,2 mol = 24 gam; K 2 SO 3 = 0,1 mol = 15,8 gam.<br />
Bài 2: Hấp thụ hoàn toàn V lít SO 2 ở đktc vào 350 ml dd NaOH 1M thu được dd Y chứa hai muối<br />
có tổng khối lượng là 28,2 gam. Tính V? ĐS: V = 5,6 lít.<br />
Bài 3: Hấp thụ hết 8,96 lít H 2 S ở đktc vào 500 ml dd NaOH x mol/l thu được dd A chứa hai chất<br />
tan có số mol bằng nhau. Tìm x biết H 2 S tan trong nước không đ<strong>án</strong>g kể?<br />
ĐS: TH1: hai chất tan là hai muối NaHS = Na 2 S = ½ H 2 S = 0,2 mol x = 1,2M.<br />
TH2: hai chất tan là Na 2 S và NaOH dư NaOH = Na 2 S = H 2 S = 0,4 mol x = 2,4M.<br />
Bài 4: Cho 5,6 lít SO 2 ở đktc hấp thụ hết vào 400 ml dd Ba(OH) 2 0,5M thu được m gam kết tủa.<br />
Tính m? ĐS: BaSO 3 = 0,15 mol m = 32,55 gam<br />
Bài 5: Hấp thụ hết V lít SO 2 ở đktc vào 500 ml dd Ba(OH) 2 0,48M thu được 43,4 gam kết tủa. Tính<br />
V? ĐS: V = 4,48 lít hoặc 6,272 lít.<br />
Bài 6: Hấp thụ 3,36 lít SO 2 (đktc) vào 0,5 lít hỗn hợp gồm NaOH 0,2M và KOH 0,2M thu được<br />
dung dịch chứa m gam hh muối. Tính m? ĐS: 18,3 gam.<br />
Bài 7: Đốt cháy hoàn toàn 6,8 g một chất vô cơ A chỉ thu được 4,48 lít khí SO 2 ở đktc và 3,6 g<br />
nước.<br />
1. Xác định thể tích khí O 2 đã dùng ở đktc và công thức phân tử của A?<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
2. Nếu đốt cháy 6,8g chất A nói trên nhưng chỉ dùng lượng O 2 bằng 2.3 lượng cần thiết. Hỏi sau<br />
phản ứng thu được những sản phẩm gì. Tính khối lượng của các sản phẩm đó.<br />
3. Hấp thụ hết 6,8g A vào 180ml dd NaOH 2M thì thu được muối gì? Bao nhiêu gam.<br />
ĐS: 1. BTKL oxi = 0,3 mol; H 2 S. 2. SO 2 = S = 0,1 mol.<br />
Bài 8: Hấp thụ hoàn toàn V lít H 2 S ở đktc vào 400 ml dd KOH 1M thu được hai muối có tỉ lệ mol<br />
= 2:1.<br />
a. Tính V?<br />
b. Cho V lít trên pư vừa đủ với nước clo được dd X. Cho X pư với dd BaCl 2 dư được m gam kết<br />
tủa. Tính m?<br />
ĐS: a. Muối trung hòa : axit = 2:1 V = 5,376 lít; muối axit : trung hòa = 2:1 V = 6,72 lít.<br />
b. m = 55,92 gam hoặc m = 69,9 gam.<br />
Bài 9: Hấp thụ hoàn toàn V lít SO 2 ở đktc vào 200 ml dd X chứa NaOH 1M và Na 2 SO 3 0,5M thu<br />
được dd Y chứa gam 37,5 gam chất tan. Tính V? ĐS: V = 5,6 lít( chất tan chứa hai muối)<br />
CHUYÊN ĐỀ: H2SO4<br />
Bài 1: Hoàn thành các pư sau:<br />
1. M + H 2 SO 4 loãng → 2. M + H 2 SO 4 đặc → + SO 2 +<br />
3. Mg + H 2 SO 4 loãng → 4. Mg + H 2 SO 4 đặc → + H 2 S +<br />
5. Al + H 2 SO 4 loãng → 6. M + H 2 SO 4 đặc → + S +<br />
7. M 2 O n + H 2 SO 4 loãng → 8. KHCO 3 H 2 SO 4 loãng →<br />
Bài 2: Hoàn thành các phản ứng sau(Kẻ bảng so s<strong>án</strong>h H 2 SO 4 loãng và đặc)<br />
1. Fe + H2SO4 đặc → 2. Fe + H2SO4 loãng → 3. FeO + H2SO4 đặc →<br />
4/ FeO + H2SO4 loãng → 5/ Fe3O4 + H2SO4 đặc → 6/ Fe3O4 + H2SO4 loãng →<br />
7/ FexOy + H2SO4 đặc → 8/ FexOy + H2SO4 loãng → 9/ FeCO3 + H2SO4 đặc →<br />
<strong>10</strong>/ FeCO3 + H2SO4 loãng → 11. FeS + H2SO4 loãng → 12. FeS + H2SO4 đặc →<br />
13. FeS2 + H2SO4 loãng → 14/ FeS2 + H2SO4 đặc → 15/ Cu2S + H2SO4 đặc →<br />
Bài 3: Tìm 9 chất thỏa mãn pư sau rồi viết pư xảy ra: X + H2SO4 đặc → Fe2(SO4)3 + SO2 + H2O<br />
ĐS: Fe, FeO, Fe 3 O 4 , FeS, FeS 2 , Fe(OH) 2 , FeSO 4 , FeSO 3 ; Fe(HSO 3 ) 2 ; Fe(HSO 4 ) 2 ; FeS 2 O 3 …<br />
Bài 4: Viết phản ứng xảy ra trong các thí nghiệm sau:<br />
a. Cho Fe dư vào dd H 2 SO 4 đặc nóng.<br />
b. Cho hh Fe 3 O 4 và Cu vào dd H 2 SO 4 loãng dư chỉ thu được dd X. Cho X pư với dd thuốc tím.<br />
c. Cho hh Fe 3 O 4 và Cu vào dd H 2 SO 4 đặc thấy Cu dư sau pư?<br />
d. Cho H 2 SO 4 đặc vào saccarozơ.<br />
Bài 5: Chia hỗn hợp A gồm Fe và Fe 3 O 4 thành hai phần bằng nhau:<br />
+ Phần 1: pư vừa đủ với 180 ml dung dịch H 2 SO 4 loãng 1M.<br />
+ Phần 2: pư với dd H 2 SO 4 đặc, nóng, dư, người ta thu được 1,12 lít khí SO 2 duy nhất (đktc).<br />
1- Viết các phương trình phản ứng 2- Tính % khối lượng các chất trong A?<br />
ĐS: Trong A có Fe = 0,04 mol = <strong>10</strong>,77% và Fe 3 O 4 = 0,08 mol = 89,23%<br />
Bài 6: Chia hỗn hợp B gồm Fe và Al 2 O 3 thành hai phần bằng nhau:<br />
+ Phần 1: Cho tác dụng vừa đủ với 50 gam dung dịch H 2 SO 4 9,8% (loãng).<br />
+ Phần 2: Cho tác dụng với dd H 2 SO 4 đặc, nóng, dư, người ta thu được 0,672 lít khí SO 2 (đktc).<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Tính khối lượng các chất trong B? ĐS: Fe = 0,02.2.56 = 2,24 g; Al 2 O 3 = 0,01.2.<strong>10</strong>2 = 2,04 g.<br />
Bài 7: Hỗn hợp B gồm Fe và FeO. Cho B + dd HCl dư được 4,48 lít khí (đktc). Mặt khác, nếu cho<br />
B + H 2 SO 4 đặc, nóng, dư được 8,96 lít khí SO 2 (đktc). Tính khối lượng các chất trong B?<br />
ĐS: Fe = 0,2 mol = 11,2 gam; FeO = 0,2 mol = 14,4 gam.<br />
Bài 8: Cho 11,2 gam hh Cu và Ag pư với H 2 SO 4 đặc nóng dư thu được khí A và dd B. Cho A +<br />
nước clo dư, dd thu được lại cho tác dụng với dd BaCl 2 dư thì thu được 18,64 gam kết tủa. Tính<br />
%m của mỗi kim loại trong hh đầu? ĐS: Cu = 0,04 mol = 22,86%.<br />
Bài 9: Chia hỗn hợp B gồm Fe và Fe 2 O 3 thành hai phần bằng nhau:<br />
+ Phần 1: Cho tác dụng vừa đủ với <strong>10</strong>0 ml dung dịch H 2 SO 4 loãng 9,8%(d=1,2 g/ml).<br />
+ Phần 2: Cho tác dụng với dd H 2 SO 4 đặc, nóng, dư, người ta thu được 1,008 lít khí SO 2 (đktc).<br />
Tính % khối lượng các chất trong B?<br />
ĐS: số mol ở mỗi phần của Fe = Fe 2 O 3 = 0,03 mol %Fe = 25,93%.<br />
Bài <strong>10</strong>: Hoà tan hoàn toàn Fe x O y bằng H 2 SO 4 đặc nóng dư thu được 2,24 lít SO 2 (đktc); phần dd<br />
chứa 120 gam một loại muối sắt duy nhất. Xác định công thức phân tử của oxit sắt?<br />
ĐS: Fe = 0,6 mol; O = 0,8 mol Fe 3 O 4 .<br />
Bài 11: Hòa tan hoàn toàn 5,76 gam một oxit sắt bằng dd H 2 SO 4 đặc, nóng thu được dd X và 0,896<br />
lít khí SO 2 (sản phẩm khử duy nhất, ở đktc). Cô cạn dd X, thu được m gam muối sunfat khan. Tìm<br />
Fe x O y và m? ĐS: Qui đổi được kết quả là FeO và 16 gam.<br />
Bài 12: Hoà tan hết a (g) Fe x O y trong H 2 SO 4 đặc nóng được V lít SO 2 duy nhất. Cho a(g) trên pư<br />
CO dư, t 0 rồi hoà tan sắt tạo thành trong H 2 SO 4 đặc nóng dư thì thu được 9V lít SO 2 trong cùng đk.<br />
Xác định công thức của oxit đó? ĐS: Fe 3 O 4 .<br />
Bài 13: Hoà tan hết 4,32 gam hỗn hợp Ag và Cu bằng một lượng vừa đủ dd H 2 SO 4 đặc nóng thu<br />
được V lít khí SO 2 ở đktc. Lượng SO 2 này được hấp thụ hoàn toàn bởi 70 ml dd NaOH 0,5M, cô<br />
cạn dd sau pư thu được 3,435 gam chất rắn khan(gồm hai muối).<br />
1- Tính %KL mỗi kim loại? 2- Tính V?<br />
Bài 14: Hoà tan hoàn toàn hỗn hợp gồm 0,002 mol FeS 2 và 0,003 mol FeS vào lượng dư H 2 SO 4<br />
đặc nóng thu được Fe 2 (SO 4 ) 3 , SO 2 và H 2 O. Hấp thụ hết SO 2 bằng một lượng vừa đủ là V lít dung<br />
dịch KMnO 4 0,2M. Tính V?<br />
ĐS: V = 0,114 lít.<br />
Bài 15: Hoà tan hết 19,2 gam kim loại M bằng dd H 2 SO 4 đặc nóng dư được khí SO 2 (sp khử duy<br />
nhất). Lượng SO 2 này được hấp thụ hoàn toàn bởi 1 lít dung dịch NaOH 0,7M được dd X chứa 41,8<br />
gam chất tan(Gợi ý <strong>thêm</strong>: hỗn hợp chất rắn khan). Tìm M?<br />
ĐS: M là Cu, chất rắn khan có NaOH dư và Na 2 SO 3 .<br />
Bài 14: Trộn dung dịch A chứa NaOH và dung dịch B chứa Ba(OH) 2 theo thể tích bằng nhau thu<br />
được dung dịch C. Trung hoà <strong>10</strong>0 ml dung dịch C cần 35 ml dung dịch H 2 SO 4 2 M đồng thời thu<br />
được 9,32 gam kết tủa.<br />
a) Tính nồng độ mol/l của dung dịch A và dung dịch B?<br />
b) Cần trộn bao nhiêu ml dung dịch B với 20 ml dung dịch A để thu được dung dịch D có thể hoà<br />
tan hết 1,08 gam Al.<br />
Bài 15: Hoà tan 1,08 g kim loại A bằng dung dịch H 2 SO 4 loãng thu được 1,344 lít một chất khí ở<br />
0 0 C và 1atm.<br />
a) Xác định kim loại A.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
b) Lấy 6,84 g muối sunfat của kim loại A cho tác dụng với 0,2 lít dung dịch KOH thấy tạo thành<br />
một chất kết tủa. Lọc lấy kết tủa rửa sạch đem nung tới khối lượng không đổi thu được 1,53g chất<br />
rắn. Tính nồng độ mol/l của dung dịch KOH? ĐS:<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 18: Hỗn hợp A gồm FeO và M 2 O 3 . Cho A tác dụng với dung dịch H 2 SO 4 loãng dư thu được<br />
dung dịch B. Cho B tác dụng với NaOH dư thì thu được kết tủa và dung dịch C. Cho C tác dụng<br />
với dung dịch HCl vừa đủ được 15,6g kết tủa. Xác định công thức M 2 O 3 . ĐS: Al 2 O 3 .<br />
Bài 19: Hoà tan hoàn toàn a mol kim loại M vào H 2 SO 4 đặc, nóng, dư được khí SO 2 duy nhất và<br />
dd chứa 1,56 gam muối. Cho khí SO 2 hấp thụ hết vào 45 ml dung dịch NaOH 0,2M thu được 0,608<br />
gam muối. Xác định M, a?<br />
ĐS: Na 2 SO 3 = 0,004 mol; NaHSO 3 = 0,001mol SO 2 = 0,005 mol<br />
2M + 2nH 2 SO 4 → M 2 (SO 4 ) n + nSO 2 + 2nH 2 O M = <strong>10</strong>8n M là Ag.<br />
0,005/n 0,005 mol<br />
Bài 20: Cho 37 g hỗn hợp X gồm Fe, Fe 3 O 4 tác dụng với H 2 SO 4 đặc nóng. Sau pư được 6,72 lít<br />
khí SO 2 duy nhất (đktc), dd Y và 2,92 g kim loại không tan. Tính KL mỗi chất trong X và Y?<br />
ĐS: Fe = 23,08 gam; Fe 3 O 4 = 0,06 mol = 13,92 gam; Y có FeSO 4 = 82,08 gam.<br />
CHUYÊN ĐỀ: BÀI TẬP OLEUM<br />
Ghi nhớ:<br />
+ Oleum được tạo thành khi cho SO 3 pư với H 2 SO 4 đặc theo pư:<br />
H 2 SO 4 + nSO 3 → H 2 SO 4 .nSO 3 .<br />
+ Phản ứng của olemum với nước:<br />
H 2 SO 4 .nSO 3 + nH 2 O → (n+1)H 2 SO 4<br />
+ Phản ứng của olemum với dd NaOH:<br />
H 2 SO 4 .nSO 3 + nH 2 O → (n+1)H 2 SO 4<br />
2NaOH + H 2 SO 4 → Na 2 SO 4 + 2H 2 O<br />
+ Để giải nhanh bài tập oleum ta qui đổi oleum thành hh H 2 SO 4 và SO 3 .<br />
Bài 1: Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200 ml dung dịch X. Để trung<br />
hoà <strong>10</strong>0 ml dung dịch X cần dùng 200 ml dung dịch NaOH 0,15M. Phần trăm về khối lượng của<br />
nguyên tố lưu huỳnh trong oleum trên là<br />
A. 23,97%. B. 35,95%*. C. 32,65%. D. 37,86%.<br />
Giải<br />
+ Ta có: n NaOH = 0,03 →<br />
n H 2 SO 4<br />
= 0,015 → Trong 200ml có 0,03 mol H 2 SO 4 .<br />
+ Công thức: nSO 3 . H 2 SO 4 bảo toàn cho S: (1 + n)0,015 = 0,03 → n = 1 → %S = 0,3595<br />
Bài 2: Hòa tan 3,38g một oleum vào nước thu được dung dịch A. Để trung hòa A cần 800 ml<br />
dung dịch KOH 0,1M.<br />
a) Hãy xác định công thức của Oleum<br />
b) Cần lấy bao nhiêu gam oleum trên hòa tan vào 200g nước để thu được dung dịch H 2 SO 4 <strong>10</strong>%?<br />
ĐS: a. H 2 SO 4 .3SO 3 . b. 18,87 gam.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 3: Hoà tan 6,67g oleum A vào nước thành 200ml dung dịch H 2 SO 4 . Lấy <strong>10</strong> ml dung dịch này<br />
trung hoà vừa hết 16 ml dung dịch NaOH 0,5M. Xác định công thức của A? ĐS: n = 4.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 4: Hãy xác định công thức oleum tạo thành khi cho 180g dung dịch H 2 SO 4 98% hấp thụ hết<br />
94,08 lít SO 3 (đktc)? ĐS: H 2 SO 4 .2SO 3 .<br />
Bài 5: Cho 24,64 lit SO 3 (đktc) hấp thụ hết vào 90g dd H 2 SO 4 98%, thu được oleum có công thức<br />
H 2 SO 4 .nSO 3 . Tính n? ĐS: H 2 SO 4 .SO 3<br />
Bài 6: Hòa tan hết 1,69 gam oleum có công thức H 2 SO 4 .3SO 3 vào nước dư. Trung hòa dung dịch<br />
thu được cần V ml dung dịch KOH 1M. Giá trị của V là:<br />
A. 20 B. 40 C. 30 D. <strong>10</strong><br />
Bài 7: Hấp thụ m gam SO 3 vào <strong>10</strong>0 gam dung dịch H 2 SO 4 96,4 % thu được một loại oleum có<br />
phần trăm khối lượng SO 3 là 40,82%. Giá trị của m là:<br />
A. <strong>10</strong>4. B. 80. C. 96. D. 98.<br />
Bài 8: Cho 6,76 gam Oleum H 2 SO 4 .nSO 3 vào nước thành 200ml dung dịch. Lấy <strong>10</strong> ml dung dịch<br />
này trung hoà vừa đủ với 16 ml dung dịch NaOH 0,5 M. Giá trị của n là:<br />
A. 2 B. 1 C. 4 D. 3<br />
Bài 9: Khối lượng oleum chứa 71% SO 3 về khối lượng cần lấy để hòa tan vào <strong>10</strong>0 gam dung dịch<br />
H 2 SO 4 60% thì thu được oleum chứa 30% SO 3 về khối lượng là<br />
A. 496,68 gam. B. 506,78 gam. C. 539,68 gam. D. 312,56 gam.<br />
Bài <strong>10</strong>: Một oleum A chứa 37,869% khối lượng S trong phân tử. Trộn m 1 gam A với m 2 gam<br />
dung dịch H 2 SO 4 83,3% được 200 gam oleum B có công thức H 2 SO 4 .2SO 3 . Giả thiết sự hao hụt<br />
khi pha trộn các chất là không đ<strong>án</strong>g kể. Giá trị của m 1 và m 2 lần lượt là<br />
A. 124,85 và 75,15. B. 160,23 và 39,77.<br />
C. 134,56 và 65,44. D. 187,62 và 12,38.<br />
Bài 0: Hoàn thành sơ đồ sau:<br />
X là H2S; Y là SO2; Z là H2SO4.<br />
C<br />
Bài tập nâng cao chương: Oxi – Lưu huỳnh<br />
(1)<br />
2. A = NaHSO3, B = Na2SO3, C = NaHSO4, D = SO2, E là H2SO4 ; F là SO3.<br />
(7)<br />
z<br />
A<br />
E<br />
(5)<br />
X<br />
z<br />
S<br />
(6)<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Bài 1: Cho x mol Fe tan hoàn toàn trong dd chứa y mol H 2 SO 4 (tỉ lệ x : y = 2 : 5), thu được một<br />
sản phẩm khử duy nhất và dd chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị<br />
hoà tan là<br />
A. 3x. B. y. C. 2x. D. 2y.<br />
Bài 2: Cho m gam Mg vào dd chứa 0,06 mol Fe 2 (SO 4 ) 3 . Sau khi pư xảy ra hoàn toàn thu được 3,36<br />
(2)<br />
(8)<br />
Y<br />
(4)<br />
z<br />
B<br />
F<br />
(3)<br />
(9)<br />
D<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
gam chất rắn. Giá trị của m là<br />
A. 2,88. B. 2,16. C. 4,32. D. 5,04.<br />
Bài 3: Nung một hh rắn gồm a mol FeCO 3 và b mol FeS 2 trong bình kín chứa không khí (dư). Sau<br />
khi các pư xảy ra hoàn toàn, đưa bình về nhiệt độ ban đầu, thu được chất rắn duy nhất là Fe 2 O 3 và<br />
hh khí. Biết áp suất khí trong bình trước và sau pư bằng nhau, mối liên hệ giữa a và b là (biết sau<br />
các pư, lưu huỳnh ở mức oxi hoá +4, thể tích các chất rắn là không đ<strong>án</strong>g kể)<br />
A. a = 0,5b. B. a = b. C. a = 4b. D. a = 2b.<br />
Bài 4: Hòa tan hoàn toàn hh X gồm 0,2 mol Fe và 0,2 mol Fe 2 O 3 vào dd H 2 SO 4 loãng, thu được<br />
2,24 lít khí (đktc) và dung dịch Y. Cho lượng dư dung dịch NaOH vào dung dịch Y, sau pư xảy ra<br />
hoàn toàn thu được m gam kết tủa. Giá trị nhỏ nhất của m là bao nhiêu? ĐS: 57,4 gam.<br />
Bài 5: Hòa tan hết a gam hh gồm Mg, Al vào b gam dd H 2 SO 4 80% thu được 8,96 lít hh khí X gồm<br />
SO 2 và H 2 S có tỉ khối so với H 2 bằng 22,625 và dd Y. Cho dd NaOH vào Y để được lượng kết tủa<br />
lớn nhất thì thu được 62,2 gam kết tủa. Tính a, b biết lượng H 2 SO 4 đã lấy dư 20% so với lượng cần<br />
thiết?<br />
ĐS: SO 2 = 0,15 mol; H 2 S = 0,25 mol n e = 2,3 mol Mg = 0,4 mol; Al = 0,5 mol; a = 23,1<br />
gam; b = 227,85 gam.<br />
Bài 6: Có dung dịch A gồm H 2 SO 4 , FeSO 4 và MSO 4 (M là kim loại hoá trị 2) và một dung dịch B<br />
gồm NaOH 0,5M và BaCl 2 dư. Để trung hoà 200ml dung dịch A cần 40ml dung dịch B. Cho 200ml<br />
dung dịch A tác dụng với 300ml dung dịch B, thu được 21,07g kết tủa gồm một muối và hai hiđroxit<br />
của hai kim loại và dung dịch D. Để trung hoà D cần 40ml dung dịch HCl 0,25M.<br />
1. Xác định kim loại M biết khối lượng nguyên tử của nó lớn hơn 23.<br />
2. Tính nồng độ mol/l của các chất trong dung dịch A.<br />
Bài 7: Cần bao nhiêu gam oleum A có công thức H 2 SO 4 .3SO 3 để pha vào <strong>10</strong>0 ml dd H 2 SO 4 40%<br />
(d = 1,31 g/cm 3 ) để tạo ra oleum có hàm lượng SO 3 là <strong>10</strong>%. Viết CTCT của A?<br />
ĐS: 594,1 gam; CTCT: HO-SO2-O-SO2-O-SO2-O-SO2-OH.<br />
Bài 8: Cho <strong>10</strong> gam hỗn hợp X gồm FeO, Fe 2 O 3 , S, FeS 2 và CuS trong đó O chiếm 16% khối lượng<br />
hỗn hợp X tác dụng vừa đủ với 0,4 mol H 2 SO 4 đặc (đun nóng) sinh ra 0,31 mol khí SO 2 và dung<br />
dịch Y. Nhúng thanh Mg dư vào Y sau khi các phản ứng xảy ra hoàn toàn lấy thanh Mg ra cân lại<br />
thấy tăng 2,8 gam (Giả sử <strong>10</strong>0% kim loại sinh ra bám vào thanh Mg). Đốt cháy hoàn toàn <strong>10</strong> gam<br />
X bằng lượng vừa đủ V lít (đktc) hỗn hợp khí A gồm O 2 và O 3 tỷ lệ mol 1:1. Giá trị của V là :<br />
A.1,4336 B.1,5232 C.1,4784 D.1,568<br />
Bài 9: Cho pư: CuFeS 2 + aFe 2 (SO 4 ) 3 + bO 2 + H 2 O → CuSO 4 + FeSO 4 + H 2 SO 4 . Tổng các hệ số<br />
(các số nguyên dương, tối giản, tỉ lệ a : b = 1 : 1) của các chất tham gia phản ứng là:<br />
A. 83 B. 27 C. 53 D. 26<br />
Bài <strong>10</strong>: Cho hỗn hợp X gồm Al và Mg tác dụng với 1 lít dd gồm AgNO 3 a mol/l và Cu(NO 3 ) 2 2a<br />
mol/l, thu được 45,2 gam chất rắn Y. Cho Y tác dụng với dung dịch H 2 SO 4 đặc, nóng (dư) thu được<br />
7,84 lít khí SO 2 (duy nhất, ở đktc). Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là :<br />
A. 0,15. B. 0,20. C. 0,30. D. 0,25.<br />
Bài 11: Cho <strong>10</strong>0 ml dung dịch FeSO 4 1M vào 500 ml dung dịch chứa đồng thời KMnO 4 0,04 M<br />
và H 2 SO 4 1M, thu được dung dịch X. Đem dung dịch X tác dụng với dung dịch Ba(OH) 2 dư thu<br />
được m gam kết tủa. Biết các phản ứng <strong>đề</strong>u xảy ra hoàn toàn. Giá trị của m là<br />
A. 127,20. B. 128,98. C. 152,28. D. 150,58.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 12: Cho từng chất Fe, FeS, FeO, Fe 2 O 3 , Fe 3 O 4 , Fe(OH) 2 , Fe(OH) 3 , FeBr 2 , FeBr 3 , FeCl 2 , FeCl 3<br />
lần lượt tác dụng với dung dịch H 2 SO 4 đặc nóng. Số trường hợp xảy ra phản ứng oxi hóa khử là :<br />
A. 9. B. <strong>10</strong> C. 8 D. 7<br />
Bài tập nồng độ phần trăm<br />
I. Kiến thức cần nắm vững<br />
+ Công thức tính C%:<br />
mct<br />
<br />
+ C% = .<strong>10</strong>0<br />
m DVC%<br />
dd mct<br />
m<br />
=<br />
dd<br />
<strong>10</strong>0<br />
+ D = <br />
V <br />
+ Tính KL dung dịch:<br />
Nếu có một chất tan: m dd = m H2O + m 1 chất tan.<br />
Nếu có nhiều chất tan: m dd = m H2O + m tổng chất tan.<br />
+ Nếu pư có tạo ra chất khí và chất kết tủa thì: m dd sau pư = m trước pư - m khí - m kết tủa.<br />
+ Nếu <strong>đề</strong> bài cho số liệu ở dạng tổng quát thì ta chọn một số thích hợp để giải nhanh.<br />
II. Bài tập.<br />
Bài 1: Khi hoà tan oxit kim loại M hóa trị II bằng một lượng vừa đủ axit dung dịch H 2 SO 4 15,806%<br />
người ta thu được dung dịch muối có nồng độ 18,18%. Vậy kim loại hoá trị II là<br />
A. Ca. B. Ba. C. Be. D. Mg.<br />
Bài 2: Hoà tan hết a(g) oxit MO (M có hoá trị 2 không đổi) bằng một lượng vừa đủ dung dịch<br />
H 2 SO 4 17,5% thu được dung dịch muối có nồng độ 20%. Xác định kim loại M? ĐS: Mg.<br />
Bài 3: Trộn 20 ml dung dịch AgNO 3 1M (d = 1,1g/ml) với 150ml dung dịch HCl 0,5M (d = 1,05g/ml)<br />
thu được dung dịch C. Tính C M và C% của các chất trong dung dịch C.<br />
Bài 4: Đổ <strong>10</strong>40 gam dung dịch BaCl 2 <strong>10</strong>% vào cốc chứa 200 gam dung dịch H 2 SO 4 chưa biết nồng<br />
độ. Sau khi lọc kết tủa, để trung hòa lượng axit dư trong nước lọc cần dùng 250 ml dung dịch NaOH<br />
25% (d = 1,28). Tính C% của dung dịch axít H 2 SO 4 ban đầu? ĐS: 49%<br />
Bài 5: Cho 200 gam dung dịch Na 2 CO 3 tác dụng vừa đủ với <strong>10</strong>0 gam dung dịch HCl. Tính C% của<br />
2 dung dịch đầu, biết rằng khối lượng của dung dịch sau phản ứng là 289 gam.<br />
Bài 6: Cho 200 gam dung dịch Na 2 CO 3 tác dụng vừa đủ với 120 gam dung dịch HCl. Sau phản ứng<br />
thu được dung dịch có nồng độ 20%. Tính C% của 2 dung dịch đầu.<br />
Bài 7: Hoà tan hết <strong>10</strong>,4 gam hỗn hợp Mg, Fe bằng 200 gam dung dịch HCl 14,6% thu được 6,72<br />
lít H 2 (đktc).<br />
1- Tính khối lượng mỗi kim loại trong hỗn hợp đầu.<br />
2-Tính C% các chất trong dung dịch sau phản ứng.<br />
Bài 8: Cho 3,2 gam kim loại M (hoá trị II) tác dụng hết với Cl 2 thu được 6,75 gam muối clorua.<br />
1- Xác định kim loại M.<br />
2- Tính khối lượng MnO 2 và thể tích dung dịch HCl 36,5% (d = 1,18 g/ml) để điều chế lượng<br />
Cl 2 cần dùng cho phản ứng trên?<br />
Bài 9: Hòa tan hoàn toàn <strong>10</strong>,2 gam một oxit kim loại hóa trị 3 cần vừa đủ 331,8 gam dung dịch<br />
H 2 SO 4 . Dung dịch thu được sau phản ứng có nồng độ <strong>10</strong>%.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
1- Tìm tên kim loại 2- Tính C% của dung dịch axit H 2 SO 4 .<br />
3- Cho 0,65 mol NaOH vào dd muối ở trên được bao nhiêu gam kết tủa?<br />
ĐS: 1. Al. 2. 8,86%. 3. 11,7 gam.<br />
Bài <strong>10</strong>: Đun 35,1 gam NaCl với H 2 SO 4 đặc dư ở nhiệt độ cao. Khí sinh ra cho vào 78,1 ml nước<br />
tạo thành dung dịch A có khối lượng riêng d = 1,2 g/ml.<br />
1- Tính C% và C M của dung dịch A.<br />
2- Để trung hòa hết 2<br />
1 dung dịch A cần <strong>10</strong>0 ml dung dịch NaOH (d = 1,05g/ml). Tính C%,<br />
C M của dung dịch NaOH đã dùng.<br />
Bài 11: Cho 31,4 gam hỗn hợp hai muối NaHSO 3 và Na 2 CO 3 vào 400 gam dung dịch H 2 SO 4 9,8%<br />
86<br />
đồng thời đun nóng thu được dd X và hỗn hợp khí A có tỉ khối hơi so với H 2 bằng . 3<br />
Tính C% các chất trong dung dịch X.<br />
Bài 12: Cho 5,67 gam Na 2 SO 3 tác dụng với dung dịch HCl dư, toàn bộ lượng khí SO 2 sinh ra được<br />
hấp thụ hết trong 50 ml dung dịch NaOH 1,5M tạo thành dung dịch X.<br />
1- Tính khối lượng từng muối có trong X.<br />
2- Biết rằng lượng khí SO 2 ở trên làm mất màu vừa đủ 20 ml dung dịch nước Br 2 . Xác định<br />
nồng độ mol/lit của dung dịch nước Br 2 đã dùng?<br />
Bài 13: Đốt cháy hoàn toàn 179,2 lít khí H 2 S (đktc) rồi cho sản phẩm khí tạo thành hấp thụ hết vào<br />
2 lít dd NaOH 25% (d = 1,28) thu được dung dịch A. Tính khối lượng các chất trong A.<br />
Bài 14: Đốt cháy hoàn toàn 5,1 gam một chất khí trong oxi dư chỉ thu được 9,6 gam SO 2 và 2,7<br />
gam H 2 O. Dẫn toàn bộ hỗn hợp sản phẩm vào 40 ml dung dịch NaOH 20% (D=1,25 g/ml) thu được<br />
dung dịch B.<br />
a. Xác định CT của chất khí đem đốt cháy.<br />
b. Tính nồng độ % các chất trong dung dịch B.<br />
Bài 15: Cho 9,2g Na vào 200g dung dịch chứa Fe 2 (SO 4 ) 3 4% và Al 2 (SO 4 ) 3 6,84%. Sau phản ứng,<br />
người ta tách kết tủa ra và nung đến khối lượng không đổi. Tính khối lượng chất rắn thu được sau<br />
khi nung và C% các muối tạo thành trong dung dịch.<br />
ĐS: Na = 0,4 mol; Fe 2 (SO 4 ) 3 = 0,02 mol; Al 2 (SO 4 ) 3 = 0,04 mol chất rắn có: Fe 2 O 3 = 0,02 mol<br />
và Al 2 O 3 = 0,02 mol chất rắn = 5,24 gam.<br />
+ KL dd = 200 + 9,2 – 0,2.2 – 0,04.<strong>10</strong>7 – 0,04.78 = 201,4 gam Na 2 SO 4 = 12,69%; NaAlO 2 =<br />
1,6286%.<br />
Bài 16: Hòa tan hoàn toàn 25 gam một cacbonat kim loại bằng dung dịch HCl 7,3% (vừa đủ) thu<br />
được dung dịch muối có nồng độ phần trăm là <strong>10</strong>,511%.<br />
a. Tìm muối cacbonat đã cho?<br />
b. Khi làm lạnh dung dịch này thấy thoát ra 26,28 gam muối rắn A(ngậm nước) và nồng độ phần<br />
trăm của muối trong dung dịch còn lại là 6,07%. Xác định công thức của muối A?<br />
ĐS: a. CaCO 3 .<br />
b. CaCl 2 .6H 2 O<br />
Bài 17: Hòa tan hoàn toàn m gam oxit MO (M là kim loại) trong 78,4 gam dung dịch H 2 SO 4 6,25%<br />
(loãng) thì thu được dung dịch X trong đó nồng độ H 2 SO 4 còn dư là 2,433%. Mặt khác, khi cho CO<br />
dư đi qua m gam MO nung nóng, sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp khí Y. Cho<br />
Y qua 500 ml dung dịch NaOH 0,1M thì chỉ còn một khí duy nhất thoát ra, trong dung dịch thu<br />
được có chứa 2,96 gam muối.<br />
1. Xác định kim loại M và tính m.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
2. Cho x gam Al vào dung dịch X thu được ở trên, sau khi các phản ứng xảy ra hoàn toàn thu<br />
được 1,12 gam chất rắn. Tính x?<br />
ĐS: 1. M là FeO; m = 2,16 g. 2. x = 0,72 gam.<br />
Bài 18: Đốt cháy hết 4,4 gam một sunfua kim loại có công thức MS (kim loại M có các số oxi hóa<br />
+2 và +3 trong các hợp chất) trong lượng dư oxi. Chất rắn thu được sau pư được hòa tan trong dd<br />
HNO 3 37,8% vừa đủ. Nồng độ % của muối trong dd thu được là 41,7%.<br />
a) Tìm MS? b)Tính khối lượng dd HNO 3 đã dùng.<br />
ĐS: a) MS là FeS. b) 25 gam.<br />
Bài 19: Cho m gam dd H2SO4 nồng độ C% pư hết với một lượng hh hai kim loại kali và magie (dùng dư), thấy<br />
khối lượng khí hiđro bay ra là 0,05m gam. Giá trị của C là:<br />
A. 19,73%. B. 15,80%. C. 17,93%. D. 18,25%.<br />
Bài 20: Khối lượng dd KOH 8% cần lấy cho pư với 47g K2O để thu được dd KOH 21% là:<br />
A. 250 g B. 320g C. 354,85g D. 400g<br />
Bài 21: Nung hh gồm 11,2 gam Fe; 6,4 gam Cu và 19,5 gam Zn với một lượng dư lưu huỳnh đến khi pư hoàn<br />
toàn. Sản phẩm của pư cho t/d với dd HCl dư thu được khí B. Thể tích dung dịch Pb(NO3)2 20% (d = 1,1<br />
g/ml) tối thiểu cần dùng để hấp thụ hết khí B là<br />
A. 752,27 ml B . 902 ,7 3 m l C. <strong>10</strong>53,18 ml D. 9<strong>10</strong>,25 ml<br />
Bài 22: Hoà tan hoàn toàn một lượng hh X gồm Fe3O4 và FeS2 trong 63 gam dd HNO3, thu được 1,568 lít NO2<br />
(đktc). Dd thu được cho pư vừa đủ với 200ml dd NaOH 2M, lọc kết tủa đem nung đến khối lượng không đổi thu<br />
được 9,76 gam chất rắn. Nồng độ % của dd HNO3 có giá trị là:<br />
A.44,2%. B. 47,2%. C. 46,2%. D. 46,6%.<br />
Bài 23: Hoà tan 28,4g photpho (V) oxit trong 500 gam dd axit photphoric có nồng độ 9,8%. Nồng độ phần trăm<br />
của dd axit photphoric thu được là<br />
A. 16,7 %. B. 17,6 %. C. 13,0 %. D. 14,7 %.<br />
Bài 24: Hòa tan hoàn toàn hỗn hợp X gồm Fe và Zn bằng một lượng vừa đủ dung dịch H2SO4 <strong>10</strong>%, thu<br />
được dung dịch Y và 22,4 lít H2 (đktc). Nồng độ của ZnSO4 trong dung dịch Y là 11,6022%. Tính khối<br />
lượng của mỗi kim loại trong hôn hợp X.<br />
Bài tập viết phản ứng và giải thích hiện tượng<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
A. Những chú ý quan trọng<br />
+ Hệ quả suy ra từ dãy hoạt động hóa học của kim loại<br />
Kim loại đứng trước Mg và oxit của nó mới pư (tan) trong nước ở đk thường<br />
Chỉ kim loại đứng trước H mới pư với HCl và H 2 SO 4 loãng<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
HNO 3 , H 2 SO 4 đặc pư được với cả kim loại đứng trước và sau H, riêng Al, Fe, Cr không pư với<br />
hai axit trên ở trạng thái đặc nguội<br />
Kim loại đứng trước(không pư với nước) đẩy được kim loại đứng sau ra khỏi dd muối.<br />
Pư trao đổi chỉ xảy ra khi sản phẩm có: , , H 2 O.<br />
Chỉ những oxit của kim loại đứng sau Al mới pư được với CO, H 2 đun nóng.<br />
+ Cho bazơ pư với muối nhôm thì tạo kết tủa sau đó kết tủa tan ra nếu bazơ dư, để tái tạo kết tủa<br />
ta cho dd thu được pư với CO 2 hoặc HCl<br />
+ Nếu pư tạo ra chất không hoặc ít tan hiện tượng là có kết tủa.<br />
+ Nếu pư tạo ra chất khí không tan trong nước có bọt khí bay ra.<br />
+ Để nêu hiện tượng chính xác ta cần biết <strong>thêm</strong> màu của các chất đặc biệt là màu của kết tủa.<br />
Bài 1: Nêu hiện tượng xảy ra và viết pư trong các TN sau<br />
1. Cho hh Cu, Al và Fe vào dd HCl dư<br />
2. Cho thanh Fe vào dd CuSO 4 màu xanh<br />
3. Cho Na vào dd CuSO 4 màu xanh<br />
4. Cho NaOH vào dd chứa HCl và AlCl 3 .<br />
5. Sục H 2 S vào dd chứa FeCl 2 ; FeCl 3 và CuCl 2 .<br />
Bài 2: Viết pư xảy ra trong các TN sau<br />
1. Cho hh X gồm Na và Al vào nước dư thấy X tan hết<br />
2. Sục hh Y gồm CO 2 , SO 2 vào nước brom dư thấy nước brom bị nhạt màu và có khí bay ra<br />
3. Sục từ từ CO 2 vào nước vôi trong thấy nước vôi trong vẩn đục, sau đó dd lại trong suốt. Đun<br />
nóng dd này lại thấy vẩn đục.<br />
4. Sục SO 2 vào dd thuốc tím thấy dd thuốc tím bị mất màu<br />
5. Cho hh Al và Al 2 O 3 vào dd NaOH dư thu được dd A và khí B. Sục CO 2 dư vào A được kết tủa<br />
C và dd D, đun nóng D thu được dd E và khí CO 2 . Cho E lần lượt pư với CaCl 2 , HCl và AlCl 3 ?<br />
Bài 3: 1. Cho hh Al và Fe vào dd HCl dư được dd X. Thêm NaOH dư vào X được kết tủa Y màu<br />
trắng xanh bị hóa nâu trong kk. Viết pư xảy ra?<br />
2. Hỗn hợp X gồm Fe, Fe 3 O 4 và Fe 2 O 3 . Cho X pư với dd H 2 SO 4 đặc nóng vừa đủ được dd Y và<br />
khí Z làm mất màu nước brom và làm nước vôi trong vẩn đục. Cho Y lần lượt pư với NaOH dư,<br />
Fe dư. Viết pư xảy ra?<br />
Bài 4: Nhiệt phân một lượng MgCO 3 trong một thời gian được chất rắn A và khí B. Cho khí B<br />
hấp thụ hoàn toàn vào dung dịch NaOH thu được dung dịch C. Dung dịch C tác dụng được với<br />
KOH và với BaCl 2 . Cho A tác dụng với dung dịch HCl dư thì thu được khí B và dung dịch D. Cô<br />
cạn dung dịch D được muối khan E, điện phân E nóng chảy được kim loại M. Viết các phương<br />
trình phản ứng xảy ra.<br />
Bài 5: a. Cho Fe 3 O 4 pư với dd H 2 SO 4 loãng dư được dd A. Viết pư của A với.<br />
1. dd NaOH dư. 2. dd KMnO 4 . 3. Cu.<br />
b. Hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO. Cho khí CO qua X nung nóng được chất rắn Y(gồm 7<br />
chất). Hòa Y vào dung dịch NaOH dư, thu được dung dịch Z và chất rắn G. Cho G pư với dd HCl dư.<br />
Bài 6: Nhiệt phân hoàn toàn hỗn hợp gồm: BaCO 3 , MgCO 3 , Al 2 O 3 được chất rắn A và khí D. Hoà<br />
tan chất rắn A trong H 2 O dư, thu được dung dịch B và kết tủa C. Sục khí D dư vào dung dịch B<br />
thấy xuất hiện kết tủa. Hoà tan C trong NaOH dư thấy ta một phần. Viết các phương trình phản<br />
ứng xảy ra và giải thích hiện tượng.<br />
Bài 7: Điện phân nóng chảy muối AX (A là kim loại kiềm, X là halogen)ta thu được chất rắn A và<br />
khí B. Cho A tác dụng với H 2 O được dung dịch A’ và khí B’. Cho B’ tác dụng với B được khí D.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Cho D tác dụng với dung dịch A’ được dung dịch E. Cho một ít quỳ tím vào E. Viết phương trình<br />
phản ứng xảy ra và giải thích sự chuyển màu của quỳ tím.<br />
Bài 8: Hỗn hợp A gồm: BaO, FeO, Al 2 O 3 . Hoà tan A trong lượng nước dư, được dung dịch D và<br />
phần không tan B. Sục khí CO 2 dư vào D, phản ứng tạo kết tủa. Cho khí CO dư đi qua B nung nóng<br />
được chất rắn E. Cho E tác dụng với dung dịch NaOH dư, thấy tan một phần và còn lại chất rắn G.<br />
Hoà tan hết G trong một lượng dư dung dịch H 2 SO 4 loãng rồi cho dung dịch thu được tác dụng với<br />
dung dịch KMnO 4 . Viết các phương trình phản ứng xảy ra.<br />
Bài 9: Cho từ từ HCl vào dd Na 2 CO 3 thấy khí bay ra một lúc thì dừng lại thu được dd X. Viết pư<br />
của X với NaOH, BaCl 2 và Ca(OH) 2 ?<br />
Bài <strong>10</strong>: 1. Cho hh Fe, FeO, Fe 3 O 4 , Fe 2 O 3 pư với dd HCl dư được dd X. Cho X pư với dd AgNO 3<br />
dư. Viết pư xảy ra?<br />
2. Cho hh Na 2 O; Na; Mg; Al 2 O 3 và Al vào nước dư<br />
3. Cho Cl 2 pư với dd NaOH loãng ở t 0 thường, dd KOH đun nóng, dd Ca(OH) 2 dạng vôi sữa.<br />
4. Nhỏ từ từ dd NaOH đến dư vào dd AlCl 3 được dd X. Thêm từ từ HCl đến dư vào X?<br />
Bài 11: Cho 4,48 lít CO 2 ở đktc vào 300 ml dd NaOH 1M được dd X. Viết pư của X với HCl; dd<br />
NaOH; nước vôi trong dư;dd NaHSO 4 ; dd AlCl 3 ?<br />
Bài 12: Nêu hiện tượng và viết pư xảy ra khi cho Ba lần lượt vào dd NaCl; Na 2 SO 4 ; CuSO 4 ;<br />
Al(NO 3 ) 3 .<br />
Bài 13: Trình bày những hiện tượng xảy ra và viết các phương trình phản ứng giải thích từng trường<br />
hợp sau:<br />
a- Nhỏ từ từ dung dịch NaOH vào dung dịch Al 2 (SO 4 ) 3 đến dư<br />
b- Nhỏ từ từ dung dịch AlCl 3 vào dung dịch NaOH đến dư<br />
c- Nhỏ từ từ dung dịch HCl vào dung dịch Na 2 CO 3 .<br />
d- Nhỏ từ từ dung dịch Na 2 CO 3 vào dung dịch HCl<br />
Bài 14: Cho hh Al và Al 2 O 3 vào dd NaOH dư được dd X. Chia X thành hai phần bằng nhau<br />
+ Sục CO 2 đến dư vào phần 1<br />
+ Sục HCl đến dư vào phần 2<br />
Nêu hiện tượng và viết pư xảy ra?<br />
Bài 15: Hãy mô tả hiện tượng và viết các phương trình phản ứng xảy ra khi:<br />
a- Cho dòng khí CO 2 liên tục đi qua dung dịch Ca(OH) 2 .<br />
b- Cho dòng khí SO 2 vào dung dịch nước brom cho đến dư.<br />
c- Cho dần dần đến dư dung dịch KMnO 4 vào cốc đựng dung dịch hỗn hợp FeSO 4 và H 2 SO 4 .<br />
Bài 16: Cho khí CO qua hh X gồm Fe 2 O 3 và Al 2 O 3 thu được chất rắn Y(gồm 5 chất). Hòa tan Y<br />
trong dd H 2 SO 4 loãng dư được dd Z. Chia Z làm hai phần<br />
+ Thêm NaOH dư vào phần 1.<br />
+ Thêm thuốc tím vào phần 2.<br />
Nêu hiện tượng và viết pư xảy ra?<br />
Bài 17: Hoà tan Fe 3 O 4 trong dung dịch H 2 SO 4 loãng dư được dung dịch A. Cho 1 lượng Fe vừa đủ<br />
vào dung dịch A thu được dung dịch B.<br />
- Cho dung dịch B tác dụng với dung dịch KOH dư thu được dung dịch D và kết tủa E. Nung E<br />
trong không khí ở nhiệt độ cao đến khối lượng không đổi được chất rắn F<br />
- Thổi một luồng CO qua ống sứ nung nóng chứa F đến dư thu được chất rắn G và khí X. Sục khí<br />
X vào dung dịch Ba(OH) 2 thì thu được kết tủa Y và dung dịch C. Lọc bỏ kết tủa Y, đun nóng<br />
dd C lại tạo kết tủa Y. Hãy xác định các chất có trong A, C, B, D, E, F, G, X, Y.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 18: Nung hỗn hợp gồm KClO 3 , KMnO 4 và Mg đến phản ứng hoàn toàn thu được chất rắn<br />
A(gồm 5 chất). Cho A phản ứng với dung dịch HCl loãng dư thu được hh khí C. Viết các phương<br />
trình phản ứng có thể xảy ra.<br />
Bài 19: Mô tả hiện tượng, viết phương trình phản ứng nếu có:<br />
1. Cho dd HCl vào: M 2 (CO 3 ) n , A x O y , Fe 3 O 4 ; KMnO 4 ; FeS; Pb(NO 3 ) 2 .<br />
2. Cho dd HF vào các chất bột: Cu, Al, CaO, NaOH, SiO 2 , C, AgNO 3 .<br />
Bài 20: Đốt cacbon trong không khí ở nhiệt độ cao, được hỗn hợp khí A. Cho A tác dụng với Fe 2 O 3<br />
nung nóng được khí B và hỗn hợp rắn C. Cho B tác dụng với dung dịch Ca(OH) 2 được kết tủa K<br />
và dung dịch D; đun sôi D lại được kết tủa K. Cho C tan trong dung dịch HCl, thu được khí và dung<br />
dịch E. Cho E tác dụng với dung dịch NaOH dư được hỗn hợp kết tủa hiđroxit F. Nung F trong<br />
không khí thu được một oxit duy nhất. Viết phương trình phản ứng.<br />
Bài 21: Cho bột Fe vào dung dịch CuSO 4 thì màu xanh của dung dịch nhạt dần, ngược lại khi cho<br />
Cu vào dung dịch Fe 2 (SO 4 ) 3 thì màu xanh của dung dịch lại đậm dần. Giải thích hiện tượng xảy ra<br />
và viết các phương trình phản ứng.<br />
Bài 22: Phân huỷ hoàn toàn a gam CaCO 3 để lấy khí CO 2 . Điện phân dung dịch chứa b gam<br />
NaCl(với điện cực trơ màng ngăn xốp) tới khi còn lại 25% NaCl không bị điện phân và tách lấy<br />
dung dịch NaOH(dung dịch X). Cho khí CO 2 ở trên hấp thụ hoàn toàn vào dung dịch X ta được<br />
dung dịch Y. Biết dung dịch Y vừa tác dụng được với KOH và BaCl 2 .<br />
a. Viết các phương trình phản ứng xảy ra?<br />
b. Lập biểu thức liên hệ giữa a và b?<br />
Bài 23: Hỗn hợp A gồm: Fe 3 O 4 , Al, Al 2 O 3 . Cho A tan trong dung dịch NaOH dư được chất rắn B<br />
dung dịch C và chất khí E. Cho khí E tác dụng với A nung nóng, được chất rắn F gồm 5 chất. Hãy<br />
viết các phương trình phản ứng xảy ra.<br />
Bài 24: Hoà tan hỗn hợp gồm: Na 2 O, BaCl 2 , NaHCO 3 , NH 4 Cl có số mol mỗi chất bằng nhau vào<br />
nước và đun nóng nhẹ, sau khi kết thúc thí nghiệm thu được dung dịch A. Hỏi dung dịch chứa<br />
những chất gì.<br />
Bài 25: Đem đốt bột Fe trong không khí được hợp chất A, hoà tan A trong dung dịch HCl dư được<br />
dung dịch B. Cho NaOH dư vào dung dịch B rồi đun nóng trong không khí cho phản ứng được xảy<br />
ra hoàn toàn. Lọc lấy kết tủa rồi đem nung tới khối lượng không đổi. Viết các phương trình phản<br />
ứng xảy ra.<br />
Bài 26: Một hỗn hợp D gồm KMnO 4 & KClO 3 . Nung hoàn toàn D được hỗn hợp A. A tác dụng<br />
với axit A 1 tạo khí B, B tác dụng với B 1 tạo ra clorua vôi, clorua vôi tác dụng với H 2 SO 4 loàn thu<br />
được chất khí B. Mặt khác, khi cho dây Fe nung nóng cháy trong khí B tạo thành chất B 2 . Viết các<br />
phương trình phản ứng xảy ra.<br />
Bài 27: Hỗn hợp A gồm Fe 3 O 4 , Al, Al 2 O 3 và Fe. Cho A tác dụng với dung dịch NaOH dư được<br />
chất rắn A 1 , dung dịch B 1 và khí C 1 . Khí C 1 dư tác dụng với A nung nóng được hỗn hợp chất rắn<br />
A 2 . Dung dịch B 1 tác dụng với dung dịch H 2 SO 4 loãng dư được dung dịch B 2 . Chất rắn A 2 tác dụng<br />
với dung dịch H 2 SO 4 đặc nóng thu được dung dịch B 3 và khí C 2 . Cho B 3 tác dụng với bột sắt được<br />
dung dịch B 4 . Viết các phương trình phản ứng xảy ra.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Chuyên <strong>đề</strong>: Giải nhanh bài tập trắc nghiệm bằng sơ đồ<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
I/ Phương pháp giải<br />
Trong nhiều bài tập có rất nhiều pư xảy ra theo nhiều giai đoạn liên tiếp nhưng ta không cần thiết<br />
phải sử dụng tất cả các chất trong đó, vì vậy để giải nhanh bài to<strong>án</strong> này ta làm như sau:<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
+ Lập sơ đồ pư: có thể lập đầy đủ hoặc chỉ cần lập chất đầu và chất cuối<br />
+ Dựa vào sơ đồ pư và định luật bảo toàn nguyên tố để giải bài to<strong>án</strong><br />
+ ĐK để áp dụng phương pháp này:<br />
Nguyên tố được dùng để áp dụng ĐLBTNT phải không bị thất thoát trong quá trình<br />
phản ứng<br />
Thường áp dụng cho BT trắc nghiệm, ít áp dụng cho bài tập tự luận<br />
VD: Trong hai sơ đồ sau thì chỉ có sơ đồ 1 là áp dụng được<br />
1. FeS 2 → SO 2 → SO 3 → H 2 SO 4 mol H 2 SO 4 = 2.mol FeS 2 .<br />
+Ca(OH) 2<br />
2. C → CO và CO 2 ⎯⎯⎯⎯→ CaCO 3 mol C = mol CaCO 3 là sai.<br />
II/ Bài tập<br />
Bài 1: Hòa tan hh X gồm 0,1 mol Fe; 0,15 mol FeO; 0,05 mol Fe 3 O 4 và 0,1 mol Fe 2 O 3 vào dd<br />
HCl dư được dd Y. Cho Y + NaOH dư rồi nung kết tủa sinh ra trong kk đến khối lượng không đổi<br />
được m gam chất rắn Z. Tính m? ĐS: m = 48 gam<br />
Bài 2: Cho một hh A gồm Fe, Fe 2 O 3 , FeO, Fe 3 O 4 tác dụng hoàn toàn với H 2 SO 4 loãng dư sau<br />
phản ứng thu được dd B và khí H 2 . Cho dd B tác dụng hoàn toàn với NaOH dư thu được kết tủa<br />
E. Nung kết tủa E trong không khí đến khối lượng không đổi thu được 16 gam chất rắn F. Mặt<br />
khác cho một luồng khí CO dư đi qua hh A thì thu đựợc m gam chất rắn. Tính m . Biết các phản<br />
ứng <strong>đề</strong>u sẩy ra hoàn toàn . ĐS: 11,2 gam<br />
Bài 3: Tính khối lượng sắt pirit cần dùng để điều chế 50 tấn axit sunfuric 98% biết hiệu suất cả<br />
quá trình là 80%?<br />
Bài 4: Hoà tan hoàn toàn a gam một oxit sắt bằng dung dịch H 2 SO 4 đặc vừ đủ có chứa 0,075 mol<br />
H 2 SO 4 thu được b gam muối và có 168ml khí SO 2 (đktc) duy nhất thoát ra. Tính b?<br />
A. 8 gam. B. 9 gam. C. 16 gam. D. 12 gam.<br />
Bài 5: Hòa tan hoàn toàn hh X gồm 0,2 mol Fe; 0,2 mol FeO và 0,1mol Fe 2 O 3 vào dd H 2 SO 4 loãng,<br />
dư thu được dd A và khí B. Dd A cho tác dụng với dd NaOH dư thu được kết tủa. Lấy toàn bộ kết<br />
tủa nung trong không khí đến khối lượng không đổi thu được chất rắn có khối lượng là<br />
A. 23,0 gam. B. 32,0 gam. C. 16,0 gam. D. 48,0 gam.<br />
Bài 6: Cho 5,6 gam Fe tác dụng hòan toàn với O 2 thu được chất rắn gồm Fe, Fe 2 O 3 , FeO, Fe 3 O 4 .<br />
Hòa tan hoàn toàn chất rắn trên trong HNO 3 dư thu được dd A. Cho dd A tác dụng hoàn toàn với<br />
NaOH dư thu được kết tủa E. Nung kết tủa E trong không khí đến khối lượng không đổi thu được<br />
m gam chất rắn. Tính m A. 16 gam B. 8 gam C. 4 gam D. 32 gam<br />
Bài 7: Cho 50 gam hh gồm FeSO 4 và Fe 2 (SO 4 ) 3 trong đó S chiếm 22 % về khối lượng. Đem hòa<br />
tan hh trên vào nước để được dd A. Cho dd A tác dụng hoàn toàn với NaOH dư thu được kết tủa.<br />
Nung kết tủa trong không khí đến khối lượng không đổi thu được m gam chất rắn. Tính m<br />
A. 26,378 gam B. 24,286gam C. 25,376 gam D. 29,765gam<br />
Bài 8: Hòa tan m gam Fe và FeO bằng HCl vừa đủ được 1,12 lít khí (đktc) và thu được dd D. Cho<br />
D tác dụng với NaOH dư, lọc kết tủa đem nung trong không khí đến khối lượng không đổi được<br />
chất rắn nặng 12 gam. Trị số của m là: A. 4,6 gam B. 5,0 gam C. 9,2 gam D. <strong>10</strong>,0 gam<br />
Bài 9: Cho một luồng khí CO đi qua ống đựng 0,01 mol FeO và 0,03 mol Fe 2 O 3 (hh A) đốt nóng.<br />
Sau khi kết thúc thí nghiệm thu được 4,784 gam chất rắn B gồm 4 chất. Hoà tan chất rắn B bằng<br />
dd HCl dư thấy thoát ra 0,6272 lít H 2 (ở đktc). Tính số mol oxit sắt từ trong hh B. Biết rằng trong<br />
B số mol oxit sắt từ bằng 1.3 tổng số mol sắt (II) oxit và sắt (III) oxit.<br />
A. 0,006. B. 0,008. C. 0,01. D. 0,012.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài <strong>10</strong>: Khử hết m gam Fe 3 O 4 bằng CO thu được hh A gồm FeO và Fe. A tan vừa đủ trong 0,3 lít<br />
dd H 2 SO 4 1M cho ra 4,48 lít khí (đktc). Tính m?<br />
A. 23,2 gam. B. 46,4 gam. C. 11,2 gam. D. 16,04 gam.<br />
Bài 11: Cho khí CO đi qua ống sứ chứa 16 gam Fe 2 O 3 đun nóng, sau phản ứng thu được hh rắn X<br />
gồm Fe, FeO, Fe 3 O 4 , Fe 2 O 3 . Hòa tan hoàn toàn X bằng H 2 SO 4 đặc, nóng thu được dd Y. Cô cạn dd<br />
Y, lượng muối khan thu được là: A. 20 gam. B. 32 gam. C. 40 gam. D. 48 gam.<br />
Bài 12: Hòa tan hoàn toàn hh gồm 0,27 gam Al và 2,04 gam Al 2 O 3 trong dd NaOH dư thu được<br />
dd X. Cho CO 2 dư pư với X được kết tủa Y. Nung Y ở nhiệt độ cao đến khối lượng không đổi<br />
được bao nhiêu gam chất rắn:A. 2,04 gam. B. 2,31 gam. C. 3,06 gam. D. 2,55 gam.<br />
Bài 13: Đun nóng hh gồm 0,06 mol Al; 0,01 mol Fe 3 O 4 : 0,015 mol Fe 2 O 3 và 0,02 mol FeO một<br />
thời gian. Hòa tan hh sau pư bằng dd HCl dư được dd X. Thêm amoniac dư vào X rồi nung kết<br />
tủa sinh ra đến khối lượng không đổi được bao nhiêu gam chất rắn:<br />
A. 9,46. B. 7,78. C. 6,40. D. 6,16.<br />
Bài 14: Lấy a mol NaOH để hấp thụ hết 2,64 gam CO 2 thu được 200 ml dd D không chứa NaOH<br />
2-<br />
và có nồng độ của CO 3 = 0,2M. Tính a? A. 0,12. B. 0,08. C. 0,06. D. 0,<strong>10</strong>.<br />
Bài 15: (CĐ - 2008) Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp<br />
rắn gồm CuO, Fe 2 O 3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X.<br />
Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH) 2 thì tạo thành 4 gam kết tủa. Giá trị của<br />
V là A. 1,120. B. 0,896. C. 0,448. D. 0,224.<br />
Bài 16: Cho hỗn hợp gồm 0,27 g Al và 2,04 g Al 2 O 3 tan hoàn toàn trong dd NaOH thu được dd<br />
X. Cho CO 2 dư tác dụng với dd X thu được kết tủa X 1 , nung X 1 ở nhiệt độ cao đến khối lượng<br />
không đổi thu được oxit X 2 . Các pư xảy ra hoàn toàn. Khối lượng X 2 là<br />
A. 1,02 gam B. 2,55 g C. 2,04 g D. 3,06 g<br />
Bài 17: Hợp chất A (không chứa clo) cháy đ ược trong khí clo tạo thành nitơ và hiđro clorua. Biết tỉ<br />
lệ thể tích clo tham gia phản ứng v à thể tích nitơ tạo thành là 3 : 1. Công thức phân tử của khí A là :<br />
A. N3H. B. NH3. C. N2H4. D. Không xác định được.<br />
Bài 18 : Đốt cháy hoàn toàn 3,4 gam hợp chất A thu được 2,24 lít khí SO2 (đkc) và 1,8 gam H2O.<br />
Xác định công thức phân tử của hợp chất A? ĐS : H 2 S<br />
Bài 19: Cho hỗn hợp Fe và FeS tác dụng với dung dịch HCl (d ư), thu được 2,464 lít hỗn hợp khí ở<br />
điều kiện tiêu chuẩn. Dẫn hỗn hợp khí này qua dung dịch Pb(NO3)2 dư, sinh ra 23,9 gam kết tủa đen.<br />
Phần trăm khối lượng của Fe và FeS trong hỗn hợp lần lượt là :<br />
A. 5,98% và 94,02%. B. 94,02% và 5,98%. C. 25% và 75%. D. 75% và 25%.<br />
Bài 20: Đem 11,2 gam Fe để ngoài không khí, sau một thời gian thu được một hỗn hợp gồm Fe và<br />
các oxit. Hòa tan hoàn toàn h ỗn hợp đó trong dung dịch H 2SO4 đặc, nóng dư thu được 3,36 lít<br />
khí SO2 (đktc). Số mol H2SO4 đã tham gia phản ứng là :<br />
A. 0,4 mol. B. 0,3 mol. C. 0,5 mol. D. 0,45 mol.<br />
Bài 21: Khử 16 gam Fe2O3 bằng CO thu được hh A gồm Fe, Fe 2O3, FeO, Fe3O4. Cho A tác dụng<br />
hết với dd H2SO4 đặc, nóng. Khối lượng muối sunfat tạo ra trong dung dịch là :<br />
A. 48 gam. B. 50 gam. C. 32 gam. D. 40 gam.<br />
Bài 22: Cho hh X gồm SO2 và O2 theo tỷ lệ số mol 1:1 đi qua V2O5 xúc tác, đun nóng thu được hỗn<br />
hợp Y có khối lượng 19,2 gam. Hoà tan Y vào nước sau đó <strong>thêm</strong> Ba(NO3)2 dư thu được 37,28<br />
gam kết tủa. Hiệu suất phản ứng SO2 + O2 là : A. 40%. B. 75%. C. 80%. D. 60%.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Giải bài tập bằng phương pháp đường chéo<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Dạng 1: Trộn lẫn 2 dung dịch có cùng chất tan<br />
Dung dịch 1 : có khối lượng m 1 , thể tích V 1 , nồng độ C 1 (C% hoặc C M ), khối lượng riêng d 1 .<br />
Dung dịch 2 : có khối lượng m 2 , thể tích V 2 , nồng độ C 2 (C 2 > C 1 ), khối lượng riêng d 2 .<br />
Dung dịch thu được có m = m 1 + m 2 , V = V 1 + V 2 , nồng độ C (C 1 < C < C 2 ), khối lượng riêng d.<br />
Sơ đồ đường chéo và công thức tương ứng với mỗi trường hợp là :<br />
a) Đối với nồng độ % về khối lượng:<br />
m 1 C 1<br />
C<br />
|C 2 - C|<br />
m 2 C 2 |C 1 - C|<br />
b) Đối với nồng độ mol/lít:<br />
c) Đối với khối lượng riêng:<br />
V 1 C 1 C<br />
|C 2 - C|<br />
V 2 C 2 |C 1 - C|<br />
V 1 d 1 d<br />
|d 2 - d|<br />
V 2 d 2 |d 1 - d|<br />
Khi sử dụng sơ đồ đường chéo ta cần chú ý:<br />
*) Chất rắn coi như dung dịch có C = <strong>10</strong>0%<br />
*) Dung môi coi như dung dịch có C = 0%<br />
*) Khối lượng riêng của H 2 O là d = 1 g/ml<br />
→<br />
→<br />
→<br />
m<br />
m<br />
V<br />
V<br />
1<br />
2<br />
1<br />
2<br />
V<br />
V<br />
1<br />
2<br />
| C2<br />
−C |<br />
=<br />
| C − C |<br />
1<br />
| C2<br />
− C |<br />
=<br />
| C − C |<br />
1<br />
| d<br />
=<br />
| d<br />
2<br />
1<br />
− d |<br />
− d |<br />
Sau đây là một số ví dụ sử dụng phương pháp đường chéo trong tính to<strong>án</strong> pha chế dung dịch.<br />
VD1: Để thu được dung dịch HCl 25% cần lấy m 1 gam dung dịch HCl 45% pha với m 2 gam dung<br />
dịch HCl 15%. Tính tỉ lệ m1.m2?<br />
Hướng dẫn giải:<br />
m<br />
1<br />
| 15 − 25 | <strong>10</strong> 1<br />
Áp dụng công thức (1): = = =<br />
m |45 − 25| 20 2<br />
2<br />
Ví dụ 1. Để pha được 500 gam dung dịch nước muối sinh lí (C = 0,9%) cần lấy v1 gam dung dịch<br />
NaCl 3% và v2 gam nước. Tính v1 và v2?<br />
Hướng dẫn giải:<br />
V 1 (NaCl) 3 |0 - 0,9|<br />
Ta có sơ đồ:<br />
0,9<br />
V 2 (H 2 O) 0 |3 - 0,9|<br />
v1<br />
0,9<br />
v 1 + v 2 = 500 và = v 1 = 150 gamvà v 2 = 350 gam.<br />
v 2,1<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2<br />
VD3: Cần bao nhiêu lít axit H 2 SO 4 (D = 1,84 gam/ml) và bao nhiêu lít nước cất để pha thành 9 lít<br />
dung dịch H 2 SO 4 có D = 1,28 gam/ml ? Biết khối lượng riêng của nước là 1 gam/ml<br />
(1)<br />
(2)<br />
(3)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Áp dụng công thức:<br />
suy ra<br />
V<br />
1<br />
| d2<br />
− d |<br />
=<br />
V |d − d|<br />
2 1<br />
hay<br />
Giải<br />
V 1 d 1<br />
d<br />
|d 2 - d|<br />
V 2 d 2 |d 1 - d|<br />
V<br />
1<br />
| 1 −1,28<br />
|<br />
=<br />
V |1,84 −1,28|<br />
và V 1 + V 2 = 9 V 1 = 3 lít và V 2 = 6 lít.<br />
2<br />
Bài tập tự giải dạng 1<br />
Bài 1: Để pha được 500 ml dung dịch NaCl 0,9M cần lấy V ml dung dịch NaCl 3M pha với nước<br />
cất. Giá trị của V là :<br />
A. 150 ml. B. 214,3 ml. C. 285,7 ml. D. 350 ml.<br />
Bài 2: Để thu được dung dịch HCl 25% cần lấy m 1 gam dung dịch HCl 35% pha với m2 gam dung<br />
dịch HCl 15%. Tỉ lệ m1.m2 là :<br />
A. 1:2. B. 1:3. C. 2:1. D. 1:1.<br />
Bài 3: Để thu được dung dịch CuSO 4 16% cần lấy m1 gam tinh thể CuSO 4 .5H 2 O cho vào m2 gam<br />
dung dịch CuSO 4 8%. Tỉ lệ m1.m2 là<br />
A. 1.3 B. 1.4 C. 1.5 D. 1.6<br />
Bài 4: Số lít nước nguyên chất cần <strong>thêm</strong> vào 1 lít dung dịch H 2 SO 4 98% (d = 1,84 g/ml) để được<br />
dung dịch mới có nồng độ <strong>10</strong>% là<br />
A. 14,192 B. 15,192 C. 16,192 D. 17,192<br />
Bài 5: Một dd HCl nồng độ 35% và 1 dd HCl khác có nồng độ 15%. Để thu được dd mới có nồng<br />
độ 20% thì cần phải pha chế 2 dd này theo tỉ lệ khối lượng là<br />
A. 1:3 B. 3:1 C. 1:5 D. 5:1<br />
Bài 6: Khối lượng dd NaCl 15% cần trộn với 200g dd NaCl 30% để thu được dd NaCl 20% là<br />
A. 250g B. 300g C. 350g D. 400g<br />
Bài 7: Thể tích nước và dd MgSO 4 2M cần để pha được <strong>10</strong>0ml dd MgSO 4 0,4M lần lượt là<br />
A. 50 và 50ml B. 40 và 60ml C. 80 và 20 ml D. 20 và 80ml<br />
Bài 8: Một dd NaOH nồng độ 2M và một dd NaOH khác nồng độ 0,5M. Để có dd mới nồng độ<br />
1M thì cần phải pha chế về thể tích giữa 2 dd theo tỉ lệ là<br />
A. 1 :2 B. 2 :1 C. 1 :3 D. 3 :1<br />
Bài 9: Thể tích nước nguyên chất cần <strong>thêm</strong> vào 1 lít dung dịch H 2 SO 4 98% (d = 1,84 g/ml) để được<br />
dung dịch mới có nồng độ <strong>10</strong>% là<br />
A. 14,192 ml. B. 15,192 ml. C. 16,192 ml. D. 17,192 ml.<br />
Bài <strong>10</strong>: Dung dịch rượu etylic 13,8 o có d (g/ml) =?. Biết d<br />
C2H5OH(ng.chÊt)<br />
= 0,8 g/ml ; d<br />
HO= 1 g ml .<br />
2<br />
A. 0,805. B. 0,8 55. C. 0,972. D. 0,915.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Dạng 2: Hòa tan một chất vào dd để được dd chứa một chất tan duy nhất<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
TH1: Hòa tan tinh thể vào dd thì ta coi tinh thể là một dd, tính C% của dd này rồi áp dụng công<br />
thức (1)<br />
VD1: Cần lấy bao nhiêu gam tinh thể CuSO4.5H2O và bao nhiêu gam dung dịch CuSO4 8% để<br />
pha thành 280 gam dung dịch CuSO4 16% ?<br />
A. 180 gam và <strong>10</strong>0 gam. B. 330 gam và 250 gam.<br />
C. 60 gam và 220 gam. D. 40 gam và 240 gam.<br />
Giải<br />
mchÊt<br />
tan<br />
160<br />
+ Coi dd CuSO 4 .5H 2 O là dd CuSO 4 với C% = .<strong>10</strong>0% = .<strong>10</strong>0% = 64%.<br />
mdd<br />
160 + 18.5<br />
m2<br />
64 −16<br />
+ Áp dụng công thức (1) ta có: = và m 1 + m 2 = 280 m 2 = 240 và m 1 = 40 gam.<br />
m1<br />
16 − 8<br />
TH2: Hòa tan hòa tan khí hoặc oxit vào dung dịch thì ta ta được dd chứa một chất tan duy nhất<br />
do chất khí hoặc oxit đó pư với nước. Để giải dạng này ta coi oxit đó là một dung dịch chất tan có<br />
nồng độ phần trăm là: C% =<br />
m<br />
m<br />
chÊt<br />
tan<br />
oxit<br />
<strong>10</strong>0% (C% ><strong>10</strong>0%), sau đó áp dụng công thức (1).<br />
VD1: Hòa tan 200 gam SO 3 vào m gam dung dịch H 2 SO 4 49% ta được dung dịch H 2 SO 4 78,4%.<br />
Giá trị của m là:<br />
A. 133,3 B. 146,9 C. 272,2 D. 300,0<br />
Phương trình phản ứng: SO 3 + H 2 O → H 2 SO 4<br />
Coi SO 3 là dd H 2 SO 4 có C% =<br />
98<br />
80<br />
Hướng dẫn giải:<br />
= 122,5%<br />
Gọi m 1 , m 2 lần lượt là khối lượng SO 3 và dung dịch H 2 SO 4 49% cần lấy. Theo (1) ta có:<br />
m<br />
m<br />
<br />
2<br />
| 49 − 78,4 |<br />
=<br />
|122,5 − 78,4 |<br />
1<br />
=<br />
29,4<br />
44,1<br />
44,1<br />
m 2<br />
= 200 = 300 (gam)<br />
29,4<br />
Đáp <strong>án</strong> D.<br />
Bài tập tự giải dạng 2<br />
Bài 1: Hòa tan hoàn toàn m gam Na 2 O nguyên chất vào 40 gam dung dịch NaOH 12% thu được<br />
dung dịch NaOH 51%. Giá trị của m (gam) là<br />
A. 11,3 B. 20,0 C. 31,8 D. 40,0<br />
Bài 2: Lượng SO 3 cần <strong>thêm</strong> vào dd H 2 SO 4 <strong>10</strong>% để được <strong>10</strong>0 gam dung dịch H 2 SO 4 20% là<br />
A. 2,5 gam. B. 8,88 gam. C. 6,66 gam. D. 24,5 gam.<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Dạng 3: Bài to<strong>án</strong> hỗn hợp 2 đồng vị<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Số khối<br />
% nguyên tử<br />
Đồng vị 1 A 1 x 1<br />
Đồng vị 1 A 2 x 2<br />
Hỗn hợp đvị A <strong>10</strong>0%<br />
x A<br />
1<br />
2<br />
− A<br />
= và x 1 + x 2 = <strong>10</strong>0.<br />
x A − A<br />
2 1<br />
VD1: Nguyên tử khối trung bình của brom là 79,319. Brom có hai đồng vị bền:<br />
81<br />
Thành phần % số nguyên tử của 35Br<br />
là:<br />
A. 84,05 B. 81,02 C. 18,98 D. 15,95<br />
81<br />
35<br />
79<br />
35<br />
Ta có sơ đồ đường chéo:<br />
Br (M=81)<br />
Br (M=79)<br />
<br />
% 81 Br<br />
35<br />
=<br />
15,95%<br />
A=79,319<br />
Đáp <strong>án</strong> D.<br />
79,319 - 79 = 0,319<br />
81 - 79,319 = 1,681<br />
Hướng dẫn giải:<br />
<br />
81<br />
%<br />
35Br<br />
0,319 81<br />
= %<br />
79<br />
35<br />
%<br />
35Br<br />
1,681<br />
79<br />
81<br />
35<br />
Br và<br />
35<br />
Br.<br />
0,319<br />
Br =<br />
<strong>10</strong>0%<br />
1,681+<br />
0,319<br />
VD2: Trong nước, hiđro tồn tại hai đồng vị 2 là 1 H và 2 H. Biết nguyên tử khối trung bình của hiđro<br />
là 1,008; của oxi là 16. Số nguyên tử đồng vị của 2 H có trong 1 ml nước nguyên chất (d = 1<br />
gam/ml) là: A. 5,53.<strong>10</strong>20. B. 5,35.<strong>10</strong>20. C. 3,35.<strong>10</strong>20. D. 4,85.<strong>10</strong>20.<br />
Giải<br />
+ Áp dụng sơ đồ đường chéo ta có:<br />
+ Số mol H 2 O =<br />
1<br />
18<br />
Số nguyên tử 2 H =<br />
số mol H =<br />
0,016 .6,02.<strong>10</strong><br />
3<br />
18<br />
sè ngtö H sè mol H 2 −1,008 0,992 99,2%<br />
= = = =<br />
sè ngtö H s H 1,008 −1 0,008 0,8%<br />
2<br />
18<br />
1 1<br />
1 1<br />
2 2<br />
1<br />
è mol<br />
1<br />
số mol 2 H =<br />
= 5,35.<strong>10</strong> 20 .<br />
2 0,016<br />
.0,8% =<br />
18 18<br />
Bài tập tự giải dạng 3<br />
Bài 1: Nguyên tử khối trung bình của đồng 63,54. Đồng có hai đồng vị bền là<br />
mol<br />
Cu vµ Cu . Tính %<br />
63 65<br />
29 29<br />
63 65<br />
số nguyên tử 29Cu<br />
vµ<br />
29Cu<br />
? ĐS :<br />
Bài 2: Nguyên tử khối trung bình của clo là 35,5. Trong tự nhiên clo có hai đồng vị bền là<br />
35 A<br />
Cl(75%) vµ Cl(25%) . Tính A ?<br />
17 17<br />
35 37<br />
Bài 3: Nguyên tử khối TB của clo là 35,5. Clo trong tự nhiên có 2 đvị là 17Cl(75%)<br />
vµ<br />
17Cl(25%)<br />
Phần trăm về khối lượng của chứa trong HClO4 (với hiđro là đồng vị 1 H , oxi là đồng vị 16 1 8O ) là giá<br />
trị nào sau đây ? A. 9,20%. B. 8,95%. C. 9,67%. D. 9,40%.<br />
Dạng 4: Tính tỉ lệ thể tích hỗn hợp 2 khí<br />
Nguyên tử khối<br />
Số mol<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Khí 1 M 1 x 1<br />
Khí 1 M 2 x 2<br />
Hỗn hợp khí M x 1 + x 2<br />
phương trình….<br />
VD1: Một hỗn hợp gồm O 2 , O 3 ở điều kiện tiêu chuẩn có tỉ khối đối với hiđro là 18. Thành phần<br />
% về thể tích của O 3 trong hỗn hợp là:<br />
A. 15% B. 25% C. 35% D. 45%<br />
Áp dụng sơ đồ đường chéo:<br />
<br />
V<br />
V<br />
O<br />
O<br />
3<br />
2<br />
4 1<br />
= = %V<br />
12 3<br />
O<br />
3<br />
Hướng dẫn giải:<br />
V M 1 = 48 |32 - 36|<br />
O 3<br />
M = 18.2 =36<br />
V M 2 = 32 |48 - 36|<br />
O 2<br />
1<br />
= <strong>10</strong>0%<br />
= 25%<br />
3 + 1<br />
VD2: Cần trộn 2 thể tích metan với một thể tích đồng đẳng X của metan để thu được hỗn hợp khí<br />
có tỉ khối hơi so với hiđro bằng 15. X là:<br />
A. C 3 H 8 B. C 4 H <strong>10</strong> C. C 5 H 12 D. C 6 H 14<br />
Giải<br />
Ta có sơ đồ đường chéo:<br />
<br />
V<br />
V<br />
CH<br />
M<br />
2<br />
V M 1 = 16 |M 2 - 30|<br />
CH 4<br />
M = 15.2 =30<br />
V M 2 = M 2 |16 - 30|<br />
M 2<br />
| M2<br />
- 30 | 2<br />
= = |<br />
M<br />
14 1<br />
2<br />
- 30 |<br />
4<br />
=<br />
28<br />
M 2 = 58 14n + 2 = 58 n = 4 X là: C 4 H <strong>10</strong><br />
VD3: Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO 3, thu được V lít<br />
(đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của<br />
X đối với H2 bằng 19. Giá trị của V là: A. 2,24. B. 4,48. C. 5,60. D. 3,36.<br />
Giải<br />
+ Dựa vào sơ đồ đường chéo ta suy ra:<br />
Fe : x mol<br />
12 gam ⎯⎯⎯→ V lÝt<br />
Cu : x mol<br />
+ HNO 3<br />
<br />
n<br />
n<br />
NO<br />
NO2<br />
= 1<br />
NO : y mol<br />
<br />
NO 2<br />
: y mol<br />
. Từ đó ta có sơ đồ:<br />
hệ:<br />
56x + 64x = 12<br />
V = 5,6 l<br />
3x + 2x = 3y + y( ® l bo toµn<br />
e)<br />
Bài tập tự giải dạng 4<br />
Bài 1: Cần lấy V1 lít CO 2 và V2 lít CO để điều chế 24 lít hỗn hợp CO 2 và CO có tỉ khối hơi đối với<br />
metan bằng 2. Giá trị của V1 (lít) là:<br />
A. 2 B. 4 C. 6 D. 8<br />
Bài 2: Để điều chế được 26 lit H 2 và CO có tỉ khối hơi đối với metan bằng 1,5 thì thể tích H 2 và<br />
CO cần lấy lần lượt là A. 4 và 22 lit B. 22 và 4 lit C. 8 và 44 lit D. 44 và 8lit<br />
Bài 3: Cần lấy V 1 lít CO 2 và V 2 lít CO để có được 24 lít hỗn hợp CO 2 và CO có tỉ khối hơi đối với<br />
metan bằng 2. Giá trị của V 1 (lít) là A. 2. B. 4. C. 6. D. 8.<br />
Bài 4: Hòa tan m gam Al bằng dung dịch HNO 3 loãng thu được hỗn hợp khí NO và N 2 O có tỉ khối<br />
so với H 2 bằng 16,75. Tỉ lệ thể tích khí trong hỗn hợp là<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
A. 2 : 3. B. 1 : 2. C. 1 : 3. D. 3 : 1.<br />
Bài 5: Đốt cháy hoàn toàn m gam cacbon trong V lít khí oxi (đktc), thu đư ợc hỗn hợp khí A có tỉ<br />
khối so với oxi là 1,25. Xác định %V của các khí trong A. ĐS: %V CO2 = 33,33% và 25%<br />
Bài 6: Hòa tan hết 11 gam hh Fe và Al vào dd HCl dư được 0,4 mol H 2 . Cũng hòa tan hết 11 gam trên<br />
vào dd HNO 3 dư thì thu được dd X không chứa muối amoni và V lít hh khí Y ở đktc có tỉ khối so với<br />
hiđro là 19,8. Tính V? ĐS: V = 11,2 lít.<br />
Bài 7: Cho 6,12 gam Mg tác dụng với dung dịch HNO3 thu được dung dịch X chỉ có một muối v à<br />
hỗn hợp khí Y gồm NO và N2O có tỉ khối hơi đối với hiđro bằng 16,75. Thể tích NO và N2O (ở đktc)<br />
thu được lần lượt là : A. 2,24 lít và 6,72 lít. B. 2,016 lít và 0,672 lít.<br />
C. 0,672 lít và 2,016 lít. D. 1,972 lít và 0,448 lít.<br />
---<br />
Dạng 5: Bài to<strong>án</strong> hỗn hợp 2 chất vô cơ có tính chất hóa học tương tự nhau<br />
VD1: Hòa tan 3,164 gam hỗn hợp 2 muối CaCO 3 và BaCO 3 bằng dung dịch HCl dư, thu được 448<br />
ml khí CO 2 (đktc). Thành phần % số mol của BaCO 3 trong hỗn hợp là:<br />
A. 50% B. 55% C. 60% D. 65%<br />
n<br />
2<br />
0,448<br />
=<br />
22,4<br />
CO<br />
=<br />
0,02 (mol)<br />
<br />
Áp dụng sơ đồ đường chéo:<br />
<br />
58,2<br />
%n<br />
BaCO<br />
= <strong>10</strong>0%<br />
= 60%<br />
3<br />
58,2 + 38,8<br />
3,164<br />
M = = 158,2<br />
0,02<br />
Hướng dẫn giải:<br />
BaCO 3 (M 1 = 197) |<strong>10</strong>0 - 158,2| = 58,2<br />
M=158,2<br />
CaCO 3 (M 2 = <strong>10</strong>0) |197 - 158,2| = 38,8<br />
VD2: Hỗn hợp gồm NaCl và NaBr. Cho hỗn hợp tác dụng với dung dịch AgNO 3 dư thì tạo ra kết<br />
tủa có khối lượng bằng khối lượng của AgNO3 đã tham gia phản ứng. Thành phần % theo khối lượng<br />
của NaCl trong hỗn hợp đầu là : A. 25,84%. B. 27,84%. C. 40,45%. D. 27,48%.<br />
VD3: Hòa tan 2,84 gam hỗn hợp 2 muối CaCO 3 và MgCO 3 bằng dung dịch HCl dư, thu được 0,672<br />
lít khí ở điều kiện tiêu chuẩn. Thành phần % số mol của MgCO 3 trong hỗn hợp là<br />
A. 33,33% B. 45,55% C. 54,45% D. 66,67%<br />
Dạng 6: Bài to<strong>án</strong> trộn 2 quặng của cùng một kim loại<br />
Đây là một dạng bài mà nếu giải theo cách thông thường là khá dài dòng, phức tạp. Tuy nhiên<br />
nếu sử dụng sơ đồ đường chéo thì việc tìm ra kết quả trở nên đơn giản và nhanh chóng hơn nhiều.<br />
Để có thể áp dụng được sơ đồ đường chéo, ta coi các quặng như một “dung dịch” mà “chất tan”<br />
là kim loại đang xét, và “nồng độ” của “chất tan” chính là hàm lượng % về khối lượng của kim<br />
loại trong quặng.<br />
VD: A là quặng hematit chứa 60% Fe 2 O 3 . B là quặng manhetit chứa 69,6% Fe 3 O 4 . Trộn m1 tấn<br />
quặng A với m2 tấn quặng B thu được quặng C, mà từ 1 tấn quặng C có thể điều chế được 0,5 tấn<br />
gang chứa 4% cacbon. Tỉ lệ m1.m2 là:<br />
A. 5/2 B. 4/3 C. 3.4 D. 2.5<br />
Giải<br />
Số kg Fe có trong 1 tấn của mỗi quặng là:<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
60 112<br />
+) Quặng A chứa: <strong>10</strong>00<br />
= 420(kg)<br />
<strong>10</strong>0 160<br />
69,6 168<br />
+) Quặng B chứa: <strong>10</strong>00<br />
= 504 (kg)<br />
<strong>10</strong>0 232<br />
4 <br />
+) Quặng C chứa: 500 1<br />
− = 480 (kg)<br />
<strong>10</strong>0 <br />
Sơ đồ đường chéo:<br />
m A 420 |504 - 480| = 24<br />
480<br />
m B 504 |420 - 480| = 60<br />
m<br />
<br />
m<br />
B<br />
24 2<br />
= Đáp <strong>án</strong> D<br />
60 5<br />
A<br />
=<br />
VD2: A là kho<strong>án</strong>g vật cuprit chứa 45% Cu 2 O. B là kho<strong>án</strong>g vật tenorit chứa 70% CuO. Cần trộn A<br />
và B theo tỉ lệ khối lượng T = mA)mB như thế nào để được quặng C, mà từ 1 tấn quặng C có thể<br />
điều chế được tối đa 0,5 tấn đồng nguyên chất. T bằng<br />
A. 5/3 B. 5/4 C. 4/5 D. 3.5<br />
VD3: Từ 1 tấn quặng hematit A điều chế được 420 kg Fe. Từ 1 tấn quặng manhetit B điều chế<br />
được 504 kg Fe. Hỏi phải trộn hai quặng trên với tỉ lệ khối lượng (m A : m B ) là bao nhiêu để được<br />
1 tấn quặng hỗn hợp mà từ 1 tấn quặng hỗn hợp này điều chế được 480 kg Fe.<br />
A. 1 : 3. B. 2 : 5. C. 2 : 3. D. 1 : 1.<br />
Dạng 7: Tính thành phần hỗn hợp muối trong phản ứng giữa đơn bazơ và đa axit<br />
Dạng bài tập này có thể giải dễ dàng bằng phương pháp thông thường (viết phương trình phản<br />
ứng, đặt ẩn). Tuy nhiên cũng có thể nhanh chóng tìm ra kết quả bằng cách sử dụng sơ đồ đường<br />
chéo.<br />
VD: Thêm 250 ml dung dịch NaOH 2M vào 200 ml dung dịch H 3 PO 4 1,5M. Muối tạo thành và<br />
khối lượng tương ứng là:<br />
A. 14,2 gam Na 2 HPO 4 ; 32,8 gam Na 3 PO 4<br />
B. 28,4 gam Na 2 HPO 4 ; 16,4 gam Na 3 PO 4<br />
C. 12,0 gam NaH 2 PO 4 ; 28,4 gam Na 2 HPO 4<br />
D. 24,0 gam NaH 2 PO 4 ; 14,2 gam Na 2 HPO 4<br />
n<br />
NaOH 0,25.2 5<br />
Có: 1<br />
= = 2<br />
n 0,2.1,5 3<br />
H 3 PO 4<br />
Hướng dẫn giải:<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Tạo ra hỗn hợp 2 muối: NaH 2 PO 4 , Na 2 HPO 4<br />
Sơ đồ đường chéo:<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho học sinh cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - <strong>Hóa</strong> Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
<br />
n<br />
n<br />
Na HPO<br />
2<br />
NaH PO<br />
2<br />
4<br />
4<br />
Na 2 HPO 4 (n 1 = 2) |1 - 5/3|<br />
2<br />
=<br />
n 5 3<br />
=<br />
NaH 2 PO 4 (n 2 = 1) 3<br />
|2 - 5/3| 1<br />
=<br />
3<br />
2<br />
= n<br />
Na2HPO<br />
= 2n<br />
4 NaH2PO4<br />
1<br />
Mà + n = n 0, 3 (mol)<br />
n<br />
n<br />
<br />
n 2HPO4<br />
NaH2PO4<br />
H3PO<br />
4<br />
<br />
m<br />
<br />
<br />
m<br />
Na<br />
=<br />
Na HPO<br />
2<br />
NaH PO<br />
2<br />
2<br />
2<br />
4<br />
4<br />
Na HPO<br />
NaH PO<br />
4<br />
= 0,2(mol)<br />
= 0,1(mol)<br />
4<br />
= 0,2.142=<br />
28,4(g)<br />
= 0,1.120=<br />
12,0(g)<br />
Đáp <strong>án</strong> C.<br />
VD2: Thêm 150 ml dung dịch KOH 2M vào 120 ml dung dịch H 3 PO 4 1M. Khối lượng các muối<br />
thu được trong dung dịch là<br />
A. <strong>10</strong>,44 gam KH 2 PO 4 ; 8,5 gam K 3 PO 4 . B. <strong>10</strong>,44 gam K 2 HPO 4 ; 12,72 gam K 3 PO 4<br />
C. <strong>10</strong>,24 gam K 2 HPO 4 ; 13,5 gam KH 2 PO 4 D. 13,5 gam KH 2 PO 4 ; 14,2 gam K 3 PO 4<br />
Bài 1:<br />
Bài 2:<br />
Bài 3:<br />
Bài 4:<br />
Bài 5:<br />
Bài 6:<br />
Bài 7:<br />
Bài 8:<br />
Bài 9:<br />
Bài 0:<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial