capitulo_muestra_02.pdf (1172.0K)
capitulo_muestra_02.pdf (1172.0K)
capitulo_muestra_02.pdf (1172.0K)
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
74 SISTEMAS DISPERSOS QUÍMICA II<br />
La concentración de una disolución es una<br />
medida de cuánto soluto está disuelto en<br />
una cantidad específica de disolvente o disolución.<br />
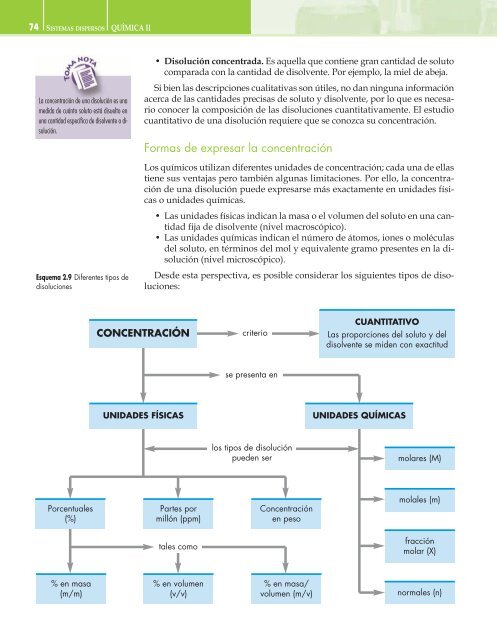
Esquema 2.9 Diferentes tipos de<br />
disoluciones<br />
Porcentuales<br />
(%)<br />
% en masa<br />
(m/m)<br />
Disolución concentrada. Es aquella que contiene gran cantidad de soluto<br />
comparada con la cantidad de disolvente. Por ejemplo, la miel de abeja.<br />
Si bien las descripciones cualitativas son útiles, no dan ninguna información<br />
acerca de las cantidades precisas de soluto y disolvente, por lo que es necesario<br />
conocer la composición de las disoluciones cuantitativamente. El estudio<br />
cuantitativo de una disolución requiere que se conozca su concentración.<br />
Formas de expresar la concentración<br />
Los químicos utilizan diferentes unidades de concentración; cada una de ellas<br />
tiene sus ventajas pero también algunas limitaciones. Por ello, la concentración<br />
de una disolución puede expresarse más exactamente en unidades físicas<br />
o unidades químicas.<br />
Las unidades físicas indican la masa o el volumen del soluto en una cantidad<br />
fija de disolvente (nivel macroscópico).<br />
Las unidades químicas indican el número de átomos, iones o moléculas<br />
del soluto, en términos del mol y equivalente gramo presentes en la disolución<br />
(nivel microscópico).<br />
Desde esta perspectiva, es posible considerar los siguientes tipos de disoluciones:<br />
CONCENTRACIÓN<br />
UNIDADES FÍSICAS<br />
Partes por<br />
millón (ppm)<br />
tales como<br />
% en volumen<br />
(v/v)<br />
criterio<br />
se presenta en<br />
los tipos de disolución<br />
pueden ser<br />
Concentración<br />
en peso<br />
% en masa/<br />
volumen (m/v)<br />
CUANTITATIVO<br />
Las proporciones del soluto y del<br />
disolvente se miden con exactitud<br />
UNIDADES QUÍMICAS<br />
molares (M)<br />
molales (m)<br />
fracción<br />
molar (X)<br />
normales (n)