mezclas homogeneas y heterogeneas sistemas materiales
mezclas homogeneas y heterogeneas sistemas materiales
mezclas homogeneas y heterogeneas sistemas materiales
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
MEZCLAS HOMOGENEAS Y HETEROGENEAS<br />
* Soluciones<br />
Medidas de concentración de soluciones<br />
1.- Unidades físicas:<br />
Porcentaje en peso: % P/P<br />
Porcentaje peso en volumen: %P/V<br />
Porcentaje volumen en volumen: %V/V<br />
2.- Unidades Químicas:<br />
Fracción molar: X<br />
Molaridad: M.<br />
Molalidad: m<br />
Preparación de soluciones<br />
* Solubilidad<br />
Estructura molecular y factores que afectan la solubilidad<br />
Solubilidad de un gas en un líquido<br />
Solubilidad de un sólido en un líquido<br />
Soluciones sobresaturadas<br />
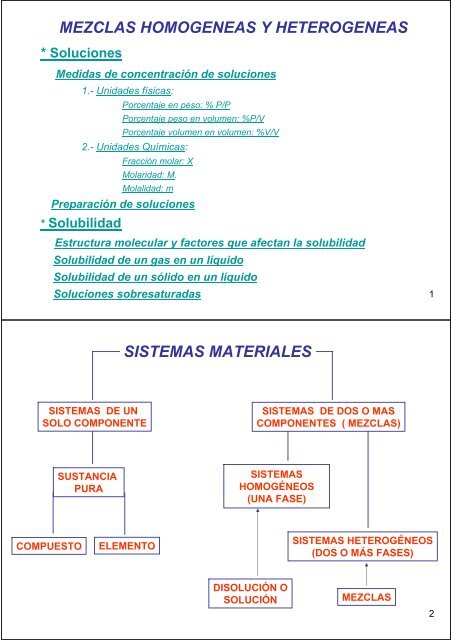
SISTEMAS DE UN<br />
SOLO COMPONENTE<br />
SUSTANCIA<br />
PURA<br />
COMPUESTO ELEMENTO<br />
SISTEMAS MATERIALES<br />
SISTEMAS DE DOS O MAS<br />
COMPONENTES ( MEZCLAS)<br />
SISTEMAS<br />
HOMOGÉNEOS<br />
(UNA FASE)<br />
DISOLUCIÓN O<br />
SOLUCIÓN<br />
SISTEMAS HETEROGÉNEOS<br />
(DOS O MÁS FASES)<br />
MEZCLAS<br />
1<br />
2
SOLUCIONES<br />
Mezclas homogéneas de dos o más componentes<br />
Componentes<br />
Mayor proporción solvente<br />
Menor proporción soluto<br />
Concentración: indica la cantidad de soluto presente en una dada<br />
cantidad de solvente o una dada cantidad de solución.<br />
Solución saturada: es una solución que no puede disolver<br />
mayores cantidades de soluto.<br />
Una solución saturada está en equilibrio con el soluto sólido.<br />
Solubilidad: concentración de soluto de la solución saturada.<br />
CLASIFICACIÓN DE LAS SOLUCIONES<br />
1.-Por el estado de agregación:<br />
Estado de la<br />
solución<br />
Gaseoso<br />
Líquido<br />
Líquido<br />
Líquido<br />
Sólido<br />
Sólido<br />
Sólido<br />
Estado del<br />
disolvente<br />
Gaseoso<br />
Líquido<br />
Líquido<br />
Líquido<br />
Sólido<br />
Sólido<br />
Sólido<br />
2.-Por la cantidad de soluto disuelto:<br />
a) Diluida<br />
b) Concentrada<br />
c) Saturada<br />
d) Sobresaturada<br />
Estado del<br />
soluto<br />
Gaseoso<br />
Gaseoso<br />
Líquido<br />
Sólido<br />
Gaseoso<br />
Líquido<br />
Sólido<br />
Ejemplo<br />
Aire, Gas natural<br />
Oxígeno en agua<br />
Alcohol en agua<br />
Sal o azúcar en agua<br />
Hidrógeno en Platino<br />
Mercurio en Plata<br />
Plata en Oro<br />
Representa una forma cualitativa de expresar la concentración de las soluciones.<br />
Ejemplo: Descripción de la adición gradual de NaCl en agua<br />
3<br />
4
Sol. Saturada:<br />
36.0 g NaCl en<br />
100 mL H 2 O<br />
PREPARACIÓN DE SOLUCIONES<br />
Solución:<br />
Mezcla homogénea del soluto en el solvente<br />
Dilución:<br />
Obtención de una solución de menor concentración a<br />
partir de una solución de mayor concentración por<br />
agregado de solvente.<br />
Saturación:<br />
Máxima cantidad de soluto disuelta por el solvente<br />
Sobresaturación:<br />
UNIDADES FÍSICAS DE CONCENTRACIÓN<br />
a) Porcentaje en peso o en masa: (% P/P ) :<br />
g de soluto disueltos en 100 g de la solución.<br />
b) Porcentaje peso en volumen: (% P/V ) :<br />
g de soluto disueltos en 100 ml de la solución.<br />
c) Porcentaje volumen en volumen: (% P/V ) :<br />
ml de soluto disueltos en 100 ml de la solución.<br />
d) Partes por millón: (ppm ) :<br />
g de soluto disueltos en 10 6 g de la solución.<br />
%<br />
p msto<br />
100<br />
p m<br />
soln<br />
%<br />
p msto<br />
100<br />
v m<br />
% v<br />
v<br />
<br />
v<br />
v<br />
m<br />
ppm <br />
m<br />
soln<br />
sto<br />
soln<br />
sto<br />
soln<br />
100<br />
6<br />
10<br />
4.0 g NaCl<br />
permanecen<br />
no disueltos<br />
5<br />
6
UNIDADES QUÍMICAS DE CONCENTRACIÓN<br />
a) Molaridad: moles de soluto en 1 litro de solución.<br />
M<br />
n<br />
<br />
V<br />
b) Molalidad: moles de soluto en 1 kg de solvente.<br />
n<br />
m <br />
m<br />
B <br />
B <br />
A<br />
moles de soluto<br />
lt. de solución<br />
moles de soluto<br />
Kg de solvente<br />
Unidad: Molar = moles/litro (M)<br />
c) Fracción Molar: relación e/ nº moles de soluto y el nº total de moles<br />
X <br />
n<br />
n B<br />
n<br />
moles de soluto<br />
<br />
moles totales<br />
A<br />
B<br />
Unidad: Molal = moles/Kg (m)<br />
SOLUBILIDAD<br />
Unidad: moles/moles<br />
adimensional (x)<br />
• Solubilidad es la cantidad máxima de soluto que<br />
es posible disolver en cierta cantidad de solvente<br />
a cierta temperatura.<br />
Sustancias con similares fuerzas<br />
intermoleculares tienden a ser más solubles<br />
entre sí.<br />
Fuerzas de atracción soluto-solvente favorecen<br />
la solubilidad<br />
Fuerzas de atracción soluto-soluto disminuyen<br />
la solubilidad.<br />
7<br />
8
EL PROCESO DE DISOLUCIÓN<br />
El soluto y el solvente en una solución pueden<br />
existir como moléculas o como iones.<br />
Por ejemplo, cuando el azúcar se disuelve en<br />
agua, el azúcar entra en la solución en forma de<br />
moléculas.<br />
Cuando el cloruro de sodio se disuelve en agua<br />
se disocia en iones cloruro y iones sodio.<br />
En ambos casos tanto las moléculas como los<br />
iones del soluto están rodeados por moléculas<br />
de agua en la solución<br />
ELECTROLITOS<br />
Si la sustancia que se disuelve se disocia en iones, hay<br />
conducción de la corriente eléctrica por la presencia de<br />
cargas móviles en la solución (NaCl).<br />
NO ELECTROLITOS<br />
Si la sustancia al disolverse no se ioniza, la solución no<br />
conducirá la corriente eléctrica (Azúcar).<br />
Sal en agua<br />
Metanol en agua<br />
Agua Metanol Sol. de Agua en<br />
Metanol 10<br />
9
LO SEMEJANTE DISUELVE LO SEMEJANTE<br />
Los compuestos iónicos (NaCl) y los polares (azúcar) son<br />
solubles en los solventes polares (H2O).<br />
Los compuestos no polares (aceites y grasas) son solubles en<br />
solventes no polares (gasolina).<br />
TIPOS DE FUERZAS DE INTERACCIÓN<br />
SOLUTO-SOLVENTE<br />
11<br />
12
ENFOQUE MICROSCÓPICO DE LA DISOLUCIÓN<br />
A-A<br />
A-B > A-A<br />
A-B > B-B<br />
A-B < A-A<br />
A-B < B-B<br />
A-B<br />
H H solución < 0<br />
H H solución > 0<br />
EXOTERMICO<br />
B-B<br />
ENDOTERMICO<br />
EFECTO DE LA TEMPERATURA<br />
Compuestos iónicos Gases<br />
H solución < 0 S disminuye al Temp.<br />
H solución > 0 S aumenta al Temp.<br />
13<br />
14
EFECTO DE LA PRESIÓN<br />
La presión no afecta la solubilidad de líquidos y sólidos pero sí la de los gases<br />
Ley de Henry<br />
Solubilidad del<br />
gas en el solvente dado<br />
s <br />
g<br />
k<br />
H<br />
P<br />
g<br />
Constante de Henry<br />
¿De qué depende?<br />
Presión del gas<br />
sobre la solución<br />
SOLUCIONES SOBRESATURADAS<br />
Contienen mayor concentración de soluto que el soluble a una cierta temperatura<br />
Q > Kc<br />
Q < Kc<br />
15<br />
16