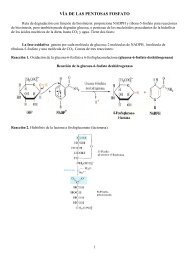
Estructura general de un aminoácido. Esta estructura es común a ...
Estructura general de un aminoácido. Esta estructura es común a ...
Estructura general de un aminoácido. Esta estructura es común a ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Estructura</strong> <strong>general</strong> <strong>de</strong> <strong>un</strong> <strong>aminoácido</strong>.<br />
<strong>Esta</strong> <strong><strong>es</strong>tructura</strong> <strong>es</strong> <strong>común</strong> a todos los alfa<strong>aminoácido</strong>s,<br />
con <strong>un</strong>a única excepción. (La<br />
excepción <strong>es</strong> la prolina, <strong>un</strong> <strong>aminoácido</strong> cíclico).<br />
El grupo R o ca<strong>de</strong>nal lateral (en rojo) <strong>un</strong>ido al<br />
carbono α (alfa) (en azul) <strong>es</strong> diferente para<br />
cada <strong>aminoácido</strong>.<br />
Se usan dos convencion<strong>es</strong> para<br />
i<strong>de</strong>ntificar a los carbonos <strong>de</strong>ntro<br />
<strong>de</strong> <strong>un</strong> <strong>aminoácido</strong>. Los carbonos<br />
adicional<strong>es</strong> <strong>de</strong> <strong>un</strong> grupo R se<br />
<strong>de</strong>signan <strong>común</strong>mente β (beta), γ<br />
(gamma), δ (<strong>de</strong>lta), ε (epsilon),<br />
empezando a partir <strong>de</strong>l carbono α<br />
(alfa). Para la mayoría <strong>de</strong> las <strong>de</strong>más<br />
moléculas orgánicas, los átomos <strong>de</strong><br />
carbono se numeran simplemente a<br />
partir <strong>de</strong> <strong>un</strong> extremo, dando la<br />
máxima prioridad<br />
a los carbonos con sustitucion<strong>es</strong> que contengan átomos <strong>de</strong> mayor número atómico.<br />
Siguiendo <strong>es</strong>ta última convención, el grupo carboxilo <strong>de</strong> <strong>un</strong> <strong>aminoácido</strong> sería el C-1 y el<br />
carbono alfa sería el C-2.<br />
Estereoisomerismo en los alfa<strong>aminoácido</strong>s.<br />
a)Los dos <strong>es</strong>tereoisómeros <strong>de</strong> la alanina, la L- y la D-alanina, son imágen<strong>es</strong> <strong>es</strong>pecular<strong>es</strong><br />
no superponibl<strong>es</strong> entre sí (enantiómeros). b) Los enlac<strong>es</strong> con forma <strong>de</strong> cuña se<br />
proyectan fuera <strong>de</strong>l plano <strong>de</strong>l papel; los enlac<strong>es</strong> a trazos lo hacen por <strong>de</strong>trás.<br />
c) Se supone que los enlac<strong>es</strong> horizontal<strong>es</strong> se proyectan fuera <strong>de</strong>l plano <strong>de</strong>l papel, los<br />
enlac<strong>es</strong> vertical<strong>es</strong> por <strong>de</strong>trás. No obstante, se utilizan a menudo las fórmulas <strong>de</strong><br />
proyección <strong>de</strong> <strong>un</strong>a forma <strong>de</strong>scuidada sin preten<strong>de</strong>r<br />
repr<strong>es</strong>entar <strong>un</strong>a configuración <strong>es</strong>tereoquímica <strong>es</strong>pecífica.
Asimetría Molecular: moléculas<br />
quiral<strong>es</strong> y aquéral<strong>es</strong>.<br />
a) Cuando <strong>un</strong> átomo <strong>de</strong> carbono<br />
tiene cuatro sustituyent<strong>es</strong><br />
diferent<strong>es</strong><br />
(A,B,X,Y), éstos pue<strong>de</strong>n<br />
disponerse <strong>de</strong> dos maneras<br />
diferent<strong>es</strong>, que dan lugar a dos<br />
moléculas no superponibl<strong>es</strong>,<br />
siendo cada <strong>un</strong>a <strong>de</strong> ellas la imagen<br />
<strong>es</strong>pecular <strong>de</strong> la otra<br />
(enantiómeros). Estos átomos <strong>de</strong><br />
carbono son asimétricos y se<br />
<strong>de</strong>nominan átomos quiral<strong>es</strong> o<br />
centros quiral<strong>es</strong>.<br />
b) Cuando alre<strong>de</strong>dor <strong>de</strong>l átomo <strong>de</strong><br />
carbono tetraédrico se disponen<br />
únicamente tr<strong>es</strong> sustituyent<strong>es</strong><br />
diferent<strong>es</strong> (<strong>es</strong> <strong>de</strong>cir, hay dos<br />
sustituyent<strong>es</strong> igual<strong>es</strong>), solamente<br />
<strong>es</strong> posible <strong>un</strong>a configuración<br />
<strong>es</strong>pacial y la molécula <strong>es</strong> simétrica<br />
o aquiral.<br />
En <strong>es</strong>te caso la molécula pue<strong>de</strong><br />
superimponerse a su imagen<br />
<strong>es</strong>pecular: aquí, la molécula <strong>de</strong> la<br />
izquierda, rotando en sentido<br />
contrario a las agujas <strong>de</strong>l reloj<br />
(cuando se mira hacia abajo por el<br />
eje vertical que <strong>un</strong>e A y C), da<br />
lugar a la molécula <strong>de</strong>l <strong>es</strong>pejo.<br />
Relación <strong>es</strong>térica <strong>de</strong> los <strong>es</strong>tereoisómeros <strong>de</strong> la<br />
alanina con la configuración absoluta <strong>de</strong>l L- y<br />
D-gliceral<strong>de</strong>hído. En <strong>es</strong>tas fórmulas <strong>de</strong><br />
perspectiva los carbonos <strong>es</strong>tán alineados<br />
verticalmente con el átomo quiral en el centro.<br />
Los carbonos <strong>de</strong> <strong>es</strong>tas moléculas <strong>es</strong>tán numerados<br />
empezando con los carbonos al<strong>de</strong>hído o carboxilo<br />
en el extremo (en rojo), 1 a 3 <strong>de</strong> arriba abajo tal<br />
como se mu<strong>es</strong>tra. Cuando se pr<strong>es</strong>entan <strong>de</strong> <strong>es</strong>ta<br />
forma, el grupo R <strong>de</strong>l <strong>aminoácido</strong> (en <strong>es</strong>te caso el<br />
grupo metilo <strong>de</strong> la alanina) <strong>es</strong>tá siempre <strong>de</strong>bajo<br />
<strong>de</strong>l carbono alfa. Los L-<strong>aminoácido</strong>s son los que<br />
tienen el grupo alfa-amino a la izquierda y los D-<strong>aminoácido</strong>s los que tienen el grupo alfa-amino a la<br />
<strong>de</strong>recha.
Aminoácidos APOLARES, con ca<strong>de</strong>nas lateral<strong>es</strong> alifáticas. (También Phe y Trp.)<br />
Aminoácidos POLARES, sin carga.<br />
¡¡ MUY IMPORTANTE, existe <strong>un</strong> error ¡!. El <strong>aminoácido</strong> PROLINA que aparece<br />
en <strong>es</strong>te última clasificación <strong>de</strong>ntro <strong>de</strong> los <strong>aminoácido</strong>s polar<strong>es</strong> sin carga, tiene<br />
como ca<strong>de</strong>na lateral <strong>un</strong>a ca<strong>de</strong>na alifática (sombreada en rosa) y <strong>es</strong> por tanto apolar,<br />
por lo que <strong>de</strong>bería aparecer en el recuadro <strong>de</strong> arriba.
Aminoácidos<br />
AROMÁTICOS<br />
con ca<strong>de</strong>nas<br />
lateral<strong>es</strong> (o<br />
grupos R)<br />
aromáticos.<br />
Aminoácidos BÁSICOS<br />
con ca<strong>de</strong>nas lateral<strong>es</strong><br />
cargadas positivamente.<br />
Aminoácidos ÁCIDOS con ca<strong>de</strong>nas lateral<strong>es</strong> cargadas negativamente.
Los 20 <strong>aminoácido</strong>s <strong>es</strong>tándar <strong>de</strong> las proteínas. Las fórmulas <strong><strong>es</strong>tructura</strong>l<strong>es</strong><br />
mu<strong>es</strong>tran el <strong>es</strong>tado <strong>de</strong> ionización que predomina a pH 7.0 Las part<strong>es</strong> no<br />
sombreadas son com<strong>un</strong><strong>es</strong> para todos los <strong>aminoácido</strong>s; las part<strong>es</strong> sombreadas en<br />
color son los grupos R. A<strong>un</strong>que el grupo R <strong>de</strong> la histidina se mu<strong>es</strong>tra sin carga, su<br />
pKa <strong>es</strong> tal que <strong>un</strong>a fracción pequeña pero significativa <strong>de</strong> <strong>es</strong>tos grupos <strong>es</strong>tá<br />
cargada positivamente a pH 7.0
Absorbancia <strong>de</strong> la luz ultravioleta por los <strong>aminoácido</strong>s aromáticos. Espectros<br />
<strong>de</strong> absorción <strong>de</strong> luz <strong>de</strong> los <strong>aminoácido</strong>s aromáticos triptófano y tirosina a pH 6,0.<br />
Los <strong>aminoácido</strong>s <strong>es</strong>tán pr<strong>es</strong>ent<strong>es</strong> en cantida<strong>de</strong>s equimolar<strong>es</strong> (10 -3 M) en idénticas<br />
condicion<strong>es</strong>. La absorción <strong>de</strong> la luz por el triptófano <strong>es</strong> cuatro vec<strong>es</strong> mayor que la<br />
<strong>de</strong> la tirosina. El máximo <strong>de</strong> absorbancia para ambos <strong>es</strong>tá cercano a 280 nm<br />
(nanómetros). La absorción <strong>de</strong> la luz <strong>de</strong>l tercer <strong>aminoácido</strong> aromático, la<br />
fenilalanina (no mostrado), <strong>general</strong>mente contribuye poco a las propieda<strong>de</strong>s <strong>de</strong><br />
absorbancia <strong>de</strong> las proteínas.<br />
Formación<br />
reversible <strong>de</strong> <strong>un</strong><br />
puente disulfuro<br />
por oxidación <strong>de</strong><br />
dos moléculas <strong>de</strong><br />
cisteína. Los<br />
puent<strong>es</strong> disulfuro<br />
entre r<strong>es</strong>iduos <strong>de</strong><br />
Cys <strong>es</strong>tabilizan las<br />
<strong><strong>es</strong>tructura</strong>s <strong>de</strong><br />
muchas proteínas.
Aminoácidos no <strong>es</strong>tándar<br />
a) Alg<strong>un</strong>os <strong>aminoácido</strong>s no <strong>es</strong>tándar<br />
encontrados en proteínas. Todos ellos<br />
provienen <strong>de</strong> <strong>aminoácido</strong>s <strong>es</strong>tándar. Los<br />
grupos f<strong>un</strong>cional<strong>es</strong> extra añadidos a través<br />
<strong>de</strong> reaccion<strong>es</strong> <strong>de</strong> modificación se mu<strong>es</strong>tran en<br />
rojo. La <strong>de</strong>smosina se forma a partir <strong>de</strong><br />
cuatro r<strong>es</strong>iduos <strong>de</strong> Lys. b) La ornitina y la<br />
citrulina, que no se encuentran en las<br />
proteínas, son intermediarios en la<br />
biosínt<strong>es</strong>is <strong>de</strong> arginina y en el ciclo <strong>de</strong> la<br />
urea.
Propieda<strong>de</strong>s y convencion<strong>es</strong> asociadas a los <strong>aminoácido</strong>s <strong>es</strong>tándar.<br />
Nombr<strong>es</strong> abreviados: Normalmente, a<strong>un</strong>que no en todos los casos, las tr<strong>es</strong> primeras letras<br />
<strong>de</strong>l nombre en inglés <strong>de</strong> cada <strong>aminoácido</strong>.<br />
pK1 indica el valor <strong>de</strong> pKa <strong>de</strong>l grupo alfa carboxilo.<br />
pK2 indica el valor <strong>de</strong> pKa <strong>de</strong>l grupo alfa amino.<br />
pKR indica el valor <strong>de</strong> pKa <strong>de</strong> la ca<strong>de</strong>na lateral <strong>de</strong> los <strong>aminoácido</strong>s cuya ca<strong>de</strong>nal lateral sea<br />
ionizable.<br />
pI indica el valor <strong>de</strong>l p<strong>un</strong>to isoeléctrico o pH isoeléctrico.<br />
Índice hidropático: <strong>es</strong>cala que combina la hidrofobicidad y la hidrofilicidad <strong>de</strong> las ca<strong>de</strong>nas<br />
lateral<strong>es</strong>, se usa para pre<strong>de</strong>cir la ten<strong>de</strong>ncia <strong>de</strong> los <strong>aminoácido</strong>s a buscar <strong>un</strong> ambiente acuoso<br />
(valor<strong>es</strong> negativos) o <strong>un</strong> ambiente hidrófobo (valor<strong>es</strong> positivos).<br />
Pr<strong>es</strong>encia en las proteínas (%): Pr<strong>es</strong>encia media en <strong>un</strong>as 1.150 proteínas <strong>es</strong>tudiadas.
Curvas <strong>de</strong> valoración <strong>de</strong>l glutamato (izquierda) y <strong>de</strong> la lisina (<strong>de</strong>recha).<br />
Glutamato: El valor <strong>de</strong> pK1 se corr<strong>es</strong>pon<strong>de</strong> con el pKa <strong>de</strong>l grupo alfa-carboxilo (2.19),<br />
El valor <strong>de</strong> pK2 se corr<strong>es</strong>pon<strong>de</strong> con el pKa <strong>de</strong>l grupo carboxilo <strong>de</strong> la ca<strong>de</strong>na lateral (4.25),<br />
El valor <strong>de</strong> pK3 se corr<strong>es</strong>pon<strong>de</strong> con el pKa <strong>de</strong>l grupo alfa-amino (9.67).<br />
El pH isoeléctrico o p<strong>un</strong>to isoeléctrico (pI) será la media aritmética <strong>de</strong> los valor<strong>es</strong> <strong>de</strong><br />
pKa <strong>de</strong> los grupos alfa-carboxilo y carboxilo <strong>de</strong> la ca<strong>de</strong>na lateral (porque en <strong>es</strong>te caso<br />
se trata <strong>de</strong> <strong>un</strong> <strong>aminoácido</strong> ácido):<br />
pI = (2.19 + 4.25) / 2 = 3.22<br />
Lisina: El valor <strong>de</strong> pK1 se corr<strong>es</strong>pon<strong>de</strong> con el pKa <strong>de</strong>l grupo alfa-carboxilo (2.18),<br />
El valor <strong>de</strong> pK2 se corr<strong>es</strong>pon<strong>de</strong> con el pKa <strong>de</strong>l grupo alfa-amino (8.95),<br />
El valor <strong>de</strong> pK3 se corr<strong>es</strong>pon<strong>de</strong> con el pKa <strong>de</strong>l grupo amino <strong>de</strong> la ca<strong>de</strong>na lateral (10.53).<br />
El pH isoeléctrico o p<strong>un</strong>to isoeléctrico (pI) será la media aritmética <strong>de</strong> los valor<strong>es</strong> <strong>de</strong> pKa <strong>de</strong> los<br />
grupos alfa-amino y amino <strong>de</strong> la ca<strong>de</strong>na lateral (porque en <strong>es</strong>te caso <strong>de</strong> trata <strong>de</strong> <strong>un</strong><br />
<strong>aminoácido</strong> básico):<br />
pI = (8.95 + 10.53) / 2 = 9.74<br />
Los <strong>aminoácido</strong>s con <strong>un</strong> grupo R ionizable (Lys, Arg, His, Asp, Glu, Tyr y Cys), tienen<br />
curvas <strong>de</strong> valoración más complejas que la <strong>de</strong> la glicina, con tr<strong>es</strong> etapas corr<strong>es</strong>pondient<strong>es</strong> a los<br />
tr<strong>es</strong> pasos <strong>de</strong> ionización posibl<strong>es</strong>; tienen por tanto tr<strong>es</strong> valor<strong>es</strong> <strong>de</strong> pKa. La etapa adicional <strong>de</strong>bida<br />
a la valoración <strong>de</strong>l grupo R ionizable se fusiona en cierto grado con las otras dos, tal y como<br />
observamos en los <strong>aminoácido</strong>s aquí expu<strong>es</strong>tos.
Formación <strong>de</strong> <strong>un</strong> enlace<br />
peptídico por con<strong>de</strong>nsación. El<br />
grupo alfa-amino <strong>de</strong> <strong>un</strong><br />
<strong>aminoácido</strong> (el que tiene el R2),<br />
actúa como nucleófilo<br />
<strong>de</strong>splazando el grupo hidroxilo<br />
<strong>de</strong> otro <strong>aminoácido</strong> (el que tiene<br />
el R1) para formar <strong>un</strong> enlace<br />
covalente <strong>de</strong>nominado enlace<br />
peptídico (sombreado en gris).<br />
Al ser <strong>es</strong>ta reacción<br />
energéticamente <strong>de</strong>sfavorable<br />
los <strong>aminoácido</strong>s <strong>de</strong>ben ser<br />
activados previamente.<br />
<strong>Estructura</strong> <strong>de</strong>l pentapéptido seril-glicil-tirosinil-alanil-leucina o Ser-Gly-Tyr-Ala-Leu.<br />
Los péptidos se nombran empezando por el r<strong>es</strong>iduo amino-terminal que, por convención,<br />
se sitúa a la izquierda y terminan con el r<strong>es</strong>iduo carboxilo-terminal, a la <strong>de</strong>recha. Los<br />
enlac<strong>es</strong> peptídicos se mu<strong>es</strong>tran sombreados en gris y las ca<strong>de</strong>nas lateral<strong>es</strong> en rojo.
Ionización y carga eléctrica <strong>de</strong>l péptido Alanil-glutamil-glicil-lisina. Este tetrapéptido<br />
tiene <strong>un</strong> grupo alfa-amino libre, <strong>un</strong> grupo alfa carboxilo libre y dos ca<strong>de</strong>nas lateral<strong>es</strong> (o<br />
grupos R) ionizabl<strong>es</strong>. Los grupos ionizados a pH 7.0 se mu<strong>es</strong>tran en rojo.<br />
Alg<strong>un</strong>os péptidos natural<strong>es</strong> con<br />
intensa actividad biológica. Los<br />
r<strong>es</strong>iduos amino-terminal<strong>es</strong> <strong>es</strong>tán a la<br />
izquierda.<br />
(a) La bradiquinina <strong>es</strong> <strong>un</strong><br />
péptido <strong>de</strong> tipo hormonal que inhibe<br />
las reaccion<strong>es</strong> inflamatorias.<br />
(b) Oxitocina, formada por la<br />
hipófisis posterior, <strong>es</strong>timula las<br />
contraccion<strong>es</strong> uterinas.<br />
(c) factor liberador <strong>de</strong> la<br />
tirotropina (o TSH), formado por el<br />
hipotálamo.<br />
(d) Dos encefalinas (Metencefalina<br />
y Leu-encefalina),<br />
péptidos cerebral<strong>es</strong> que afectan a la<br />
percepción <strong>de</strong>l dolor.<br />
(e) Gramicidina S,<br />
antibiótico producido por la bacteria<br />
Bacillus brevis . Las flechas indican<br />
la dirección <strong>de</strong>s<strong>de</strong> el extremo amino<br />
al carboxilo <strong>de</strong> cada r<strong>es</strong>iduo. El<br />
péptido no tiene final porque <strong>es</strong><br />
circular.<br />
Orn <strong>es</strong> el símbolo <strong>de</strong> la ornitina,<br />
<strong>aminoácido</strong> que <strong>general</strong>mente no se<br />
pr<strong>es</strong>enta en las proteínas.<br />
Obsérv<strong>es</strong>e que la gramicidina S contiene dos r<strong>es</strong>iduos <strong>de</strong> <strong>un</strong> D-<strong>aminoácido</strong> (D-fenilalanina).
Propieda<strong>de</strong>s ácido-base
<strong>Estructura</strong> química.<br />
a) Modificación <strong>de</strong> los extremos NH2 –terminal: acetilacion<strong>es</strong>, aa cíclicos<br />
COOH –terminal: en forma amida<br />
b) Por proteolisis <strong>de</strong> precursor<strong>es</strong> mayor<strong>es</strong><br />
c) En hongos y bacterias: pr<strong>es</strong>encia <strong>de</strong> <strong><strong>es</strong>tructura</strong>s cíclicas y D-<strong>aminoácido</strong>s<br />
a)<br />
Ejemplos<br />
Ac-NH-SYSMEHFRWGKPV-CONH2 α-MSH (hormona <strong>es</strong>timulante <strong>de</strong> los melanocitos)<br />
b)<br />
TRH (hormona liberadora <strong>de</strong> tirotropina)<br />
PROOPIOMELANOCORTINA<br />
SYSMEHFRWGKPVGKKRRPVKVYPDAGEDQSAEAFPLEF<br />
(ACTH)<br />
SYSMEHFRWGKPV (α-MSH)<br />
c)<br />
γ-<br />
MSH<br />
β-lipotropina<br />
γ-lipotropina βendorf.
1) Péptidos vasoactivos<br />
A) Vasoconstrictor<strong>es</strong><br />
B) Vasodilatador<strong>es</strong><br />
Actividad biológica<br />
ANGIOTENSINOGENO<br />
RENINA → ↓<br />
ANGIOTENSINA I DRVYIHPFHL<br />
ANGIOTENSINASA → ↓<br />
ANGIOTENSINA II DRVYIHPF + HL<br />
2) Hormonas<br />
QUININÓGENO<br />
KALIKREÍNAS → ↓<br />
BRADIQUININA Y KALIDINA<br />
RPPGFSPFR KRPPGFSPFR<br />
OXITOCINA CYIQNCPLG-CO-NH2<br />
ARGININ-VASOPRESINA (ADH) CYFQNCPRG-CO-NH2<br />
LISIN-VASOPRESINA (ADH) CYFQNCPKG-CO-NH2<br />
Otras hormonas:<br />
a) hipotlámicas<br />
b) hipofisarias<br />
c) pancreáticas: insulina, glugagón<br />
d) gastroint<strong>es</strong>tinal<strong>es</strong>: gastrina, secretina, colecistoquinina, VIP (péptido int<strong>es</strong>tinal vasoactivo, etc<br />
3) neurotransmisor<strong>es</strong><br />
4) Antioxidante<br />
ENDORFINAS<br />
PROTEOLISIS ESPECÍFICA ↓<br />
Leu-encefalina YGGFL<br />
Met-encefalina YGGFM<br />
GLUTATION (γ-glutamil-L-cistenil-glicina)<br />
2GSH + H2O2 → GSSG + 2H2O
Proteínas conjugadas: proteínas que contienen<br />
component<strong>es</strong> químicos diferent<strong>es</strong> a los<br />
<strong>aminoácido</strong>s. La parte no <strong>aminoácido</strong> <strong>de</strong> <strong>un</strong>a<br />
proteína conjugada se <strong>de</strong>nomina frecuentemente<br />
grupo prostético.
Ant<strong>es</strong> <strong>de</strong> comenzar la secuenciación se purifica la proteína, y <strong>un</strong>a vez en su <strong>es</strong>tado<br />
puro, se rompen los puent<strong>es</strong> disulfuro si se trata <strong>de</strong> <strong>un</strong>a proteína que los contiene,<br />
<strong>de</strong> <strong>es</strong>ta forma se obtienen las ca<strong>de</strong>nas polipeptídicas separadas. La secuenciación<br />
se lleva a cabo con cada polipéptido por separado.<br />
Rotura enzimática <strong>de</strong>l enlace peptídico mediante tripsina, enzima proteolítico.
Secuenciación indirecta. Hoy en día la <strong><strong>es</strong>tructura</strong> primaria <strong>de</strong> muchas proteínas se conoce<br />
a partir <strong>de</strong> las secuencias <strong>de</strong> nucleótidos <strong>de</strong> los gen<strong>es</strong> que las codifican.<br />
Las primeras bas<strong>es</strong> <strong>de</strong> datos <strong>de</strong> secuencias <strong>de</strong> <strong>aminoácido</strong>s proteicos fueron re<strong>un</strong>idas<br />
basándose en el uso <strong>de</strong> los métodos <strong>de</strong> secuenciación química. Hoy en día, la enorme<br />
prepon<strong>de</strong>rancia <strong>de</strong> información <strong>de</strong> las secuencias <strong>de</strong> proteínas <strong>de</strong>rivan <strong>de</strong> la traducción <strong>de</strong><br />
las secuencias <strong>de</strong> los gen<strong>es</strong> codificadas en los codon<strong>es</strong> y <strong>de</strong>s<strong>de</strong> ésta la obtención <strong>de</strong> las<br />
secuencias <strong>de</strong> los <strong>aminoácido</strong>s proteicos. Secuenciar el or<strong>de</strong>n <strong>de</strong> los nucléotidos en los gen<strong>es</strong><br />
clonados <strong>es</strong> <strong>un</strong> proc<strong>es</strong>o más rápido, eficiente e informativo que la <strong>de</strong>terminación <strong>de</strong> las<br />
secuencias <strong>de</strong> los <strong>aminoácido</strong>s proteicos por métodos químicos.<br />
El <strong>de</strong>sarrollo <strong>de</strong> métodos rápidos para la secuenciación <strong>de</strong>l DNA, el <strong>de</strong>scubrimiento <strong>de</strong>l código<br />
genético, y el <strong>de</strong>sarrollo <strong>de</strong> técnicas para el aislamiento <strong>de</strong> gen<strong>es</strong>, permiten <strong>de</strong>ducir la<br />
secuencia <strong>de</strong> <strong>un</strong> polipéptido mediante la <strong>de</strong>terminación <strong>de</strong> la secuencia <strong>de</strong> nucleótidos <strong>de</strong>l gen<br />
que lo codifica. De <strong>es</strong>ta manera se ha llegado a conocer secuencias <strong>de</strong> muchas proteínas ant<strong>es</strong><br />
<strong>de</strong> su aislamiento o mera caracterización.
Separación <strong>de</strong> <strong>aminoácido</strong>s<br />
Poli<strong>es</strong>tireno<br />
sulfonado<br />
pH
La mariposa<br />
Ciclo Vital <strong>de</strong> la Mariposa<br />
Mismo genoma Distintas proteínas<br />
El huevo<br />
crisálida<br />
Proteómica<br />
La oruga<br />
Conocer el proteóma <strong>de</strong> <strong>un</strong> organismo <strong>es</strong> tener <strong>un</strong>a imagen dinámica <strong>de</strong> todas<br />
las proteínas expr<strong>es</strong>adas por <strong>es</strong>e organismo, en <strong>un</strong> momento dado y bajo<br />
<strong>de</strong>terminadas condicion<strong>es</strong> concretas <strong>de</strong> tiempo y ambiente<br />
¿Qué f<strong>un</strong>ción tienen las proteínas?,<br />
¿Qué tipo <strong>de</strong> modificacion<strong>es</strong> postraduccional<strong>es</strong> sufren las proteínas y cuál <strong>es</strong><br />
su f<strong>un</strong>ción?,<br />
¿Cómo varían las proteínas <strong>de</strong> <strong>un</strong>a célula enfrentada a distintas condicion<strong>es</strong><br />
ambiental<strong>es</strong>?.<br />
También <strong>es</strong> posible enten<strong>de</strong>r la proteómica como el conj<strong>un</strong>to <strong>de</strong> técnicas que<br />
permiten analizar el conj<strong>un</strong>to <strong>de</strong> proteínas pr<strong>es</strong>ent<strong>es</strong> en la célula en<br />
<strong>de</strong>terminado momento, o sea, el proteoma. <strong>Esta</strong>s técnicas incluyen el 2D-<br />
PAGE (electrofor<strong>es</strong>is <strong>de</strong> poliacrilamida <strong>de</strong> dos dimension<strong>es</strong>) y la MS<br />
(<strong>es</strong>pectrometría <strong>de</strong> masas). La manera más fácil <strong>de</strong> hacer <strong>un</strong> <strong>es</strong>tudio<br />
proteómico <strong>es</strong> comparar los proteomas <strong>de</strong> dos condicion<strong>es</strong> y observar sus<br />
diferencias.
Electroforésis en dos dimension<strong>es</strong>