SISTEMAS REDOX
SISTEMAS REDOX
SISTEMAS REDOX
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Podemos comprobarlo planteando las semirreacciones correspondientes:<br />
y la reacción total:<br />
H2O2 (ac) + 2H + (ac) + 2e - → 2H2O(l) E° = 1,76V<br />
O2 (g) + 2H + (ac) + 2e - → H2O2 (ac) E° = 0,70V<br />
H2O2 (ac) → 2H2O(l) + O2 (g) E° = 1,06V<br />
Como E° es mayor que cero, la dismutación es termodinámicamente favorable<br />
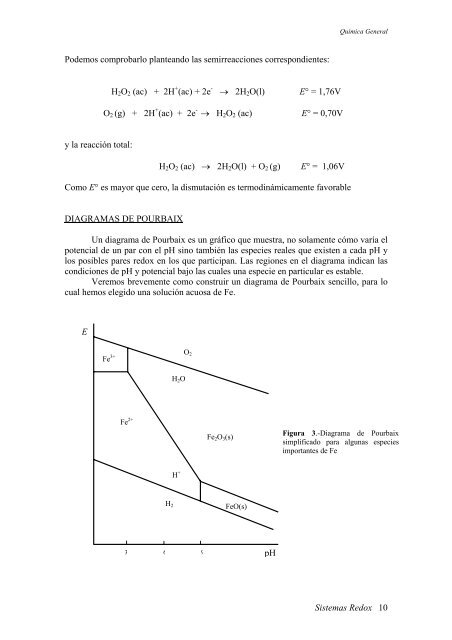
DIAGRAMAS DE POURBAIX<br />
Química General<br />
Un diagrama de Pourbaix es un gráfico que muestra, no solamente cómo varía el<br />
potencial de un par con el pH sino también las especies reales que existen a cada pH y<br />
los posibles pares redox en los que participan. Las regiones en el diagrama indican las<br />
condiciones de pH y potencial bajo las cuales una especie en particular es estable.<br />
Veremos brevemente como construir un diagrama de Pourbaix sencillo, para lo<br />
cual hemos elegido una solución acuosa de Fe.<br />
E<br />
Fe 3+<br />
Fe 2+<br />
H2<br />
H2O<br />
H +<br />
O2<br />
3 6 9<br />
Fe2O3(s)<br />
FeO(s)<br />
pH<br />
Figura 3.-Diagrama de Pourbaix<br />
simplificado para algunas especies<br />
importantes de Fe<br />
Sistemas Redox 10





![OBTENCIÓN Y PROPIEDADES DEL Cu2[Hg I4] (P 3)](https://img.yumpu.com/14365645/1/184x260/obtencion-y-propiedades-del-cu2hg-i4-p-3.jpg?quality=85)


![K3[Fe(ox)3]](https://img.yumpu.com/14204537/1/184x260/k3feox3.jpg?quality=85)

