Potenciales de reducción estándar en el grupo del boro Diagrama ...
Potenciales de reducción estándar en el grupo del boro Diagrama ...
Potenciales de reducción estándar en el grupo del boro Diagrama ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
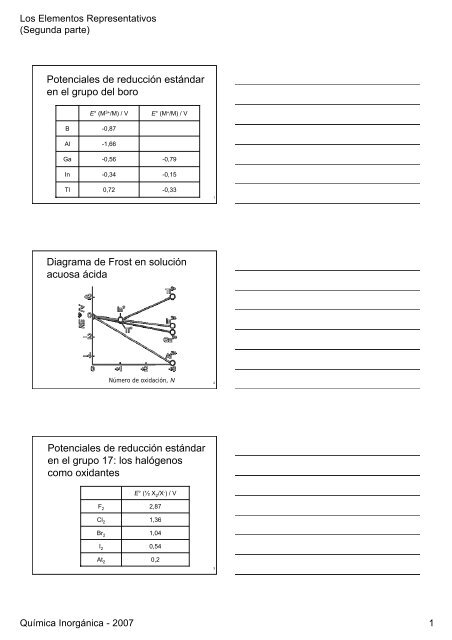
<strong>Pot<strong>en</strong>ciales</strong> <strong>de</strong> <strong>reducción</strong> <strong>estándar</strong><br />
<strong>en</strong> <strong>el</strong> <strong>grupo</strong> <strong>de</strong>l <strong>boro</strong><br />
B<br />
Al<br />
Ga<br />
In<br />
Tl<br />
E° (M 3+ /M) / V<br />
-0,87<br />
-1,66<br />
-0,56<br />
-0,34<br />
0,72<br />
E° (M + /M) / V<br />
-0,79<br />
-0,15<br />
-0,33<br />
<strong>Diagrama</strong> <strong>de</strong> Frost <strong>en</strong> solución<br />
acuosa ácida<br />
Número <strong>de</strong> oxidación, N<br />
<strong>Pot<strong>en</strong>ciales</strong> <strong>de</strong> <strong>reducción</strong> <strong>estándar</strong><br />
<strong>en</strong> <strong>el</strong> <strong>grupo</strong> 17: los halóg<strong>en</strong>os<br />
como oxidantes<br />
F 2<br />
Cl 2<br />
Br 2<br />
I 2<br />
At 2<br />
E° (½ X 2 /X - ) / V<br />
2,87<br />
1,36<br />
1,04<br />
0,54<br />
0,2<br />
1<br />
2<br />
3<br />
Química Inorgánica - 2007 1
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Ciclo termodinámico<br />
Δ at H° (X)<br />
+ ½ EE (H-H)<br />
X(g) + H(g) X – (g) + H + ΔionH° (H)<br />
+ AE (Cl)<br />
(g)<br />
Δ hid H° (X – )<br />
+ Δ hid H° (H + )<br />
½X2(ee) + ½ H2(g) X – (ac) + H + ΔredH° (ac)<br />
Tabla <strong>de</strong> valores<br />
Δ at H° (X)<br />
AE (Cl)<br />
Δ hid H° (X – )<br />
Σ (H)<br />
Δ red H°<br />
F<br />
80<br />
-328<br />
-513<br />
410<br />
-351<br />
122<br />
-349<br />
-370<br />
410<br />
-187<br />
96<br />
-325<br />
-339<br />
410<br />
-158<br />
Algunas reacciones <strong>de</strong> los<br />
<strong>el</strong>em<strong>en</strong>tos con <strong>el</strong> hidróg<strong>en</strong>o<br />
Na + ½ H 2<br />
Cl<br />
NaH<br />
Br<br />
I<br />
76<br />
-295<br />
-274<br />
410<br />
-83<br />
Todos los alcalinos, calcio, estroncio y bario,<br />
reaccionan directam<strong>en</strong>te con <strong>el</strong> hidróg<strong>en</strong>o<br />
para dar hidruros iónicos<br />
Li + Al + 2 H 2<br />
Δ<br />
250 atm, 120-150 °C<br />
éter<br />
LiAlH 4<br />
4<br />
5<br />
6<br />
Química Inorgánica - 2007 2
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Algunas reacciones <strong>de</strong> los<br />
<strong>el</strong>em<strong>en</strong>tos con <strong>el</strong> hidróg<strong>en</strong>o (II)<br />
N 2 + 3 H 2<br />
O 2 + 2 H 2<br />
Cl 2 + H 2<br />
Δ, P<br />
Fe<br />
luz<br />
2 NH 3<br />
2 H 2 O<br />
2 HCl<br />
Clasificación <strong>de</strong> hidruros<br />
H<br />
Li<br />
K<br />
Rb<br />
Cs<br />
Fr<br />
Be<br />
Na Mg<br />
Ca<br />
Sr<br />
Ba<br />
Ra<br />
B<br />
Al<br />
Ga<br />
In<br />
Tl<br />
C<br />
Si<br />
Ge<br />
Sn<br />
Pb<br />
N<br />
P<br />
As<br />
Sb<br />
Bi<br />
O<br />
S<br />
Se<br />
Te<br />
Po<br />
F<br />
Cl<br />
Br<br />
I<br />
At<br />
He<br />
Ne<br />
Xe<br />
Rn<br />
Propieda<strong>de</strong>s <strong>de</strong> los hidruros<br />
iónicos<br />
Pres<strong>en</strong>tan estructuras tridim<strong>en</strong>sionales infinitas<br />
El LiH fundido conuce la <strong>el</strong>ectricidad y se libera H 2 <strong>en</strong> <strong>el</strong><br />
ánodo. También se <strong>de</strong>spr<strong>en</strong><strong>de</strong> hidróg<strong>en</strong>o <strong>en</strong> <strong>el</strong> ánodo<br />
por <strong>el</strong>ectrólisis <strong>de</strong> sus soluciones <strong>en</strong> haluros alcalinos<br />
fundidos<br />
Reaccionan fácilm<strong>en</strong>te con <strong>el</strong> agua y con ag<strong>en</strong>tes<br />
oxidantes<br />
NaH + H 2 O NaOH + H 2<br />
X δ- —H δ+ + H - X - + H 2<br />
Ar<br />
Kr<br />
7<br />
8<br />
9<br />
Química Inorgánica - 2007 3
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Hidruros con <strong>en</strong>laces<br />
multicéntricos<br />
BeH 2 : ca<strong>de</strong>na 1D<br />
AlH 3 : red 3D<br />
B 2 H 6 : molécula dinuclear<br />
Todos son muy reactivos con <strong>el</strong> agua<br />
B 2 H 6 + 6 H 2 O 2 H 3 BO 3 + 3 H 2<br />
Algunos hidruros no tan s<strong>en</strong>cillos<br />
Be<br />
Be<br />
Hidruros <strong>de</strong> los <strong>el</strong>em<strong>en</strong>tos <strong>de</strong>l <strong>grupo</strong> 14<br />
Hidrocarburos: C n H 2n+2 , C n H 2n , C n H 2n-2 , ...<br />
Silanos<br />
Germanos<br />
Estannanos<br />
Plumbanos<br />
Boranos<br />
B n H n+4<br />
B n H n+6<br />
Algunas reacciones <strong>de</strong> los<br />
<strong>el</strong>em<strong>en</strong>tos con <strong>el</strong> agua<br />
Todos los metales alcalinos, más Ca, Sr y Ba<br />
reaccionan con <strong>el</strong> agua liberando hidróg<strong>en</strong>o<br />
K + H2O KOH + ½ H2 Ca + 2 H2O Ca(OH) 2 + H2 El Mg sólo reacciona con agua cali<strong>en</strong>te<br />
Mg + 2 H2O Mg(OH) 2 + H2 Mg +H2O MgO + H2 El Be no reacciona<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
B<br />
H<br />
H<br />
H<br />
H<br />
B<br />
Be<br />
H<br />
H<br />
10<br />
11<br />
12<br />
Química Inorgánica - 2007 4
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Algunas reacciones <strong>de</strong> los<br />
<strong>el</strong>em<strong>en</strong>tos con <strong>el</strong> agua (II)<br />
El Al no reacciona con agua pura (pasivación)<br />
Al + 3H 2 SO 4<br />
Al 2 (SO 4 ) 3 + 3 H 2<br />
2 Al + 2 NaOH + H 2 O 2 Na[Al(OH) 4 ] + 3 H 2<br />
Reacciones con <strong>el</strong> agua: los<br />
halóg<strong>en</strong>os como oxidantes<br />
½F 2 (g) + e - → F - (ac) E ° = 2,85 V<br />
½Cl 2 (g) + e - → Cl - (ac) E ° = 1,36 V<br />
½Br 2 (l) + e - → Br - (ac) E ° = 1,06 V<br />
½I 2 (s) + e - → I - (ac) E ° = 0,53 V<br />
½O 2 (g) + 2H + (ac) + 2e - → H 2 O(ac) E ° = 1,23 V<br />
(<strong>en</strong> medio neutro: E °’ = 0,82 V)<br />
X 2(<strong>el</strong>em) + H 2O(ac) → X - (ac) + 2H + (ac) + ½O 2(g)<br />
Reacciones con <strong>el</strong> agua:<br />
<strong>de</strong>sproporcionación<br />
HClO(ac) + H + (ac) + e - → H 2 O (ac) + ½ Cl 2 (g)<br />
E ° = 1,63 V<br />
HBrO(ac) + H + (ac) + e - → H 2 O (ac) + ½ Br 2 (l)<br />
E ° = 1,59 V<br />
HIO (ac) + H + (ac) + e - → H 2 O(ac) + ½ I 2 (s)<br />
E ° = 1,45 V<br />
X 2(<strong>el</strong>em) + H 2O(ac) → X - (ac) + H + (ac) + HXO(ac)<br />
X 2(<strong>el</strong>em) + 2 OH - (ac) → X - (ac) + XO - (ac) + H 2O(l)<br />
13<br />
14<br />
15<br />
Química Inorgánica - 2007 5
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Compuestos oxig<strong>en</strong>ados <strong>de</strong> los<br />
metales alcalinos y su reacción<br />
con <strong>el</strong> agua<br />
4 Li + O2 2 Na + O2 K + O2 2 Li2O Na2O2 KO 2<br />
M 2O + H 2O 2 MOH<br />
M 2O 2 + 2 H 2O 2 MOH + H 2O 2<br />
2 MO 2 + 2 H 2O 2 MOH + H 2O 2 + O 2<br />
Todos los óxidos, peróxidos y superóxidos son<br />
bases fuertes<br />
O 2- + H 2O OH - + OH -<br />
H<br />
O<br />
H<br />
La basicidad <strong>de</strong> los óxidos aum<strong>en</strong>ta <strong>de</strong> Li 2O a<br />
Cs 2O<br />
Los peróxidos se <strong>de</strong>scompon<strong>en</strong> a óxidos al<br />
cal<strong>en</strong>tarlos<br />
Li 2O 2(s) Li 2O(s) + ½ O 2(g)<br />
Los carbonatos se <strong>de</strong>scompon<strong>en</strong> a óxidos al<br />
cal<strong>en</strong>tarlos<br />
Li 2CO 3(s) Li 2O(s) + CO 2(g)<br />
O<br />
2-<br />
16<br />
17<br />
18<br />
Química Inorgánica - 2007 6
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Para los metales alcalino-térreos<br />
2 M + O 2<br />
2 MO<br />
CaO(s) + H 2O(l) Ca(OH) 2(s)<br />
Ca(OH) 2(s) + CO 2(g) CaCO 3(s) + H 2O(l)<br />
> 900 °C<br />
CaCO3(s) CaO(s) + CO2(g) Óxido e hidróxido <strong>de</strong> berilio:<br />
propieda<strong>de</strong>s ácido-base<br />
Be(OH) 2 + 2 OH - [Be(OH) 4] 2-<br />
HO<br />
Be(OH) 2 + H 2SO 4<br />
OH<br />
Be<br />
OH<br />
OH<br />
BeSO 4 + H 2O<br />
Compuestos oxig<strong>en</strong>ados <strong>de</strong> los<br />
<strong>el</strong>em<strong>en</strong>tos <strong>de</strong>l <strong>grupo</strong> 13<br />
En condiciones normales, <strong>el</strong> B y <strong>el</strong> Al no reaccionan con<br />
<strong>el</strong> oxíg<strong>en</strong>o <strong>de</strong>l aire<br />
El carácter básico <strong>de</strong> los óxidos crece al bajar <strong>en</strong> <strong>el</strong><br />
<strong>grupo</strong>:<br />
B 2 O 3 es ácido<br />
Al 2 O 3 y Ga 2 O 3 son anfóteros<br />
In 2 O 3 y Tl 2 O 3 son básicos<br />
Tl 2 O + H 2 O 2 TlOH<br />
2-<br />
19<br />
20<br />
21<br />
Química Inorgánica - 2007 7
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Boratos<br />
B 2O 3 + 3 H 2O 2 B(OH) 3<br />
Algunos ejemplos:<br />
HO<br />
OH<br />
O B<br />
B O<br />
O B<br />
OH<br />
[B3O3 (OH) 6 ]<br />
HO<br />
B<br />
O<br />
B<br />
HO<br />
Unida<strong>de</strong>s estructurales: [BO 3 ] y [BO 4 ]<br />
HO<br />
B<br />
OH<br />
O O B<br />
B - O<br />
O O B<br />
OH<br />
[B 5 O 6 (OH) 4 ] -<br />
Compuestos oxig<strong>en</strong>ados <strong>de</strong> los<br />
<strong>el</strong>em<strong>en</strong>tos <strong>de</strong>l <strong>grupo</strong> 14<br />
Carácter ácido-base <strong>de</strong> los óxidos:<br />
CO2 + H2O H2CO3 CO2 + OH- [HCO3] -<br />
CO + OH - no hay reacción<br />
SiO 2 + OH - muy l<strong>en</strong>ta<br />
GeO, GeO 2, SnO y SnO 2 son anfóteros<br />
PbO es anfótero<br />
PbO 2 es ácido<br />
Óxidos y oxoaniones<br />
CO 2 : moléculas aisladas<br />
SiO 2,GeO 2,SnO 2 y PbO 2 : re<strong>de</strong>s 3D<br />
O<br />
Si<br />
O O<br />
O<br />
[CO 3 ] 2-<br />
O<br />
H<br />
OH<br />
OH<br />
C O<br />
silicatos:<br />
tetraedros unidos por los vértices<br />
4-<br />
O<br />
C O<br />
O<br />
H<br />
22<br />
23<br />
24<br />
Química Inorgánica - 2007 8
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Oxidos <strong>de</strong> nitróg<strong>en</strong>o<br />
O<br />
N<br />
N<br />
N<br />
N<br />
N<br />
O<br />
O<br />
O<br />
O<br />
N<br />
O<br />
O<br />
O<br />
N<br />
O<br />
Oxidos <strong>de</strong> fósforo<br />
Algunos oxoaniones <strong>de</strong><br />
nitróg<strong>en</strong>o y fósforo<br />
nitrito<br />
H<br />
H<br />
O<br />
P O<br />
O<br />
-<br />
N<br />
hipofosfito<br />
O<br />
-<br />
fosfito<br />
O<br />
H<br />
P O<br />
O<br />
2-<br />
O<br />
dipolifosfato<br />
N<br />
O<br />
O<br />
fosfato<br />
N<br />
N<br />
O<br />
O O<br />
O<br />
O<br />
O<br />
O<br />
[NO 2 ][NO 3 ]<br />
O<br />
P O<br />
O<br />
P O<br />
O<br />
3-<br />
O<br />
P O<br />
O<br />
4-<br />
25<br />
26<br />
27<br />
Química Inorgánica - 2007 9
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Comportami<strong>en</strong>to redox <strong>en</strong><br />
solución acuosa<br />
Oxidos <strong>de</strong> azufre<br />
Algunos oxoaniones <strong>de</strong> azufre<br />
y s<strong>el</strong><strong>en</strong>io<br />
O<br />
S O<br />
O<br />
sulfito<br />
O<br />
2-<br />
S<br />
S O<br />
O<br />
tiosulfato<br />
2-<br />
O<br />
O<br />
S O<br />
O<br />
sulfato<br />
2-<br />
peroxodisulfato<br />
O<br />
O<br />
S O<br />
O<br />
O<br />
O<br />
O<br />
S O<br />
O<br />
O<br />
Se O<br />
O<br />
s<strong>el</strong><strong>en</strong>ato<br />
2-<br />
2-<br />
28<br />
29<br />
30<br />
Química Inorgánica - 2007 10
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Propieda<strong>de</strong>s redox<br />
Oxidos <strong>de</strong> los halóg<strong>en</strong>os<br />
2 F 2 + 2 OH - OF 2 + 2 F - + H 2O<br />
2 Cl 2 + 2 HgO HgCl 2·HgO + Cl 2O<br />
2 ClO 3 - + SO2 2 ClO 2 + SO 4 2-<br />
2 ClO 2 + 2 O 3<br />
2 HClO 4<br />
Cl 2O 7<br />
Cl 2O 6 + 2 O 2<br />
Oxoácidos y oxoaniones<br />
F 2 + H 2O HOF + HF (T = - 40°C)<br />
3 OX - 2 X - + XO 3 - (v aum<strong>en</strong>ta al aum<strong>en</strong>tar T)<br />
2 ClO 2 + 2 OH - ClO 2 - + ClO3 - + H2O<br />
4 ClO 3 - 3 ClO 4 - + Cl - (muy l<strong>en</strong>ta)<br />
IO 3 - + 6 OH - + Cl2 IO 6 5- + 3 H2O + 2 Cl -<br />
31<br />
32<br />
33<br />
Química Inorgánica - 2007 11
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Propieda<strong>de</strong>s redox <strong>en</strong> solución<br />
acuosa<br />
Metales, semimetales, no<br />
metales (III)<br />
H<br />
Li<br />
K<br />
Rb<br />
Cs<br />
Fr<br />
Be<br />
Na Mg<br />
Ca<br />
Sr<br />
Ba<br />
Ra<br />
B<br />
Al<br />
Ga<br />
In<br />
Tl<br />
C<br />
Si<br />
Ge<br />
Sn<br />
Pb<br />
N<br />
P<br />
As<br />
Sb<br />
Bi<br />
O<br />
S<br />
Se<br />
Te<br />
Po<br />
F<br />
Cl<br />
Br<br />
I<br />
At<br />
He<br />
Ne<br />
Ar<br />
Kr<br />
Xe<br />
Rn<br />
34<br />
35<br />
36<br />
Química Inorgánica - 2007 12
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Reacciones <strong>de</strong> los <strong>el</strong>em<strong>en</strong>tos con<br />
los halóg<strong>en</strong>os<br />
Todos los metales <strong>de</strong> los <strong>grupo</strong>s 1, 2 y 13<br />
reaccionan <strong>en</strong> forma directa con los<br />
halóg<strong>en</strong>os<br />
2 M + n X 2<br />
Boro<br />
2 B + 3 F 2<br />
Haluros binarios<br />
H<br />
Li<br />
K<br />
Rb<br />
Cs<br />
Fr<br />
Be<br />
Na Mg<br />
Ca<br />
Sr<br />
Ba<br />
Ra<br />
Δ<br />
B<br />
Al<br />
Ga<br />
In<br />
Tl<br />
2MX n<br />
2 BF 3<br />
C<br />
Si<br />
Ge<br />
Sn<br />
Pb<br />
As<br />
Sb<br />
Bi<br />
Haluros intermedios<br />
N<br />
P<br />
O<br />
S<br />
Se<br />
Te<br />
Po<br />
F<br />
Cl<br />
Br<br />
I<br />
At<br />
He<br />
Ne<br />
Ar<br />
Kr<br />
Xe<br />
Rn<br />
37<br />
38<br />
39<br />
Química Inorgánica - 2007 13
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Características <strong>de</strong> los haluros<br />
coval<strong>en</strong>tes<br />
Fórmula g<strong>en</strong>eral: AX n<br />
Difer<strong>en</strong>cia <strong>de</strong> <strong>el</strong>ectronegativida<strong>de</strong>s <strong>en</strong>tre A y X,<br />
g<strong>en</strong>eralm<strong>en</strong>te <strong>en</strong>tre 0 y 1<br />
En g<strong>en</strong>eral, ti<strong>en</strong><strong>en</strong> como base estructural<br />
moléculas discretas, con <strong>en</strong>laces coval<strong>en</strong>tes,<br />
<strong>de</strong> geometría pre<strong>de</strong>cible por RPENV<br />
Reacciones <strong>de</strong> los <strong>el</strong>em<strong>en</strong>tos con<br />
los halóg<strong>en</strong>os (II)<br />
2 P + n X2 2PXn n = 3: todos los halóg<strong>en</strong>os<br />
n = 5: sólo F, Cl y Br<br />
S + n X2 SX2n n = 2: sólo Cl y F<br />
n = 3: sólo F<br />
Más haluros coval<strong>en</strong>tes<br />
14<br />
15<br />
16<br />
CX 4<br />
NF 3<br />
NCl 3<br />
OF 2<br />
SiX 4<br />
PX 3<br />
PF 5 , PCl 5<br />
PBr 5<br />
SF2 , SCl2 SF4 , SCl4 SF6 GeX2 GeX4 AsX3 AsF5 SeCl2 SeBr2 SeCl4 SeBr 4 , SeF 6<br />
SnX2 SnX4 SbX 3<br />
SbF 5 , SbCl 5<br />
TeCl 2<br />
TeBr 2<br />
TeX 4<br />
TeF 6<br />
40<br />
41<br />
42<br />
Química Inorgánica - 2007 14
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Interhalóg<strong>en</strong>os<br />
XY<br />
ClF<br />
BrF *<br />
IF *<br />
BrCl *<br />
ICl<br />
IBr<br />
XY 3<br />
ClF 3<br />
BrF 3<br />
(IF 3) n<br />
I 2Cl 6<br />
XY 5<br />
ClF 5<br />
BrF 5<br />
IF 5<br />
Reacción <strong>de</strong> los hidruros<br />
coval<strong>en</strong>tes con <strong>el</strong> agua<br />
XY 7<br />
IF 7<br />
BCl 3 + 3H 2O H 3BO 3 + 3HCl<br />
SiCl 4 + 2H 2O SiO 2 + 4HCl<br />
PCl 5 + 4H 2O H 3PO 4 + 5HCl<br />
BrCl + H 2O HBrO + HCl<br />
SF 6 + 3H 2O SO 2 + 6HF + ½O 2<br />
PF 3 + 3H 2O H 2PO 3 + 3HF + ½H 2<br />
NCl 3 + 3H 2O NH 3 + 3HClO<br />
Haluros <strong>de</strong> los gases nobles<br />
400°C, 1 atm<br />
Xe(g) + F 2(g) XeF 2(g)<br />
600°C, 6 atm<br />
Xe(g) + 2 F 2(g) XeF 4(g)<br />
300°C, 60 atm<br />
Xe(g) + 3 F 2(g) XeF 6(g)<br />
Xe <strong>en</strong> exceso<br />
Xe:F 2 = 1:5<br />
Xe:F 2 = 1:20<br />
43<br />
44<br />
45<br />
Química Inorgánica - 2007 15
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Reacciones <strong>de</strong> los fluoruros <strong>de</strong><br />
x<strong>en</strong>ón (I)<br />
2 XeF 2(g) + 2 H 2O(l) 2 Xe(g) + 4 HF(g) + O 2(g)<br />
XeF 4(g) + Pt(s) Xe(g) + PtF 4(s)<br />
XeF 2 + SbF 5<br />
[XeF] + [SbF 6] -<br />
XeF 4 + [N(CH 3) 4]F [N(CH 3) 4] + [XeF 5] -<br />
Reacciones <strong>de</strong> los fluoruros <strong>de</strong><br />
x<strong>en</strong>ón (II)<br />
XeF 6 + 3 H 2O XeO 3 + 6 HF<br />
2 XeF 6 + 3 SiO 2<br />
2 XeO 3 + 3 SiF 4<br />
XeO3 HXeVIO -<br />
4 (ac) Xe0 + [XeVIIIO6] 4- OH<br />
(ac)<br />
- (ac)<br />
Aspectos <strong>de</strong><br />
estructura y <strong>en</strong>lace<br />
48<br />
46<br />
47<br />
Química Inorgánica - 2007 16
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
F<br />
F<br />
Formas <strong>de</strong> las moléculas<br />
O<br />
O<br />
O<br />
Xe<br />
O<br />
F<br />
Xe<br />
F<br />
O<br />
O<br />
4 -<br />
XeF 2 : lineal<br />
XeF 4 : plana cuadrada<br />
XeO 6 4- : octaédrica<br />
F<br />
F<br />
F<br />
Xe F<br />
Mo<strong>de</strong>lo <strong>de</strong> RPENV<br />
Formas <strong>de</strong> las moléculas (II)<br />
F<br />
Br<br />
F<br />
F<br />
ClF 3 : forma <strong>de</strong> “T”<br />
BrF 5 : pirámi<strong>de</strong> <strong>de</strong> base cuadrada<br />
IF 7 : bipirámi<strong>de</strong> p<strong>en</strong>tagonal<br />
Formas <strong>de</strong> las moléculas (III)<br />
F<br />
F<br />
Cl<br />
F<br />
F<br />
F<br />
F<br />
I<br />
F<br />
F<br />
F<br />
F<br />
49<br />
50<br />
51<br />
Química Inorgánica - 2007 17
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Hibridación<br />
sp lineal<br />
sp 2 triangular plana<br />
sp 3 tetraédrica<br />
sp 3 d (d z 2) bipiramidal trigonal<br />
sp 3 d (d x 2_ y 2) piramidal <strong>de</strong> base cuadrada<br />
sp 3 d 2 octaédrica<br />
sp 2 d plano-cuadrada<br />
La hibridación <strong>de</strong> los orbitales <strong>de</strong> val<strong>en</strong>cia s y<br />
p es más efectiva cuando n = 2<br />
La participación <strong>de</strong> los orbitales d <strong>en</strong> <strong>en</strong>laces<br />
σ localizados es tema <strong>de</strong> <strong>de</strong>bate<br />
Energías <strong>de</strong> <strong>en</strong>lace al variar <strong>el</strong><br />
número <strong>de</strong> coordinación<br />
F F<br />
S<br />
sp 3 d<br />
F<br />
F<br />
sp 3<br />
S F<br />
F<br />
SF2 SF4 SF6 Valores <strong>en</strong> kJ/mol<br />
sp 3 d 2<br />
367<br />
339<br />
329<br />
¿Hay casos <strong>en</strong> que no se cumple<br />
la regla <strong>de</strong>l octeto?<br />
F<br />
F<br />
F<br />
S<br />
F<br />
F<br />
F<br />
F<br />
F<br />
F<br />
F<br />
F<br />
S<br />
F<br />
F<br />
S<br />
2+<br />
F<br />
F<br />
F<br />
F<br />
F<br />
_<br />
_<br />
2+ _<br />
F<br />
_<br />
F<br />
F<br />
S<br />
F<br />
F<br />
F<br />
52<br />
53<br />
54<br />
Química Inorgánica - 2007 18
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
¿Hay casos <strong>en</strong> que no se cumple<br />
la regla <strong>de</strong>l octeto?<br />
_<br />
F<br />
F<br />
Xe<br />
F<br />
. . +<br />
+<br />
: Xe : : Xe :<br />
. .<br />
F<br />
F<br />
_<br />
F<br />
hibridación: sp3d (parcipan orbitales d)<br />
hibridación: sp 2<br />
(no participan orbitales d)<br />
Enlace tricéntrico con cuatro<br />
<strong>el</strong>ectrones: XeF2 + +<br />
+ +<br />
+ +<br />
p<br />
2F F-Xe-F Xe<br />
F<br />
Xe<br />
No se requier<strong>en</strong> orbitales d para <strong>de</strong>scribir <strong>el</strong> <strong>en</strong>lace<br />
Moléculas <strong>de</strong>fici<strong>en</strong>tes <strong>en</strong><br />
<strong>el</strong>ectrones: <strong>en</strong>lace tricéntrico con<br />
dos <strong>el</strong>ectrones<br />
sp 3<br />
3σ<br />
2σ<br />
1σ<br />
2B B-H-B H<br />
σ ∗<br />
Pu<strong>en</strong>tes <strong>de</strong> hidróg<strong>en</strong>o<br />
σ<br />
F<br />
p<br />
s<br />
55<br />
56<br />
57<br />
Química Inorgánica - 2007 19
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Concat<strong>en</strong>ación<br />
Carbono: alcanos, alqu<strong>en</strong>os, alquinos, anillos<br />
aromáticos<br />
Silanos, germanos y estannanos: E nH 2n+2<br />
(n= 10 → E = Si, Ge; n=2 → E=Sn)<br />
Organocompuestos: ca<strong>de</strong>nas E n(CH 3) 2n+2 ,<br />
anillos (ER 2) n<br />
Carbono y silicio<br />
A n-1H 2n(g) + A(s) + H 2(g) → A nH 2n+2(g)<br />
C-C<br />
Si-Si<br />
356<br />
226<br />
C=C<br />
Si=Si<br />
Valores <strong>en</strong> kJ/mol<br />
602<br />
310<br />
C-H<br />
Si-H<br />
H-H<br />
Carbono y silicio (II)<br />
416<br />
326<br />
435<br />
Crecimi<strong>en</strong>to <strong>de</strong> la ca<strong>de</strong>na<br />
Enlaces que se romp<strong>en</strong><br />
2 (A-A) + 1 (H-H)<br />
Enlaces que se forman<br />
1 (A-A) + 2 (A-H)<br />
Balance<br />
Para A = Carbono: - 41 kJ/mol<br />
Para A = Silicio: +6 kJ/mol<br />
C-Cl<br />
Si-Cl<br />
Cl-Cl<br />
338<br />
391<br />
242<br />
58<br />
59<br />
60<br />
Química Inorgánica - 2007 20
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Carbono y silicio (III)<br />
Combustión<br />
A nH 2n+2 + (3n+1)/2 O 2 → n AO 2 + (n+1) H 2O<br />
Hidrólisis<br />
A nH 2n+2 + 2n H 2O → n AO 2 + (3n+1) H 2<br />
Cloruros<br />
A n-1Cl 2n(g) + A(s) + Cl 2(g) → A nCl 2n+2(g)<br />
Energías <strong>de</strong> <strong>en</strong>lace<br />
simple y múltiples<br />
C-C<br />
C=C<br />
Si-Si<br />
Si=Si<br />
14<br />
356<br />
602<br />
226<br />
310<br />
N-N<br />
N≡N<br />
P-P<br />
P≡P<br />
15<br />
167<br />
945<br />
209<br />
493<br />
Los <strong>en</strong>laces múltiples<br />
O-O<br />
O=O<br />
S-S<br />
S=S<br />
16<br />
144<br />
513<br />
226<br />
431<br />
Valores <strong>en</strong> kJ/mol<br />
Elem<strong>en</strong>tos <strong>de</strong>l segundo período: bu<strong>en</strong><br />
solapami<strong>en</strong>to pπ – pπ<br />
Elem<strong>en</strong>tos <strong>de</strong> los períodos sigui<strong>en</strong>tes:<br />
solapami<strong>en</strong>to pπ – pπ <strong>de</strong>fici<strong>en</strong>te<br />
61<br />
62<br />
63<br />
Química Inorgánica - 2007 21
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Algunas consecu<strong>en</strong>cias<br />
P<br />
S<br />
S<br />
P<br />
P<br />
S<br />
S<br />
S<br />
P<br />
S<br />
<strong>en</strong> lugar <strong>de</strong><br />
Más consecu<strong>en</strong>cias<br />
S<br />
6 x EE(P-P) = 1254 kJ/mol<br />
2 x EE(P≡P) = 986 kJ/mol<br />
S<br />
2 x<br />
P P<br />
<strong>en</strong> lugar <strong>de</strong> 4 x S S<br />
Estructuras <strong>de</strong> los dióxidos <strong>de</strong> carbono y silicio<br />
Elección <strong>en</strong>tre formar más <strong>en</strong>laces simples A-O<br />
ó <strong>en</strong>laces dobles A=O<br />
Compuestos <strong>de</strong> Si, Ge o Pb análogos a<br />
alqu<strong>en</strong>os y alquinos<br />
Si 2 H 4 oSi 2 H 2 nunca se han aislado<br />
Enlaces múltiples se estabilizan por <strong>grupo</strong>s<br />
orgánicos voluminosos<br />
Ejemplos<br />
R<br />
R<br />
Si Si<br />
R<br />
R<br />
X<br />
X<br />
E +<br />
R<br />
R<br />
Si Si<br />
Si<br />
Si<br />
Si Si<br />
E +<br />
R<br />
R<br />
64<br />
65<br />
66<br />
Química Inorgánica - 2007 22
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Moléculas R 2X=XR 2 no planas<br />
La participación <strong>de</strong> orbitales d <strong>en</strong><br />
<strong>en</strong>laces múltiples<br />
pπ –dπ<br />
dπ –dπ<br />
Estructuras <strong>de</strong> la trimetilamina y trisililamina:<br />
Piramidal vs. triangular<br />
C<br />
H 3<br />
N<br />
CH3 CH3 R<strong>el</strong>aciones iso<strong>el</strong>ectrónicas:<br />
similitu<strong>de</strong>s <strong>en</strong>tre C-C y B-N<br />
{BN} x pres<strong>en</strong>ta<br />
estructura tipo<br />
grafito<br />
H<br />
H<br />
H<br />
Si<br />
N<br />
SiH 3<br />
SiH 3<br />
67<br />
68<br />
69<br />
Química Inorgánica - 2007 23
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
R<strong>el</strong>aciones iso<strong>el</strong>ectrónicas:<br />
similitu<strong>de</strong>s <strong>en</strong>tre C-C y B-N<br />
Boracina B 3N 3H 6<br />
Anomalías <strong>en</strong> <strong>el</strong> segundo período<br />
Li y Be respecto <strong>de</strong> los restantes metales <strong>de</strong>l<br />
bloque s<br />
Alótropos <strong>de</strong> <strong>el</strong>em<strong>en</strong>tos <strong>de</strong>l bloque p con<br />
<strong>en</strong>laces múltiples<br />
Regla <strong>de</strong>l octeto<br />
Mayor estabilidad cinética <strong>de</strong> haluros <strong>de</strong>l<br />
bloque p fr<strong>en</strong>te a la sustitución nucleofílica<br />
El primer <strong>el</strong>em<strong>en</strong>to <strong>de</strong>l <strong>grupo</strong><br />
Tamaño pequeño<br />
Mayor <strong>el</strong>ectronegatividad<br />
Enlaces π fuertes, usando orbitales p<br />
T<strong>en</strong><strong>de</strong>ncia a formar aniones y estados <strong>de</strong><br />
oxidación negativos<br />
No hay orbitales d <strong>de</strong> baja <strong>en</strong>ergía, número<br />
máximo <strong>de</strong> coordinación 4<br />
70<br />
71<br />
72<br />
Química Inorgánica - 2007 24
Los Elem<strong>en</strong>tos Repres<strong>en</strong>tativos<br />
(Segunda parte)<br />
Los <strong>el</strong>em<strong>en</strong>tos restantes<br />
Gran discontinuidad <strong>en</strong> las propieda<strong>de</strong>s<br />
respecto <strong>de</strong>l primer <strong>el</strong>em<strong>en</strong>to (C, N, O)<br />
El <strong>el</strong>em<strong>en</strong>to más pesado <strong>de</strong>l <strong>grupo</strong> difiere <strong>de</strong>l<br />
resto <strong>en</strong>:<br />
Estabilidad <strong>de</strong> estados <strong>de</strong> oxidación m<strong>en</strong>ores<br />
(positivos)<br />
Oxidos más básicos<br />
Enlaces más débiles con H<br />
Los <strong>el</strong>em<strong>en</strong>tos más pesados pue<strong>de</strong>n pres<strong>en</strong>tar<br />
mayores números <strong>de</strong> coordinación<br />
R<strong>el</strong>aciones diagonales<br />
Li y Mg<br />
Be y Al<br />
B y Si<br />
73<br />
74<br />
Química Inorgánica - 2007 25





![OBTENCIÓN Y PROPIEDADES DEL Cu2[Hg I4] (P 3)](https://img.yumpu.com/14365645/1/184x260/obtencion-y-propiedades-del-cu2hg-i4-p-3.jpg?quality=85)


![K3[Fe(ox)3]](https://img.yumpu.com/14204537/1/184x260/k3feox3.jpg?quality=85)

