Kit Monouso PRGF®-Endoret® Traumatologia - BTI Biotechnology ...
Kit Monouso PRGF®-Endoret® Traumatologia - BTI Biotechnology ...
Kit Monouso PRGF®-Endoret® Traumatologia - BTI Biotechnology ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Kit</strong> Endoret ® traumatología (set 4 tubos) y<br />
<strong>Kit</strong> Endoret ® traumatología (set 8 tubos)<br />
es<br />
Uso previsto: Los KIT ENDORET® TRAUMATOLOGÍA (sets 4 tubos) y KIT ENDORET® TRAUMATOLOGÍA (sets 8 tubos) constituyen<br />
un sistema de obtención de plasma rico en factores de crecimiento, que pueden aplicarse en la regeneración de hueso y otros<br />
tejidos conjuntivos y en el tratamiento de lesiones músculo-esqueléticas.<br />
Descripción del producto: Los KIT ENDORET® TRAUMATOLOGIA (sets 4 tubos) y KIT ENDORET® TRAUMATOLOGIA (sets 8 tubos)<br />
contienen 8 kits monouso cada uno de ellos.<br />
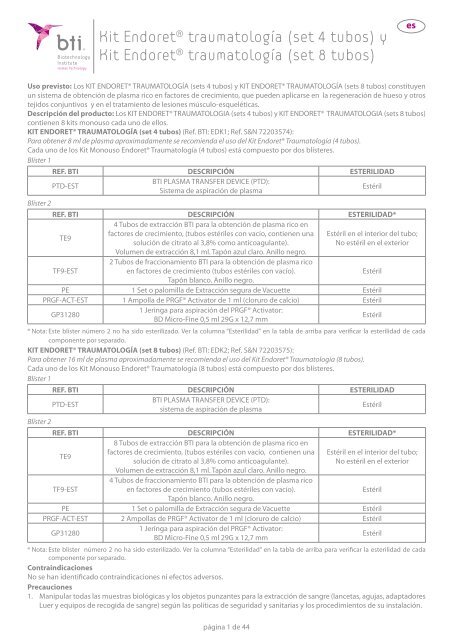
KIT ENDORET® TRAUMATOLOGÍA (set 4 tubos) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
Para obtener 8 ml de plasma aproximadamente se recomienda el uso del <strong>Kit</strong> Endoret® Traumatología (4 tubos).<br />
Cada uno de los <strong>Kit</strong> <strong>Monouso</strong> Endoret® Traumatología (4 tubos) está compuesto por dos blísteres.<br />
Blíster 1<br />
REF. <strong>BTI</strong> DESCRIPCIÓN ESTERILIDAD<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD):<br />
PTD-EST<br />
Estéril<br />
Sistema de aspiración de plasma<br />
Blíster 2<br />
REF. <strong>BTI</strong> DESCRIPCIÓN ESTERILIDAD*<br />
TE9<br />
TF9-EST<br />
4 Tubos de extracción <strong>BTI</strong> para la obtención de plasma rico en<br />
factores de crecimiento, (tubos estériles con vacío, contienen una<br />
solución de citrato al 3,8% como anticoagulante).<br />
Volumen de extracción 8,1 ml. Tapón azul claro. Anillo negro.<br />
2 Tubos de fraccionamiento <strong>BTI</strong> para la obtención de plasma rico<br />
en factores de crecimiento (tubos estériles con vacío).<br />
Tapón blanco. Anillo negro.<br />
Estéril en el interior del tubo;<br />
No estéril en el exterior<br />
PE 1 Set o palomilla de Extracción segura de Vacuette Estéril<br />
PRGF-ACT-EST 1 Ampolla de PRGF® Activator de 1 ml (cloruro de calcio) Estéril<br />
GP31280<br />
1 Jeringa para aspiración del PRGF® Activator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Estéril<br />
* Nota: Este blíster número 2 no ha sido esterilizado. Ver la columna “Esterilidad” en la tabla de arriba para verificar la esterilidad de cada<br />
componente por separado.<br />
KIT ENDORET® TRAUMATOLOGÍA (set 8 tubos) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
Para obtener 16 ml de plasma aproximadamente se recomienda el uso del <strong>Kit</strong> Endoret® Traumatología (8 tubos).<br />
Cada uno de los <strong>Kit</strong> <strong>Monouso</strong> Endoret® Traumatología (8 tubos) está compuesto por dos blísteres.<br />
Blíster 1<br />
REF. <strong>BTI</strong> DESCRIPCIÓN ESTERILIDAD<br />
PTD-EST<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD):<br />
sistema de aspiración de plasma<br />
Estéril<br />
Blíster 2<br />
REF. <strong>BTI</strong> DESCRIPCIÓN ESTERILIDAD*<br />
8 Tubos de extracción <strong>BTI</strong> para la obtención de plasma rico en<br />
TE9<br />
factores de crecimiento, (tubos estériles con vacío, contienen una Estéril en el interior del tubo;<br />
solución de citrato al 3,8% como anticoagulante).<br />
No estéril en el exterior<br />
Volumen de extracción 8,1 ml. Tapón azul claro. Anillo negro.<br />
TF9-EST<br />
4 Tubos de fraccionamiento <strong>BTI</strong> para la obtención de plasma rico<br />
en factores de crecimiento (tubos estériles con vacío).<br />
Estéril<br />
Tapón blanco. Anillo negro.<br />
PE 1 Set o palomilla de Extracción segura de Vacuette Estéril<br />
PRGF-ACT-EST 2 Ampollas de PRGF® Activator de 1 ml (cloruro de calcio) Estéril<br />
GP31280<br />
1 Jeringa para aspiración del PRGF® Activator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Estéril<br />
* Nota: Este blíster número 2 no ha sido esterilizado. Ver la columna “Esterilidad” en la tabla de arriba para verificar la esterilidad de cada<br />
componente por separado.<br />
Contraindicaciones<br />
No se han identificado contraindicaciones ni efectos adversos.<br />
Precauciones<br />
1. Manipular todas las muestras biológicas y los objetos punzantes para la extracción de sangre (lancetas, agujas, adaptadores<br />
Luer y equipos de recogida de sangre) según las políticas de seguridad y sanitarias y los procedimientos de su instalación.<br />
Estéril<br />
página 1 de 44
2. Virus (como los de la hepatitis B y C, el VIH (SIDA) u otras enfermedades infecciosas) pueden transmitirse por contacto con<br />
las muestras biológicas. En caso de exposición a muestras biológicas, reciba la atención médica apropiada.<br />
3. Si se recoge la sangre a través de una vía intravenosa, comprobar que no queda nada de cualquier medicamento o disolución<br />
química. Desechar los objetos de acuerdo a la política de extracción de sangre del centro.<br />
4. Todos los aditivos líquidos en los tubos de sangre deben de ser incoloros e inodoros. No utilizar tubos en los que haya<br />
cambiado el color del aditivo. No utilizar si se detectan materias extrañas en los tubos o en el activador.<br />
5. La reutilización y/ó re esterilización de éstos productos puede provocar riesgo de infección y/ó contaminación cruzada.<br />
6. Seguir siempre el protocolo de extracción de sangre del centro.<br />
7. Niños, embarazo y mujeres lactantes: No se consideran precauciones adicionales debido a estos estados, sin embargo, la situación<br />
individual de cada paciente deberá ser tenida en cuenta por el clínico antes de la aplicación de la técnica PRGF-ENDORET ®.<br />
Práctica aséptica<br />
1. Siga los protocolos de operación aséptica de su centro, para minimizar las posibilidades de contaminar las fracciones de<br />
plasma obtenidas mediante la técnica PRGF-ENDORET®.<br />
2. La utilización de una cabina de flujo laminar adecuada en los procesos de fraccionamiento y activación (Cabina de flujo<br />
laminar <strong>BTI</strong>, Ref.FLVA60<strong>BTI</strong>) disminuye el riesgo de contaminación microbiológica.<br />
Eliminación de los residuos<br />
1. Deben observarse las directivas generales sobre higiene y la normativa legal que regula la eliminación apropiada del<br />
material infeccioso.<br />
2. Lleve guantes para reducir el riesgo de infecciones.<br />
3. Los tubos de recogida llenos o los tubos que contengan sangre contaminada deben reunirse en recipientes adecuados para<br />
residuos potencialmente infecciosos.<br />
4. Los residuos se eliminan normalmente o bien mediante incineración o bien mediante tratamiento en autoclave (esterilización<br />
al vapor).<br />
Precauciones de almacenamiento<br />
Temperatura de almacenamiento: guardar a 4-25º C.<br />
AVISO: Superar la temperatura de almacenamiento máxima puede inducir un deterioro de la calidad del tubo (es decir,<br />
pérdida de vacío, evaporación de los aditivos líquidos, cambio de color, etc.).<br />
No utilizar después de la fecha de caducidad.<br />
Mantener fuera de la luz del sol.<br />
Instrucciones de Uso<br />
1. Extracción de sangre<br />
Llevar guantes durante la extracción de sangre y al manipular los tubos de recogida de sangre para reducir al mínimo el riesgo de<br />
exposición.<br />
La sangre debe ser utilizada dentro de las 4 horas después de la extracción. No extraer la sangre si se plantea utilizarla después de<br />
4 horas desde la extracción.<br />
1. Seleccionar los tubos necesarios para obtener las fracciones de plasma deseadas.<br />
NOTA: Los tubos de extracción de <strong>BTI</strong> contienen aditivos. Por tanto, es importante evitar el posible reflujo desde el tubo,<br />
dada la posibilidad de reacciones adversas en el paciente. Para evitar el reflujo del tubo al brazo del paciente, observar<br />
las siguientes precauciones:<br />
a) Colocar el brazo del paciente en posición descendente.<br />
b) Sostener el tubo con el tapón hacia arriba.<br />
c) Liberar el compresor en cuanto la sangre empiece a fluir al tubo.<br />
d) Comprobar que el contenido del tubo no toca el extremo de la aguja durante la venopunción.<br />
2. Aplicar un compresor (máx. 1 minuto). Preparar el sitio de venopunción con una toallita con antiséptico. No palpar la zona<br />
de venopunción después de limpiarla.<br />
3. Extraer la palomilla con el tubo de silicona y el adaptador de su envoltura estéril.<br />
4. Retirar el capuchón de la aguja.<br />
5. Realizar la venopunción con el brazo del paciente en posición descendente.<br />
6. Empujar el tubo contra el soporte y la válvula de la aguja perforando el diafragma de goma. Centrar bien los tubos en el<br />
soporte cuando se introduzca el tapón para evitar la perforación lateral y la consiguiente pérdida prematura del vacío.<br />
7. Retirar el compresor en cuanto aparezca sangre en el tubo. No permitir que el contenido del tubo toque el tapón durante el<br />
procedimiento. No invertir el tubo y mantenerlo siempre en posición ascendente apretándolo con el pulgar para asegurar<br />
una completa aspiración al vacío.<br />
8. Cuando el primer tubo esté lleno y cese el flujo de sangre, retirarlo suavemente del soporte.<br />
NOTA: Si no fluye sangre al tubo o si se interrumpe el flujo antes de obtener una muestra adecuada, se sugieren las siguientes<br />
etapas para completar una extracción satisfactoria:<br />
a) Empujar el tubo hacia delante hasta perforar el tapón. Mantenerlo siempre en posición apretándolo con el pulgar para<br />
asegurar una extracción al vacío completa.<br />
b) Confirmar la posición correcta de la aguja en la vena.<br />
c) Si la sangre sigue sin fluir, retirar el tubo y colocar uno nuevo en el soporte.<br />
d) Si esta acción sigue sin dar resultados satisfactorios, retirar la aguja y desecharla. Repetir el procedimiento desde el paso 1.<br />
9. Invertir con suavidad los tubos de 4 a 6 veces inmediatamente después de la extracción para conseguir una mezcla apropiada del<br />
aditivo y la sangre. Girar el tubo lleno de arriba a abajo y volver a colocarlo hacia arriba. Esto constituye una inversión completa.<br />
página 2 de 44
NOTA: No agitar los tubos. Una mezcla enérgica puede provocar espuma, hemólisis y activación de las plaquetas, así como<br />
resultados incorrectos de la Técnica PRGF-ENDORET®. Una mezcla inadecuada puede generar también resultados<br />
indeseables.<br />
10. Repetir los pasos 6, 7, 8 con el resto de los tubos necesarios.<br />
11. En cuanto la sangre deje de fluir en el último tubo, retirar la aguja de la vena, aplicando presión en la zona del pinchazo<br />
con una torunda estéril seca hasta que cese la hemorragia. En cuanto se haya producido la coagulación, aplicar un apósito<br />
estéril.<br />
NOTA: Después de la venopunción, la parte superior del tapón puede contener restos de sangre. Tomar las precauciones apropiadas<br />
cuando se manipulen los tubos para evitar el contacto con esta sangre. Cualquier objeto que se contamine con sangre se<br />
considera peligroso y debe desecharse inmediatamente.<br />
12. Desechar la aguja utilizada con el soporte empleando un dispositivo de eliminación apropiado. NO VOLVER A TAPAR. Volver<br />
a colocar el capuchón de las agujas aumenta el riesgo de pinchazo y de exposición a sangre.<br />
NOTA: Puede producirse el derrame ocasional de sangre del manguito de la aguja. Practicar precauciones de seguridad universales<br />
para reducir al mínimo el riesgo de exposición.<br />
2. Centrifugación<br />
Una vez llenos, los tubos deben centrifugarse inmediatamente después de la extracción de sangre o en un máximo de una hora. Bajo<br />
ningún concepto deben refrigerarse.<br />
LOS TUBOS DE EXTRACCION <strong>BTI</strong> SÓLO DEBEN CENTRIFUGARSE EN UNA CENTRÍFUGA MODELO SYSTEM IV DE <strong>BTI</strong>. De esta forma,<br />
aseguramos que las fracciones de plasma obtenidas mediante la técnica PRGF-ENDORET® están debidamente separadas y listas<br />
para ser utilizadas en las diferentes aplicaciones clínicas aprobadas.<br />
Síganse las instrucciones específicas de uso de la centrífuga System IV de <strong>BTI</strong>.<br />
Tras la centrifugación la sangre se separa en tres componentes:<br />
• Plasma rico en factores de crecimiento: es la columna de plasma (color amarillo) que contiene la mayor parte de las<br />
plaquetas, distribuidas según un gradiente creciente de concentración (esto quiere decir que el número de plaquetas es<br />
menor en la parte alta del tubo y aumenta al descender).<br />
• Serie blanca ó leucocitos: es la capa fina blanquecina que se deposita justo encima de los hematíes (también llamada<br />
buffy coat).<br />
• Hematíes: es la columna roja que ocupa la parte inferior del tubo.<br />
3. Fraccionamiento usando el PLASMA TRANSFER DEVICE (PTD)<br />
Antes de iniciar el fraccionamiento, con ayuda de la regla que aparece en la etiqueta del tubo, valorar el volumen total (Vt) de plasma<br />
que se ha obtenido tras centrifugar (va a depender del hematocrito que tenga el paciente).<br />
1. Utilizando guantes estériles retire el tapón azul de los tubos de extracción centrifugados y colocados en la gradilla GT16<br />
(Ref. S&N: 72203572). Tenga cuidado de no mezclar la serie roja con el plasma.<br />
2. Extraer el dispositivo de aspiración <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) del blíster estéril.<br />
3. Retirar el tubo protector de la cánula.<br />
4. Insertar en la parte posterior del PTD un tubo de fraccionamiento <strong>BTI</strong>.<br />
5. Posicionar la cánula del PTD en la zona más superficial de la fracción de plasma a extraer. Mantenga el extremo de la cánula<br />
del PTD justo por debajo de la superficie del plasma (alrededor de 1-2 milímetros) y en contacto con la pared interna del<br />
tubo.<br />
6. Presionar suavemente el pulsador azul para comenzar la aspiración de la Fracción 1 (F1) de plasma. Durante el proceso<br />
acompañar la aspiración con un movimiento vertical descendente, de modo que la cánula se encuentre siempre en la zona<br />
más superficial de la fracción deseada a aspirar. Aspirar lentamente para evitar turbulencias.<br />
7. Dejar de aspirar el plasma cuando queden aproximadamente 2 ml de plasma por encima de la serie blanca o buffy coat.<br />
AVISO: NO ASPIRAR AIRE. Pulsar el botón azul mientras el extremo de la cánula del PTD está en el aire hará que el tubo de<br />
fraccionamiento pierda vacio.<br />
8. Repetir los pasos 5, 6 y 7 para cada tubo de extracción <strong>BTI</strong> (previamente centrifugados) con el mismo PTD y tubo de<br />
fraccionamiento, después retirar el tubo de fraccionamiento y colocarlo en la gradilla estéril (Ref. <strong>BTI</strong>: GTT; Ref. S&N 72203573).<br />
Figura 1:<br />
Vt<br />
F1<br />
F2<br />
FRACCIÓN 1<br />
Vt - 2 ml<br />
FRACCIÓN 2<br />
2 ml<br />
Serie Blanca<br />
Serie roja<br />
Tubo 9 ml<br />
9. Repetir los pasos 4-8 para aspirar la fracción 2 (F2) de todos los tubos de extracción. Aspire la fracción de volumen constante<br />
(2 ml), es importante no aspirar el contenido de la serie blanca o “buffy coat”.<br />
10. Colocar todas las fracciones F1 obtenidas del paciente en un mismo tubo de fraccionamiento de plasma.<br />
página 3 de 44
11. Colocar todas las fracciones F2 obtenidas del paciente en un mismo tubo de fraccionamiento de plasma.<br />
12. Desechar el <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD), dispositivo de un solo uso; NO REUTILIZABLE.<br />
4. Protocolo de activación de plaquetas<br />
AVISO: Una vez preparado el plasma, aplicar en un máximo de 4 horas desde la extracción.<br />
La activación del plasma se realiza añadiendo una cantidad precisa de PRGF® Activator.<br />
• La fracción 2 (F2) contiene un mayor número de plaquetas y factores de crecimiento. Se puede utilizar en forma líquida<br />
(activado) o como coágulo.<br />
• Se recomienda la fracción 1 (F1) para preparar membranas de fibrina. Para la elaboración de las mismas es conveniente utilizar<br />
los recipientes para injertos (Ref. <strong>BTI</strong>: RPI40, RPI50 & RPI60; Ref. S&N: 72203583, 72203584 y 72203585, respectivamente).<br />
1. Adicionar con la jeringa de aspiración BD Micro-fine el volumen de PRGF® Activator necesario en función del volumen<br />
de plasma a activar contenido en el tubo de fraccionamiento, a razón de 0.05 ml (5 unidades en la escala de la jeringa BD<br />
Micro -fine) de PRGF® Activator por cada mililitro de plasma.<br />
Nota: Tenga en cuenta que la escala en la jeringa BD Micro-Fine está marcada por unidades, no en mililitros. La conversión<br />
es esencial para evitar errores.<br />
Volumen de plasma (ml) Volumen PRGF® Activator (ml)<br />
Volumen PRGF® Activator<br />
(Unidades marcadas en la jeringa BD Micro-fine)<br />
1 0.05 5<br />
2 0.10 10<br />
4 0.20 20<br />
6 0.30 30<br />
8 0.40 40<br />
2. Desechar la jeringa y el PRGF® Activator sobrante.<br />
Observaciones: Considerar con cuidado el tiempo que debe transcurrir desde la adición del activador, según se quiera utilizar el<br />
plasma, en forma líquida (activado) ó coágulo.<br />
Información presente en la etiqueta de la caja<br />
Fecha de caducidad<br />
Los productos pueden<br />
ser utilizados hasta el fin<br />
LOT Número de lote<br />
Marcado CE<br />
del mes indicado<br />
0123<br />
8<br />
Contenido suficiente<br />
para 8 usos<br />
REF<br />
Referencia<br />
Consúltense las<br />
instrucciones de uso<br />
Limitación de<br />
temperatura<br />
Mantener fuera de la luz<br />
del sol<br />
0123<br />
página 4 de 44
Endoret ® <strong>Kit</strong> orthopedics (4 tube sets) and<br />
Endoret ® <strong>Kit</strong> orthopedics (8 tube sets)<br />
en<br />
Intended use: ENDORET® KIT ORTHOPEDICS (4 tube sets) and ENDORET®KIT ORTHOPEDICS (8 tube sets) are systems for<br />
obtaining Plasma Rich in Growth Factors which can be used in the regeneration of bone or other connective tissues for the<br />
treatment of musculoskeletal injuries.<br />
Product description: The ENDORET® KIT ORTHOPEDICS (4 tube sets) and ENDORET® KIT ORTHOPEDICS (8 tube sets) contain<br />
8 single-use kits each.<br />
ENDORET® KIT ORTHOPEDICS (4 tube sets) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
The Endoret® <strong>Kit</strong> Orthopedics (4 tubes) is recommended to obtain 8 ml of plasma.<br />
Each single-use Endoret® <strong>Kit</strong> Orthopedics (4 tubes) is composed of two blisters.<br />
Blister 1<br />
REF. <strong>BTI</strong> DESCRIPTION STERILITY<br />
PTD-EST <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) Plasma-drawing system Sterile<br />
Blister 2<br />
REF. <strong>BTI</strong> DESCRIPTION STERILITY*<br />
TE9<br />
TF9-EST<br />
4 <strong>BTI</strong> collection tubes for obtaining Plasma Rich in Growth Factors<br />
(sterile vacuum tubes with 3.8% citrate solution as anticoagulant).<br />
8.1-ml collection volume. Light blue cap. Black ring.<br />
2 <strong>BTI</strong> fractionation tubes for obtaining Plasma Rich in Growth<br />
Factors (sterile vacuum tubes). White cap. Black ring.<br />
Sterile interior tube;<br />
Non-sterile exterior<br />
PE 1 Vacuette winged butterfly set Sterile<br />
PRGF-ACT-EST 1 1-ml PRGF® activator ampoule (calcium chloride) Sterile<br />
GP31280<br />
1 Syringe for drawing PRGF® Activator:<br />
BD Micro-Fine 0.5 ml 29G x 12.7 mm<br />
Sterile<br />
* Note: Blister 2 is non-sterile. See the “Sterility” column in the previous table to check the sterility of each component.<br />
ENDORET® KIT ORTHOPEDICS (8 tube sets) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
The Endoret® <strong>Kit</strong> Orthopedics (8 tubes) is recommended to obtain 16 ml of plasma.<br />
Each single-use Endoret® <strong>Kit</strong> Orthopedics (8 tubes) is composed of two blisters.<br />
Blister 1<br />
REF. <strong>BTI</strong> DESCRIPTION STERILITY<br />
PTD-EST <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD): plasma-drawing system Sterile<br />
Blister 2<br />
REF. <strong>BTI</strong> DESCRIPTION STERILITY*<br />
TE9<br />
8 <strong>BTI</strong> collection tubes for obtaining Plasma Rich in Growth Factors<br />
Sterile interior tube;<br />
(sterile vacuum tubes with 3.8% citrate solution as anticoagulant).<br />
Non-sterile exterior<br />
8.1-ml collection volume. Light blue cap. Black ring.<br />
TF9-EST<br />
4 <strong>BTI</strong> fractionation tubes for obtaining Plasma Rich in Growth<br />
Factors (sterile vacuum tubes).<br />
Sterile<br />
White cap. Black ring.<br />
PE 1 Vacuette winged butterfly set Sterile<br />
PRGF-ACT-EST 2 1-ml PRGF® Activator ampoules (calcium chloride) Sterile<br />
GP31280<br />
1 Syringe for drawing PRGF® Activator:<br />
BD Micro-Fine 0.5 ml 29G x 12.7 mm<br />
Sterile<br />
* Note: Blister 2 is non-sterile. See the “Sterility” column in the previous table to check the sterility of each component.<br />
Contraindications<br />
No contraindications or side effects have been identified.<br />
Precautionary measures<br />
1. Handle all biological samples and blood collection “sharps” (lancets, needles, Luer adapters, and blood collection sets)<br />
according to the safety and sanitation policies and procedures of your facility.<br />
2. Viruses (such as Hepatitis B and C, HIV (AIDS) and other infectious diseases) may be transmitted by contact with biological<br />
samples. In the event of any exposure to biological samples, obtain appropriate medical attention.<br />
3. If blood is collected through an intravenous line, ensure that the line has been cleared of any medication or chemical<br />
solution. Flush and waste according to your facility’s blood draw policy.<br />
4. All liquid additives in blood tubes should be colorless and odorless. Do not use tubes if the color of the additive has changed.<br />
Do not use tubes or activator if any sediment is observed in the liquid.<br />
5. The re-use and/or re-sterilization of these products may cause risk of infection and/or cross contamination.<br />
Sterile<br />
page 5 of 44
6. Always follow your facility’s protocol for blood draws.<br />
7. Children, pregnant and nursing women: There are no additional precautions in any of these conditions. However, each<br />
individual patient situation should be considered by the physician before using the PRGF system.<br />
Aseptic Practice<br />
1. Follow your facility’s aseptic operation procedures to minimize the risk of microbiological contamination of the PRGF-ENDORET®<br />
fractions.<br />
2. The use of an appropriate laminar flow cabinet for the fractionation and activation processes will reduce the risk of<br />
microbiological contamination.<br />
Waste disposal<br />
1. Observe your organization’s general directives on hygiene and legal regulations governing the proper disposal of infectious<br />
material and sharps.<br />
2. Wear gloves to reduce risk of exposure to biological materials.<br />
3. Full collection tubes or tubes containing contaminated blood must be placed in appropriate containers designed for the<br />
disposal of potentially infectious waste material.<br />
4. Waste disposal usually involves incineration or autoclaving (steam sterilization).<br />
Storage measures<br />
Storage temperature: keep at 4-25ºC<br />
WARNING: Exceeding the maximum storage temperature may lead to impairment of the tube quality (i.e. vacuum loss,<br />
drying out of liquid additives, decoloring, etc.).<br />
Do not use after expiration date.<br />
Keep away from direct sunlight.<br />
Instructions for Use<br />
1. Blood Collection<br />
Wear gloves during blood collection and while handling blood collection tubes to minimize hazard exposure.<br />
Blood should be used within 4 hours of draw. Do not draw blood if planning to use more than 4 hours from time of draw.<br />
1. Select the number of blue tubes required to prepare the necessary PRGF.<br />
NOTE: PRFG collection tubes contain additives. Therefore it is important to avoid potential backflow from the tube, due<br />
to the possibility of adverse patient reactions. To prevent backflow from tube into the patient’s arm, observe the<br />
following precautions:<br />
a) Place patient’s arm in a downward position.<br />
b) Hold tube upright with the cap at the top.<br />
c) Release tourniquet as soon as blood starts to flow into the tube.<br />
d) Make sure tube contents do not touch the cap of the tube during this procedure.<br />
2. Apply a tourniquet (max. 1 minute to prevent hemolysis). Prepare the venipuncture site with an antiseptic wipe. Do not<br />
touch the venipuncture area after cleansing.<br />
3. Extract butterfly with silicone tube and adapter from its sterile wrap.<br />
4. Remove needle shield.<br />
5. Perform venipuncture with patient’s arm in a downward position.<br />
6. Push tube into the holder and onto the needle valve puncturing the rubber diaphragm. Center tubes in holder when<br />
penetrating the cap to prevent sidewall penetration and subsequent premature vacuum loss.<br />
7. Remove tourniquet as soon as blood appears in the tube. Do not allow contents of tube to contact the cap during procedure.<br />
Do not hold the tube upside down and always hold in place by pressing the tube with the thumb to ensure complete<br />
vacuum draw<br />
8. When the first tube is full and blood flow ceases, gently remove it from holder.<br />
NOTE: If no blood flows into the tube or if blood flow ceases before an adequate sample is collected, the following steps are<br />
suggested to complete satisfactory collection:<br />
a) Push tube forward until tube cap has been penetrated. Always hold in place by pressing the tube with the thumb to<br />
ensure complete vacuum draw.<br />
b) Confirm correct position of needle in vein.<br />
c) If blood still does not flow, remove tube and place new tube onto the holder.<br />
d) If this action is unsuccessful too, remove needle and discard. Repeat procedure from step 1<br />
9. Gently invert the tubes 4-6 times immediately after blood collection to mix blood with tube additives. Turn the filled tube<br />
upside-down and return it to upright position. This is equivalent to a complete inversion.<br />
NOTE: Do not shake the tubes. Vigorous mixing may cause foaming, hemolysis and platelet activation leading to poor ENDORET®<br />
Technique results. Inadequate mixing may also generate undesirable results.<br />
10. Repeat steps 6, 7, 8 with the remaining tubes.<br />
11. As soon as blood stops flowing in the last tube, remove needle from vein, applying pressure to puncture sit with dry sterile<br />
swab until bleeding stops. Once clotting has occurred, apply a sterile dressing.<br />
NOTE: After venipuncture, the top of the cap may contain residual blood. Take proper precautions when handling tubes to avoid<br />
contact with this blood. Any equipment contaminated with blood is considered hazardous and should be disposed of<br />
immediately.<br />
12. Discard the used needle with holder using an appropriate disposal device. DO NOT RECAP. Recapping of needles increases<br />
the risk of needle stick injury and blood exposure.<br />
NOTE: Blood may occasionally leak from the needle sleeve. Practice universal safety precautions to minimize hazard exposure.<br />
page 6 of 44
2. Centrifugation:<br />
Tubes filled with blood should be centrifuged within a maximum of one hour. Under no circumstances should they be refrigerated.<br />
<strong>BTI</strong> TUBES SHOULD ONLY BE CENTRIFUGED USING A <strong>BTI</strong> SYSTEM IV CENTRIFUGE. To assure that fractions are properly separated<br />
and ready for necessary clinical applications.<br />
Please refer the <strong>BTI</strong> System IV Centrifuge instructions for use to complete this procedure.<br />
Through centrifugation, the blood is separated into its three basic components:<br />
• Plasma rich in growth factors: plasma (yellowish color) contains the largest volume of platelets, distributed according to an<br />
increasing density gradient (i.e., the platelet count is smaller in the upper part of the tube and increases gradually toward<br />
the bottom of the plasma layer).<br />
• White blood cells or leukocytes: the thin grayish-white layer deposited just above the red blood cells (also known as<br />
buffy coat).<br />
• Red blood cells: red layer at the bottom of the tube.<br />
3. Fractionation using PLASMA TRANSFER DEVICE (PTD)<br />
Before starting fractionation, record the total volume of plasma (Vt) obtained after centrifugation by using the volume indications<br />
that appear on the tube label (Vt depends on the patient’s haematocrit).<br />
1. Using Sterile gloves, remove the blue caps of collection tubes centrifuged and placed in the GT 16 tube rack (Ref. S&N: 72203572).<br />
being careful not to mix the blood fractions.<br />
2. Remove the PTD from the sterile blister.<br />
3. Remove the protecting tube from the cannula.<br />
4. Insert tube 1 at the back of the <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD).<br />
5. Place the cannula of the PTD in the upper surface of the plasma fraction to be drawn. Keep tip of cannula just below the<br />
plasma surface (about 1-2 millimeters) and touching the edge of the tube glass.<br />
6. Gently press the blue button on the PTD to start drawing the F1 plasma fraction, while simultaneously moving the cannula<br />
along the descending volume of the plasma so that the cannula always stays at the upper surface of the fraction to be<br />
drawn. Proceed slowly to avoid turbulence.<br />
7. Stop drawing when there are about 2 ml of plasma left over the buffy coat layer.<br />
WARNING: DO NOT DRAW AIR. Pushing the blue button while the PTD tip is in the air will cause the PTD to eject the plasma<br />
back out of the fractioning tube.<br />
8. Repeat Steps 5, 6 & 7 for each <strong>BTI</strong> TE9 collection tube (previously centrifuged) with the same PTD and fractionation tube,<br />
then remove the fractionation tube and place it in a sterile tube rack (Ref. <strong>BTI</strong>: GTT; Ref. S&N 72203573).<br />
Figure 1:<br />
Vt<br />
F1<br />
F2<br />
FRACTION 1<br />
Vt - 2 ml<br />
FRACTION 2<br />
2 ml<br />
White blood cells<br />
Red blood cells<br />
9 ml tube<br />
9. Repeat Steps 4-8 for drawing F2 from all the blood collection tubes. You may draw Fraction 2 up to 1 ml from the grayish<br />
white buffy coat, but it is important to not draw contents from the buffy coat.<br />
10. Place all F1 fractions obtained from the patient in the same plasma fractionation tube.<br />
11. Place all F2 fractions obtained from the patient in the same plasma fractionation tube.<br />
12. Discard the <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) single-use device; NON REUSABLE.<br />
4. Platelet Activation Protocol<br />
WARNING: The plasma should not be kept longer than four hours after blood collection.<br />
For plasma activation, estimate the plasma volume contained in the Fraction tube intended for use.<br />
• Fraction 2 contains higher number of platelets and growth factors upon activation. It can be used in a liquid form (activated)<br />
or as a clot.<br />
• Fraction 1 is recommended for fibrin membrane preparation. Use graft containers (Ref. <strong>BTI</strong>: RPI40, RPI50 & RPI60; Ref. S&N:<br />
72203583, 72203584 and 72203585, respectively) to conveniently prepare the membranes.<br />
1. Using the BD Micro-fine drawing syringe, draw the necessary PRGF® Activator volume in the ratio of 0.05 ml (5 units in the<br />
BD Micro-fine syringe scale) of PRGF® Activator per milliliter of plasma.<br />
Note: Be aware that the BD Micro-fine drawing syringe is labeled in UNITS, not milliliters. Conversion is critical to prevent<br />
errors.<br />
page 7 of 44
Plasma Volume (ml) PRGF® Activator Volume (ml)<br />
PRGF® Activator Volume<br />
(BD Micro-fine drawing syringe units)<br />
1 0.05 5<br />
2 0.10 10<br />
4 0.20 20<br />
6 0.30 30<br />
8 0.40 40<br />
2. Discard the syringe and any remaining PRGF® Activator.<br />
Observations: Carefully consider the time that should elapse once the activator is added according to the intended use of the plasma,<br />
in liquid form (activated) or as a clot.<br />
Package label information<br />
Expiration date<br />
Products may be used<br />
until end of month<br />
LOT<br />
Batch code<br />
EC label<br />
specified<br />
0123<br />
8<br />
Contents enough<br />
for 8 uses<br />
REF<br />
Catalogue number<br />
Check the Instructions<br />
for Use<br />
Temperature limitation<br />
Keep away from direct<br />
sunlight<br />
0123<br />
page 8 of 44
Set Endoret ® traumatologie (4-röhrchen-sets)<br />
und Set Endoret ® traumatologie (8-Röhrchen-Sets)<br />
de<br />
Verwendungszweck: Das SET ENDORET® TRAUMATOLOGIE (4-Röhrchen-Sets) bzw. das SET ENDORET® TRAUMATOLOGIE (8-Röhrchen-<br />
Sets) bieten ein System zur Gewinnung von Plasma, welches reich an Wachstumsfaktoren ist (Plasma Rich in Growth Factors) und das bei<br />
der Behandlung von Skelettmuskulaturverletzungen sowie für die Regeneration von Knochen und anderen Bindegeweben verwendet<br />
wird.<br />
Produktbeschreibung: Das SET ENDORET® TRAUMATOLOGIE (4-Röhrchen-Sets) und das SET ENDORET® TRAUMATOLOGIE<br />
(8-Röhrchen-Sets) enthalten jeweils 8 Einweg-Sets.<br />
SET ENDORET® TRAUMATOLOGIE (4-Röhrchen-Sets) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
Um ca. 8 ml Plasma zu erhalten, wird die Verwendung des SET ENDORET® TRAUMATOLOGIE (4-Röhrchen) Einweg-Set empfohlen.<br />
Jedes SET ENDORET® TRAUMATOLOGIE (4-Röhrchen) Einweg-Set enthält zwei Blister.<br />
Blister 1<br />
REF. <strong>BTI</strong> BESCHREIBUNG STERILITÄT<br />
PTD-EST <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD): Plasma-Pipettiersystem Steril<br />
Blister 2<br />
REF. <strong>BTI</strong> BESCHREIBUNG STERILITÄT<br />
TE9<br />
TF9-EST<br />
4 <strong>BTI</strong> TE9 zur Gewinnung von Plasma, das reich an<br />
Wachstumsfaktoren ist (Plasma Rich in Growth Factors)<br />
(Sterile vakuumverpackte Röhrchen, enthalten eine Citrat-Lösung<br />
(3,8 %) als Blutgerinnungshemmer). Entnahmevolumen 8,1 ml.<br />
Hellblaue Kappe. Schwarzer Ring.<br />
2 <strong>BTI</strong>-Fraktionierungsröhrchen® zur Gewinnung von Plasma, das reich<br />
an Wachstumsfaktoren ist (Plasma Rich in Growth Factors – PRGF)<br />
(Sterile Röhrchen im Vakuum). Weiße Kappe. Schwarzer Ring.<br />
Steril im Inneren des Röhrchens;<br />
außen nicht steril<br />
PE 1 Set aus Flügelkanülen Vacuette Steril<br />
PRGF-ACT-EST 1 Ampulle mit PRGF®-Aktivator, 1 ml (Kalziumchlorid) Steril<br />
GP31280<br />
1 Spritze zum Pipettieren des PRGF®-Aktivators:<br />
BD Micro-Fine 0,5 ml 29 g x 12,7 mm<br />
Steril<br />
* Hinweis: Dieser Blister Nr. wurde nicht sterilisiert. Siehe Spalte „Sterilität“ in der Tabelle oben, um die Sterilität jeder Komponente einzeln zu<br />
überprüfen.<br />
SET ENDORET® TRAUMATOLOGIE (8-Röhrchen-Sets) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
Um ca. 16 ml Plasma zu erhalten, wird die Verwendung des SET ENDORET® TRAUMATOLOGIE (8-Röhrchen) Einweg-Set empfohlen.<br />
Jedes SET ENDORET® TRAUMATOLOGIE (8-Röhrchen) Einweg-Set enthält zwei Blister.<br />
Blister 1<br />
REF. <strong>BTI</strong> BESCHREIBUNG STERILITÄT<br />
PTD-EST <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD): Plasma-Pipettiersystem Steril<br />
Blister 2<br />
REF. <strong>BTI</strong> BESCHREIBUNG STERILITÄT<br />
8 <strong>BTI</strong> TE9 zur Gewinnung von Plasma, das reich an<br />
TE9<br />
Wachstumsfaktoren ist (Plasma Rich in Growth Factors – PRGF)<br />
Steril im Inneren des Röhrchens;<br />
(Sterile vakuumverpackte Röhrchen, enthalten eine Citrat-Lösung<br />
außen nicht steril<br />
(3,8 %) als Blutgerinnungshemmer). Entnahmevolumen 8,1 ml.<br />
Hellblaue Kappe. Schwarzer Ring.<br />
TF9-EST<br />
4 <strong>BTI</strong>-Fraktionierungsröhrchen® zur Gewinnung von Plasma, das<br />
reich an Wachstumsfaktoren ist (Plasma Rich in Growth Factors –<br />
Steril<br />
PRGF) (Sterile Röhrchen im Vakuum). Weiße Kappe. Schwarzer Ring.<br />
PE 1 Set aus Flügelkanülen Vacuette Steril<br />
PRGF-ACT-EST 2 Ampullen mit PRGF®-Aktivator, 1 ml (Kalziumchlorid) Steril<br />
GP31280<br />
1 Spritze zum Pipettieren des PRGF® -Aktivators:<br />
BD Micro-Fine 0,5 ml 29 g x 12,7 mm<br />
Steril<br />
* Hinweis: Dieser Blister Nr. wurde nicht sterilisiert. Siehe Spalte „Sterilität“ in der Tabelle oben, um die Sterilität jeder Komponente einzeln zu überprüfen.<br />
Gegenanzeigen<br />
Es wurden keine Gegenanzeigen oder Nebenwirkungen festgestellt.<br />
Vorsichtsmaßnahmen<br />
1. Alle biologischen Proben sowie scharfe Gegenstände zur Blutentnahme (Lanzetten, Nadeln, Luer-Adapter und Blutabnahme-Sets)<br />
sind unter Beachtung der in Ihrer Einrichtung üblichen Sicherheits- und Hygienebestimmungen und -verfahren zu behandeln.<br />
Steril<br />
seite 9 von 44
2. Durch Kontakt mit biologischen Proben können Viren wie Hepatitis B oder C, HIV (AIDS) oder andere infektiöse Erkrankungen<br />
übertragen werden. Bei jeglichem Kontakt mit biologischen Proben muss ärztliche Hilfe aufgesucht werden.<br />
3. Wenn das Blut intravenös entnommen wird, muss sichergestellt werden, dass keine Medikamente oder Chemikalien in die<br />
Blutbahn gelangen. Entsorgen Sie alle Gegenstände gemäß den Blutentnahmebestimmungen des Zentrums.<br />
4. Alle flüssigen Zusätze in den Blutentnahmeröhrchen müssen farb- und geruchlos sein. Wenn sich die Farbe der Zusätze<br />
verändert hat, dürfen die Röhrchen nicht mehr verwendet werden. Nicht verwenden, wenn Sie Fremdkörper in den<br />
Schläuchen oder im Aktivator entdecken.<br />
5. Die Wiederverwendung und/oder Resterilisation dieser Produkte kann das Risiko einer Infektion und/oder Kreuzkontamination<br />
verursachen.<br />
6. Beachten Sie immer das Protokoll zur Blutabnahme Ihrer Einrichtung.<br />
7. Kinder, Schwangere und stillende Frauen: Bei diesen sind keine zusätzlichen Vorsichtmaßnahmen erforderlich. Dennoch<br />
sollte die individuelle Befindlichkeit jedes Patienten/jeder Patientin vom Arzt vor Anwendung des Systems PRGF-ENDORET®<br />
berücksichtigt werden.<br />
Aseptische Verfahrensweise<br />
1. Die aseptischen Verfahrensweisen der Einrichtung befolgen, um das Risiko einer mikrobiologischen Kontaminierung der<br />
durch die PRGF-ENDORET®-Technik erhaltenen Plasmafraktionen möglichst gering zu halten.<br />
2. Die Verwendung einer geeigneten Laminar-Flow-Kabine (<strong>BTI</strong> Laminar Flow Cabinet, Ref.FLVA60<strong>BTI</strong>) für das Fraktionierungsund<br />
Aktivierungsverfahren reduziert zusätzlich das Risiko einer mikrobiologischen Kontaminierung.<br />
Entsorgung von Reststoffen<br />
1. Die allgemeinen Richtlinien zur Hygiene und die rechtlichen Vorschriften bezüglich der ordnungsgemäßen Entsorgung von<br />
infektiösen Materialien müssen eingehalten werden.<br />
2. Das Tragen von Handschuhen mindert das Infektionsrisiko.<br />
3. Volle Blutentnahmeröhrchen oder Röhrchen, die kontaminiertes Blut enthalten, müssen in Behältern für die Entsorgung<br />
von potenziell infektiösem Material gesammelt werden.<br />
4. Reststoffe werden im Allgemeinen in einem Verbrennungsofen oder durch Autoklavierung (Dampfsterilisation) entsorgt.<br />
Hinweise zur Lagerung<br />
Lagerungstemperatur: bei 4-25 ºC lagern.<br />
HINWEIS: Überschreiten der maximalen Lagerungstemperatur kann zur Beeinträchtigung der Qualität der Röhrchen führen<br />
(z.B. Verlust des Vakuums, Austrocknen der flüssigen Zusätze, Verfärbung, etc.).<br />
Nicht nach dem Verfallsdatum verwenden.<br />
Vor Sonneneinstrahlung schützen.<br />
Gebrauchsanleitung<br />
1. Blutentnahme<br />
Handschuhe während der Blutprobenentnahme und der Handhabung der Entnahmeröhrchen verwenden, um das Infektionsrisiko<br />
weitgehend zu verringern.<br />
Das Blut muss innerhalb von 4 Stunden nach der Entnahme verwendet werden. Kein Blut entnehmen, wenn geplant ist, dieses erst<br />
4 Stunden oder später nach der Entnahme zu verwenden.<br />
1. Die für die Erzielung der gewünschten Plasmafraktionen erforderlichen Röhrchen auswählen.<br />
HINWEIS: Die <strong>BTI</strong>-Entnahmeröhrchen enthalten Zusätze. Daher ist es aufgrund der Möglichkeit unerwünschter Nebenwirkungen<br />
beim Patienten, wichtig, einen möglichen Rückfluss aus dem Röhrchen zu verhindern. Um einen Rückfluss aus dem<br />
Röhrchen in den Arm des Patienten zu vermeiden, sind folgende Vorsichtsmaßnahmen zu beachten:<br />
a) Den Arm des Patienten nach unten richten.<br />
b) Das Röhrchen mit der Kappe nach oben festhalten.<br />
c) Staubinde lösen, sobald das Blut in das Röhrchen zu fließen beginnt.<br />
d) Sicherstellen, dass der Inhalt des Röhrchens während der Venenpunktion nicht das Nadelende berührt.<br />
2. Staubinde anlegen (maximal 1 Minute). Die Einstichstelle mit dem in Antiseptikum getränkten Tüchlein vorbereiten. Nach<br />
der Reinigung die Punktionsstelle nicht mehr palpieren.<br />
3. Die Flügelkanüle mit Silikonschlauch und Adapter aus der sterilen Verpackung entnehmen.<br />
4. Nadelschutz abnehmen.<br />
5. Die Venenpunktion am gesenkten Arm des Patienten ausführen.<br />
6. Das Röhrchen in den Halter einführen und auf das Nadelventil drücken und dabei die Gummimembran durchstechen. Die<br />
Röhrchen beim Durchstechen der Kappe zentriert im Halter ausrichten, um ein Durchstechen der Seitenwand und den<br />
daraus folgenden vorzeitigen Verlust des Vakuums zu vermeiden.<br />
7. Sobald Blut in das Röhrchen eintritt, ist die Staubinde zu entfernen. Der Inhalt des Röhrchens darf während des Verfahrens<br />
nicht in Kontakt mit der Kappe kommen. Das Röhrchen nicht verkehrt herum halten und immer mit dem Daumen nach<br />
oben fixieren, um eine vollständige Entnahme unter Vakuum sicherzustellen.<br />
8. Wenn das erste Röhrchen gefüllt ist und der Blutfluss nachlässt, das Röhrchen vorsichtig aus dem Halter nehmen.<br />
HINWEIS: Wenn kein Blut in das Röhrchen fließt oder der Blutfluss abbricht, bevor eine ausreichende Probenmenge<br />
gewonnen wurde, werden folgende Schritte empfohlen, um eine ausreichende Blutentnahme zu gewährleisten:<br />
a) Das Röhrchen vorschieben, bis die Kappe durchstochen ist. Immer mit Druck durch den Daumen auf das Röhrchen<br />
fixieren, um eine vollständige Entnahme unter Vakuum sicherzustellen.<br />
b) Korrekten Sitz der Nadel in der Vene überprüfen.<br />
c) Wenn das Blut immer noch nicht fließt, ist das Röhrchen im Halter durch ein neues Röhrchen zu ersetzen.<br />
d) Wenn auch diese Maßnahme keinen Erfolg zeigt, die Nadel entfernen und entsorgen. Verfahren vom Schritt 1 an wiederholen.<br />
seite 10 von 44
9. Um eine gute Durchmischung von Zusatz und Blut zu erreichen, die Röhrchen sofort nach der Blutentnahme vorsichtig 4<br />
bis 6 Mal schwenken. Das gefüllte Röhrchen mit der Kappe nach unten drehen und wieder zurück in die aufrechte Position<br />
bringen. Dies ist eine vollständige Umdrehung.<br />
HINWEIS: Die Röhrchen nicht schütteln. Durch zu starkes Mischen kann es zu Aufschäumen, Hämolyse und Blutplättchenaktivierung<br />
und dadurch zu verfälschten Ergebnissen der PGRF-ENDORET®-Technik kommen. Eine nicht ausreichende Vermischung<br />
kann ebenfalls zu unerwünschten Ergebnissen führen.<br />
10. Die Schritte 6, 7 und 8 mit den restlichen erforderlichen Röhrchen wiederholen.<br />
11. Sobald der Blutfluss im letzten Röhrchen beendet ist, die Nadel aus der Vene entfernen. Dabei mit einem trockenen, sterilen<br />
Tupfer die Punktionsstelle komprimieren, bis die Blutung gestoppt ist. Wenn die Blutung gestoppt ist, ein steriles Pflaster<br />
aufkleben.<br />
HINWEIS: Nach der Venenpunktion kann der obere Teil der Kappe Blutreste enthalten. Bei der Handhabung der Röhrchen sind<br />
entsprechende Vorsichtsmaßnahmen zu beachten, um den Kontakt mit diesem Blut zu verhindern. Alle Gegenstände, die<br />
mit Blut kontaminiert wurden, sind als gefährlich und infektiös anzusehen und müssen sofort entsorgt werden.<br />
12. Die benutzte Nadel mit dem Halter in einem geeigneten Abfallbehälter entsorgen. DIE SCHUTZHÜLLE DER NADEL NICHT<br />
WIEDER ÜBER DIE NADEL SCHIEBEN. Der Wiederverschluss der Nadeln mit den Schutzhüllen erhöht das Risiko der Verletzung<br />
durch Nadelstich und des Kontaktes mit Blut.<br />
HINWEIS: Manchmal kann Blut aus der Nadel austreten. Allgemeine Vorsichtsmaßnahmen zur Minimierung des Infektionsrisikos beachten.<br />
2. Zentrifugierung<br />
Nach dem Füllen der Röhrchen sollten diese umgehend oder bis spätestens eine Stunde nach der Blutentnahme zentrifugiert werden.<br />
Die Röhrchen dürfen unter keinen Umständen gekühlt werden.<br />
<strong>BTI</strong>-ENTNAHMERÖHRCHEN SOLLTEN NUR IN EINEM <strong>BTI</strong>-SYSTEM IV ZENTRIFUGENMODELL ZENTRIFUGIERT WERDEN. Damit<br />
wird sichergestellt, dass die mittels PRGF-ENDORET®-Technik erhaltenen Plasmafraktionen richtig getrennt wurden und für den<br />
Gebrauch zu verschiedenen zugelassenen klinischen Anwendungen geeignet sind.<br />
Befolgen Sie die spezifischen Gebrauchsanweisungen der <strong>BTI</strong>-System IV-Zentrifuge.<br />
Durch die Zentrifugierung wird das Blut in drei Basiskomponenten getrennt:<br />
• Plasma Rich in Growth Factors (Plasma reich an Wachstumsfaktoren): Obere Plasmaschicht (gelbliche Farbe), in dem die<br />
größte Menge der Thrombozyten enthalten ist. Diese sind gemäß dem ansteigenden Dichtegradienten verteilt (d. h. die<br />
Anzahl der Thrombozyten ist im oberen Bereich des Röhrchens geringer und steigt von oben nach unten schrittweise an).<br />
• Leukozytenschicht: Die dünne gräulich-weiße Schicht direkt über den Erythrozyten (auch Buffy Coat“ genannt).<br />
• Erythrozyten: Rote Ablagerung im unteren Bereich des Röhrchens.<br />
3. Fraktionierung mithilfe des PLASMA-TRANSFER-GERÄTS (PLASMA TRANSFER DEVICE = PTD)<br />
Vor der Fraktionierung muss das durch die Zentrifugierung erreichte Gesamt-Plasmavolumen (Vt) anhand der Volumenangaben auf<br />
dem Etikett des Röhrchens bestimmt werden (Vt ist abhängig vom Hämatokrit des Patienten).<br />
1. Mit sterilen Handschuhen die blaue Kappe der zentrifugierten Entnahmeröhrchen abnehmen, die auf dem Gestell GT16<br />
abgestellt wurden (Ref. S&N: 72203572). Darauf achten die Erythrozytenschicht nicht mit dem Plasma zu mischen.<br />
2. Das Pipettiergerät <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) aus dem sterilen Blister entnehmen.<br />
3. Die Schutzkappe von der Kanüle entfernen.<br />
4. Auf der Hinterseite des PTD ein <strong>BTI</strong>-Fraktionierröhrchen einsetzen.<br />
5. Die Kanüle des PTD am oberen Bereich der zu pipettierenden Plasmafraktion anbringen. Das Ende der PDT-Kanüle genau<br />
unter der Oberfläche des Plasmas (ca. 1-2 Millimeter) und in Kontakt mit der Innenwand des Röhrchens halten.<br />
6. Vorsichtig den blauen Knopf drücken, um mit dem Pipettieren der Plasmafraktion 1 (F1) zu beginnen. Führen Sie während<br />
des Pipettierens eine vertikale, nach unten gerichtete Bewegung durch, damit die Kanüle sich immer am oberen Bereich der<br />
zu pipettierenden Fraktion befindet. Langsam pipettieren, um Turbulenzen zu vermeiden.<br />
7. Das Pipettieren des Plasmas beenden, wenn noch ca. 2 ml Plasma über der Leukozytenschicht oder dem „Buffy Coat“<br />
vorhanden sind.<br />
HINWEIS: KEINE LUFT PIPETTIEREN. Wenn man den blauen Knopf drückt, während sich die Kanüle des PTD in der Luft<br />
befindet, verliert das Fraktionierungsröhrchen Vakuum.<br />
8. Die Schritte 5, 6 und 7 für jedes (zuvor zentrifugierte) <strong>BTI</strong>-Entnahmeröhrchen mit demselben PTD und Fraktionierungsröhrchen<br />
wiederholen, danach das Fraktionierungsröhrchen entfernen und auf dem sterilen Gestell abstellen (Ref. <strong>BTI</strong>: GTT; Ref. S&N 72203573).<br />
Abbildung 1:<br />
Vt<br />
F1<br />
F2<br />
FRAKTION 1<br />
Vt - 2 ml<br />
FRAKTION 2<br />
2 ml<br />
Leukozytenschicht<br />
Erythrozytensc<br />
Röhrchen 9 ml<br />
9. Die Schritte 4-8 wiederholen, um die Fraktion 2 (F2) aller Entnahmeröhrchen zu pipettieren. Die Fraktion mit konstantem<br />
Volumen pipettieren (2 ml). Wichtig: Nicht den Inhalt der Leukozytenschicht oder des „Buffy Coats“ pipettieren.<br />
seite 11 von 44
10. Alle F1-Fraktionen aus der Patientenprobe in das gleiche Fraktionierungsröhrchen geben.<br />
11. Alle F2-Fraktionen aus der Patientenprobe in das gleiche Fraktionierungsröhrchen geben.<br />
12. Das <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) entsorgen. Die Pipette dient nur zum einmaligen Gebrauch; NICHT<br />
WIEDERVERWENDBAR.<br />
4. Aktivierungsprotokoll für Thrombozyten<br />
HINWEIS: Das vorbereitete Plasma muss bis spätestens 4 Stunden nach der Entnahme verwendet werden.<br />
Um die Plasmafraktionierung durchzuführen, wird eine exakte Menge PRGF®-Aktivator benötigt.<br />
• Die Fraktion 2 (F2) enthält eine größere Menge an Thrombozyten und Wachstumsfaktoren. Man kann sie in flüssiger Form<br />
(aktiviert) oder geronnen verwenden.<br />
• Die F1-Fraktion wird zur Vorbereitung von Fibrinmembranen empfohlen. Für die Vorbereitung derselben die entsprechenden<br />
Implantatbehälter verwenden (Ref. <strong>BTI</strong>: RPI40, RPI50 & RPI60; Ref. S&N: 72203583, 72203584 und 72203585).<br />
1. Mit der Pipette BD Micro-fine die notwendige Menge PRGF®-Aktivator abhängig vom zu aktivierenden Plasmavolumen im<br />
Fraktionierungssröhrchen hinzufügen. Das Verhältnis ist 0,05 ml (5 Einheiten auf der Skala der Spritze BD Micro-fine) PRGF®-<br />
Aktivator für jedes Milliliter Plasma.<br />
Hinweis: Beachten, dass auf der Skala der Spritze BD Micro-Fine die Einheiten und nicht die Milliliter markiert sind. Beachten<br />
Sie die richtige Umwandlung, um Fehler zu vermeiden.<br />
Volumen PRGF® Aktivator<br />
Plasma-Volumen (ml) Volumen PRGF® Aktivator (ml)<br />
(Einheiten auf der Spritze BD Micro-fine markiert)<br />
1 0.05 5<br />
2 0.10 10<br />
4 0.20 20<br />
6 0.30 30<br />
8 0.40 40<br />
2. Die Spritze und den übriggebliebenen PRGF®-Aktivator entsorgen.<br />
Anmerkungen: Je nach Verwendungsform des Plasmas, d. h. flüssig (aktiviert) oder geronnen, muss sorgfältig bestimmt werden, wie<br />
viel Zeit nach dem Hinzufügen des Aktivators vergehen darf.<br />
Auf dem Etikett der Schachtel enthaltene Informationen<br />
Verfallsdatum<br />
Die Produkte können<br />
bis zum Ende des LOT Chargennummer<br />
CE-Kennzeichnung<br />
angegebenen Monats<br />
0123<br />
verwendet werden.<br />
8<br />
Inhalt reicht für 8<br />
Anwendungen<br />
REF<br />
Referenz<br />
Siehe<br />
Gebrauchsanweisung<br />
Temperaturbeschränkung<br />
Vor Sonneneinstrahlung<br />
schützen<br />
0123<br />
seite 12 von 44
<strong>Kit</strong> Endoret ® traumatologie (sets 4 tubes) et<br />
<strong>Kit</strong> Endoret ® traumatologie (sets 8 tubes)<br />
fr<br />
Utilisation prévue : Les KIT ENDORET® TRAUMATOLOGIE (sets 4 tubes) et KIT ENDORET® TRAUMATOLOGIE (sets 8 tubes) constituent<br />
un système pour obtenir un plasma riche en facteurs de croissance qui peuvent être appliqués dans la régénération des os et<br />
d’autres tissus ainsi que dans le traitement des troubles musculosquelettiques.<br />
Description du produit : Chaque KIT ENDORET® TRAUMATOLOGIE (sets 4 tubes) et KIT ENDORET® TRAUMATOLOGIE (sets 8<br />
tubes) contient 8 kits à usage unique.<br />
KIT ENDORET® TRAUMATOLOGIE (sets 4 tubes) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
L’utilisation du KIT ENDORET® TRAUMATOLOGIE (4 tubes) est recommandée pour obtenir environ 8 ml de plasma.<br />
Chaque kit à usage unique KIT ENDORET® TRAUMATOLOGIE (4 tubes) contient deux blisters.<br />
Blister 1<br />
RÉF. <strong>BTI</strong> DESCRIPTION STÉRILITÉ<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) :<br />
PTD-EST<br />
Stérile<br />
Système d’aspiration de plasma<br />
Blister 2<br />
RÉF. <strong>BTI</strong> DESCRIPTION STÉRILITÉ*<br />
TE9<br />
TF9-EST<br />
4 tubes de prélèvement <strong>BTI</strong> pour l’obtention de plasma riche en<br />
facteurs de croissance (tubes stériles avec vide, qui contiennent<br />
une solution de citrate à 3,8% comme anticoagulant).<br />
Volume de prélèvement 8,1 ml. Bouchon bleu clair. Bague noire.<br />
2 tubes de fractionnement <strong>BTI</strong> pour l’obtention de plasma riche en<br />
facteurs de croissance (tubes stériles avec vide). Bouchon blanc.<br />
Bague noire.<br />
page 13 sur 44<br />
Stérile à l’intérieur du tube ;<br />
non stérile à l’extérieur<br />
Stérile<br />
PE 1 Unité de prélèvement à ailettes Vacuette Stérile<br />
PRGF-ACT-EST 1 Ampoule de PRGF® Activator, de 1 ml (chlorure de calcium) Stérile<br />
GP31280<br />
1 Seringue pour aspiration du PRGF® Activator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Stérile<br />
* Remarque : Ce blister numéro 2 n’a pas été stérilisé. Cf. colonne “Stérilité” de la grille ci-dessus pour vérifier la stérilité de chaque pièce séparément.<br />
KIT ENDORET® TRAUMATOLOGIE (sets 8 tubes) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
L’utilisation du ENDORET® TRAUMATOLOGIE (8 tubes) est recommandée pour obtenir environ 16 ml de plasma.<br />
Chaque kit à usage unique KIT ENDORET® TRAUMATOLOGIE (8 tubes) contient deux blisters.<br />
Blister 1<br />
RÉF. <strong>BTI</strong> DESCRIPTION STÉRILITÉ<br />
PTD-EST<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) :<br />
système d’aspiration de plasma.<br />
Stérile<br />
Blister 2<br />
RÉF. <strong>BTI</strong> DESCRIPTION STÉRILITÉ*<br />
TE9<br />
TF9-EST<br />
8 tubes de prélèvement <strong>BTI</strong> pour l’obtention de plasma riche en<br />
facteurs de croissance (tubes stériles avec vide, qui contiennent<br />
une solution de citrate à 3,8% comme anticoagulant).<br />
Volume de prélèvement 8,1 ml. Bouchon bleu clair. Bague noire.<br />
4 tubes de fractionnement <strong>BTI</strong> pour l’obtention de plasma riche en<br />
facteurs de croissance (tubes stériles avec vide).<br />
Bouchon blanc. Bague noire.<br />
Stérile à l’intérieur du tube ; non<br />
stérile à l’extérieur<br />
Stérile<br />
PE 1 Unité de prélèvement à ailettes Vacuette Stérile<br />
PRGF-ACT-EST 2 ampoules de PRGF® Activator, de 1 ml (chlorure de calcium). Stérile<br />
GP31280<br />
1 Seringue pour aspiration du PRGF® Activator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Stérile<br />
* Remarque : Ce blister numéro 2 n’a pas été stérilisé. Cf. colonne “Stérilité” de la grille ci-dessus pour vérifier la stérilité de chaque pièce séparément.<br />
Contre-indications<br />
Nous n’avons identifié aucune contre-indication ni aucun effet secondaire.<br />
Précautions<br />
1. Manipulez tous les échantillons biologiques et les objets piquants pour le prélèvement de sang (lancettes, aiguilles,<br />
adaptateurs Luer et matériel de recueil du sang) en appliquant les réglementations de sécurité et sanitaires.<br />
2. Des virus –comme ceux de l’hépatite B et C, le VIH (SIDA) ou d’autres maladies infectieuses- peuvent se transmettre par contact<br />
avec les échantillons biologiques. En cas d’exposition à des échantillons biologiques, recevez les soins médicaux appropriés.
3. Si vous prélevez le sang par une voie intraveineuse, vérifiez qu’il n’y a plus aucune trace de médicament ou de solution<br />
chimique. Jetez les objets en fonction de la politique de prélèvement du sang du centre.<br />
4. Tous les additifs liquides dans les tubes de sang doivent être incolores et inodores. N’utilisez pas de tubes dans lesquels<br />
l’additif aurait changé de couleur. Ne l’utilisez pas s’il y a des corps étrangers dans les tubes ou l’activateur.<br />
5. La réutilisation et/ou re-stérilisation de ces produits peut provoquer des risques d’infection et/ou de contamination croisée.<br />
6. Appliquez à tout moment le protocole de prélèvement du sang du centre.<br />
7. Enfants, femmes enceintes et allaitantes : Des précautions supplémentaires ne sont pas prises en considération pour ces<br />
états; cependant, la situation individuelle de chaque patient doit être prise en compte par le clinicien avant la mise en œuvre<br />
de la technique PRGF-ENDORET ®.<br />
Pratique aseptique<br />
1. Suivez attentivement les protocoles d’opération aseptique de votre centre pour minimiser les possibilités de contamination<br />
des fractions de plasma obtenues par la technique PRGF-ENDORET®.<br />
2. L’utilisation d’une cabine de flux laminaire adéquate dans les procédés de fractionnement et d’activation (Cabine de flux<br />
laminaire <strong>BTI</strong>, Réf.FLVA60<strong>BTI</strong>) réduit le risque de contamination microbiologique.<br />
Élimination des déchets.<br />
1. Observez attentivement les directives générales sur l’hygiène et la réglementation légale qui régit l’élimination appropriée<br />
du matériau infectieux.<br />
2. Portez des gants pour réduire le risque d’infections.<br />
3. Les tubes de recueil pleins ou les tubes qui contiennent du sang contaminé doit être groupés dans des récipients prévus<br />
pour les déchets potentiellement infectieux.<br />
4. Les déchets sont normalement éliminés soit par incinération soit par traitement en autoclave (stérilisation à la vapeur).<br />
Précautions pour le stockage :<br />
Température de stockage : conservez entre 4-25ºC.<br />
AVERTISSEMENT: Ne dépassez pas la température maximale de stockage pour éviter une détérioration de la qualité du tube<br />
(c’est-à-dire perte de vide, évaporation des additifs liquides, changement de couleur, etc.).<br />
N’utilisez pas le produit au-delà de sa date de péremption.<br />
Conservez à l’abri du soleil.<br />
Instructions d’utilisation<br />
1. Prélèvement du sang<br />
Portez des gants lors du prélèvement du sang ainsi que de la manipulation des tubes de prélèvement afin de minimiser le risque d’exposition.<br />
Le sang devra être utilisé dans les 4 heures qui suivent le prélèvement. Ne prélevez pas de sang s’il sera utilisé après les 4 heures qui<br />
suivent le prélèvement.<br />
1. Sélectionnez les tubes nécessaires pour obtenir les fractions de plasma désirées.<br />
REMARQUE : Les tubes d’extraction <strong>BTI</strong> contiennent des additifs. Il est donc important d’éviter un reflux éventuel depuis le<br />
tube étant donné la possibilité de réactions nocives chez le patient. Pour éviter le reflux du tube au bras du<br />
patient, observez les précautions ci-après :<br />
a) Placez le bras du patient en position descendante.<br />
b) Tenez le tube avec le bouchon vers le haut.<br />
c) Libérez le garrot dès que le sang commence à couler dans le tube.<br />
d) Vérifiez que le contenu du tube ne touche pas l’extrémité de l’aiguille pendant la ponction veineuse.<br />
2. Appliquez un garrot (1 minute max). Préparez l’endroit où effectuer la ponction veineuse avec la lingette imbibée<br />
d’antiseptique. Ne palpez pas la zone de ponction veineuse après l’avoir nettoyée.<br />
3. Extrayez le dispositif de prélèvement à ailettes avec le tube de silicone et l’adaptateur de leur emballage stérile.<br />
4. Enlevez le capuchon de l’aiguille.<br />
5. Réalisez la ponction veineuse avec le bras du patient en position descendante.<br />
6. Enfoncez le tube contre le support, la valve de l’aiguille perfore le diaphragme en caoutchouc. Centrez bien les tubes sur le<br />
support lorsque vous introduisez le bouchon pour éviter la perforation latérale et la perte prématurée de vide.<br />
7. Enlevez le garrot dès que le sang apparaît dans le tube. Ne laissez pas le contenu du tube toucher le bouchon pendant<br />
l’opération. Ne renversez pas le tube et laissez-le toujours en position ascendante en appuyant dessus avec votre pouce<br />
pour vous assurer que le vide est bien complètement aspiré.<br />
8. Lorsque le premier tube est rempli et que le sang ne coule plus, enlevez-le doucement du support.<br />
REMARQUE : Si le sang ne s’écoule pas dans le tube ou si le débit est interrompu avant d’obtenir l’échantillon nécessaire, nous<br />
vous conseillons de procéder comme indiqué ci-après pour que la ponction soit satisfaisante :<br />
a) Enfoncez le tube vers l’avant jusqu’à ce que le bouchon soit perforé. Tenez-le en position en appuyant dessus avec votre<br />
pouce pour vous assurer que le vide est bien complètement aspiré.<br />
b) Confirmez la position correcte de l’aiguille dans la veine.<br />
c) Si le sang ne coule toujours pas, retirez le tube et placez-en un nouveau dans le support.<br />
d) Si cette action ne produit toujours pas de résultats satisfaisants, enlevez l’aiguille et jetez-la. Répétez cette opération à<br />
partir de l’étape 1.<br />
9. Prélevez le sang et renversez en douceur les tubes 4 à 6 fois immédiatement après le prélèvement pour obtenir un bon<br />
mélange de l’additif et du sang. Renversez le tube plein de haut en bas et replacez-le vers le haut. Cela constitue un<br />
renversement complet.<br />
REMARQUE : N’agitez pas les tubes. Un mélange énergique peut entraîner la formation de mousse, d’hémolyse et une activation<br />
des plaquettes, ainsi que des résultats incorrects de la technique PRGF-ENDORET®. Un mélange incorrect peut<br />
page 14 sur 44
également produire des résultats non souhaités.<br />
10. Répétez les étapes 6, 7, 8 avec le reste des tubes nécessaires.<br />
11. Dès que le sang ne coule plus dans le dernier tube, retirez l’aiguille de la veine en appuyant sur la zone de ponction avec<br />
une compresse stérile sèche jusqu’à ce que l’hémorragie cesse. Dès que la coagulation se produit, appliquez le pansement<br />
stérile.<br />
REMARQUE : Après la ponction veineuse, la partie supérieure du bouchon peut contenir des restes de sang. Prenez les précautions<br />
nécessaires lorsque vous manipulez les tubes pour éviter tout contact avec ce sang. Tout objet contaminé de sang est<br />
jugé dangereux et doit être immédiatement jeté.<br />
12. Jetez l’aiguille utilisée avec le support en utilisant un système d’élimination approprié. NE LA REBOUCHEZ PAS. En replaçant<br />
le bouchon sur les aiguilles, vous risquez d’augmenter le risque de piqûre et d’exposition au sang.<br />
REMARQUE : Il peut se produire un déversement accidentel de sang du petit manchon de l’aiguille. Appliquez les mesures de<br />
sécurité générales pour réduire au minimum le risque d’exposition.<br />
2. Centrifugation<br />
Lorsqu’ils sont remplis, les tubes doivent être centrifugés immédiatement après le prélèvement de sang, ou dans l’heure qui suit au<br />
maximum. Ils ne doivent en aucun cas être réfrigérés.<br />
LES TUBES DE PRÉLÈVEMENT <strong>BTI</strong> NE DOIVENT ÊTRE CENTRIFUGÉS QUE DANS UNE CENTRIFUGEUSE MODÈLE SYSTEM IV DE <strong>BTI</strong>.<br />
Cela nous permet de garantir que les fractions de plasma obtenues par la technique PRGF-ENDORET® sont correctement séparées<br />
et prêtes à être utilisées dans les différentes applications cliniques approuvées.<br />
Suivez les instructions spécifiques d’utilisation de la centrifugeuse System IV de <strong>BTI</strong>.<br />
Après la centrifugation, le sang se sépare en trois composants :<br />
• Plasma riche en facteurs de croissance ; c’est la colonne de plasma (couleur jaune) qui contient la plupart des plaquettes,<br />
réparties selon un niveau croissant de concentration (c’est-à-dire que le nombre de plaquettes est moins grand dans la<br />
partie haute du tube et qu’il augmente vers le bas).<br />
• Série blanche ou leucocytes: la couche fine blanchâtre qui est déposée juste au-dessus des hématies (appelée également<br />
buffy coat).<br />
• Hématies : la colonne rouge qui occupe la partie inférieure du tube.<br />
3. Fractionnement avec le PLASMA TRANSFER DEVICE (PTD)<br />
Avant de commencer le fractionnement, à l’aide de la règle prévue sur l’étiquette du tube, vérifiez le volume total (Vt) de plasma obtenu<br />
après la centrifugation (cela dépendra de l’hématocrite du patient).<br />
1. En portant des gants stériles, enlevez le bouchon bleu des tubes de prélèvement centrifugés et placés sur le porte-tubes<br />
GT16 (Réf. S&N: 72203572). Attention à ne pas mélanger la série rouge avec le plasma.<br />
2. Retirez le dispositif d’aspiration <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) du blister stérile.<br />
3. Retirez le tube protecteur de la canule.<br />
4. Insérez dans la partie postérieure du PTD un tube de fractionnement <strong>BTI</strong>.<br />
5. Placez la canule du PTD dans la zone la plus superficielle de la fraction de plasma à extraire. Tenez l’extrémité de la canule du<br />
PTD juste par dessous de la surface du plasma (environ 1-2 millimètres) et en contact avec la paroi interne du tube.<br />
6. Appuyez doucement sur le bouton-poussoir bleu pour commencer l’aspiration de la fraction 1 (F1) de plasma. Pendant<br />
l’opération, accompagnez l’aspiration avec un mouvement vertical descendant, de telle sorte que la canule se trouve<br />
toujours dans la zone la plus superficielle de la fraction à aspirer souhaitée. Aspirez lentement pour éviter les turbulences.<br />
7. Arrêtez l’aspiration du plasma quand il n’en reste que 2 ml environ de plasma par-dessus de la série blanche ou buffy coat.<br />
AVERTISSEMENT : N’ASPIREZ PAS D’AIR Si vous appuyez sur le bouton bleu pendant que l’extrémité de la canule du PTD est<br />
en l’air, le tube de fractionnement perdra le vide.<br />
8. Répétez les étapes 5, 6 et 7 pour chaque tube de prélèvement <strong>BTI</strong> (préalablement centrifugés) avec les mêmes PTD et tube de<br />
fractionnement; ensuite, retirez le tube de fractionnement et placez-le sur le porte-tubes stérile (Réf. <strong>BTI</strong>: GTT; Réf. S&N 72203573).<br />
Figure 1 :<br />
Vt<br />
F1<br />
F2<br />
FRACTION 1<br />
Vt - 2 ml<br />
FRACTION 2<br />
2 ml<br />
Série Blanche<br />
Série rouge<br />
Tube 9 ml<br />
9. Répétez les étapes 4-8 pour aspirer la fraction 2 (F2) de tous les tubes de prélèvement. Aspirez la fraction de volume<br />
constante (2 ml) ; il est important de ne pas aspirer le contenu de la série blanche ou « buffy coat ».<br />
10. Placez toutes les fractions F1 obtenues du patient dans un même tube de fractionnement du plasma.<br />
11. Placez toutes les fractions F2 obtenues du patient dans un même tube de fractionnement du plasma.<br />
12. Jetez le <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD), dispositif à usage unique ; NON RÉUTILISABLE.<br />
page 15 sur 44
4. Protocole d’activation des plaquettes<br />
AVERTISSEMENT: Une fois le plasma est préparé, appliquez dans un délai maximum de 4 heures après le prélèvement.<br />
L’activation du plasma se fait en ajoutant une quantité précise de PRGF® Activator.<br />
• La fraction 2 (F2) contient un plus grand nombre de plaquettes et de facteurs de croissance. Elle peut être utilisée sous<br />
forme liquide (activée) ou coagulée.<br />
• Nous recommandons la fraction 1 (F1) pour préparer les membranes de fibrine. Pour l’élaboration de ces membranes,<br />
il est convenable d’utiliser les récipients pour greffons (Réf. <strong>BTI</strong>: RPI40, RPI50 & RPI60; Réf. S&N: 72203583, 72203584 et<br />
72203585, respectivement)<br />
1. Ajoutez avec la seringue d’aspiration BD micro-fine le volume de PRGF® Activator nécessaire en fonction du volume de<br />
plasma à activer contenu dans le tube de fractionnement à raison de 0,05ml (5 unités dans la graduation de la seringue BD<br />
Micro-fine) de PRGF® Activator pour chaque millilitre de plasma.<br />
Remarque : Tenez compte du fait que l’échelle sur la seringue BD Micro-Fine est marqué par unités et ne pas en millimètres.<br />
La conversion est essentielle pour éviter des erreurs.<br />
Volume PRGF® Activator (unités marquées sur la<br />
Volume de plasma Volume PRGF® Activator (ml)<br />
seringue BD Micro-fine)<br />
1 0.05 5<br />
2 0.10 10<br />
4 0.20 20<br />
6 0.30 30<br />
8 0.40 40<br />
2. Jetez la seringue et le PRGF® Activator restant.<br />
Observations : Jaugez soigneusement le temps qui doit s’écouler entre l’ajout de l’activateur selon que vous souhaitez utiliser le plasma<br />
sous forme liquide (activé) ou coagulé.<br />
Information indiquée sur l’étiquette<br />
Date de péremption<br />
Les produits peuvent être<br />
utilisés jusqu’à la fin du<br />
LOT<br />
Numéro de lot<br />
Marquage CE<br />
mois indiqué<br />
0123<br />
8<br />
Contenu suffisant pour<br />
8 utilisations<br />
REF<br />
Référence<br />
Consultez les Consignes<br />
d’utilisation<br />
Limite de température<br />
Conservez à l’abri du<br />
soleil<br />
0123<br />
page 16 sur 44
<strong>Kit</strong> Endoret ® traumatologia (confezioni 4 ciale)<br />
e <strong>Kit</strong> Endoret ® traumatologia (confezioni 8 ciale)<br />
it<br />
Uso previsto: 1 KIT ENDORET® TRAUMATOLOGIA (confezioni 4 ciale) e KIT ENDORET® TRAUMATOLOGIA (confezioni 8 ciale)<br />
costituiscono un sistema di ottenimento di plasma ricco di fattori di crescita che può essere applicato nella rigenerazione ossea<br />
e di altri tessuti connettivi e nel trattamento delle lesioni muscolo-scheletriche.<br />
Descrizione del prodotto: KIT ENDORET® TRAUMATOLOGIA (confezioni 4 ciale) e ENDORET® TRAUMATOLOGIA (confezioni 8<br />
ciale) contengono 8 kit monouso ciascuno.<br />
KIT ENDORET® TRAUMATOLOGIA (confezioni 4 ciale) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
Per ottenere 8 ml di plasma circa si raccomanda l’uso del KIT ENDORET® TRAUMATOLOGIA (4 ciale).<br />
Ciascun KIT monouso ENDORET® TRAUMATOLOGIA (4 ciale) è costituito da due blister.<br />
Blister 1<br />
REF. <strong>BTI</strong> DESCRIZIONE STERILITÀ<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD)<br />
PTD-EST<br />
Sterile<br />
Sistema di aspirazione del plasma<br />
Blister 2<br />
REF. <strong>BTI</strong> DESCRIZIONE STERILITÀ<br />
TE9<br />
TF9-EST<br />
4 Provette per l’estrazione <strong>BTI</strong> per l’ottenimento di plasma ricco di<br />
fattori di crescita, (provette sterili sotto vuoto che contengono una<br />
soluzione di citrato al 3,8% come anticoagulante).<br />
Volume d’estrazione 8,1 ml. Tappo azzurro. Anello nero.<br />
2 Provette di frazionamento <strong>BTI</strong> per l’ottenimento di plasma ricco<br />
di fattori di crescita (provette sterili sotto vuoto).<br />
Tappo bianco. Anello nero.<br />
Sterile all’interno della provetta,<br />
non sterile all’esterno<br />
PE 1 Set o aghi-cannula per estrazione sicura marca Vacuette Sterile<br />
PRGF-ACT-EST 1 Fiala di PRGF® Activator, da 1ml (cloruro di calcio) Sterile<br />
GP31280<br />
1 Siringa di aspirazione del PRGF® Activator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Sterile<br />
* Nota: Questo blister numero 2 non è stato sterilizzato. Consultare la colonna “Sterilità” nella tabella sopra per verificare la sterilità di ciascun<br />
singolo componente.<br />
KIT ENDORET® TRAUMATOLOGIA (confezioni 8 ciale) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
Per ottenere 16 ml di plasma circa si raccomanda l’uso del KIT ENDORET® TRAUMATOLOGIA (8 ciale).<br />
Ciascun KIT monouso ENDORET® TRAUMATOLOGIA (8 ciale) è costituito da due blister.<br />
Blister 1<br />
REF. <strong>BTI</strong> DESCRIZIONE STERILITÀ<br />
PTD-EST<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD)<br />
Sistema di aspirazione del plasma<br />
Sterile<br />
Blister 2<br />
REF. <strong>BTI</strong> DESCRIZIONE STERILITÀ*<br />
8 Provette per l’estrazione <strong>BTI</strong> per l’ottenimento di plasma ricco di<br />
TE9<br />
fattori di crescita, (provette sterili sotto vuoto che contengono una Sterile all’interno della provetta,<br />
soluzione di citrato al 3,8% come anticoagulante).<br />
non sterile all’esterno<br />
Volume d’estrazione 8,1 ml. Tappo azzurro. Anello nero.<br />
TF9-EST<br />
4 Provette di frazionamento <strong>BTI</strong> per l’ottenimento di plasma ricco<br />
di fattori di crescita (provette sterili sotto vuoto). Tappo bianco.<br />
Sterile<br />
Anello nero.<br />
PE 1 Set o aghi-cannula per estrazione sicura marca Vacuette Sterile<br />
PRGF-ACT-EST 2 Fiale di PRGF® Activator, da 1ml (cloruro di calcio) Sterile<br />
GP31280<br />
1 Siringa di aspirazione del PRGF® Activator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Sterile<br />
* Nota: Questo blister numero 2 non è stato sterilizzato. Consultare la colonna “Sterilità” nella tabella sopra per verificare la sterilità di ciascun<br />
singolo componente.<br />
Controindicazioni<br />
Non sono stati identificate controindicazioni o effetti collaterali.<br />
Avvertenze<br />
1. Manipolare tutti i campioni biologici e le parti “appuntite” del sistema di raccolta sangue (lance, aghi, adattatori Luer e<br />
gruppi di raccolta sangue) secondo le politiche e le procedure di sicurezza nonché d’igiene della vostra struttura sanitaria.<br />
Sterile<br />
pagina 17 di 44
2. Virus come quelli responsabili delle epatiti B e C, HIV (AIDS) o di altre malattie infettive vengono trasmessi attraverso il contatto<br />
con campioni biologici. Se l’addetto viene a contatto con campioni biologici, deve ricevere l’attenzione medica opportuna.<br />
3. Se il sangue viene raccolto per linea endovenosa, assicuratevi che la linea sia pulita da qualsiasi medicinale o soluzione<br />
chimica. Smaltire gli oggetti in ottemperanza alle norme di estrazione di sangue del centro sanitario.<br />
4. Tutti gli additivi liquidi presenti nelle provette devono essere incolori e inodori. Non utilizzare le provette quando è cambiato<br />
il colore dell’additivo. Non utilizzare in presenza di materiale estraneo nelle provette o nell’attivatore.<br />
5. II riutilizzo e/o la risterilizzazione di questi prodotti può determinare rischio di infezione e/o contaminazione crociata.<br />
6. Per il prelievo del sangue seguire sempre il protocollo della vostra struttura sanitaria.<br />
7. Bambini, gravidanza e allattamento: Non sono previste precauzioni speciali per pazienti di questo tipo, tuttavia la situazione<br />
personale di ogni paziente deve essere tenuta in considerazione dal personale medico prima dell’applicazione della tecnica<br />
PRGF-ENDORET ®.<br />
Pratica asettica<br />
1. Seguire le procedure asettiche di funzionamento previste dalla propria struttura per ridurre al minimo il rischio di<br />
contaminazione microbiologica delle frazioni del plasma raccolte con la tecnica PRGF-ENDORET®.<br />
2. Inoltre, l’utilizzo di una cappa a flusso laminare adeguata (Cappa a flusso laminare <strong>BTI</strong>, rif. FLVA60<strong>BTI</strong>) per il processo di<br />
attivazione e frazionamento ridurrà il rischio di contaminazione microbiologica.<br />
Smaltimento dei residui<br />
1. Si consiglia di osservare le linee guida igieniche e legali generali vigenti in materia di smaltimento corretto di materiale<br />
infettivo.<br />
2. Indossare guanti per ridurre il rischio di infezioni.<br />
3. Le provette per il prelievo piene o contenenti sangue contaminato devono essere raccolte in appositi contenitori per lo<br />
smaltimento di materiale residuo potenzialmente infettivo.<br />
4. Il materiale residuo di solito viene smaltito in inceneritori o trattato in autoclave (sterilizzazione a vapore).<br />
Precauzioni di conservazione<br />
Temperatura di conservazione: conservare a 4-25º C.<br />
AVVISO: Al di sopra della temperatura massima di conservazione può verificarsi una riduzione della qualità della provetta<br />
(cioè perdita del vuoto, evaporazione degli additivi liquidi, modifica dei colori, ecc.).<br />
Non utilizzare dopo la data di scadenza.<br />
Mantenere lontano dalla luce del sole.<br />
Istruzioni per l’uso<br />
1. Prelievo di sangue<br />
Durante le operazioni di prelievo di sangue e di manipolazione delle provette di raccolta del sangue, indossare gli appositi guanti per<br />
ridurre al minimo il rischio di esposizione.<br />
Il sangue deve essere utilizzato entro 4 ore dall’estrazione. Evitare il prelievo di sangue se questo non verrà utilizzato entro 4 ore<br />
dal prelievo stesso.<br />
1. Selezionare le provette necessarie per ottenere le frazioni di plasma desiderate.<br />
NOTA: Le provette di estrazione <strong>BTI</strong> contengono additivi. E’ importante quindi evitare l’eventuale reflusso dalla provetta data<br />
la possibilità di reazioni nocive per il paziente. Per prevenire il reflusso dalla provetta al braccio del paziente, occorre<br />
osservare le seguenti precauzioni:<br />
a) Posizionare verso il basso il braccio del paziente.<br />
b) Tenere la provetta con il tappo orientato verso l’alto.<br />
c) Rilasciare il laccio emostatico non appena il sangue inizia a fluire nella provetta.<br />
d) Assicurarsi che il contenuto della provetta non tocchi l’estremità dell’ago durante la venopuntura.<br />
2. Applicare un compressore (max. 1 minuto). Preparare la sede per la venopuntura con l’apposito panno antisettico. Non<br />
palpare l’area della venopuntura dopo averla pulita.<br />
3. Estrarre l’ago-cannula con il tubicino di silicone e l’adattatore dal relativo involucro sterile.<br />
4. Rimuovere il cappuccio dell’ago.<br />
5. Eseguire la venopuntura con il braccio del paziente tenuto verso il basso.<br />
6. Spingere la provetta nel portaprovette e sulla valvola dell’ago, forando il diaframma di gomma. Centrare le provette nel<br />
portaprovette durante la penetrazione del tappo onde evitare la penetrazione delle pareti laterali e successiva perdita<br />
prematura del vuoto.<br />
7. Togliere il compressore appena appare sangue nella provetta. Durante la procedura evitare il contatto tra il contenuto della<br />
provetta e il tappo. Non tenere la provetta capovolta bensì sempre in posizione ascendente mantenendola premuta con il<br />
pollice per assicurare una completa aspirazione a vuoto.<br />
8. Quando la prima provetta è piena e il sangue cessa di fluire, rimuoverla con cura dal portaprovette.<br />
NOTA: Se il sangue non passa nella provetta o il flusso di sangue si interrompe prima di aver ottenuto un campione adeguato,<br />
si consigliano i seguenti passi per completare il prelievo in modo soddisfacente:<br />
a) Spingere in avanti la provetta fino a perforare il tappo. Tenere sempre la provetta in posizione mantenendola premuta<br />
con il pollice per assicurare un’aspirazione completa a vuoto.<br />
b) Assicurarsi del corretto inserimento dell’ago in vena.<br />
c) Se il sangue non circola ancora, rimuovere la provetta e posizionarne una nuova nel portaprovette.<br />
d) Se neanche questa operazione ha successo, rimuovere ed eliminare l’ago. Ripetere la procedura dal passo 1.<br />
pagina 18 di 44
9. Subito dopo il prelievo di sangue capovolgere delicatamente le provette 4-6 volte onde ottenere una miscela di additivo<br />
e sangue. Capovolgere la provetta piena e rimetterla in posizione verticale. Questa operazione porta a una inversione<br />
completa.<br />
NOTA: Non agitare le provette. La miscelazione energica può portare alla formazione di schiuma, emolisi e attivazione piastrinica<br />
compromettendo i risultati della tecnica PRGF-ENDORET®. La miscelazione scorretta può inoltre generare risultati<br />
indesiderati.<br />
10. Ripetere i passi 6, 7, 8 con il resto delle provette necessarie.<br />
11. Non appena il sangue cessa di fluire nell’ultima provetta, rimuovere l’ago dalla vena, premendo sul sito della puntura con<br />
un bastoncino idrofilo sterile asciutto finché non smette di sanguinare. Una volta avvenuta la coagulazione, , applicare<br />
lápposito sterile.<br />
NOTA: Dopo la venopuntura, la parte superiore del tappo può contenere sangue residuo. Prendere le dovute precauzione nel<br />
manipolare le provette per evitare il contatto con il sangue. Qualunque oggetto contaminato di sangue è considerato<br />
pericoloso e deve essere immediatamente eliminato.<br />
12. Eliminare l’ago con portaago utilizzando un dispositivo di smaltimento adeguato. NON RIMETTERE IL TAPPO. La ritappatura<br />
degli aghi aumenta il rischio dei danni da ago ed esposizione al sangue.<br />
NOTA: Occasionalmente, il sangue può fuoriuscire dal manicotto della guaina dell’ago. Adottare precauzioni di sicurezza universali<br />
onde minimizzare il rischio di esposizione.<br />
2. Centrifugazione:<br />
Una volta piene, le provette devono essere centrifugate subito dopo aver prelevato il sangue o entro un’ora al massimo. Non refrigerare<br />
per nessun motivo.<br />
LE PROVETTE PER ESTRAZIONE <strong>BTI</strong> DEVONO ESSERE CENTRIFUGATE UNICAMENTE CON UNA CENTRIFUGA MODELLO SYSTEM IV<br />
<strong>BTI</strong>. In questo modo si garantisce che le frazioni di plasma ottenute mediante la tecnica PRGF-ENDORET® sono opportunamente<br />
separate e pronte per essere usate nelle varie applicazioni cliniche approvate.<br />
Seguire le istruzioni specifiche per uso della centrifuga System IV di <strong>BTI</strong>.<br />
La centrifugazione consente di separare il sangue nei suoi tre componenti base:<br />
• Plasma ricco in fattori di crescita: strato superiore del plasma (colore giallastro) che contiene la maggior quantità di<br />
piastrine, distribuite secondo un gradiente crescente di densità (il conteggio delle piastrine è inferiore nella porzione<br />
superiore della provetta e aumenta gradualmente dall’alto verso il basso della provetta).<br />
• Serie bianca o leucociti: sottile strato bianco-grigiastro situato appena sopra gli eritrociti (conosciuto anche come<br />
buffy-coat).<br />
• Eritrociti: sedimentano sul fondo della provetta.<br />
3. Frazionamento mediante PLASMA TRANSFER DEVICE (PTD)<br />
Prima di iniziare l’aspirazione, determinare il volume totale del plasma (Vt) utilizzando gli indicatori di volume sull’etichetta della<br />
provetta (Vt dipende dall’ematocrito del paziente).<br />
1. Utilizzando guanti sterili, togliere il tappo blu dalle provette di estrazione previamente centrifugate e collocate sul supporto<br />
GT16 (Ref. S&N: 72203572). Fatte attenzione a non mescolare la serie rossa con il plasma.<br />
2. Estrarre il dispositivo di aspirazione <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) dal blister sterile.<br />
3. Togliere il tubetto di protezione dalla cannula<br />
4. Inserire nella parte posteriore del PTD una provetta di frazionamento <strong>BTI</strong>.<br />
5. Posizionare la cannula del PTD nel punto più superficiale della frazione di plasma da estrarre. Mantenere l’estremità della<br />
cannula del PTD appena sotto la superficie del plasma (circa 1-2 millimetri) e in contatto con la parete interna della provetta.<br />
6. Premere delicatamente il pulsante blu per iniziare l’aspirazione della Frazione 1 (F1) di plasma. Durante il processo,<br />
accompagnare l’aspirazione con un movimento verticale discendente, in modo tale che la cannula sia sempre nella parte<br />
più superficiale della frazione da aspirare. Aspirare lentamente per evitare turbolenze.<br />
7. Interrompere l’aspirazione del plasma quando rimangono circa 2 ml di plasma sopra la serie bianca conosciuta come buffy coat.<br />
AVVISO: NON ASPIRARE ARIA Premere il pulsante blu mentre l’estremità della cannula del PTD è scoperta farà perdere il<br />
vuoto alla provetta di frazionamento.<br />
8. Ripetere i passi 5, 6 e 7 per ciascuna provetta di estrazione <strong>BTI</strong> (precedentemente centrifugate) con lo stesso PTD e provetta di<br />
funzionamento, quindi rimuovere la provetta di frazionamento e collocarla sul supporto sterile (Ref. <strong>BTI</strong>: GTT; Ref. S&N 72203573).<br />
Figura 1:<br />
Vt<br />
F1<br />
F2<br />
FRAZIONE 1<br />
Vt - 2 ml<br />
FRAZIONE 2<br />
2 ml<br />
Serie Bianca<br />
Serie Rossa<br />
Provetta 9 ml<br />
9. Ripetere i passi 4-8 per aspirare la frazione 2 (F2) di tutte le provette di estrazione. Aspirare la frazione di volume in modo<br />
uniforme (2 ml); è importante non aspirare il contenuto della serie bianca o “buffy coat”.<br />
pagina 19 di 44
10. Collocare tutte le frazioni F1 del paziente nella stessa provetta per il frazionamento del plasma.<br />
11. Collocare tutte le frazioni F2 del paziente ottenute nella stessa provetta per il frazionamento del plasma.<br />
12. Gettare il <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD), dispositivo monouso; NON RIUTILIZZABILE.<br />
4. Protocollo di attivazione piastrinica<br />
AVVISO: Dopo aver preparato il plasma, utilizzarlo entro 4 ore dall’estrazione.<br />
L’attivazione del plasma si realizza aggiungendo una quantità precisa di PRGF® Activator.<br />
• La frazione 2 (F2) contiene un maggior numero di piastrine e fattori di crescita. Può essere utilizzato in modo liquido<br />
(attivato) o come coagulo.<br />
• È consigliata la frazione 1 (F1) per la preparazione delle membrane di fibrina. Per l’elaborazione delle stesse è opportuno<br />
utilizzare i recipienti per innesto (Ref. <strong>BTI</strong>: RPI40, RPI50 & RPI60; Ref. S&N: 72203583, 72203584 e 72203585, rispettivamente).<br />
1. Aggiungere con la siringa di aspirazione BD Micro-fine il volume di PRGF® Activator necessario in base al volume di<br />
plasma da attivare contenuto nella provetta di frazionamento, con un rapporto di 0,05ml (5 unità nella scala della siringa<br />
BD Micro -fine) di PRGF® Activator per ciascun millilitro di plasma.<br />
Nota: Tenere presente che la graduazione della siringa BD Micro-Fine si esprime in unità, no in millilitri. La conversione è<br />
essenziale per evitare errori.<br />
Volume PRGF® Activator<br />
Volume di plasma Volume PRGF® Activator (mL)<br />
(unità indicate nella siringa BD Micro-fine)<br />
1 0.05 5<br />
2 0.10 10<br />
4 0.20 20<br />
6 0.30 30<br />
8 0.40 40<br />
2. Eliminare la siringa e il PRGF® Activator che avanza.<br />
Osservazioni: Valutare attentamente il tempo che deve intercorrere una volta aggiunto l’attivatore in base all’utilizzo che si vuole fare<br />
del plasma, in forma liquida (attivato) o come coagulo.<br />
Informazioni contenute nell’etichetta della scatola<br />
Data di scadenza<br />
I prodotti possono essere<br />
utilizzati fino alla fine del LOT<br />
Lotto<br />
Marcatura CE<br />
mese indicato<br />
0123<br />
Contenuto sufficiente per<br />
8 usi<br />
REF<br />
Riferimento<br />
Consultare le istruzioni<br />
per l’uso<br />
8<br />
Limite di temperatura<br />
Mantenere lontano dalla<br />
luce del sole<br />
0123<br />
pagina 20 di 44
<strong>Kit</strong> Endoret ® traumatologia (sets 4 tubos) e<br />
<strong>Kit</strong> Endoret ® traumatologia (sets 8 tubos)<br />
pt<br />
Utilização prevista: Os KIT ENDORET® TRAUMATOLOGIA (sets 4 tubos) e KIT ENDORET® TRAUMATOLOGIA (sets 8 tubos) consistem<br />
num sistema para obter plasma rico em factores de crescimento, que pode ser utilizado na regeneração óssea e de outros tecidos<br />
conjuntivos no tratamento de lesões músculo-esqueléticas.<br />
Descrição do produto: Os KIT ENDORET® TRAUMATOLOGIA (sets 4 tubos) e KIT ENDORET® TRAUMATOLOGIA (sets 8 tubos) KIT<br />
ENDORET® TRAUMATOLOGIA (sets 8 tubos) contêm cada um 8 kits descartáveis.<br />
KIT ENDORET® TRAUMATOLOGIA (sets 4 tubos) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
Para obter aproximadamente 8 ml de plasma é aconselhável utilizar o KIT ENDORET® TRAUMATOLOGIA (4 tubos).<br />
Cada KIT ENDORET® TRAUMATOLOGIA (4 tubos) é composto por dois blisters.<br />
Blister 1<br />
REF. <strong>BTI</strong> DESCRIÇÃO ESTERILIZAÇÃO<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD):<br />
PTD-EST<br />
Esterilizado<br />
Sistema de aspiração do plasma<br />
Blister 2<br />
REF. <strong>BTI</strong> DESCRIÇÃO ESTERILIZAÇÃO*<br />
TE9<br />
TF9-EST<br />
4 Tubos de colheita <strong>BTI</strong> para obter plasma rico em factores de<br />
crescimento, (tubos esterilizados em vácuo, contêm uma solução<br />
de citrato a 3,8% como anticoagulante). Volume de colheita 8.1 ml.<br />
Tampa azul clara. Aro preto.<br />
2 Tubos de fraccionamento <strong>BTI</strong> para obter plasma rico em factores de<br />
crescimento (tubos esterilizados em vácuo).<br />
Tampa branca. Aro preto.<br />
página 21 de 44<br />
Esterilizado no interior do tubo;<br />
Não esterilizado no exterior<br />
Esterilizado<br />
PE 1 Set o borboleta de colheita de sangue Vacuette Esterilizado<br />
PRGF-ACT-EST 1 Ampola de PRGF® Activator, de 1ml (cloreto de cálcio) Esterilizado<br />
GP31280<br />
1 Seringa para aspiração do PRGF® Activator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Esterilizado<br />
* Nota: Este blister número 2 não foi esterilizado. Ver a coluna “Esterilização” no quadro de cima para verificar a esterilização de cada componente<br />
em separado.<br />
KIT ENDORET® TRAUMATOLOGIA (sets 8 tubos) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
Para obter aproximadamente 16 ml de plasma é aconselhável utilizar o KIT ENDORET® TRAUMATOLOGIA (8 tubos).<br />
Cada KIT ENDORET® TRAUMATOLOGIA (8 tubos) é composto por dois blisters.<br />
Blister 1<br />
REF. <strong>BTI</strong> DESCRIÇÃO ESTERILIZAÇÃO<br />
PTD-EST<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD):<br />
sistema de aspiração do plasma<br />
Esterilizado<br />
Blister 2<br />
REF. <strong>BTI</strong> DESCRIÇÃO ESTERILIZAÇÃO*<br />
8 Tubos de colheita <strong>BTI</strong> para obter plasma rico em factores de<br />
TE9<br />
crescimento, (tubos esterilizados em vácuo, contêm uma solução de Esterilizado no interior do tubo;<br />
citrato a 3,8% como anticoagulante).<br />
Não esterilizado no exterior<br />
Volume de colheita 8.1 ml. Tampa azul clara. Aro preto.<br />
TF9-EST<br />
4 Tubos de fraccionamento <strong>BTI</strong> para obter plasma rico em factores de<br />
crescimento (tubos esterilizados em vácuo).<br />
Esterilizado<br />
Tampa branca. Aro preto.<br />
PE 1 Set ou borboleta de colheita de sangue Vacuette Esterilizado<br />
PRGF-ACT-EST 2 Ampolas de PRGF® Activator, de 1ml (cloreto de cálcio) Esterilizado<br />
GP31280<br />
1 Seringa para aspiração do PRGF® Activator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Esterilizado<br />
* Nota: Este blister número 2 não foi esterilizado. Ver a coluna “Esterilização” no quadro de cima para verificar a esterilização de cada componente<br />
em separado.<br />
Contra-indicações<br />
Não foram identificadas contra-indicações nem efeitos adversos.<br />
Advertências<br />
1. Manipular as amostras biológicas e os objectos “pontiagudos” para a colheita de sangue (lancetas, agulhas, adaptadores<br />
Lúer e conjuntos de colheita de sangue) de acordo com as políticas de saúde e segurança e os procedimentos da sua<br />
instituição.
2. Podem ser transmitidos vírus (como a hepatite B e C, HIV - SIDA - ou outras doenças infecciosas) através do contacto com as<br />
amostras biológicas. Certifique-se de receber os cuidados médicos adequados em caso de exposição a amostras biológicas.<br />
3. Se o sangue for colhido por uma via intravenosa, verificar que não permanece nenhum resto de medicamentos ou soluções<br />
químicas. Eliminar os objectos de acordo com o protocolo de colheita de sangue da instituição.<br />
4. Todos os aditivos líquidos nos tubos de sangue devem ser incolores e inodoros. Não utilizar tubos que apresentem uma<br />
alteração da cor do aditivo. Não utilizar os tubos se conterem matérias estranhas nos tubos ou no activador.<br />
5. A reutilização e/ou esterilização destes produtos pode provocar risco de infecção e/ou contaminação cruzada.<br />
6. Seguir sempre o protocolo de colheita de sangue da instituição.<br />
7. Crianças, gravidez e aleitamento: Não existem precauções adicionais nestes casos, no entanto, o profissional clínico deverá<br />
ter em conta a situação individual de cada paciente antes da aplicação da técnica PRGF-ENDORET ®.<br />
Operação asséptica<br />
1. Seguir os protocolos de operação asséptica da instituição para minimizar o risco de contaminação das fracções de plasma<br />
conseguidas através da técnica PRGF-ENDORET®.<br />
2. Além disso, a utilização de um gabinete de fluxo laminar adequado (gabinete de fluxo laminar <strong>BTI</strong>, Ref.FLVA60<strong>BTI</strong>) nos<br />
processos de fraccionamento e activação diminui o risco de contaminação microbiológica.<br />
Eliminação dos resíduos<br />
1. Devem ser respeitadas as directivas gerais sobre higiene e as normas legais que regulam a eliminação adequada do material<br />
infeccioso.<br />
2. Usar luvas para reduzir o risco de infecções.<br />
3. Os tubos de colheita cheios ou os tubos contaminados devem ser colocados em recipientes adequados para resíduos<br />
potencialmente infecciosos.<br />
4. Os resíduos são normalmente eliminados através de incineração ou tratamento de autoclave (esterilização por vapor).<br />
Precauções de armazenamento<br />
Temperatura de armazenamento: guardar a 4-25º C.<br />
AVISO: Ultrapassar a temperatura de armazenamento máxima pode resultar numa deterioração da qualidade do tubo (ou<br />
seja: perda de vácuo, evaporação dos aditivos líquidos, descoloração, etc.).<br />
Não utilizar após expiração da data de validade.<br />
Proteger da luz directa do sol.<br />
Instruções de Utilização<br />
1. Extracção de sangue<br />
Usar luvas durante a colheita de sangue e o manuseamento dos tubos de colheita para reduzir ao mínimo os riscos de exposição.<br />
O sangue deve ser utilizado num prazo de 4 horas depois da extracção. Não colher o sangue se pensar utilizá-lo passadas 4 horas<br />
depois da colheita.<br />
1. Seleccionar os tubos necessários para obter as fracções de plasma pretendidas.<br />
NOTA: Os tubos de colheita <strong>BTI</strong> contêm aditivos. Por conseguinte, é importante evitar o refluxo eventual a partir do tubo,<br />
dada a possibilidade de reacções adversas no paciente. Para evitar o refluxo do tubo para o braço do paciente,<br />
respeitar as seguintes precauções:<br />
a) Colocar o braço do paciente em posição descendente.<br />
b) Segurar o tubo com a tampa virada para cima.<br />
c) Soltar o torniquete assim que o sangue começar a fluir no tubo.<br />
d) Verificar que o conteúdo do tubo não toca na extremidade da agulha durante a venipunctura.<br />
2. Aplicar um torniquete (máx. 1 minuto). Preparar o sitio de venipunctura com o toalhete embebido com anti-séptico. Não<br />
palpar o local de venipunctura depois de a limpar.<br />
3. Extrair a borboleta com o tubo de silicone e o adaptador do invólucro esterilizado.<br />
4. Retirar a tampa da agulha.<br />
5. Realizar a venipunctura com o braço do paciente em posição descendente.<br />
6. Empurrar o tubo contra o suporte e a válvula da agulha perfurando o diafragma de borracha. Centrar os tubos no suporte<br />
quando introduzir a tampa para evitar a perfuração lateral e a consequente perda prematura de vácuo.<br />
7. Retirar o torniquete assim que aparecer sangue no tubo. Não deixar o conteúdo do tubo entrar em contacto com a tampa<br />
durante o procedimento. Não virar o tubo e mantê-lo sempre em posição vertical ascendente apertando-o com o polegar<br />
para garantir uma aspiração completa em vácuo.<br />
8. Quando o primeiro tubo estiver cheio e o fluxo de sangue parar, retirá-lo cuidadosamente do suporte.<br />
NOTA: Se não fluir sangue no tubo ou se o fluxo for interrompido antes da colheita de uma amostra adequada, são<br />
recomendadas as etapas seguintes para realizar uma colheita satisfatória:<br />
a) Empurrar o tubo para a frente até perfurar a tampa. Manter sempre em posição apertando o tubo com o polegar para<br />
assegurar uma aspiração em vácuo total.<br />
b) Confirmar a posição correcta da agulha na veia.<br />
c) Se o sangue continuar a não fluir, retirar o tubo e colocar um novo no suporte.<br />
d) Se esta acção não resultar, retirar a agulha e eliminá-la. Repetir o procedimento a partir do passo 1.<br />
9. Virar devagar os tubos 4 a 6 vezes imediatamente após a colheita de sangue para obter uma mistura adequada do sangue<br />
e do aditivo. Virar o tubo cheio com a parte superior para baixo e voltar a colocá-lo na posição para cima. Esta acção<br />
corresponde a uma inversão completa.<br />
NOTA: Não agitar os tubos. Uma mistura enérgica pode provocar espuma, hemólise e activação das plaquetas, bem como resultados<br />
incorrectos da Técnica PRGF-ENDORET®. Uma mistura inadequada pode gerar também resultados indesejáveis.<br />
página 22 de 44
10. Repetir os passos 6, 7 e 8 com o resto dos tubos necessários.<br />
11. Assim que o sangue deixar de fluir no último tubo, retirar a agulha da veia, exercendo pressão no local da punctura com uma<br />
compressa esterilizada seca até parar a hemorragia. Quando ocorrer a coagulação, aplicar um penso esterilizado.<br />
NOTA: Após a venipunctura, a parte superior da tampa pode conter restos de sangue. Tomar as precauções adequadas quando<br />
manusear os tubos para evitar entrar em contacto com este sangue. Qualquer objecto que seja contaminado com sangue<br />
é considerado perigoso e deve ser eliminado imediatamente.<br />
12. Eliminar a agulha utilizada com o suporte utilizando um dispositivo de eliminação apropriado. NÃO VOLTAR A TAPAR. Voltar<br />
a colocar a tampa das agulhas aumenta o risco de picadura e exposição ao sangue.<br />
NOTA: Pode ocorrer um derrame à volta da haste da agulha. Aplicar precauções de segurança universais para reduzir ao mínimo<br />
o risco de exposição.<br />
2. Centrifugação<br />
Uma vez cheios, os tubos devem ser centrifugados imediatamente após a colheita de sangue ou no prazo de uma hora. Em caso<br />
algum devem ser refrigerados.<br />
OS TUBOS <strong>BTI</strong> DE COLHEITA SÓ DEVEM SER CENTRIFUGADOS NUMA CENTRÍFUGA MODELO SYSTEM IV DA <strong>BTI</strong>. Desta forma<br />
assegura-se que as fracções de plasma conseguidas através da técnica PRGF-ENDORET® estão devidamente separadas e<br />
preparadas para serem utilizadas nas diferentes aplicações clínicas aprovadas.<br />
Seguir as instruções específicas de utilização da centrífuga System IV da <strong>BTI</strong>.<br />
Após a centrifugação, o sangue é separado nos seus três componentes básicos:<br />
• Plasma rico em factores de crescimento: é a camada superior do plasma (cor amarelado) que contém a maior parte das<br />
plaquetas, distribuídas de acordo com um gradiente crescente concentração (ou seja, o número de plaquetas é menor na<br />
parte superior do tubo e aumenta gradualmente de cima para baixo no tubo).<br />
• Camada de glóbulos brancos ou leucócitos: a camada fina branca-acinzentada depositada exactamente por cima dos<br />
glóbulos vermelhos do sangue ou hemoglobina (também conhecida como camada leuco-plaquetária ou buffy coat).<br />
• Glóbulos vermelhos ou hemoglobina: Glóbulos vermelhos ou hemoglobina pousados no fundo do tubo.<br />
3. Fraccionamento através do PLASMA TRANSFER DEVICE (PTD)<br />
Antes de iniciar a aspiração, é necessário determinar o volume total (Vt) de plasma com os indicadores de volume que aparecem na<br />
graduação do tubo (Vt depende do hematócrito do paciente).<br />
1. Usando luvas esterilizadas, retire a tampa azul dos tubos de colheita centrifugados e colocados no suporte GT16<br />
(Ref. S&N: 72203572). Tenha cuidado para não misturar a série vermelha com o plasma.<br />
2. Retirar o dispositivo de aspiração <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) do blister esterilizado.<br />
3. Retirar o tubo protector da cânula.<br />
4. Inserir um tubo de fraccionamento <strong>BTI</strong> na parte posterior do PTD.<br />
5. Posicionar a cânula do PTD na zona mais superficial da fracção de plasma a retirar. Manter a extremidade da cânula do PTD<br />
exactamente por baixo da superfície do plasma (aproximadamente 1-2 milímetros) e em contacto com a parede interna do tubo.<br />
6. Premir levemente o botão azul para começar a aspiração da Fracção 1 (F1) do plasma. Durante o processo, combinar a<br />
aspiração com um movimento vertical descendente, de forma a que a cânula esteja sempre situada na zona mais superficial<br />
da fracção pretendida a aspirar. Aspirar lentamente para evitar turbulências.<br />
7. Deixar de aspirar o plasma quando sobrar aproximadamente 2 ml de plasma por cima da camada leuco-plaquetária ou<br />
buffy coat.<br />
AVISO: NÃO ASPIRAR AR. Ao premir o botão azul enquanto a extremidade da cânula do PTD estiver no ar, o tubo de<br />
fraccionamento perde propriedades de vácuo.<br />
8. Repetir os passos 5, 6 e 7 para cada tubo de colheita <strong>BTI</strong> (previamente centrifugados) com o mesmo PTD e tubo de fraccionamento<br />
depois de retirar o tubo de fraccionamento e colocá-lo no suporte esterilizado (Ref. <strong>BTI</strong>: GTT; Ref. S&N 72203573).<br />
Figura 1:<br />
Vt<br />
F1<br />
F2<br />
FRACÇÃO 1<br />
Vt - 2 ml<br />
FRACÇÃO 2<br />
2 ml<br />
Glóbulos<br />
Brancos<br />
Glóbulos<br />
vermelhos<br />
Tubo 9 ml<br />
9. Repetir os passos 4-8 para aspirar a fracção 2 (F2) de todos os tubos de colheita. Aspirar a fracção de volume constante<br />
(2 ml). É importante não aspirar o conteúdo dos glóbulos brancos ou “buffy coat”.<br />
10. Colocar todas as fracções F1 obtidas do paciente no mesmo tubo de fraccionamento de plasma.<br />
11. Colocar todas as fracções F2 obtidas do paciente no mesmo tubo de fraccionamento de plasma.<br />
12. Eliminar o dispositivo de uso único <strong>BTI</strong> PLASMA TRANSFER DEVICE ( PTD); NÃO REUTILIZÁVEL.<br />
4. Protocolo de activação das plaquetas<br />
AVISO: Assim que o plasma estiver preparado aplicar num prazo máximo de 4 horas depois da colheita.<br />
A activação do plasma é feita adicionando uma medida exacta de PRGF® Activator.<br />
página 23 de 44
• A fracção 2 (F2) contém um número superior de plaquetas e de factores de crescimento. Pode ser utilizada em forma<br />
líquida (activada) ou em coágulo.<br />
• É aconselhável a fracção 1 (F1) para preparar as membranas de fibrina. Para a elaboração das próprias é conveniente utilizar<br />
os recipientes para enxertos (Ref. <strong>BTI</strong>: RPI40, RPI50 e RPI60; Ref. S&N: 72203583, 72203584 e 72203585, respectivamente).<br />
1. Adicionar com a seringa de aspiração BD Micro-fine o volume de PRGF® Activator necessário confo0rme o volume de plasma<br />
a activar contido no tubo de fraccionamento, à razão de 0,05ml (5 unidades na escala da seringa BD Micro -fine) de PRGF®<br />
Activator por cada mililitro de plasma.<br />
Nota: Tenha em conta que a escala na seringa BD Micro-Fine vem marcada por unidades e não por mililitros. A conversão é<br />
fundamental para evitar erros.<br />
Volume de plasma Volume PRGF® Activator (mL)<br />
Volume PRGF® Activator<br />
(Unidades marcadas na seringa BD Micro-fine)<br />
1 0.05 5<br />
2 0.10 10<br />
4 0.20 20<br />
6 0.30 30<br />
8 0.40 40<br />
2. Eliminar a seringa e o PRGF® Activator excedentes.<br />
Advertência: Calcular cuidadosamente o tempo que deve decorrer desde que se adiciona o activador, dependendo de se pretender<br />
utilizar o plasma em forma líquida (activado) ou em coágulo.<br />
Informações da etiqueta da embalagem<br />
Prazo de validade<br />
Os produtos podem ser<br />
LOT Número de lote<br />
Marca CE<br />
utilizados até ao fim do<br />
mês indicado<br />
0123<br />
8<br />
Conteúdo suficiente para<br />
8 usos Referência<br />
REF<br />
Consultar as instruções<br />
de utilização<br />
Limite de temperatura<br />
Proteger da luz directa<br />
do sol<br />
0123<br />
página 24 de 44
Endoret ® -<strong>Kit</strong> traumatologi (4 sæt rør) og<br />
Endoret ® -<strong>Kit</strong> traumatologi (8 sæt rør)<br />
da<br />
Tilsigtet anvendelse: ENDORET®-KIT TRAUMATOLOGI (4 sæt rør) og ENDORET®-KIT TRAUMATOLOGI (8 sæt rør) udgør et system<br />
til opnåelse af plasma, som er rigt på vækstfaktorer, der kan anvendes til regenerering af knogler og andre bindevæv og i<br />
behandlingen af muskel- og skeletlæsioner.<br />
Produktbeskrivelse: ENDORET®-KIT TRAUMATOLOGI (4 sæt rør) og ENDORET®-KIT TRAUMATOLOGI (8 sæt rør) indeholder hver<br />
især 8 sæt til engangsbrug.<br />
ENDORET®-KIT TRAUMATOLOGI (4 sæt rør) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
For at opnå cirka 8 ml plasma anbefales det at anvende ENDORET®-KIT TRAUMATOLOGI (4 rør).<br />
Hvert ENDORET®-KIT TRAUMATOLOGI (4 rør) engangsbrug består af to blisterpakninger.<br />
Blisterpakning 1<br />
REF. <strong>BTI</strong> BESKRIVELSE STERILITET<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD):<br />
PTD-EST<br />
Steril<br />
System til opsugning af plasma<br />
Blisterpakning 2<br />
REF. <strong>BTI</strong> BESKRIVELSE STERILITET*<br />
TE9<br />
TF9-EST<br />
4 <strong>BTI</strong>-prøveglas til opnåelse af plasma, som er rigt på vækstfaktorer,<br />
(sterile vakuumglas, der indeholder en 3,8 % citratopløsning som<br />
antikoagulans).<br />
Prøvevolumen 8,1 ml. Lyseblå hætte. Sort ring.<br />
2 <strong>BTI</strong>-fraktioneringsglas til opnåelse af plasma, som er rigt på<br />
vækstfaktorer (sterile vakuumglas). Hvid hætte. Sort ring.<br />
side 25 af 44<br />
Steril inde i glasset;<br />
usteril på den udvendige side.<br />
PE 1 sæt eller en vingeskrue til sikker udtagning fra Vacuette. Steril<br />
PRGF-ACT-EST 1 ampul af PRGF®-aktivator 1 ml (calciumchlorid) Steril<br />
GP31280<br />
1 kanyle til opsugning af PRGF®-aktivator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Steril<br />
* Bemærk: Denne blisterpakning nummer 2 er ikke steriliseret. Se kolonnen “Sterilitet” i tabellen herover for at kontrollere steriliteten for hver<br />
komponent separat.<br />
ENDORET®-KIT TRAUMATOLOGI (8 sæt rør) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
For at opnå cirka 16 ml plasma anbefales det at anvende ENDORET®-KIT TRAUMATOLOGI (8 rør).<br />
Hvert ENDORET®-KIT TRAUMATOLOGI (8 rør) til engangsbrug består af to blisterpakninger.<br />
Blisterpakning 1<br />
REF. <strong>BTI</strong> BESKRIVELSE STERILITET<br />
PTD-EST<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD):<br />
system til opsugning af plasma<br />
Steril<br />
Blisterpakning 2<br />
REF. <strong>BTI</strong> BESKRIVELSE STERILITET*<br />
TE9<br />
8 <strong>BTI</strong>-prøveglas til opnåelse af plasma, som er rigt på vækstfaktorer,<br />
Steril inde i glasset; ikke steril på<br />
(sterile vakuumglas, der indeholder en 3,8 % citratopløsning som<br />
den udvendige side.<br />
antikoagulans). Prøvevolumen 8,1 ml. Lyseblå hætte. Sort ring.<br />
TF9-EST<br />
4 <strong>BTI</strong>-fraktioneringsglas til opnåelse af plasma, som er rigt på<br />
vækstfaktorer (sterile vakuumglas). Hvid hætte. Sort ring.<br />
Steril<br />
PE 1 sæt eller en vingeskrue til sikker udtagning fra Vacuette. Steril<br />
PRGF-ACT-EST 2 ampuller af PRGF®-aktivator 1 ml (calciumchlorid) Steril<br />
GP31280<br />
1 kanyle til opsugning af PRGF®-aktivator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Steril<br />
* Bemærk: Denne blisterpakning nummer 2 er ikke steriliseret. Se kolonnen “Sterilitet” i tabellen herover for at kontrollere steriliteten for hver<br />
komponent separat.<br />
Kontraindikationer<br />
Der er ikke identificeret bivirkninger eller kontraindikationer.<br />
Forholdsregler<br />
1. Alle biologiske prøver og skarpe genstande til blodudtagning (lancetter, kanyler, luer-adaptere og blodopsamlingsmateriel)<br />
skal håndteres i henhold til sundheds- og sikkerhedspolitikken og procedurerne for installation.<br />
2. Virus (såsom hepatitis B og C, HIV (AIDS) eller andre smitsomme sygdomme) kan overføres via kontakt med de biologiske<br />
prøver. I tilfælde af kontakt med biologiske prøver skal passende medicinsk behandling foretages.<br />
3. Hvis blodet opsamles intravenøst, skal det sikres, at der ikke efterlades nogen rester fra medicin eller kemiske opløsninger.<br />
Bortskaf objekter i overensstemmelse med institutionens politik for blodudtagning.<br />
Steril
4. Alle flydende tilsætningsstoffer i blodglassene skal være farveløse og lugtfri. Brug ikke glas, hvor tilsætningsstoffet har<br />
skiftet farve. Anvend ikke, hvis der påvises fremmede stoffer i glassene eller aktivatoren.<br />
5. Genbrug og/eller resterilisering af disse produkter kan provokere infektionsrisiko og/eller krydskontaminering.<br />
6. Følg altid institutionens protokol for blodopsamling.<br />
7. Børn, graviditet og ammende kvinder: Der kræves ingen yderligere forholdsregler på grund af disse tilstande, dog bør den<br />
individuelle situation for hver enkelt patient tages i betragtning af sundhedmedarbejderen før anvendelse af teknikken<br />
PRGF-ENDORET®.<br />
Aseptisk praksis<br />
1. Følg institutionens protokoller for aseptisk håndtering, for at minimere risikoen for forurening af plasmafraktioner opnået<br />
ved hjælp af teknikken PRGF-ENDORET®.<br />
2. Anvendelse af et laminar flow-kabinet beregnet til fraktionerings- og aktiveringsprocesser (<strong>BTI</strong> laminar flow-kabinet,<br />
Ref. FLVA60<strong>BTI</strong>) mindsker risikoen for mikrobiologisk forurening.<br />
Bortskaffelse af affald<br />
1. Overhold de generelle hygiejniske retningslinjer og lovbefalede bestemmelser om korrekt bortskaffelse af infektiøst<br />
materiale.<br />
2. Brug handsker for at mindske risikoen for infektion.<br />
3. De fulde prøveglas eller de glas, der indeholder forurenet blod, skal samles i beholdere egnet til potentielt smittefarligt affald.<br />
4. Affaldet bortskaffes som regel ved forbrænding eller ved autoklavering (dampsterilisering).<br />
Forholdsregler ved oplagring<br />
Opbevaringstemperatur: opbevar ved 4-25 ºC.<br />
ADVARSEL: Overskridelse af den maksimale opbevaringstemperatur kan foranledige forringelse af glassets kvalitet (dvs. tab<br />
af vakuum, fordampning af de flydende tilsætningsstoffer, farveændring, osv.).<br />
Må ikke anvendes efter udløbsdatoen.<br />
Holdes væk fra direkte sollys.<br />
Brugsanvisninger<br />
1. Blodudtagning<br />
Brug handsker under blodudtagningen og under håndtering af blodprøveglassene for at minimere risikoen for kontakt.<br />
Blodet skal anvendes inden for 4 timer efter prøveudtagningen. Udtag ikke blodet, hvis det planlægges at anvende det mere end<br />
4 timer efter prøveudtagningen.<br />
1. Udvælg det nødvendige antal glas til opnåelse af de ønskede plasmafraktioner.<br />
BEMÆRK: <strong>BTI</strong>-prøveglassene indeholder tilsætningsstoffer. Det er derfor vigtigt at undgå muligt tilbageløb fra glasset, da der<br />
er mulighed for bivirkninger hos patienten. For at forhindre tilbageløb fra glasset til patientens arm overholdes<br />
følgende forholdsregler:<br />
a) Anbring patientens arm i nedadgående position.<br />
b) Hold glasset med hætten opad.<br />
c) Frigør staseslangen, når blodet begynder at flyde til glasset.<br />
d) Sørg for at glassets indhold ikke rører ved nålens spids under venepunkturen.<br />
2. Anvend en staseslange (maks. 1 minut). Forbered venepunkturstedet med den antiseptiske serviet. Berør ikke venepunkturzonen<br />
efter, at den er blevet renset.<br />
3. Udtag vingeskruen med silikoneslangen og adapteren fra den sterile indpakning.<br />
4. Fjern hætten fra nålen.<br />
5. Foretag venepunkturen med patientens arm i nedadgående position.<br />
6. Skub glasset mod holderen og nålens ventil, når gummimembranen perforeres. Sørg for, at glassene er godt centreret i<br />
holderen, når hætten sættes i, for at undgå lateral perforering og påfølgende for tidligt tab af vakuum.<br />
7. Slæk staseslangen, når der viser sig blod i glasset. Tillad ikke at glassets indhold rører ved hætten under proceduren. Vend<br />
ikke glasset om og hold det altid i lodret stilling med tommelfingertryk for at sikre en fuldstændig opsugning i vakuum.<br />
8. Når det første glas er fyldt, og blodstrømmen stopper, fjernes det forsigtigt fra holderen.<br />
BEMÆRK: Hvis der ikke flyder blod til glasset, eller tilstrømningen stopper, før der er opnået en passende prøve, foreslås de<br />
følgende etaper for at fuldføre en tilfredsstillende prøveudtagning:<br />
a) Skub glasset fremad, indtil hætten perforeres. Hold det altid i lodret stilling med tommelfingertryk for at sikre en<br />
fuldstændig vakuumopsugning.<br />
b) Det skal sikres, at nålen er placeret korrekt i åren.<br />
c) Hvis blodet fortsat ikke flyder, fjernes glasset, og der indsættes et nyt i holderen.<br />
d) Hvis denne handling stadigvæk ikke giver tilfredsstillende resultater, fjernes nålen og den bortskaffes. Gentag proceduren<br />
fra trin 1.<br />
9. Vend forsigtigt glassene mellem 4 og 6 gange straks efter udtagningen for at opnå en passende blanding af tilsætningsstoffet<br />
og blodet. Vend det fulde glas op og ned og anbring det igen opad. Dette udgør en hel vending.<br />
BEMÆRK: Ryst ikke glassene. En energisk blanding kan provokere skum, hæmolyse og thrombocytaktivering samt ukorrekte<br />
resultater af teknikken PRGF-ENDORET®. En utilstrækkelig blanding kan også forårsage uønskede resultater.<br />
10. Gentag trin 6, 7, 8 med resten af de glas, der er behov for.<br />
11. Når blodet ophører med at flyde til det sidste glas, tages nålen ud af åren, og der lægges tryk på punkturstedet med en tør,<br />
steril vatpind, indtil blødningen stopper. Når koaguleringen har fundet sted, pålægges den sterile forbinding..<br />
BEMÆRK: Efter venepunktur kan der være blodrester på den øvre del af hætten. Tag de nødvendige forholdregler under<br />
håndteringen af glassene for at undgå kontakt med dette blod. Ethvert objekt, der forurenes med blod anses for at være<br />
farligt og skal bortskaffes øjeblikkeligt.<br />
side 26 af 44
12. Bortskaf den nål, der blev brugt med holderen, ved hjælp af en passende elemineringsanordning. PÅSÆT IKKE HÆTTEN<br />
IGEN At påsætte nålehætten igen forøger risikoen for stik og for kontakt med blod.<br />
BEMÆRK: Der kan lejlighedsvis forekomme blodudløb fra nålens lille muffe. Træf almindelige sikkerhedsforanstalninger for at<br />
reducere risikoen for kontakt med blod til det minimale.<br />
2. Centrifugering<br />
Når først glassene er fulde, skal de centrifugeres straks efter blodudtagningen eller højst en time efter. De må under ingen<br />
omstændigheder nedkøles.<br />
<strong>BTI</strong>-PRØVEGLASSENE MÅ KUN CENTRIFUGERES I EN <strong>BTI</strong>-CENTRIFUGE MODEL SYSTEM IV. På den måde sikrer vi at plasmafraktionerne<br />
opnået ved hjælp af teknikken PRGF-ENDORET® er passende adskilt og klar til brug inden for de forskellige kliniske anvendelsesområder.<br />
Følg de specifikke brugsanvisninger for <strong>BTI</strong>-centrifugen System IV.<br />
Efter centrifugeringen adskilles blodet i tre forskellige komponenter:<br />
• Plasma, som er rigt på vækstfaktorer: Er den plasmasøjle (gul farve), der indeholder størstedelen af blodpladerne, fordelt<br />
efter stigende koncentrationsgrad (dette betyder at antallet af blodplader er mindst i den øvre del af glasset og forøges i<br />
nedadgående retning).<br />
• Hvid serie eller leukocytter: Er det tynde hvidlige lag, der deponeres lige oven på de røde blodlegemer (også kaldet<br />
buffy coat).<br />
• Erytrocytter: Er den røde søjle, der fylder den nedre del af glasset.<br />
3. Fraktionering ved hjælp af PLASMA TRANSFER DEVICE (PTD)<br />
Før fraktioneringen påbegyndes vurderes, ved hjælp af skalaen, der vises på glassets etiket, det totalt opnåede plasmavolumen (Vt)<br />
efter centrifugeringen (det afhænger af den hæmatokritværdi, som patienten har).<br />
1. Med anvendelse af sterile handsker fjernes den blå hætte fra de centrifugerede prøveglas, der står i stativet GT16<br />
(Ref. S&N: 72203572). Vær påpasselig med ikke at blande den den røde serie med plasmaet.<br />
2. Udtag sugeanordningen <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) fra den sterile blisterpakning.<br />
3. Fjern beskyttelsesglasset fra kanylen.<br />
4. Indsæt et <strong>BTI</strong>-fraktioneringsglas bagerst i PTD´en.<br />
5. Anbring PTD-kanylen i den øverste del af den plasmafraktion, der skal udtages. Hold PDT-kanylens spids lige under plasmaets<br />
overflade (mellem 1-2 milímeter) og i kontakt med glassets indre væg.<br />
6. Tryk forsigtigt på den blå knap for at påbegynde opsugningen af plasmaets Fraktion 1 (F1). Under proceduren ledsages<br />
opsugningen af en nedadgående vertikal bevægelse, således at kanylen altid befinder sig i den øverste del af den fraktion,<br />
der ønsket opsuget. Foretag opsugningen langsomt for at undgå turbulens.<br />
7. Stop opsugningen af plasma, når der er cirka 2 ml plasma tilbage oven på den hvide serie eller buffy coat.<br />
ADVARSEL: OPSUG IKKE LUFT. Hvis der trykkes på den blå knap, mens spidsen af PDT-kanylen befinder sig i luften, vil det<br />
forårsage, at glasset mister vakuum.<br />
8. Gentag trin 5, 6 og 7 for hvert <strong>BTI</strong>-prøveglas (allerede centrifugerede) med samme PTD og fraktioneringsglas, herefter<br />
fjernes fraktioneringsglasset, og det anbringes i det sterile stativ (Ref. <strong>BTI</strong>: GTT; Ref. S&N 72203573).<br />
Figur 1:<br />
Vt<br />
F1<br />
F2<br />
FRAKTION 1<br />
Vt - 2 ml<br />
FRAKTION 2<br />
2 ml<br />
Hvid serie<br />
Rød serie<br />
Glas 9 ml<br />
9. Gentag trin 4-8 for at opsuge fraktion 2 (F2) fra alle prøveglassene. Opsug fraktionen med konstant volumen (2 ml); det er<br />
vigtigt ikke at opsuge indholdet af den hvide serie eller “buffy coat”.<br />
10. Anbring alle de F1-fraktioner, der er opnået fra patienten, i samme plasmafraktioneringsglas.<br />
11. Anbring alle de F2-fraktioner, der er opnået fra patienten i samme plasmafraktioneringsglas.<br />
12. Bortskaf <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD), engangsanording; KAN IKKE GENANVENDES.<br />
4. Protokol for thrombocytaktivering<br />
ADVARSEL: Når plasmaet er præpareret, må der højst anvendes i 4 timer efter prøveudtagningen.<br />
Aktiveringen af plasmaet foretages ved at tilføre en præcis mængde af PRGF®-aktivator.<br />
• Fraktion 2 (F2) indeholder et større antal thrombocytter og vækstfaktorer. Kan anvendes i flydende form (aktiveret) eller koaguleret.<br />
• Fraktion 1 (F1) anbefales til fremstilling af fibrinmembraner. Til udarbejdelsen af disse er det praktisk at anvende<br />
podningsbeholderne (Ref. <strong>BTI</strong>: RPI40, RPI50 & RPI60; Ref. S&N: henholdsvis 72203583, 72203584 og 72203585).<br />
1. Tilfør med opsugningskanylen BD Micro-fine den mængde af PRGF®-aktivator, der er nødvendig i forhold til den<br />
plasmamængde indeholdt i fraktioneringsglasset, der skal aktiveres, i forholdet 0,05 ml (5 skalaenheder på kanylen BD<br />
Micro -fine) PRGF®-aktivator per milliliter plasma.<br />
Bemærk: Vær opmærksom på at skalaen på kanylen BD Micro-Fine markerer enheder og ikke milliliter. Omregningen er<br />
vigtig for at undgå fejl.<br />
side 27 af 44
Plasmavolumen Volumen PRGF®-aktivator (ml)<br />
Volumen PRGF®-aktivator<br />
(Enheder markeret på kanylen BD Micro-fine)<br />
1 0,05 5<br />
2 0,10 10<br />
4 0,20 20<br />
6 0,30 30<br />
8 0,40 40<br />
2. Bortskaf kanylen og overskydende PRGF®-aktivator.<br />
Observationer: Vær nøje opmærksom på den tid, der skal gå fra tilsætning af aktivatoren i forhold til, om plasmaet ønskes anvendt i<br />
flydende form (aktiveret) eller koaguleret.<br />
Oplysninger på emballagemærkaten<br />
Udløbsdato<br />
Produkterne kan<br />
LOT<br />
Partinummer<br />
CE-mærket<br />
anvendes indtil udgangen<br />
af den angivne måned<br />
0123<br />
8<br />
Indeholder tilstrækkeligt<br />
til 8 anvendelser<br />
REF<br />
Reference<br />
Se venligst<br />
brugsanvisningen<br />
Temperaturbegrænsning<br />
Holdes væk fra direkte<br />
sollys<br />
0123<br />
side 28 af 44
Endoret ® <strong>Kit</strong> traumatologia (4 putken sarjat)<br />
ja Endoret ® <strong>Kit</strong> traumatologia (8 putken sarjat)<br />
fi<br />
Käyttötarkoitus: ENDORET® KIT TRAUMATOLOGIA (4 putken sarjat) ja ENDORET® KIT TRAUMATOLOGIA (8 putken sarjat)<br />
muodostavat järjestelmän kasvutekijöitä sisältävän plasman keräämiseen. Plasmaa voidaan käyttää luiden ja muiden<br />
sidekudosten uudismuodostuksessa sekä lihasten ja luuston leesioiden hoidossa.<br />
Tuotteen kuvaus: ENDORET® KIT TRAUMATOLOGIA (4 putken sarjat) ja ENDORET® KIT TRAUMATOLOGIA (8 putken sarjat)<br />
sisältävät kumpikin kahdeksan kertakäyttöistä settiä.<br />
ENDORET® KIT TRAUMATOLOGIA (4 putken sarjat) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
Jos halutaan saada noin 8 ml plasmaa, on suositeltavaa käyttää ENDORET® KIT TRAUMATOLOGIA (4 putken).<br />
Kaikissa ENDORET® KIT TRAUMATOLOGIA (4 putken) on kaksi läpipainopakkausta.<br />
Läpipainopakkaus 1<br />
<strong>BTI</strong>-VIITE KUVAUS STERIILIYS<br />
PTD-EST <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD): plasman aspirointijärjestelmä Steriili<br />
Läpipainopakkaus 2<br />
<strong>BTI</strong>-VIITE KUVAUS STERIILIYS*<br />
TE9<br />
TF9-EST<br />
4 <strong>BTI</strong>-näytteenottoputkea kasvutekijöitä sisältävän plasman<br />
keräykseen (steriilit tyhjiöputket, joissa on antikoagulanttina<br />
3,8-prosenttista sitraattiliuosta). Täyttömäärä 8,1 ml.<br />
Kirkkaansininen korkki. Musta rengas.<br />
2 <strong>BTI</strong>-fraktiointiputkea kasvutekijöitä sisäl-tävän plasman<br />
keräykseen (steriilit tyhjiö-putket). Valkoinen korkki. Musta rengas.<br />
Putken sisäpuoli steriili.<br />
Ulkopuoli epästeriili.<br />
PE 1 sarja tai siipimutterilla varustettu Vacuette-näytteenottolaite Steriili<br />
PRGF-ACT-EST 1 PRGF® Activator -ampulli, 1 ml (kalsiumkloridia) Steriili<br />
GP31280<br />
1 ruisku PRGF® Activator -liuoksen aspiraa-tioon:<br />
BD Micro-Fine 0,5 ml 29 G x 12,7 mm<br />
Steriili<br />
* Huomautus: Läpipainopakkausta 2 ei ole steriloitu. Katso kunkin osan steriiliys yllä olevan taulukon sarakkeesta “Steriiliys”.<br />
ENDORET® KIT TRAUMATOLOGIA (8 putken sarjat) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
Jos halutaan saada noin 16 ml plasmaa, on suositeltavaa käyttää ENDORET® KIT TRAUMATOLOGIA (8 putken).<br />
Kaikissa ENDORET® KIT TRAUMATOLOGIA (8 putken) on kaksi läpipainopakkausta.<br />
Läpipainopakkaus 1<br />
<strong>BTI</strong>-VIITE KUVAUS STERIILIYS<br />
PTD-EST <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD): plasman aspirointijärjestelmä Steriili<br />
Läpipainopakkaus 2<br />
<strong>BTI</strong>-VIITE KUVAUS STERIILIYS*<br />
8 <strong>BTI</strong>-näytteenottoputkea kasvutekijöitä sisältävän plasman<br />
TE9<br />
keräykseen (steriilit tyhjiö-putket, joissa on antikoagulanttina Putken sisäpuoli steriili.<br />
3,8-prosenttista sitraattiliuosta). Täyttömäärä 8,1 ml.<br />
Ulkopuoli epästeriili.<br />
Kirkkaansininen korkki. Musta rengas.<br />
TF9-EST<br />
4 <strong>BTI</strong>-fraktiointiputkea kasvutekijöitä sisältävän plasman<br />
keräykseen (steriilit tyhjiöputket). Valkoinen korkki. Musta rengas.<br />
Steriili<br />
PE 1 sarja tai siipimutterilla varustettu Vacuette-näytteenottolaite Steriili<br />
PRGF-ACT-EST 2 PRGF® Activator -ampulli, 1 ml (kalsiumkloridia) Steriili<br />
GP31280<br />
1 ruisku PRGF® Activator -liuoksen aspiraa-tioon:<br />
BD Micro-Fine 0,5 ml 29 G x 12,7 mm<br />
Steriili<br />
* Huomautus: Läpipainopakkausta 2 ei ole steriloitu. Katso kunkin osan steriiliys yllä olevan taulukon sarakkeesta “Steriiliys”.<br />
Vasta-aiheet<br />
Vasta-aiheita tai haittavaikutuksia ei ole tiedossa.<br />
Varotoimet<br />
1. Kaikkia biologisia näytteitä ja teräviä, verinäytteen otossa käytettäviä esineitä (lansetteja, neuloja, Luer-liittimiä ja<br />
verinäytteenottolaitteita) on käsiteltävä laitoksen turvallisuus- ja infektiovaarakäytäntöjen ja -menettelytapojen mukaisesti.<br />
2. Kosketuksesta biologisiin näytteisiin voi aiheutua virustartunta (kuten hepatiitti B tai C, HIV (AIDS) tai muita tartuntatauteja).<br />
Jos joku henkilö altistuu biologisille näytteille, hänen on hakeuduttava tarvittavaan lääkärinhoitoon.<br />
3. Mikäli verinäyte otetaan laskimosta, on varmistettava, ettei näytteeseen jää lääkkeitä tai kemiallisia liuoksia. Välineet on<br />
hävitettävä laitoksen verinäytteiden ottamiskäytäntöjen mukaisesti.<br />
4. Kaikkien verinäyteputkien nestemäisten lisäaineiden täytyy olla värittömiä ja hajuttomia. Putkia, joissa lisäaineen väri on<br />
muuttunut, ei saa käyttää. Jos putkissa tai aktivaattorissa näkyy vierasta materiaalia, niitä ei saa käyttää.<br />
Steriili<br />
sivu 29/44
5. Näiden tuotteiden uudelleenkäyttö ja/tai steriloiminen uudelleen voi aiheuttaa infektio- ja/tai ristikontaminaatiovaaran.<br />
6. Laitoksen verinäytteenottokäytäntöjä on aina noudatettava.<br />
7. Lapset, raskaana olevat naiset ja imettävät naiset eivät edellytä lisävarotoimia, mutta jokaisen yksittäisen potilaan tilanne on<br />
kuitenkin otettava huomioon ennen PRGF-ENDORET®-tekniikan käyttämistä.<br />
Aseptinen tekniikka<br />
1. Minimoi PRGF-ENDORET®-tekniikalla saatujen plasmafraktioiden kontaminoitumisriski noudattamalla laitoksesi aseptisia<br />
käytäntöjä.<br />
2. Virtauskammion käyttäminen fraktioinnissa ja aktivoinnissa (virtauskammio <strong>BTI</strong>, viite FLVA60<strong>BTI</strong>) vähentää mikrobiologisen<br />
kontaminaation vaaraa.<br />
Jäämien poistaminen<br />
1. Noudata yleisiä hygienia- ja viranomaismääräyksiä, jotka koskevat tartuntavaarallisen materiaalin asianmukaista poistamista.<br />
2. Käytä käsineitä pienentämään infektiovaaraa.<br />
3. Täydet tai kontaminoitunutta verta sisältävät putket on kerättävä sopiviin astioihin, jotka on tarkoitettu tartuntavaaralliselle<br />
jätteelle.<br />
4. Jäämät poistetaan normaalisti joko polttamalla tai autoklaavikäsittelyllä (höyrysterilointi).<br />
Säilytystä koskevat varotoimet<br />
Säilytyslämpötila: 4–25 ºC.<br />
HUOMAA: Säilytyksen enimmäislämpötilan ylittyminen voi aiheuttaa putken laadun huononemista (tyhjiön häviämistä,<br />
lisäaineiden haihtumista, värimuutoksia yms.).<br />
Ei saa käyttää viimeisen käyttöpäivämäärän jälkeen.<br />
Pidä suojassa suoralta auringonvalolta.<br />
Käyttöohjeet<br />
1. Verinäytteen ottaminen<br />
Käytä käsineitä verinäytteen ottamisen ja verinäyteputkien käsittelyn aikana, jotta altistusvaara on mahdollisimman pieni.<br />
Veri on käytettävä neljän tunnin kuluessa verinäytteen ottamisesta. Verta ei pidä ottaa, jos se aiotaan käyttää yli neljän tunnin<br />
kuluttua näytteen ottamisesta.<br />
1. Valitse tarvittavat putket, jotta saat haluamasi plasmafraktiot.<br />
HUOMAUTUS: <strong>BTI</strong>-näytteenottoputket sisältävät lisäaineita. Siten on tärkeää estää mahdollinen takaisinvirtaus putkesta,<br />
koska lisäaineet voivat aiheuttaa potilaalle haittavaikutuksia. Voit estää takaisinvirtauksen putkesta potilaan<br />
käsivarteen noudattamalla seuraavia varotoimia:<br />
a) Aseta potilaan käsivarsi alaviistoon.<br />
b) Pidä putkea korkki ylöspäin.<br />
c) Vapauta puristusside heti, kun putkeen alkaa tulla verta.<br />
d) Varmista, ettei putken sisältö koske neulan päähän laskimopunktion aikana.<br />
2. Käytä puristussidettä (enint. 1 minuutti). Valmistele pistokohta antiseptisellä pyyhkeellä. Älä palpoi pistokohtaa sen<br />
puhdistamisen jälkeen.<br />
3. Poista siipimutteri, silikoniputki sekä liitin steriilistä pakkauksesta.<br />
4. Vedä neulansuojus taakse.<br />
5. Aseta potilaan käsivarsi alaviistoon ja tee laskimopunktio.<br />
6. Työnnä putkea tukea ja neulan venttiiliä vasten niin, että kumisuljin puhkeaa. Keskitä putket hyvin tukeen, kun asetat korkin,<br />
jotteivät ne puhkea sivusuunnassa ja aiheuta tyhjiön häviämistä ennenaikaisesti.<br />
7. Poista puristusside heti, kun putkessa näkyy verta. Älä anna putken sisällön koskea korkkiin toimenpiteen aikana. Älä käännä<br />
putkea ylösalaisin, vaan pidä se koko ajan pystyasennossa puristaen sitä peukalolla, jotta tyhjiö täyttyy kokonaan.<br />
8. Kun ensimmäinen putki on täynnä ja verenvirtaus lakkaa, poista putki varovaisesti tuesta.<br />
HUOMAUTUS: Mikäli putkeen ei virtaa verta tai virtaus katkeaa ennen riittävän näytteen saamista, tyydyttävä näytteenotto<br />
voi edellyttää seuraavia toimia:<br />
a) Työnnä putkea eteenpäin, kunnes korkki puhkeaa. Pidä putki aina oikeassa asennossa puristaen sitä peukalolla, jotta<br />
tyhjiö täyttyy kokonaan.<br />
b) Varmista neulan oikea sijainti laskimossa.<br />
c) Mikäli verta ei vieläkään virtaa, poista putki ja aseta tukeen uusi putki.<br />
d) Mikäli tämä ei tuota tyydyttäviä tuloksia, poista neula ja hävitä se. Toista toimenpide vaiheesta 1.<br />
9. Kääntele putkia varovasti 4–6 kertaa heti näytteenoton jälkeen, jotta lisäaine ja veri sekoittuvat sopivasti. Käännä täysi putki<br />
ylösalaisin ja takaisin oikein päin. Tämä on yksi kokonainen käännöskerta.<br />
HUOMAUTUS: Älä ravista putkia. Voimakas ravistus voi aiheuttaa vaahtoa, hemolyysiä ja verihiutaleiden aktivaatiota sekä<br />
virheellisiä tuloksia PRGF-ENDORET®-tekniikalla. Riittämätön sekoitus voi myös tuottaa ei-haluttuja tuloksia.<br />
10. Toista vaiheet 6, 7 ja 8 muiden putkien kohdalla.<br />
11. Kun veri lakkaa virtaamasta viimeiseen putkeen, poista neula laskimosta ja paina pistokohtaa steriilillä, kuivalla sidetaitoksella,<br />
kunnes verenvuoto lakkaa. Kun veri on hyytynyt, aseta päälle steriili side.<br />
HUOMAUTUS: Laskimopunktion jälkeen korkin yläosassa voi olla verijäämiä. Kosketus tähän vereen on estettävä asianmukaisilla<br />
varotoimilla putkien käsittelyn aikana. Kaikki veren kontaminoimat esineet katsotaan vaarallisiksi, ja ne on<br />
hävitettävä välittömästi.<br />
12. Hävitä käytetty neula ja tuki sopivalla hävitysmenetelmällä. NIITÄ EI SAA KÄYTTÄÄ UUDELLEEN. Neulojen venttiilikorkin<br />
uudelleenkäyttö lisää pistovaaraa ja verelle altistumisen vaaraa.<br />
HUOMAUTUS: Joskus neulan holkkiin voi kertyä verta. Minimoi altistusvaara noudattamalla yleisiä turvallisuusvarotoimia.<br />
sivu 30/44
2. Sentrifugointi<br />
Kun putket ovat täynnä, ne on sentrifugoitava välittömästi verinäytteen ottamisen jälkeen tai viimeistään tunnin kuluessa. Niitä ei<br />
saa missään tapauksessa laittaa jääkaappiin tai pakastimeen.<br />
<strong>BTI</strong>-NÄYTEPUTKET SAA SENTRIFUGOIDA VAIN <strong>BTI</strong>:N SYSTEM IV -SENTRIFUGIMALLISSA. Näin voidaan varmistaa, että PRGF-<br />
ENDORET®-tekniikalla saadut plasmafraktiot on erotettu asianmukaisesti ja että ne ovat valmiita käytettäväksi erilaisiin<br />
hyväksyttyihin kliinisiin käyttötarkoituksiin.<br />
Noudata <strong>BTI</strong>:n System IV -sentrifugin käyttöohjeita.<br />
Sentrifugoinnissa veri jakautuu kolmeen osaan:<br />
• Kasvutekijöitä sisältävä plasma: plasmaosa (keltainen), joka sisältää suurimman osan verihiutaleista jakautuneina<br />
kasvavaan pitoisuusgradienttiin (ts. verihiutaleiden määrä putken yläosassa on pienempi kuin alaosassa).<br />
• Valkoinen eli leukosyyttikerros: hienoinen valkoiselta näyttävä kerros, joka on aivan punasolujen päällä (kutsutaan myös<br />
nimellä buffy coat).<br />
• Punasolut: punainen kerros putken alaosassa.<br />
3. Fraktiointi PLASMA TRANSFER DEVICE (PTD) -laitteella<br />
Ennen fraktioinnin aloittamista on arvioitava sentrifugoinnissa saadun plasman kokonaismäärä (Vt) putken etiketissä olevan<br />
säännön avulla (määräytyy potilaan hematokriittiarvon perusteella).<br />
1. Poista sentrifugoiduista ja muottiin GT16 (S&N-viite: 72203572) asetetuista näyteputkista sininen korkki käyttämällä steriilejä<br />
käsineitä. Ole varovainen, ettei punainen kerros sekoitu plasmaan.<br />
2. Ota <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) -aspiraatioväline steriilistä läpipainopakkauksesta.<br />
3. Poista kanyylin letkunsuojus.<br />
4. Työnnä PTD:n takaosaan <strong>BTI</strong>:n fraktiointiputki.<br />
5. Aseta PTD-kanyyli kerättävän plasman fraktion pinnanpuoleisimpaan osaan. Pidä PTD-kanyylin päätä aivan plasmakerroksen<br />
pinnan alapuolella (noin 1–2 mm) ja kosketuksessa putken sisäreunaan.<br />
6. Aloita plasman fraktion 1 (F1) aspirointi painamalla kevyesti sinistä painonappia. Laske kanyyliä alemmas aspiroinnin<br />
edetessä, jotta kanyyli on aina aspiroitavan fraktion pinnanpuoleisimmassa osassa. Aspiroi hitaasti, jottei siitä aiheudu<br />
turbulenssia.<br />
7. Lopeta plasman aspirointi, kun plasmaa on jäljellä noin 2 ml valkoisen kerroksen eli buffy coat -kerroksen yläpuolella.<br />
HUOMAA: ÄLÄ ASPIROI ILMAA. Jos painat sinistä painonappia, kun PTD-kanyylin pää on ilmassa, fraktiointiputkesta<br />
häviää tyhjiö.<br />
8. Toista vaiheet 5, 6 ja 7 jokaisen (aiemmin sentrifugoidun) <strong>BTI</strong>-näyteputken kohdalla samalla PTD-laitteella ja fraktiointiputkella.<br />
Aseta sitten fraktiointiputki steriiliin kehikkoon (<strong>BTI</strong>-viite: GTT; S&N-viite: 72203573).<br />
Kuva 1:<br />
Vt<br />
F1<br />
F2<br />
FRAKTIO 1<br />
Vt - 2 ml<br />
FRAKTIO 2<br />
2 ml<br />
Valkoinen kerros<br />
Punainen kerros<br />
Putki 9 ml<br />
9. Aspiroi fraktio 2 (F2) kaikista näytteenottoputkista toistamalla vaiheet 4–8. Aspiroi vakiomääräinen (2 ml) fraktio. On tärkeää,<br />
ettei valkoisen kerroksen eli buffy coat -kerroksen sisältöä aspiroida.<br />
10. Aseta kaikki potilaasta saadut F1-fraktiot samaan plasmafraktiointiputkeen.<br />
11. Aseta kaikki potilaasta saadut F2-fraktiot samaan plasmafraktiointiputkeen.<br />
12. Hävitä kertakäyttöinen <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD). EI SAA KÄYTTÄÄ UUDELLEEN.<br />
4. Verihiutaleiden aktivointi<br />
HUOMAA: Kun plasma on valmisteltu, anna sen seistä enintään 4 tuntia keräämisen jälkeen.<br />
Plasma aktivoidaan lisäämällä tarkka määrä PRGF® Activator -liuosta.<br />
• Fraktio 2 (F2) sisältää suuremman määrän verihiutaleita ja kasvutekijöitä. Sitä voidaan käyttää nestemäisessä muodossa<br />
(aktivoituna) tai hyytyneenä.<br />
• Fraktiota 1 (F1) suositellaan fibriinikalvojen valmisteluun. Niiden valmistukseen on suositeltavaa käyttää elinsiirreastioita<br />
(<strong>BTI</strong>-viitteet RPI40, RPI50 & RPI60; S&N-viitteet 72203583, 72203584 ja 72203585).<br />
1. Lisää BD Micro-fine -aspirointiruiskulla PRGF® Activator -ainetta tarvittava määrä fraktiointiputken sisältämän plasmamäärän<br />
aktivoimiseen, noin 0,05 ml (5 yksikköä BD Micro-fine -ruiskun asteikolla) PRGF® Activator -ainetta yhtä plasmamillilitraa kohti.<br />
Huomautus: Ota huomioon, että BD Micro-Fine -ruiskuun on merkitty yksikköasteikko, ei millilitra-asteikkoa. Yksiköt on<br />
muunnettava, jotta vältytään virheiltä.<br />
sivu 31/44
Plasman määrä (ml)<br />
PRGF® Activator-aineen määrä PRGF® Activator -aineen määrä (BD Micro-fine<br />
(ml)<br />
-ruiskuun merkityt yksiköt)<br />
1 0,05 5<br />
2 0,10 10<br />
4 0,20 20<br />
6 0,30 30<br />
8 0,40 40<br />
2. Hävitä ruisku ja yli jäänyt PRGF® Activator.<br />
Huomautus: Harkitse huolellisesti aikaa, jonka täytyy kulua aktivaattorin lisäyksen jälkeen, sen mukaan, halutaanko plasmaa käyttää<br />
nestemäisessä (aktivoidussa) vai hyytyneessä muodossa.<br />
Pakkausetiketin tiedot<br />
Viimeinen käyttöpäivä<br />
Tuotteita voidaan käyttää<br />
LOT<br />
Eränumero<br />
EY-etiketti<br />
ilmoitetun kuukauden<br />
loppuun asti.<br />
0123<br />
Sisältö riittää 8<br />
käyttökertaan<br />
REF<br />
Viitteet<br />
Tarkista käyttöohjeet<br />
8<br />
Lämpötilarajoitus<br />
Pidä suojassa suoralta<br />
auringonvalolta<br />
0123<br />
sivu 32/44
Endoret ® <strong>Kit</strong> traumatologie (sets met 4 buisjes)<br />
en Endoret ® <strong>Kit</strong> traumatologie (sets met 8 buisjes)<br />
nl<br />
Beoogd gebruik: de ENDORET® KIT TRAUMATOLOGIE (sets met 4 buisjes) en de ENDORET® KIT TRAUMATOLOGIE (sets met 8<br />
buisjes) zijn een systeem waarmee plasma kan worden verkregen dat rijk is aan groeifactoren en kan worden gebruikt voor het<br />
regenereren van bot of andere bindweefsels bij de behandeling van letsel van het skeletspierstelsel.<br />
Productbeschrijving: de ENDORET® KIT TRAUMATOLOGIE (sets met 4 buisjes) en de ENDORET® KIT TRAUMATOLOGIE (sets met<br />
8 buisjes) bevatten elk acht kits voor eenmalig gebruik.<br />
ENDORET® KIT TRAUMATOLOGIE (sets met 4 buisjes) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
Als er ongeveer 8 ml plasma moet worden verkregen, wordt aangeraden de ENDORET® KIT TRAUMATOLOGIE (4 buisjes) te gebruiken.<br />
Elke set uit de ENDORET® KIT TRAUMATOLOGIE (4 buisjes) bestaat uit twee blisterverpakkingen.<br />
Blisterverpakking 1<br />
REF. <strong>BTI</strong> BESCHRIJVING STERILITEIT<br />
<strong>BTI</strong> HULPMIDDEL VOOR OVERBRENGEN VAN PLASMA (PTD):<br />
PTD-EST<br />
Steriel<br />
plasma-opzuigsysteem<br />
Blisterverpakking 2<br />
REF. <strong>BTI</strong> BESCHRIJVING STERILITEIT*<br />
TE9<br />
TF9-EST<br />
4 <strong>BTI</strong> afnamebuisjes voor het verkrijgen van plasma dat rijk<br />
is aan groeifactoren (steriele vacuümbuisjes met een 3,8%<br />
citraatoplossing als antistollingsmiddel) Afnamevolume van 8,1 ml.<br />
Lichtblauwe dop. Zwarte ring.<br />
2 <strong>BTI</strong> fractioneringsbuisjes voor het verkrijgen van plasma dat rijk<br />
is aan groeifactoren (steriele vacuümbuisjes).<br />
Witte dop. Zwarte ring.<br />
pagina 33 van 44<br />
Alleen binnenzijde van buisje;<br />
niet steriel aan de buitenkant.<br />
PE 1 Vacuette vleugelnaaldset Steriel<br />
PRGF-ACT-EST 1 ampul van 1 ml PRGF® activator (calciumchloride) Steriel<br />
GP31280<br />
1 spuit voor opzuigen van PRGF® activator:<br />
BD Micro-Fine 0,5 ml 29 G x 12,7 mm<br />
Steriel<br />
* Opmerking: blisterverpakking nr. 2 is niet gesteriliseerd. Zie de kolom “steriliteit” in de tabel hierboven om de steriliteit van ieder onderdeel<br />
apart te verifiëren.<br />
ENDORET® KIT TRAUMATOLOGIE (sets met 8 buisjes) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
Als er ongeveer 16 ml plasma moet worden verkregen, wordt aangeraden de ENDORET® KIT TRAUMATOLOGIE (8 buisjes) te gebruiken.<br />
Elke set uit de ENDORET® KIT TRAUMATOLOGIE (8 buisjes) bestaat uit twee blisterverpakkingen.<br />
Blisterverpakking 1<br />
REF. <strong>BTI</strong> BESCHRIJVING STERILITEIT<br />
PTD-EST<br />
<strong>BTI</strong> HULPMIDDEL VOOR OVERBRENGEN VAN PLASMA (PTD):<br />
plasma-opzuigsysteem<br />
Steriel<br />
Blisterverpakking 2<br />
REF. <strong>BTI</strong> BESCHRIJVING STERILITEIT*<br />
8 <strong>BTI</strong> afnamebuisjes voor het verkrijgen van plasma dat rijk<br />
TE9<br />
is aan groeifactoren (steriele vacuümbuisjes met een 3,8% Alleen binnenzijde van buisje;<br />
citraatoplossing als antistollingsmiddel). Afnamevolume 8,1 ml. niet steriel aan de buitenkant.<br />
Lichtblauwe dop. Zwarte ring.<br />
TF9-EST<br />
4 <strong>BTI</strong> fractioneringsbuisjes voor het verkrijgen van plasma dat rijk is<br />
aan groeifactoren (steriele vacuümbuisjes). Witte dop. Zwarte ring.<br />
Steriel<br />
PE 1 Vacuette vleugelnaaldset Steriel<br />
PRGF-ACT-EST 2 ampullen van 1 ml PRGF® activator (calciumchloride) Steriel<br />
GP31280<br />
1 spuit voor opzuigen van PRGF® activator: BD Micro-Fine 0,5 ml 29<br />
G x 12,7 mm<br />
Steriel<br />
* Opmerking: blisterverpakking nr. 2 is niet gesteriliseerd. Zie de kolom “steriliteit” in de tabel hierboven om de steriliteit van<br />
ieder onderdeel apart te verifiëren.<br />
Contra-indicaties<br />
Er zijn geen contra-indicaties of bijwerkingen bekend.<br />
Voorzorgsmaatregelen<br />
1. Alle biologische monsters en scherpe voorwerpen om bloed af te nemen (lancetten, naalden, Luer-adapters en materialen<br />
om bloed op te vangen) moeten worden gehanteerd conform het veiligheidsbeleid, de richtlijnen in de gezondheidszorg<br />
en de specifieke procedures die gelden in uw eigen instelling.<br />
Steriel
2. Virussen (zoals het hepatitis B- en C-virus, het hiv-virus (aids) en andere infectieziekten) kunnen worden overgedragen door contact<br />
met de biologische monsters. Als u aan biologische monsters bent blootgesteld, zorg dan dat u adequate medische hulp krijgt.<br />
3. Als het bloed intraveneus wordt verkregen, controleer dan of er niets van een geneesmiddel of chemische oplossing<br />
achterblijft. Gooi voorwerpen weg conform het voor bloedafname geldende beleid van de instelling.<br />
4. Alle vloeibare additieven in de bloedbuizen moeten kleurloos en geurloos zijn. Gebruik geen buizen waarin de kleur van het<br />
additief is veranderd. Gebruik de buizen of de activator niet als er vreemde stoffen in worden ontdekt.<br />
5. Hergebruik en/of opnieuw steriliseren van deze producten kan een risico op infectie en/of kruisbesmetting met zich<br />
meebrengen.<br />
6. Volg altijd het protocol voor bloedafname van de instelling.<br />
7. Kinderen, zwangere vrouwen en vrouwen die borstvoeding geven: er zijn geen extra voorzorgsmaatregelen nodig voor<br />
deze doelgroepen, maar de arts dient wel rekening te houden met de individuele situatie van iedere patiënt voordat hij de<br />
PRGF-ENDORET®-techniek toepast.<br />
Aseptische techniek<br />
1. Volg de protocollen voor aseptisch werken van uw instelling om het risico op besmetting van de middels de PRGF-ENDORET®techniek<br />
verkregen plasmafracties zo klein mogelijk te houden.<br />
2. Het gebruik van een geschikte laminaire luchtstroomkast tijdens de fractionerings- en activeringsprocessen (<strong>BTI</strong> laminaire<br />
luchtstroomkast, Ref. FLVA60<strong>BTI</strong>) vermindert het risico op microbiologische besmetting.<br />
Vernietiging van de residuen<br />
1. Raadpleeg de algemene richtlijnen inzake hygiëne en de wetgeving waarin de toepasselijke procedures voor vernietiging<br />
van besmettelijke stoffen staan beschreven.<br />
2. Draag handschoenen om het risico op infecties tot een minimum te beperken.<br />
3. De volle buisjes bloed of de buisjes die besmet bloed bevatten moeten worden ingezameld in daartoe bestemde vaten voor<br />
mogelijk besmettelijke residuen.<br />
4. De residuen worden vernietigd op de normale wijze, door middel van verbranding of door middel van een<br />
autoclaafbehandeling (stoomsterilisatie).<br />
Voorzorgsmaatregelen voor opslag<br />
Opslagtemperatuur: bewaren bij een temperatuur tussen 4 en 25 ºC.<br />
WAARSCHUWING: als de maximale opslagtemperatuur wordt overschreden, kan de kwaliteit van de buis afnemen (dat wil<br />
zeggen vacuümverlies, verdamping van vloeibare additieven, kleurverandering enz.).<br />
Niet gebruiken na de vervaldatum.<br />
Buiten bereik van direct zonlicht bewaren.<br />
Gebruiksaanwijzing<br />
1. Bloedafname<br />
Draag handschoenen tijdens de bloedafname en het hanteren van de bloedafnamebuisjes om blootstellingsgevaar tot een<br />
minimum te beperken.<br />
Het bloed moet binnen vier uur na afname worden gebruikt. Neem geen bloed af als het niet binnen vier uur na afname zal<br />
worden gebruikt.<br />
1. Kies de benodigde buisjes om de gewenste plasmafracties af te nemen.<br />
OPMERKING: <strong>BTI</strong> afnamebuisjes bevatten additieven. Vanwege mogelijke nadelige reacties van de patiënt is het derhalve<br />
van belang om terugstroom uit het buisje te voorkomen. Neem de volgende voorzorgsmaatregelen in acht om<br />
terugstroom uit het buisje in de arm van de patiënt te voorkomen:<br />
a) Houd de arm van de patiënt naar beneden.<br />
b) Houd het buisje zo vast dat de dop zich op het hoogste punt bevindt.<br />
c) Maak de stuwband los zodra bloed in het buisje begint te stromen.<br />
d) Zorg er tijdens venapunctie voor dat de inhoud van het buisje niet in aanraking komt met het uiteinde van de naald.<br />
2. Breng een stuwband aan (max. 1 minuut). Bereid de locatie van de venapunctie voor met het alcoholdoekje. Raak na<br />
reiniging het venapunctiegebied niet meer aan.<br />
3. Neem de vleugelnaald met het siliconen buisje en de adapter uit de steriele verpakking.<br />
4. Verwijder de naaldbeschermer.<br />
5. Voer een venapunctie uit waarbij de arm van de patiënt naar beneden wordt gehouden.<br />
6. Duw het buisje in de houder en op de klep van de naald waarmee het rubber membraan wordt doorboord. Centreer het<br />
buisje in de houder wanneer u de dop doorboort om het doorboren van de zijwand en voortijdig verlies van vacuüm als<br />
gevolg daarvan te voorkomen.<br />
7. Verwijder de stuwband zodra er bloed in het buisje te zien is. Laat tijdens de procedure de inhoud van het buisje niet in<br />
aanraking komen met de dop. Houd het buisje niet ondersteboven en houd het altijd op zijn plaats door met uw duim<br />
ertegen te drukken om een volledige vacuümafname te garanderen.<br />
8. Wanneer het eerste buisje vol is en de bloedstroom stopt, verwijdert u het buisje voorzichtig uit de houder.<br />
OPMERKING: als er geen bloed in het buisje stroomt of de bloedstroom stopt voordat er voldoende bloed is afgenomen,<br />
kunt u de volgende stappen uitvoeren om een toereikende hoeveelheid te verkrijgen:<br />
a) Duw het buisje naar voren tot de dop van het buisje is doorboord. Houd het buisje altijd op zijn plaats door met uw duim<br />
ertegen te drukken om een volledige vacuümafname te garanderen.<br />
b) Controleer of de naald goed in de ader is geplaatst.<br />
c) Als het bloed nog steeds niet stroomt, verwijdert u het buisje en plaatst u een nieuw buisje op de houder.<br />
d) Als dit evenmin succes oplevert, verwijdert u de naald en gooit u deze weg. Herhaal de procedure vanaf stap 1.<br />
pagina 34 van 44
9. Keer onmiddellijk na bloedafname de buisjes voorzichtig 4-6 maal om, om het bloed en het additief goed te mengen. Keer<br />
het gevulde buisje om en plaats het daarna weer rechtop. Dit staat gelijk aan een volledige omkering.<br />
OPMERKING: schud de buisjes niet. Door krachtig mengen kan er schuimvorming, hemolyse en activering van bloedplaatjes<br />
optreden en kan de PFGF-ENDORET® techniek onjuiste resultaten opleveren. Onvoldoende mengen kan ook<br />
ongewenste resultaten veroorzaken.<br />
10. Herhaal de stappen 6, 7 en 8 met de rest van de benodigde buizen.<br />
11. Zodra er geen bloed meer in het laatste buisje stroomt, verwijdert u de naald uit de ader terwijl u met een droog steriel<br />
gaasje druk blijft uitoefenen op de punctieplaats tot het bloeden stopt. Wanneer stolling is opgetreden, brengt u de steriele<br />
kleefpleister aan.<br />
OPMERKING: na venapunctie kan de bovenzijde van de dop bloedresten bevatten. Neem de juiste voorzorgsmaatregelen bij het<br />
hanteren van buisjes om contact met dit bloed te voorkomen. Elke naaldhouder die verontreinigd raakt met bloed<br />
wordt als gevaarlijk beschouwd en moet onmiddellijk worden afgevoerd.<br />
12. Gebruik een geschikt hulpmiddel voor het afvoeren van de gebruikte naald met de houder. NIET OPNIEUW AFSLUITEN.<br />
Opnieuw afsluiten van naalden verhoogt het risico op prikaccidenten en blootstelling aan bloed.<br />
OPMERKING: het kan in zeldzame gevallen voorkomen dat er bloed lekt uit het koppelstuk van de naald. Neem de gebruikelijke<br />
veiligheidsmaatregelen om het risico op blootstelling tot een minimum te beperken.<br />
2. Centrifugeren<br />
Als de buizen vol zijn, moeten ze direct na afname of binnen maximaal een uur worden gecentrifugeerd. Ze mogen onder geen beding<br />
worden ingevroren.<br />
<strong>BTI</strong> BUISJES MOGEN UITSLUITEND WORDEN GECENTRIFUGEERD IN EEN <strong>BTI</strong> SYSTEM IV CENTRIFUGE. Zo waarborgen we dat<br />
de fracties die middels de PRGF-ENDORET®-techniek zijn verkregen op de juiste wijze worden gescheiden en dat ze gebruikt<br />
kunnen worden voor de verschillende erkende klinische toepassingen.<br />
Volg de specifieke instructies voor gebruik van de <strong>BTI</strong> System IV centrifuge.<br />
Door het centrifugeren wordt het bloed in drie basisbestanddelen gescheiden:<br />
• Plasma dat rijk is aan groeifactoren: bovenste plasmalaag (geelachtig van kleur) die het grootste volume aan bloedplaatjes<br />
bevat, verdeeld volgens een toenemende dichtheidsgradiënt (in het bovenste deel van het buisje is het aantal plaatjes het<br />
kleinst en dit aantal neemt naar beneden geleidelijk toe).<br />
• Witte bloedcellen of leukocyten: de dunne grijs/witte laag die net boven de rode bloedcellen wordt afgezet (wordt ook<br />
buffy coat genoemd).<br />
• Rode bloedcellen: rode kolom van sediment op de bodem van het buisje.<br />
3. Fractionering met behulp van het PLASMA TRANSFER DEVICE (PTD)<br />
Voordat wordt gestart met fractioneren moet het totale volume van het plasma (Vt) dat is verkregen na centrifugeren worden bepaald aan de<br />
hand van de volume-aanduidingen die op het etiket van het buisje zijn aangegeven (Vt is afhankelijk van de hematocrietwaarde van de patiënt).<br />
1. Draag steriele handschoenen als u de blauwe dop van de gecentrifugeerde, in de monsterhouder GT16 (Ref. S&N: 72203572)<br />
geplaatste afnamebuizen haalt. Let op dat u de rode bloedcellen niet met het plasma vermengt.<br />
2. Haal het <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) uit de steriele blisterverpakking.<br />
3. Verwijder de beschermslang van de canule.<br />
4. Plaats een <strong>BTI</strong> fractioneringsbuisje op de achterzijde van de PTD.<br />
5. Plaats de canule van de PTD in het bovenoppervlak van de op te zuigen plasmafractie. Houd het uiteinde van de canule van de<br />
PTD net onder het oppervlak van het plasma (ongeveer 1-2 mm) en houd de naald in contact met de binnenwand van het buisje.<br />
6. Druk zachtjes op de blauwe knop om het opzuigen van plasmafractie 1 (F1) te starten. Voer tijdens het proces een gelijktijdige<br />
beweging verticaal naar beneden uit terwijl u het plasma opzuigt, zodat de canule altijd aan het bovenoppervlak van de op<br />
te zuigen fractie blijft. Zuig het plasma langzaam af om turbulentie te voorkomen.<br />
7. Stop met het opzuigen van het plasma als er nog ongeveer 2 ml plasma op de witte bloedcellen of de buffy coat ligt.<br />
WAARSCHUWING: ZORG DAT U GEEN LUCHT AANZUIGT. Als u op de blauwe knop drukt terwijl het uiteinde van de canule<br />
van de PTD nog aan de lucht is blootgesteld, zal het fractioneringsbuisje vacuüm verliezen.<br />
8. Herhaal stap 5, 6 en 7 voor iedere (vooraf gecentrifugeerde) <strong>BTI</strong> afnamebuisje met dezelfde PTD en hetzelfde fractioneringsbuisje.<br />
Verwijder dan het fractioneringsbuisje en plaats dit in de steriele monsterhouder (Ref. <strong>BTI</strong>: GTT; Ref. S&N 72203573).<br />
Afbeelding 1:<br />
Vt<br />
F1<br />
F2<br />
FRACTIE 1<br />
Vt - 2 ml<br />
FRACTIE 2<br />
2 ml<br />
Witte bloedcellen<br />
Rode bloedcellen<br />
Buis 9 ml<br />
9. Herhaal de stappen 4-8 om fractie 2 (F2) van alle afnamebuisjes op te zuigen. Zuig de fractie in een constant volume (2 ml) op.<br />
Het is belangrijk dat u de witte bloedcellen of buffy coat niet opzuigt.<br />
10. Doe alle van de patiënt verkregen F1-fracties in één plasmafractioneringsbuisje.<br />
pagina 35 van 44
11. Doe alle van de patiënt verkregen F2-fracties in één plasmafractioneringsbuisje.<br />
12. Voer het <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) af. Dit is een hulpmiddel voor eenmalig gebruik, NIET GESCHIKT VOOR<br />
HERGEBRUIK.<br />
4. Activeringsprotocol voor bloedplaatjes<br />
WAARSCHUWING: na centrifugeren mag het plasma niet langer dan 4 uur worden bewaard.<br />
Voor het activeren van plasma voegt u een exacte hoeveelheid PRGF® activator toe.<br />
• Fractie 2 (F2) bevat een groot aantal bloedplaatjes en groeifactoren. Fractie 2 kan in vloeibare vorm (geactiveerd) worden<br />
gebruikt of als stolsel.<br />
• Fractie 1 (F1) wordt aangeraden voor het prepareren van fibrinemembranen. Voor de bewerking van fibrinemembranen is<br />
het handig vaten voor implantaten te gebruiken (Ref. <strong>BTI</strong>: RPI40, RPI50 & RPI60; Ref. S&N: 72203583, 72203584 en 72203585,<br />
respectievelijk).<br />
1. Voeg met de BD Micro-fine opzuigspuit het benodigde volume PRGF® activator toe op basis van het plasmavolume in het<br />
fractioneringsbuisje, in een verhouding van 0,05 ml (5 eenheden op de schaal van de BD Micro-fine spuit) PRGF® activator<br />
per milliliter plasma.<br />
Opmerking: let op dat de schaal op de BD Micro-Fine opzuignaald staat aangegeven in eenheden, niet in milliliters. Omzetting<br />
is essentieel om fouten te voorkomen.<br />
PRGF® Activatorvolume<br />
Plasmavolume (ml) PRGF® Activatorvolume (ml)<br />
(eenheden op de BD Micro-fine opzuignaald)<br />
1 0,05 5<br />
2 0,10 10<br />
4 0,20 20<br />
6 0,30 30<br />
8 0,40 40<br />
2. Werp de spuit en de resterende hoeveelheid PRGF® activator weg.<br />
Opmerkingen: ga zorgvuldig na hoeveel tijd er moet verstrijken na het toevoegen van de activator volgens het bedoelde gebruik van<br />
het plasma, in vloeibare vorm (geactiveerd) of als stolsel.<br />
Informatie op verpakkingsetiket<br />
Vervaldatum<br />
Producten mogen tot het<br />
LOT<br />
Partijnummer<br />
EC-label<br />
einde van de opgegeven<br />
maand worden gebruikt<br />
0123<br />
8<br />
Inhoud voldoende voor 8<br />
toepassingen<br />
REF<br />
Referentie<br />
Zie de<br />
gebruiksaanwijzing<br />
Temperatuurbegrenzing<br />
Buiten bereik van direct<br />
zonlicht bewaren<br />
0123<br />
pagina 36 van 44
Endoret ® <strong>Kit</strong> traumatologi (4 slangesett) og<br />
Endoret ® <strong>Kit</strong> traumatologi (8 slangesett)<br />
no<br />
Bruksområde: ENDORET® KIT TRAUMATOLOGI (4 slangesett) OG ENDORET® KIT TRAUMATOLOGI (8 slangesett) utgjør et system<br />
for utvinning av platerikt plasma, som kan anvendes i gjendannelse av ben og andre bindevev, og i behandling av muskel- og<br />
skjelettskader.<br />
Produktbeskrivelse: ENDORET® KIT TRAUMATOLOGI (4 slangesett) og ENDORET® KIT TRAUMATOLOGI (8 slangesett) inneholder<br />
8 engangssett hver.<br />
ENDORET® KIT TRAUMATOLOGI (4 slangesett) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
For å utvinne omtrent 8 ml plasma anbefales ENDORET® KIT TRAUMATOLOGI (4 slange).<br />
Hvert av engangssettene i ENDORET® KIT TRAUMATOLOGI (4 slange) består av to blisterpakninger.<br />
Blisterpakning 1<br />
REF. <strong>BTI</strong> BESKRIVELSE STERILITET<br />
<strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD):<br />
PTD-EST<br />
Sterilt<br />
System for innsuging av plasma<br />
Blisterpakning 2<br />
REF. <strong>BTI</strong> BESKRIVELSE STERILITET*<br />
TE9<br />
4 <strong>BTI</strong>-ekstraksjonsrør for utvinning av platerikt plasma, (sterile<br />
Steril inni røret;<br />
vakuumrør inneholder en citratløsning på 3,8 % som antikoagulant).<br />
ikke steril utenpå.<br />
Ekstraksjonsvolum 8,1 ml. Lyseblå propp. Svart ring.<br />
TF9-EST<br />
2 <strong>BTI</strong>-fraksjonsrør for utvinning av platerikt plasma (sterile<br />
vakuumrør). Hvit propp. Svart ring.<br />
Sterilt<br />
PE 1 Vacuette-sett/sommerfuglsett for sikker tapping Sterilt<br />
PRGF-ACT-EST 1 ampulle PRGF®-aktivator på 1 ml (kalsiumklorid) Sterilt<br />
GP31280<br />
1 sprøyte for tapping av PRGF®-aktivator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Sterilt<br />
* Merknad: Blisterpakning nummer 2 har ikke blitt sterilisert. Se kolonnen “Sterilitet” i tabellen ovenfor for å bekrefte hver enkelt komponents<br />
sterilitet separat.<br />
ENDORET® KIT TRAUMATOLOGI (8 slangesett) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
For å utvinne omtrent 16 ml plasma anbefales ENDORET® KIT TRAUMATOLOGI (8 slange).<br />
Hvert av engangssettene i ENDORET® KIT TRAUMATOLOGI (8 slange) består av to blisterpakninger.<br />
Blisterpakning 1<br />
REF. <strong>BTI</strong> BESKRIVELSE STERILITET<br />
PTD-EST <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD): system for tapping av plasma Sterilt<br />
Blisterpakning 2<br />
REF. <strong>BTI</strong> BESKRIVELSE STERILITET*<br />
TE9<br />
TF9-EST<br />
8 <strong>BTI</strong>-ekstraksjonsrør for utvinning av platerikt plasma,<br />
(sterile vakuumrør inneholder en citratløsning på 3,8 % som<br />
antikoagulant). Ekstraksjonsvolum 8,1 ml.<br />
Lyseblå propp. Svart ring.<br />
4 <strong>BTI</strong>-fraksjonsrør for utvinning av platerikt plasma (sterile<br />
vakuumrør). Hvit propp. Svart ring.<br />
Steril inni røret;<br />
ikke steril utenpå.<br />
PE 1 Vacuette-sett/sommerfuglsett for sikker tapping Sterilt<br />
PRGF-ACT-EST 2 ampuller av PRGF®-aktivator på 1 ml (kalsiumklorid) Sterilt<br />
1 sprøyte for tapping av PRGF®-aktivator:<br />
GP31280<br />
Sterilt<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
* Merknad: Blisterpakning nummer 2 har ikke blitt sterilisert. Se kolonnen “Sterilitet” i tabellen ovenfor for å bekrefte hver enkelt komponents<br />
sterilitet separat.<br />
Kontraindikasjoner<br />
Ingen kontraindikasjoner eller bivirkninger påvist.<br />
Forholdsregler<br />
1. Håndter alle biologiske prøver og spisse gjenstander for blodprøver (lansetter, nåler, Luer-adaptere og utstyr for blodtapping)<br />
i henhold til retningslinjer for sikkerhet og sanitet, og fremgangsmåte for bruk.<br />
2. Virus (som hepatitt B og C, HIV (AIDS) og andre smittefarlige sykdommer) kan overføres ved kontakt med de biologiske<br />
prøvene. Ved eksponering mot biologiske prøver, få riktig medisinsk behandling.<br />
3. Ved intravenøs tapping av blod, kontrollér at det ikke er igjen noe av medikamenter eller kjemiske løsninger. Fjern<br />
gjenstandene i tråd med senterets retningslinjer for blodtapping.<br />
Sterilt<br />
side 37 av 44
4. Alle flytende hjelpestoffer i blodrørene må være farge- og luktfrie. Ikke bruk rør hvor hjelpestoffets farge har endret seg. Ikke<br />
bruk hvis det forekommer fremmedpartikler i rørene eller i aktivatoren.<br />
5. Gjenbruk og/eller gjensterilisering av disse produktene kan medføre fare for infeksjon og/eller smitteoverføring.<br />
6. Følg alltid sentrets protokoll for blodtapping.<br />
7. Barn, gravide og ammende kvinner: Ingen spesielle tilleggsforholdsregler gjelder for disse gruppene, hver enkelt pasients<br />
situasjon må imidlertid vurderes av klinikken før anvendelse av PRGF-ENDORET® -metoden.<br />
Aseptisk praksis<br />
1. Følg senterets retningslinjer for aseptisk praksis for å minimere faren for kontaminering av plasmaprøver utvunnet med<br />
PRGF-ENDORET® -metoden.<br />
2. Bruk av riktig Laminar Flow-kabinett ved sengrifugering og aktivering (Laminar Flow-kabinett <strong>BTI</strong>, Ref. FLVA60<strong>BTI</strong>) minker<br />
risikoen for mikrobiologisk smitte.<br />
Tilintetgjøring av restkonsentrasjoner<br />
1. Generelle direktiver for hygiene og lover for regulering av riktig tilintetgjøring av smittsomme stoffer må følges.<br />
2. Bruk hansker for å minimere risikoen for smitte.<br />
3. Fulle rør eller rør som inneholder kontaminert blod må plasseres i riktige beholdere for potensielt smittsomme stoffer.<br />
4. Restkonsentrasjoner tilintetgjøres normalt ved forbrenning eller ved behandling i autoklav (sterilisering med damp).<br />
Forholdsregler for oppbevaring<br />
Oppbevaringstemperatur: lagre i 4-25 ºC.<br />
MERKNAD: Dersom maksimal temperatur overstiges, kan dette medføre forringelse av rørets kvalitet (dvs. tap av vakuum,<br />
fordamping av flytende hjelpestoffer, endring av farge osv.).<br />
Ikke bruk etter utløpsdato.<br />
Skal ikke utsettes for direkte sollys.<br />
Bruksanvisninger<br />
1. Blodtapping<br />
Bruk hansker ved tapping av blod og håndtering av rør for oppsamling av blod for å minimere eksponeringsrisikoen.<br />
Blodet må anvendes innen 4 timer etter tapping. Ikke tapp blod hvis det skal benyttes mer enn 4 timer etter tapping.<br />
1. Velg nødvendig antall rør for å få den ønskede plasmamengden.<br />
MERKNAD: <strong>BTI</strong>-ekstraksjonsrørene inneholder hjelpestoffer. Det er derfor viktig å unngå mulig tilbakestrømning fra røret på<br />
grunn av risikoen for uønskede reaksjoner hos pasienten. For å unngå tilbakestrømning fra røret til pasientens<br />
arm, følg disse forholdsreglene:<br />
a) Hold pasientens arm i en nedadgående posisjon.<br />
b) Hold røret med proppen vendt opp.<br />
c) Frigjør kompresset når blodet begynner å flyte ut i røret.<br />
d) Kontroller at innholdet i røret ikke er i kontakt med nålspissen under venepunksjonen.<br />
2. Legg på et kompress (maks 1 minutt). Klargjør punktet for venepunksjon med en antiseptisk klut. Ikke berør punktet for<br />
venepunksjon etter rengjøring.<br />
3. Ta ut sommerfuglsettet med silikonrøret og adapteren fra den sterile pakningen.<br />
4. Fjern nålehetten.<br />
5. Gjennomfør venepunksjonen med pasientens arm i en nedadgående posisjon.<br />
6. Trykk røret mot støtten og med nåleventilen slik at denne perforerer gummimembranen. Plasser rørene i støtten når<br />
proppen settes inn for å unngå skjev perforering og følgelig tap av vakuum.<br />
7. Fjern kompresset når blod er synlig i røret. Pass på at innholdet i røret ikke berører proppen under prosessen. Ikke snu røret,<br />
og hold dette alltid i vertikal posisjon klemt til med tommelen for å sørge for fullstendig vakuuminnsug.<br />
8. Når det første røret er fullt og blodstrømmen opphører, fjern det forsiktig fra støtten.<br />
MERKNAD: Dersom blodet ikke fyller røret eller hvis blodstrømmen avbrytes før tilstrekkelig prøve har blitt utvunnet,<br />
anbefales følgende fremgangsmåte for å oppnå en tilfredsstillende ekstraksjon:<br />
a) Press røret fremover til proppen perforeres. Hold denne alltid i posisjon med å klemme med tommelen for å sørge for<br />
fullstendig vakuuminnsug.<br />
b) Se til at nålen er riktig plassert på venen.<br />
c) Hvis blodet fortsatt ikke strømmer til, fjern røret og plasser et nytt i støtten.<br />
d) Dersom problemet fortsetter, fjern nålen og kast denne. Gjenta fremgangsmåten fra trinn 1.<br />
9. Vend rørene forsiktig 4 til 6 ganger umiddelbart etter ekstraksjon for å sørge for riktig blanding av hjelpestoff og blod. Vend<br />
det fulle røret opp og ned, og plasser det deretter pekende oppover. Dette tilsvarer en full vending.<br />
MERKNAD: Ikke rist rørene. En kraftig miksing kan forårsake skum, hemolyse og aktivering av blodplatene, og dermed uriktige<br />
resultater ved PRGF-ENDORET® -metoden. Uegnet blanding kan også forårsake uønskede resultater.<br />
10. Gjenta trinn 6, 7 og 8 med resten av rørene som trengs.<br />
11. Dersom blodstrømmen stopper i det siste røret, fjern nålen fra venen, trykk på venepunksjonspunktet med steril, tørr bomull<br />
til blødningen opphører. Sett på en steril bandasje når koagulering har inntruffet.<br />
MERKNAD: Etter venepunksjonen vil det kunne forekomme rester av blod på den øvre delen av proppen. Ta nødvendige<br />
forholdsregler ved håndtering av rørene for å unngå kontakt med dette blodet. Ethvert objekt som tilsmusses med<br />
blod anses som farlig og må kastes umiddelbart.<br />
12. Kast den brukte nålen med støtten i en egnet avfallsbeholder. IKKE SETT PÅ PROPPEN. Å sette på proppen på sprøytenåla<br />
øker risikoen for stikk og eksponering mot blod.<br />
MERKNAD: Det kan komme blodrester på sprøytehylsa. Ta universelle sikkerhetsforholdsregler for å minimere faren for eksponering.<br />
side 38 av 44
2. Sentrifugering<br />
Når rørene er fulle, må de sentrifugeres umiddelbart etter bloduttak, og maksimalt innen én time. De må ikke under noen<br />
omstendigheter fryses.<br />
<strong>BTI</strong>-EKSTRAKSJONSRØRENE MÅ KUN SENTRIFUGERES I ET IV-SYSTEM AV TYPEN <strong>BTI</strong>. På denne måten forsikrer vi oss om at<br />
plasmaprøvene utvunnet med PRGF-ENDORET® -metoden er riktig separerte og klare til bruk i de ulike godkjente kliniske prosessene.<br />
Følg den spesifikke bruksanvisningen til sentrifugen IV-system fra <strong>BTI</strong>.<br />
Under sentrifugeringen vil blodet separeres i tre komponenter:<br />
• Platerikt plasma: plasmasøylen (gul farge) som inneholder størsteparten av blodplatene, fordelt etter voksende<br />
konsentrasjon (det vil si at konsentrasjonen av blodplater er lavest øverst i søylen og øker nedover).<br />
• Hvite blodceller eller leukocytter: det tynne hvitaktige laget som ligger oppå de røde blodcellene (kalles også<br />
buffy coat).<br />
• Røde blodceller: den røde søylen nederst i røret.<br />
3. Sengrifugering ved bruk av PLASMA TRANSFER DEVICE (PTD)<br />
Før man går i gang med sengrifugeringen, kontroller totalt volum (Vt) av plasma som er utvunnet via sentrifugering (vil avhenge av<br />
pasientens hematokrit) ved hjelp av målelinjene på rørets etikett.<br />
1. Bruk sterile hansker ved fjerning av den blå proppen på sentrifugerte ekstraksjonsrør og plasser disse i stativet GT16 (Ref.<br />
S&N: 72203572). Vær forsiktig så de røde blodcellene ikke blander seg med plasmaet.<br />
2. Fjern ekstraksjonsinnretningen <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD) fra den sterile blisterpakningen.<br />
3. Fjern beskyttelsesrøret fra kanylen.<br />
4. Fest et <strong>BTI</strong>-fraksjonsrør på bakparten av PDT.<br />
5. Plasser PDT-kanylen helt på overflaten av plasmaprøven som skal ekstraheres. Hold tuppen av PTD-kanylen like under<br />
overflaten av plasmaet (ca. 1-2 milli-meter) og i kontakt med innsiden av røret.<br />
6. Trykk forsiktig på den blå knappen for å begynne innsuging av plasma, Fraksjon 1 (F1) Under prosessen, utfør innsugingen<br />
med en nedadgående vertikal bevegelse, på en slik måte at kanylen alltid befinner seg i den øvre delen av fraksjonen som<br />
skal suges opp. Sug sakte for å unngå turbulens.<br />
7. Avslutt oppsuging av plasma når det er igjen omtrent 2 ml plasma over de hvite blodcellene (buffy coat).<br />
MERKNAD: IKKE SUG INN LUFT. Dersom man trykker inn den blå knappen når PTD-kanylens spiss befinner seg i luften, vil<br />
dette føre til at fraksjonsrøret mister vakuum.<br />
8. Gjenta trinn 5, 6 og 7 for hvert <strong>BTI</strong>-ekstraksjonsrør (tidligere sentrifugert) med samme PTD og fraksjonsrør, fjern deretter<br />
fraksjonsrøret og plasser dette i det sterile stativet (Ref. <strong>BTI</strong>: GTT; Ref. S&N 72203573).<br />
Figur 1:<br />
Vt<br />
F1<br />
F2<br />
FRAKSJON 1<br />
Vt - 2 ml<br />
FRAKSJON 2<br />
2 ml<br />
Hvite blodceller<br />
Røde blodceller<br />
Rør 9 ml<br />
9. Gjenta trinnene 4-8 for oppsuging av fraksjon 2 (F2) for alle ekstraksjonsrørene. Sug opp samme volum (2 ml), det er viktig<br />
å ikke suge opp innholdet i det hvite laget (buffy coat).<br />
10. Plasser alle F1-fraksjonene utvunnet fra pasienten i det samme plasma-fraksjonsrøret.<br />
11. Plasser alle F2-fraksjonene utvunnet fra pasienten i det samme plasma-fraksjonsrøret.<br />
12. Kast engangsinnretningen <strong>BTI</strong> PLASMA TRANSFER DEVICE (PTD); IKKE GJENBRUKBAR.<br />
4. Aktiveringsprotokoll for blodplater<br />
MERKNAD: Når plasma er klargjort, utfør senest 4 timer etter ekstraksjon.<br />
Aktivering av plasma utføres ved å tilføre en eksakt mengde PRGF®-aktivator.<br />
• Fraksjon 2 (F2) inneholder en større andel blodplater og vekstfaktorer. Kan benyttes i flytende form (aktivert) eller koagulert.<br />
• Det anbefales å bruke fraksjon 1 (F1) til å klargjøre fibrin-membraner. Til behandling av disse er det praktisk å benytte<br />
beholder for transplantert vev (Ref. <strong>BTI</strong>: RPI40, RPI50 & RPI60; Ref. S&N: henholdsvis 72203583, 72203584 y 72203585).<br />
1. Tilfør nødvendig mengde PRGF®-aktivator med BD Micro-fine sprøyta ut fra volum med plasma som skal aktiveres i<br />
fraksjonsrøret, i forholdet 0,05 ml<br />
(5 enheter på BD Micro-fine sprøytas målestokk) PRGF®-aktivator per milliliter plasma.<br />
Merknad: Vær oppmerksom på at målestokken på BD Micro-fine sprøyta er merket per enhet, ikke i milliliter. Omregning er<br />
essensielt for å unngå feil.<br />
side 39 av 44
Plasmavolum (ml) Volum PRGF®-aktivator (ml)<br />
Volum PRGF®-aktivator<br />
(Enheter merket på BD Micro-fine sprøyta)<br />
1 0,05 5<br />
2 0,10 10<br />
4 0,20 20<br />
6 0,30 30<br />
8 0,40 40<br />
2. Kast sprøyta og PRGF®-aktivator som er til overs.<br />
Hensyn: Ta nøye hensyn til tiden som må forløpe fra tilførsel av aktivator, ettersom hvordan man vil anvende plasmaen, i flytende form<br />
(aktivert) eller koagulert.<br />
Informasjon på pakkeetikett<br />
Utløpsdato<br />
Produktene kan brukes til<br />
utgangen av angitt<br />
LOT<br />
Partinummer<br />
0123<br />
EC-merke<br />
8<br />
REF<br />
Inneholder nok til 8 bruk Referanse Se bruksanvisningen<br />
Temperaturbegrensning<br />
Skal ikke utsettes for<br />
direkte sollys<br />
0123<br />
side 40 av 44
Endoret ® <strong>Kit</strong> traumatologisats (4 slangsatser)<br />
och Endoret ® <strong>Kit</strong> traumatologisats (8 slangsatser)<br />
sv<br />
Avsedd användning: ENDORET® KIT TRAUMATOLOGISATS (4 slangsatser) och ENDORET® KIT TRAUMATOLOGISATS (8 slangsatser)<br />
är system för insamling av plasma med hög koncentration av tillväxtfaktorer, vilken kan användas till regenerering av ben och<br />
annan bindväv samt för behandling av muskuloskeletala skador.<br />
Produktbeskrivning: ENDORET® KIT TRAUMATOLOGISATS (4 slangsatser) och ENDORET® KIT TRAUMATOLOGISATS (8<br />
slangsatser) innehåller 8 stycken engångsset vardera.<br />
ENDORET® KIT TRAUMATOLOGISATS (4 slangsatser) (Ref. <strong>BTI</strong>: EDK1; Ref. S&N 72203574):<br />
För insamling av cirka 8 ml blodplasma rekommenderas ENDORET® KIT TRAUMATOLOGISATS (4 slang)<br />
Varje engångsset i ENDORET® KIT TRAUMATOLOGISATS (4 slang) innehåller två blisterförpackningar.<br />
Blisterförpackning 1<br />
BEST.NR. <strong>BTI</strong> BESKRIVNING STERILITET<br />
PTD-EST<br />
<strong>BTI</strong> PLASMAÖVERFÖRINGSENHET (PTD):<br />
System för aspirering av plasma<br />
Steril<br />
Blisterförpackning 2<br />
BEST.NR. <strong>BTI</strong> BESKRIVNING STERILITET*<br />
TE9<br />
4 <strong>BTI</strong>-extraktionsrör för insamling av plasma med hög<br />
koncentration av tillväxtfaktorer (sterila vakuumrör innehållande<br />
en citratlösning till 3,8 % som antikoagulantia).<br />
Enbart inuti röret.<br />
Extraktions-volym 8,1 ml. Ljusblå propp. Svart ring.<br />
TF9-EST<br />
2 <strong>BTI</strong>-separationsrör för insamling av plasma med hög<br />
koncentration av tillväxtfaktorer (sterila vakuumrör).<br />
Steril<br />
Vit propp. Svart ring.<br />
PE<br />
1 Vacuette venprovtagningsset med butterfly-nål för säker<br />
provtagning<br />
Steril<br />
PRGF-ACT-EST 1 ml PRGF®-aktivatorampull (kalciumklorid) Steril<br />
GP31280<br />
1 spruta för upptagning av PRGF®-aktivator:<br />
BD Micro-Fine 0,5 ml 29G x 12,7 mm<br />
Steril<br />
* Obs! Blisterförpackning 2 är inte steril. Se kolumnen ”Sterilitet” för information om sterilitet för varje enskild enhet.<br />
ENDORET® KIT TRAUMATOLOGISATS (8 slangsatser) (Ref. <strong>BTI</strong>: EDK2; Ref. S&N 72203575):<br />
För insamling av cirka 16 ml blodplasma rekommenderas ENDORET® KIT TRAUMATOLOGISATS (8 slang).<br />
Varje engångsset i ENDORET® KIT TRAUMATOLOGISATS (8 slang) innehåller två blisterförpackningar.<br />
Blisterförpackning 1<br />
BEST.NR. <strong>BTI</strong> BESKRIVNING STERILITET<br />
PTD-EST<br />
<strong>BTI</strong> PLASMAÖVERFÖRINGSENHET (PTD):<br />
system för aspirering av plasma<br />
Steril<br />
Blisterförpackning 2<br />
BEST.NR. <strong>BTI</strong> BESKRIVNING STERILITET*<br />
TE9<br />
8 <strong>BTI</strong>-extraktionsrör för insamling av plasma med hög<br />
koncentration av tillväxtfaktorer (sterila vakuumrör innehållande<br />
en citratlösning till 3,8 % som antikoagulantia). Extraktionsvolym<br />
Enbart inuti röret.<br />
8,1 ml. Ljusblå propp. Svart ring.<br />
TF9-EST<br />
4 <strong>BTI</strong>-separationsrör för insamling av plasma med hög<br />
koncentration av tillväxtfaktorer (sterila vakuumrör).<br />
Steril<br />
Vit propp. Svart ring.<br />
PE<br />
1 Vacuette venprovtagningsset med butterfly-nål för säker<br />
provtagning<br />
Steril<br />
PRGF-ACT-EST 2 1 ml PRGF®-aktivatorampuller (kalciumklorid) Steril<br />
GP31280<br />
1 spruta för upptagning av PRGF®-aktivator: BD Micro-Fine 0,5 ml<br />
29G x 12,7 mm<br />
Steril<br />
* Obs! Blisterförpackning 2 är inte steril. Se kolumnen ”Sterilitet” för information om sterilitet för varje enskild enhet.<br />
Kontraindikationer<br />
Inga kontraindikationer eller biverkningar har identifierats.<br />
Försiktighetsåtgärder<br />
1. Hantera alla biologiska prover och stickande skärande föremål för blodprovstagning (lansetter, kanyler, Luer-adaptrar och<br />
venprovtagningsset) i enlighet med lokala rutiner samt säkerhets- och hälsoföreskrifter.<br />
sida 41 av 44
2. Virus (t.ex. hepatit B och C, HIV/AIDS och andra infektiösa sjukdomar) kan överföras genom kontakt med biologiska prover.<br />
Uppsök läkare om du har kommit i kontakt med biologiska prover.<br />
3. Kontrollera vid intravenös blodprovstagning att inga rester av läkemedel eller kemiska lösningar finns kvar. Kassera<br />
föremålen i enlighet med lokala föreskrifter för venprovtagning.<br />
4. Alla flytande tillsatser i provrören ska vara färg- och luktlösa. Använd inte provrör med tillsatser vars färg har ändrats. Använd<br />
inte provrör eller aktivator om främmande beståndsdelar har identifierats i dessa.<br />
5. Återanvändning och/eller återsterilisering av dessa produkter kan medföra infektionsrisker och/eller korskontaminering.<br />
6. Följ alltid lokala rutiner för venprovtagning.<br />
7. Barn, gravida och ammande: Inga ytterligare försiktighetsåtgärder finns avseende dessa personer. Varje patients individuella<br />
situation ska emellertid beaktas av läkaren före användning av PRGF-ENDORET®-tekniken.<br />
Aseptiskt arbetssätt<br />
1. Följ lokala aseptiska rutiner för att minimera risken för kontamination av de plasmafraktioner som samlats in med hjälp av<br />
PRGF-ENDORET®-tekniken.<br />
2. Genom användning av lämplig LAF-bänk (<strong>BTI</strong> sterilbänk med laminärt luftflöde, ref. FLVA60<strong>BTI</strong>) vid fraktionering och<br />
aktivering minskar risken för mikrobiologisk kontamination.<br />
Avfallshantering<br />
1. Generella hygienbestämmelser och tillämpliga lagar om korrekt kassering av infektiöst material ska följas.<br />
2. Använd handskar för att minska infektionsrisken.<br />
3. Fyllda provrör eller rör med kontaminerade prover ska samlas i behållare avsedda för potentiellt infektiöst material.<br />
4. Avfallet kasseras vanligtvis genom antingen förbränning eller behandling i autoklav (ångsterilisering).<br />
Förvaring<br />
Förvaringstemperatur: mellan 4 och 25 ºC.<br />
VARNING: Om maximal temperatur för lagring överskrids kan detta medföra att rörets kvalitet försämras (t.ex. genom<br />
vakuumförlust, förångning av flytande tillsatser eller färgförändringar).<br />
Använd inte efter utgångsdatum.<br />
Skyddas mot solljus.<br />
Bruksanvisning<br />
1. Blodprovstagning<br />
Använd handskar vid blodprovstagning och hantering av blodprovsrör för att reducera risken för exponering till ett minimum.<br />
Blodet bör användas inom 4 timmar efter blodprovstagningen. Om blodet ska användas mer än 4 timmar efter blodprovstagningen<br />
ska blodprov inte tas.<br />
1. Välj de rör som behövs för önskade plasmafraktioner.<br />
OBS! <strong>BTI</strong>-extraktionsrören innehåller tillsatser. Det är viktigt att ett eventuellt återflöde av rörets innehåll förhindras, eftersom<br />
det annars finns risk för biverkningar hos patienten. Vidta följande säkerhetsåtgärder för att förhindra återflöde till<br />
patientens arm:<br />
a) Placera patientens arm snett nedåt.<br />
b) Håll röret med proppen uppåt.<br />
c) Släpp stasen så fort blod kommer ner i röret.<br />
d) Se till att rörets innehåll inte kommer i kontakt med kanylspetsen vid venpunktionen.<br />
2. Applicera stas (högst 1 minut). Desinficera punktionsstället med enantiseptisk servett. Rör inte vid punktionsstället efter<br />
desinficering.<br />
3. Öppna den sterila förpackningen och ta ut butterfly-nålen med slang och adapter.<br />
4. Avlägsna kanylens skyddshylsa.<br />
5. Utför venpunktionen med patientens arm snett nedåt.<br />
6. Tryck röret mot hållaren och kanylen så att proppens gummidel perforeras. Se till att röret befinner sig mitt i hållaren när<br />
proppen trycks in för att förhindra perforering från sidan, vilket orsakar förtida vakuumförlust.<br />
7. Ta bort stasen så fort blod kommer ner i röret. Låt inte rörets innehåll komma i kontakt med proppen under provtagningen.<br />
Vänd inte på röret utan håll det hela tiden i upprätt position. Håll fast röret med tummen tills vakuumeffekten upphör helt.<br />
8. Ta försiktigt bort det första röret från hållaren när det är fyllt och blodflödet har avstannat.<br />
OBS! Om blodet inte kommer ner i röret, eller om blodflödet upphör innan röret är fyllt, ska följande steg vidtas för att<br />
fullfölja provtagningen:<br />
a) Tryck röret framåt tills proppen perforeras. Håll röret stilla och hela tiden på plats med tummen tills vakuumeffekten<br />
upphör helt.<br />
b) Kontrollera att kanylen är korrekt placerad i venen.<br />
c) Om blodflöde fortfarande inte uppstår tas röret bort och ett nytt rör sätts fast i hållaren.<br />
d) Om inte heller denna åtgärd ger resultat tas kanylen bort och kasseras. Börja om från steg 1.<br />
9. Vänd röret försiktigt 4 till 6 gånger omedelbart efter provtagningen så att tillsatsen blandas korrekt med blodet. Vänd det<br />
fyllda röret först nedåt och sedan uppåt igen. Detta motsvarar en vändning.<br />
OBS! Skaka inte röret. Alltför kraftig skakning kan orsaka skumbildning, hemolys eller aktivering av blodplättarna. Det kan även<br />
medföra felaktiga analysresultat vid användning av PRGF-ENDORET®-teknik. Om provet inte blandas tillräckligt kan detta<br />
ge oönskade resultat.<br />
10. Upprepa steg 6, 7 och 8 för de återstående rör som behövs.<br />
11. Dra ut kanylen från punktionsstället när det inte kommer ner mer blod i det sista röret. Tryck på punktionsstället med en<br />
steril tork tills blödningen avstannar. Sätt på ett sterilt plåster när blödningen har avstannat.<br />
sida 42 av 44
OBS! Efter venpunktionen kan det finnas blodrester kvar ovanpå proppen. Vidta lämpliga åtgärder vid hantering av rören för att<br />
undvika kontakt med detta blod. Varje objekt som kommer i kontakt med blodet ska betraktas som farligt avfall och bör<br />
omedelbart kasseras.<br />
12. Kasta den använda kanylen med respektive hållare i en för ändamålet avsedd avfallsburk. SÄTT INTE TILLBAKA SKYDDSHYLSAN.<br />
Om skyddshylsan sätts tillbaka på kanylen ökar risken för nålstick och blodexponering.<br />
OBS! Blodspill kan förekomma från kanylfästet. Följ generella säkerhetsföreskrifter för att reducera risken för exponering till ett<br />
minimum.<br />
2. Centrifugering<br />
Rören ska centrifugeras omedelbart efter provtagningen eller som högst efter en timme. De får under inga omständigheter kylas.<br />
<strong>BTI</strong>-EXTRAKTIONSRÖREN FÅR ENDAST CENTRIFUGERAS I EN CENTRIFUG AV MODELLEN SYSTEM IV FRÅN <strong>BTI</strong>. På så vis säkerställs<br />
att de plasmafraktioner som samlats in med PRGF-ENDORET®-tekniken blir korrekt avskilda och färdiga för användning i<br />
godkända kliniska tillämpningar.<br />
Följ den särskilda bruksanvisningen för centrifug System IV från <strong>BTI</strong>.<br />
Efter centrifugering delas blodet upp i tre fraktioner:<br />
• Plasma med hög koncentration av tillväxtfaktorer: fraktionen med plasma (gulfärgad) innehåller huvuddelen av<br />
blodplättarna, fördelade i stigande koncentrations-grad (d.v.s. antalet blodplättar är lägst i övre delen av röret och ökar<br />
nedåt).<br />
• Vita blodkroppar eller leukocyter: finns i det tunna vitaktiga skikt som hamnar ovanför de röda blodkropparna (även kallat<br />
”buffy-coat”).<br />
• Röda blodkroppar: den röda fraktion som hamnar i rörets nedre del.<br />
3. Fraktionering med hjälp av PLASMAÖVERFÖRINGSENHET (PTD)<br />
Använd graderingen på rörets etikett för att bedöma den totala plasmavolym (Vt) som erhållits efter centrifugering innan<br />
fraktioneringen påbörjas (den totala plasmavolymen varierar beroende på patientens EVF).<br />
1. Avlägsna med sterila handskar den blå proppen från de centrifugerade extraktionsrör som placerats på provrörshållaren<br />
GT16 (ref. S&N: 72203572). Var försiktig så att inte de röda blodkropparna blandas med plasman.<br />
2. Öppna den sterila plastförpackningen och ta ut <strong>BTI</strong> PLASMAÖVERFÖRINGS¬ENHETEN (PTD).<br />
3. Avlägsna kanylens skyddshylsa.<br />
4. För in PTD-enhetens främre del i ett <strong>BTI</strong>-separationsrör.<br />
5. Placera PTD-enhetens kanyl vid ytan av den plasmafraktion som ska extraheras. Håll PTD-enhetens kanylspets omedelbart<br />
under plasmafraktionens ytskikt (cirka 1–2 mm) och i kontakt med rörets innervägg.<br />
6. Tryck försiktigt på den blå påslagningsknappen för att påbörja aspireringen av fraktion 1 (F1) med plasma. För apparaten<br />
vertikalt nedåt under aspireringen så att kanylen hela tiden befinner sig vid ytan av den fraktion som ska aspireras. Aspirera<br />
långsamt för att förhindra att provet grumlas.<br />
7. Avbryt aspireringen när cirka 2 ml plasma återstår ovanför skiktet med de vita blodkropparna (”buffy-coat”).<br />
VARNING: DRA EJ UPP LUFT. Om den blå knappen trycks in när PTD-enhetens kanylspets befinner sig i luften förlorar<br />
separeringsröret sin vakuumeffekt.<br />
8. Upprepa steg 5, 6 och 7 för varje <strong>BTI</strong>-extraktionsrör (efter centrifugering) med samma PTD-enhet och separationsrör.<br />
Avlägsna därefter separationsröret och placera det i det sterila provrörsstället (ref. <strong>BTI</strong>: GTT, ref. S&N 72203573).<br />
Figur 1:<br />
Vt<br />
F1<br />
F2<br />
FRAKTION 1<br />
Vt - 2 ml<br />
FRAKTION 2<br />
2 ml<br />
Vita blodkroppar<br />
Röda blodkroppar<br />
Rör 9 ml<br />
9. Upprepa steg 4–8 för att aspirera fraktion 2 (F2) ur samtliga extraktionsrör. Aspirera den fraktion som har en konstant mängd<br />
(2 ml). Det är viktigt att inte skiktet med de vita blodkropparna (”buffy-coat”) aspireras.<br />
10. Placera samtliga patientens F1-fraktioner i samma plasmaseparationsrör.<br />
11. Placera samtliga patientens F2-fraktioner i samma plasmaseparationsrör.<br />
12. Kassera <strong>BTI</strong> PLASMAÖVERFÖRINGSENHETEN (PTD) efter användning. FÅR EJ ÅTERANVÄNDAS.<br />
4. Aktiveringsprotokoll för blodplättar<br />
VARNING! När plasman är förberedd ska den användas inom 4 timmar efter extrahering.<br />
Plasman aktiveras genom tillsättning av en exakt mängd PRGF®-aktivator.<br />
• Fraktion 2 (F2) innehåller en hög andel blodplättar och tillväxtfaktorer. Den kan användas i flytande form (aktiverad) eller<br />
som koagel.<br />
• Fraktion 1 (F1) rekommenderas för framställning av fibrin. Vid sådan framställning kan behållare för transplantat användas<br />
(ref. <strong>BTI</strong>: RPI40, RPI50 och RPI60 respektive ref. S&N: 72203583, 72203584 och 72203585).<br />
sida 43 av 44
1. Använd BD Micro-fine-sprutan för att tillsätta nödvändig mängd PRGF®-aktivator i förhållande till den mängd plasma som<br />
ska aktiveras i separationsröret. Det krävs 0,05 ml (5 enheter på BD Micro-fine-sprutans gradering) PRGF®-aktivator per<br />
milliliter plasma.<br />
Obs! Kom ihåg att BD Micro-Fine-sprutans gradering anges i enheter och inte i milliliter. För att undvika fel är denna konvertering<br />
mycket viktig.<br />
Plasmamängd (ml)<br />
Mängd PRGF®-aktivator (ml)<br />
Mängd PRGF®-aktivator (markerade<br />
enheter på BD Micro-fine-sprutan)<br />
1 0,05 5<br />
2 0,10 10<br />
4 0,20 20<br />
6 0,30 30<br />
8 0,40 40<br />
2. Kassera sprutan och resterande PRGF®-aktivator.<br />
Anmärkning: Beräkna noggrant tiden från det att aktivatorn tillsätts. Tiden varierar beroende på om plasman ska användas i flytande<br />
form (aktiverad) eller som koagel.<br />
Etikettinformation<br />
Utgångsdatum<br />
Produkten kan användas<br />
LOT<br />
Batchnummer<br />
CE-märkning<br />
fram till utgången av<br />
angiven månad.<br />
0123<br />
8<br />
Innehåller tillräckligt för 8<br />
användningar Beställningsnummer Se bruksanvisning<br />
REF<br />
Förvaringstemperatur<br />
Skyddas mot solljus<br />
0123<br />
B.T.I. <strong>Biotechnology</strong> Institute S.L.<br />
Parque Tecnológico de Álava Leonardo Da Vinci, 14<br />
01510 Miñano (Álava), Spain<br />
Tlf.: (+34) 945 29 70 30 Fax: (+34) 945 29 70 31<br />
www.bti-implant.com bti.implantes@bti-implant.es<br />
Distributed by:<br />
Smith & Nephew, Inc (Endoscopy division)<br />
150 Minuteman Road<br />
Andover,MA 01810<br />
USA<br />
sida 44 av 44<br />
MA091<br />
Ed. 3 Rev. 1<br />
30/07/12