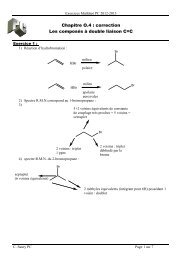
cours polymere 1
cours polymere 1
cours polymere 1
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Document de <strong>cours</strong> MathSpé PC 2011-2012<br />
Chapitre P1 :<br />
Les matières plastiques :<br />
Généralités et définitions<br />
1. Définition des macromolécules<br />
Littéralement “grosses molécules”, les macromolécules peuvent être naturelles, artificielles ou synthétiques.<br />
Naturelles : les fibres textiles, laine, coton, soie, etc...le caoutchouc naturel, obtenu à partir de la sève de<br />
l’hévéa, la cellulose, l’amidon, entre autres.<br />
Artificielles : obtenues par modification chimique d’une macromolécule naturelle pour améliorer ses<br />
propriétés ou les adapter à un usage particulier.<br />
Synthétiques : créées de toute pièce par l’industrie à partir de petites molécules.<br />
2. Description des polymères<br />
2.1) MOTIF :<br />
La macromolécule, qu’elle soit naturelle, synthétique ou artificielle, se présente comme une répétition d’un<br />
ensemble d’atomes lié à un ensemble identique un grand nombre de fois. Cet ensemble s’appelle le motif.<br />
Il renferme les atomes de la “petite molécule” qui a servi à créer le polymère artificiel. Cette petite molécule<br />
est le monomère, et la macromolécule est son polymère.<br />
On parle aussi d’oligomère et de dimère.<br />
la notion de monomère s’applique aussi aux macromolécules naturelles, dont la dégradation conduit à des<br />
petites molécules dites monomères.<br />
2.2) Exemples :<br />
Cas 1 : n A = ( motif)n en général polyaddition<br />
Cas 2 : n AA + n BB = (AB)n difonctionnel en général polycondensation<br />
H 2C CH 2<br />
ClCH CH 2<br />
H3C<br />
H2C<br />
C<br />
H2C C<br />
C<br />
monomère polymère<br />
éthylène ( H2C CH2 )<br />
n<br />
CH CH2<br />
O<br />
C<br />
CH2<br />
H<br />
CH 3<br />
OCH3<br />
phényléthylène, ou<br />
vinylbenzène ou<br />
styrène<br />
chloroéthylène ou<br />
chlorure de vinyle<br />
isoprène<br />
méthacrylate de<br />
méthyle<br />
( CH CH2 )<br />
n<br />
( CH CH2 )<br />
n<br />
polyéthylène<br />
polystyrène<br />
C. Saury Page 1 sur 6<br />
Cl<br />
H3C<br />
C<br />
( H2C<br />
C<br />
O<br />
C<br />
CH2<br />
H<br />
( H2C C )<br />
n<br />
CH 3<br />
) n<br />
OCH 3<br />
polychlorure de<br />
vinyle<br />
polyisoprène<br />
polyméthacrylate de<br />
méthyle (PMMA,<br />
plexiglas)
Document de <strong>cours</strong> MathSpé PC 2011-2012<br />
3.Masse molaire et degré de polymérisation<br />
C. Saury Page 2 sur 6
Document de <strong>cours</strong> MathSpé PC 2011-2012<br />
Que la substance macromoléculaire soit élaborée naturellement ou industriellement, il est impossible de définir<br />
sa masse molaire au sens habituel du terme. En effet, elle est constituée d’un mélange de molécules de<br />
masses molaires élevées, mais différentes entre elles.<br />
3.1) Le degré de polymérisation d’une chaîne est le nombre moyen de molécules de monomère inclus<br />
dans cette chaîne. On ne peut définir qu’un DP moyen pour une matière plastique donnée.<br />
Il existe des grandeurs qui chiffrent la dispersion des chaînes dans une même « matière plastique »<br />
C’est le nombre d’unités monomères /nombre de chaines<br />
Ni. i<br />
DP = Ni nombre de macromolécules inclus i monomères<br />
Ni<br />
Si motif issu d’un seul monomère : DP=n nombre de motif exemple PVC<br />
Si le motif est issu de deux monomères différents : DP = 2n si la stoechiométrie est respectée<br />
Exemple nylon 6,6<br />
3.2) Masse molaire moyenne<br />
On ne peut donc définir qu’une masse molaire moyenne, qui donne une idée de la grosseur des molécules,<br />
mais ne reflète pas la dispersion des vraies masses molaires autour de cette valeur.<br />
On définit la masse molaire moyenne en nombre :<br />
Ni. i.<br />
M 0<br />
Mn = M0 masse molaire du motif et i le nombre de monomères inclus Mn = DP. M0 pour un<br />
Ni<br />
polymère a un monomère (si plusieurs monomères on pondère pour avoir une masse molaire fictive)<br />
Déterminé par pression osmotique<br />
On définit la masse molaire moyenne en masse :<br />
Ni . Mi ²<br />
Mw =<br />
NiMi<br />
Déterminé par diffraction de la lumière<br />
C. Saury Page 3 sur 6
Document de <strong>cours</strong> MathSpé PC 2011-2012<br />
3.3)Indice de polymolécularité<br />
On définit aussi l’indice de polymolécularité qui traduit la dispersion par rapport a une valeur moyenne.<br />
IP = Mw/Mn<br />
Mesure par chromato d’exclusion stérique<br />
4. Structure covalente de la chaîne macromoléculaire<br />
4.1) chaîne linéaire<br />
homopolymère : tous les monomères associés sont identiques, donc tous les motifs sont identiques.<br />
Ex : polystyrène, polyéthylène.<br />
copolymère: les motifs sont différents, ils résultent de l’association de deux monomères différents.<br />
Ils peuvent être statistiques, séquencés ou alternés.<br />
Exemple : les copolymères du styrène PhCH=CH2 et de l’acrylonitrile H 2C CH C N<br />
sont constitués de motifs -PhCH-CH2- (notés -A-)<br />
et de motifs notés -B-<br />
H2C CH<br />
CN<br />
copolymère statistique : -A-A-A-B-A-B-B-A-A-B-B-B-A-B-A-B-B-............<br />
copolymère alterné : -A-B-A-B-A-B-A-B-A-B-A-B-A-B-A-B-.................<br />
copolymère séquencé : -A-A-A-A-B-B-B-B-A-A-A-A-B-B-B-B-A-A-A-A-............<br />
C. Saury Page 4 sur 6
4.2) chaîne ramifiée<br />
Document de <strong>cours</strong> MathSpé PC 2011-2012<br />
homopolymère: la ramification résulte d’un “accident” au <strong>cours</strong> de la réaction de polymérisation.<br />
copolymère : cas des polymères greffés<br />
4.3) structure réticulée<br />
ex : polyéthylène "basse densité"<br />
H2C CH2 ( CH2 CH ) (CH2<br />
n<br />
CH2)<br />
m<br />
(CH2 CH2)p<br />
A A A A A A A A A A A A A A<br />
B<br />
B<br />
B<br />
Il s’agit de liaisons supplémentaires (réticulations) entre chaînes linéaires ou ramifiées déjà formées.<br />
On définit le degré de réticulation comme le nombre moyen de motif entre deux points de réticulation<br />
la formation de résines glycérophtaliques,<br />
On peut l’illustrer avec la vulcanisation du caoutchouc<br />
C. Saury Page 5 sur 6<br />
B<br />
B<br />
B
Document de <strong>cours</strong> MathSpé PC 2011-2012<br />
5. Régiosélectivité et stéréochimie de l’enchaînement dans les polymères<br />
vinyliques.<br />
5.1) Régiosélectivité : tête à tête et tête à queue pour les polymères vinyliques<br />
Pour un polymère vinylique .....H2C-CHR-CH2-CHR-CH2-CHR....le motif H2C-CHR est non symétrique. On<br />
peut définir une tête CHR et une queue CH2 .Une liaison entre monomères peut donc se faire :<br />
tête à queue : -CH2-CHRCH2-CHR- (1)<br />
tête à tête : -CH2-CHRCHR-CH2- (2)<br />
Pour des raisons stériques, la forme (1) est favorisée, d’autant plus que R est volumineux .<br />
5.2) Stéréochimie des chaînes dans les polymères vinyliques: tacticité<br />
Dans la chaîne formée à partir du monomère A-CH=CH , que l’on peut noter :<br />
2<br />
-(ACH-CH ) -, on voit que les atomes de carbone qui portent les groupes A sont asymétriques. Il existe donc un<br />
2 n<br />
grand nombre de stéréoisomères pour la chaîne, de l’ordre de 2 n<br />
théoriquement. En fait, on classe en trois<br />
catégories les polymères obtenus :<br />
isotactique<br />
A A A A A A A A<br />
syndiotactique<br />
n ( ) n caoutchouc naturel<br />
réticulation :<br />
plusieurs<br />
(<br />
linéaire<br />
A A A A A A A A<br />
) n<br />
(<br />
+ 2 S<br />
atactique : répartition au hasard<br />
5.3) Importance sur les propriétés<br />
Pour un même monomère, la régiosélectivité et la stéréochimie de l’enchaînement ont une grande<br />
importance dans les propriétés physiques du polymère obtenu. Le mode de polymérisation ( radicalaire,<br />
anionique, cationique...) influence la tacticité du polymère, donc ses propriétés physiques.<br />
Exemple : le polystyrène isotactique fond à 250°C et est insoluble dans les solvants classiques, alors que<br />
l’atactique se ramollit dès 100°C et se dissout dans de nombreux solvants.<br />
C. Saury Page 6 sur 6<br />
) n<br />
.......<br />
caoutchouc artificiel<br />
S<br />
S<br />
.......<br />
....... .......<br />
vers d'autres chaînes :<br />
polymère tridimensionnel