(Zn/HgO).
(Zn/HgO).
(Zn/HgO).
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
25/11/2009<br />
ELECTROCHIMIE ET<br />
SES APPLICATIONS<br />
PILES AU ZINC<br />
M. OLIVIER<br />
marjorie.olivier@fpms.ac.be
La pile Leclanché - 1866.<br />
A la cathode:<br />
Graphite inerte<br />
MnO 2: oxydant de la réaction<br />
électrochimique non conducteur.<br />
2<br />
Pile Leclanché.<br />
Mélange à du graphite et du noir<br />
d’acétylène le tout finement broyé<br />
+ agent gélifiant.<br />
Parfaite cohésion et passage des e - .<br />
Collecteur d’e - sous forme de bâton<br />
de graphite.<br />
Couple Mn IV /Mn III
A l’anode:<br />
Zinc – constitue le boîtier.<br />
Composé métallique dans<br />
l’électrolyte: le chlorure de zinc.<br />
Couple <strong>Zn</strong> 2+ /<strong>Zn</strong><br />
Electrolyte gélifié (gel à base<br />
d’amidon de faible résistance<br />
interne).<br />
pH proche de 4<br />
f.e.m = 1,5 V<br />
3<br />
Pile Leclanché.
Masse active anodique - Zinc:<br />
4<br />
Pile Leclanché.<br />
Différents additifs:<br />
- Augmentation des propriétés mécaniques ;<br />
- Déplacement du potentiel de dégagement de H 2 (réduire la<br />
corrosion);<br />
- Additifs : Cd, Hg, Pb (0,01 à 0,06% en masse)<br />
- Suppression de Hg (toxique): utilisation d’un zinc plus pur<br />
(sans impureté métallique).
5<br />
Pile Leclanché.<br />
Milieu électrolytique:<br />
- Solution concentrée (60 à 80% en masse d’eau pour<br />
40% à 20% en masse de sel) de NH 4Cl pouvant<br />
comporter <strong>Zn</strong>Cl 2.<br />
- Sel dissocié dans l’eau en NH 4 + et Cl - (milieu conducteur<br />
ionique).<br />
- Risque: permet les échanges ioniques se produisant lors<br />
des phénomènes de corrosion à l’électrode négative<br />
(autodécharge) ou de certaines parties inactives de la<br />
pile (collecteurs, connexions internes et boîtier par<br />
exemple).<br />
- Solution de <strong>Zn</strong>Cl 2 : meilleures caractéristiques de<br />
décharge en régime continu.<br />
- Inhibiteurs de corrosion en faible quantité.
Milieu électrolytique:<br />
6<br />
Pile Leclanché.<br />
- Consommation de sel lors de la décharge: formation d’un sel<br />
dérivé du chlorure de zinc à l’anode.<br />
- A la cathode, les protons libérés par les cations ammonium<br />
sont fixés par les O 2- de la structure MnO 2.<br />
- Formation de MnOOH, dans lequel le métal de transition est à<br />
un niveau d’oxydation plus faible (III au lieu de IV).<br />
- Diffusion des protons dans la structure du MnO 2pour accéder<br />
aux sites réactifs: importance de la granulométrie de la<br />
poudre de MnO 2 pour obtenir la capacité la plus grande.
Réactions globales de décharge.<br />
Electrolyte à base de NH 4Cl<br />
En décharge lente :<br />
<strong>Zn</strong><br />
En décharge rapide :<br />
<strong>Zn</strong><br />
Et en prolongeant la décharge :<br />
7<br />
Pile Leclanché.<br />
2 MnO 2 NH Cl 2 MnOOH <strong>Zn</strong>Cl . 2 NH<br />
2<br />
2<br />
4<br />
4<br />
2 MnO NH Cl H O 2 MnOOH <strong>Zn</strong> ( OH ) Cl NH<br />
2<br />
<strong>Zn</strong> 6<br />
MnOOH 2 Mn O <strong>Zn</strong>O 3 H O<br />
3 4<br />
2<br />
2<br />
3<br />
3
Réactions globales de décharge.<br />
Electrolyte à base de <strong>Zn</strong>Cl 2<br />
En décharge lente ou rapide :<br />
Et en prolongeant la décharge :<br />
8<br />
Pile Leclanché.<br />
<strong>Zn</strong> MnO 2 H O <strong>Zn</strong>Cl 2 MnOOH 2 <strong>Zn</strong> ( OH ) Cl<br />
2 2<br />
2<br />
2<br />
<strong>Zn</strong> 6<br />
MnOOH <strong>Zn</strong> ( OH ) Cl 2 Mn O <strong>Zn</strong>Cl , 2 <strong>Zn</strong>O , 4 H O<br />
3 4<br />
2<br />
2
Capacité pratique.<br />
9<br />
Pile Leclanché.<br />
L’ordre de 85 A.h/kg aux faibles régimes<br />
Jusqu’à des valeurs d’environ 35 A.h/kg pour des régimes élevés.
10<br />
Pile Leclanché.
11<br />
Pile Leclanché.
En pratique,<br />
Energie massique : 70 Wh/kg<br />
Energie volumique: 110 Wh/dm 3<br />
12<br />
Pile Leclanché.<br />
Masse volumique moyenne: 1,6 g/cm3.<br />
Rendement très dépendant du régime de décharge :<br />
A régimes très faibles, la capacité restituée est très supérieure à<br />
celle obtenue à des régimes de décharge élevés (rapport jusqu’à<br />
10).
Applications et formats<br />
13<br />
Pile Leclanché.<br />
Peu de puissance ou un fonctionnement intermittent.<br />
Exemples:<br />
lampes de poche, postes de radio à transistors,<br />
télécommandes, certains jouets, pendules, caméras super 8,<br />
appareils photographiques, flashes électroniques, allume-gaz,<br />
certaines calculatrices, télécommandes diverses, etc…<br />
Les formats fabriqués en très grande quantité sont les formats<br />
cylindriques.
La pile alcaline.<br />
14<br />
Pile alcaline.<br />
Différences par rapport à la pile Leclanché:<br />
A l’anode<br />
• Anode toujours en zinc mais ne constitue plus le boîtier. Poudre<br />
pour augmenter la surface réactionnelle.<br />
• Collecteur d’e - n’est plus le zinc mais un clou en acier central.<br />
Couple <strong>Zn</strong>(OH) 4 2- /<strong>Zn</strong><br />
A la cathode<br />
• L’oxydant toujours MnO 2 comprimé avec du graphite.<br />
• Collecteur d’e - : boîtier en acier. On peut loger 2,5 X plus de<br />
MnO 2. La pile alcaline dure plus longtemps.<br />
Couple MnO 2/MnO(OH)
La pile alcaline.<br />
15<br />
Pile alcaline.<br />
Différences par rapport à la pile Leclanché:<br />
L’électrolyte<br />
• Potasse (KOH) en solution concentrée.<br />
F.e.m: sensiblement la même dans les deux cas<br />
• Pour éviter les fuites et les déformations: second boîtier en<br />
acier nickelé.<br />
• Les cellules peuvent être plates.<br />
• la gamme de température : – 20°C à +70°C.<br />
• Zinc de haute pureté (99,9%)
16<br />
Pile alcaline.
La pile alcaline.<br />
17<br />
Pile alcaline.<br />
<strong>Zn</strong>/KOH(30% à 50%)+<strong>Zn</strong>O/MnO 2)<br />
Réaction globale:<br />
<strong>Zn</strong><br />
20<br />
9<br />
MnO<br />
2<br />
0 , 9<br />
:<br />
MnOOH<br />
0 , 1<br />
: 0,<br />
15<br />
H<br />
2<br />
O<br />
2<br />
3<br />
H<br />
2<br />
O<br />
20<br />
9<br />
MnOOH<br />
<strong>Zn</strong>O
18<br />
Pile alcaline.
En pratique,<br />
19<br />
Pile alcaline.<br />
Energie massique : 100 Wh/kg (même ordre de grandeur que les<br />
piles Leclanché)<br />
Energie volumique: 250 Wh/dm 3<br />
Masse volumique moyenne: 2,5 g/cm 3 .<br />
Rendement très supérieur à celui des piles salines à régimes de<br />
décharge élevés ou dans des conditions d’utilisation plus sévères.<br />
Dans ces conditions, énergie massique pratique des piles<br />
supérieure à celle des piles salines.
Applications et formats<br />
20<br />
Pile Alcaline.<br />
- Applications nécessitant de la puissance.<br />
- Exemples:<br />
Appareils mettant en œuvre des petits moteurs<br />
électriques : rasoirs, magnétophones portables, appareil<br />
photo, jouets, tournebroche.<br />
Les formats fabriqués en très grande quantité sont les<br />
formats cylindriques.
21<br />
Pile (<strong>Zn</strong>/Ag 2O).<br />
Autre oxydant que le dioxyde de manganèse (miniaturisation).<br />
• Fortes énergies massiques et courants de décharge importants.<br />
• Fonctionnement aux basses températures (-20°C).<br />
• Fabriquées en faible quantité du fait de leur prix.<br />
• Marchés habituels conquis par les piles au Li-MnO 2.
22<br />
Pile (<strong>Zn</strong>/Ag 2O).<br />
Autre oxydant que le dioxyde de manganèse (miniaturisation).<br />
• Compartiment cathodique: oxyde d’argent mêlé à de la poudre de<br />
graphite imprégné de potasse.<br />
• Compartiment anodique: zinc en poudre amalgamé et humecté<br />
de potasse.<br />
• Electrolyte: potasse ou soude en solution (50%).<br />
• Electrodes: deux moitiés de boîtier en acier nickelé (joint en<br />
nylon)<br />
• La matière active anodique (pôle négatif) : zinc amalgamé ou de<br />
poudre de zinc gélifiée.<br />
• Coût: facteur 100 avec le dioxyde de manganèse.
La pile bouton.<br />
23<br />
Piles bouton.
Constituants.<br />
24<br />
Pile (<strong>Zn</strong>/Ag 2O).<br />
• Masse cathodique: Ag 2O + graphite (moins de 10%) pour<br />
assurer une conductivité électronique.<br />
• Lors de la décharge: Ag se forme et la conductivité devient très<br />
bonne.<br />
• Matière active anodique: poudre de zinc, amalgamé ou non, de<br />
haute surface spécifique et gélifiée par des agents comme la<br />
CMC (carboxyméthylcellulose) ou d’autres liants de type<br />
polymère.<br />
• Milieu électrolytique : une solution concentrée de potasse ou de<br />
soude. Afin d’éviter la génération d’hydrogène, de l’oxyde de zinc<br />
est ajouté à des teneurs de moins de 10% en masse.<br />
• Les ions OH- formés à la cathode sont transportés vers l’anode<br />
lors de cette décharge.<br />
• Séparateur: matériaux polymères (Ex: dérivés cellulosiques),
Réactions globales de décharge.<br />
A l’anode:<br />
25<br />
Pile (<strong>Zn</strong>/Ag 2O)<br />
<strong>Zn</strong> Ag O <strong>Zn</strong>O 2<br />
<strong>Zn</strong><br />
Globalement à l’anode:<br />
2<br />
2<br />
2<br />
2<br />
<strong>Zn</strong> <strong>Zn</strong> 2<br />
e<br />
4 OH <strong>Zn</strong> ( OH<br />
Ag<br />
<strong>Zn</strong> (<br />
OH ) <strong>Zn</strong>O 2 OH H O<br />
4<br />
2<br />
<strong>Zn</strong> 4 OH <strong>Zn</strong> ( OH ) 2<br />
2<br />
4<br />
)<br />
2<br />
4<br />
e
Réactions globales de décharge.<br />
A la cathode:<br />
Réaction globale de décharge:<br />
26<br />
Ag<br />
Pile (<strong>Zn</strong>/Ag 2O)<br />
Ag O H O 2 e 2 Ag 2 OH<br />
2<br />
2<br />
O<br />
H<br />
2<br />
2<br />
O<br />
<strong>Zn</strong><br />
2 Ag <strong>Zn</strong> ( OH<br />
Consommation d’eau à la cathode pour former des ions OH -<br />
Consommation des ions OH - à l’anode pour former à<br />
nouveau l’eau consommée à la cathode.<br />
)<br />
2
27<br />
Pile (<strong>Zn</strong>/Ag 2O)
28<br />
Pile (<strong>Zn</strong>/Ag 2O)
En pratique,<br />
Energie massique : 100 Wh/kg<br />
Energie volumique: 395 Wh/dm 3<br />
29<br />
Pile (<strong>Zn</strong>/Ag 2O)<br />
Masse volumique moyenne: 3,95 g/cm 3 .<br />
Très bonne stabilité de la tension en circuit ouvert, en fonction de<br />
la durée de stockage et de la température.<br />
Autodécharge assez faible.<br />
Entre +20°C et 45°C, la perte de capacité en stockage est d’1%<br />
environ par mois pendant 24 mois.
Applications et formats<br />
Régimes de décharge élevés.<br />
30<br />
Pile (<strong>Zn</strong>/Ag 2O)<br />
Les applications actuelles : petites lampes de poche,<br />
désignateurs lasers de poche, cellule d’appareils<br />
photographiques, calculatrices, montres, instrumentation.<br />
Applications militaires spécifiques : la propulsion des torpilles<br />
électriques, l’alimentation des intensificateurs de lumière, les<br />
bouées actives, les systèmes de secours, les systèmes de<br />
surveillance, certains capteurs de sécurité, etc.
31<br />
Pile (<strong>Zn</strong>/<strong>HgO</strong>).<br />
Autre oxydant que le dioxyde de manganèse (miniaturisation).<br />
• Stabilité de la tension et très faible autodécharge (le stockage<br />
dans les conditions tropicales est possible).<br />
• Plus vendues maintenant car Hg ainsi que ses composés sont très<br />
toxiques.<br />
• La matière active cathodique (pôle positif) : mélange d’oxyde de<br />
mercure très peu conducteur et de graphite compacté pour<br />
former l’électrode.<br />
• Le milieu électrolytique : gel alcalin de potasse ou de soude.<br />
• La matière active anodique (pôle négatif) : zinc amalgamé ou de<br />
poudre de zinc.
Réactions globales de décharge.<br />
A l’anode:<br />
32<br />
Pile (<strong>Zn</strong>/<strong>HgO</strong>)<br />
<strong>Zn</strong><br />
<strong>Zn</strong><br />
Globalement à l’anode:<br />
2<br />
<strong>HgO</strong><br />
<strong>Zn</strong>O<br />
2<br />
<strong>Zn</strong> <strong>Zn</strong> 2<br />
2<br />
e<br />
Hg<br />
4 OH <strong>Zn</strong> ( OH<br />
<strong>Zn</strong> (<br />
OH ) <strong>Zn</strong>O 2 OH H O<br />
4<br />
2<br />
<strong>Zn</strong> 4 OH <strong>Zn</strong> ( OH ) 2<br />
)<br />
2<br />
4<br />
2<br />
4<br />
e
Réactions globales de décharge.<br />
A la cathode:<br />
33<br />
Pile (<strong>Zn</strong>/<strong>HgO</strong>)<br />
<strong>HgO</strong> H O 2 e Hg 2<br />
2<br />
OH<br />
Consommation d’eau à la cathode pour former des ions OH -<br />
Consommation des ions OH - à l’anode pour former à<br />
nouveau l’eau consommée à la cathode.
34<br />
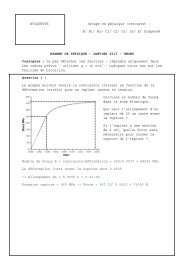
Pile (<strong>Zn</strong>/<strong>HgO</strong>)
35<br />
Pile (<strong>Zn</strong>/<strong>HgO</strong>)
En pratique,<br />
Energie massique : 90 Wh/kg<br />
Energie volumique: 355 Wh/dm 3<br />
36<br />
Pile (<strong>Zn</strong>/<strong>HgO</strong>)<br />
Masse volumique moyenne: 3,95 g/cm 3 .<br />
Très bonne stabilité de la tension en circuit ouvert, en fonction de<br />
la durée de stockage et de la température.<br />
Autodécharge assez faible.
Applications et formats<br />
37<br />
Pile (<strong>Zn</strong>/<strong>HgO</strong>)<br />
Conditions d’utilisation ou de stockage tropicales<br />
Energie volumique élevée.<br />
Les applications actuelles : aides auditives, cellules d’appareil<br />
photo, calculatrices, montres, détecteurs de fumée, parfois des<br />
piles étalons, instrumentation, détonateur, etc.<br />
Les applications militaires: bouées actives, les systèmes de<br />
secours, les systèmes de surveillance, certains capteurs de<br />
sécurité, etc.<br />
Formats bouton et cylindriques type R6, R20 et R50.
38<br />
Pile zinc/air.<br />
• Composé réactif cathodique (O 2) = air environnant (libération<br />
de la place et de la masse).<br />
• Possibilité d’une grande quantité de composé anodique<br />
(aboutir à des énergies massiques élevées) pour des régimes<br />
de décharge faibles (ex : décharge en un temps supérieur à<br />
10h).<br />
• Cathode non consommable adaptée à la réduction de O 2<br />
(Surface d’autant plus grande que l’on cherchera à débiter des<br />
courants importants).<br />
• Densités d’énergie très élevées = 150 à 350 Wh/kg (avant<br />
décharge).<br />
• Décharge de ces piles = fixation de l’O 2 de l’air et stockage<br />
des produits de réaction qui alourdissent la pile de façon<br />
significative lors de cette décharge (prévoir l’augmentation de<br />
volume des matières actives).
39<br />
Pile zinc/air.<br />
Capacités: quelques mA.h (bouton) à plus d’un millier A.h<br />
(prismatique).<br />
La matière active cathodique (pôle positif) : l’oxygène de<br />
l’air environnant (sans stockage): ouverture pour l’accès de O 2<br />
à l’électrode afin de permettre sa réduction.<br />
Le milieu électrolytique : solution alcaline de potasse<br />
concentrée et pas consommée par la réaction de décharge de<br />
la pile.<br />
La matière active anodique (pôle négatif) est composée de<br />
zinc sous forme soit métallique, soit de poudre de zinc gélifiée.
40<br />
Pile zinc/air.
Constituants.<br />
41<br />
Pile <strong>Zn</strong>/Air.<br />
• La masse cathodique = une structure poreuse de carbone<br />
(contenant éventuellement un catalyseur de réduction de O 2) +<br />
un polymère hydrophobe.<br />
• Interface dite à « triple contact » = réaction de réduction de<br />
l’O 2 au contact de la structure poreuse conductrice électronique<br />
(apport d’électrons) et évacuation des espèces ioniques<br />
formées vers l’électrolyte.<br />
• Arrivée en O 2 en quantité suffisante et rapidement pour des<br />
régimes de décharge élevés .<br />
• Le rôle du composé hydrophobe: assurer la stabilité des films<br />
d’électrolyte aqueux formés dans le milieu poreux carboné ; ces<br />
films sont responsables du bon fonctionnement de l’électrode à<br />
air.
Constituants.<br />
42<br />
Pile <strong>Zn</strong>/Air.<br />
• Structure à grande surface développée.<br />
• La stabilité de ces films d’épaisseur micrométrique.
Constituants.<br />
43<br />
Pile <strong>Zn</strong>/Air.<br />
• La matière active anodique = poudre de zinc, amalgamé ou<br />
non, de haute surface spécifique et gélifiée.<br />
• Le milieu électrolytique = solution concentrée KOH ou NaOH<br />
(30 à 45% en masse).<br />
• Flux de OH - formés à la cathode vers l’anode lors de la<br />
décharge.<br />
• Accès de l’air environnant à l’intérieur de la pile, risque de<br />
formation de carbonate de potassium qui dégrade les<br />
propriétés et le fonctionnement de la pile = dispositif de<br />
décarbonatation.<br />
• Dans le cas de piles utilisées à régime élevé (décharge en un<br />
temps court), la carbonatation de l’électrolyte n’a pas le<br />
temps d’avoir lieu.<br />
• Opercule de protection avant utilisation.<br />
• Le séparateur est identique aux précédents.
Réactions globales de décharge.<br />
A l’anode:<br />
Globalement à l’anode:<br />
44<br />
<strong>Zn</strong><br />
Pile <strong>Zn</strong>/Air.<br />
H<br />
2<br />
<strong>Zn</strong><br />
2<br />
O<br />
1<br />
2<br />
1<br />
2<br />
O<br />
O<br />
2<br />
2<br />
<strong>Zn</strong> ( OH<br />
<strong>Zn</strong>O<br />
<strong>Zn</strong> 4 OH <strong>Zn</strong> ( OH ) 2 e<br />
<strong>Zn</strong> ( OH ) <strong>Zn</strong>O 2 OH H O<br />
4<br />
2<br />
<strong>Zn</strong> OH <strong>Zn</strong>O H O 2<br />
2 2<br />
2<br />
4<br />
)<br />
2<br />
e
Réactions globales de décharge.<br />
A la cathode:<br />
45<br />
Pile <strong>Zn</strong>/Air.<br />
O H O 4 e 4<br />
2<br />
2 2<br />
OH<br />
Consommation d’eau à la cathode pour former des ions OH -<br />
Consommation des ions OH - à l’anode pour former à<br />
nouveau l’eau consommée à la cathode.
46<br />
Pile <strong>Zn</strong>/Air
47<br />
Pile <strong>Zn</strong>/Air.
En pratique,<br />
Energie massique : 230 Wh/kg<br />
Energie volumique: 400 Wh/dm 3<br />
48<br />
Pile <strong>Zn</strong>/Air.<br />
Masse volumique moyenne: 1,74 g/cm 3 .
Applications et formats<br />
49<br />
Pile <strong>Zn</strong>/Air.<br />
Longues durées de décharge (régimes plutôt faibles) et coûts<br />
d’usage les plus bas.<br />
Les applications actuelles : signalisation des chemins de fer et les<br />
clôtures électriques pour le bétail, l’alimentation des aides<br />
auditives, des petits systèmes électroniques portables comme les<br />
calculatrices et les montres.<br />
Formats bouton et prismatiques.
La pile bouton à anode de zinc.<br />
50<br />
Piles bouton.<br />
Pile Réaction cathodique<br />
<strong>Zn</strong> – Ag 2O Ag 2O + H 2O + 2e - 2 Ag + 2 OH<br />
<strong>Zn</strong> - <strong>HgO</strong> <strong>HgO</strong> + H 2O + 2e - Hg + 2 OH<br />
<strong>Zn</strong> - O 2 ½ O 2 + H 2O + 2e- 2 OH<br />
Réaction anodique commune: <strong>Zn</strong> + 4 OH - → <strong>Zn</strong>(OH) 4 2- + 2 e -
La pile bouton à anode de zinc.<br />
Matière<br />
cathodique<br />
active<br />
51<br />
fem<br />
(V)<br />
Piles bouton.<br />
Capacité<br />
pratique<br />
(Ah)<br />
MnO 2 1,5 0,1<br />
(5mA x 20h)<br />
Ag 2 O 1,6 0,130<br />
(6,5 mA x 20h)<br />
<strong>HgO</strong> 1,4 0,24<br />
(12 mA x 20h)<br />
O 2 1,4 0,5<br />
(25 mA x 20h)<br />
Energie<br />
(Wh)<br />
Energie<br />
volumique<br />
(Wh/cm 3 )<br />
Energie<br />
massique<br />
(Wh/kg)<br />
Poids<br />
(g)<br />
0,15 0,26 83,3 1,8<br />
0,2 0,35 100 2<br />
0,34 0,6 136 2,5<br />
0,56 0,98 295 1,9<br />
Piles boutons de 11,6 mm de ,<br />
de 5,4 mm de hauteur (0,57 cm 3 en volume).