MICROBIOLOGIE ET COQUILLAGES - ifremer
MICROBIOLOGIE ET COQUILLAGES - ifremer
MICROBIOLOGIE ET COQUILLAGES - ifremer
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
1<br />
Direction des Opérations<br />
Laboratoire Environnement Ressources-Concarneau<br />
Patrick Monfort<br />
<strong>MICROBIOLOGIE</strong> <strong>ET</strong> <strong>COQUILLAGES</strong><br />
1 – Les Toxi-Infections alimentaires<br />
Les coquillages, consommés crus ou peu cuits, peuvent être à l’origine de toxiinfections<br />
alimentaires (TIA), comme l’ensemble des denrées alimentaires dont les<br />
symptômes sont le plus souvent de nature digestive. Quand deux cas groupés<br />
apparaissent, on parle alors de Toxi-Infections Alimentaires Collectives (TIACs).<br />
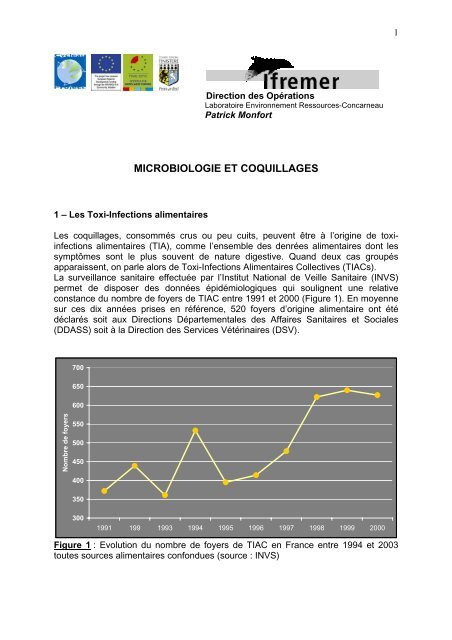
La surveillance sanitaire effectuée par l’Institut National de Veille Sanitaire (INVS)<br />
permet de disposer des données épidémiologiques qui soulignent une relative<br />
constance du nombre de foyers de TIAC entre 1991 et 2000 (Figure 1). En moyenne<br />
sur ces dix années prises en référence, 520 foyers d’origine alimentaire ont été<br />
déclarés soit aux Directions Départementales des Affaires Sanitaires et Sociales<br />
(DDASS) soit à la Direction des Services Vétérinaires (DSV).<br />
700<br />
650<br />
600<br />
Nombre de foyers<br />
550<br />
500<br />
450<br />
400<br />
350<br />
300<br />
1991 199 1993 1994 1995 1996 1997 1998 1999 2000<br />
Figure 1 : Evolution du nombre de foyers de TIAC en France entre 1994 et 2003<br />
toutes sources alimentaires confondues (source : INVS)
2<br />
Parmi ces 520 foyers de Toxi-Infections Alimentaires Collectives, 51(9.8 %) ont<br />
concerné les produits marins dont 13 (2.5%) mettaient en cause les coquillages.<br />
Sur la période 1995 – 2001, les données acquises par l’INVS montrent que les<br />
bactéries et virus sont les agents le plus souvent impliqués dans les TIACs<br />
engendrées par la consommation de coquillages (figure 2).<br />
Ces statistiques ne doivent cependant pas faire oublier que bon nombre de TIA<br />
familiales non déclarées, voire non diagnostiquées, échappent à ces recensements.<br />
Ainsi, les experts estiment que ces statistiques officielles ne représentent que 1% à<br />
10% des cas réels de salmonelloses (Mossel 1989, Desenclos 1996).<br />
Figure 2 : Importance respective des agents pathogènes dans les TIACs liées aux<br />
coquillages entre 1995 et 2001(source : INVS).<br />
Par ailleurs, certains travaux se sont intéressés à l’incidence économique, financière<br />
et sociale de ces épisodes infectieux. Ainsi, Archer et Kvenberg (1985) déterminent<br />
les coûts induits annuellement par les salmonelloses aux USA entre 1.9 et 2.3<br />
milliards de dollars. Roberts (1988) quant à lui évalue le coût des toxi-infections<br />
bactériennes aux USA à 4.8 milliards de dollars pour l’année 1987. Ces constats<br />
devraient tout naturellement conduire à privilégier les actions de prévention tant<br />
chez les professionnels de l’alimentation que chez les consommateurs.<br />
2 – Germes pathogènes et coquillages<br />
Les microorganismes pathogènes (samonelles, listeria, vibrios, virus de l’hépatite A,<br />
entérovirus,…) dans l’environnement sont le plus souvent des germes allochtones au<br />
milieu marin dont l’origine est à rechercher dans l’intestin de l’homme et des animaux<br />
à sang chaud. On parle alors de bactéries entériques. Toutefois, la recherche de ces
3<br />
microorganismes pathogènes, présents en faible quantité, est coûteuse et les<br />
techniques d’identification complexes. Aussi, pour évaluer le risque de contamination<br />
d’origine fécale, les hygiénistes ont retenu au sein du groupe des coliformes, une<br />
espèce, Escherichia coli, comme indicateur de contamination fécale en raison de leur<br />
spécificité fécale, de la résistance comparable d’E.coli et des pathogènes entériques<br />
dans le milieu extérieur et de la sensibilité des méthodes analytiques. La validité des<br />
Escherichia coli pour estimer la présence de bactéries pathogènes dans les eaux et<br />
les coquillages a donné lieu à de nombreuses contreverses (Thomas et Jones 1971,<br />
Andrews et al. 1975, Marjori et al. 1977, Fraiser et Koburger 1984). Une synthèse<br />
des données finistériennes sur l’occurrence des salmonelles dans les coquillages<br />
(Monfort et al 1997) a permis de mettre en évidence une relation hautement<br />
significative (p10000<br />
6.4<br />
Classes<br />
1<br />
2<br />
3<br />
4<br />
5.98<br />
17.2<br />
11.98<br />
non Fouisseurs<br />
Fouisseurs<br />
0.92<br />
1 2 3 4<br />
Classes d''Escherichia coli<br />
Figure 3 : Pourcentage d’isolements de salmonelles dans les coquillages du<br />
Finistère par classe d’E.coli (source : IFREMER Concarneau).<br />
33.6<br />
Ces germes font l’objet d’une dissémination dans l’environnement , induite par les<br />
rejets des effluents urbains (station d’épuration, poste de relèvement, assainissement<br />
autonome) et industriels ou encore par l’épandage des effluents d’élevages agricoles<br />
utilisés à des fins fertilisatrices (figure 4).<br />
S’il paraît vain de vouloir éradiquer ces germes pathogènes de notre environnement<br />
et des salmonelles en particulier en raison de la complexité du cycle de<br />
contamination (figure 5), du moins pouvons nous tenter de limiter les effets délétères<br />
des toxi-infections alimentaires en mettant en place les mesures préventives à tous<br />
les niveaux (réduire les pressions anthropiques sur le bassin versant, assurer une<br />
purification efficace des coquillages, contrôler la qualité sanitaire des produits finis,
4<br />
conserver les coquillages dans des conditions optimales du producteur au<br />
consommateur, prendre les mesures d’hygiène appropriées,…).<br />
Figure 4 : 0rigines des sources potentielles de contamination fécale des eaux et des<br />
coquillages (source : http://www.<strong>ifremer</strong>.fr/envlit/).<br />
Figure 5 : Cycle potentiel de transmission des salmonelles.
5<br />
3 – Origines de la contamination microbiologique des eaux<br />
3.1 – Origine urbaine<br />
3.1.1 – Assainissement collectif<br />
Avec le développement de l’urbanisation et de l’industrialisation, les rejets d’eaux<br />
usées ont considérablement évolués tant sur le plan qualitatif que quantitatif. Pour ne<br />
pas hypothéquer les usages de l’eau en aval de ces rejets, des réglementations<br />
européennes (Directive Eaux Résiduaires Urbaines – 21/05/1991) et nationales (Loi<br />
sur l’eau – 3/01/1992, décret – 03/06/1994, Arrêtés – 06/05/1996 et 21/06/1996) ont<br />
été édictées. Elles fixent les obligations des communes et des particuliers et définit le<br />
rôle de l’Etat.<br />
Ces réglementations définissent la notion d’Equivalent-Habitant (EH) qui est<br />
l’estimation de la quantité de pollution journalière rejetée par un habitant (tableau 2 ).<br />
L’équivalent-habitant permet ainsi d’exprimer, à l’aide d’une unité commune, des<br />
types de rejets différents et de pouvoir en conséquence les comparer.<br />
Paramètres<br />
Equivalent - Habitant<br />
Volume consommé<br />
150 litres<br />
Demande Biologique en Oxygène sur 5 jours (DBO5)<br />
60 g<br />
Demande Chimique en Oxygène (DCO)<br />
120 g<br />
Matières en suspension (MES)<br />
90 g<br />
Matières azotées (Azote total –NTK)<br />
15 g<br />
Matières phosphorées (phosphore total – PT)<br />
4 g<br />
Escherichia coli (cf. 3.2) 2.14 10 9<br />
Tableau 2 : Pollution émise journellement par un habitant<br />
D’après le recensement de la population en 1999, 97% des logements disposaient<br />
d’un système d’assainissement et 80% des logements étaient raccordés à un réseau<br />
collectif d’assainissement.<br />
L’épuration des eaux usées domestiques fait appel à différents systèmes alternatifs<br />
(lagunage, filtres plantés de roseaux, lits bactériens, boues activées) dont la mise en<br />
place sera effective en fonction des contraintes locales (capacités épuratrices,<br />
disponibilité de terres,…). Pour les stations d’épuration de plus de 10000<br />
Equivalents-habitant , 50% d’entre elles sont construites sur le principe des boues<br />
activées qui est décrit ci-dessous (figure 6).<br />
Prétraitements<br />
Le Dégrillage consiste à éliminer les déchets les plus grossiers.<br />
Le dessablage et le Déshuilage consistent à faite passer l’effluent dans<br />
un bassin où la réduction de la vitesse d’écoulement va permettre une décantation<br />
des sables et une flottaison des graisses. L’injection de microbulles d’air assure une<br />
accélération de la flottaison des graisses.<br />
Traitements primaires physico-chimiques
6<br />
Les traitements primaires s’intéressent aux matières particulaires<br />
décantables. Pour cela ils utilisent des traitements physico-chimiques qui permet<br />
d’agglomérer les particules par adjonction d’agents coagulants et floculants (sels de<br />
fer ou d’alumine) qui sont séparés par décantation ou flottaison.<br />
Traitements secondaires biologiques<br />
Ce traitement biologique permet d’extraire des eaux usées les polluants<br />
dissous que ce soit le carbone, l’azote ou le phosphore en favorisant la multiplication<br />
de bactéries aérobies c’est à dire qui se développent en présence d’air, capables de<br />
transformer le carbone en CO2, l’azote en nitrates puis en azote gazeux (N2) soit de<br />
stocker le phosphore. La séparation de l’eau traitée et de la masse des bactéries que<br />
l’on appelle « les boues » se fait au sein d’un clarificateur. Pour conserver une masse<br />
bactérienne suffisante dans le bassin des boues activées une partie de ces boues<br />
est réinjectée dans ce bassin. Ces boues qui contiennent une part des bactéries et<br />
virus amenés à la station d’épura tion sont ensuite égouttées, puis éliminées le plus<br />
souvent par épandage sur les sols agricoles.<br />
Figure 6 : Principe de fonctionnement d’une station d’épuration à boues activées<br />
(source : http://www.<strong>ifremer</strong>.fr/envlit/).<br />
Pour les différents types de traitement des eaux usées domestiques il est<br />
communément admis les abattements bactériens moyens suivants (tableau 3)<br />
Type de traitement<br />
Abattement bactérien<br />
(1Log= une puissance de 10)<br />
Lagunage naturel<br />
3 à 4 Log<br />
Boues activées+membranes filtrantes<br />
6 Log<br />
Boues activées<br />
2 à 3 Log<br />
Lits bactériens<br />
1 Log<br />
Tableau 3 : Types de traitement épuratoire et performances d’élimination<br />
bactériennes
7<br />
3.1.2 – Assainissement autonome<br />
L’assainissement autonome non maîtrisé est également un vecteur potentiel de<br />
contamination bactériologique du milieu naturel. Afin de satisfaire à une démarche<br />
globale de restauration de la qualité des eaux sur les bassins versants, la loi sur l’eau<br />
a prévu la création d’un Service Public d’Assainissement Non Collectif (SPANC) à<br />
l’échelle locale pour contrôler ces installations chez les particuliers.<br />
3.2 – Origine agricole<br />
La définition officielle d’équivalent-habitant n’intègre pas le paramètre relatif au rejet<br />
bactérien, ce qui nous a contraint de rechercher dans la bibliographie les données<br />
disponibles sur ce sujet. Les études menées par Geldreich 1978, Weather et al. 1979<br />
et Mara et Oragui 1983 mettent en évidence une variabilité importante de la<br />
contamination fécale animale. Toutefois pour satisfaire aux exigences de<br />
comparaison des sources potentielles de pollution sur les territoires, l’IFREMER<br />
utilise les valeurs suivantes (figure7), retenues initialement dans le cadre de l’étude<br />
rejets agricoles et bactériologie (Dupray et al.1999).<br />
Espèces Flux/j d’E. coli Equivalent-Habitant<br />
2.14 10 9 1<br />
5<br />
30<br />
0.06<br />
Figure 7 : Comparaison inter espèces de la contamination fécale journalière<br />
Ces contaminations bactériologiques peuvent avoir diverses origines qui sont<br />
déclinées ci-dessous :<br />
• La présence d’écoulements aux sièges d’exploitations qui, de fossés<br />
en ruisseaux, peuvent aboutir à l’estuaire.
8<br />
• L’épandage des effluents agricoles, et tout particulièrement les lisiers,<br />
qui réalisé dans des conditions défavorables (pluviométrie, sol gelé),<br />
peut s’avérer fort dommageable pour la qualité de l’eau.<br />
• Les points d’abreuvage ainsi que le passage des animaux dans les<br />
rivières s’avèrent des foyers de contamination non négligeables en<br />
période pluvieuse (figure 8). Cette figure souligne ainsi l’ augmentation<br />
significative de la contamination bactériologique en concentration<br />
(x1400) et en flux (x4600) après un épisode pluvieux de 17.3 mm.<br />
Figure 8 : Contamination de l’eau en aval d’un point d’abreuvage sur le bassin<br />
versant du Bélon en 2005 (source : IFREMER Concarneau).<br />
3.3 – Origine liée aux activités de loisirs<br />
Les activités liées au littoral, et la plaisance notamment, peuvent induire une<br />
dégradation microbiologique des eaux en raison du déversement des eaux noires<br />
des bateaux. Afin de limiter l’impact des rejets de cette activité de loisir, une<br />
réglementation européenne va imposer à terme la mise en place de bac de vidange<br />
dans les ports de plaisance de la communauté européenne.<br />
4 – Contamination des eaux estuariennes<br />
Si les rejets directs (urbain, agricole, industriel) ou diffus (épandage des lisiers et des<br />
boues de station d’épuration) dans l’environnement sont une condition nécessaire à<br />
la contamination microbiologique des eaux estuariennes, elle n’est nullement une<br />
condition suffisante. En effet, les microorganismes rejetés sur le bassin versant, pour<br />
parvenir au littoral, seront sous la dépendance d’un certains nombre de facteurs<br />
naturels (pentes, pluviométrie, importance du réseau hydrographique,…) et humains
9<br />
(pratiques agricoles,…) qui faciliteront leur transit du point de rejet à l’estuaire (figure<br />
8).<br />
Figure 8 : Recensement des facteurs susceptibles d’influer sur la<br />
contamination ultime des eaux estuariennes.<br />
Parmi ces différents facteurs, la pluviométrie est sans aucun doute celui qui occupe<br />
une place primordiale dans cette contamination à l’échelle du bassin versant. Il n’en<br />
est pour s’en convaincre que de se référer aux résultats obtenus dans le cadre du<br />
projet Cycleau (Monfort et al. 2006). Ceux-ci font apparaître une perte d’une à deux<br />
classes de qualité sur le paramètre microbiologique à la suite d’épisodes pluvieux<br />
(figure 9).
10<br />
Figure 9 : Concentrations bactériennes dans les eaux superficielles du Bélon en<br />
périodes sèches et pluvieuses (source : IFREMER Concarneau).<br />
5 – Survie des bactéries en mer<br />
Les bactéries et virus, hôtes habituels de l’intestin de l’homme et des animaux à sang<br />
chaud, qui arrivent dans le milieu marin, se retrouvent dans un milieu hostile peu<br />
propice à leur croissance. Incapables de se multiplier dans cet environnement, ces<br />
microorganismes vont y survivre plus ou moins longtemps en fonction des<br />
paramètres physiques, chimiques et biologiques du milieu (figure 10). Les<br />
microorganismes sont soit libres dans la masse d’eau, soit associés à des particules<br />
organiques ou minérales. Suivant le poids de ces particules, les microorganismes<br />
vont être soumis à une dilution tout au long de l’estuaire ou à une sédimentation<br />
favorable à leur concentration. Ainsi on estime que les sédiments sont de 100 à 1000<br />
fois plus contaminés que l’eau environnante (Gerba 1976, Smith 1978, Labelle et al.<br />
1980) et vont constituer un réservoir potentiel pour une recontamination ultérieure<br />
des eaux à la faveur de la remise en suspension des microorganismes lors des<br />
phénomènes naturels (crues, tempête) ou d’activités humaines (dragages). Le temps<br />
de survie des microorganismes est défini par le temps nécessaire à la disparition de<br />
90% de la population initiale, exprimé par le T90. De quelques heures à quelques<br />
jours pour les bactéries, cette survie est prolongée, pour les virus, de plusieurs<br />
semaines à plusieurs mois.
11<br />
Figure 10 : Paramètres physiques, chimiques et biologiques influençant la survie des<br />
germes en milieu marin (source : M. Pommepuy – IFREMER)<br />
La lumière<br />
L’action bactéricide des rayons ultra-violets (UV) de la lumière solaire est connue<br />
depuis longtemps et la variabilité saisonnière (hiver – été) de la survie des germes<br />
peut être observée en fonction de la présence ou de l’absence de la couche<br />
nuageuse.<br />
Une turbidité élevée de l’eau limite la pénétration des rayons UV dans l’eau et<br />
contribue également à réduire l’efficacité des rayons UV vis à vis des cellules<br />
microbiennes. Ainsi dans une eau peu chargée en matières en suspension (1mg/l),<br />
environ 80% de l’intensité lumineuse est transmise dans les cinq premiers mètres<br />
alors que dans une eau plus turbide (10mg/l) ce pourcentage n’est plus que de 20%<br />
(Pommepuy et al. 1991).<br />
La température<br />
D’une manière générale, on observe un allongement de la durée de survie des<br />
microorganismes à basse température, induite par un ralentissement de leur<br />
métabolisme. Ainsi, dans le cadre d’une étude de la survie des listeria et des<br />
salmonelles dans l’environnement marin (Monfort et al. 2000), nous avons enregistré<br />
respectivement en eau de mer des T90 de 9 et de 14 heures à 18°C et de 67 et<br />
167 heures à 5°C (figures 11 et 12 ).
12<br />
Figure 11 : Evaluation de la survie bactérienne des salmonelles et des listeria en<br />
laboratoire à 18°C (source : IFREMER Concarneau).<br />
Figure 12 : Evaluation de la survie bactérienne des salmonelles et des listeria en<br />
laboratoire à 5°C (source : IFREMER Concarneau).<br />
La salinité<br />
Parmi les stress subis par les bactéries d’origine entérique arrivant en milieu<br />
marin, l’un des principaux est exercé par la salinité (Pommepuy et al.1991). Ces<br />
auteurs montrent qu’à une concentration de 10g/l 100% des souches d’E.coli<br />
croissent en milieu minimum alors qu’à 20g/l, 25% des souches bactériennes ont<br />
disparu. Ils soulignent également que la présence de particules organiques permet<br />
aux microorganismes de lutter plus efficacement contre le stress salin.<br />
Autres<br />
La compétitivité entre cette flore fécale et la flore bactérienne autochtone au<br />
milieu marin, leur prédation par d’autres organismes ainsi que l’absence de nourriture<br />
(oligotrophie) sont autant de facteurs supplémentaires qui concourent à la disparition<br />
des bactéries entériques apportées au littoral.
13<br />
6 – La contamination des coquillages<br />
Outre la présence de germes dans l’eau, inhérente aux activités et aux usages<br />
anthropiques, le risque de Toxi-Infection Alimentaire est intimement lié à la<br />
physiologie des mollusques bivalves filtreurs (figure 13). En effet, pour satisfaire<br />
leurs exigences nutritionnelles et respiratoires, les coquillages filtrent des volumes<br />
d’eau importants. Ce faisant, ils ingèrent le phytoplancton, base essentielle de leur<br />
nourriture mais concentrent également dans leur tractus digestif et leurs tissus, les<br />
polluants chimiques et les microorganismes présents dans le milieu naturel. Aussi,<br />
les coquillages présentent ils une plus grande sensibilité analytique et des<br />
fluctuations temporelles moins marquée que l’eau dans laquelle ils sont élevés<br />
(figure 14), ce qui leur confèrent un rôle de sentinelle de l’environnement, mis à profit<br />
dans la surveillance des eaux littorales que ce soit aux Etats-Unis (mussel watch) ou<br />
en France (Réseau microbiologique-REMI).<br />
Figure 13 : La filtration, un impératif physiologique à double tranchant<br />
Figure 14 : Evolution des concentrations en E. coli dans les moules et dans l’eau<br />
environnante au cours d’un cycle de marée (source : IFREMER Concarneau).
14<br />
Facteurs agissant sur l’accumulation<br />
Cette accumulation de microorganismes dans les bivalves, liée à leur activité<br />
physiologique de filtration, est conditionnée par divers paramètres.<br />
• L’espèce et la taille des coquillages est un facteur important de<br />
différenciation d’enrichissement. Au sein de l’espèce, On note<br />
également une variabilité individuelle plus marquée chez l’ huître<br />
creuse que chez la moule.<br />
• La filtration optimale des coquillages se situe le plus souvent entre 18 et<br />
22°C. A l’extérieur de cette fourchette, la filtration est ralentie tandis<br />
qu’en dessous de 10°C et au dessus de 27°C, elle est fortement<br />
perturbée (Rowse and Fleet 1984).<br />
• L’optimum de salinité est variable selon les espèces considérées mais<br />
elles supportent en général de large gradient de salinité (espèces<br />
euryhalines). Une forte et brutale dessalure peut toutefois entraîner une<br />
mortalité importante des coquillages.<br />
• Les bivalves utilisent l’oxygène dissous dans l’eau de mer pour<br />
satisfaire leurs besoins respiratoires. En dessous des valeurs situées<br />
entre 28 et 35 mg/l (His et Cantin 1995), on observe une perturbation<br />
de l’activité physiologique et donc une moindre capacité de filtration.<br />
• Une turbidité de l’eau excessive entraîne un ralentissement du<br />
pompage par le coquillage et donc une filtration moindre.<br />
• L’état physiologique des coquillages (Le Bec et al. 2002).<br />
L’accumulation des bactéries dans les tissus des bivalves se traduit par un<br />
enrichissement bactérien par rapport à l’eau environnante (tableau 4 ). L’observation<br />
de valeurs différentes dépend non seulement du germe de référence mais également<br />
des conditions d’étude (in vivo ou in vitro), des conditions environnementales de<br />
l’expérience (Température, salinité,…) mais aussi l’état physiologique du coquillage.<br />
Des facteurs de 10 à 30, communément admis pour Escherichia coli, sont utilisés<br />
dans les modèles prédictifs de dispersion des rejets polluants afin d’évaluer leurs<br />
impacts sur la contamination des zones conchylicoles. Des études menées au<br />
laboratoire de Concarneau ont permis de noter une variabilité importante de ce<br />
facteur d’enrichissement chez la moule, non seulement entre les sites mais<br />
également au cours du cycle de marée (figures 13 et 14).
15<br />
Références Bivalve Conditions Groupe<br />
bactérien<br />
Facteur<br />
d’enrichissement<br />
Cabelli et<br />
Heffernan 1970 M. mercenaria expérimentales E. coli 6.5 – 8.5<br />
Cooke 1976 E. coli 3.2<br />
Mazières et al.<br />
1980 Huîtres Coliformes 30<br />
Perkins et al.<br />
1980 Huîtres<br />
Delattre et<br />
Delesmont 1981 Huîtres et<br />
coques<br />
naturelles<br />
Coliformes<br />
fécaux 3 - 16<br />
Coliformes<br />
fécaux<br />
Streptocoques<br />
fécaux<br />
Plusquellec et<br />
al.1983 Moules Naturelles Coliformes<br />
fécaux<br />
Streptocoques<br />
fécaux<br />
Timoney and<br />
Abston 1984 M. mercenaria Expérimentales E.coli<br />
Plusquellec et<br />
al. 1990 Moules Naturelles<br />
Salmonella<br />
Coliformes<br />
fécaux<br />
E. coli<br />
10<br />
150<br />
13.2<br />
250<br />
Expérimentales<br />
9.8<br />
Chamelea<br />
gallina expérimentales E.coli 1.6<br />
Nishio et al<br />
1980<br />
Tableau 4 : Données bibliographiques concernant l’enrichissement bactérien dans<br />
les bivalves (source :Prieur et al. 1990).<br />
3<br />
3<br />
20<br />
Figure 13 : Evolution du facteur d’enrichissement (E. coli) chez la moule par faible<br />
coefficient de marée selon le site d’étude (source : IFREMER Concarneau).
16<br />
Figure 14 : Evolution du facteur d’enrichissement (E. coli) chez la moule par fort<br />
coefficient de marée selon le site d’étude (source : IFREMER Concarneau).<br />
7– Bibliographie<br />
Andrews W.H., Diggs C.O., Presnel M.W., Miescer J.J., Wilson C.R., Goodwin<br />
C.P., Adams W.N., Furfari S.A. and Musselman J.F. 1975<br />
Comparative validity of the total coliform and fecal coliform groups for indicating the<br />
presence of Salmonella in the eastern oyster Crassostrea virginica.<br />
J. Milk Food Technol. 38 (8) : 453 - 456<br />
Archer and Kvenberg 1985<br />
Incidence and cost of foodborne diarrehal diseases in Canada and the US<br />
J. Food Prot. 47, p. 322 – 328.<br />
Desenclos JC., Bouvet P., Pirre V., Brisabois A., Frémy S., Lahelléc C., Grimont<br />
F., et Grimont P.A.D 1996.<br />
Epidémiologie des infections à salmonella : tendances récentes en France et en<br />
Europe.<br />
Bull. Soc. Fr. Microbiol. 11(3), p. 209 – 215<br />
Dupray E. 1999<br />
Rejets agricoles et bactériologie<br />
Rapport final IFREMER rédigé dans le cadre du programme Bretagne eau pure, 71<br />
p.
17<br />
Fraiser M.B. and Koburger J.A. 1984<br />
Incidence of Salmonella in clams, oysters, crabs and mullets<br />
J. Food Prot. 47 (5) : 343 – 345<br />
Geldreich E.E. 1978<br />
Bacterial populations and indicator concepts in feces, sewage, stormwater and solid<br />
wastes<br />
In: Indicator of viruses in water and food, Berg G. Editor, chap. 4, p. 51 – 97.<br />
Gerba C.P. and Mc Leod J.J. 1976<br />
Effects of sediments on the survival of E. coli in marine waters<br />
Appl. And Environ. Microbiol., 56, p. 551 – 554.<br />
His et Cantin 1995<br />
Biologie et physiologiedes coquillages<br />
IFREMER Direction de l’environnement et de l’aménagement littoral, R.INT.<br />
DEL/95.06/Arcachon, 108 p.<br />
Labelle R.L., Gerba C.P., Goyal S.M., Melnick J.L., Cech I and Bogdam G.F. 1980<br />
Relationships between environmental factors, bacterial indicators and the occurrence<br />
of enteric viruses in estuarine sediments<br />
Appl. And Environ. Microbiol. 39 : 588 – 596<br />
Le Bec (coordonnateur) 2002<br />
Incidence de la station d’épuration de Lannion sur l’estuaire du Léguer.<br />
IFREMER - Rapport de fin d’étude, 71 p.<br />
Marjori L., Campello C. et Crevatin E. 1978<br />
Salmonella pollution of coastal seawaters of the gulf of trieste : a 3-year survey.<br />
IV journées Etud. Poll., Antalya C.I.E.S.M. : 505 - 510<br />
Monfort P., Hervio-Heath D., Caprais MP., Pommepuy M., Annézo JP., Loaec S.,<br />
Le Mennec C. Guillerm E., Boulben S. et Bilien G. 2006<br />
Le basin versant du Bélon : Vers une restauration durable de la qualité<br />
bactériologique des eaux estuariennes.<br />
Rapport final du projet européen cycleau, 76 p.<br />
Monfort P., Piclet G. and Plusquellec A. 2000.<br />
Listeria innocua and Salmonella panama in estuarine water and seawater : a<br />
comparative study.<br />
Wat. Res. Vol. 34, N°3, pp. 983 – 989.<br />
Monfort P. , Piclet G., Le Gal D., Raguénès P., Le Naour G., Boulben S. et Le<br />
Saux JC. 1997.<br />
Incidence de salmonella spp. dans les bivalves issus de zones conchylicoles du<br />
Finistère (France).<br />
Colloque salmonelles et salmonelloses, Ploufragan, p. 431-433.
18<br />
Mossel D.A.A. 1989.<br />
Infections et intoxications alimentaires.<br />
In : Microbiologie du tube digestif, l’eau et les aliments part. 4, chap.IV,2, p. 389 –<br />
412.<br />
Pommepuy M., Dupray E., Guillaud J.F., Derrien A., L’Yavanc J. and Cormier M.<br />
1991<br />
Rejets urbains et contamination fécale.<br />
Oceanologica acta. Proceedings of the international colloquium on the environment<br />
of epicontinental seas, Lille 20-22 mars 1990 n°11, p. 321 – 327..<br />
Prieur D., Mével G., Nicolas J.L., Plusquellec A. and Vigneulle M. 1990<br />
Interactions between bivalve molluscs and bacteria in the marine environment.<br />
Oceanogr. Mar. Biol. Annu. Rev. 28, p. 277 – 352.<br />
Roberts 1988<br />
Salmonellosis control : Estimated economic costs<br />
Poultry Sci., 67, p. 936 – 943.<br />
Rowse A.J. and Fleet G.H. 1984<br />
Effects of water temperature and salinity on elimination of Salmonella charity and<br />
Escherichia coli from Sydney rock oysters.<br />
Appl.and Environ.Microbiol., 48 (5), p. 1061 – 1063.<br />
Smith E.M., Gerba C.P. and Melnick J.L. 1978<br />
Role of sediment in the persistence of enteroviruses in the estuarine environment.<br />
Appl. And Environ. Microbiol. 35, p. 685 – 689.<br />
Thomas K.L. and Jones A.M. 1971<br />
Comparison of methods on estimating the number of E. coli in edile mussels and the<br />
relationship between the presence of Salmonella and E. coli<br />
J. Appl. Bacteriol. 34 : 717 – 725<br />
Weather DWF., Mara D.D. and Oragui J. 1979.<br />
Indicator systems to distinguish sewage from stormwater run-off and human from<br />
animal fecal material.<br />
James A, EvisonL. Ed. “Biological indicators of water quality” chap. 21, 27 p.