Farmaci Antivirali - Sezione di Microbiologia
Farmaci Antivirali - Sezione di Microbiologia
Farmaci Antivirali - Sezione di Microbiologia
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Microbiology update OE Varnier<br />
GENERALITÀ. I virus, a <strong>di</strong>fferenza <strong>di</strong> batteri e<br />
protozoi, sono patogeni obbligati, devono cioè<br />
paras-sitare la cellula ospite per sfruttarne i<br />
meccanismi replicativi. Gli agenti antivirali<br />
devono essere in grado <strong>di</strong> colpire selettivamente le<br />
<strong>di</strong>verse tappe della fisiologia dell’infezione virale.<br />
Inoltre il farmaco ideale dovrebbe ridurre i sintomi<br />
della malattia senza però mo<strong>di</strong>ficare l’infezione<br />
così tanto da prevenire una risposta immune<br />
nell’ospite. In realtà è stato molto <strong>di</strong>fficile<br />
sviluppare farmaci che <strong>di</strong>stinguessero i proces-si<br />
replicativi virali da quelli dell’ospite: i primi<br />
farmaci antivirali erano quin<strong>di</strong> tossici per<br />
l’organismo e il loro uso è limitato ad un ristretto<br />
numero <strong>di</strong> casi: ad esem-pio nel trattamento degli<br />
immunodepressi. I farmaci risultano essere<br />
importanti per quei virus per i quali NON esiste<br />
una profilassi valida (vaccino), o non esistono<br />
vaccini efficaci, sia per la molteplicità dei sierotipi<br />
virali (rhinovirus), sia per la variabilità del singolo<br />
virus infettante (influenza, HIV).<br />
BERSAGLI. Gli stu<strong>di</strong> <strong>di</strong> virologia molecolare<br />
hanno identificato le <strong>di</strong>verse fasi del processo<br />
infettivo virus specifico al fine <strong>di</strong> in<strong>di</strong>viduare i<br />
bersagli per l’inibizione farmacologica.<br />
Teoricamente qualsiasi sta<strong>di</strong>o del ciclo replicativo<br />
TERAPIE ANTIVIRALI<br />
FARMACI ANTIVIRALI<br />
virale potrebbe essere il sito d’azione per una<br />
terapia:<br />
• l’attacco del virus alla cellula ospite,<br />
• lo scapsidamento del genoma virale,<br />
• la retrotrascrizione e l'integrazione (in alcuni<br />
virus),<br />
• la trascrizione virale,<br />
• la replicazione degli aci<strong>di</strong> nucleici virali,<br />
• la traduzione <strong>di</strong> proteine virali,<br />
• l'assemblaggio,la maturazione e il rilascio dei<br />
virioni.<br />
MECCANISMO D’AZIONE. I meccanismi dei vari<br />
farmaci variano molto. Talvolta il farmaco è<br />
attivato da enzimi cellulari prima <strong>di</strong> attivare<br />
l’inibizione della replicazione virale; i farmaci più<br />
selettivi sono attivati da enzimi co<strong>di</strong>ficati dal virus<br />
nella cellula infettata.<br />
CLASSI DI FARMACI. I farmaci antivirali possono<br />
essere <strong>di</strong>visi in:<br />
A. Analoghi dei nucleosi<strong>di</strong><br />
B. Analoghi dei nucleoti<strong>di</strong><br />
C. Inibitori della trascrittasi inversa<br />
D. Inibitori della proteasi<br />
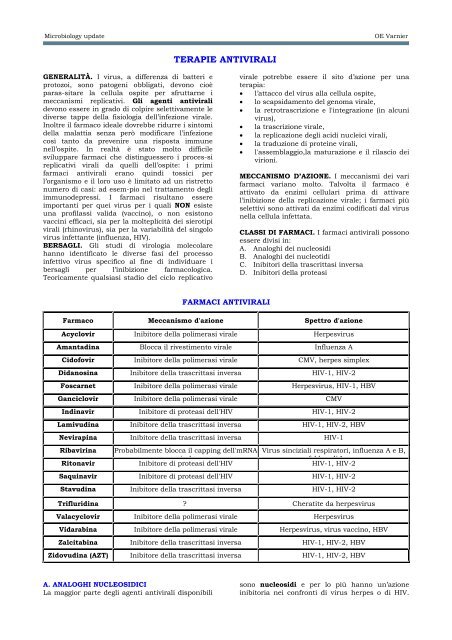
Farmaco Meccanismo d'azione Spettro d'azione<br />
Acyclovir Inibitore della polimerasi virale Herpesvirus<br />
Amanta<strong>di</strong>na Blocca il rivestimento virale Influenza A<br />
Cidofovir Inibitore della polimerasi virale CMV, herpes simplex<br />
Didanosina Inibitore della trascrittasi inversa HIV-1, HIV-2<br />
Foscarnet Inibitore della polimerasi virale Herpesvirus, HIV-1, HBV<br />
Ganciclovir Inibitore della polimerasi virale CMV<br />
In<strong>di</strong>navir Inibitore <strong>di</strong> proteasi dell'HIV HIV-1, HIV-2<br />
Lamivu<strong>di</strong>na Inibitore della trascrittasi inversa HIV-1, HIV-2, HBV<br />
Nevirapina Inibitore della trascrittasi inversa HIV-1<br />
Ribavirina Probabilmente blocca il capping dell'mRNA Virus sinciziali respiratori, influenza A e B,<br />
Ritonavir<br />
irale<br />
Inibitore <strong>di</strong> proteasi dell'HIV<br />
febbre <strong>di</strong> Lassa<br />
HIV-1, HIV-2<br />
Saquinavir Inibitore <strong>di</strong> proteasi dell'HIV HIV-1, HIV-2<br />
Stavu<strong>di</strong>na Inibitore della trascrittasi inversa HIV-1, HIV-2<br />
Trifluri<strong>di</strong>na ? Cheratite da herpesvirus<br />
Valacyclovir Inibitore della polimerasi virale Herpesvirus<br />
Vidarabina Inibitore della polimerasi virale Herpesvirus, virus vaccino, HBV<br />
Zalcitabina Inibitore della trascrittasi inversa HIV-1, HIV-2, HBV<br />
Zidovu<strong>di</strong>na (AZT) Inibitore della trascrittasi inversa HIV-1, HIV-2, HBV<br />
A. ANALOGHI NUCLEOSIDICI<br />
La maggior parte degli agenti antivirali <strong>di</strong>sponibili<br />
sono nucleosi<strong>di</strong> e per lo più hanno un’azione<br />
inibitoria nei confronti <strong>di</strong> virus herpes o <strong>di</strong> HIV.
Questi inibiscono la replicazione degli aci<strong>di</strong><br />
nucleici bloccando l’attività del metabolismo<br />
delle purine e delle pirimi<strong>di</strong>ne o delle polimerasi.<br />
Alcuni possono essere incorporati nell’acido<br />
nucleico e bloccare la sintesi o alterarne le<br />
funzioni. Gli analoghi dei nucleosi<strong>di</strong> possono<br />
inibire enzimi cellulari e virali. L’uso clinico <strong>di</strong><br />
questi composti deriva da un’alta razionalità<br />
terapeutica, per cui il beneficio dell’attività<br />
antivirale supera la tossicità intrinseca nel<br />
farmaco. I nuovi tipi <strong>di</strong> analoghi sono quelli in<br />
grado <strong>di</strong> inibire in modo specifico gli enzimi<br />
co<strong>di</strong>ficati da genomi virali. Si selezionano mutanti<br />
virali resistenti al farmaco (a volte anche<br />
rapidamente). L’uso combinato <strong>di</strong> più farmaci può<br />
ridurre la farmaco resistenza (ad es.: la triplice<br />
terapia per HIV).<br />
1. ACICLOVIR (acicloguanosina) e VALACICLO-<br />
VIR<br />
L’aciclovir è un analogo della guanosina o deossiguanosina<br />
che inibisce fortemente <strong>di</strong>versi<br />
herpesvirus, mentre ha un effetto minimo su altri<br />
virus a DNA e sulle cellule ospiti. Clinicamente è<br />
usato per trattare le infezioni da herpes simplex <strong>di</strong><br />
tipo 1 e 2, e da herpes zoster. Il farmaco, che è<br />
ben tollerato, viene fosforilato dalla timi<strong>di</strong>na<br />
chinasi co<strong>di</strong>ficata dal virus e causa un’inibizione<br />
della DNA polimerasi virale molto maggiore rispetto<br />
a quella degli enzimi corrispondenti della cellula<br />
ospite. Dopo essere stato inserito nel filamento<br />
<strong>di</strong> DNA neosintetizzato, blocca la sintesi <strong>di</strong><br />
DNA. Gli herpesvirus che co<strong>di</strong>ficano la loro<br />
2<br />
<strong>Farmaci</strong> antivirali<br />
timi<strong>di</strong>na chinasi (herpes simplex e varicellazoster)<br />
sono molto più sensibili <strong>di</strong> quelli che non<br />
la co<strong>di</strong>ficano (CMV e virus <strong>di</strong> Epstein-Barr). I<br />
mutanti <strong>di</strong> herpesvirus che non co<strong>di</strong>fi-cano la<br />
timi<strong>di</strong>na chinasi non fosforilano il farmaco e sono<br />
resistenti ad esso.<br />
L’aciclovir è attivo in vivo nei topi con encefalite da<br />
herpes ed è efficace nel trattamento topico delle<br />
lesioni oculari erpetiche nei conigli e delle lesioni<br />
cutanee nelle cavie. La somministrazione topica è<br />
efficace nel controllare le lesioni oculari erpetiche<br />
nell'uomo e nella guarigione delle lesioni cutanee<br />
erpetiche primarie, ma non <strong>di</strong> quelle ricorrenti. È<br />
attivo solo contro il virus che si sta replicando,<br />
pertanto le infezioni latenti nei gangli non sono<br />
curate. La sommi-nistrazione parenterale <strong>di</strong><br />
aciclovir ha prevenuto la riattivazione <strong>di</strong> infezioni<br />
erpetiche latenti ed è stata anche efficace nel<br />
trattamento <strong>di</strong> lesioni erpetiche attive in pazienti<br />
in terapia immunosoppressiva.<br />
Un estere dell’aciclovir, il valaciclovir, ha una<br />
mag-giore <strong>di</strong>sponibilità orale. Dopo esser stato<br />
assorbito, viene rapidamente convertito in<br />
aciclovir, quin<strong>di</strong> ha lo stesso meccanismo<br />
d’azione. È efficace nel tratta-mento dell’herpes<br />
zoster.<br />
2. DIDANOSINA ( <strong>di</strong>deossinosina, ddl )<br />
La <strong>di</strong>danosina è un <strong>di</strong>deossinucleoide che inibisce<br />
la trascrittasi inversa <strong>di</strong> HIV e blocca la sintesi del<br />
DNA provirale. La forma attiva è prodotta<br />
me<strong>di</strong>ante fosforilazione da enzimi cellulari. Il<br />
farmaco è stato approvato per la prima volta nel<br />
1991 per il trattamento delle infezioni dell’HIV.<br />
3. GANCICLOVIR<br />
Il ganciclovir è un derivato della metilguanina<br />
simile all’aciclovir. È attivo contro il<br />
citomegalovirus, poiché inibisce la DNA polimerasi<br />
virale e blocca l’allunga-mento della catena <strong>di</strong><br />
DNA virale.
Microbiology update OE Varnier<br />
Non è attivo contro le infezioni latenti. Significativi<br />
benefici clinici sono stati ottenuti in pazienti<br />
trapiantati con gravi infezioni da CMV. Alcuni<br />
pazienti con retinite da CMV hanno risposto bene.<br />
Una formulazione per l'impianto intraoculare è<br />
<strong>di</strong>sponibile, che consente un rilascio a lungo<br />
termine. Il Ganciclovir passa la barriera ematoencefalica<br />
e la placenta.<br />
4. IDOSSIURIDINA<br />
La Idossiuri<strong>di</strong>na, che è una pirami<strong>di</strong>na alogenata,<br />
inibisce la timi<strong>di</strong>na chinasi ed viene incorporata<br />
nel DNA. È stato il primo farmaco antivirale ad<br />
essere autorizzato nell'uomo. La somministrazione<br />
topica <strong>di</strong> idossiuri<strong>di</strong>na è stata usata sull’uomo nel<br />
trattamento <strong>di</strong> lesioni della cornea dal virus<br />
herpes simplex. Questo farmaco è stato<br />
largamente superato da analoghi più recenti e<br />
meno tossici.<br />
5. LAMIVUDINA (3TC)<br />
La Lamivu<strong>di</strong>na (3TC) è un altro analogo<br />
nucleosi<strong>di</strong>co con attività antiretrovirale. Inibisce la<br />
trascrittasi in-versa dell’HIV ed è stato approvato<br />
l’utilizzo nel 1995. Il farmaco è attivo anche contro<br />
il virus dell’epatite B. Il metabolita fosforilato è il<br />
composto attivo che inibisce la trascrittasi inversa<br />
e la sintesi <strong>di</strong> DNA virale.<br />
3<br />
È stato descritto che la resistenza alla lamivu<strong>di</strong>na<br />
è associata con la mutazione nel codone 184 del<br />
gene della trascrittasi inversa. Questa mutazione<br />
inibisce la comparsa <strong>di</strong> una mutazione nel codone<br />
215, che è associata alla resistenza alla<br />
zidovu<strong>di</strong>na.<br />
6. RIBAVIRINA<br />
La Ribavirina è un nucleoside sintetico strutturalmente<br />
simile alla guanosina che è attivo in vario<br />
grado contro molti virus a DNA ed RNA in vitro. Il<br />
suo meccanismo d'azione non è stato chiarito:<br />
determina una riduzione della guanosina trifosfato,<br />
che può alterare la sintesi (capping) degli<br />
RNAm virali. Un sistema <strong>di</strong> somministrazione per<br />
aerosol a piccole goccie è stato progettato per il<br />
trattamento delle infezioni da virus influenzale e<br />
virus respiratorio sinciziale. Il farmaco è stato<br />
approvato per il trattamento per aerosol delle<br />
infezioni da virus respiratorio sinciziale nei<br />
bambini. La ribavirina per via endovenosa è stata<br />
<strong>di</strong>mostrata essere efficace nel trattamento della<br />
febbre <strong>di</strong> Lassa.
7. STAVUDINE ( d4T)<br />
La Stavu<strong>di</strong>na (d4T) è un analogo nucleosi<strong>di</strong>co<br />
sintetico della timi<strong>di</strong>na. L’attività antivirale <strong>di</strong>pende<br />
dalla sua fosforilazione da parte <strong>di</strong> chinasi<br />
cellulari. Inibisce la trascrittasi inversa <strong>di</strong> HIV e la<br />
sintesi <strong>di</strong> DNA virale. È stato approvato il suo<br />
impiego nella infezione da HIV nel 1994.<br />
8. TRIFLURIDINA (trifluorotimi<strong>di</strong>na)<br />
La Trifluri<strong>di</strong>na è un nucleoside pirimi<strong>di</strong>nico<br />
fluorinato. Interferisce con la sintesi del DNA con<br />
un meccansmo sconosciuto. Ha attività antivirale<br />
contro il virus herpes simplex <strong>di</strong> tipo 1 e 2 e il<br />
virus vaccinico. Viene impiegata nel trattamento<br />
topico della cheratite erpetica.<br />
9. VIDARABINA (adenina arabinoside = ARA-A)<br />
La Vidarabina è un analogo purinico usato come<br />
farmaco antivirale oftalmico. Il preciso meccanismo<br />
<strong>di</strong> azione non è chiaro, ma probabilmente<br />
blocca la sintesi <strong>di</strong> DNA virale inibendo la DNA<br />
polimerasi virale. Ha attività antivirale contro i<br />
4<br />
<strong>Farmaci</strong> antivirali<br />
virus herpes simplex, varicella-zoster, CMV,<br />
vaccinico e dell'epatite B. La Vidarabina viene<br />
usata nel trattamento topico delle lesioni della<br />
cornea da virus herpes simplex. Il suo impiego è<br />
stato approvato nel 1976.<br />
10. ZALCITABINA (<strong>di</strong>deossicitosina, ddC)<br />
La Zalcitabina è un altro analogo nucleosi<strong>di</strong>co che<br />
inibisce la trascrittasi inversa <strong>di</strong> HIV e, dopo<br />
fosforilazione nella cellula, blocca la sintesi <strong>di</strong><br />
DNA provirale. È stata approvata nel 1992 per il<br />
trattamento delle infezioni da HIV. Ha anche una<br />
certa attività contro il virus dell’epatite B.<br />
11. ZIDOVUDINA ( azidotimi<strong>di</strong>na, AZT)<br />
L’AZT è un <strong>di</strong>deossinucleoside sintetico, un analogo<br />
della timi<strong>di</strong>na, che inibisce la replicazione <strong>di</strong><br />
HIV bloccando la sintesi del DNA provirale.<br />
Inizialmente viene attivato nella cellula da ripetute<br />
fosforilazioni da enzimi cellulari. La trascrittasi<br />
inversa virale è 100 volte più sensibile all’inibizione<br />
da AZT della DNA polimerasi cellulare. Il<br />
farmaco viene incorporato nel DNA neosintetizzato<br />
al posto della timi<strong>di</strong>na. È anche attivo contro<br />
l’EBV e il virus dell’epatite B. L’AZT è stato il<br />
primo farmaco antiretrovirale approvato per la<br />
terapia delle infezioni da HIV (1987). È stato<br />
<strong>di</strong>mostrato che <strong>di</strong>minuisce la morbilità e la morta-
Microbiology update OE Varnier<br />
lità in pazienti con AIDS. Le varianti virali resistenti<br />
sono il risultato <strong>di</strong> mutazioni della trascrittasi<br />
inversa. L’AZT è efficace nel ridurre la<br />
trasmissione dell’infezione da HIV dalla madre al<br />
figlio. Non è in grado <strong>di</strong> era<strong>di</strong>care infezioni infezioni<br />
latenti da HIV in macrofagi e cellule CD4 + né <strong>di</strong><br />
prevenire l’infezione. È inoltre un farmaco molto<br />
tossico.<br />
B. ANALOGHI NUCLEOTIDICI<br />
1. CIDOFOVIR (HPMPC). È il primo membro della<br />
nuova classe <strong>di</strong> analoghi nucleoti<strong>di</strong>ci, che <strong>di</strong>fferiscono<br />
dagli analoghi nucleosi<strong>di</strong>ci nell’avere attaccato<br />
un gruppo fosfato. La loro capacità <strong>di</strong> persistere<br />
nelle cellule per lunghi perio<strong>di</strong> aumenta la<br />
loro efficacia. Il Cidofovir è attivo contro il CMV e il<br />
virus herpes simplex. Inibisce la DNA polimerasi<br />
virale e arresta la sintesi delle catene <strong>di</strong> DNA. È<br />
stato approvato per il trattamento delle retiniti da<br />
CMV nel 1996.<br />
C. INIBITORI NON-NUCLEOSIDICI DELLA<br />
TRASCRITTASI INVERSA.<br />
1. NEVIRAPINA. È il primo membro della classe<br />
degli inibitori non nucleosi<strong>di</strong>ci della trascrittasi<br />
inversa. Non richiede fosforilazione per essere<br />
attivato e non compete con i nucleosi<strong>di</strong> trifosfato,<br />
ma agisce legandosi <strong>di</strong>rettamente alla trascrittasi<br />
5<br />
inversa e rompendo il sito catalitico dell’enzima.<br />
La Nevirapina inibisce la trascrittasi inversa dell’HIV.<br />
I mutanti virali resistenti aumentano rapidamente,<br />
quin<strong>di</strong> il suo uso è raccomandato nelle<br />
terapie combinate. È stato approvato nel 1996.<br />
D. INIBITORI DELLE PROATEASI<br />
1. INDINAVIR. In<strong>di</strong>navir è un inibitore delle<br />
proteasi, approvato nel 1996 per il trattamento<br />
delle infezioni da HIV. Inibisce le proteasi sia <strong>di</strong><br />
HIV-1 che <strong>di</strong> HIV-2. Il meccanismo d’azione è lo<br />
stesso del saquinavir.<br />
2. NEFLINAVIR. Inibitore delle proteasi usato<br />
contro le infezioni da HIV.<br />
3. RITONAVIR. Il Ritonavir è un inibitore delle<br />
proteasi con una migliore bio<strong>di</strong>sponibilità, approvato<br />
nel 1996 per il trattamento delle infezioni da<br />
HIV. È un inibitore competitivo sia delle proteasi<br />
<strong>di</strong> HIV-1 che <strong>di</strong> HIV-2. Il meccanismo d’azione è lo<br />
stesso del saquina-vir. Sono stati identificati ceppi<br />
virali resistenti.<br />
4. SAQUINAVIR. Il Saquinavir è stato il primo<br />
inibitore delle proteasi ad essere approvato (1995)<br />
per il trattamento delle infezioni da HIV. È stato<br />
<strong>di</strong>segnato al computer come una molecola che<br />
sarebbe entrata nel sito attivo della proteasi dell’HIV.<br />
La sintesi del composto è un processo lungo<br />
e complicato, che rende il farmaco molto costoso.<br />
Il Saquinavir inibisce la proteasi virale, che è<br />
richiesta nella fase terminale del ciclo replicativo<br />
per tagliare le proteine strutturali virali necessarie<br />
per formare il core maturo del virione e per<br />
attivare la trascrittasi inversa che sarà usata nel<br />
ciclo successivo dell’infezione. L’inibizione della<br />
proteasi rende le particelle virali non infettive.
Gli inibitori delle proteasi sono spesso usati in<br />
combinazione con altre classi <strong>di</strong> farmaci antiretrovirali,<br />
un protocollo terapeutico molto efficace<br />
nel ridurre la carica virale e nell'aumentare la<br />
sopravvivenza dei pazienti infettati. Esistono ceppi<br />
mutanti resistenti. Non c’è resistenza incrociata<br />
tra inibitori delle proteasi ed inibitori della<br />
trascrittasi inversa, perché sono coinvolti <strong>di</strong>versi<br />
enzimi bersaglio.<br />
A. ALTRI TIPI DI AGENTI ANTIVIRALI<br />
Alcuni altri tipi <strong>di</strong> composti possiedono una certa<br />
attività antivirale in alcune con<strong>di</strong>zioni.<br />
1. AMANTADINA E RIMANTADINA. La Amanta<strong>di</strong>na,<br />
una amina sintetica, inibisce specificamente<br />
il virus A dell’influenza, bloccando lo<br />
scapsidamento virale. Quando somministrato a<br />
scopo profilattico, ha nell’uomo un significativo<br />
effetto protettivo contro l’influenza <strong>di</strong> tipo A, ma<br />
non contro l’influenza B o altri virus.<br />
La Rimanta<strong>di</strong>na è un derivato dell’amanta<strong>di</strong>na con<br />
lo stesso spettro <strong>di</strong> attività antivirale, ma meno<br />
tossico.<br />
2. FOSCARNET (acido fosfonoformico, PFA)<br />
Il Foscarnet è un analogo organico del pirofosfato<br />
inorganico. Inibisce la replicazione della maggior<br />
parte degli Herpes virus (CMV, herpes simplex,<br />
varicella-zoster, EBV e herpes virus umano 6) e, in<br />
minor grado, la polimerasi del virus dell’epatite B<br />
e dei retrovirus. Il Foscarnet inibisce in maniera<br />
selettiva le DNA polimerasi virali e le trascrittasi<br />
inverse nel sito <strong>di</strong> legame per il pirofosfato, mentre<br />
6<br />
<strong>Farmaci</strong> antivirali<br />
non agisce sulle DNA polimerasi cellulari. Il<br />
farmaco non richiede fosforilazione per essere<br />
attivato. È consigliato per il trattamento delle retiniti<br />
da CMV e <strong>di</strong> certe infezioni da herpes simplex.<br />
3. METISAZONE<br />
Il Metisazone è un inibitore <strong>di</strong> interesse storico del<br />
virus del vaiolo ed è stato il primo agente antivirale<br />
ad essere stato descritto, ma, poichè il<br />
vaiolo è stato era<strong>di</strong>cato, non è più in uso. Il<br />
Metisazone era altamente virus-specifico e non<br />
alterava il normale metabolismo cellulare. Bloccava<br />
lo sta<strong>di</strong>o tar<strong>di</strong>vo della replicazione virale con<br />
la formazione <strong>di</strong> particelle virali immature e non<br />
infettive.<br />
Aggiornato 17 gennaio 2006