NOTE DI CHIMICA ORGANICA Gli idrocarburi I ... - Istituto Pontano
NOTE DI CHIMICA ORGANICA Gli idrocarburi I ... - Istituto Pontano
NOTE DI CHIMICA ORGANICA Gli idrocarburi I ... - Istituto Pontano
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>NOTE</strong> <strong>DI</strong> <strong>CHIMICA</strong> <strong>ORGANICA</strong><br />
<strong>Gli</strong> <strong>idrocarburi</strong><br />
Tranne rarissime eccezioni (ad esempio, CO e C2), il carbonio forma sempre 4 legami.<br />
<strong>Gli</strong> <strong>idrocarburi</strong> sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della<br />
chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti si possono considerare<br />
come derivati da essi per sostituzione di un atomo di idrogeno con un cosiddetto gruppo funzionale,<br />
quel gruppo chimico, cioè, che conferisce al composto proprietà caratteristiche, diverse da quelle<br />
dell'idrocarburo di origine e peculiari di una classe di composti.<br />
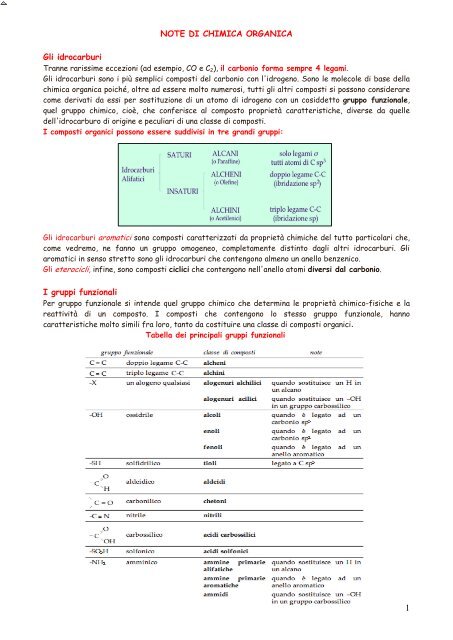
I composti organici possono essere suddivisi in tre grandi gruppi:<br />
<strong>Gli</strong> <strong>idrocarburi</strong> aromatici sono composti caratterizzati da proprietà chimiche del tutto particolari che,<br />
come vedremo, ne fanno un gruppo omogeneo, completamente distinto dagli altri <strong>idrocarburi</strong>. <strong>Gli</strong><br />
aromatici in senso stretto sono gli <strong>idrocarburi</strong> che contengono almeno un anello benzenico.<br />
<strong>Gli</strong> eterocicli, infine, sono composti ciclici che contengono nell'anello atomi diversi dal carbonio.<br />
I gruppi funzionali<br />
Per gruppo funzionale si intende quel gruppo chimico che determina le proprietà chimico-fisiche e la<br />
reattività di un composto. I composti che contengono lo stesso gruppo funzionale, hanno<br />
caratteristiche molto simili fra loro, tanto da costituire una classe di composti organici.<br />
Tabella dei principali gruppi funzionali<br />
1
L'isomeria cis-trans Si definiscono infatti così quegli isomeri che differiscono soltanto per la<br />
disposizione nello spazio degli atomi. Più precisamente sono diastereoisomeri perché non sono l'uno<br />
l'immagine speculare dell'altro (non sono enantiomeri).<br />
Questo tipo di isomeria si definisce isomeria geometrica Il fenomeno della isomeria geometrica è<br />
possibile in tutte le classi di composti che contengono un doppio legame.<br />
I cicloalcani appartengono alla categoria degli <strong>idrocarburi</strong> aliciclici, quei composti cioè caratterizzati da<br />
una struttura ad anello costituito esclusivamente da atomi di carbonio. Vengono anche detti omocicli, in<br />
contrapposizione agli eterocicli, il cui anello contiene anche atomi diversi dal carbonio. Hanno<br />
caratteristiche che ricordano in larga parte quelle degli <strong>idrocarburi</strong> alifatici.<br />
Dato il loro limitato interesse biologico, ci occuperemo quasi esclusivamente della loro struttura, in<br />
particolar modo di quella del cicloesano, la cui conoscenza ci sarà utile in seguito per comprendere<br />
meglio la struttura dei monosaccaridi.<br />
Per quanto riguarda la nomenclatura, basta anteporre il prefisso ciclo- al nome del corrispondente<br />
idrocarburo alifatico. La loro struttura si può rappresentare semplicemente con una figura geometrica,<br />
omettendo gli atomi di carbonio dell’anello e gli idrogeni ad essi legati:<br />
Ciclopropano e Ciclobutano sono molecole in forte tensione (tensione angolare) a causa del fatto che gli<br />
angoli di legame degli atomi dell'anello sono molto distanti dal valore dell'angolo tetraedrico (109.5°),<br />
caratteristico dell'ibridazione sp 3 . Per questo motivo, il ciclopropano e il ciclobutano sono molto reattivi<br />
e tendono a dare facilmente reazioni di addizione che provocano l'apertura dell'anello. Ciclopentano e<br />
Cicloesano sono invece stabiliAd esempio, il cicloesano può esistere in tre diverse conformazioni, "a<br />
sedia", "a barca" e "twist", tutte prive di tensioni angolari. Delle tre, quella "a sedia" è la più stabile.<br />
Le molecole aromatiche<br />
Il termine «aromatico» fu usato inizialmente per designare i composti organici dotati di odore<br />
gradevole. Oggi il termine ha piuttosto un significato “strutturale”, poiché con esso si indicando<br />
molecole caratterizzate da un particolare assetto elettronico, che conferisce loro un determinato<br />
comportamento chimico.<br />
Il primo termine di questa famiglia è il benzene, che ha formula molecolare C6H6, con un rapporto C:H<br />
uguale a 1. Il termine aromatico iniziò ad assumere un significato volto piuttosto a descrivere il loro<br />
particolare comportamento chimico, cioè la tendenza a dare reazioni di sostituzione nonostante<br />
l'elevato grado di insaturazione.<br />
Condizione di aromaticità: (4n+2) elettroni π in un sistema ciclico planare<br />
2
Basandosi su calcoli applicati alla meccanica quantistica, Erich Hückel dimostrò che per essere<br />
aromatico un composto deve avere nuvole elettroniche cicliche contenenti 4n+2 elettroni π<br />
delocalizzati (regola di Hückel). La delocalizzazione elettronica in un sistema ciclico non è quindi<br />
condizione sufficiente per l'aromaticità, ma occorre un determinato numero (2, 6, 10, 14, etc.) di<br />
elettroni π. Un'ulteriore condizione di aromaticità è la planarità dell'anello.<br />
Ad esempio, un composto come il cicloottatetraene non può avere carattere aromatico, non solo perché<br />
contiene 8 elettroni π, ma anche perché non può assumere una struttura planare. I dati sperimentali<br />
confermano questa ipotesi.<br />
Effetto dei gruppi sostituenti<br />
Il benzene non dà reazioni di addizione poiché queste lo trasformerebbero in un prodotto meno<br />
stabile, Per questo motivo, il benzene tende a dare piuttosto reazioni di sostituzione. La reazione di<br />
sostituzione elettrofila avviene sostanzialmente con lo stesso meccanismo, indipendentemente dal<br />
sostituente: l'elettrofilo va a sostituire un idrogeno dell'anello che esce come protone.<br />
I gruppi già legati all'anello benzenico ne influenzano la reattività e dirigono l'orientamento di una<br />
successiva sostituzione. In altre parole, quando un elettrofilo attacca l'anello aromatico, è il gruppo già<br />
legato che assume il controllo cinetico della reazione e stabilisce il punto d'attacco del nuovo<br />
sostituente.<br />
Per quanto riguarda la reattività, i gruppi sostituenti si possono classificare in attivanti e disattivanti.<br />
<strong>Gli</strong> attivanti rendono il derivato più reattivo del benzene: hanno questo effetto i gruppi capaci di<br />
"rifornire" di elettroni l'anello (elettrondonatori).<br />
I disattivanti rendono il composto meno reattivo del benzene: hanno questo effetto i gruppi che<br />
impoveriscono di elettroni l'anello (elettronattrattori).<br />
Si tenga presente che i termini “più reattivo” o “meno reattivo” sono sempre riferiti al benzene e<br />
relativamente a reazioni di sostituzione elettrofila. La<br />
• gruppi attivanti sono tutti orto-para orientanti.<br />
• I gruppi disattivanti sono tutti meta orientanti, ad eccezione degli alogeni che sono orto-para<br />
orientanti.<br />
3