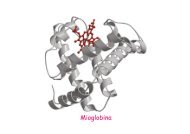
Funzione di adattatore del tRNA
Funzione di adattatore del tRNA
Funzione di adattatore del tRNA
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Funzione</strong> <strong>di</strong><br />
<strong>adattatore</strong><br />
<strong>del</strong> <strong>tRNA</strong><br />
Amminoacido<br />
Siti <strong>di</strong> legame<br />
<strong>del</strong>l’amminoacido<br />
Adattatore<br />
Tripletta <strong>di</strong> nucleoti<strong>di</strong><br />
che co<strong>di</strong>fica un dato<br />
amminoacido
Degenerazione <strong>del</strong> co<strong>di</strong>ce gentico<br />
Amminoacido Numero <strong>di</strong> codoni
Sequenza <strong>di</strong> amminoaci<strong>di</strong><br />
Quadro <strong>di</strong> lettura<br />
Altre sequenze <strong>di</strong> mRNA che<br />
specificano la stessa sequenza <strong>di</strong><br />
amminoaci<strong>di</strong>
Subunità ribosomiali<br />
Polipeptide in<br />
crescita<br />
Direzione <strong>del</strong>la<br />
traduzione<br />
Polisoma
Sintesi proteica<br />
• Attivazione degli amminoaci<strong>di</strong><br />
• Inizio<br />
• Allungamento<br />
• Termine e rilascio<br />
• Ripiegamento e mo<strong>di</strong>ficazioni post-traduzionali
Estremità 3’ <strong>del</strong> <strong>tRNA</strong><br />
Adenina<br />
Attivazione degli<br />
amminoaci<strong>di</strong><br />
A<br />
Amminoacil<strong>tRNA</strong><br />
Gruppo amminoacilico<br />
C<br />
C<br />
Ansa <strong>del</strong>l’amminoacido<br />
Ansa<br />
Ansa D<br />
Ansa <strong>del</strong>l’anticodone<br />
Amminoacil-<strong>tRNA</strong> sintetasi<br />
Amminoacido + <strong>tRNA</strong> + ATP amminoacil-<strong>tRNA</strong> + AMP + PPi
Attivazione degli<br />
amminoaci<strong>di</strong><br />
Amminoacido<br />
Adenina<br />
Adenina<br />
5’-Amminoacil-adenilato<br />
(amminoacil-AMP)<br />
Amminoacil-<strong>tRNA</strong><br />
sintetasi <strong>di</strong> classe I<br />
Amminoacil-<strong>tRNA</strong><br />
sintetasi <strong>di</strong> classe II
Attivazione degli<br />
amminoaci<strong>di</strong>
N-Formilmetionina<br />
Fase<br />
d’inizio
Fase<br />
d’inizio<br />
Subunità 30S<br />
Codone d’inizio<br />
Subunità 50S<br />
Subunità 50S<br />
complesso<br />
d’inizio
Estremità 3’<br />
<strong>del</strong>l’RNA 16S<br />
<strong>del</strong>la subunità<br />
30S<br />
mRNA procariotico con una sequenza consenso <strong>del</strong> tipo Shine-Dalgarno
Fase d’allungamento<br />
1: legame <strong>del</strong>l’amminoacil-<strong>tRNA</strong><br />
Complesso d’inizio<br />
50S (70S)<br />
Codone<br />
d’inizio<br />
Codone successivo<br />
Amminoacil-<strong>tRNA</strong><br />
successivo<br />
Legame<br />
<strong>del</strong>l’amminoacil-<strong>tRNA</strong><br />
successivo
Fase d’allungamento<br />
2: formazione <strong>di</strong> un legame pepti<strong>di</strong>co<br />
Sito E Sito P Sito A<br />
fMet-<strong>tRNA</strong> fMet<br />
Amminoacil-<strong>tRNA</strong> 2<br />
Formazione <strong>del</strong> legame<br />
pepti<strong>di</strong>co<br />
Sito E Sito P Sito A<br />
<strong>tRNA</strong> fMet<br />
deacilato<br />
Dipepti<strong>di</strong>l<strong>tRNA</strong><br />
2
Fase d’allungamento<br />
3: traslocazione<br />
Sito E Sito P Sito A<br />
<strong>tRNA</strong> fMet<br />
deacilato<br />
Dipepti<strong>di</strong>l<strong>tRNA</strong><br />
2<br />
Traslocazione<br />
Sito E Sito P Sito A<br />
Amminoacil-<strong>tRNA</strong> 3<br />
Direzione <strong>del</strong><br />
movimento <strong>del</strong><br />
ribosoma
Terminazione<br />
Legame <strong>del</strong><br />
fattore <strong>di</strong><br />
rilascio<br />
Il legame <strong>del</strong> polipepti<strong>di</strong>l<strong>tRNA</strong><br />
viene idrolizzato<br />
1<br />
Disassociazione dei<br />
componenti<br />
1