Primair centraal zenuwstelsel non-Hodgkin lymfoom
Primair centraal zenuwstelsel non-Hodgkin lymfoom
Primair centraal zenuwstelsel non-Hodgkin lymfoom
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Centraal-<strong>zenuwstelsel</strong>lymfomen<br />
H. Haaxma-Reiche, G.W. van Imhoff, Ph. Poortmans, M.J. van den Bent<br />
5<br />
CZS LYMFOMEN 1
1 <strong>Primair</strong> <strong>centraal</strong> <strong>zenuwstelsel</strong> <strong>non</strong>-<strong>Hodgkin</strong> <strong>lymfoom</strong><br />
5<br />
10<br />
15<br />
20<br />
25<br />
30<br />
1.1 Incidentie en risicofactoren<br />
Het primaire <strong>centraal</strong> <strong>zenuwstelsel</strong> (hersenweefsel, ogen, liquor, zenuwwortels) <strong>non</strong>-<strong>Hodgkin</strong><br />
<strong>lymfoom</strong> (PCZSL) is vrij zeldzaam. Het moet worden onderscheiden van een systemisch <strong>non</strong><br />
<strong>Hodgkin</strong> <strong>lymfoom</strong> met <strong>centraal</strong> <strong>zenuwstelsel</strong> (CZS) disseminatie (in dit geval meestal<br />
meningeaal gelocaliseerd). Een initiële epidurale NHL localisatie behoort er niet toe, maar is<br />
een uiting van een systemisch NHL. PCZSL komt vooral voor bij patiënten tussen de 45 en<br />
70 jaar oud met een mediane leeftijd van ongeveer 60 jaar. Het komt iets meer voor bij<br />
mannen dan bij vrouwen (ratio 1,4-2:1). Ongeveer 1% van alle tumoren van het centrale<br />
<strong>zenuwstelsel</strong> en 1 à 2% van alle <strong>non</strong>-<strong>Hodgkin</strong> lymfomen zijn een PCZSL. De laatste<br />
decennia is het voorkomen van PCZSL sterk gestegen, waarbij dit niet volledig verklaard kan<br />
worden door de toegenomen incidentie van AIDS, of verbetering van diagnostiek. In de<br />
Verenigde Staten is de incidentie ondertussen gestegen tot ruim 5% van alle primaire<br />
<strong>centraal</strong> <strong>zenuwstelsel</strong>tumoren met een risico van 30 per miljoen personen per jaar 1, 2 .<br />
Een hogere incidentie wordt gezien bij patiënten die een aangeboren of verworven<br />
immuundeficiëntie hebben, zoals bij HIV-infecties en patiënten die met immunosuppresiva<br />
worden behandeld (transplantaties, autoimmuunziekten). AIDS-patiënten hebben een risico<br />
van 2-6%. Dit risico neemt echter toe met de duur van de ziekte, terwijl uit obductiemateriaal<br />
(12% PCZSL) blijkt dat de diagnose tijdens het leven lang niet altijd wordt vermoed. Onder<br />
invloed van highly active antiretroviral therapy (HAART) lijkt de incidentie weer af te nemen.<br />
Het risico voor transplantatiepatiënten is het grootst na hart-, long- en levertransplantatie (2-<br />
7%) en het laagst bij niertransplantatie en allogene stamceltransplantatie (1-2%). Bij<br />
congenitale immunodeficiëntie is het risico 4% 3 .<br />
Tenzij uitdrukkelijk anders wordt vermeld, wordt hier verder alleen het PCZSL bij<br />
immunocompetente personen besproken. Gezien de korte prognose van het PCZSL bij AIDS<br />
patiënten en de veelal complexe situatie door andere tegelijkertijd voorkomende<br />
aandoeningen en het gebruik van diverse medicamenten, verdient het aanbeveling het<br />
beleid te individualiseren. Hierbij zullen een AIDS-expert, een hematoloog en een neurooncoloog<br />
betrokken moeten zijn.<br />
35<br />
40<br />
45<br />
50<br />
55<br />
1.2 Klinische presentatie<br />
De symptomatologie van het PCZSL is erg wisselend en afhankelijk van de locatie en de<br />
uitgebreidheid. De klinische presentatie bestaat meestal uit een combinatie van<br />
karakterveranderingen, focale uitval, epilepsie, visusstoornissen en tekenen van intracraniële<br />
drukverhoging. Zowel oculaire (5-25%) als leptomeningeale localisaties (25-40%) komen<br />
frequent voor 4, 5 . Deze kunnen zowel bij presentatie als ten tijde van een recidief optreden.<br />
Het primaire leptomeningeale PCZSL zonder parenchymateuze localisaties blijkt niet<br />
zeldzaam, geschat vormt dit 7% van de PCZSL 6 .<br />
Eventuele visusklachten berusten vaak op een bilaterale maligne lymphomateuze vitreïtis of<br />
uveïtis (IOL, intraoculair <strong>lymfoom</strong>) 7 . Ongeveer 25% van de patiënten met PCZSL heeft ten<br />
tijde van het stellen van de diagnose een (asymptomatische) oculaire manifestatie.<br />
Daarenboven ontwikkelt nog eens meer dan een kwart van de patiënten met PCZSL een IOL<br />
tijdens het ziektebeloop 2, 4 . Omgekeerd ontwikkelt meer dan 80%-90% van de patiënten met<br />
primair IOL later een cerebrale manifestatie. Ook zonder evidente CZS-localisaties moet een<br />
oculair <strong>lymfoom</strong> daarom worden opgevat als een uiting van PCZSL.<br />
Het klinische beloop van een PCZSL kan opmerkelijk zijn. Bekend zijn de snelle, vaak<br />
complete en soms langdurig remissies op corticosteroïden 8 . Door het snelle oncolytisch<br />
effect van steroïden is het starten daarvan voordat histologische verificatie is verkregen<br />
berucht om de interferentie met de diagnostiek van een PCZSL. Bij verdenking op een<br />
PCZSL moet derhalve slechts in het uiterste geval tot het geven van steroïden worden<br />
CZS LYMFOMEN 2
5<br />
besloten. Bij aanwezigheid van uitval is een snelle diagnostische procedure essentieel.<br />
Soms is er een opmerkelijk wisselend beloop met niet aankleurende laesies die aan multiple<br />
sclerose of aan een leuko-encefalopathie doen denken 9, 10 . Hoewel zeldzaam zijn ook<br />
spontane remissies gerapporteerd 11 .<br />
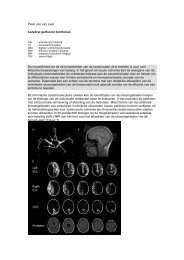
1.3 Neuroradiologie<br />
10<br />
15<br />
20<br />
25<br />
Bij de ongeveer de helft van patiënten is er sprake van een unifocale tumor, bij de overigen<br />
is er sprake van multifocale laesies, en soms van diffuse afwijkingen. Ongeveer de helft van<br />
de tumoren is in een cerebrale hemisfeer gelocaliseerd, in een kwart is er een localisatie in<br />
de basale ganglia. Hersenstam en cerebellaire localisaties zijn zeldzame localisaties. In een<br />
kwart van de gevallen is er contact met het ependym, soms met een uitgesproken<br />
subependymale uitbreiding.<br />
Op de CT-scan zijn de laesies voor contrasttoediening doorgaans isodens of iets hyperdens,<br />
met sterke en vrij egale aankleuring na toediening van contrast. Vaak zijn de randen wat<br />
onscherp 12 .<br />
Bij MRI-onderzoek zijn de afwijkingen op T1-gewogen opnamen iso- of hypointens, met<br />
opnieuw sterke aankleuring met contrast. Op T2 opnames kunnen de afwijkingen zowel<br />
hypo-, iso- als hyperintens zijn 13 . Bij 5-10% van de patiënten komen (voornamelijk) niet<br />
aankleurende laesies voor 13, 14 . Bij immuungecompromiteerden hebben de laesies vaak een<br />
niet aankleurend (necrotisch) centrum 13, 15 .<br />
De MRI- en CT-beelden zijn niet specifiek. Hieruit volgt de volgende differentiële diagnose:<br />
andere primaire hersentumoren, metastasen, toxoplasma, intracraniële inflammatoire<br />
tumoren zonder monoclonale cel proliferatie (zoals bij granulomateuse angiïtis, histiocytosis<br />
of sarcoidose), multiple sclerose, of leukoencefalopathie 16 .<br />
30<br />
35<br />
40<br />
45<br />
50<br />
1.4 Diagnose en stadiëring<br />
De diagnose berust altijd op histologie of minstens cytologie. Corticosteroïden dient men<br />
indien mogelijk pas te starten na cytologisch of histologisch bewijs van het PCZSL, omdat na<br />
het starten van corticosteroïden een zeer snelle en opvallende verbetering van zowel het<br />
klinische beeld als de radiologische afwijkingen kan optreden. In sommige gevallen blijven<br />
de afwijkingen gedurende maanden tot jaren afwezig (“ghost tumor”) waarbij de diagnose<br />
niet meer met zekerheid gesteld kan worden.<br />
De PA-diagnose kan, al naar gelang de presentatie (ligging, uitbreiding en symptomen)<br />
worden gesteld op weefsel van een stereotactisch biopt of op cytologisch onderzoek van<br />
liquor of glasvocht. Bij histologisch onderzoek vrijwel altijd een diffuus grootcellig <strong>non</strong>-<br />
<strong>Hodgkin</strong><strong>lymfoom</strong> van B-cel origine gevonden. Andere subtypes komen zelden voor. Indien bij<br />
liquoronderzoek cytologisch afwijkende cellen of een lymfocytose worden gevonden dient het<br />
onderzoek te worden aangevuld met immunocytologie of flowcytometrie. Het vinden van<br />
cytologisch pathologische cellen met een B-cel immunofenotype dan wel een monoclonale<br />
B-lymfocytose is vrijwel bewijzend voor de aanwezigheid van een B-cel <strong>lymfoom</strong> 17 .<br />
Als minimaal stadiëringsonderzoek zijn essentieel: liquordiagnostiek en oogheelkundig<br />
onderzoek, inclusief spleetlamp onderzoek, zonodig glasvocht cytologie 18 . Gezien de<br />
associatie van HIV met het PCZSL dient HIV-serologie te worden bepaald.<br />
Andere onderzoeken kunnen worden uitgevoerd op indicatie of in het kader van bijvoorbeeld<br />
een trial, maar mogen nooit leiden tot een uitstel van de start van de behandeling. Indien<br />
relevant voor de verdere behandeling zijn op indicatie te overwegen: CT-thorax/-abdomen,<br />
MRI spinale kanaal, beenmergonderzoek. De waarde van deze laatste onderzoeken is<br />
echter beperkt. Het PCZSL is een primaire aandoening van het CZS waarbij bij de primaire<br />
presentatie slechts zelden localisaties elders in het lichaam worden gevonden. In een grote<br />
retrospectieve studie van 128 patiënten werd dit bij slechts 4% van de patiënten<br />
CZS LYMFOMEN 3
5<br />
vastgesteld 19 . Ten tijde van een locaal of locoregionaal CZS-recidief bestaat bij ongeveer<br />
10% van de patiënten uitbreiding naar systemische localisaties 20 .<br />
Het primaire oculaire <strong>lymfoom</strong> dient op dezelfde wijze benaderd te worden, dat wil zeggen:<br />
neurologisch onderzoek en MRI-hersenen, eventueel liquordiagnostiek.<br />
1.5 Prognose<br />
10<br />
Een patiënt met een onbehandeld PCZSL heeft na de diagnose een mediane overleving van<br />
anderhalve maand. De belangrijkste prognostische factoren zijn de leeftijd (gunstiger < 60<br />
jaar); de algemene toestand; de neurologische functiestatus en volgens sommigen ook het<br />
proteïnegehalte in de liquor en het LDH-gehalte in het bloed 21, 22 .<br />
15<br />
20<br />
25<br />
30<br />
35<br />
40<br />
45<br />
50<br />
55<br />
1.6 Therapie<br />
Er bestaan helaas geen goede vergelijkende studies naar de verschillende therapeutische<br />
modaliteiten die bij de behandeling van het PCZSL effectief zijn. De beschikbare gegevens<br />
zijn afkomstige uit (soms vergelijkende) retrospectieve studies, fase II studies en kleine fase<br />
III studies.<br />
De rol van chirurgie beperkt zich tot het verkrijgen van weefsel voor PA-diagnose. Een<br />
uitgebreidere resectie heeft geen therapeutisch meerwaarde.<br />
Bij symptomatische patiënten kan na het verkrijgen van weefsel voor PA gestart worden met<br />
corticosteroïden. Deze hebben naast een anti-oedeem effect ook een direct oncolytisch<br />
effect op <strong>lymfoom</strong>cellen. Corticosteroïden brengen bij een groot deel van de patiënten een<br />
belangrijke symptomatische verbetering teweeg, waarbij ook de radiologische afwijkingen<br />
duidelijk kunnen afnemen en soms zelfs verdwijnen. Bij de meerderheid van de patiënten<br />
treedt na enkele maanden echter opnieuw progressie van het PCZSL op, dan vaak niet meer<br />
reagerend op corticosteroïden.<br />
Radiotherapie van de gehele schedelinhoud leidt meestal tot een zeer goede initiële reactie<br />
met een snelle verbetering van de symptomatologie en van de radiologische afwijkingen.<br />
Daar bij de grote meerderheid van de patiënten gemiddeld binnen 1 jaar een recidief<br />
optreedt ter hoogte van of vlakbij de oorspronkelijke tumorlocalisatie bedraagt de mediane<br />
overleving na radiotherapie toch slechts 15 maanden. Een verhoging van de dosis tot 60 Gy<br />
of het bestralen van de volledige craniospinale as leidt niet tot betere resultaten 23 . Volgens<br />
een retrospectieve studie bleek een dosis reductie van 45 Gy tot 30 Gy tot slechtere<br />
resultaten te leiden 24 .<br />
Uit onderzoek van de talrijke onderzochte chemotherapieschema’s (zowel retrospectief als<br />
prospectief in fase II studies) komt één constante naar voren: intraveneuze chemotherapie<br />
met hoge dosis methotrexaat (HD MTX, minimaal 3 g/m 2 ) met leukovorin-rescue verbetert in<br />
significante mate de kans op een langere overleving ten opzichte van behandeling met<br />
radiotherapie alleen 25-31 . Een mediane overleving van ongeveer 3 jaar werd door meerdere<br />
onderzoekers gepubliceerd na hoge dosis chemotherapie gevolgd door consoliderende<br />
radiotherapie.<br />
De rol van Ara-C en andere cytostatica is veel minder goed gedocumenteerd 32 . Standaard<br />
chemotherapieschema’s als CHOP bleken niet effectief en resulteerden ook in combinatie<br />
met radiotherapie niet tot betere resultaten dan radiotherapie alleen 33-35 .<br />
De rol van intrathecale chemotherapie is onduidelijk. Met intraveneus toegediende HD MTX<br />
of Ara-C worden therapeutische spiegels in de liquor bereikt. Het nut van bijkomende<br />
intrathecale toedieningen van MTX, Ara-C of dexamethason bij het gebruik van deze hoge<br />
doses i.v. is nimmer bewezen 36 .<br />
Onvoldoende onderzocht en derhalve nog experimenteel zijn de combinatie van<br />
chemotherapie met een verstoring van de bloedhersenbarrière, een onderhoudsbehandeling<br />
met chemotherapie, hoge dosis chemotherapie alleen en nieuwere chemotherapeutische en<br />
immunologische agentia 37-39 .<br />
CZS LYMFOMEN 4
5<br />
Bij recidieven na radiotherapie en/of chemotherapie is de prognose over het algemeen<br />
beperkt, waarbij met tweedelijns chemotherapie (experimenteel met hoge dosis en perifere<br />
stamceltransplantatie) of radiotherapie indien nog niet eerder gegeven bij patiënten in een<br />
goede algemene toestand een beperkte overleving bereikt kan worden, met soms<br />
langduriger overleving 39, 40 .<br />
1.7 Late complicaties<br />
10<br />
15<br />
20<br />
Met name bij patiënten die langer overleven kan leukoencefalopathie ontstaan als gevolg<br />
van de oorspronkelijke tumoruitbreiding en/of de therapie. De symptomatologie hiervan kan<br />
erg wisselend zijn, van geringe geheugenstoornissen tot een ernstig dementiëel beeld.<br />
Risicofactoren voor deze late complicaties zijn: hogere leeftijd (>60); slechte neurologische<br />
functie bij diagnose; radiotherapie op de schedelinhoud; hoge dosis MTX gegeven na<br />
radiotherapie en een lange overleving 12, 22, 41 . Patiënten > 60 jaar die radiotherapie hadden<br />
gekregen, toonden in 83% een leukoencefalopathie. Bij patiënten < 60 jaar werd dit slechts<br />
in 6% gezien 25, 42 . Het weglaten van de radiotherapie leidt echter tot een hogere kans op een<br />
recidief.<br />
1.8 Conclusie<br />
Niveau 3<br />
Gezien de onduidelijkheid over de meest optimale behandeling dient deze bij<br />
voorkeur plaats te vinden in het kader van een klinische trial. Anno 2003 is de<br />
behandeling buiten een klinische trial voor patiënten ≤ 60 jaar op HD MTX<br />
gebaseerde chemotherapie gevolgd door radiotherapie tot 40 Gy in fracties van<br />
1,8 Gy op de gehele hersenen. Boven deze leeftijd gaan de late cognitieve<br />
complicaties van deze gecombineerde behandeling sterk wegen. Bij een patiënt<br />
> 60 jaar en in een goede conditie valt een op HD MTX (minimaal 3 g/m 2 )<br />
gebaseerde chemotherapie te overwegen, met weglaten van de radiotherapie<br />
indien een complete reponse op de chemotherapie wordt bereikt. Radiotherapie<br />
is dan geïndiceerd indien chemotherapie onvoldoende effect heeft (geen CR) of<br />
bij het optreden van een laat recidief na chemotherapie alleen. Patiënten die<br />
geen radiotherapie krijgen, hebben echter een hogere recidief kans. Bij<br />
patiënten in een matige conditie maar met behandelingswens kan overwogen<br />
worden alleen een korte serie radiotherapie (5 keer 4 Gy) te geven ( 23-26, 42 ).<br />
25<br />
30<br />
35<br />
40<br />
1.9 Advies<br />
Patiënten met een primair <strong>centraal</strong> <strong>zenuwstelsel</strong> <strong>non</strong>-<strong>Hodgkin</strong> <strong>lymfoom</strong> worden bij voorkeur<br />
in studieverband behandeld.<br />
In geval van een extraprotocollaire behandeling dient op HD MTX (minimaal 3 g/m 2 )<br />
gebaseerde chemotherapie gegeven te worden, gevolgd door radiotherapie op de gehele<br />
hersenen (tot 40 Gy in fracties van 1,8 Gy). De ooglens wordt hierbij buiten het<br />
bestralingsveld gehouden als er geen IOL aangetoond is. Bij patiënten >60 jaar wordt van<br />
radiotherapie afgezien, tenzij met chemotherapie geen complete remissie werd bereikt.<br />
Radiotherapie kan alsnog worden toegepast bij deze patiënten in geval van een laat recidief<br />
na chemotherapie alleen.<br />
Bij patiënten in een matige conditie maar met behandelingswens kan een korte serie<br />
radiotherapie worden gegeven (5 x 4 Gy).<br />
Bij het gebruik van HD chemotherapie is er onvoldoende bewijs om additionele intrathecale<br />
therapie te rechtvaardigen.<br />
CZS LYMFOMEN 5
2 Disseminatie van NHL naar het centrale en perifere <strong>zenuwstelsel</strong><br />
5<br />
10<br />
15<br />
20<br />
2.1 Inleiding<br />
De kans op disseminatie van het NHL naar het <strong>zenuwstelsel</strong> is sterk afhankelijk van het<br />
histologische subtype, primaire localisatie disseminatie en fase van de ziekte. Invasie van<br />
het perifere <strong>zenuwstelsel</strong> (neurolymfomatosis) is erg zeldzaam. De aantasting betreft<br />
meestal de leptomeningen, vaak gelijktijdig met extracraniele tumorprogressie en slechts<br />
sporadisch als initiële manifestatie. Durale localisaties zijn voornamelijk in de sinus<br />
cavernosus te vinden. Intraparenchymateuze haarden (hersenen, ruggenmerg) komen<br />
zeldzaam voor en dan veelal in een vergevorderd stadium van ziekteprogressie. Alhoewel<br />
epidurale localisaties in het wervelkanaal, al dan niet gepaard gaande met ruggenmergcompressie<br />
vaak tot een CZS uitbreiding gerekend worden, zijn deze dit in engere zin niet,<br />
omdat deze localisaties buiten de bloed-hersen/ruggenmerg barrière gelegen zijn. Omdat<br />
voornoemde disseminatievormen in publicaties vaak onvoldoende gescheiden worden, de<br />
meeste publicaties over incidentie en risicofactoren retrospectief en van wat oudere datum<br />
zijn, en intussen de histologische classificatie en de behandeling van het NHL veranderd zijn,<br />
kunnen getallen over incidentie en prognose slechts een algemene indruk weergeven.<br />
2.2 Incidentie en risicofactoren<br />
25<br />
30<br />
35<br />
40<br />
45<br />
50<br />
Voor alle manifestaties van NHL tezamen loopt de incidentie van een CZS-localisatie, solitair<br />
of in het kader van een systemisch recidief uiteen van 2 tot 30% 43-51 . Bij het indolente NHL<br />
komt het slechts sporadisch voor (3-7%), meestal bij transformatie van het <strong>lymfoom</strong> naar een<br />
hogere maligniteitsgraad 51, 52 . Bij de agressieve lymfomen is er een duidelijk verschil tussen<br />
de lymfoblastaire en Burkitt lymfomen met een hoge incidentie tot 30% 51-53 en de overige<br />
agressieve lymfomen met een incidentie rond de 5% 50-54 .<br />
Bij het diffuus grootcellig <strong>lymfoom</strong> zijn in twee onafhankelijk van elkaar geanalyseerde grote<br />
groepen met CHOP behandelde patienten uit Noord-Amerika 54 en Scandinavië 51 bij<br />
multivariate analyses de aanwezigheid van meer dan één extranodale localisatie en/of een<br />
verhoogd LDH als significante risicofactoren voor CZS disseminatie geïdentificeerd. Hoewel<br />
het globale risico op CZS-recidief bij diffuus grootcellig <strong>lymfoom</strong> in deze studies rond de 5%<br />
lag, ging de combinatie van een verhoogd LDH en meer dan één extranodale localisatie<br />
gepaard met een kans van 17% op CZS-recidief 54 . In een analyse van de coöperatieve<br />
Franse <strong>lymfoom</strong> groep (GELA) van 974 patiënten met diffuus grootcellig <strong>lymfoom</strong> behandeld<br />
met intensieve CHOP (ACVBP) gecombineerd met intrathecale MTX-profylaxe per<br />
lumbaalpunctie en intraveneuze hoge dosis MTX als onderdeel van het behandelschema,<br />
werd een incidentie van CZS-recidief van slechts 1,6% gezien. In de multivariate analyse van<br />
deze studie werd naast een relatie met verhoogd LDH en de aanwezigheid van meer dan<br />
één extranodale localisatie ook een relatie met de IPI gevonden voor het risico op een CZS<br />
recidief 55 . Dit bevestigt het al eerder gevonden verband tussen CZS recidief en een hoge IPI<br />
risico score gevonden in de analyse van de HOVON bij patiënten behandeld met CHOP of<br />
CHOP gevolgd door autologe stamceltransplantatie 50 . Verder kan ook localisatie in testis,<br />
met een kans van 15% op CZS disseminatie als risicofactor worden genoemd 56 . In oudere<br />
literatuur worden localisaties in orbita / paranasale sinus 48 , en epidurale localisaties 57 ook wel<br />
genoemd als mogelijke risicofactoren, doch dit is niet sterk onderbouwd en wordt in meer<br />
recente literatuur weerlegd 58, 59 .<br />
2.3 Klinische presentatie<br />
55<br />
Patiënten met leptomeningeale disseminatie tonen wisselende verschijnselen afhankelijk van<br />
de localisatie. Zij kunnen radiculaire pijn hebben en craniale of radiculaire neuropathieën<br />
CZS LYMFOMEN 6
5<br />
10<br />
vertonen. De cauda equina en de basale meningen zijn vaak aangedaan. Focale<br />
uitvalsverschijnselen van de hersenen en het ruggenmerg wijzen op invasie vanuit de<br />
perivasculaire ruimte. Verwardheid kan wijzen op een beginnende obstructieve hydrocefalie.<br />
Bij n.III, n.IV, n.V en n.VI aantasting moet gedacht worden aan tumor in de sinus cavernosus.<br />
Epidurale tumor uitbreiding geeft symptomen afhankelijk van het aangedane niveau. Veelal<br />
is dit een combinatie van radiculaire pijn of uitval en een myelopathie.<br />
Uiteraard is bij de zeldzame infiltratie van een perifere zenuw, de uitval afhankelijk van de<br />
aangedane zenuw(en).<br />
Bij de NHL-patiënten uit de risicogroepen moet men verdacht zijn op de vroege symptomen.<br />
Anderzijds kunnen deze symptomen ook de eerste presentatie zijn van een nog niet bekend<br />
NHL. Paraneoplastische verschijnselen zijn zeldzaam.<br />
15<br />
20<br />
25<br />
2.4 Diagnose<br />
Uitgebreid neurologisch onderzoek levert regelmatig meer laesies op dan uit het<br />
aanvankelijke klachtenpatroon naar voren komt. Voor meningeale disseminatie is<br />
bevestiging door middel van cytologisch onderzoek van de liquor de gouden standaard.<br />
Echter, niet altijd worden zo maligne cellen aangetroffen. Bijdragend voor de diagnose<br />
kunnen dan zijn: verhoogd totaal eiwit, verhoogd aantal witte cellen en monoclonaliteit van<br />
de lymfocyten in de liquor in combinatie met een verdacht klinisch neurologisch beeld en/of<br />
een meningeale aankleuring bij MRI hersenen / spinale kanaal. Uiteraard dienen dan andere<br />
oorzaken zoals (opportunistische) infecties, multiple sclerose en neurosarcoidose uitgesloten<br />
te worden. Bij sterke verdenking en negatieve liquor cytologie moet het liquor onderzoek<br />
herhaald worden.<br />
MRI is het onderzoek van eerste keuze bij epidurale localisaties. Hiermee kan ook een<br />
wervellocalisatie en/of doorgroei van de prevertebrale lymfeklieren worden gediagnosticeerd.<br />
30<br />
35<br />
40<br />
45<br />
2.5 Prognose<br />
Een recidief NHL in het CZS heeft over het algemeen een slechte prognose (mediane<br />
overleving 2,5 - 4 maanden), ondanks ingestelde intrathecale therapie, radiotherapie en<br />
systemische therapie. Kortdurende palliatie van symtomen valt hiermee wel te bereiken. De<br />
overleving is slecht, omdat meningeale disseminatie meestal optreedt in het kader van<br />
actieve ziekte (progressie).<br />
De prognose van een epidurale tumorlocalisatie, zeker als die initieel of vroeg optreedt is<br />
veel beter. Het gaat hier immers om een tumor die buiten de bloed-hersen barrière is<br />
gelegen en als zodanig als systemisch NHL (primaire presentatie of recidief) toegankelijk is<br />
voor chemotherapie en radiotherapie. Dwarslaesie c.q. cauda equina verschijnselen<br />
herstellen na een spoedig ingestelde behandeling vaak zeer goed. Vroege herkenning is<br />
uiterst belangrijk voor een goede functionele uitkomst. De overleving wordt niet ongunstig<br />
beïnvloed door deze localisatie 59 , daarom dienen diegenen met neurologische<br />
restverschijnselen adequate revalidatie te krijgen. Bij een dergelijke manifestatie in het kader<br />
van uitgebreide ziekteprogressie wordt de therapie en zo ook de overleving bepaald door het<br />
totale ziekteproces en de resterende mogelijkheden tot behandeling.<br />
50<br />
55<br />
2.6 Therapie van leptomeningeale disseminatie<br />
Bij een eenmaal vastgestelde leptomeningeale disseminatie dient men zich eerst af te<br />
vragen wat de prognose van de patiënt is. Indien deze naar verwachting slecht is zonder<br />
reële systemische behandelingsopties kan radiotherapie op het symptomatische gebied<br />
worden overwogen met een kort schema. Zijn er systemische behandelingsopties dan heeft<br />
intrathecale chemotherapie in combinatie met systemische chemotherapie de voorkeur.<br />
CZS LYMFOMEN 7
5<br />
10<br />
15<br />
20<br />
25<br />
30<br />
Intrathecale chemotherapie kan worden toegediend door middel van lumbaalpuncties en via<br />
een Ommaya reservoir. Voordelen van het Ommaya reservoir zijn een betere MTX-verdeling<br />
over de liquorruimte 60 , terwijl de toediening voor de patiënt makkelijker is zonder de kans op<br />
onbedoelde epidurale toediening. Nadelen zijn het infectierisico en het mogelijk optreden van<br />
complicaties bij het inbrengen van het Ommaya systeem. Herhaalde lumbaalpuncties<br />
hebben als additioneel risico het optreden van subdurale effusies. Over het totaal aantal te<br />
geven injecties bestaan geen consensus. De initiële dosis is MTX 12,5-15 mg of Ara-C 75-<br />
100 mg.<br />
Therapie-inductie wordt gegeven met MTX of MTX / Ara-C alternerend twee keer per week<br />
tot stabilisatie van het neurologisch beeld en negatieve liquorcytologie. Dit laatste lukt vaak<br />
niet. Het klinisch beeld bepaalt dan het moment van overgang naar een<br />
onderhoudsbehandeling. Onderhoudsbehandeling bestaat vervolgens uit een aantal injecties<br />
in afnemende frequentie bijvoorbeeld: 4 injecties / 1x per week, daarna 4 injecties / 1x per 2<br />
weken, vervolgens 6 injecties / 1x per 4 weken.<br />
Bij te hoge MTX-spiegels in de liquor, moet de MTX-dosis worden aangepast of de<br />
frequentie verlaagd. Intrathecaal toegediend MTX kan leucopenie en mucositis veroorzaken.<br />
Daarom is het te overwegen om bij patiënten die hiervoor at risk zijn leucovorin resue te<br />
geven (oraal, 12,5 mg 12 en 24 uur na de intrathecale injectie). Verder kan intrathecale MTX<br />
en Ara-C een chemische meningitis veroorzaken. Daarom kan gelijktijdig 4 mg<br />
dexamethason worden toegediend.<br />
Op focale tumorlocalisaties kan locale radiotherapie gegeven worden. Als dit cranieel<br />
gebeurt, dient men bedacht te zijn op verhoogde neurotoxiciteit van MTX. Vervanging door<br />
Ara-C is dan aan te bevelen. Zo mogelijk wordt de radiotherapie pas gegeven nadat het<br />
MTX-schema en eventuele systemische chemotherapie is afgewerkt.<br />
Systemische therapie, al dan niet gevolgd door hoge dosis therapie met<br />
stamceltransplantatie bij response kan overwogen worden, afhankelijk van de eerdere<br />
behandelingen en de mogelijkheid nog een systemische tumorremissie te bereiken.<br />
Uitsluitend op het CZS gerichte therapie moet als palliatief worden beschouwd 61, 62 .<br />
Naar de waarde van intraventriculair slow-release Ara-C wordt nog onderzoek gedaan.<br />
2.7 CZS-profylaxe met chemotherapie<br />
35<br />
40<br />
45<br />
50<br />
55<br />
Door het ontbreken van prospectieve studies bestaat hierover geen communis opinio. CZS<br />
profylaxe wordt door de meeste auteurs als een essentieel onderdeel van de<br />
behandelingsstrategie gezien bij het lymfoblastair <strong>lymfoom</strong> (B-cel en T-cel) en het Burkitt<br />
<strong>lymfoom</strong>. Voor de overige agressieve NHL is de waarde moeilijker aan te geven. Diffuus<br />
grootcellig <strong>lymfoom</strong> met een verhoogd LDH in combinatie met multiple extranodale<br />
localisaties komt mogelijk in aanmerking voor profylaxe 51, 54, 55 . CZS profylaxe is geïndiceerd<br />
wanneer de testis is aangedaan 56 . Bij een positief beenmerg werd voorheen voor CZS<br />
profylaxe een indicatie gezien. In meer recente literatuur worden echter wisselende<br />
standpunten ingenomen 50, 54, 63 . Ook over de waarde van de IPI om een keuze te maken<br />
wordt wisselend gedacht 50, 55, 64 . Bij localisatie van een diffuus grootcellig <strong>lymfoom</strong> in de<br />
paranasale sinus of orbita is het risico op CZS-disseminatie bij gecombineerde chemo- en<br />
radiotherapie onvoldoende hoog om CZS-profylaxe aan te bevelen. In een serie van 42 met<br />
gecombineerde chemo- en radiotherapie behandelde patiënten werd slechts 1 patiënt gezien<br />
met CZS-disseminatie. Het betrof hier een locale doorgroei na onvoldoende response op<br />
locale therapie 58 . CZS-profylaxe bij een epiduraal gelocaliseerde tumor lijkt niet nodig 59 .<br />
Indien wordt besloten tot CZS-profylaxe is het ook van belang om aandacht te schenken aan<br />
de keuze van het medicament, het type, het aanvangstijdstip en de frequentie van CZSprofylaxe,<br />
alsmede aan het al dan niet geven van systemische chemotherapie met o.a. hoge<br />
dosis intraveneus MTX en/of Ara-C.<br />
CZS-profylaxe kan gegeven worden als bij ALL, maar het aantal injecties dat zinvol is, staat<br />
niet vast. Ook hier geldt dat er op basis van de literatuur geen voorkeur kan worden<br />
CZS LYMFOMEN 8
5<br />
10<br />
uitgesproken voor toediening via een Ommaya reservoir of via lumbaalpuncties. Bij<br />
lymfoblastaire lymfomen moet gestreefd worden naar vroege toediening van intrathecale<br />
therapie in voldoende hoge frequentie. Een werkzaam schema is bijvoorbeeld: 4 injecties<br />
eenmaal per week, daarna 2 injecties om de 2 weken, gevolgd door 6 injecties om de 4<br />
weken. Bij het Burkitt <strong>lymfoom</strong>, waarbij de systemische therapie over het algemeen<br />
kortdurend is en vaak systemisch hoge dosis MTX en/of Ara-C wordt gegeven, kan het<br />
aantal injecties afhankelijk van het systemische regime meestal worden teruggebracht naar<br />
in totaal 5-6 vroeg in de ziekteperiode.<br />
De dosis van de intrathecale/intraventriculaire MTX is 12,5-15 mg per keer, zonodig op<br />
geleide van spiegels aan te passen. Bij langzame afbraak van MTX of neurotoxiciteit kan dit<br />
vervangen worden door Ara-C (dosis 75-100 mg).<br />
15<br />
20<br />
25<br />
30<br />
2.8 (Late) complicaties<br />
Implantatie van het Ommaya reservoir vereist ervaring van de neurochirurg. Is die aanwezig<br />
dan zijn de risico’s op complicatie door implantatie gering. Voorwaarden zijn thrombocyten<br />
aantal boven 70 x 10 9 /l bij implantatie en daarna gedurende 2 weken >20. Antibiotische<br />
profylaxe is sterk aan te bevelen en kan het beste gestart worden de avond voor implantatie.<br />
Zo kunnen vroege catheterinfecties voorkomen worden.<br />
Tijdens gebruik dient streng aseptisch gewerkt te worden om infecties te voorkomen.<br />
Mochten deze onverhoopt toch ontstaan dan kan het reservoir meestal in situ blijven met<br />
toediening van intraventriculaire en systemische antibiotica. Door de intraventriculaire<br />
behandeling kunnen een aseptische chemische meningitis en myelosuppressie ontstaan.<br />
Leuco-encefalopathie en myelopathie zijn meestal het gevolg van te hoge MTX-spiegels in<br />
de liquor en (locale) bestraling. Door goede MTX-spiegelcontrole, alternerend MTX en Ara-C,<br />
overschakelen naar alleen Ara-C na radiotherapie en het zo mogelijk uitstellen van het<br />
moment van radiotherapie, is dit risico te verminderen. Uiteraard is de interpretatie van de<br />
MTX-spiegel afhankelijk van het aantal dagen dat verstreken is na de injectie. Een<br />
zogenaamd lijstje met ‘veilige waarden’ is ontleend aan Bleyer 65 (zie Bijlage 1).<br />
2.9 Conclusie<br />
35<br />
Niveau 3<br />
Het risico op CZS-disseminatie bij lymfoblastair en Burkitt <strong>lymfoom</strong> is hoog<br />
(30%). Vroegtijdige CZS-profylaxe, hetzij direct gericht op het CZS, hetzij door<br />
middel van hoge dosis intraveneus MTX of Ara-C, kan dit risico aanmerkelijk<br />
terugdringen 51-53 .<br />
Niveau 3 CZS-disseminatie komt voor bij 5% van de overige agressieve NHL 50-54 .<br />
Profylaxe bij deze overige agressieve lymfomen valt te overwegen bij de<br />
volgende risicogroepen:<br />
Niveau 3 • Patiënten met testislocalisatie dienen intrathecale profylaxe te krijgen 56 .<br />
Niveau 3 • Bij patiënten met een combinatie van verhoogd LDH en meerdere<br />
extranodale localisaties kan profylaxe overwogen worden 51, 54, 55 .<br />
Niveau 3<br />
Bij een leptomeningeale of cerebrale localisatie die ontstaat in het kader van<br />
progressie of recidief NHL, is de prognose beperkt 43-57 .<br />
40<br />
2.10 Advies<br />
CZS-profylaxe is geïndiceerd bij patiënten met een lymfoblastair of Burkitt <strong>lymfoom</strong>. Voor de<br />
overige patiënten met een agressief <strong>lymfoom</strong> is CZS-profylaxe te overwegen bij de<br />
CZS LYMFOMEN 9
5<br />
combinatie van een verhoogd LDH en meerdere extranodale localisaties en bij testis<br />
localisaties. Bij die patiënten bij wie CZS profylaxe is geïndiceerd dient men deze vroegtijdig<br />
aan te vangen en adequaat uit te voeren.<br />
Bij CZS-localisaties tijdens systemische progressie blijft vroegtijdige diagnostiek en<br />
behandeling van belang voor een zo goed mogelijk behoud van neurologische functie, welke<br />
ook palliatief van grote waarde is.<br />
Er is geen plaats voor bestraling van de craniospinale as; het gaat hier om een belastende<br />
behandeling, terwijl het levenseinde voor de patiënt veelal nabij is.<br />
10<br />
CZS LYMFOMEN 10
Referenties<br />
5<br />
10<br />
15<br />
20<br />
25<br />
30<br />
35<br />
40<br />
45<br />
50<br />
1. Corn BW, Marcus SM, Topham A, Hauck W, Curran WJ, Jr. Will primary central<br />
nervous system lymphoma be the most frequent brain tumor diagnosed in the year<br />
2000? Cancer 1997; 79:2409-13.<br />
2. Krogh-Jensen M, D'Amore F, Jensen MK, Christensen BE, Thorling K, Pedersen M,<br />
et al. Clinicopathological features, survival and prognostic factors of primary central<br />
nervous system lymphomas: trends in incidence of primary central nervous system<br />
lymphomas and primary malignant brain tumors in a well-defined geographical area.<br />
Population-based data from the Danish Lymphoma Registry, LYFO, and the Danish<br />
Cancer Registry. Leuk Lymphoma 1995; 19:223-33.<br />
3. Huncharek M, Kupelnick B. Epidermal growth factor receptor gene amplification as a<br />
prognostic marker in glioblastoma multiforme: results of a meta-analysis. Oncol Res<br />
2000; 12:107-12.<br />
4. Peterson K, Gordon KB, Heinemann MH, DeAngelis LM. The clinical spectrum of<br />
ocular lymphoma. Cancer 1993; 72:843-9.<br />
5. Balmaceda C, Gaynor JJ, Sun M, Gluck JT, DeAngelis LM. Leptomeningeal tumor in<br />
primary central nervous system lymphoma: recognition, significance, and<br />
implications. Ann Neurol 1995; 38:202-9.<br />
6. Lachance DH, O'Neill BP, Macdonald DR, Jaeckle KA, Witzig TE, Li CY, et al.<br />
Primary leptomeningeal lymphoma: report of 9 cases, diagnosis with<br />
immunocytochemical analysis, and review of the literature. Neurology 1991; 41:95-<br />
100.<br />
7. Matsuo T, Yamaoka A, Shiraga F, Matsuo N. Two types of initial ocular<br />
manifestations in intraocular-central nervous system lymphoma. Retina 1998; 18:301-<br />
7.<br />
8. van den Bent MJ, Vanneste JA, Ansink BJ. Prolonged remission of primary central<br />
nervous system lymphoma after discontinuation of steroid therapy. J Neurooncol<br />
1992; 13:257-9.<br />
9. DeAngelis LM. Primary central nervous system lymphoma imitates multiple sclerosis.<br />
J Neurooncol 1990; 9:177-81.<br />
10. Brecher K, Hochberg FH, Louis DN, de la Monte S, Riskind P. Case report of unusual<br />
leukoencephalopathy preceding primary CNS lymphoma. J Neurol Neurosurg<br />
Psychiatry 1998; 65:917-20.<br />
11. Al-Yamany M, Lozano A, Nag S, Laperriere N, Bernstein M. Spontaneous remission<br />
of primary central nervous system lymphoma: report of 3 cases and discussion of<br />
pathophysiology. J Neurooncol 1999; 42:151-9.<br />
12. Cellerier P, Chiras J, Gray F, Metzger J, Bories J. Computed tomography in primary<br />
lymphoma of the brain. Neuroradiology 1984; 26:485-92.<br />
13. Johnson BA, Fram EK, Johnson PC, Jacobowitz R. The variable MR appearance of<br />
primary lymphoma of the central nervous system: comparison with histopathologic<br />
features. AJNR Am J Neuroradiol 1997; 18:563-72.<br />
14. DeAngelis LM. Cerebral lymphoma presenting as a <strong>non</strong>enhancing lesion on<br />
computed tomographic/magnetic resonance scan. Ann Neurol 1993; 33:308-11.<br />
15. Lanfermann H, Heindel W, Schaper J, Schroder R, Hansmann ML, Lehrke R, et al.<br />
CT and MR imaging in primary cerebral <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma. Acta Radiol 1997;<br />
38:259-67.<br />
16. Postler E, Bornemann A, Skalej M, Krober S, Kaiserling E, Wickboldt J, et al.<br />
Intracranial inflammatory tumors: a survey of their various etiologies by presentation<br />
of 5 cases. J Neurooncol 1999; 43:209-17.<br />
17. Wildemann B, Jansen O, Haas J, Vogt-Schaden ME, Storch-Hagenlocher B. Rapid<br />
distinction of acute demyelinating disorders and central nervous system lymphoma by<br />
molecular analysis of cerebrospinal fluid cells. J Neurol 2001; 248:127-30.<br />
CZS LYMFOMEN 11
5<br />
10<br />
15<br />
20<br />
25<br />
30<br />
35<br />
40<br />
45<br />
50<br />
18. Whitcup SM, de Smet MD, Rubin BI, Palestine AG, Martin DF, Burnier M, Jr., et al.<br />
Intraocular lymphoma. Clinical and histopathologic diagnosis. Ophthalmology 1993;<br />
100:1399-406.<br />
19. O'Neill BP, Dinapoli RP, Kurtin PJ, Habermann TM. Occult systemic <strong>non</strong>-<strong>Hodgkin</strong>'s<br />
lymphoma (NHL) in patients initially diagnosed as primary central nervous system<br />
lymphoma (PCNSL): how much staging is enough? J Neurooncol 1995; 25:67-71.<br />
20. Miller DC, Hochberg FH, Harris NL, Gruber ML, Louis DN, Cohen H. Pathology with<br />
clinical correlations of primary central nervous system <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma. The<br />
Massachusetts General Hospital experience 1958-1989. Cancer 1994; 74:1383-97.<br />
21. Bataille B, Delwail V, Menet E, Vandermarcq P, Ingrand P, Wager M, et al. Primary<br />
intracerebral malignant lymphoma: report of 248 cases. J Neurosurg 2000; 92:261-6.<br />
22. Blay JY, Conroy T, Chevreau C, Thyss A, Quesnel N, Eghbali H, et al. High-dose<br />
methotrexate for the treatment of primary cerebral lymphomas: analysis of survival<br />
and late neurologic toxicity in a retrospective series. J Clin Oncol 1998; 16:864-71.<br />
23. Nelson DF, Martz KL, Bonner H, Nelson JS, Newall J, Kerman HD, et al. Non-<br />
<strong>Hodgkin</strong>'s lymphoma of the brain: can high dose, large volume radiation therapy<br />
improve survival? Report on a prospective trial by the Radiation Therapy Oncology<br />
Group (RTOG): RTOG 8315. Int J Radiat Oncol Biol Phys 1992; 23:9-17.<br />
24. Bessell EM, Lopez-Guillermo A, Villa S, Verger E, Nomdedeu B, Petit J, et al.<br />
Importance of radiotherapy in the outcome of patients with primary CNS lymphoma:<br />
an analysis of the CHOD/BVAM regimen followed by two different radiotherapy<br />
treatments. J Clin Oncol 2002; 20:231-6.<br />
25. Abrey LE, Yahalom J, DeAngelis LM. Treatment for primary CNS lymphoma: the next<br />
step. J Clin Oncol 2000; 18:3144-50.<br />
26. Blay JY, Bouhour D, Carrie C, Bouffet E, Brunat-Mentigny M, Philip T, et al. The C5R<br />
protocol: a regimen of high-dose chemotherapy and radiotherapy in primary cerebral<br />
<strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma of patients with no known cause of immunosuppression.<br />
Blood 1995; 86:2922-9.<br />
27. Brada M, Hjiyiannakis D, Hines F, Traish D, Ashley S. Short intensive primary<br />
chemotherapy and radiotherapy in sporadic primary CNS lymphoma (PCL). Int J<br />
Radiat Oncol Biol Phys 1998; 40:1157-62.<br />
28. Cher L, Glass J, Harsh GR, Hochberg FH. Therapy of primary CNS lymphoma with<br />
methotrexate-based chemotherapy and deferred radiotherapy: preliminary results.<br />
Neurology 1996; 46:1757-9.<br />
29. Glass J, Gruber ML, Cher L, Hochberg FH. Preirradiation methotrexate chemotherapy<br />
of primary central nervous system lymphoma: long-term outcome. J Neurosurg 1994;<br />
81:188-95.<br />
30. O'Brien P, Roos D, Pratt G, Liew K, Barton M, Poulsen M, et al. Phase II multicenter<br />
study of brief single-agent methotrexate followed by irradiation in primary CNS<br />
lymphoma. J Clin Oncol 2000; 18:519-26.<br />
31. Sandor V, Stark-Vancs V, Pearson D, Nussenblat R, Whitcup SM, Brouwers P, et al.<br />
Phase II trial of chemotherapy alone for primary CNS and intraocular lymphoma. J<br />
Clin Oncol 1998; 16:3000-6.<br />
32. O'Neill BP, O'Fallon JR, Earle JD, Colgan JP, Brown LD, Krigel RL. Primary central<br />
nervous system <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma: survival advantages with combined initial<br />
therapy? Int J Radiat Oncol Biol Phys 1995; 33:663-73.<br />
33. Lachance DH, Brizel DM, Gockerman JP, Halperin EC, Burger PC, Boyko OB, et al.<br />
Cyclophosphamide, doxorubicin, vincristine, and prednisone for primary central<br />
nervous system lymphoma: short-duration response and multifocal intracerebral<br />
recurrence preceding radiotherapy. Neurology 1994; 44:1721-7.<br />
34. Mead GM, Bleehen NM, Gregor A, Bullimore J, Shirley D, Rampling RP, et al. A<br />
medical research council randomized trial in patients with primary cerebral <strong>non</strong>-<br />
<strong>Hodgkin</strong> lymphoma: cerebral radiotherapy with and without cyclophosphamide,<br />
doxorubicin, vincristine, and prednisone chemotherapy. Cancer 2000; 89:1359-70.<br />
CZS LYMFOMEN 12
5<br />
10<br />
15<br />
20<br />
25<br />
30<br />
35<br />
40<br />
45<br />
50<br />
35. Schultz C, Scott C, Sherman W, Donahue B, Fields J, Murray K, et al. Preirradiation<br />
chemotherapy with cyclophosphamide, doxorubicin, vincristine, and dexamethasone<br />
for primary CNS lymphomas: initial report of radiation therapy oncology group<br />
protocol 88-06. J Clin Oncol 1996; 14:556-64.<br />
36. Ferreri AJ, Reni M, Villa E. Therapeutic management of primary central nervous<br />
system lymphoma: lessons from prospective trials. Ann Oncol 2000; 11:927-37.<br />
37. Freilich RJ, Delattre JY, Monjour A, DeAngelis LM. Chemotherapy without radiation<br />
therapy as initial treatment for primary CNS lymphoma in older patients. Neurology<br />
1996; 46:435-9.<br />
38. Neuwelt EA, Goldman DL, Dahlborg SA, Crossen J, Ramsey F, Roman-Goldstein S,<br />
et al. Primary CNS lymphoma treated with osmotic blood-brain barrier disruption:<br />
prolonged survival and preservation of cognitive function. J Clin Oncol 1991; 9:1580-<br />
90.<br />
39. Soussain C, Suzan F, Hoang-Xuan K, Cassoux N, Levy V, Azar N, et al. Results of<br />
intensive chemotherapy followed by hematopoietic stem-cell rescue in 22 patients<br />
with refractory or recurrent primary CNS lymphoma or intraocular lymphoma. J Clin<br />
Oncol 2001; 19:742-9.<br />
40. Reni M, Ferreri AJ, Villa E. Second-line treatment for primary central nervous system<br />
lymphoma. Br J Cancer 1999; 79:530-4.<br />
41. Herrlinger U, Schabet M, Brugger W, Kortmann RD, Kanz L, Bamberg M, et al.<br />
Primary central nervous system lymphoma 1991-1997: outcome and late adverse<br />
effects after combined modality treatment. Cancer 2001; 91:130-5.<br />
42. Abrey LE, DeAngelis LM, Yahalom J. Long-term survival in primary CNS lymphoma. J<br />
Clin Oncol 1998; 16:859-63.<br />
43. Litam JP, Cabanillas F, Smith TL, Bodey GP, Freireich EJ. Central nervous system<br />
relapse in malignant lymphomas: risk factors and implications for prophylaxis. Blood<br />
1979; 54:1249-57.<br />
44. Levitt LJ, Dawson DM, Rosenthal DS, Moloney WC. CNS involvement in the <strong>non</strong>-<br />
<strong>Hodgkin</strong>'s lymphomas. Cancer 1980; 45:545-52.<br />
45. Ersboll J, Schultz HB, Thomsen BL, Keiding N, Nissen NI. Meningeal involvement in<br />
<strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma: symptoms, incidence, risk factors and treatment. Scand J<br />
Haematol 1985; 35:487-96.<br />
46. Mead GM, Kennedy P, Smith JL, Thompson J, Macbeth FR, Ryall RD, et al.<br />
Involvement of the central nervous system by <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma in adults. A<br />
review of 36 cases. Q J Med 1986; 60:699-714.<br />
47. Hoerni-Simon G, Suchaud JP, Eghbali H, Coindre JM, Hoerni B. Secondary<br />
involvement of the central nervous system in malignant <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma. A<br />
study of 30 cases in a series of 498 patients. Oncology 1987; 44:98-101.<br />
48. Liang R, Chiu E, Loke SL. Secondary central nervous system involvement by <strong>non</strong>-<br />
<strong>Hodgkin</strong>'s lymphoma: the risk factors. Hematol Oncol 1990; 8:141-5.<br />
49. Keldsen N, Michalski W, Bentzen SM, Hansen KB, Thorling K. Risk factors for central<br />
nervous system involvement in <strong>non</strong>-<strong>Hodgkin</strong>s-lymphoma--a multivariate analysis.<br />
Acta Oncol 1996; 35:703-8.<br />
50. Bos GM, van Putten WL, van der Holt B, van den Bent M, Verdonck LF, Hagenbeek<br />
A. For which patients with aggressive <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma is prophylaxis for<br />
central nervous system disease mandatory? Dutch HOVON Group. Ann Oncol 1998;<br />
9:191-4.<br />
51. Hollender A, Kvaloy S, Nome O, Skovlund E, Lote K, Holte H. Central nervous<br />
system involvement following diagnosis of <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma: a risk model.<br />
Ann Oncol 2002; 13:1099-107.<br />
52. Bollen EL, Brouwer RE, Hamers S, Hermans J, Kluin M, Sankatsing SU, et al. Central<br />
nervous system relapse in <strong>non</strong>-<strong>Hodgkin</strong> lymphoma. A single-center study of 532<br />
patients. Arch Neurol 1997; 54:854-9.<br />
CZS LYMFOMEN 13
5<br />
10<br />
15<br />
20<br />
25<br />
30<br />
35<br />
40<br />
53. Johnson GJ, Oken MM, Anderson JR, O'Connell MJ, Glick JH. Central nervous<br />
system relapse in unfavourable-histology <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma: is prophylaxis<br />
indicated? Lancet 1984; 2:685-7.<br />
54. van Besien K, Ha CS, Murphy S, McLaughlin P, Rodriguez A, Amin K, et al. Risk<br />
factors, treatment, and outcome of central nervous system recurrence in adults with<br />
intermediate-grade and immunoblastic lymphoma. Blood 1998; 91:1178-84.<br />
55. Haioun C, Besson C, Lepage E, Thieblemont C, Simon D, Rose C, et al. Incidence<br />
and risk factors of central nervous system relapse in histologically aggressive <strong>non</strong>-<br />
<strong>Hodgkin</strong>'s lymphoma uniformly treated and receiving intrathecal central nervous<br />
system prophylaxis: a GELA study on 974 patients. Groupe d'Etudes des<br />
Lymphomes de l'Adulte. Ann Oncol 2000; 11:685-90.<br />
56. Zucca E, Conconi A, Mughal TI, Sarris AH, Seymour JF, Vitolo U, et al. Patterns of<br />
outcome and prognostic factors in primary large-cell lymphoma of the testis in a<br />
survey by the International Extranodal Lymphoma Study Group. J Clin Oncol 2003;<br />
21:20-7.<br />
57. MacKintosh FR, Colby TV, Podolsky WJ, Burke JS, Hoppe RT, Rosenfelt FP, et al.<br />
Central nervous system involvement in <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma: an analysis of 105<br />
cases. Cancer 1982; 49:586-95.<br />
58. Logsdon MD, Ha CS, Kavadi VS, Cabanillas F, Hess MA, Cox JD. Lymphoma of the<br />
nasal cavity and paranasal sinuses: improved outcome and altered prognostic factors<br />
with combined modality therapy. Cancer 1997; 80:477-88.<br />
59. McDonald AC, Nicoll JA, Rampling RP. Non-<strong>Hodgkin</strong>'s lymphoma presenting with<br />
spinal cord compression; a clinicopathological review of 25 cases. Eur J Cancer<br />
2000; 36:207-13.<br />
60. Shapiro WR, Young DF, Mehta BM. Methotrexate: distribution in cerebrospinal fluid<br />
after intravenous, ventricular and lumbar injections. N Engl J Med 1975; 293:161-6.<br />
61. van Besien K, Forman A, Champlin R. Central nervous system relapse of lymphoid<br />
malignancies in adults: the role of high-dose chemotherapy. Ann Oncol 1997; 8:515-<br />
24.<br />
62. Paulus JA, Bos GM, Lowenberg B, Van Den Bent MJ. [Treatment results and the<br />
prognosis in patients with localization of <strong>non</strong>-<strong>Hodgkin</strong>s-lymphoma in the central<br />
nervous system]. Ned Tijdschr Geneeskd 1998; 142:2196-200.<br />
63. Tomita N, Kodama F, Sakai R, Koharasawa H, Hattori M, Taguchi J, et al. Predictive<br />
factors for central nervous system involvement in <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma:<br />
significance of very high serum LDH concentrations. Leuk Lymphoma 2000; 38:335-<br />
43.<br />
64. Chua SL, Seymour JF, Streater J, Wolf MM, Januszewicz EH, Prince HM. Intrathecal<br />
chemotherapy alone is inadequate central nervous system prophylaxis in patients<br />
with intermediate-grade <strong>non</strong>-<strong>Hodgkin</strong>'s lymphoma. Leuk Lymphoma 2002; 43:1783-8.<br />
65. Bleyer WA, Dedrick RL. Clinical pharmacology of intrathecal methotrexate. I.<br />
Pharmacokinetics in <strong>non</strong>toxic patients after lumbar injection. Cancer Treat Rep 1977;<br />
61:703-8.<br />
CZS LYMFOMEN 14
Bijlage 1<br />
Liquor MTX spiegels “zonder neurotoxiciteit” na intrathecale/intraventriculaire toediening<br />
5<br />
Dag 2 1.7 x 10 -7 M ≅ 75.3 µg/L<br />
3 3.4 x 10 -8 15.1<br />
4 8.6 x 10 -9 3.8<br />
5 5.7 x 10 -9 2.5<br />
6 1.4 x 10 -9 0.6<br />
CZS LYMFOMEN 15