Avaliação Bimestral de Ciências - Colegioiesp.com.br
Avaliação Bimestral de Ciências - Colegioiesp.com.br
Avaliação Bimestral de Ciências - Colegioiesp.com.br
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
AVALIAÇÃO: Exercícios <strong>de</strong> Recuperação COMP. CURRICULAR: QUÍMICA<<strong>br</strong> />
NOME: Nº. SÉRIE: 1 EM A / B<<strong>br</strong> />
PROFESSOR: Flávio DATA: VALOR: 2,0 NOTA:<<strong>br</strong> />
TEXTO PARA A PRÓXIMA QUESTÃO<<strong>br</strong> />
A produção <strong>de</strong> energia nas usinas <strong>de</strong> Angra 1 e Angra 2 é baseada na fissão nuclear <strong>de</strong> átomos <strong>de</strong> urânio radioativo £¤©U. O<<strong>br</strong> />
urânio é obtido a partir <strong>de</strong> jazidas minerais, na região <strong>de</strong> Caetité, localizada na Bahia, on<strong>de</strong> é beneficiado até a obtenção <strong>de</strong><<strong>br</strong> />
um concentrado <strong>br</strong>uto <strong>de</strong> UƒOˆ, também chamado <strong>de</strong> "yellowcake".<<strong>br</strong> />
O concentrado <strong>br</strong>uto <strong>de</strong> urânio é processado através <strong>de</strong> uma série <strong>de</strong> etapas até chegar ao hexafluoreto <strong>de</strong> urânio,<<strong>br</strong> />
<strong>com</strong>posto que será submetido ao processo final <strong>de</strong> enriquecimento no isótopo radioativo £¤©U, conforme o esquema a seguir.<<strong>br</strong> />
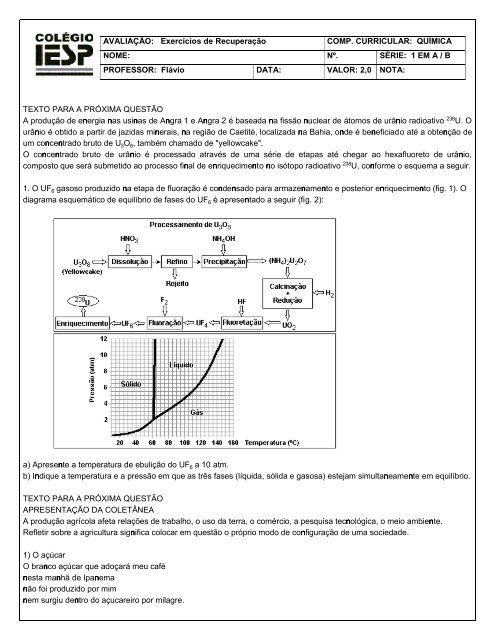
1. O UF† gasoso produzido na etapa <strong>de</strong> fluoração é con<strong>de</strong>nsado para armazenamento e posterior enriquecimento (fig. 1). O<<strong>br</strong> />
diagrama esquemático <strong>de</strong> equilí<strong>br</strong>io <strong>de</strong> fases do UF† é apresentado a seguir (fig. 2):<<strong>br</strong> />
a) Apresente a temperatura <strong>de</strong> ebulição do UF† a 10 atm.<<strong>br</strong> />
b) Indique a temperatura e a pressão em que as três fases (líquida, sólida e gasosa) estejam simultaneamente em equilí<strong>br</strong>io.<<strong>br</strong> />
TEXTO PARA A PRÓXIMA QUESTÃO<<strong>br</strong> />
APRESENTAÇÃO DA COLETÂNEA<<strong>br</strong> />
A produção agrícola afeta relações <strong>de</strong> trabalho, o uso da terra, o <strong>com</strong>ércio, a pesquisa tecnológica, o meio ambiente.<<strong>br</strong> />
Refletir so<strong>br</strong>e a agricultura significa colocar em questão o próprio modo <strong>de</strong> configuração <strong>de</strong> uma socieda<strong>de</strong>.<<strong>br</strong> />
1) O açúcar<<strong>br</strong> />
O <strong>br</strong>anco açúcar que adoçará meu café<<strong>br</strong> />
nesta manhã <strong>de</strong> Ipanema<<strong>br</strong> />
não foi produzido por mim<<strong>br</strong> />
nem surgiu <strong>de</strong>ntro do açucareiro por milagre.
Vejo-o puro<<strong>br</strong> />
e afável ao paladar<<strong>br</strong> />
<strong>com</strong>o beijo <strong>de</strong> moça, água<<strong>br</strong> />
na pele, flor<<strong>br</strong> />
que se dissolve na boca. Mas este açúcar<<strong>br</strong> />
não foi feito por mim.<<strong>br</strong> />
Este açúcar veio<<strong>br</strong> />
da mercearia da esquina e tampouco o fez o Oliveira,<<strong>br</strong> />
dono da mercearia.<<strong>br</strong> />
Este açúcar veio<<strong>br</strong> />
<strong>de</strong> uma usina <strong>de</strong> açúcar em Pernambuco<<strong>br</strong> />
ou no Estado do Rio<<strong>br</strong> />
e tampouco o fez o dono da usina.<<strong>br</strong> />
Este açúcar era cana<<strong>br</strong> />
e veio dos canaviais extensos<<strong>br</strong> />
que não nascem por acaso<<strong>br</strong> />
no regaço do vale.<<strong>br</strong> />
Em lugares distantes, on<strong>de</strong> não há hospital<<strong>br</strong> />
nem escola,<<strong>br</strong> />
homens que não sabem ler e morrem <strong>de</strong> fome<<strong>br</strong> />
aos 27 anos<<strong>br</strong> />
plantaram e colheram a cana<<strong>br</strong> />
que viraria açúcar.<<strong>br</strong> />
Em usinas escuras,<<strong>br</strong> />
homens <strong>de</strong> vida amarga<<strong>br</strong> />
e dura<<strong>br</strong> />
produziram este açúcar<<strong>br</strong> />
<strong>br</strong>anco e puro<<strong>br</strong> />
<strong>com</strong> que adoço meu café esta manhã em<<strong>br</strong> />
Ipanema.<<strong>br</strong> />
(Ferreira Gullar, "Dentro da noite veloz". Rio <strong>de</strong> Janeiro: Civilização Brasileira, 1975, p. 44, 45.)<<strong>br</strong> />
2) Se eu pu<strong>de</strong>sse alguma coisa <strong>com</strong> Deus, lhe rogaria quisesse dar muita geada anualmente nas terras <strong>de</strong> serra acima,<<strong>br</strong> />
on<strong>de</strong> se faz o açúcar; porque a cultura da cana tem sido muito prejudicial aos povos: 1¡-) porque tem abandonado ou<<strong>br</strong> />
diminuído a cultura do milho e do feijão e a criação dos porcos; estes gêneros têm encarecido, assim <strong>com</strong>o a cultura <strong>de</strong><<strong>br</strong> />
trigo, e do algodão e azeite <strong>de</strong> mamona; 2¡-) porque tem introduzido muita escravatura, o que empo<strong>br</strong>ece os lavradores,<<strong>br</strong> />
corrompe os contumes e leva ao <strong>de</strong>sprezo pelo trabalho <strong>de</strong> enxada; 3¡-) porque tem <strong>de</strong>vastado as belas matas e reduzido a<<strong>br</strong> />
taperas muitas herda<strong>de</strong>s; 4¡-) porque rouba muitos <strong>br</strong>aços à agricultura, que se empregam no carreto dos africanos; 5¡-)<<strong>br</strong> />
porque exige gran<strong>de</strong> número <strong>de</strong> bestas muares que não procriam e que consomem muito milho; 6¡-) porque diminuiria a<<strong>br</strong> />
feitura da cachaça, que tão prejudicial é do moral e físico dos moradores do campo.<<strong>br</strong> />
(Adaptado <strong>de</strong> José Bonifácio <strong>de</strong> Andrada e Silva [1763- -1838], "Projetos para o Brasil". São Paulo: Companhia das<<strong>br</strong> />
Letras, 1998, p. 181, 182.)<<strong>br</strong> />
3) Uma parceria entre órgãos públicos e iniciativa privada prevê o fornecimento <strong>de</strong> oleoginosas produzidas em<<strong>br</strong> />
assentamentos rurais paulistas para a fa<strong>br</strong>icação <strong>de</strong> biodiesel. De um lado, a parceria proporcionará aos assentados uma<<strong>br</strong> />
nova fonte <strong>de</strong> renda. De outro, facilitará o cumprimento da exigência do programa nacional <strong>de</strong> biodiesel que estabelece que,
no Estado <strong>de</strong> São Paulo, 30 % das oleaginosas para a produção <strong>de</strong> biodiesel sejam provenientes da agricultura familiar,<<strong>br</strong> />
para que as indústrias tenham acesso à redução dos impostos fe<strong>de</strong>rais.<<strong>br</strong> />
(Adaptado <strong>de</strong> Alessandra Nogueira, "Alternativa para os assentamentos". Energia Brasileira, n¡- 3, jun. 2006, p. 63.)<<strong>br</strong> />
4) Parece que os orixás da Bahia já previam. O mesmo <strong>de</strong>ndê que ferve a moqueca e frita o acarajé po<strong>de</strong> também mover os<<strong>br</strong> />
trios elétricos no Carnaval. O biotrio, trio elétrico <strong>de</strong> última geração, movido a biodiesel, conquista o folião e atrai a atenção<<strong>br</strong> />
<strong>de</strong> investidores. Se aproveitarem a dica dos biotrios e usarem biodiesel, os sistemas <strong>de</strong> transporte coletivo dos centros<<strong>br</strong> />
urbanos transferirão recursos que hoje financiam o petrodiesel para as lavouras das plantas oleaginosas, ajudando a<<strong>br</strong> />
<strong>de</strong>spoluir as cida<strong>de</strong>s. A auto-suficiência em petróleo, meta conquistada, é menos importante hoje do que foi no passado. O<<strong>br</strong> />
<strong>de</strong>safio agora é gerar exce<strong>de</strong>ntes para exportar energias renováveis por meio <strong>de</strong> econegócios que melhorem a qualida<strong>de</strong> do<<strong>br</strong> />
ambiente urbano, <strong>com</strong> ocupação e geração <strong>de</strong> renda no campo, alimentando as economias rurais e redistribuindo riquezas.<<strong>br</strong> />
(Adaptado <strong>de</strong> Eduardo Athay<strong>de</strong>, "Biodiesel no Carnaval da Bahia". Folha <strong>de</strong> S. Paulo, 28/02/2006, p. A3.)<<strong>br</strong> />
5) Especialistas dizem que, nos EUA, <strong>com</strong> o aumento dos preços do petróleo, os agricultores estão dirigindo uma parte<<strong>br</strong> />
maior <strong>de</strong> suas colheitas para a produção <strong>de</strong> <strong>com</strong>bustível do que para alimentos ou rações animais. A nova estimativa<<strong>br</strong> />
salienta a crescente concorrência entre alimentos e <strong>com</strong>bustível, que po<strong>de</strong>rá colocar os ricos motoristas <strong>de</strong> carros do<<strong>br</strong> />
Oci<strong>de</strong>nte contra os consumidores famintos nos países em <strong>de</strong>senvolvimento.<<strong>br</strong> />
(Adaptado <strong>de</strong> "Menos milho, mais etanol". Energia Brasileira, n¡- 3, jun. 2006, p. 39.)<<strong>br</strong> />
6) O agronegócio respon<strong>de</strong> por um terço do PIB, 42 % das exportações e 37 % dos empregos. Com clima privilegiado, solo<<strong>br</strong> />
fértil, disponibilida<strong>de</strong> <strong>de</strong> água, rica biodiversida<strong>de</strong> e mão-<strong>de</strong>-o<strong>br</strong>a qualificada, o Brasil é capaz <strong>de</strong> colher até duas safras<<strong>br</strong> />
anuais <strong>de</strong> grãos. As palavras são do Ministério da Agricultura e correspon<strong>de</strong>m aos fatos. Essa é, no entanto, apenas meta<strong>de</strong><<strong>br</strong> />
da história. Há uma série <strong>de</strong> questões pouco <strong>de</strong>batidas: Como se distribui a riqueza gerada no campo? Que impactos o<<strong>br</strong> />
agronegócio causa na socieda<strong>de</strong>, na forma <strong>de</strong> <strong>de</strong>semprego, concentração <strong>de</strong> renda e po<strong>de</strong>r, êxodo rural, contaminação da<<strong>br</strong> />
água e do solo e <strong>de</strong>struição <strong>de</strong> biomas? Quanto tempo essa bonança vai durar, tendo em vista a exaustão dos recursos<<strong>br</strong> />
naturais? O <strong>de</strong>scuido socioambiental vai servir <strong>de</strong> argumento para a criação <strong>de</strong> barreiras não-tarifárias, <strong>com</strong>o a que vivemos<<strong>br</strong> />
<strong>com</strong> a China na questão da soja contaminada por agrotóxicos?<<strong>br</strong> />
(Adaptado <strong>de</strong> Amália Safatle e Flávia Pardini, "Grãos na Balança". Carta Capital, 01/09/2004, p. 42.)<<strong>br</strong> />
7) No que diz respeito à política <strong>de</strong> <strong>com</strong>ércio internacional da produção agrícola, não basta batalhar pela redução <strong>de</strong> tarifas<<strong>br</strong> />
aduaneiras e pela diminuição <strong>de</strong> subsídios concedidos aos produtores e exportadores no mundo rico. Também não basta<<strong>br</strong> />
<strong>com</strong>bater o protecionismo disfarçado pelo excesso <strong>de</strong> normas sanitárias. Este problema é real, mas, se for superado, ainda<<strong>br</strong> />
restarão regras <strong>de</strong> fiscalização perfeitamente razoáveis e necessárias a todos os países. O Brasil não está apenas atrasado<<strong>br</strong> />
em seu sistema <strong>de</strong> controle sanitário, em relação às normas em vigor nos países mais <strong>de</strong>senvolvidos. A <strong>de</strong>ficiência, neste<<strong>br</strong> />
momento, é mais grave. Houve um retrocesso em relação aos padrões alcançados há alguns anos e a economia <strong>br</strong>asileira<<strong>br</strong> />
já está sendo punida por isso.<<strong>br</strong> />
(Adaptado <strong>de</strong> "Nem tudo é protecionismo". O Estado <strong>de</strong> S. Paulo, 14/07/2006, p. B14.)<<strong>br</strong> />
8) A marcha para o oeste nos Estados Unidos, no século XIX, só se tornou realida<strong>de</strong> <strong>de</strong>pois da popularização do arado <strong>de</strong><<strong>br</strong> />
aço, por volta <strong>de</strong> 1830. A partir do momento em que o solo duro pô<strong>de</strong> ser arado, a região se tornou uma das mais produtivas<<strong>br</strong> />
do mundo. No Brasil, o <strong>de</strong>s<strong>br</strong>avamento do Centro-Oeste, no século XX, também foi resultado da tecnologia. Os primeiros<<strong>br</strong> />
agricultores do cerrado per<strong>de</strong>ram quase todo o investimento porque suas sementes não vingavam no solo da região.<<strong>br</strong> />
Johanna Dobereiner <strong>de</strong>sco<strong>br</strong>iu que bactérias po<strong>de</strong>riam ser utilizadas para diminuir a necessida<strong>de</strong> <strong>de</strong> gastos <strong>com</strong> adubos<<strong>br</strong> />
químicos. A <strong>de</strong>scoberta permitiu a expansão <strong>de</strong> culturas subtropicais em direção ao Equador.<<strong>br</strong> />
(Adaptado <strong>de</strong> Eduardo Salgado, "Tecnologia a serviço do <strong>de</strong>s<strong>br</strong>avamento". Veja, 29/09/2004, p. 100.)<<strong>br</strong> />
9) Devido às pressões <strong>de</strong> fazen<strong>de</strong>iros do Meio-Oeste e <strong>de</strong> empresas do setor agrícola que querem proteger o etanol norteamericano,<<strong>br</strong> />
produzido <strong>com</strong> base no milho, contra a <strong>com</strong>petição do álcool <strong>br</strong>asileiro à base <strong>de</strong> açúcar, os Estados Unidos<<strong>br</strong> />
impuseram uma tarifa (US$ 0,14 por litro) que inviabiliza a importação do produto <strong>br</strong>asileiro. E o fizeram mesmo que o etanol<<strong>br</strong> />
à base <strong>de</strong> açúcar <strong>br</strong>asileiro produza oito vezes mais energia do que o <strong>com</strong>bustível fóssil utilizado em sua produção,<<strong>br</strong> />
enquanto o etanol <strong>de</strong> milho norte-americano só produz 130 % mais energia do que sua produção consome. Eles o fizeram
mesmo que o etanol à base <strong>de</strong> açúcar reduza mais as emissões dos gases responsáveis pelo efeito estufa do que o etanol<<strong>br</strong> />
<strong>de</strong> milho. E o fizeram mesmo que o etanol à base <strong>de</strong> cana-<strong>de</strong>-açúcar pu<strong>de</strong>sse facilmente ser produzido nos países tropicais<<strong>br</strong> />
po<strong>br</strong>es da África e do Caribe e talvez ajudar a reduzir sua po<strong>br</strong>eza.<<strong>br</strong> />
(Adaptado <strong>de</strong> Thomas Friedman, "Tão burros quanto quisermos". Folha <strong>de</strong> S. Paulo, 21/09/2006, p. B2.)<<strong>br</strong> />
2. O poema apresentado na coletânea faz alusão ao açúcar da cana. A preocupação do poeta não é <strong>com</strong> a química, embora<<strong>br</strong> />
passagens do poema possam permitir alguma leitura nessa área. Nas questões a serem respondidas, serão citadas<<strong>br</strong> />
algumas passagens do poema, que, sugerimos, seja lido no todo para facilitar as respostas.<<strong>br</strong> />
a) No início o poeta fala em "<strong>br</strong>anco açúcar" e <strong>de</strong>pois usa "vejo-o puro". Justifique, sob um ponto <strong>de</strong> vista químico, por que<<strong>br</strong> />
nem sempre é apropriado associar as palavras "<strong>br</strong>anco" e "puro".<<strong>br</strong> />
b) Mais à frente, o poeta usa a construção: "flor que dissolve na boca". Se essa frase fosse usada por um químico, <strong>com</strong>o ele<<strong>br</strong> />
justificaria, através <strong>de</strong> interações intermoleculares, o processo mencionado?<<strong>br</strong> />
c) Quase ao final, o poeta usa a expressão: "plantaram e colheram a cana que viraria açúcar". Se um químico estivesse<<strong>br</strong> />
usando essa frase numa explanação so<strong>br</strong>e o processo <strong>de</strong> fa<strong>br</strong>icação do açúcar, muito provavelmente ele colocaria, após a<<strong>br</strong> />
palavra "cana", uma seqüência <strong>de</strong> termos técnicos para <strong>de</strong>screver o processo <strong>de</strong> obtenção do açúcar, e eliminaria as<<strong>br</strong> />
palavras "que viraria açúcar". A seguir são listados os termos que o químico usaria. Coloque-os (todos) na seqüência certa<<strong>br</strong> />
que o químico usaria ao <strong>de</strong>screver a produção do açúcar, reescrevendo a frase <strong>com</strong>pleta: SECARAM-NO, CRISTALIZARAM<<strong>br</strong> />
O AÇUCAR, ENSACANDO-O, CONCENTRARAM O CALDO, MOERAM-NA, CENTRIFUGARAM-NO.<<strong>br</strong> />
TEXTO PARA A PRÓXIMA QUESTÃO<<strong>br</strong> />
Vivemos em uma época notável. Os avanços da ciência e da tecnologia nos possibilitam enten<strong>de</strong>r melhor o planeta em que<<strong>br</strong> />
vivemos. Contudo, apesar dos volumosos investimentos e do enorme esforço em pesquisa, a Terra ainda permanece<<strong>br</strong> />
misteriosa. O entendimento <strong>de</strong>sse sistema multifacetado, físico-químico-biológico, que se modifica ao longo do tempo, po<strong>de</strong><<strong>br</strong> />
ser <strong>com</strong>parado a um enorme que<strong>br</strong>a-cabeças. Para entendê-lo, é necessário conhecer suas partes e associá-las. Des<strong>de</strong><<strong>br</strong> />
fenômenos inorgânicos até os intrincados e sutis processos biológicos, o nosso <strong>de</strong>sconhecimento ainda é enorme. Há muito<<strong>br</strong> />
o que apren<strong>de</strong>r. Há muito trabalho a fazer. Nesta prova, vamos fazer um pequeno ensaio na direção do entendimento do<<strong>br</strong> />
nosso planeta, a Terra, da qual <strong>de</strong>pen<strong>de</strong> a nossa vida.
3. A figura a seguir representa o ciclo da água na Terra. Nela estão representados processos naturais que a água sofre em<<strong>br</strong> />
seu ciclo.<<strong>br</strong> />
Com base no <strong>de</strong>senho, faça o que se pe<strong>de</strong>:<<strong>br</strong> />
a) Consi<strong>de</strong>rando que as nuvens são formadas por minúsculas gotículas <strong>de</strong> água, que mudança(s) <strong>de</strong> estado físico ocorre(m)<<strong>br</strong> />
no processo 1?<<strong>br</strong> />
b) Quando o processo 1 está ocorrendo, qual o principal tipo <strong>de</strong> ligação que está sendo rompido/formado na água?<<strong>br</strong> />
c) Cite pelo menos um <strong>de</strong>sses processos (<strong>de</strong> 1 a 6) que, apesar <strong>de</strong> ser <strong>de</strong> pequena intensida<strong>de</strong>, ocorre no sul do Brasil.<<strong>br</strong> />
Qual o nome da mudança <strong>de</strong> estado físico envolvida nesse processo?<<strong>br</strong> />
4. Consi<strong>de</strong>re o esquema a seguir que mostra uma ca<strong>de</strong>ia <strong>de</strong> produção <strong>de</strong> <strong>de</strong>rivados do petróleo e seus processos <strong>de</strong><<strong>br</strong> />
separação, representados em I, II e III, e responda ao que se pe<strong>de</strong>.<<strong>br</strong> />
a) Qual o método a<strong>de</strong>quado para a separação dos <strong>com</strong>ponentes da mistura obtida após o processo <strong>de</strong> separação III?<<strong>br</strong> />
Admitindo não existir gran<strong>de</strong>s diferenças entre as temperaturas <strong>de</strong> ebulição dos <strong>com</strong>ponentes individuais da mistura,<<strong>br</strong> />
explique sua resposta.<<strong>br</strong> />
b) Qual método <strong>de</strong> separação seria a<strong>de</strong>quado à etapa I? Justifique sua resposta.
5. Qual o estado físico (sólido, líquido ou gasoso) das substâncias da tabela a seguir, quando as mesmas se encontram no<<strong>br</strong> />
Deserto da Arábia, à temperatura <strong>de</strong> 50 °C (pressão ambiente = 1atm)?<<strong>br</strong> />
6. A figura adiante mostra o esquema <strong>de</strong> um processo usado para a obtenção <strong>de</strong> água potável a partir <strong>de</strong> água salo<strong>br</strong>a (que<<strong>br</strong> />
contém alta concentração <strong>de</strong> sais). Este "aparelho" improvisado é usado em regiões <strong>de</strong>sérticas da Austrália.<<strong>br</strong> />
a) Que mudanças <strong>de</strong> estado ocorrem <strong>com</strong> a água, <strong>de</strong>ntro do "aparelho"?<<strong>br</strong> />
b) On<strong>de</strong>, <strong>de</strong>ntro do "aparelho", ocorrem estas mudanças?<<strong>br</strong> />
c) Qual <strong>de</strong>stas mudanças absorve energia e <strong>de</strong> on<strong>de</strong> esta energia provém?
7. Dois béqueres iguais, <strong>de</strong> capacida<strong>de</strong> calorífica <strong>de</strong>sprezível, contendo quantida<strong>de</strong>s diferentes <strong>de</strong> água pura a 25°C, foram<<strong>br</strong> />
aquecidos, sob pressão constante <strong>de</strong> 1atm, em uma mesma chama. A temperatura da água em cada béquer foi medida em<<strong>br</strong> />
função do tempo <strong>de</strong> aquecimento, durante 20 minutos. Após esse tempo, ambos os béqueres continham expressivas<<strong>br</strong> />
quantida<strong>de</strong>s <strong>de</strong> água. Os resultados encontrados estão registrados nos gráficos a seguir.<<strong>br</strong> />
1- INDIQUE o valor das temperaturas TÛ e T½. JUSTIFIQUE sua resposta.<<strong>br</strong> />
2- INDIQUE o béquer que contém maior quantida<strong>de</strong> <strong>de</strong> água. JUSTIFIQUE sua resposta.<<strong>br</strong> />
3- CALCULE a massa <strong>de</strong> água no béquer B, caso o béquer A contenha 200g <strong>de</strong> água.<<strong>br</strong> />
INDIQUE seu cálculo.<<strong>br</strong> />
4- INDIQUE qual dos dois gráficos apresentaria um patamar maior se a temperatura dos béqueres continuasse a ser<<strong>br</strong> />
anotada até a vaporização total da água. JUSTIFIQUE sua resposta.<<strong>br</strong> />
8. Consi<strong>de</strong>re quatro garrafas térmicas contendo:<<strong>br</strong> />
Garrafa 1: 20 gramas <strong>de</strong> água líquida e 80 gramas <strong>de</strong> gelo picado.<<strong>br</strong> />
Garrafa 2: 70 gramas <strong>de</strong> solução aquosa 0,5 mol dm¤ em sacarose e 30 gramas <strong>de</strong> gelo picado.<<strong>br</strong> />
Garrafa 3: 50 gramas <strong>de</strong> água líquida e 50 gramas <strong>de</strong> gelo picado.<<strong>br</strong> />
Garrafa 4: 70 gramas <strong>de</strong> solução aquosa 0,5 mol dm¤ em NaCØ e 30 gramas <strong>de</strong> gelo picado.<<strong>br</strong> />
O conteúdo <strong>de</strong> cada garrafa está em equilí<strong>br</strong>io térmico, isto é, em cada caso a temperatura do sólido é igual à do líquido.<<strong>br</strong> />
a) Consi<strong>de</strong>re que as temperaturas T , T‚, Tƒ e T„ correspon<strong>de</strong>m, respectivamente, às garrafas 1, 2, 3 e 4. Or<strong>de</strong>ne essas<<strong>br</strong> />
temperaturas <strong>de</strong> maneira crescente usando os símbolos a<strong>de</strong>quados <strong>de</strong>ntre os seguintes: >,
10. Um copo aberto, exposto à atmosfera, contém água sólida em contato <strong>com</strong> água líquida em equilí<strong>br</strong>io termodinâmico. A<<strong>br</strong> />
temperatura e pressão ambientes são mantidas constantes e iguais, respectivamente, a 25°C e 1atm. Com o <strong>de</strong>correr do<<strong>br</strong> />
tempo, e enquanto as duas fases estiverem presentes, é ERRADO afirmar que<<strong>br</strong> />
a) a temperatura do conteúdo do copo permanecerá constante e igual a aproximadamente 0°C.<<strong>br</strong> />
b) a massa da fase sólida diminuirá.<<strong>br</strong> />
c) a pressão <strong>de</strong> vapor da fase líquida permanecerá constante.<<strong>br</strong> />
d) a concentração (mol/L) <strong>de</strong> água na fase líquida será igual à da fase sólida.<<strong>br</strong> />
e) a massa do conteúdo do copo diminuirá.<<strong>br</strong> />
Justificar por que cada uma das opções D e E da questão está CORRETA ou ERRADA.<<strong>br</strong> />
11. Explique por que água pura exposta à atmosfera e sob pressão <strong>de</strong> 1,0 atm entra em ebulição em uma temperatura <strong>de</strong><<strong>br</strong> />
100°C, enquanto água pura exposta à pressão atmosférica <strong>de</strong> 0,7 atm entra em ebulição em uma temperatura <strong>de</strong> 90°C.<<strong>br</strong> />
12. Um dos critérios utilizados pelos químicos para classificar as substâncias leva em consi<strong>de</strong>ração, principalmente, o tipo<<strong>br</strong> />
<strong>de</strong> elemento e o número <strong>de</strong> átomos <strong>de</strong>sse elemento. Muitas proprieda<strong>de</strong>s são <strong>de</strong>correntes <strong>de</strong>ssas <strong>com</strong>binações. A tabela a<<strong>br</strong> />
seguir contém proprieda<strong>de</strong>s <strong>de</strong> algumas substâncias.<<strong>br</strong> />
a) Em que estado físico se encontra a glicerina num dia muito frio, <strong>com</strong> a temperatura próxima a 0°C ?<<strong>br</strong> />
b) Uma mistura <strong>de</strong> eugenol e glicerina po<strong>de</strong> ser separada por adição <strong>de</strong> água? Justifique.
13. O gráfico abaixo representa a variação <strong>de</strong> temperatura observada ao se aquecer uma substância A durante cerca <strong>de</strong> 80<<strong>br</strong> />
minutos.<<strong>br</strong> />
a) A faixa <strong>de</strong> temperatura em que a substância A permanece sólida é _________________.<<strong>br</strong> />
b) A faixa <strong>de</strong> temperatura em que a substância A permanece líquida é ___________________.<<strong>br</strong> />
c) A temperatura <strong>de</strong> ebulição da substância A é _____________.<<strong>br</strong> />
14. A Chapada dos Vea<strong>de</strong>iros também é famosa por suas inúmeras cachoeiras e enormes paredões <strong>de</strong> cristais <strong>de</strong> quartzo,<<strong>br</strong> />
que são silicatos. No diagrama <strong>de</strong> fases, a seguir, estão representadas três fases sólidas <strong>de</strong> um silicato <strong>de</strong> alumínio <strong>com</strong><<strong>br</strong> />
fórmula molecular Al‚SiO…, on<strong>de</strong> cada fase sólida representa um tipo <strong>de</strong> mineral diferente: cianita (<strong>de</strong>nsida<strong>de</strong> = 3,63 g.cm¤),<<strong>br</strong> />
andalusita (<strong>de</strong>nsida<strong>de</strong> = 3,16 g.cm¤) e silimanita (<strong>de</strong>nsida<strong>de</strong> = 3,24 g.cm¤).<<strong>br</strong> />
Nesse diagrama, a linha vertical reflete a mudança das fases, <strong>com</strong> a pressão, na temperatura fixa <strong>de</strong> 700 K.<<strong>br</strong> />
Explique quais as fases predominantes na transformação isotérmica do ponto A ao ponto C, i<strong>de</strong>ntificando cada uma <strong>de</strong>las.
15. Um dos sistemas propelentes usados em foguetes consiste <strong>de</strong> uma mistura <strong>de</strong> hidrazina (N‚H„) e peróxido <strong>de</strong> hidrogênio<<strong>br</strong> />
(H‚O‚). Sabendo que o ponto triplo da hidrazina correspon<strong>de</strong> à temperatura <strong>de</strong> 2,0 °C e à pressão <strong>de</strong> 3,4 mm Hg, que o<<strong>br</strong> />
ponto crítico correspon<strong>de</strong> à temperatura <strong>de</strong> 380 °C e à pressão <strong>de</strong> 145 atm e que na pressão <strong>de</strong> 1 atm as temperaturas <strong>de</strong><<strong>br</strong> />
fusão e <strong>de</strong> ebulição são iguais a 1,0 e 113,5 °C, respectivamente, pe<strong>de</strong>m-se:<<strong>br</strong> />
a) Um esboço do diagrama <strong>de</strong> fases da hidrazina para o intervalo <strong>de</strong> pressão e temperatura consi<strong>de</strong>rados neste enunciado.<<strong>br</strong> />
b) A indicação, no diagrama esboçado no item a), <strong>de</strong> todos os pontos indicados no enunciado e das fases presentes em<<strong>br</strong> />
cada região do diagrama.<<strong>br</strong> />
c) A equação química <strong>com</strong>pleta e balanceada que <strong>de</strong>screve a reação <strong>de</strong> <strong>com</strong>bustão entre hidrazina e peróxido <strong>de</strong><<strong>br</strong> />
hidrogênio, quando estes são misturados numa temperatura <strong>de</strong> 25 °C e pressão <strong>de</strong> 1 atm. Nesta equação, indique os<<strong>br</strong> />
estados físicos <strong>de</strong> cada substância.<<strong>br</strong> />
d) O cálculo da variação <strong>de</strong> entalpia da reação mencionada em c).<<strong>br</strong> />
Dados eventualmente necessários: variação <strong>de</strong> entalpia <strong>de</strong> formação (ÐH¡f), na temperatura <strong>de</strong> 25 °C e pressão <strong>de</strong> 1 atm,<<strong>br</strong> />
referente a:<<strong>br</strong> />
N‚H„(g): ÐH¡f = 95,4 kJ mol¢.<<strong>br</strong> />
N‚H„(Ø ): ÐH¡f = 50,6 kJmol¢.<<strong>br</strong> />
H‚O‚(Ø ): ÐH¡f = - 187,8 kJmol¢.<<strong>br</strong> />
H‚O(g): ÐH¡f = - 241,8 kJmol¢.<<strong>br</strong> />
16. Sob pressão <strong>de</strong> 1 atm, adiciona-se água pura em um cilindro provido <strong>de</strong> termômetro, <strong>de</strong> manômetro e <strong>de</strong> pistão móvel<<strong>br</strong> />
que se <strong>de</strong>sloca sem atrito. No instante inicial (t³), à temperatura <strong>de</strong> 25 °C, todo o espaço interno do cilindro é ocupado por<<strong>br</strong> />
água pura. A partir do instante (t ), mantendo a temperatura constante (25 °C), o pistão é <strong>de</strong>slocado e o manômetro indica<<strong>br</strong> />
uma nova pressão. A partir do instante (t‚), todo o conjunto é resfriado muito lentamente a -10°C, mantendo-se-o em<<strong>br</strong> />
repouso por 3 horas. No instante (tƒ), o cilindro é agitado, observando-se uma queda <strong>br</strong>usca da pressão. Faça um esboço do<<strong>br</strong> />
diagrama <strong>de</strong> fases da água e assinale, neste esboço, a(s) fase(s) (co)existente(s) no cilindro nos instantes t³, t , t‚ e tƒ.<<strong>br</strong> />
17. O diagrama <strong>de</strong> fases da água é representado a seguir.<<strong>br</strong> />
As diferentes condições ambientais <strong>de</strong> temperatura e pressão <strong>de</strong> duas cida<strong>de</strong>s, A e B, influenciam nas proprieda<strong>de</strong>s físicas<<strong>br</strong> />
da água. Essas cida<strong>de</strong>s estão situadas ao nível do mar e a 2400 m <strong>de</strong> altitu<strong>de</strong>, respectivamente. Sabe-se, também, que a<<strong>br</strong> />
cada aumento <strong>de</strong> 12 m na altitu<strong>de</strong> há uma mudança média <strong>de</strong> 1 mmHg na pressão atmosférica. Sendo a temperatura em A<<strong>br</strong> />
<strong>de</strong> - 5 °C e em B <strong>de</strong> - 35 °C, responda:<<strong>br</strong> />
a) Em qual das duas cida<strong>de</strong>s é mais fácil liquefazer a água por <strong>com</strong>pressão? Justifique.<<strong>br</strong> />
b) Quais são as mudanças esperadas nos pontos <strong>de</strong> fusão e ebulição da água na cida<strong>de</strong> B <strong>com</strong> relação a A.
18. Os gases nitrogênio, oxigênio e argônio, principais <strong>com</strong>ponentes do ar, são obtidos industrialmente através da <strong>de</strong>stilação<<strong>br</strong> />
fracionada do ar liquefeito. Indique a seqüência <strong>de</strong> obtenção <strong>de</strong>ssas substâncias neste processo <strong>de</strong> <strong>de</strong>stilação fracionada.<<strong>br</strong> />
Justifique sua resposta.<<strong>br</strong> />
Dados: temperaturas <strong>de</strong> ebulição a 1,0 atm<<strong>br</strong> />
Argônio = -186°C<<strong>br</strong> />
Nitrogênio = -196°C<<strong>br</strong> />
Oxigênio = -183°C<<strong>br</strong> />
19. Têm as seguintes misturas:<<strong>br</strong> />
I. areia e água,<<strong>br</strong> />
II. álcool (etanol) e água,<<strong>br</strong> />
III. sal <strong>de</strong> cozinha(NaCØ) e água, neste caso uma mistura homogênea.<<strong>br</strong> />
Cada uma <strong>de</strong>ssas misturas foi submetida a uma filtração em funil <strong>com</strong> papel e, em seguida, o líquido resultante (filtrado) foi<<strong>br</strong> />
aquecido até sua total evaporação. Pergunta-se:<<strong>br</strong> />
a) Qual mistura <strong>de</strong>ixou um resíduo sólido no papel após a filtração? O que era esse resíduo?<<strong>br</strong> />
b) Em qual caso apareceu um resíduo sólido após a evaporação do líquido? O que era esse resíduo?<<strong>br</strong> />
20. Um copo contém uma mistura <strong>de</strong> água, acetona, cloreto <strong>de</strong> sódio e cloreto <strong>de</strong> prata. A água, a acetona e o cloreto <strong>de</strong><<strong>br</strong> />
sódio estão numa mesma fase líquida, enquanto que o cloreto <strong>de</strong> prata se encontra numa fase sólida. Descreva <strong>com</strong>o<<strong>br</strong> />
po<strong>de</strong>mos realizar, em um laboratório <strong>de</strong> química, a separação dos <strong>com</strong>ponentes <strong>de</strong>sta mistura. De sua <strong>de</strong>scrição <strong>de</strong>vem<<strong>br</strong> />
constar as etapas que você empregaria para realizar esta separação, justificando o(s) procedimento(s) utilizado(s).<<strong>br</strong> />
21. Uma mistura constituída <strong>de</strong> ÁGUA, LIMALHA DE FERRO, ÁLCOOL e AREIA foi submetida a três processos <strong>de</strong><<strong>br</strong> />
separação, conforme fluxograma.<<strong>br</strong> />
IDENTIFIQUE os processos 1, 2 e 3 e COMPLETE as caixas do fluxograma <strong>com</strong> os resultados <strong>de</strong>stes processos.
22. O tratamento da água é fruto do <strong>de</strong>senvolvimento científico que se traduz em aplicação tecnológica relativamente<<strong>br</strong> />
simples. Um dos processos mais <strong>com</strong>uns para o tratamento químico da água utiliza cal virgem (óxido <strong>de</strong> cálcio) e sulfato <strong>de</strong><<strong>br</strong> />
alumínio. Os íons alumínio, em presença <strong>de</strong> íons hidroxila, formam o hidróxido <strong>de</strong> alumínio que é pouquíssimo solúvel em<<strong>br</strong> />
água. Ao hidróxido <strong>de</strong> alumínio formado a<strong>de</strong>re a maioria das impurezas presentes. Com a ação da gravida<strong>de</strong>, ocorre a<<strong>br</strong> />
<strong>de</strong>posição dos sólidos. A água é então separada e encaminhada a uma outra fase <strong>de</strong> tratamento.<<strong>br</strong> />
a) Que nome se dá ao processo <strong>de</strong> separação acima <strong>de</strong>scrito que faz uso da ação da gravida<strong>de</strong>?<<strong>br</strong> />
b) Por que se usa cal virgem no processo <strong>de</strong> tratamento da água? Justifique usando equação(ões) química(s).<<strong>br</strong> />
c) Em algumas estações <strong>de</strong> tratamento <strong>de</strong> água usa-se cloreto <strong>de</strong> ferro(III) em lugar <strong>de</strong> sulfato <strong>de</strong> alumínio. Escreva a<<strong>br</strong> />
fórmula e o nome do <strong>com</strong>posto <strong>de</strong> ferro formado nesse caso.<<strong>br</strong> />
23. Na produção industrial <strong>de</strong> álcool <strong>com</strong>bustível, a partir da fermentação do caldo <strong>de</strong> cana-<strong>de</strong>-açúcar, além do etanol, são<<strong>br</strong> />
formados <strong>com</strong>o subprodutos os álcoois: n-butanol, n-pentanol e n-propanol.<<strong>br</strong> />
Indique a or<strong>de</strong>m <strong>de</strong> saída <strong>de</strong>stes <strong>com</strong>postos, durante a <strong>de</strong>stilação fracionada do meio fermentado, realizada à pressão<<strong>br</strong> />
atmosférica. Justifique a sua resposta.<<strong>br</strong> />
24. As "margarinas", muito usadas <strong>com</strong>o substitutos da manteiga, contêm gorduras vegetais hidrogenadas. A diferença<<strong>br</strong> />
fundamental entre uma margarina "light" e outra "normal" está no conteúdo <strong>de</strong> gordura e <strong>de</strong> água.<<strong>br</strong> />
Colocou-se em um tubo <strong>de</strong> ensaio uma certa quantida<strong>de</strong> <strong>de</strong> margarina "normal" e, num outro tubo <strong>de</strong> ensaio, idêntico ao<<strong>br</strong> />
primeiro, colocou-se a mesma quantida<strong>de</strong> <strong>de</strong> margarina "light".<<strong>br</strong> />
Aqueceram-se em banho-maria os dois tubos contendo as margarinas até que aparecessem duas fases, <strong>com</strong>o<<strong>br</strong> />
esquematizado na figura.<<strong>br</strong> />
a) Reproduza, na resposta, a figura do tubo correspon<strong>de</strong>nte à margarina "light", i<strong>de</strong>ntificando as fases lipídica e aquosa.<<strong>br</strong> />
b) Admitindo que as duas margarinas tenham o mesmo preço e consi<strong>de</strong>rando que este preço diz respeito, apenas, ao teor<<strong>br</strong> />
da gordura <strong>de</strong> cada uma, em qual <strong>de</strong>las a gordura custa mais e quantas vezes (multiplicação) este preço é maior do que na<<strong>br</strong> />
outra?
25. Em uma feira <strong>de</strong> ciências, dois alunos propuseram um método para <strong>de</strong>ssalinizar a água do mar a fim <strong>de</strong> torná-la potável,<<strong>br</strong> />
ou seja, própria para o consumo humano, conforme a foto do evento mostrada a seguir:<<strong>br</strong> />
a) Cite e explique a função <strong>de</strong> quatro instrumentos <strong>de</strong> laboratório essenciais para a construção e o funcionamento do<<strong>br</strong> />
aparelho utilizado no processo <strong>de</strong> <strong>de</strong>ssalinização da água, mostrado na foto.<<strong>br</strong> />
b) Cite dois motivos técnicos que justifiquem ser preferível preservar a água potável do que produzi-la a partir da imensa<<strong>br</strong> />
quantida<strong>de</strong> <strong>de</strong> água que existe no mar.
26. As técnicas <strong>de</strong> separação dos <strong>com</strong>ponentes <strong>de</strong> uma mistura baseiam-se nas proprieda<strong>de</strong>s físico-químicas <strong>de</strong>sses<<strong>br</strong> />
<strong>com</strong>ponentes. Assim, consi<strong>de</strong>rando os sistemas, apresentados a seguir (figuras 1, 2 e 3), associe as misturas às figuras que<<strong>br</strong> />
representam os equipamentos a<strong>de</strong>quados a suas separações, bem <strong>com</strong>o às proprieda<strong>de</strong>s físico-químicas responsáveis pela<<strong>br</strong> />
utilização da técnica. Justifique suas escolhas.<<strong>br</strong> />
Sistema<<strong>br</strong> />
a) Água e sulfato <strong>de</strong> bário<<strong>br</strong> />
b) Água e tetracloreto <strong>de</strong> carbono<<strong>br</strong> />
c) Água e etanol<<strong>br</strong> />
Proprieda<strong>de</strong><<strong>br</strong> />
1) Temperatura <strong>de</strong> ebulição<<strong>br</strong> />
2) Solubilida<strong>de</strong><<strong>br</strong> />
3) Densida<strong>de</strong>
27. Oxalato <strong>de</strong> cálcio monoidratado (CaC‚O„.H‚O) aquecido ao ar <strong>de</strong><strong>com</strong>põe-se gradativamente seguindo três etapas (I, II e<<strong>br</strong> />
III). As equações das reações e as respectivas faixas <strong>de</strong> temperatura em que elas ocorrem são dadas a seguir:<<strong>br</strong> />
a) Esboce um gráfico, massa <strong>de</strong> sólido em função da temperatura <strong>de</strong> aquecimento, que representa essa <strong>de</strong><strong>com</strong>posição.<<strong>br</strong> />
Inicie <strong>com</strong> uma massa qualquer à temperatura ambiente. Indique no gráfico as substâncias que estão presentes nas<<strong>br</strong> />
seguintes faixas <strong>de</strong> temperatura:<<strong>br</strong> />
25-130°C, 210-420°C e 510-630°C.<<strong>br</strong> />
b) Qual das equações dadas representa uma reação <strong>de</strong> oxirredução? Justifique.<<strong>br</strong> />
28. O diagrama 1 representa a variação do ponto <strong>de</strong> fusão <strong>de</strong> quatro sais em função da soma dos raios do cátion e do ânion<<strong>br</strong> />
<strong>de</strong> cada um dos sais. Note que um dos valores permanece incógnito (Y).<<strong>br</strong> />
Os sais representados no diagrama são formados por íons isoeletrônicos. O valor do raio iônico (em Angstrons) <strong>de</strong><<strong>br</strong> />
diferentes cátions e ânions é apresentado na tabela a seguir.<<strong>br</strong> />
Escreva a equação da reação cujos produtos são unicamente o sal <strong>de</strong> maior ponto <strong>de</strong> fusão e água.
29. A fenolftaleína apresenta proprieda<strong>de</strong>s catárticas e por isso era usada, em mistura <strong>com</strong> ‘-lactose monoidratada, na<<strong>br</strong> />
proporção <strong>de</strong> 1:4 em peso, na formulação <strong>de</strong> um certo laxante. Algumas das proprieda<strong>de</strong>s <strong>de</strong>ssas substâncias são dadas na<<strong>br</strong> />
tabela.<<strong>br</strong> />
Deseja-se separar e purificar essas duas substâncias, em uma amostra <strong>de</strong> 100 g da mistura. Com base nas informações da<<strong>br</strong> />
tabela, foi proposto o procedimento representado no fluxograma acima.<<strong>br</strong> />
a) Supondo que não ocorram perdas nas etapas, calcule a massa <strong>de</strong> lactose que <strong>de</strong>ve cristalizar no procedimento adotado.<<strong>br</strong> />
b) Com relação à separação / purificação da fenolftaleína,<<strong>br</strong> />
- explique se o volume <strong>de</strong> etanol proposto é suficiente para dissolver toda a fenolftaleína contida na mistura.<<strong>br</strong> />
- usando seus conhecimentos so<strong>br</strong>e a solubilida<strong>de</strong> do etanol em água, explique por que a adição <strong>de</strong> água à solução<<strong>br</strong> />
alcóolica provoca a cristalização da fenolftaleína.<<strong>br</strong> />
30. Dois frascos idênticos estão esquematizados abaixo.<<strong>br</strong> />
Um <strong>de</strong>les contém uma certa massa <strong>de</strong> água (H‚0) e o outro, a mesma massa <strong>de</strong> álcool (CHƒCH‚OH).<<strong>br</strong> />
a) Qual das substâncias está no frasco A e qual está no frasco B? Justifique.<<strong>br</strong> />
b) Consi<strong>de</strong>rando a massa das substâncias contidas nos frascos A e B, qual contém maior quantida<strong>de</strong> <strong>de</strong> átomos? Explique.
31. Uma receita <strong>de</strong> biscoitinhos Petit Four <strong>de</strong> laranja leva os seguintes ingredientes:<<strong>br</strong> />
A <strong>de</strong>nsida<strong>de</strong> aparente da "massa" recém preparada e antes <strong>de</strong> ser assada é <strong>de</strong> 1,10g/cm¤. Enten<strong>de</strong>-se por <strong>de</strong>nsida<strong>de</strong><<strong>br</strong> />
aparente a relação entre a massa da "massa" ou do ingrediente, na "forma" em que se encontra, e o respectivo volume<<strong>br</strong> />
ocupado.<<strong>br</strong> />
a) Qual o volume ocupado pela "massa" recém preparada, correspon<strong>de</strong>nte a uma receita?<<strong>br</strong> />
b) Como se justifica o fato da <strong>de</strong>nsida<strong>de</strong> aparente da "massa" ser diferente da média pon<strong>de</strong>rada das <strong>de</strong>nsida<strong>de</strong>s aparentes<<strong>br</strong> />
dos constituintes?<<strong>br</strong> />
32. Dois experimentos foram realizados em um laboratório <strong>de</strong> química.<<strong>br</strong> />
Experimento 1: Três frascos abertos contendo, separadamente, volumes iguais <strong>de</strong> três solventes, I, II e III, foram <strong>de</strong>ixados<<strong>br</strong> />
em uma capela (câmara <strong>de</strong> exaustão). Após algum tempo, verificou-se que os volumes dos solventes nos três frascos<<strong>br</strong> />
estavam diferentes.<<strong>br</strong> />
Experimento 2: Com os três solventes, foram preparadas três misturas binárias. Verificou-se que os três solventes eram<<strong>br</strong> />
miscíveis e que não reagiam quimicamente entre si. Sabe-se, ainda, que somente a mistura (I + III) é uma mistura<<strong>br</strong> />
azeotrópica.<<strong>br</strong> />
a) Coloque os solventes em or<strong>de</strong>m crescente <strong>de</strong> pressão <strong>de</strong> vapor. Indique um processo físico a<strong>de</strong>quado para separação<<strong>br</strong> />
dos solventes na mistura (I + II).<<strong>br</strong> />
b) Esboce uma curva <strong>de</strong> aquecimento (temperatura × tempo) para a mistura (II + III), indicando a transição <strong>de</strong> fases. Qual é
a diferença entre as misturas (II + III) e (I + III) durante a ebulição?<<strong>br</strong> />
33. Quer-se distinguir uma amostra <strong>de</strong> p-clorofenol <strong>de</strong> uma <strong>de</strong> o-nitrofenol, ambos sólidos.<<strong>br</strong> />
a) Determinou-se o ponto <strong>de</strong> fusão <strong>de</strong> cada amostra, utilizando um termômetro que permite a leitura da temperatura <strong>com</strong><<strong>br</strong> />
incerteza <strong>de</strong> 1°C. Foi possível, <strong>com</strong> esta medida experimental, distinguir essas amostras? Explique.<<strong>br</strong> />
b) Em água, tais fenóis (ArOH) apresentam caráter ácido:<<strong>br</strong> />
ArOH Ï ArO + H®<<strong>br</strong> />
Mostre <strong>com</strong> cálculos que a <strong>de</strong>terminação do pH <strong>de</strong> soluções aquosas <strong>de</strong>sses fenóis, <strong>de</strong> concentração 0,01 mol /L, serviria<<strong>br</strong> />
para i<strong>de</strong>ntificá-las.<<strong>br</strong> />
Dados:<<strong>br</strong> />
p-clorofenol:<<strong>br</strong> />
ponto <strong>de</strong> fusão (°C) = 43,5<<strong>br</strong> />
constante <strong>de</strong> ionização em água (Ka) = 1 x 10ª<<strong>br</strong> />
o-nitrofenol:<<strong>br</strong> />
ponto <strong>de</strong> fusão (°C) = 45<<strong>br</strong> />
constante <strong>de</strong> ionização em água (Ka) = 1 x 10¨<<strong>br</strong> />
34. A massa do ¨Li¤® é 7,014359 u.m.a. . Calcule a energia <strong>de</strong> ligação <strong>de</strong>ste nuclí<strong>de</strong>o.<<strong>br</strong> />
Dados:<<strong>br</strong> />
1 u.m.a. = 931 MeV<<strong>br</strong> />
massa do próton = 1,007276 u.ma.<<strong>br</strong> />
massa do nêutron = 1,008665 u.ma.<<strong>br</strong> />
massa do elétron = 0,000549 u.ma.<<strong>br</strong> />
35. Em 1909, Geiger e Mars<strong>de</strong>n realizaram, no laboratório do professor Ernest Rutherford, uma série <strong>de</strong> experiências que<<strong>br</strong> />
envolveram a interação <strong>de</strong> partículas alfa <strong>com</strong> a matéria. Esse trabalho, às vezes é referido <strong>com</strong>o "Experiência <strong>de</strong><<strong>br</strong> />
Rutherford". O <strong>de</strong>senho a seguir esquematiza as experiências realizadas por Geiger e Mars<strong>de</strong>n.<<strong>br</strong> />
Uma amostra <strong>de</strong> polônio radioativo emite partículas alfa que inci<strong>de</strong>m so<strong>br</strong>e uma lâmina muito fina <strong>de</strong> ouro. Um anteparo <strong>de</strong><<strong>br</strong> />
sulfeto <strong>de</strong> zinco indica a trajetória das partículas alfa após terem atingido a lâmina <strong>de</strong> ouro, uma vez que, quando elas<<strong>br</strong> />
inci<strong>de</strong>m na superfície <strong>de</strong> ZnS, ocorre uma cintilação.<<strong>br</strong> />
1- EXPLIQUE o que são partículas alfa.<<strong>br</strong> />
2- DESCREVA os resultados que <strong>de</strong>veriam ser observados nessa experiência se houvesse uma distribuição homogênea<<strong>br</strong> />
das cargas positivas e negativas no átomo.<<strong>br</strong> />
3- DESCREVA os resultados efetivamente observados por Geiger e Mars<strong>de</strong>n.<<strong>br</strong> />
4- DESCREVA a interpretação dada por Rutherford para os resultados <strong>de</strong>ssa experiência.
36. O elemento cloro apresenta dois isótopos mais abundantes na natureza, um <strong>com</strong> 18 nêutrons e o outro <strong>com</strong> 20 nêutrons.<<strong>br</strong> />
a) Determine os números <strong>de</strong> massa <strong>de</strong>sses dois isótopos do cloro.<<strong>br</strong> />
b) Selecione, na tabela periódica, o metal mais eletronegativo que pertence ao mesmo período que o cloro.<<strong>br</strong> />
Escreva a fórmula química e o nome do <strong>com</strong>posto formado pelo cloro e por esse metal.<<strong>br</strong> />
37. Cálcio é um dos elementos principais da estrutura óssea dos seres humanos. Uma doença muito <strong>com</strong>um em pessoas<<strong>br</strong> />
idosas, principalmente em mulheres após a menopausa, é a osteoporose, que consiste na <strong>de</strong>smineralização óssea causada<<strong>br</strong> />
pela perda <strong>de</strong> Ca®£, provocando fraturas freqüentes e encurvamento da coluna verte<strong>br</strong>al.<<strong>br</strong> />
Uma das formas utilizadas pelos médicos para estudar a osteoporose consiste em administrar aos pacientes uma dieta<<strong>br</strong> />
contendo sais <strong>de</strong> estrôncio e a<strong>com</strong>panhar a taxa <strong>de</strong> absorção do mesmo pelo organismo. O estrôncio tem a capacida<strong>de</strong> <strong>de</strong><<strong>br</strong> />
substituir o cálcio em seus <strong>com</strong>postos.<<strong>br</strong> />
a) A partir da estrutura atômica dos dois elementos, explique por que o estrôncio po<strong>de</strong> ser utilizado no lugar do cálcio.<<strong>br</strong> />
b) Uma alternativa a sais <strong>de</strong> estrôncio no procedimento anterior para estudar a osteoporose é utilizar sais <strong>de</strong> cálcio<<strong>br</strong> />
radioativo. O isótopo 47 <strong>de</strong>sse elemento, por exemplo, <strong>de</strong>cai emitindo uma partícula beta e formando um elemento X.<<strong>br</strong> />
Baseado na equação <strong>de</strong> <strong>de</strong>caimento apresentada a seguir, dê o número atômico e o número <strong>de</strong> massa do elemento X.<<strong>br</strong> />
‚³Ca¥¨ ë X + ÷ e¡
38. Um dos maiores escritores da língua portuguesa, José Maria Eça <strong>de</strong> Queiroz, nasceu em Portugal em 1845 e morreu em<<strong>br</strong> />
Paris em 1900. A seguir encontra-se um texto retirado <strong>de</strong> "Os Maias", publicado em 1888, em que é apresentado o romance<<strong>br</strong> />
que um dos personagens, o Ega, está escrevendo:<<strong>br</strong> />
... Intitulava-se Memórias dum Átomo, e tinha a forma <strong>de</strong> uma autobiografia. Este átomo (o átomo do Ega, <strong>com</strong>o se<<strong>br</strong> />
lhe chamava a sério, em Coim<strong>br</strong>a), aparecia no primeiro capítulo, rolando ainda no vago das nebulosas primitivas; <strong>de</strong>pois<<strong>br</strong> />
vinha em<strong>br</strong>ulhado, faísca can<strong>de</strong>nte, na massa do fogo que <strong>de</strong>via ser mais tar<strong>de</strong> a terra: enfim, fazia parte da primeira<<strong>br</strong> />
FOLHA DE PLANTA que surgiu da crosta ainda mole do globo. Des<strong>de</strong> então, viajando nas incessantes transformações da<<strong>br</strong> />
substância, o átomo do Ega entrava na ru<strong>de</strong> estrutura do Orango, pai da humanida<strong>de</strong> - e mais tar<strong>de</strong> vivia nos LÁBIOS DE<<strong>br</strong> />
PLATÃO. Negrejava no burel dos santos, refulgia na ESPADA DOS HERÓIS, palpitava no coração dos poetas. GOTA DE<<strong>br</strong> />
ÁGUA nos lagos <strong>de</strong> Galiléia, ouvira o falar <strong>de</strong> Jesus, aos fins da tar<strong>de</strong>, quando os apóstolos recolhiam as re<strong>de</strong>s; NÓ DE<<strong>br</strong> />
MADEIRA na tribuna da Convenção, sentira o frio da mão <strong>de</strong> Robespierre.<<strong>br</strong> />
(Nota: a marcação em maiúsculo foi feita pela banca <strong>de</strong> professores <strong>de</strong> Química do Concurso <strong>de</strong> Seleção para<<strong>br</strong> />
Ingresso nos Cursos <strong>de</strong> Graduação 2001 da UFRJ)<<strong>br</strong> />
a) Consi<strong>de</strong>rando que o "átomo <strong>de</strong> Ega" pertence ao constituinte principal <strong>de</strong> cada um dos vários materiais marcados no texto<<strong>br</strong> />
(folha <strong>de</strong> planta, lábios <strong>de</strong> Platão, espada dos heróis, gota <strong>de</strong> água e nó <strong>de</strong> ma<strong>de</strong>ira), explique por que po<strong>de</strong>mos afirmar que<<strong>br</strong> />
quimicamente seria impossível existir tal átomo.<<strong>br</strong> />
b) Redija um texto <strong>de</strong> 1 a 5 linhas que mostre <strong>com</strong>o um átomo que seja um dos constituintes principais da "GOTA DE ÁGUA<<strong>br</strong> />
nos lagos <strong>de</strong> Galiléia" se transformaria em um átomo do principal constituinte do "NÓ DE MADEIRA na tribuna da<<strong>br</strong> />
Convenção". Para tal, utilize, no mínimo, 2 fenômenos físicos e 1 fenômeno químico.<<strong>br</strong> />
39. Um elemento M apresenta os isótopos ¨ªM e ©¢M. Sabendo que a massa atômica do elemento M é 79,90u, <strong>de</strong>termine os<<strong>br</strong> />
percentuais <strong>de</strong> cada isótopo do elemento M.<<strong>br</strong> />
40. Qual o número atômico (Z) do átomo cujo elétron <strong>de</strong> diferenciação é (3, 2, +1, +1/2)?<<strong>br</strong> />
41. O elemento cloro tem o número atômico 17 e a massa atômica 35,45. Na natureza há apenas dois isótopos <strong>de</strong>sse<<strong>br</strong> />
elemento:<<strong>br</strong> />
¤¦CØ = 34,97 e ¤¨CØ = 36,97.<<strong>br</strong> />
a) Indicar o número <strong>de</strong> prótons, elétrons e nêutrons do ¤¨CØ.<<strong>br</strong> />
b) Calcular a <strong>com</strong>posição percentual <strong>de</strong> cada isótopo.
42. No processo <strong>de</strong> amadurecimento <strong>de</strong> frutas, uma <strong>de</strong>terminada substância é liberada. Essa substância, que também é<<strong>br</strong> />
responsável pela aceleração do processo, é um gás cujas moléculas são constituídas apenas por átomos <strong>de</strong> hidrogênio e <strong>de</strong><<strong>br</strong> />
carbono, numa proporção <strong>de</strong> 2:1. Além disso, essa substância é a primeira <strong>de</strong> uma série homóloga <strong>de</strong> <strong>com</strong>postos orgânicos.<<strong>br</strong> />
a) Em face das informações acima, é possível explicar o hábito que algumas pessoas têm <strong>de</strong> em<strong>br</strong>ulhar frutas ainda ver<strong>de</strong>s<<strong>br</strong> />
para que amadureçam mais <strong>de</strong>pressa? Justifique.<<strong>br</strong> />
b) Qual é a fórmula molecular e o nome do gás que <strong>de</strong>sempenha esse importante papel no amadurecimento das frutas?<<strong>br</strong> />
c) Escreva as fórmulas estruturais dos isômeros <strong>de</strong> menor massa molar <strong>de</strong>ssa série homóloga.<<strong>br</strong> />
43. O carbono ocorre na natureza <strong>com</strong>o uma mistura <strong>de</strong> átomos dos quais 98,90% são ¢£C e 1,10% são ¢¤C.<<strong>br</strong> />
a) Explique o significado das representações ¢£C e ¢¤C.<<strong>br</strong> />
b) Com esses dados, calcule a massa atômica do carbono natural.<<strong>br</strong> />
Dados: massas atômicas: ¢£C=12,000; ¢¤C=13,003.<<strong>br</strong> />
44. A tabela a seguir fornece alguns dados referentes a uma certa amostra da substância <strong>de</strong> fórmula AB‚.<<strong>br</strong> />
a) Qual o número atômico do elemento B?<<strong>br</strong> />
b) Qual a massa total da amostra?
45. Para i<strong>de</strong>ntificar minerais po<strong>de</strong>-se fazer uso <strong>de</strong> proprieda<strong>de</strong>s físicas <strong>com</strong>o a dureza (resistência ao riso) e algumas<<strong>br</strong> />
análises químicas, <strong>com</strong>o reações <strong>com</strong> ácidos inorgânicos.<<strong>br</strong> />
Três amostras <strong>de</strong> minerais <strong>de</strong>nominados A, B, e C foram analisadas conforme os métodos da escala <strong>de</strong> dureza e da reação<<strong>br</strong> />
<strong>com</strong> ácidos. Os resultados encontram-se na tabela a seguir:<<strong>br</strong> />
A escala <strong>de</strong> dureza utilizada foi a seguinte: unha
GABARITO<<strong>br</strong> />
1. a) A temperatura <strong>de</strong> ebulição do UF† a 10 atm é igual a 140°C.<<strong>br</strong> />
b) A temperatura é igual a 65°C e a pressão é igual a 2 atm.<<strong>br</strong> />
2. a) A coloração não indica a pureza <strong>de</strong> uma substância, pois uma mistura po<strong>de</strong> apresentar uma única cor.<<strong>br</strong> />
Uma substância pura é formada partículas iguais, <strong>com</strong>o átomos, moléculas ou íons, não é possível classificarmos um<<strong>br</strong> />
sistema em puro ou não apenas observando sua coloração.<<strong>br</strong> />
b) Primeiramente o açúcar se dissolve na água da saliva <strong>de</strong>vido a que<strong>br</strong>a das ligações <strong>de</strong> hidrogênio existentes entre as<<strong>br</strong> />
moléculas <strong>de</strong> açúcar no retículo cristalino e <strong>de</strong>pois pela formação <strong>de</strong> novas ligações <strong>de</strong> hidrogênio (pontes <strong>de</strong> hidrogênio)<<strong>br</strong> />
entre as moléculas <strong>de</strong> açúcar e a água da saliva.<<strong>br</strong> />
c) A seqüência seria:<<strong>br</strong> />
Plantaram, colheram e moeram a cana.<<strong>br</strong> />
Concentraram o caldo, cristalizaram e centrifugaram o açúcar.<<strong>br</strong> />
Secaram e ensacaram o açúcar.<<strong>br</strong> />
3. a) Processo 1: evaporação da água e sua con<strong>de</strong>nsação na forma <strong>de</strong> gotículas (em suspensão) formando as nuvens.<<strong>br</strong> />
b) Pontes <strong>de</strong> hidrogênio.<<strong>br</strong> />
c) O processo 3: solidificação.<<strong>br</strong> />
4. a) Destilação fracionada. Porque nesse caso, quando existe uma mistura <strong>de</strong> <strong>com</strong>ponentes <strong>com</strong> pontos <strong>de</strong> ebulição<<strong>br</strong> />
próximos, fazer a <strong>de</strong>stilação simples (única etapa) não é a<strong>de</strong>quado. A <strong>de</strong>stilação fracionada baseia-se num processo on<strong>de</strong> a<<strong>br</strong> />
mistura é vaporizada e con<strong>de</strong>nsada várias vezes (ocorrem várias micro<strong>de</strong>stilações). Dessa forma, os vapores con<strong>de</strong>nsados<<strong>br</strong> />
na última etapa estão enriquecidos <strong>com</strong> o <strong>com</strong>ponente mais volátil, tornando o processo mais eficiente em relação à<<strong>br</strong> />
<strong>de</strong>stilação simples.<<strong>br</strong> />
b) Como a água é uma substância polar e o petróleo uma mistura <strong>de</strong> hidrocarbonetos (apolares), forma-se um sistema<<strong>br</strong> />
bifásico. Nesse caso, é a<strong>de</strong>quado utilizar-se a <strong>de</strong>cantação, uma operação na qual líquidos imiscíveis, <strong>de</strong> diferentes<<strong>br</strong> />
<strong>de</strong>nsida<strong>de</strong>s, po<strong>de</strong>m ser separados.<<strong>br</strong> />
5. clorofórmio - líquido<<strong>br</strong> />
éter etílico - gasoso<<strong>br</strong> />
etanol - líquido<<strong>br</strong> />
fenol - líquido<<strong>br</strong> />
pentano - gasoso<<strong>br</strong> />
6. a) evaporação e liquefação<<strong>br</strong> />
b) A evaporação na superfície da água salo<strong>br</strong>a e a liquefação na superfície do plástico.<<strong>br</strong> />
c) A evaporação, que absorve energia do Sol.<<strong>br</strong> />
7. 1) TÛ = 100 °C; T½ - 100 °C. TÛ e T½ são iguais e representam a temperatura <strong>de</strong> ebulição da água.<<strong>br</strong> />
2) Béquer A pois leva menos tempo para ebulir.<<strong>br</strong> />
4) Béquer B pois tem maior quantida<strong>de</strong> <strong>de</strong> água.<<strong>br</strong> />
8. a) T„ < T‚ < Tƒ = T<<strong>br</strong> />
b) O sistema 4 é uma solução e tem maior número <strong>de</strong> partículas dissolvidas, por litro, já que o soluto (NaCØ) está dissociado.
9. a) Admitindo-se a existência <strong>de</strong> líquido nos frascos, a temperatura máxima alcançada pelo sistema constituído pelo líquido<<strong>br</strong> />
X e frasco é 50°C (durante o processo <strong>de</strong> ebulição). Esse frasco po<strong>de</strong>rá ser tocado <strong>com</strong> a mão, sem que se corra risco <strong>de</strong><<strong>br</strong> />
queimaduras.<<strong>br</strong> />
No sistema constituído pelo líquido Y e frasco, a temperatura máxima alcançada é 100°C, quando atinge o equilí<strong>br</strong>io <strong>com</strong> a<<strong>br</strong> />
chapa elétrica <strong>de</strong> aquecimento. Neste caso, po<strong>de</strong>rá haver risco <strong>de</strong> queimaduras, se o frasco em questão for tocado <strong>com</strong> a<<strong>br</strong> />
mão.<<strong>br</strong> />
b) A adição <strong>de</strong> um soluto não volátil eleva a temperatura <strong>de</strong> ebulição <strong>de</strong> um líquido. Portanto:<<strong>br</strong> />
- o líquido X po<strong>de</strong>rá atingir uma temperatura superior a 50°C, antes <strong>de</strong> entrar em ebulição.<<strong>br</strong> />
- a temperatura máxima que o líquido Y atingirá será 100°C, mesmo <strong>com</strong> a presença <strong>de</strong> soluto não-volátil, porque é igual à<<strong>br</strong> />
temperatura <strong>de</strong> aquecimento da chapa.<<strong>br</strong> />
10. a) Correta<<strong>br</strong> />
O sistema mostra a mudança <strong>de</strong> estado físico da água pura, portanto o ponto <strong>de</strong> fusão permanece constante até o<<strong>br</strong> />
<strong>de</strong>rretimento total da água sólida (0°C).<<strong>br</strong> />
b) Correta<<strong>br</strong> />
A massa da fase sólida diminuirá porque a temperatura ambiente (25°C) é maior que 0°C.<<strong>br</strong> />
c) Correta<<strong>br</strong> />
A pressão <strong>de</strong> vapor da fase líquida permanecerá constante, pois a temperatura do sistema é constante (0°C).<<strong>br</strong> />
d) Errada<<strong>br</strong> />
A relação quantida<strong>de</strong> <strong>de</strong> matéria por volume será diferente, pois o volume ocupado pela fase líquida é menor em relação à<<strong>br</strong> />
fase sólida, para uma mesma massa.<<strong>br</strong> />
e) Correta<<strong>br</strong> />
A massa do corpo diminuirá <strong>de</strong>vido à evaporação da água, pois é um sistema aberto.<<strong>br</strong> />
11. A pressão <strong>de</strong> vapor <strong>de</strong> uma substância aumenta <strong>com</strong> o aumento da temperatura.<<strong>br</strong> />
Quando a pressão <strong>de</strong> vapor se iguala à pressão local (pressão atmosférica), o líquido entra em ebulição; portanto, em um<<strong>br</strong> />
local on<strong>de</strong> a pressão atmosférica é 0,7atm, a água entra em ebulição em uma temperatura menor que 100°C.<<strong>br</strong> />
12. a) Sólido<<strong>br</strong> />
b) Sim. Pois a glicerina é solúvel em água e o eugenol não é solúvel em água.<<strong>br</strong> />
13. a) 10°C a 20°C<<strong>br</strong> />
b) 20°C a 40°C<<strong>br</strong> />
c) 40°C<<strong>br</strong> />
14. A <strong>de</strong>nsida<strong>de</strong> aumenta <strong>com</strong> o aumento da pressão, <strong>de</strong> acordo <strong>com</strong> o diagrama <strong>de</strong> fases:<<strong>br</strong> />
d(I) > d(II) > d(III), então:<<strong>br</strong> />
I é cianita<<strong>br</strong> />
II é silimanita<<strong>br</strong> />
III é andalusita<<strong>br</strong> />
Do ponto A ao B: andalusita e silimanita.<<strong>br</strong> />
Do ponto B ao C: silimanita e cianita.
15. a) e b)<<strong>br</strong> />
c) N‚H„(Ø) + 2H‚O‚(Ø) ë N‚(g) + 4H‚O(g)<<strong>br</strong> />
d) ÐH = - 642,2 kJ<<strong>br</strong> />
16. Observe a figura a seguir:<<strong>br</strong> />
17. a) Na cida<strong>de</strong> A. De acordo <strong>com</strong> o diagrama <strong>de</strong> fases, a pressão a ser exercida na água para que<<strong>br</strong> />
ocorra a liquefação é menor.<<strong>br</strong> />
b) Como B está a aproximadamente 2400 m <strong>de</strong> altitu<strong>de</strong>, a pressão atmosférica é menor. Conseqüentemente a temperatura<<strong>br</strong> />
<strong>de</strong> fusão da água será maior que em A, e a temperatura <strong>de</strong> ebulição será menor que em A.
18. N‚ ë Ar ë O‚<<strong>br</strong> />
-196°C -186°C -183°C<<strong>br</strong> />
19. a) mistura I ë resíduo : areia<<strong>br</strong> />
b) mistura III ë resíduo : NaCØ<<strong>br</strong> />
20. Primeira etapa: Filtração para separar o cloreto <strong>de</strong> prata (fase sólida) dos outros <strong>com</strong>ponentes.<<strong>br</strong> />
Segunda etapa: Destilação fracionada para a obtenção da acetona a partir da coluna <strong>de</strong> fracionamento e do con<strong>de</strong>nsador.<<strong>br</strong> />
Terceira etapa: Destilação simples para separar a água do cloreto <strong>de</strong> sódio que restará no balão <strong>de</strong> <strong>de</strong>stilação.<<strong>br</strong> />
21. Observe a tabela e o fluxograma preenchidos:<<strong>br</strong> />
22. a) O processo <strong>de</strong> separação é a <strong>de</strong>cantação.<<strong>br</strong> />
b) A cal virgem reage <strong>com</strong> água formando hidróxido <strong>de</strong> cálcio, pois é um óxido básico.<<strong>br</strong> />
CaO(s)+H‚O(Ø)ëCa(OH)‚(aq)ëCa®£(aq)+2OH(aq)<<strong>br</strong> />
O hidróxido <strong>de</strong> cálcio reage <strong>com</strong> o sulfato <strong>de</strong> alumínio produzindo o hidróxido <strong>de</strong> alumínio<<strong>br</strong> />
3Ca(OH)‚(aq) + AØ‚(SO„)ƒ(aq) ë<<strong>br</strong> />
ë 3CaSO„(s) + 2AØ(OH)ƒ(s)<<strong>br</strong> />
ou<<strong>br</strong> />
AØ®¤(aq) + 3OH(aq) ë AØ(OH)ƒ(s)<<strong>br</strong> />
Po<strong>de</strong>r-se-ia usar outra base em vez da cal virgem, o que não é feito <strong>de</strong>vido ao baixo custo <strong>de</strong>sta.<<strong>br</strong> />
c) Fe(OH)ƒ: hidróxido <strong>de</strong> ferro III ou hidróxido férrico.<<strong>br</strong> />
23. Após o etanol, a or<strong>de</strong>m <strong>de</strong> saída é: n-propanol, n-butanol, e n-pentanol. Justificativa: o ponto <strong>de</strong> ebulição <strong>de</strong> alcóois<<strong>br</strong> />
primários não ramificados aumenta <strong>com</strong> o tamanho da ca<strong>de</strong>ia.<<strong>br</strong> />
24. a) A margarina "light" contém menos gorduras vegetais hidrogenadas do que a margarina "normal". O tubo que<<strong>br</strong> />
correspon<strong>de</strong> à margarina "light" é:
) Margarina "light": fase lipídica: 4 unida<strong>de</strong>s <strong>de</strong> volume.<<strong>br</strong> />
Margarina "normal": fase lipídica: 8 unida<strong>de</strong>s <strong>de</strong> volume.<<strong>br</strong> />
A gordura da margarina "light" custa mais que a gordura da margarina "normal". O preço é duas vezes maior.<<strong>br</strong> />
25. a) Con<strong>de</strong>nsador: con<strong>de</strong>nsação da água.<<strong>br</strong> />
Balão <strong>de</strong> <strong>de</strong>stilação: recipiente para o aquecimento da água do mar.<<strong>br</strong> />
Erlenmeyer: frasco <strong>de</strong> recolhimento da água <strong>de</strong>stilada.<<strong>br</strong> />
Bico <strong>de</strong> bünsen: Bico <strong>de</strong> gás para esquentar a água do mar.<<strong>br</strong> />
b) 1Ž) A utilização <strong>de</strong> gran<strong>de</strong> quantida<strong>de</strong> <strong>de</strong> energia para o aquecimento da água do mar. No caso da utilização <strong>de</strong><<strong>br</strong> />
<strong>com</strong>bustíveis fósseis há o problema da poluição gerada.<<strong>br</strong> />
2Ž) A água obtida precisa conter uma certa concentração <strong>de</strong> sais para evitar osmose <strong>de</strong>scontrolada nas células animais e<<strong>br</strong> />
no caso da <strong>de</strong>stilação simples não contém sais minerais.<<strong>br</strong> />
26. FIG. 1) C e 1. O etanol tem ponto <strong>de</strong> ebulição menor do que o da água. Desse modo, a técnica a<strong>de</strong>quada para realizar<<strong>br</strong> />
essa separação é a <strong>de</strong>stilação.<<strong>br</strong> />
FIG. 2) A e 2. O sulfato <strong>de</strong> bário é insolúvel em água, po<strong>de</strong>ndo-se separá-lo da água utilizando-se a técnica da filtração,<<strong>br</strong> />
<strong>de</strong>sse modo, enquanto a água passa pelo filtro, o sulfato <strong>de</strong> bário fica retido.<<strong>br</strong> />
FIG. 3) B e 3. O tetracloreto <strong>de</strong> carbono é mais <strong>de</strong>nso do que a água e as substâncias são imiscíveis. Quando em um funil<<strong>br</strong> />
<strong>de</strong> separação, o tetracloreto <strong>de</strong> carbono vai se <strong>de</strong>positar abaixo da água e, <strong>de</strong>sse modo, escoará primeiro, ocorrendo a<<strong>br</strong> />
separação das substâncias.<<strong>br</strong> />
27. a) Observe a figura
) Equação II: o Nox do carbono varia <strong>de</strong> +3 para +4 e +2.<<strong>br</strong> />
28. Sal <strong>de</strong> maior ponto <strong>de</strong> fusão = NaF<<strong>br</strong> />
Reação: HF + NaOH ë NaF + H‚O<<strong>br</strong> />
29. a) 80g<<strong>br</strong> />
b) Temos 20g <strong>de</strong> fenolftaleína:<<strong>br</strong> />
100mL _____ 6,7 g<<strong>br</strong> />
350mL _____ x<<strong>br</strong> />
x = 23,45g<<strong>br</strong> />
O volume <strong>de</strong> etanol é suficiente para dissolver toda a fenolftaleína.<<strong>br</strong> />
O álcool é solúvel em água <strong>de</strong>vido à sua parte polar (-CH‚-O-H), ocorrendo ponte <strong>de</strong> hidrogênio entre as duas espécies.<<strong>br</strong> />
A parte apolar do etanol (HƒC-CH‚-) é responsável pela dissolução da fenolftaleína por meio <strong>de</strong> forças <strong>de</strong> van <strong>de</strong>r Waals<<strong>br</strong> />
entre as duas espécies.<<strong>br</strong> />
A adição <strong>de</strong> água (bastante polar) na solução <strong>de</strong> fenolftaleína em etanol <strong>de</strong>ixa o meio mais polar, provocando a cristalização<<strong>br</strong> />
da fenolftaleína. Esta é insolúvel em solvente bastante polar.<<strong>br</strong> />
30. a) Como <strong>de</strong>nsida<strong>de</strong> é d = m/V, para massas iguais, quanto maior a <strong>de</strong>nsida<strong>de</strong>, menor será o volume ocupado pela<<strong>br</strong> />
substância; logo, o frasco B contém água, porque apresenta maior <strong>de</strong>nsida<strong>de</strong> que o álcool, e o frasco A contém álcool.<<strong>br</strong> />
b) Para uma mesma massa x, temos:<<strong>br</strong> />
-Cálculo do número <strong>de</strong> átomos no frasco contendo água (H‚O):<<strong>br</strong> />
18,0148 g __________ 3. 6,02 . 10£¤ átomos<<strong>br</strong> />
x g __________ a<<strong>br</strong> />
a = (x . 3 . 6,02 . 10£¤)/18,0148<<strong>br</strong> />
átomos ¸ x . 1,00 . 10£¤ átomos<<strong>br</strong> />
-Cálculo do número <strong>de</strong> átomos no frasco contendo álcool (C‚H†O):<<strong>br</strong> />
46,0714 g __________ 9 . 6,02 . 10£¤ átomos<<strong>br</strong> />
x g __________ b<<strong>br</strong> />
b = (x . 9 . 6,02 . 10£¤)/46,0714<<strong>br</strong> />
átomos ¸ x . 1,18 . 10£¤ átomos<<strong>br</strong> />
O frasco contendo álcool, CHƒCH‚OH, apresenta maior número <strong>de</strong> átomos.<<strong>br</strong> />
31. a) Cálculo da "massa" recém-preparada para uma receita:<<strong>br</strong> />
360g + 6g + 1g + 100g + 90g + 100g + 3g = 660g<<strong>br</strong> />
Como a <strong>de</strong>nsida<strong>de</strong> aparente da "massa" recém-preparada é 1,10g/cm¤, temos:<<strong>br</strong> />
1cm¤ ______ 1,10g<<strong>br</strong> />
x __________ 660g<<strong>br</strong> />
x = 600cm¤<<strong>br</strong> />
b) A <strong>de</strong>nsida<strong>de</strong> aparente da "massa" recém-preparada não é a medida das <strong>de</strong>nsida<strong>de</strong>s aparentes dos constituintes, porque<<strong>br</strong> />
o ingrediente isolado está em uma certa "forma" e a massa está em uma "forma" diferente. Quando os ingredientes são<<strong>br</strong> />
misturados, aparecem novas interações intermoleculares que po<strong>de</strong>m fazer variar o volume total.
32. a) Pelo volume dos frascos: VII < VIII < VI percebemos que o frasco II evaporou mais rapidamente e isto significa que a<<strong>br</strong> />
substância contida nele apresenta a maior pressão <strong>de</strong> vapor seguida da substância contida no frasco III e por último a<<strong>br</strong> />
substância contida no frasco I, ou seja, a or<strong>de</strong>m crescente <strong>de</strong> pressão <strong>de</strong> vapor é dada por: PV(I) < PV(III) < PV(II).<<strong>br</strong> />
Como a mistura da substância I <strong>com</strong> a substância III é azeotrópica, ela não po<strong>de</strong> ser separada apenas por <strong>de</strong>stilação<<strong>br</strong> />
fracionada, mas a <strong>de</strong>stilação fracionada é um processo físico a<strong>de</strong>quado para a separação dos solventes na mistura (I + II).<<strong>br</strong> />
b) Como a mistura <strong>de</strong> II e III é uma mistura <strong>com</strong>um ela terá a seguinte curva <strong>de</strong> aquecimento, dada na figura 1:<<strong>br</strong> />
(Observação: S = sólido; L = líquido; G = vapor.)<<strong>br</strong> />
----- split ---><<strong>br</strong> />
Como a mistura <strong>de</strong> I e III é azeotrópica ela terá a seguinte curva <strong>de</strong> aquecimento, dada na figura 2:<<strong>br</strong> />
----- split ---><<strong>br</strong> />
Ou seja, <strong>com</strong>o po<strong>de</strong>mos observar, a temperatura <strong>de</strong> ebulição da mistura entre II e III varia. Já a temperatura <strong>de</strong> ebulição da<<strong>br</strong> />
mistura entre I e III se mantém constante (mistura azeotrópica).<<strong>br</strong> />
33. a) Não é possível a distinção das amostras através <strong>de</strong> seus pontos <strong>de</strong> fusão pois, <strong>com</strong>o o termômetro apresenta uma<<strong>br</strong> />
incerteza <strong>de</strong> 1°C, temos:<<strong>br</strong> />
- ponto <strong>de</strong> fusão do p-clorofenol = 43,5°C. A <strong>de</strong>terminação experimental forneceria um resultado entre 42,5°C e 44,5°C.<<strong>br</strong> />
- ponto <strong>de</strong> fusão do o-nitrofenol = 45°. A <strong>de</strong>terminação experimental fornece resultado entre 44°C e 46°C.<<strong>br</strong> />
Existe uma so<strong>br</strong>eposição dos intervalos em que se situam os resultados possíveis.<<strong>br</strong> />
b) Ka = [ArO][H®]/[ArOH] e [H®] = [ArO], logo<<strong>br</strong> />
Ka = [H®]£/[ArOH] ë [H®] = Ë(Ka. [ArOH]).
Utilizando os valores do enunciado:<<strong>br</strong> />
- p-clorofenol: [H®] =Ë(1,0.10 ª.10£) = Ë(10¢¢)=<<strong>br</strong> />
= 10¦'¦ mol.L¢ e, portanto, pH = 5,5.<<strong>br</strong> />
- o-nitrofenol: [H®] = Ë(1,0.10¨.10£) = Ë(10ª) =<<strong>br</strong> />
= 10¥'¦ mol.L¢ e, portanto, pH = 4,5.<<strong>br</strong> />
Conclusão: O pH é indicativo para i<strong>de</strong>ntificar estas substâncias.<<strong>br</strong> />
34. E = 6530,3682 MeV<<strong>br</strong> />
35. 1) São núcleos <strong>de</strong> He (2p e 2n)<<strong>br</strong> />
2) Praticamente todas as partículas alfa seriam <strong>de</strong>sviadas.<<strong>br</strong> />
3) Poucas partículas alfa sofreriam <strong>de</strong>svio, o qual era muito gran<strong>de</strong>.<<strong>br</strong> />
4) A massa do átomo está praticamente toda concentrada num só ponto: núcleo, <strong>com</strong> os prótons, e os elétrons giram em<<strong>br</strong> />
torno na eletrosfera.<<strong>br</strong> />
36. a) ¤¦ CØ, ¤¨CØ<<strong>br</strong> />
b) AØC؃, cloreto <strong>de</strong> alumínio<<strong>br</strong> />
37. a) Cálcio e estrôncio são elementos representativos da mesma coluna da tabela periódica (ou mesma família),<<strong>br</strong> />
apresentando portanto a mesma distribuição eletrônica na camada <strong>de</strong> valência (no caso, última camada), e<<strong>br</strong> />
conseqüentemente, proprieda<strong>de</strong>s químicas semelhantes.<<strong>br</strong> />
b) Com a emissão <strong>de</strong> uma partícula beta há o acréscimo <strong>de</strong> uma unida<strong>de</strong> no número atômico, sem contudo acarretar<<strong>br</strong> />
mudanças no número <strong>de</strong> massa. Ou seja, o elemento X terá número <strong>de</strong> massa 47, e número atômico 21. Consulta a tabela<<strong>br</strong> />
periódica revela ser este elemento o Escândio.<<strong>br</strong> />
38. a) O que caracteriza e i<strong>de</strong>ntifica um átomo é o seu núcleo, e durante as reações químicas o núcleo <strong>de</strong> um átomo<<strong>br</strong> />
permanece inalterado. Os constituintes principais da primeira folha <strong>de</strong> planta e dos lábios <strong>de</strong> Platão eram C, N, H e O, os<<strong>br</strong> />
quais apenas H e O são constituintes principais da gota <strong>de</strong> água, e não po<strong>de</strong>riam transformar-se através <strong>de</strong> reações<<strong>br</strong> />
químicas no metal da espada dos heróis.<<strong>br</strong> />
b) A questão é aberta, sendo portanto possíveis diversas respostas. Porém, em sendo um átomo do constituinte principal da<<strong>br</strong> />
ma<strong>de</strong>ira (a celulose, substância <strong>com</strong>posta <strong>de</strong> hidrogênio, oxigênio e carbono) a incorporação <strong>de</strong> um átomo <strong>de</strong> hidrogênio, ou<<strong>br</strong> />
<strong>de</strong> oxigênio, a esta envolve em alguma etapa o processo <strong>de</strong> fotossíntese. Por exemplo: por evaporação uma molécula <strong>de</strong><<strong>br</strong> />
água abandona o lago da Galiléia, é carreada pelos ventos até o continente on<strong>de</strong> se con<strong>de</strong>nsa e é absorvida pelo solo. Em<<strong>br</strong> />
seguida é utilizada no mecanismo <strong>de</strong> fotossíntese <strong>de</strong> uma árvore para constituir a celulose do nó da ma<strong>de</strong>ira.<<strong>br</strong> />
Nota da banca: A utilização do singular em algumas passagens - viajando nas incessantes transformações da substância,<<strong>br</strong> />
espada dos heróis - parece indicar que Eça <strong>de</strong> Queiroz não tem mesmo a intenção <strong>de</strong> referir-se a um átomo cientificamente<<strong>br</strong> />
possível, mas sim a um átomo simbólico, literário, filosófico e metafísico.<<strong>br</strong> />
39. P (¨ªM) = 55%<<strong>br</strong> />
P (©¢M) = 45%<<strong>br</strong> />
40. 29
41. a) p = 17 ; e = 17 ; n = 20<<strong>br</strong> />
b) ¤¦CØ = 76 % ; ¤¨CØ = 24 %<<strong>br</strong> />
42. a) Ao se em<strong>br</strong>ulharem as frutas, o gás mencionado é liberado, acelerando o processo <strong>de</strong> amadurecimento, <strong>de</strong>vido ao<<strong>br</strong> />
contato permanente <strong>com</strong> as frutas.<<strong>br</strong> />
b) C‚H„ - eteno ou etileno<<strong>br</strong> />
c) Observe as figuras a seguir<<strong>br</strong> />
43. a) Isótopos do elemento químico carbono <strong>de</strong> números <strong>de</strong> massa 12 e 13.<<strong>br</strong> />
b) 12,01 u.<<strong>br</strong> />
44. a) Z = 17<<strong>br</strong> />
b) 1110 g<<strong>br</strong> />
45. a) A - MnO(OH)<<strong>br</strong> />
B - SrSO„<<strong>br</strong> />
C - CaCOƒ<<strong>br</strong> />
b) CaCOƒ ë libera gás (CO‚) em reação <strong>com</strong> ácidos.