HALOGÉNEZETT SZÉNHIDROGÉNEK
HALOGÉNEZETT SZÉNHIDROGÉNEK
HALOGÉNEZETT SZÉNHIDROGÉNEK
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>HALOGÉNEZETT</strong> <strong>SZÉNHIDROGÉNEK</strong><br />
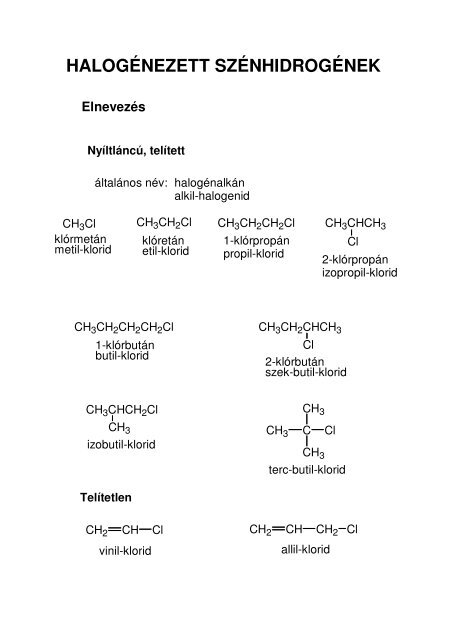
Elnevezés<br />
Nyíltláncú, telített<br />
általános név: halogénalkán<br />
alkil-halogenid<br />
CH3Cl CH3CH2Cl CH3CH2CH2Cl CH3CHCH3 klórmetán<br />
metil-klorid<br />
klóretán<br />
etil-klorid<br />
1-klórpropán<br />
propil-klorid<br />
Cl<br />
2-klórpropán<br />
izopropil-klorid<br />
CH3CH2CH2CH2Cl CH3CH2CHCH3 1-klórbután<br />
butil-klorid<br />
Cl<br />
2-klórbután<br />
szek-butil-klorid<br />
CH 3CHCH 2Cl<br />
CH 3<br />
izobutil-klorid<br />
Telítetlen<br />
CH 3<br />
CH 3<br />
C Cl<br />
CH 3<br />
terc-butil-klorid<br />
CH 2 CH Cl CH 2 CH CH 2 Cl<br />
vinil-klorid<br />
allil-klorid
Aromás<br />
Cl Cl<br />
Br<br />
CH 2Cl<br />
klórbenzol 1-bróm-2-klórbenzol benzil-klorid<br />
Többértékű<br />
CH 3Cl CH 2Cl 2 CHCl 3 CCl 4<br />
klórmetán<br />
metil-klorid<br />
C<br />
Cl<br />
diklórmetán<br />
metilén-klorid<br />
Cl C C<br />
Cl Cl<br />
triklórmetán<br />
kloroform<br />
tetraklórmetán<br />
szén-tetraklorid<br />
C C C<br />
Cl Cl<br />
geminális vicinális diszjunkt
Kötésrendszer<br />
C F<br />
C Cl<br />
C Br<br />
C I<br />
Kötéshossz (pm) Kötési energia (kJ/mól)<br />
141<br />
177<br />
194<br />
212<br />
FIZIKAI TULAJDONSÁGOK<br />
Forráspont (°C)<br />
Me<br />
Et<br />
F<br />
-78<br />
-32<br />
Cl<br />
-24<br />
12<br />
CH 3CH 2CH 2CH 2Br CH 3CH 2CHCH 3<br />
102 °C<br />
Br<br />
Br<br />
-3<br />
38<br />
488<br />
326<br />
278<br />
210<br />
CH 3<br />
I<br />
CH 3<br />
C<br />
CH 3<br />
91 °C 73 °C<br />
42<br />
72<br />
Br
Dipólusmomentum<br />
elektronegativitás<br />
C H<br />
Példák<br />
C<br />
2.5<br />
H<br />
2.1<br />
δ+ δ-<br />
C X<br />
-I effektus<br />
F<br />
4.0<br />
Cl<br />
3.0<br />
Br<br />
2.8<br />
δ- δ+<br />
C X<br />
+I effektus<br />
CH 3F CH 3Cl CH 3Br CH 3I<br />
µ (D) 1.83 1.86 1.82 1.48<br />
CH 3Br CH 3CH 2Br CH 3CH 2CH 2Br<br />
1.82 1.88 1.93<br />
H<br />
C C<br />
H<br />
Cl Cl<br />
Cl<br />
C C<br />
H Cl<br />
1.85 0<br />
H<br />
I<br />
2.5
NUKLEOFIL SZUBSZTITÚCIÓS REAKCIÓK<br />
Nu + R X R Nu + X<br />
nukleofil szubsztrát termék távozó csoport<br />
Példák<br />
- -<br />
-<br />
-<br />
HO + CH3 Cl CH3 OH + Cl<br />
-<br />
-<br />
CH3O + CH3CH2 Br CH3CH2 OCH3 + Br<br />
-<br />
-<br />
I + CH3CH2 Br CH3CH2 I + Br
Az S N reakciók mechanizmusa<br />
- 60°C<br />
-<br />
HO + CH3 Cl CH3 OH +<br />
H<br />
Cl<br />
2O<br />
v = k[CH 3Cl][OH - ] S N2<br />
H<br />
H H<br />
H<br />
δ- δ-<br />
H<br />
C Cl HO C Cl HO C<br />
H<br />
H<br />
+<br />
-<br />
- -<br />
HO<br />
Cl<br />
H H<br />
G<br />
reaktánsok<br />
átmeneti állapot<br />
reakciókoordináta<br />
termékek
Az S N2 sztereomechanizmusa<br />
CH 3<br />
Cl<br />
inverzió<br />
-<br />
OH CH3 OH<br />
-<br />
+ Cl<br />
transz-1-klór-2-metilciklopentán cisz-2-metilciklopentanol<br />
CH 3<br />
S N2<br />
CH 3<br />
-<br />
HO<br />
H<br />
C Br<br />
SN2 HO C<br />
H<br />
-<br />
+ Br<br />
C6H13 C6H13 (R)-(-)-2-brómoktán<br />
[α] D = -34.2<br />
(S)-(+)-2-oktanol<br />
[α] D = +9.9
S N2 reakcióval előállítható vegyületek típusai<br />
R X<br />
-X -<br />
I -<br />
HO -<br />
RO -<br />
R'-CO-O -<br />
HS -<br />
RS -<br />
'RC C -<br />
CN -<br />
H 2N -<br />
N 3 -<br />
R I<br />
R OH<br />
R OR'<br />
R O-CO-R'<br />
R SH<br />
R SR'<br />
R C CR'<br />
R CN<br />
R NH 2<br />
R N 3<br />
alkil-jodid<br />
alkohol<br />
éter<br />
észter<br />
tiol<br />
tioéter<br />
alkin<br />
nitril<br />
amin<br />
azid
CH 3 C<br />
CH 3<br />
CH 3<br />
Cl<br />
+<br />
HO -<br />
aceton<br />
H 2O<br />
v = k[(CH 3) 3CCl] S N1<br />
CH 3<br />
CH 3 C<br />
1. lassú<br />
CH3 C Cl<br />
CH3 C<br />
+<br />
2.<br />
G<br />
CH 3<br />
CH 3<br />
CH 3<br />
+<br />
CH3 C<br />
CH 3<br />
C<br />
CH 3<br />
Cl<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
OH - gyors<br />
(vagy H2O) CH3 C<br />
CH 3<br />
CH 3<br />
C+<br />
CH 3<br />
Cl -<br />
OH Cl -<br />
+<br />
+ Cl -<br />
CH 3<br />
CH 3<br />
CH 3<br />
OH<br />
C<br />
reakciókoordináta<br />
CH 3<br />
CH 3<br />
OH
1.<br />
2.<br />
Az S N1 sztereomechanizmusa<br />
CH 3CH 2CH 2<br />
CH 3<br />
C Br<br />
CH3CH2 (S)-3-bróm-3-metilhexán<br />
CH 3CH 2CH 2<br />
C+<br />
CH 3 CH 2CH 3<br />
-Br -<br />
CH 3CH 2CH 2<br />
CH 3CH 2CH 2<br />
+<br />
C<br />
CH 3 CH 2CH 3<br />
OH - C OH<br />
CH 3<br />
CH 3CH 2<br />
+<br />
HO C<br />
CH 2CH 2CH 3<br />
CH 3<br />
CH 2CH 3<br />
racemizáció<br />
(S)-3-bróm-3-metilhexán racém 3-metilhexán-3-ol
S N1 típusú szolvolízises reakciók<br />
R X<br />
-X -<br />
-H -<br />
Mechanizmus<br />
CH 3<br />
H2O hidrolízis<br />
R'OH<br />
alkoholízis<br />
R'COOH<br />
acidolízis<br />
NH 3<br />
ammonolízis<br />
R OH<br />
R OR'<br />
R O-CO-R'<br />
R NH 2<br />
lassú<br />
1. CH3 C Cl<br />
CH3 C+<br />
2.<br />
3.<br />
CH 3<br />
CH 3<br />
CH3 C+<br />
CH 3 C<br />
CH 3<br />
O<br />
H<br />
H<br />
gyors<br />
CH 3<br />
CH 3<br />
CH 3 C<br />
+ Cl -<br />
CH3 +<br />
CH 3<br />
O<br />
alkohol<br />
éter<br />
észter<br />
amin<br />
CH3 H<br />
CH3 + gyors<br />
+<br />
CH 3<br />
O<br />
H<br />
O<br />
H<br />
H CH 3 C<br />
CH 3<br />
H<br />
H<br />
OH + H O H<br />
H
Az S N reakciók sebességét befolyásoló tényezők<br />
H<br />
1<br />
oldószer<br />
-<br />
-<br />
R X + Nu<br />
R Nu + X<br />
1 2<br />
H<br />
H<br />
R-csoport<br />
S N2<br />
C<br />
R Br + I -<br />
R<br />
CH 3-<br />
CH 3CH 2-<br />
(CH 3) 2CH-<br />
(CH 3) 3C-<br />
CH 3<br />
4<br />
aceton<br />
k rel<br />
145<br />
1<br />
0.008<br />
0.0005<br />
> H C > C ><br />
H<br />
CH 3<br />
CH 3<br />
H<br />
3<br />
R I + Br -<br />
CH 3<br />
CH 3<br />
CH 3<br />
C
S N1<br />
R Br + H2O +<br />
R OH + HBr<br />
H<br />
H<br />
H<br />
C<br />
R<br />
relatív stabilitás<br />
CH 3-<br />
CH 3CH 2-<br />
(CH 3) 2CH-<br />
(CH 3) 3C-<br />
k rel<br />
(1)<br />
(1)<br />
12<br />
10 6<br />
CH3 CH3 CH3 +<br />
H C<br />
+<br />
CH3 +<br />
C CH3 C<br />
+<br />
H<br />
R +<br />
Br -<br />
< < <<br />
H<br />
CH 3
2<br />
Nukleofil reagens<br />
S N1 nem befolyásol<br />
S N2<br />
a) bázicitás (azonos támadó atom esetén)<br />
RO -<br />
savi erősség<br />
> > > ROH > H2O HO -<br />
RCOO -<br />
+<br />
ROH < H2O < RCOOH < ROH2 <<br />
b) polározhatóság<br />
I -<br />
HS -<br />
RS -<br />
> > ><br />
><br />
><br />
Br -<br />
HO -<br />
RO -<br />
Cl -<br />
F -<br />
H 3O +
3 Távozó csoport<br />
bázicitás<br />
gyenge bázis<br />
jó távozó csoport<br />
savi erősség<br />
I < < <<br />
- Br- Cl- F- erős bázis<br />
rossz távozó csoport<br />
HI > HBr > HCl > HF<br />
nem halogenid távozó csoportok<br />
RSO2O > > ><br />
- CH3COO- C6H5O- HO- RSO 2OH<br />
pK negatív<br />
CH 3COOH<br />
pK = 4.76<br />
C 6H 5OH<br />
pK = 10<br />
H 2O<br />
pK = 15.7<br />
HBr<br />
R OH +<br />
Br<br />
R OH2 R Br<br />
-<br />
-Br- -H2O R'-SO 2-Cl<br />
-HCl<br />
Br -<br />
R-O-SO 2-R'<br />
Br -<br />
-R'-SO 2-O -
4 Oldószer<br />
CH 3 C<br />
oldószer<br />
polaritás<br />
CH 3<br />
CH 3<br />
S N1<br />
CH 3<br />
CH 3<br />
δ+ δ−<br />
Cl CH3 C Cl<br />
+<br />
CH3 C<br />
CH 3<br />
poláros oldószer segít<br />
protikus aprotikus<br />
H 2O<br />
HCOOH<br />
CH 3OH<br />
CH 3CH 2OH<br />
CH 3COOH<br />
CH 3<br />
O<br />
S CH 3<br />
H-CO-N(CH 3) 2<br />
CH 3CN<br />
CH 3-CO-CH 3<br />
CH 3<br />
+ Cl -<br />
dielektromos<br />
állandó<br />
80<br />
59<br />
49<br />
37<br />
36<br />
33<br />
24<br />
21<br />
6
Szubsztrát<br />
Nukleofil<br />
Távozó csoport<br />
Oldószer<br />
S N1 S N2<br />
tercier primer<br />
semleges molekula<br />
gyakran oldószer<br />
(szolvolízis)<br />
anion<br />
gyenge bázis gyenge bázis<br />
poláros protikus leggyakrabban<br />
poláros aprotikus
S N REAKCIÓK TELÍTETLEN <strong>HALOGÉNEZETT</strong><br />
<strong>SZÉNHIDROGÉNEK</strong>KEL<br />
Vinil- és aril-halogenidek<br />
C C X Cl csökkent reaktivitás<br />
-<br />
+<br />
CH2 CH Cl CH2 CH Cl CH2 CH Cl<br />
S N1<br />
S N2<br />
Allil- és benzil-halogenidek<br />
erősebb kötés<br />
C C C X CH2Cl fokozott reaktivitás<br />
CH 2Cl<br />
CH<br />
CH 2<br />
CH2 CH CH2 Cl<br />
1/2+<br />
CH2 CH<br />
1/2+<br />
CH2 allil kation<br />
HO -<br />
HO<br />
H H<br />
C<br />
CH<br />
CH 2<br />
Cl<br />
-<br />
CH 2OH<br />
CH<br />
CH 2<br />
+ Cl -
AROMÁS NUKLEOFIL SZUBSZTITÚCIÓ<br />
Cl<br />
Cl OH<br />
+<br />
NO 2<br />
100 °C<br />
130 °C<br />
OH<br />
Cl OH<br />
35 °C<br />
NO 2<br />
NO2 NO2 NO2<br />
NO2<br />
NO 2<br />
NaOH<br />
NO 2<br />
Cl NH 2<br />
NO2 NO2 NO2 NO2 25 °C<br />
+<br />
NH 3<br />
NaHCO 3<br />
NaHCO 3<br />
NO 2 NO2
1.<br />
2.<br />
Mechanizmus<br />
X<br />
Alifás S N2<br />
Aromás S N2<br />
Nu<br />
X Nu<br />
-<br />
addíció<br />
X Nu X Nu X Nu<br />
-<br />
-<br />
X Nu<br />
-<br />
egylépéses<br />
kétlépéses<br />
X Nu<br />
-X -<br />
-<br />
-<br />
dönt<br />
C-X erősség<br />
addíció C-re<br />
R<br />
elektronszívó R segít<br />
Nu<br />
elimináció<br />
sorrend<br />
FI
E-A mechanizmusú aromás nukleofil szubsztitúció<br />
1.<br />
2.<br />
Br<br />
+ KNH 2<br />
Mechanizmus<br />
Bizonyíték<br />
Br<br />
H<br />
NH 3<br />
"A"<br />
NH 2<br />
NH 3<br />
-30 °C<br />
Br<br />
* *<br />
KNH 2<br />
-<br />
"E"<br />
-Br -<br />
-<br />
+<br />
NH3 NH 3<br />
NH 2<br />
dehidrobenzol<br />
(benzin)<br />
*<br />
*<br />
NH 2<br />
NH 2<br />
NH 2
ELIMINÁCIÓS REAKCIÓK<br />
Példák<br />
CH 3 CH<br />
Br<br />
CH 3 C<br />
CH 3 C<br />
C C<br />
Y Z<br />
H<br />
C C<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
X<br />
Br<br />
CH 3<br />
-YZ<br />
-H X<br />
dehidrohalogénezés<br />
C 2H 5O -<br />
C 2H 5O -<br />
EtOH<br />
C C<br />
C C<br />
CH 2 CH CH 3<br />
CH 2 C<br />
Cl CH 2 C<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3
Az eliminációs reakciók mechanizmusa<br />
CH3 CH CH3 +<br />
Br<br />
C 2H 5O -<br />
55 °C<br />
EtOH<br />
CH 2 CH CH 3<br />
v = k[CH 3-CHBr-CH 3][C 2H 5O - ] E 2<br />
C 2H 5O -<br />
H<br />
H C<br />
H<br />
Br<br />
C<br />
H<br />
CH 3<br />
H<br />
H<br />
C C<br />
CH 3<br />
H<br />
C 2H 5O<br />
H<br />
H C<br />
H<br />
EtOH Br -<br />
+ +<br />
Br<br />
C<br />
H<br />
CH 3<br />
C2H5OH Br -<br />
+ +<br />
-
Az E 2 sztereomechanizmusa<br />
C<br />
Példa<br />
H<br />
C(CH 3) 3<br />
H<br />
C(CH 3) 3<br />
H<br />
Br<br />
X<br />
A B<br />
A<br />
D C D<br />
Br<br />
B -<br />
(H 3C) 3C<br />
(H 3C) 3C<br />
H<br />
H<br />
C<br />
Br<br />
H<br />
Br<br />
D<br />
B<br />
A<br />
gyors<br />
E 2<br />
E 2<br />
X<br />
B<br />
B<br />
-<br />
C(CH 3) 3
Termékösszetétel<br />
CH 3 CH CH<br />
HO<br />
H<br />
Cl<br />
-H 2O<br />
-Cl -<br />
CH 3 CH CH<br />
CH 2<br />
H<br />
H<br />
Cl<br />
-<br />
OH<br />
CH 2<br />
H<br />
CH 3 CH CH<br />
H<br />
-H 2O<br />
-Cl -<br />
CH 2<br />
CH 3 CH CH CH 3 CH 3 CH 2 CH CH 2<br />
főtermék<br />
Zajcev szabály<br />
- -<br />
Cl<br />
H OH
E 2 reakció nagy térigényű bázissal<br />
CH 3 CH C<br />
H<br />
Br<br />
CH 3<br />
CH 2<br />
-<br />
OC(CH3) 3<br />
CH 3 CH C CH 3 CH 2 C<br />
27%<br />
CH 3<br />
CH 3<br />
H<br />
73%<br />
CH 3<br />
CH 2
1.<br />
2.<br />
CH 3 C<br />
CH 3<br />
Br<br />
CH 3<br />
Mechanizmus<br />
H<br />
C 2H 5OH<br />
hevítés<br />
EtOH<br />
CH 2 C<br />
CH 3<br />
CH 3<br />
v = k[(CH 3) 3-CBr] E 1<br />
CH 3 C<br />
H<br />
CH 3<br />
Br<br />
C C<br />
+<br />
H<br />
CH 3<br />
CH3 CH3 C<br />
+<br />
CH 3<br />
Termékösszetétel<br />
CH 3 C<br />
CH 3<br />
Cl<br />
CH 2 C<br />
CH 3<br />
-Cl -<br />
CH 2 C<br />
CH 3<br />
CH 3<br />
CH2 CH3 CH3 C<br />
+<br />
CH 3<br />
+ +<br />
CH 3<br />
H +<br />
Br -<br />
CH 3 + Br -<br />
CH 3<br />
+<br />
+ C2H5OH2 CH 2 CH 3<br />
CH2 CH3 CH3 C CH CH3 20% 80%<br />
Zajcev szabály<br />
-H +<br />
-H +
Párhuzamos reakciók<br />
E 2<br />
Y nukleofil vagy bázis<br />
C C<br />
H<br />
X<br />
-<br />
Y<br />
S N2<br />
1. R-csoport szerkezete<br />
primer<br />
tercier<br />
2. Bázis, nukleofil<br />
S N2<br />
-X -<br />
E 2<br />
-X - , -HY<br />
S N2<br />
E 2<br />
C C<br />
H Y<br />
C C<br />
jó nukleofil, gyenge bázis (pl. I - , CH 3COO - )<br />
rossz nukleofil, erős bázis (pl. NH 2 - , H - )<br />
nagy térigényű bázis E 2<br />
S N2<br />
E 2
E 1<br />
C C<br />
H<br />
X<br />
+<br />
C C<br />
H<br />
-X -<br />
YH<br />
S N1<br />
S N1<br />
E 1<br />
C C<br />
H Y<br />
C C<br />
Egymás mellett lejátszódó reakciók legtöbbször keveréktermék<br />
Összefoglalás<br />
Halogénatom<br />
R-csoport növekvő rendűsége<br />
Oldószer polaritásának növelése<br />
Erős bázis, gyenge nukleofil<br />
Gyenge bázis, jó nukleofil<br />
I - > Br - > Cl - > F -<br />
S N1, E 1, E 2 > S N2<br />
S N1, E 1 > S N2, E 2<br />
E > S N<br />
S N > E
Cl C<br />
Az α-elimináció<br />
Cl<br />
Cl<br />
H<br />
-<br />
OH<br />
-H2O Cl<br />
Cl<br />
-<br />
C<br />
R<br />
C C<br />
H<br />
+ CCl2<br />
H R<br />
Cl<br />
-Cl -<br />
R H<br />
H<br />
C C<br />
R<br />
C<br />
Cl Cl<br />
CCl 2<br />
diklór-karbén
Halogénezett szénhidrogének reakciója magnéziummal<br />
Et2O R X + Mg R MgX<br />
Szerkezet<br />
δ-<br />
R<br />
δ+<br />
MgX<br />
Bázikus jelleg<br />
R MgX<br />
H Q<br />
Grignard reagens<br />
R H + Q - Mg + X<br />
Q-H = HCl, H-OH, R-OH, R-COOH, R C CH
A Grignard reagens felhasználása szintézisekben<br />
1. Reakció oxovegyületekkel; nukleofil addíció (Ad N)<br />
1.<br />
2.<br />
δ- δ+ δ+<br />
-<br />
R MgBr +<br />
C O R C O<br />
alkoholát<br />
-<br />
R C O + H Cl R C OH<br />
alkohol<br />
a)<br />
H<br />
C<br />
H<br />
O<br />
1. R MgBr<br />
2. HCl<br />
R CH2OH formaldehid<br />
primer<br />
b)<br />
R1 C<br />
H<br />
O<br />
1. R MgBr<br />
2. HCl<br />
R CH OH<br />
aldehid<br />
szekunder<br />
R1 1. R MgBr<br />
c) C O<br />
R C<br />
2. HCl<br />
R 2<br />
keton<br />
R 1<br />
R 1<br />
R 2<br />
tercier<br />
OH
1.<br />
2.<br />
2. Reakció észterekkel<br />
1.<br />
2.<br />
δ−<br />
R<br />
δ+<br />
MgBr + R1 O<br />
C OQ<br />
δ+<br />
R1 -<br />
O<br />
C<br />
R<br />
OH<br />
R 1 C<br />
R<br />
R<br />
tercier alkohol<br />
3. Reakció oxiránnal (epoxiddal)<br />
δ−<br />
R MgBr<br />
O<br />
+ H 2C CH 2<br />
1.<br />
R MgBr<br />
2. HCl<br />
O<br />
R 1 C<br />
-<br />
R CH2CH2 O<br />
R<br />
keton<br />
OQ<br />
-<br />
R CH2CH2 O + HCl R CH2CH2 OH<br />
4. Reakció széndioxiddal<br />
δ−<br />
R MgBr<br />
R C<br />
-<br />
O<br />
O<br />
O C O R C<br />
+ HCl R C<br />
-<br />
O<br />
O<br />
OH<br />
O<br />
karbonsav