Visualizar PDF - Tecnologia em Metalurgia, Materiais e Mineração
Visualizar PDF - Tecnologia em Metalurgia, Materiais e Mineração
Visualizar PDF - Tecnologia em Metalurgia, Materiais e Mineração
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
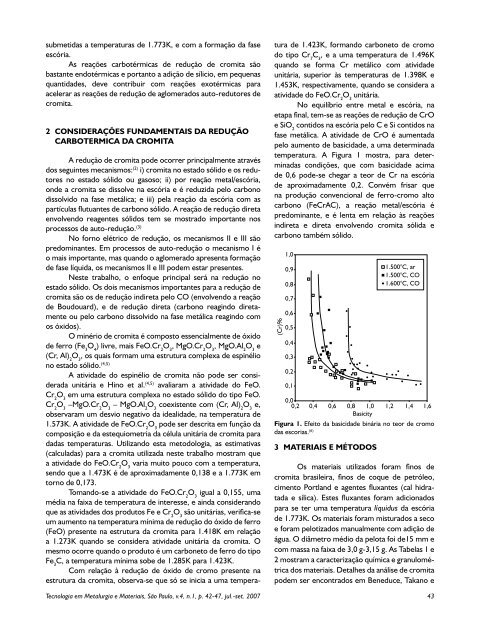
submetidas a t<strong>em</strong>peraturas de 1.773K, e com a formação da faseescória.As reações carbotérmicas de redução de cromita sãobastante endotérmicas e portanto a adição de sílicio, <strong>em</strong> pequenasquantidades, deve contribuir com reações exotérmicas paraacelerar as reações de redução de aglomerados auto-redutores decromita.2 CONSIDERAÇÕES FUNDAMENTAIS da reduçãocarbotermica da cromitaA redução de cromita pode ocorrer principalmente atravésdos seguintes mecanismos: (2) i) cromita no estado sólido e os redutoresno estado sólido ou gasoso; ii) por reação metal/escória,onde a cromita se dissolve na escória e é reduzida pelo carbonodissolvido na fase metálica; e iii) pela reação da escória com aspartículas flutuantes de carbono sólido. A reação de redução diretaenvolvendo reagentes sólidos t<strong>em</strong> se mostrado importante nosprocessos de auto-redução. (3)No forno elétrico de redução, os mecanismos II e III sãopredominantes. Em processos de auto-redução o mecanismo I éo mais importante, mas quando o aglomerado apresenta formaçãode fase líquida, os mecanismos II e III pod<strong>em</strong> estar presentes.Neste trabalho, o enfoque principal será na redução noestado sólido. Os dois mecanismos importantes para a redução decromita são os de redução indireta pelo CO (envolvendo a reaçãode Boudouard), e de redução direta (carbono reagindo diretamenteou pelo carbono dissolvido na fase metálica reagindo comos óxidos).O minério de cromita é composto essencialmente de óxidode ferro (Fe 3O 4) livre, mais FeO.Cr 2O 3, MgO.Cr 2O 3, MgO.Al 2O 3e(Cr, Al) 2O 3, os quais formam uma estrutura complexa de espinéliono estado sólido. (4,5)A atividade do espinélio de cromita não pode ser consideradaunitária e Hino et al. (4,5) avaliaram a atividade do FeO.Cr 2O 3<strong>em</strong> uma estrutura complexa no estado sólido do tipo FeO.Cr 2O 3–MgO.Cr 2O 3– MgO.Al 2O 3coexistente com (Cr, Al) 2O 3e,observaram um desvio negativo da idealidade, na t<strong>em</strong>peratura de1.573K. A atividade de FeO.Cr 2O 3pode ser descrita <strong>em</strong> função dacomposição e da estequiometria da célula unitária de cromita paradadas t<strong>em</strong>peraturas. Utilizando esta metodologia, as estimativas(calculadas) para a cromita utilizada neste trabalho mostram quea atividade do FeO.Cr 2O 3varia muito pouco com a t<strong>em</strong>peratura,sendo que a 1.473K é de aproximadamente 0,138 e a 1.773K <strong>em</strong>torno de 0,173.Tomando-se a atividade do FeO.Cr 2O 3igual a 0,155, umamédia na faixa de t<strong>em</strong>peratura de interesse, e ainda considerandoque as atividades dos produtos Fe e Cr 2O 3são unitárias, verifica-seum aumento na t<strong>em</strong>peratura mínima de redução do óxido de ferro(FeO) presente na estrutura da cromita para 1.418K <strong>em</strong> relaçãoa 1.273K quando se considera atividade unitária da cromita. Omesmo ocorre quando o produto é um carboneto de ferro do tipoFe 3C, a t<strong>em</strong>peratura mínima sobe de 1.285K para 1.423K.Com relação à redução de óxido de cromo presente naestrutura da cromita, observa-se que só se inicia a uma t<strong>em</strong>pera-tura de 1.423K, formando carboneto de cromodo tipo Cr 7C 3, e a uma t<strong>em</strong>peratura de 1.496Kquando se forma Cr metálico com atividadeunitária, superior às t<strong>em</strong>peraturas de 1.398K e1.453K, respectivamente, quando se considera aatividade do FeO.Cr 2O 3unitária.No equilíbrio entre metal e escória, naetapa final, t<strong>em</strong>-se as reações de redução de CrOe SiO 2contidos na escória pelo C e Si contidos nafase metálica. A atividade de CrO é aumentadapelo aumento de basicidade, a uma determinadat<strong>em</strong>peratura. A Figura 1 mostra, para determinadascondições, que com basicidade acimade 0,6 pode-se chegar a teor de Cr na escóriade aproximadamente 0,2. Convém frisar quena produção convencional de ferro-cromo altocarbono (FeCrAC), a reação metal/escória épredominante, e é lenta <strong>em</strong> relação às reaçõesindireta e direta envolvendo cromita sólida ecarbono também sólido.(Cr)%1,00,90,80,70,60,50,40,30,20,11.500°C, ar1.500°C, CO1.600°C, CO0,00,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6BasicityFigura 1. Efeito da basicidade binária no teor de cromodas escorias. (6)3 MATERIAIS E MÉTODOSOs materiais utilizados foram finos decromita brasileira, finos de coque de petróleo,cimento Portland e agentes fluxantes (cal hidratadae sílica). Estes fluxantes foram adicionadospara se ter uma t<strong>em</strong>peratura líquidus da escóriade 1.773K. Os materiais foram misturados a secoe foram pelotizados manualmente com adição deágua. O diâmetro médio da pelota foi de15 mm ecom massa na faixa de 3,0 g-3,15 g. As Tabelas 1 e2 mostram a caracterização química e granulométricados materiais. Detalhes da análise de cromitapod<strong>em</strong> ser encontrados <strong>em</strong> Beneduce, Takano e<strong>Tecnologia</strong> <strong>em</strong> <strong>Metalurgia</strong> e <strong>Materiais</strong>, São Paulo, v.4, n.1, p. 42-47, jul.-set. 2007 43