Opracowanie wyników - AGH
Opracowanie wyników - AGH
Opracowanie wyników - AGH
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Opracowanie</strong> <strong>wyników</strong><br />
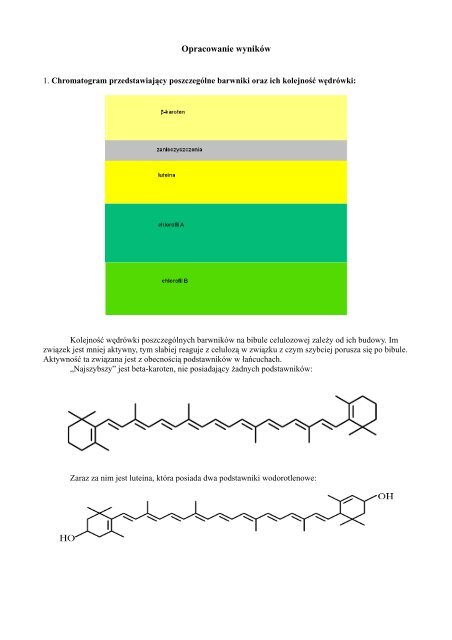
1. Chromatogram przedstawiający poszczególne barwniki oraz ich kolejność wędrówki:<br />
Kolejność wędrówki poszczególnych barwników na bibule celulozowej zależy od ich budowy. Im<br />
związek jest mniej aktywny, tym słabiej reaguje z celulozą w związku z czym szybciej porusza się po bibule.<br />
Aktywność ta związana jest z obecnością podstawników w łańcuchach.<br />
„Najszybszy” jest beta-karoten, nie posiadający żadnych podstawników:<br />
Zaraz za nim jest luteina, która posiada dwa podstawniki wodorotlenowe:
Kolejna jest wiolaksantyna, posiadająca dwa dodatkowe tleny i dwie grupy OH. Nie zaznaczyłyśmy<br />
jej na naszym chromatogramie, gdyż pietruszka posiada bardzo niewielkie ilości tego barwnika i podczas<br />
doświadczenia pasek odpowiadający temu barwnikowi był niemal niewidoczny.<br />
Następnie na chromatogramie można było zaobserwować chlorofil A, który oprócz podstawników<br />
azotowych i magnezowego posiada w łańcuchu 5 podstawników tlenowych i jeden wodorowy:
Na końcu zaobserwowałyśmy barwny pasek odpowiadający chlorofilowi B, który z powodu<br />
największej liczby podstawników najbardziej reagował z celulozową bibułą:<br />
2. Wykresy przedstawiające kolejne widma absorpcji badanych przez nas barwników, ich maksima<br />
oraz stosunki absorbancji barwników chlorofilowych.<br />
Widmo 1: z powodu zbyt wysokiego stężenia ekstraktu z pietruszki (rozcieńczenie wynosiło 1:4),<br />
otrzymaliśmy za wysoką absorbancję, która nie powinna przekraczać wartości 1.<br />
Absorbancja<br />
5<br />
4<br />
3<br />
2<br />
1<br />
0<br />
300 400 500 600 700 800<br />
Długość fali [nm]
Widmo 2, jest widmem ekstraktu pietruszki w rozcieńczeniu 1:16 z acetonem.<br />
Absorbancja<br />
1,4<br />
1,2<br />
1,0<br />
0,8<br />
0,6<br />
0,4<br />
0,2<br />
0,0<br />
-0,2<br />
300 400 500 600 700 800<br />
Długość fali [nm]<br />
Widmo 3 przedstawia absorbancję beta-karotenu.<br />
Absorbancja<br />
0,5<br />
0,4<br />
0,3<br />
0,2<br />
0,1<br />
0,0<br />
widmo 3 - β - karoten<br />
300 400 500 600 700 800<br />
Długość fali [nm]
Widmo 4 – luteina:<br />
na tym widmie widoczne są 2 maksima, jedno długo a drugie krótkofalowe. Powstanie niewielkiego<br />
maksimum długofalowego jest prawdopodobnie wynikiem zanieczyszczeń w badanym preparacie.<br />
Absorbancja<br />
0,6<br />
0,5<br />
0,4<br />
0,3<br />
0,2<br />
0,1<br />
0,0<br />
Widmo 5 – chlorofil B<br />
Absorbancja<br />
0,7<br />
0,6<br />
0,5<br />
0,4<br />
0,3<br />
0,2<br />
0,1<br />
0,0<br />
widmo 4: luteina<br />
300 400 500 600 700 800<br />
Długość fali [nm]<br />
0,8 widmo 5: chlorofil B<br />
-0,1<br />
300 400 500 600 700 800<br />
Długość fali [nm]
Widmo 6 – chlorofil A<br />
Stosunki A1/A2 :<br />
Absorbancja<br />
0,7<br />
0,6<br />
0,5<br />
0,4<br />
0,3<br />
0,2<br />
0,1<br />
0,0<br />
-0,1<br />
300 400 500 600 700 800<br />
chlorofil A: 1,26 (0,702/0,556)<br />
chlorofil B: 3,16 (0,775/0,245)<br />
0,8 widmo 6: chlorofil A<br />
Długość fali [nm]<br />
Maksima absorbancji wyznaczone Maksima absorbancji tablicowe<br />
Barwnik krótkofalowe długofalowe krótkofalowe długofalowe<br />
Beta-karoten 452,980 - 452 -<br />
Luteina 447,930 - 447 -<br />
Chlorofil A 429,990 662,030 430 662<br />
Chlorofil B 456,040 645,990 456 645<br />
Długości fali, dla których występują maksima absorbancji wyznaczone przez nas są bardzo zbliżone do<br />
wartości tablicowych, natomiast stosunki absorbancji nieco się różnią, co może być spowodowane<br />
zanieczyszczeniem próbki oraz minimalnymi błędami przy odczycie danych z wykresu.
3. Opisać i przedyskutować zmiany widm badanych chromoforów wskutek zmiany środowiska<br />
Dla krótkich fal zdecydowanie najwyższą absorbancję ma chlorofil A w stężonym kwasie solnym<br />
(maksimum przesunięte nieco w lewo w stosunku do pozostałych), niższą absorbancję ma chlorofil A z<br />
acetonem, a najniższą chlorofil A w środowisku metanolu.<br />
Inaczej przedstawia się wykres dla długich fal: tutaj najwyższą absorbancję ma chlorofil A z acetonem, nieco<br />
niższą z metanolem, a najniższą ze stężonym kwasem solnym.<br />
Maksima widma dla chlorofilu w metanolu:<br />
długofalowe: A666 = 0,451<br />
krótkofalowe: A431 = 0,469<br />
Według wartości tablicowych, maksimum długofalowe występuje przy długości fali równej<br />
665 nm, natomiast krótkofalowe przy 432 nm. Nasze wyniki to odpowiednio 666 nm oraz 431 nm.<br />
Wyniki przez nas uzyskane są więc bardzo zbliżone do wartości tablicowych,<br />
4.Stężenia właściwe barwników w roztworze wyjściowym:<br />
Ogólne wzory:<br />
Dane:<br />
Absorbancja<br />
1,1<br />
1,0<br />
0,9<br />
0,8<br />
0,7<br />
0,6<br />
0,5<br />
0,4<br />
0,3<br />
0,2<br />
0,1<br />
0,0<br />
-0,1<br />
300 400 500 600 700 800<br />
Chlorofil A: A662 = 0,556 A645 = 0,113<br />
Chlorofil B: A662 = 0,075 A645 = 0,245<br />
Beta-karoten: A470 = 0,419<br />
Luteina: A470 = 0,458<br />
chlorofil A<br />
--------- chlorofil A w stężonym kwasie solnym<br />
--------- chlorofil A w metanolu<br />
Długość fali [nm]<br />
c Chla = 11,75 × A 662 – 2,35 × A 645<br />
c Chlb = 18,61 × A 645 – 3,96 × A 662<br />
c kar = [1000 × A 470 – 2,27 × c Chla – 81,4 × c Chlb ]/227
Obliczenia:<br />
c Chla = 4,07 [µg/ml]<br />
c Chlb = 4,26 [µg/ml]<br />
cβ = 0,28 [µg/ml]<br />
cluteina = 0,45 [µg/ml]<br />
5. Z prawa Lamberta – Beer'a obliczyłyśmy stężenie poszczególnych barwinków:<br />
A= c*l*ε => c = A / (l*ε)<br />
Chlorofil A:<br />
c = A662 / (l*ε) = 0,556 / (1 cm * 82,6e3 1/(M*cm)) = 6,73e-6 M<br />
Chlorofil B:<br />
c = 5,22e-6 M<br />
Beta-karoten:<br />
c = 3,6e-6 M<br />
Luteina:<br />
c = 4,36e-6 M<br />
Wnioski<br />
Po przeprowadzeniu powyższego doświadczenia, możemy wywnioskować, że taki a nie inny<br />
kolor roślin jest spowodowany występowaniem w nich barwników takich jak: chlorofile: a i b,<br />
karotenoidy: β-karoten czy luteina. Największe stężenie w otrzymanym przez nas ekstrakcie chlorofilu<br />
a jest przyczyną zielonego zabarwienia liści pietruszki.<br />
Ponadto, doszłyśmy do wniosku, że barwniki roślin „uzupełniają” się nawzajem. Każdy<br />
absorbuje fale elektromagnetyczne w odrobinę innym zakresie długości fal, co powoduje wypadkowy,<br />
szerszy zakres absorpcji promieniowania słonecznego. Wpływ na zakres absorbowanych fal ma również<br />
środowisko reakcji chemicznej.