Slajdy z notatkami
Slajdy z notatkami
Slajdy z notatkami
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Przewodnictwo elektrolitów(7)Rezystancja (opór bierny) dana jest wzorem (II prawo Ohma):UR =i1= ⋅κlsUl= κ1 ⋅isisU= j = κ ⋅ = κ ⋅ ElChem. Fiz. TCH II/14 1Gęstość prądu – ważna wielkość w elektrochemii1
Wyznaczanie liczbprzenoszenia (1)Metoda ruchomej granicy (McInnesa).u M >u NRG2M + X –KatodaR. prowadzącyRG1N + X –R. następujący(wskaźnikowy)AnodaChem. Fiz. TCH II/14 2Warianty: Wspólny kation (wtedy marsz w kierunku anody), metoda zstępującazamiast wstępującej2
Wyznaczanie liczbprzenoszenia (2)Metoda ruchomej granicy (McInnesa).q = 0,001⋅c ⋅ v ⋅(z F M)+q+= q = i ⋅tqt+t+0,001c⋅v⋅ F=i ⋅tRG2RG1M + X –N + X –KatodaAnodaChem. Fiz. TCH II/14 30,001 bo v w cm 3 , a v to objętość między położeniami RG1 i RG2,q wyznaczamy sobie jakkolwiek, np. jako iloczyn natężenia i czasu.Zmiana położenia granicy może być mierzona na wiele sposobów.3
Metoda Hittorfa (aparat).Wyznaczanie liczbprzenoszenia (3)anolitAnodaKatodakatolitChem. Fiz. TCH II/14 4Skład katolitu i anolitu zmienia się podczas elektrolizy. Kationy wędrują do katody,aniony do anody, co nazywamy migracją (ruch jonó w polu elektrycznym).4
Metoda Hittorfa (bilans).Wyznaczanie liczbprzenoszenia (4)Roztwór: AgNO 3 Katoda: Ag Anoda AgJest to układ przykładowy, cała sztuka polega na sporządzeniubilansu dla różnych układów elektrolit/elektrody.Reakcja na katodzie: Ag + (aq) + e – = Ag 0 (s)Reakcja na anodzie: Ag 0 (s) = Ag + (aq) + e –Zakładamy, że przepuszczono znany ładunek q, którymożemy oznaczyć jako iloczyn i·t, lub mierzyć niezależniekulometremChem. Fiz. TCH II/14 5Trochę tu już wchodzimy w elektrodykę, ale trudno.5
Wyznaczanie liczbprzenoszenia (5)Metoda Hittorfa (bilans przestrzeni przykatodowej w molach).jonreakcjamigracjałącznieAg +–q/zF+t + q/zF–t – q/zFNO 3–---–t – q/zF–t – q/zF∆(ubytek) –t – q/zF mola AgNO 3Chem. Fiz. TCH II/14 66
Wyznaczanie liczbprzenoszenia (5)Metoda Hittorfa (bilans przestrzeni przyanodowej w molach).jonreakcjamigracjałącznieAg ++q/zF–t + q/zF+t – q/zFNO 3–---+t – q/zF+t – q/zF∆(przyrost) +t – q/zF mola AgNO 3Chem. Fiz. TCH II/14 7W niektórych układach może ubywać jednej substancji, a przybywać innej. Dotyczyto układów niesymetrycznych pod względem reakcji elektrodowej (tzn. gdyanodowa nie jest prostą odwrotnością katodowej).7
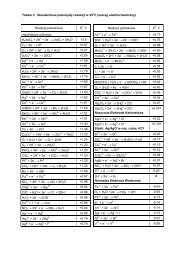
Szczególna ruchliwośćGraniczne przewodnictwo molowe wybranych jonównieorganicznych [S·cm 2 /mol] w 25 o C.JonH +OH –71,42Na + Li + K + ClO– 4 F –50,08 38,66 73,48 67,3 55,4jonów H + i OH –NO– 3λ 0 349,65 198,0Chem. Fiz. TCH II/14 8Wskazuje to na odmienny (lub dodatkowy) mechanizm ich przenoszenia.8
MiareczkowaniekonduktometryczneCo to jest miareczkowanie?Miareczkowanie jest to dział analizy ilościowej polegający nastopniowym dodawaniu do roztworu próbki odczynnika (zwanegotitrantem, najczęściej w postaci roztworu mianowanego z biurety))reagującego z substancją oznaczaną (analitem) z równoczesnymśledzeniem postępów reakcji z wykorzystaniem dodatkowejtechniki pomiarowej, co ma na celu wykrycie momentustechiometrycznego zmieszania titranta i analitu. Moment tennazywa się punktem równoważnikowym. Faktyczny punktzakończenia miareczkowania zwany jest punktem końcowym. Immniejsza rozbieżność między nimi, tym mniejszy błądmiareczkowania.Chem. Fiz. TCH II/14 99
Miareczkowaniekonduktometryczne (2)Miareczkowania dzielimy według:• reakcji analitycznej (kwasowo zasadowe, strąceniowe,kompleksometryczne, redoks)• sposobu kontroli przebiegu reakcji – wykrycia PK (wizualne –ze wskaźnikami barwnymi, potencjometryczne,konduktometryczne, spektrofotometryczne, i inne)• sposobu dozowania titranta (klasyczne, roztwór wzorcowy +biureta oraz kulometryczne).Możliwe są jeszcze inne podziały, ze względu na szczegółytechniki.Chem. Fiz. TCH II/14 1010
Krzywa miareczkowania:Miareczkowaniekonduktometryczne (3)Krzywa miareczkowania (doświadczalna lub wyliczona – modelowa)jest to wykres pewnej wielkości, będącej właściwością roztworumiareczkowanego, jako funkcji ilości (objętości roztworu wzorcowego,ładunku elektrycznego, a w ostatecznym rozrachunku zawsze liczbymoli) titranta. W przypadku miareczkowania konduktometrycznego jestto wykres:R=f(V t ) lub G=f(V t ) lub κ=f(V t ) lub λ =f(V t )Chem. Fiz. TCH II/14 1111
Miareczkowaniekonduktometryczne (4)mocny kwas – mocną zasadąsłaby kwas – mocną zasadąChem. Fiz. TCH II/14 1212
Miareczkowaniekonduktometryczne (5)mocny kwas – słabą zasadąsłaby kwas – słabą zasadąChem. Fiz. TCH II/14 1313
Miareczkowaniekonduktometryczne (6)NH 4 Cl – mocną zasadą (NaOH) słaby kwas dwukarboksylowy –mocną zasadąChem. Fiz. TCH II/14 1414
Miareczkowaniekonduktometryczne (7)miareczkowanie strąceniowechlorki azotanem(V) srebra(I)Chem. Fiz. TCH II/14 1515