Slajdy z notatkami
Slajdy z notatkami
Slajdy z notatkami
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Podstawowe definicje (2)2) Składniki niezależne –są to składniki, których stężenia w układziemożna, przynajmniej w pewnym zakresie, zmieniać dowolnie. Ichliczbę można wyznaczyć odejmując od liczby składników (bez przymiotnika)liczbę możliwych reakcji chemicznych, zachodzących międzynimi w danych warunkach.Składnikiem niezależnym nie sąnp. jony w roztworach elektrolitów,bowiem zawsze trzebarazem z nimi dodać towarzyszącyim jon o przeciwnym znaku.W pozostającym w równowadze(chemicznej) układzie:CaCO 3 (s) = CaO(s) + CO 2 (g)są tylko 2 (dwa) składnikiniezależne.Chem. Fiz. TCH II/08 2Równaniem wiążącym trzeci składnik jest równanie reakcji i odpowiednia stałarównowagi.
Podstawowe definicje (3)3) Liczba stopni swobody – liczba parametrów, jakie można zmieniaćw układzie, przynajmniej w pewnym zakresie, bez zmianyliczby istniejących w nim faz. Inaczej – najmniejsza liczbaparametrów wystarczająca do jednoznacznego zdefiniowaniastanu układu.Chem. Fiz. TCH II/08 3W obszarach (płaszczyznach) istnienia jednej fazy mamy dwa stopnie swobody –można zmieniać P i T. Wzdłuż linii (dwie fazy współistnieją) – tylko jedenparametr – drugi jest narzucony. Punkt potrójny nie ma w ogóle stopni swobody– jest to tzw. stan inwariantny.
Reguła faz Gibbsa (1)Jeśli policzymy ile parametrów (stopni swobody) F musimy podać,aby jednoznacznie określić stan układu zawierającego C niezależnychskładników i P faz:Zmiennych stężeniowych: C –1 dla każdej fazy, orazP(C –1) dla wszystkich faz, a uwzględniwszy P i T: P(C –1)+2Jak wykazaliśmy, dla każdego składnika: µ α J= µ βJ... µ βJ= µ γJ...co daje: P –1 równań dla jednego składnika, oraz C(P –1)Chem. Fiz. TCH II/08 5Skróty F, C, P pochodzą z języka angielskiego: degrees of Freedom,Components, Phases.C – 1 dla każdej fazy, bowiem ułamków molowych wystarczy podać właśnietyle, suma musi wynosić 1.
Reguła faz Gibbsa (2)co daje: P –1 równań dla jednego składnika, oraz C(P –1)dla wszystkich składników. Pomniejsza to liczbę parametrów koniecznychdo scharakteryzowania układu (czyli liczbę stopni swobody):F = P(C –1) + 2 –C(P –1) = C – P + 2Jest to reguła faz Gibbsa.Chem. Fiz. TCH II/08 6Z reguły faz zastosowanej do układu jednoskładnikowego wynika, żemaksymalna liczba faz współistniejących (dla F= 0) wynosi P=3. Zatem staninwariantny w układzie jednoskładnikowym odpowiada punktowi potrójnemu.Obserwowany przez nas punkt poczwórny na układzie fazowym dla helu był alboartefaktem (błędem, choć istnieje w źródle, skąd go przerysowywałem) i wrzeczywistości są tam bardzo blisko położone dwa punkty potrójne, albo helznów jest czymś arcywyjątkowym. Mimo przeprowadzonego śledztwa, niepotrafię rozstrzygnąć. Opowiadam się jednak za słusznością reguły faz (czylipierwsza możliwość wytłumaczenia – dwa punkty potrójne).
Równowaga ciecz-gaz wukładzie dwuskładnikowymWarunek równowagi w układzie jednoskładnikowym:w szczególności, dla układu ciecz – gaz:µc= µgµ α = µ βT=const0 PPotencjał chemiczny gazu dany jest równaniem: µg= µg+ RT ln P0Nad czystym składnikiem A:Nad mieszaniną, dla A:Łącznie daje to:o* 0 pA*µgA= µgA+ RT ln = µ0 cA= µP0 pAµgA= µgA+ RT ln = µcA= µ0APpµ = µ * + RT lnAA AopAChem. Fiz. TCH II/08 7*APotencjał chemiczny gazu określiliśmy na wykładzie V; slajdy: „Entalpiaswobodna a lotność gazów (1)” i „Potencjał chemiczny mieszanin gazowych(1)”.Prężność P A nad mieszaniną jest prężnością cząstkową. Na razie zakładamyzachowanie par jak gazu doskonałego.
Prawo Raoulta (2)Ciecze podobnechemicznieCiecze różniące się właściwościamichemicznymiChem. Fiz. TCH II/08 9Wykresy (od lewej) odpowiadająukładom: Benzen – Toluen, Aceton –Disiarczek węgla, Chloroform – Aceton.Wszystkie dla 298,15 K.Układ pierwszy zachowuje się prawieidealnie zgodnie (spełnia całkowicie)prawo Raoulta, układ drugi wykazujeodchylenia dodatnie, zaś trzeci –ujemne.
Układ dwuskładnikowya reguła fazWniosek (1):C = 2, czyli F + P = 4W układzie dwuskładnikowym możliwy jest punkt poczwórny.Wniosek (2):W układzie dwuskładnikowym możliwy są 3 stopnie swobody(parametry definiujące stan układu). Będą to, ciśnienie, temperaturaoraz ułamek molowy jednego ze składników. Aby móc przedstawiaćwykresy fazowe na płaszczyźnie (w dwóch wymiarach),zwykle ustala się warunki jako izotermiczne lub izobaryczne, kiedyto F + P = 3 (dla T = const lub P = const).Chem. Fiz. TCH II/08 10Wniosek (1) dotyczy stanu inwariantnego, gdy F=0.Wniosek (2) dotyczy układu, w którym istnieje tylko 1 faza, P=1.
Diagram fazowyciecz-para (1a)T=constpara nienasyconaX B =constX B =y BaaChem. Fiz. TCH II/08 11Krzywa rosy pokazuje zależność prężności pary nasyconej P (obu składników) odjej składu X=y.Krzywa wrzenia pokazuje zależność prężności pary nasyconej P od składu cieczyz którą para ta jest w równowadze, X=x.
Diagram fazowyciecz-para (1b)para nienasyconaX B =y BbaT=constX B =constbarosa naściankachChem. Fiz. TCH II/08 12Krzywa rosy pokazuje zależność prężności pary nasyconej P (obu składników) odjej składu X=y.Krzywa wrzenia pokazuje zależność prężności pary nasyconej P od składu cieczyz którą para ta jest w równowadze, X=x.
Diagram fazowyciecz-para (1c)para nienasyconaparanasycona X B =y Bbax B
Diagram fazowyciecz-para (1d)dpara nienasyconaparanasycona X B =y Bbax B resztka
Diagram fazowyciecz-para (1)depara nienasyconaparanasycona X B =y Bbax B resztka
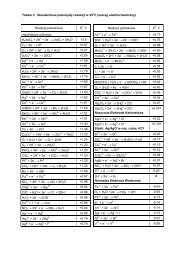
Diagram fazowyciecz-para (2)X B –ułamek molowy składnika Bw całym układzie,x B –ułamek molowy składnika B w cieczy,y B –ułamek molowy składnika B w parze.Równanie krzywej wrzenia:(gdy spełnione jest prawo Raoulta –powinna być prostą)pAB=poAxBAp =A=poApoBoAx( 1−xB)P = p + p = p + ( p − p ) xBoBoABChem. Fiz. TCH II/08 16
Diagram fazowyciecz-para (3)Równanie krzywej rosy:(gdy spełnione jest prawo Raoulta)Definicja ułamkamolowego w gazie:yB=pApB+ pBWprowadzamy prawo Raoulta:yB=poAopBxB(1 − x ) + pBoBxB=poAp− px+oB BoAxBpoBxBskąd:xB=poBop pB− ( p − poAoBoA) yBChem. Fiz. TCH II/08 17
Diagram fazowyciecz-para (4)Równanie krzywej rosy (c.d.)(gdy spełnione jest prawo Raoulta)opAyBWyrażenie na x B : xB=o op − ( p − pBBoA) ywprowadzamy do wzoru na krzywą wrzenia,aby ciśnienie całkowite uzależnić od y B :,P = p + p = p + ( p − p ) xBAoAoBoABBco daje poprzekształceniu:P =poBop pB− ( p − poAoBoA) yBChem. Fiz. TCH II/08 18
Diagram fazowyciecz-para (5)Chem. Fiz. TCH II/08 19Ogladamy te same układy, co na slajdzie „Prawo Raoulta (2)”.
Reguła dźwigniX B –ułamek molowy składnika Bw całym układzie, liczba moli tamże nx B –ułamek molowy składnika B w cieczy, n cy B –ułamek molowy składnika B w parze, n p .Bilans:n x + n y = nX = X ( n + n ) pcBpBBBcnncp=yXBB− X− xBBl=lpcl cl px B y BChem. Fiz. TCH II/08 20
Prawa KonowałłowaI. Para jest bogatsza w ten składnik, którego dodanie domieszaniny cieczy powoduje podwyższenie całkowitejprężności par mieszaniny.II.W przypadku takiego składu fazy ciekłej, któremu odpowiadaekstremum na krzywej prężności pary w warunkachizotermicznych i równocześnie ekstremumtemperatury na krzywej w warunkach izobarycznych,skład pary nasyconej jest równy składowi cieczy.Chem. Fiz. TCH II/08 21Uzasadnienie teoretyczne w oparciu o równanie Gibbsa – Duhema, zostaniezaprezentowane na następnym wykładzie.